Сенсорные системы, 2021, T. 35, № 1, стр. 22-29
Даунрегуляция ультрафиолет-чувствительного зрительного пигмента таракана уменьшает эффект маскинга при коротковолновом освещении
Е. С. Новикова 1, И. Ю. Северина 1, И. Л. Исавнина 1, М. И. Жуковская 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, пр. Тореза, 44, Россия
* E-mail: mzhukovskaya@yahoo.com
Поступила в редакцию 04.06.2020
После доработки 24.06.2020
Принята к публикации 22.07.2020
Аннотация
Свет, попадающий в глаз насекомого, несет информацию не только о форме и цвете окружающих предметов, но и об общем уровне освещения, регулируя суточные и сезонные ритмы физиологических функций. Освещение американского таракана ярким светом в ночную фазу суточного цикла приводит к возникновению эффекта маскинга, наиболее заметным проявлением которого были периоды полной неподвижности – замирания. Подавление экспрессии ультрафиолет-чувствительного зрительного пигмента таракана методом РНК-интерференции достоверно уменьшало эффект маскинга, приводя к сокращению длительности замираний. Наблюдаемые изменения в поведении оказались небольшими по величине вследствие малого остаточного количества ультрафиолет-чувствительного опсина.
ВВЕДЕНИЕ
Синантропные насекомые обитают в жилищах, а также в других зданиях – складах, помещениях промышленных и сельскохозяйственных предприятий, офисных помещениях, в транспортных средствах. Адаптация видов к обитанию рядом с человеком идет постепенно, от временного присутствия внутри или вблизи построек до облигатного развития в присутствии человека. Синантропные насекомые более всего подвержены изменениям, вносимым человеком в окружающую среду. Условия освещения, включая интенсивность, спектральный состав и суточную динамику, меняются стремительно, воздействие этих изменений на насекомых изучено недостаточно.
Свет, попадающий в глаза насекомого, помимо информации о характеристиках окружающих предметов, регулирует суточные и сезонные ритмы активности. Накапливающиеся к настоящему времени данные свидетельствуют о том, что свет разной длины волны запускает определенные поведенческие реакции (Song, Lee, 2018) напрямую или взаимодействует с системой внутренних часов насекомого. Американский таракан, Periplaneta americana L. – широко распространенный синантропный вид, активен преимущественно в первой половине ночи, причем половозрелые самцы уходят достаточно далеко от дневных убежищ, предпочитая возвращаться каждый раз в одно и то же место перед началом дня. Нимфы, и особенно самки, несущие оотеку, покидают убежище не каждую ночь и проводят вне его гораздо меньше времени (Bell, Adiyodi, 1982; Laurent Salazar et al., 2015).
Тараканы избегают яркого света, при этом наибольший эффект вызывается коротковолновым излучением (Kelly, Mote, 1990). Свет эти насекомые воспринимают двумя парами фоторецепторных органов – крупными сложными глазами и простыми глазками. Сложные глаза американского таракана имеют фоторецепторы двух спектральных типов с максимумами чувствительности в 365 и 507 нм (Mote, Goldsmith, 1970; Butler,1971). Большинство дневных насекомых имеют аппозиционные глаза в противоположность суперпозиционным глазам ночных насекомых (Грибакин, 1981), однако, аппозиционные глаза американского таракана приспособлены к работе в условиях низкой освещенности (Greiner, 2006; Heimonen et al., 2012). Сложные глаза, помимо зрительной информации об окружающем мире, участвуют в организации суточных ритмов (Page, 1982) и в выборе затененного убежища (Okada, Toh, 1998). Развитие глазков в ходе онтогенеза сопровождается резким ростом и усложнением нервных связей в процессе имагинальной линьки, что может свидетельствовать об участии органов в организации полета (Toh, Yokohari, 1988) или другом поведении, связанном с размножением. При внезапном освещении убежища в дневное время тараканы покидают его, разбегаясь в разных направлениях (Laurent Salazar et al., 2013). В своих наблюдениях за американскими тараканами мы обнаружили, что при освещении люминесцентной лампой холодного света и при невозможности скрыться самцы американского таракана замедляют свое движение и замирают (Новикова, Жуковская, 2017). Поскольку фоторецепторы таракана экспрессируют ультрафиолетчувствительный (pUVO) и два зеленочувствительных зрительных пигмента (pGO1, pGO2) (French et al., 2015), дальнейшие исследования были направлены на определение спектрального состава света, вызывающего такую реакцию. Оказалось, что именно коротковолновое освещение приводит к появлению замираний, в то время как длинноволновое вызывает усиление локомоторной активности, однако, свет любого спектрального состава большой интенсивности вызывает эффект замирания (Zhukovskaya et al., 2017). Разработка молекулярных методов манипулирования уровнем зрительных пигментов позволила показать, что подавление экспрессии зеленочувствительного опсина при помощи РНК-интерференции приводит к уменьшению его уровня в глазу таракана на 97% и электроретинограммы – на 75% (French et al., 2015). Чувствительность к коротковолновому освещению при использовании этого метода для УФ-чувствительного опсина снижалась на 91% при внутриклеточных отведениях (Saari et al., 2018). Таким образом, экспериментальное снижение уровней зрительных пигментов таракана вызывает существенное уменьшение чувствительности фоторецепторов обоих спектральных классов.
Цель настоящей работы – определить влияние снижения количества УФ-чувствительного зрительного пигмента в фоторецепторах на поведение тараканов при освещении коротковолновым светом.
МАТЕРИАЛЫ И МЕТОДЫ
Нимф самцов последнего возраста американского таракана отбирали из лабораторной колонии и выдерживали при инвертированном фоторежиме 12:12 ч (свет: темнота), температуре 24–28°С до линьки на имаго; вода и пища присутствовали постоянно. После имагинальной линьки насекомых отсаживали в экспериментальную установку.
При помощи микропипетки инъецировали 1.5 мл раствора двуцепочечной РНК против опсина в Рингере концентрацией 4 мг/мл в клипеус таракана (рис. 1, врезка) по центру немного ниже линии, соединяющей антеннальные впадины, как было описано ранее (French et al., 2015; Saari et al., 2018). Эксперименты начинали через 14 дней после инъекции. Продолжительность экспериментов составляла две недели.
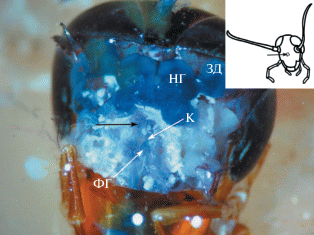
Рис. 1.
Морфологический контроль. Удален участок головной капсулы (кутикулы) с фронтальной части головы таракана. НГ – надглоточный ганглий, ЗД – зрительные доли, ФГ – фронтальный ганглий, К – коннектива. Черная стрелка – место инъекции. На врезке показана область инъекции.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Для морфологического контроля использовали 2 мл смеси 1:1 двуцепочечной РНК и 10% раствора хлористого никеля. Было проведено девять инъекций. Через час после инъекции проводили вскрытие головной капсулы и удаляли участок кутикулы с фронтальной области головы. После удаления кутикулы окраску хлористого никеля проявляли с использованием спиртового раствора рубеановой кислоты (Delcomyn, 1981). Место введения и повреждение тканей оценивали при помощи стереомикроскопа Stemi 2000 и фотографировали камерой Canon PS G-15.
Вольер размером 300 × 450 × 300 мм, в котором находились вода и пища, был постоянно соединен с затемненным убежищем размером 170 × × 170 × 55 мм проходом 40 × 40 мм (Новикова, Жуковская, 2017). Инвертированный фоторежим 12:12 создавали с применением лампы накаливания 25 Вт, температуру поддерживали в диапазоне 23–26°С.
Перед началом эксперимента к вольеру присоединяли тестовую камеру размером 200 × 200 × × 80 мм, освещаемую темно-красным светом при помощи светодиодного фотофонаря “Рубин-3” (производства ЗАО НПО “Интротест”, Россия) в режиме низкой освещенности. Подъемная дверца отделяла тестовую камеру от вольера. Стандартная увлажненная воздушная смесь, содержащая 20% кислорода и 80% азота, подавалась в камеру со скоростью 100 мл/мин. Регистрацию поведения проводили при помощи черно-белой видеокамеры VSC‑756 USB (производства компании “ЭВС”, Россия) с разрешением 740 × 576 пикселей и частотой 25 кадров/с. Видеокамеру располагали на высоте 300 мм от пола тестовой камеры. Анализ видеофайлов производился покадрово с использованием программы Virtual.Dub (Lee A Virtual.Dub http://www.virtual.dub.org/index.html).
Эксперименты проводили в первой половине темновой фазы суточного цикла. Одно насекомое впускали в тестовую камеру, после чего дверцу закрывали. Через 10 мин начинали видеорегистрацию. Эксперимент состоял из двух 30-минутных сессий, разделенных 10-минутным перерывом. В первой сессии дополнительных источников освещения, помимо темно-красной фоновой подсветки, к которой тараканы практически нечувствительны, не было. Во второй сессии включали ультрафиолетовое светодиодное освещение низкой интенсивности, создающее световой поток 2.8 × 1010 фотон/см2 × с (Zhukovskaya et al., 2017).
Было выполнено три серии экспериментов.
Интактная – животные находились без инъекций, N = 12.
Контрольная – тараканам инъецировали раствор Рингера, N = 17.
Опытная – тараканам вводили раствор двуцепочечной РНК против УФ-чувствительного опсина, N = 12.
Локомоторную активность подсчитывали как число посещенных квадрантов, оценивали количество и длительность остановок, замираний, а также параметры груминга (Новикова, Жуковская, 2017). Остановки определяли, как состояния, при которых животное, находясь на одном месте, совершало характерные сканирующие движения антеннами, а замирания – как периоды полной неподвижности (Новикова, Жуковская, 2017).
Статистическую обработку данных начинали с проверки выборок на нормальность распределения при помощи теста Колмогорова–Смирнова. Поскольку распределение выборок не отличалось от нормального, применяли методы параметрической статистики: Т-критерий Стьюдента, двухфакторный дисперсионный анализ ANOVA. Критерий Хи-квадрат применяли для сравнения распределений. Достоверными считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При морфологическом контроле было обнаружено, что место инъекции находилось ниже надглоточного ганглия и ни у одного из тараканов не наблюдалось каких-либо его повреждений (рис. 1). Весь надглоточный ганглий был интенсивно окрашен. У одного насекомого была повреждена коннектива, которая соединяет надглоточный и фронтальный ганглии, возможно, в процессе препарирования.
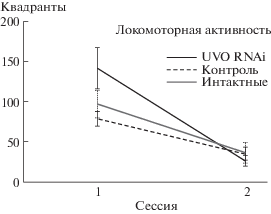
Анализ локомоторной активности показал, что тараканы, которым была сделана инъекция двуцепочечной РНК против УФ-чувствительного опсина, были более подвижны в первой сессии при фоновой подсветке темно-красным светом, чем насекомые контрольной группы (рис. 2). При коротковолновом освещении локомоторная активность снижалась в опытной и контрольной сериях до сходных значений. Контрольные животные, получившие инъекцию раствора Рингера, не отличались от интактных. Двухфакторный дисперсионный анализ выявил значимые различия как между контрольной и опытной сериями (F1/57 = 4.15, p < 0.05), так и между последовательными сессиями обеих серий (F1/57 = 31.62, p < < 0.0001), взаимодействие факторов также оказалось достоверным (F1/57 = 7.37, p < 0.01).
Рис. 2.
Локомоторная активность. Число квадрантов, посещенных за сессию. UVO RNAi – инъекция двуцепочечной РНК против УФ-чувствительного опсина, опытная группа, контроль – инъекция раствора Рингера. Данные представлены как средние ± ошибка среднего.
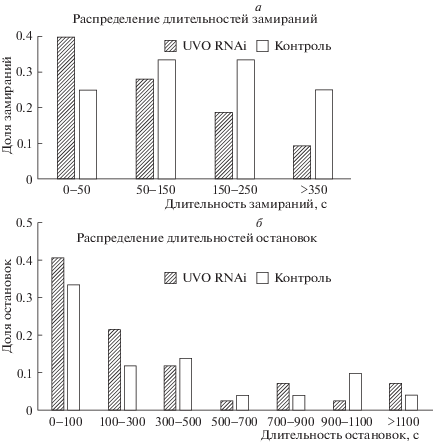
Периоды полной неподвижности, замирания, наблюдались у тараканов всех трех групп при освещении коротковолновым светом. В первой сессии кратковременные замирания отмечены лишь для одного животного в опытной серии. Во вторых сессиях замирания наблюдались во всех сериях экспериментов, однако после инъекции двуцепочечной РНК против УФ опсина максимум распределения смещался в сторону увеличения доли коротких замираний по сравнению с контролем (Хи-квадрат, p < 0.01, рис. 3, а). Количество остановок увеличивалось во второй сессии экспериментов сходным образом для интактной, контрольной и опытных групп (p < 0.01, Т-критерий Стьюдента). Длительность остановок также росла во второй сессии, но для интактных животных достоверность различий не была определена из-за их малого количества в первой сессии. Различий между контрольной и опытной группами при освещении по параметрам остановок не обнаружено (Хи-квадрат, p > 0.05, рис. 3, б).
Рис. 3.
Распределения длительностей замираний (а) и остановок (б) тараканов при коротковолновом освещении во вторых сессиях экспериментов. UVO RNAi – инъекция двуцепочечной РНК против УФ-чувствительного опсина, опытная группа, контроль – инъекция раствора Рингера.
Количество актов груминга антенн, а также их длительность не изменялись при экспериментальных воздействиях. При этом количество и длительность чисток антенн уменьшались во вторых сессиях как контрольных, так и опытных экспериментов (T-тест Стьюдента, p < 0.001), что сходно с интактными животными (p < 0.01). Общая продолжительность груминга была примерно одинаковой во всех сериях и не различалась между сессиями (табл. 1). Последовательности груминга – чистки разных частей тела подряд, увеличивались как по количеству очищаемых органов, так и по длительности (сходно во всех сериях экспериментов) (табл. 2).
Таблица 1.
Суммарное время груминга разных частей тела таракана. Звездочками обозначены достоверные различия между сессиями одного и того же эксперимента (Т-критерий Стьюдента, * – p < 0.05, ** – p < 0.01, *** – p < 0.001).
| Эксперимен-тальные группы | сес-cия | Суммарное время чисток, с | |||||
|---|---|---|---|---|---|---|---|
| Антенны | Основания антенн | Передние ноги | Средние и задние ноги | Церки | Сумма | ||
| Интактные | 1 | 75.92 ± 10.04 | 12.17 ± 8.61 | 55.92 ± 17.01 | 42.5 ± 11.52 | 2.33 ± 1.41 | 188.83 ± 32.93 |
| 2 | 48.42 ± 9.75** | 24.75 ± 7.55 | 54.33 ± 9.85 | 36.42 ± 7.36 | 3 ± 1.14 | 166.92 ± 26.2 | |
| Контроль | 1 | 72.25 ± 7.77 | 20.08 ± 5.93 | 64.33 ± 7.05 | 52.67 ± 10.8 | 3.67 ± 1.99 | 213 ± 22.32 |
| 2 | 33.67 ± 10.38* | 12.25 ± 7.5 | 35.92 ± 16.73 | 44.08 ± 20.23 | 8.17 ± 4.96 | 134.08 ± 47.83 | |
| Опыт | 1 | 82.92 ± 12.08 | 8.75 ± 4.02 | 44.42 ± 12.53 | 32.42 ± 10.14 | 0.08 ± 0.08 | 168.58 ± 35.34 |
| 2 | 48.33 ± 9.12** | 19.83 ± 5.47 | 57.83 ± 11.94 | 47.5 ± 13.08 | 3.67 ± 3.49 | 177.17 ± 33.45 | |
Таблица 2.
Параметры последовательностей груминга. Статистические различия обозначены как в табл. 1
| Эксперимен- тальные группы | Сессия | N последовательностей | Длительность последовательности | N элементов в каждой последовательности |
|---|---|---|---|---|
| Интактные | 1 | 6.42 ± 0.73 | 22.14 ± 3.13 | 3.85 ± 0.51 |
| 2 | 3.67 ± 0.54* | 42.11 ± 6.03** | 7.13 ± 1.01** | |
| Контроль | 1 | 6.06 ± 0.64 | 29.62 ± 3.24 | 4.3 ± 0.47 |
| 2 | 2.94 ± 0.7** | 72.51 ± 10.87*** | 7.3 ± 0.82*** | |
| Опыт | 1 | 4.25 ± 0.8 | 28.48 ± 3.95 | 3.95 ± 0.47 |
| 2 | 2.92 ± 0.5 | 64.13 ± 12.72* | 7.75 ± 1.64* |
ОБСУЖДЕНИЕ
Использованный метод введения двуцепочечной РНК не нарушает целостность надглоточного ганглия и только в редких случаях может приводить к изменению поведения из-за частичного нарушения функций фронтального ганглия. Фронтальный ганглий является центром стоматогастрической системы, и при его повреждении нарушается процесс глотания пищи и воды. При удалении фронтального ганглия у тараканов может наблюдаться обезвоживание (Penzlin, 1971). Поскольку ни у одного из тараканов контрольной и опытной серий не наблюдались признаки обезвоживания, можно заключить, что фронтальный ганглий и его коннективы не имели существенных повреждений при инъекции. Изменения груминга были сходными для всех серий и могут рассматриваться как возникновение стресса новизны при входе в тестовую камеру и его угасание во второй сессии экспериментов всех серий (Zhukovskaya, 2014; Новикова, Жуковская, 2015).
Двигательная активность тараканов интактной и контрольной серий была в целом сходна с описанными ранее изменениями (Zhukovskaya et al., 2017), а именно достоверно уменьшалась во второй сессии при освещении коротковолновым светом (рис. 2). Инъекция двуцепочечной РНК против УФ-чувствительного опсина привела к существенному усилению локомоторной активности при темно-красном освещении. Фоновая темно-красная подсветка слабо возбуждает зеленочувствительные фоторецепторы (Mote, Goldsmith, 1970), но при инактивации коротковолновых фоторецепторов, по-видимому, вклад длинноволновых рецепторов в общий ответ глаза возрастает, приводя к усилению локомоторной активности, характерной для длинноволнового света. Подвижность тараканов при попадании в новую обстановку значительно ослабевает после угасания ориентировочно-исследовательского поведения во второй сессии экспериментов. Уменьшение длительности замираний у тараканов опытной группы при коротковолновом освещении свидетельствует в пользу того, что оно связано с возбуждением УФ-чувствительных фоторецепторов. Увеличение доли коротких замираний и, напротив, сокращение доли долгих замираний по сравнению с контролем (рис. 3, а) говорит об увеличении общей подвижности животных, и, соответственно, неустойчивости и общем уменьшении эффекта маскинга (Mrosovsky, 1999) при освещении в ночной период. Эффект маскинга, наблюдаемый нами ранее (Новикова, Жуковская, 2017; Zhukovskaya et al., 2017), у животных с ночной активностью в виде появления при освещении в темное время суток элементов поведения, характерных для неактивной дневной фазы суточного цикла, проявлялся слабее у тараканов опытной группы, однако не исчезал полностью. Поскольку освещение коротковолновым светом насекомых, лишенных зрительного пигмента, чувствительного в этой области длин волн, должно быть аналогично отсутствию освещения для интактных тараканов, интересно сравнить полученные в настоящей работе данные с ранее описанными. При темно-красной подсветке во второй сессии экспериментов крайне редко наблюдались лишь очень короткие замирания длительностью 28 ± 24 с (Новикова, Жуковская, 2017). Уменьшение экспрессии УФ опсина при коротковолновом освещении приводило к более длительным замираниям на 165.3 ± 29.7 с в опытной серии настоящего исследования. Таким образом, снижение количества коротковолнового опсина в фоторецепторах тараканов не полностью блокировало светозависимое поведение, по-видимому, вследствие сохранения части зрительного пигмента в глазу (Saari et al., 2018). Слабый физиологический эффект нокдауна зрительного пигмента был также отмечен для длинноволнового (540 нм) фоторецепторного белка медоносной пчелы Apis mellifera (Leboulle et al., 2013). Тем не менее у цикадки Empoasca vitis экспериментальное подавление зеленочувствительного, но не сине- и ультрафиолет-чувствительного зрительного пигмента методом РНК-интерференции, существенно влияет на поведенческие ответы на цвет кормового растения (Zhang et al., 2018).
Поскольку при РНК-интерференции зрительный пигмент не исчезает полностью, как у генетических мутантов (Yamaguchi et al., 2008), естественно ожидать частичную сохранность поведенческих реакций, возникающих при стимуляции фоторецепторов исследуемого спектрального класса.
ВЫВОДЫ
Уменьшение уровня УФ-чувствительного пигмента в глазу такого вида ночного насекомого, как американский таракан, приводит к уменьшению выраженности эффекта маскинга при коротковолновом освещении.
Наблюдаемый эффект оказался относительно слабым вследствие неполного нокдауна УФ-чувствительного зрительного пигмента.
Исследование выполнено при финансовой поддержке госбюджета РФ, программа АААА-А18-118013090245-6.
Список литературы
Грибакин Ф.Г. Механизмы фоторецепции насекомых. Л.: Наука, 1981. 213 с.
Новикова Е.С., Жуковская М.И. Октопамин, гормон стресса насекомых, изменяет паттерн груминга у таракана Periplaneta americana. Ж. эвол. биохим. и физиол. 2015. Т. 51. № 2. С. 139–141. https://doi.org/10.1134/S0022093015020118
Новикова Е.С., Жуковская М.И. Реакция замирания под действием яркого света у американского таракана, Periplaneta americana. Сенсорные системы. 2017. Т. 31. № 1. С. 44–50.
Bell W.J., Adiyodi K.G. The American Cockroach. London. Chapman & Hall, 1982. 538 p.
Butler R. The identification and mapping of spectral. cell types in the retina of Periplaneta americana. Z. Vergl. Physiol. 1971. V. 72. № 1. P. 67–80. https://doi.org/10.1007/BF00299204
Delcomyn F. Nickel chloride for intracellular staining of neurons in insects. J. Neurobiol. 1981. V. 12. № 6. P. 623–627. https://doi.org/10.1002/neu.480120610
French A.S., Meisner S., Liu H., Weckstrom M., Torkkeli P.H. Transcriptome analysis and RNA interference of cockroach phototransduction indicate three opsins and suggest a major role for TRPL channels. Front. Physiol. 2015. V. 6. P. 207. https://doi.org/10.3389/fphys.2015.00207
Greiner B. Adaptations for nocturnal vision in insect apposition eyes. Int. Rev. Cytol. 2006. V. 250. P. 1–46. https://doi.org/10.1016/S0074-7696(06)50001-4
Heimonen K., Immonen E.V., Frolov R.V., Salmela I., Juusola M., Vähäsöyrinki M., Weckström M. Signal coding in cockroach photoreceptors is tuned to dim environments. J. Neurophysiol. 2012. V. 108. P. 2641–2652. https://doi.org/10.1152/jn.00588.2012
Kelly K.M., Mote M.I. Avoidance of monochromatic light by the cockroach Periplaneta americana. J. Insect Physiol. 1990. V. 36. № 4. P. 287–291. https://doi.org/10.1016/0022-1910(90)90113-T
Laurent Salazar M.O., Deneubourg J.L. Sempo G. Information cascade ruling the fleeing behaviour of a gregarious insect. Anim. Behav. 2013. V. 85. № 6. P. 1271–1285. https://doi.org/10.1002/cne.902690202
Laurent Salazar M.O., Planas-Sitjà I., Deneubourg J.L., Sempo G. Collective resilience in a disturbed environment: stability of the activity rhythm and group personality in Periplaneta americana. Behav. Ecol. Sociobiol. 2015. V. 69. № 11. P. 1879–1896. https://doi.org/10.1007/s00265-015-2000-3
Leboulle G., Niggebrügge C., Roessler R., Briscoe A.D., Menzel R., de Ibarra N.H. Characterisation of the RNA interference response against the long-wavelength receptor of the honeybee. Insect Biochem. Mol. Biol. 2013. V. 43. № 10. P. 959–969. https://doi.org/10.1016/j.ibmb.2013.07.006
Mote M.I., Goldsmith T.H. Spectral sensitivities of color receptors in the compound eye of the cockroach Periplaneta. J. Exp. Zool. 1970. V. 173. P. 137–145. https://doi.org/10.1002/jez.1401730203
Mrosovsky N. Masking: history, definitions, and measurement. Chronobiol. Int. 1999. V. 16. № 4. P. 415–429. https://doi.org/10.3109/07420529908998717
Okada J., Toh Y. Shade response in the escape behavior of the cockroach, Periplaneta americana. Zool. Sci. 1998. V. 15. № 6. P. 831–835. https://doi.org/10.2108/zsj.15.831
Page T.L. Transplantation of the cockroach circadian pacemaker. Science. 1982. V. 216. № 4541. P. 73–75. https://doi.org/10.1126/science.216.4541.73
Penzlin H., Stölzner W. Frontal ganglion and water balance in Periplaneta americana L. Experientia. 1971. V. 27. № 4. P. 390–391. https://doi.org/10.1007/BF02137265
Saari P., Immonen E.V., French A.S., Torkkeli P.H., Liu H., Heimonen K., Frolov, R.V. Electrical interactions between photoreceptors in the compound eye of Periplaneta americana. J. Exp. Biol. 2018. V. 221. https://doi.org/10.1242/jeb.189340
Song B.M., Lee C.H. Toward a mechanistic understanding of color vision in insects. Frontiers in neural circuits. 2018. V. 12. P. 16. https://doi.org/10.3389/fncir.2018.00016
Toh Y., Yokohari F. Postembryonic development of the dorsal. ocellus of the American cockroach. J. Comp. Neurol. 1988. V. 269. № 2. P. 157–167. https://doi.org/10.1002/cne.902690202
Yamaguchi S., Wolf R., Desplan C., Heisenberg M. Motion vision is independent of color in Drosophila. Proc. Natl. Acad. Sci. U.S.A. 2008. V. 105. № 12. P. 4910–4915. https://doi.org/10.1073/pnas.0711484105
Zhang X., Pengsakul T., Tukayo M., Yu L., Fang W., Luo D. Host-location behavior of the tea green leafhopper Empoasca vitis Göthe (Hemiptera: Cicadellidae): olfactory and visual effects on their orientation. Bull. Entomol. Res. 2018. V. 108. № 4. P. 423–433. https://doi.org/10.1017/S0007485317000931
Zhukovskaya M.I. Grooming behavior in American cockroach is affected by novelty and odor. The Scientific World Journal. 2014. 6 p. https://doi.org/10.1155/2014/329514
Zhukovskaya M.I., Novikova E.S., Saari P., Frolov R.V. Behavioral responses to visual overstimulation in the cockroach Periplaneta americana L. J. Comp. Physiol. A. 2017. V. 203. P. 1007–1015. DOI: 9-017-1210-8https://doi.org/10.1007/s0035
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


