Сенсорные системы, 2021, T. 35, № 1, стр. 11-21
Нейроны Tectum opticum рыб, электрическая активность и подбор адекватной стимуляции
А. А. Зайчикова 1, *, И. Дамянович 1, П. В. Максимов 1, А. Т. Алипер 1, Е. М. Максимова 1
1 Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Большой Каретный переулок, д. 19, Россия
* E-mail: zaichikova_alisa@mail.ru
Поступила в редакцию 25.09.2020
После доработки 19.10.2020
Принята к публикации 02.11.2020
Аннотация
У всех животных tectum opticum (ТО) (или “верхнее двухолмие” у млекопитающих) обеспечивает руководство внешним вниманием, что является не единственной функцией тектума, однако критически важно для развития поведенческих зрительно обусловленных реакций. У рыб ТО является главным первичным зрительным центром. От сетчатки в него поступают сигналы подавляющего числа ганглиозных клеток (ГК) разных (известных) типов. Для понимания механизмов организации поведения важно знать свойства нейронов собственно ТО, как структурные, так и физиологические. Мы регистрировали экстраклеточно электрическую активность в ТО живой взрослой рыбы (Carassius auratus gibelio). Были записаны одновременно реакции ГК сетчатки (от терминалей их аксонов) и собственно тектальных нейронов (ТН), вероятно, от тел клеток. Описано четыре типа ТН с дирекциональной избирательностью (ДИ) (такие нейроны далее – ДИ ТН) на разных (определенных) глубинах в ТО. Кроме них (поверхностно) одновременно с реакциями каудоростральных ДИ ГК при одном положении электрода регулярно отводятся редкие спорадические импульсы, не имеющие ДИ и возникающие при стимуляции в любом месте большой площади. Это предположительно реакции поверхностных тектальных нейронов (superficial inhibitory neurons) – “SIN”. Для появления четко выраженных реакций “SIN” был произведен перебор различных видов стимуляции. Сопоставление результатов наших электрофизиологических исследований с литературными данными (большинство работ в этом направлении выполнено методом кальциевого имаджинга на прозрачных мальках данио рерио (Danio rerio)) позволяет отождествить ДИ ТН с глутаматэргическими перивентрикулярными интернейронами ТО, а “SIN” – с ГАМК-эргическими тормозными интернейронами (SIN). Последние предположительно обеспечивают выделение главного объекта (pop-out) в поле зрения.
ВВЕДЕНИЕ
Выходными нейронами сетчатки являются ганглиозные клетки (ГК), передающие информацию о картине мира от сетчатки на нейроны tectum opticum (ТО), которые являются первичным зрительным центром у рыб. Одной из функций тектума у всех животных является руководство внешним вниманием, что необходимо для запуска поведенческих программ в текущей ситуации (Northmore, 2011). Для успешного выбора поведенческой реакции необходим механизм “обнаружения признаков”.
Для тектума характерна слоистая структура, в его ретинореципиентном слое расположены аксональные терминали ГК, тела и окончания тектальных нейронов (ТН). Полное покрытие рецепторного поля сетчатки дендритными ветвлениями ГК каждого из 13 типов (“tiling”), а также ретинотопический принцип передачи информации от ГК к нейронам ТО позволяют выделить значимые признаки изображения и сохранить упорядоченность передачи визуальной информации (Максимов и др., 2005; 2009; Maximov et al., 2005; Maximova et al., 2012; Damjanović et al., 2009). Для осмысления работы зрительной системы необходимо изучить взаимосвязи между ГК и ТН, т.е. как происходит дальнейшее преобразование сигналов от ГК нейронами ТО.
На данный момент передача зрительной информации в сетчатке изучена лучше, чем последующая ее обработка в первичных зрительных центрах. Нейроны тектума менее изучены: большая часть информации о ТН – это морфологические сведения, полученные на мальках Danio rerio, которые относятся к тому же семейству, что и караси (Nevin, 2010; Walker et al., 2013; Barker, Baier, 2015). Однако есть и электрофизиологические данные, полученные разными методами. При помощи методики пэтч-кламп на мальках данио были исследованы ТН при появлении в поле зрения малька объекта, похожего на добычу (Preuss et al., 2014). Поведенческие опыты в сочетании с экстраклеточным отведением от нейронов тектума на рыбах-брызгунах были использованы для изучения механизмов выделения главного стимула (pop-out) во всей визуальной картине (Ben-Tov et al., 2015; Kardamakis et al., 2015). Было описано несколько типов тектальных нейронов, содержащих разные медиаторы, о функциях таких ТН высказываются различные предположения (Gabriel et al., 2012; Barker, Baier, 2013; Preuss et al., 2014).
Дирекционально-избирательные ГК (ДИ ГК) сетчатки реагируют на движение стимула в определенном направлении. Электрофизиологическим методом были также описаны дирекционально-избирательные ТН (ДИ ТН), своими свойствами ДИ ТН очень схожие с ГК (сходная контрастная чувствительность, разрешающая способность) (Damjanović et al., 2019). Они так же, как и ДИ ГК, реагируют на движение разнообразных стимулов: широкие движущиеся границы, полосы, пятна, основное для таких элементов – это движение любого стимула в предпочтительном для нейрона направлении. В ходе экспериментальной работы были выделены четыре группы ДИ ТН с разными предпочтительными направлениями. Предпочтительные направления движения стимула трех групп ТН (каудоростральное, дорсовентральное и вентродорсальное) в точности совпадали с направлениями, известными для ДИ ГК. Тектальные нейроны четвертой группы имели рострокаудальное предпочтительное направление, которое отсутствует у ДИ ГК (рис. 1). На рисунке данные для ДИ ГК представлены синим цветом, n = 299 (только караси), данные для ДИ ТН – серым, n = 117 (98 – карась, 19 – карп). Из 117 тектальных нейронов 39 относились к ДИ ТН 1-й группы, которые в тектуме расположены на глубине около 100 мкм, и 78 к ДИ ТН 2-й группы, расположенных на глубине около 300 мкм (точные значения глубин приведены в табл. 1)11. В отличие от ДИ ГК, ДИ ТН являются элементами on-off-типа, т.е. безразличны к знаку контраста, тогда как ДИ ГК у рыб бывают либо on-, либо off-типа.
Рис. 1.
Гистограммы распределения типов нейронов с разными предпочтительными направлениями представлены в полярных координатах (модифицированный рисунок по (Damjanović et al., 2019)). а – ДИ ГК; б – ДИ ТН; в – ДИ ТН 1-й группы; г – ДИ ТН 2-й группы.
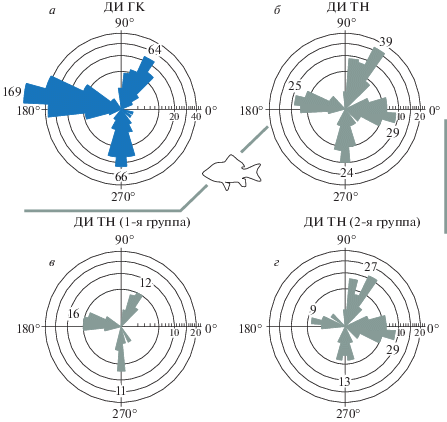
Таблица 1.
Средние значения глубин расположения реакций ТН разных типов и ДИ ГК
| Тип элемента | Средняя глубина расположения ± ст. ошибка среднего, мкм | Медиана и интерквартильный размах, мкм |
|---|---|---|
| “SIN”, n = 28 | 41 ± 24 | 20–55 (медиана = 39) |
| ДИ ГК, n = 130 | 54 ± 18 | 40–64 (медиана = 53) |
| Первая группа ДИ ТН, n = 18 | 113 ± 56 | 75–147 (медиана = 106.5) |
| Вторая группа ДИ ТН, n = 19 | 282 ± 59 | 239–335 (медиана = 266) |
На данный момент мы уже знаем, как соотносятся глубины залегания аксональных терминалей ГК и ТН в тектуме (Aliper et al., 2019; Damjanović et al., 2019). Так, было показано, что реакции ДИ ГК и ДИ ТН регистрируются на разных глубинах. ДИ ГК расположены в поверхностных подслоях ретино-реципиентного слоя ТО. В свою очередь реакции ДИ ТН могут быть зарегистрированы на нескольких уровнях: в том подслое ретино-реципиентного слоя, где также расположены детекторы ориентированных линий и детекторы пятна, и под подслоем аксональных терминалей ГК с темновой и световой фоновой активностью (средняя глубина расположения = = 195 мкм). Данные о точных значениях глубин представлены в табл. 1, сформированной на основе результатов работы (Damjanović et al., 2019).
Большая часть входов от сетчатки приходит в слои SO и SFGS (SO – stratum opticum, SFGS – stratum fibrosum et griseum superficiale) (Robles et al., 2013). Вся визуальная информация далее передается в более глубокие слои ТО, откуда поступает уже в двигательные центры среднего и заднего мозга. В глубоких слоях ТО, в основном в перивентрикулярном слое (SPV – stratum periventriculare), находятся тела так называемых перивентрикулярных тектальных нейронов (PVN), дендриты части таких нейронов восходят в SFGS (Northmore, 2011). Большая часть PVN является глутаматэргическими (Kinoshita et al., 2006). Описано два класса PVN: перивентрикулярные проекционные нейроны (PVPN) и перивентрикулярные интернейроны (PVIN). Дендритные ветвления интернейронов не выходят за пределы тектума. Часть интернейронов посылает свои отростки в поверхностные ретинореципиентные слои. В свою очередь проекционные PVN образуют синапсы с интернейронами в глубоких слоях ТО, а свои эфферентные аксоны посылают в премоторные и моторные области мозга (Nevin et al., 2010).
Помимо перивентрикулярных ТН у мальков данио при использовании метода кальциевого имаджинга были описаны поверхностные ГАМК-эргические интернейроны (SIN – superficial inhibitory neurons). Тела SIN, по морфологическим данным, расположены в слое SO, а отросток густо ветвится в одной плоскости сразу под телом клетки на самой поверхности ретино-реципиентного слоя (Bene et al., 2010). Такие нейроны получают входы как от аксональных окончаний ГК, так и от тектальных PVN (Barker, Baier, 2013). Предполагается, что SIN участвуют в настройке восприятия объектов определенного размера, оказывая ингибиторные влияния.
При помощи метода микроэлектродной экстраклеточной регистрации, использованного в данном исследовании, можно отводить импульсные реакции как ГК, так и ТН. Важно отметить, что в том числе возможна одновременная регистрация реакций ГК и тектальных нейронов в одном положении микроэлектрода. Это позволяет нам изучать, как именно передается и обрабатывается зрительная информация на разных уровнях между различными элементами зрительной системы. В данной работе были использованы взрослые особи карасей и карпов. Однако у нас есть все основания сравнивать наши электрофизиологические данные с литературными, полученными на мальках данио, так как малек , по сути, уже сформировавшееся животное. Наши данные по стратификации реакций от аксональных окончаний ГК разных типов совпадают с таковыми, полученными на данио методом кальциевого имаджинга (Nikolaou et al., 2012). Электрофизиологический метод, примененный на взрослых карасях и карпах, используется много лет и зарекомендовал себя как очень информативный. Полученные сведения могут быть полезны в дальнейших исследованиях в этой области, в том числе с использованием иных методов.
Зная входы (реакции ГК), на следующем этапе исследований является естественным посмотреть, как преобразуются (используются) эти сигналы нейронами ТО. Для корректного описания свойств ТН разных типов первоначально было необходимо подобрать адекватную стимуляцию. Без этого невозможно определить большинство параметров (например, размер рецептивного поля, его положение), которые необходимы для сравнения свойств ТН и ГК. Ранее, чтобы сравнить глубины залегания аксональных терминалей ГК и собственно ТН, было произведено измерение глубины отведений (Aliper et al., 2019).
Поскольку SIN в литературе приписывают функцию выделения pop-out стимула, на основании морфологических и нейромедиаторных свойств, и эта гипотеза, на наш взгляд, выглядит логичной, мы попытались изучить и свойства электрических реакций этих нейронов.
ОПИСАНИЕ МЕТОДИКИ
Экспериментальные объекты и препаровка
Работа выполнена на представителях двух видов рыб сем. Карповые (Cyprinidae): серебряный карась (Carassius gibelio) и обыкновенный карп (Cyprinus carpio) из подмосковных рыбных хозяйств. Размер тела животных в длину – 10–15 см, масса – от 40 до 100 г. В эксперименте было 36 особей (и 533 записи реакций ГК и ТН из базы данных). До начала эксперимента в течение нескольких месяцев животные находились в аэрируемых лабораторных аквариумах при комнатной температуре и естественном режиме освещения.
Во время проведения эксперимента животное с нормальным кровообращением и неповрежденной зрительной системой обездвиживали внутримышечной инъекцией d-тубокурарина (0.3 мг/100 г массы тела). Далее животное закрепляли в естественном положении (в котором караси и карпы перемещаются в воде) в прозрачном аквариуме из плексигласа, с принудительным протоком аэрированной воды через жабры. Циркуляция обеспечивалась насосом с термостатом. Животное смотрело через прозрачную стенку аквариума правым глазом на экран монитора, на котором предъявляли компьютер-генерируемые стимулы. Для доступа к ТО участок головы рыбы анестезировали льдом, после чего удаляли теменно-затылочную кость с левой стороны черепа контралатерально относительно правого “рабочего глаза”. Далее убирали жировую клетчатку, твердую и мягкую мозговые оболочки. Уровень воды в экспериментальном аквариуме поддерживался так, чтобы вода не попадала в мозг, однако глаза рыбы находились под водой.
Экспериментальная установка и зрительная стимуляция
Экспериментальная установка состояла из трех связанных синхронизированных компьютерных модулей: стимулирующего, регистрирующего и командного. Стимулирующий модуль обслуживал 17-дюймовый ЭЛТ-монитор LG Flatron 775FT, где отображались зрительные стимулы. Монитор располагали на подвижном столике, что позволяло перемещать его. Расстояние от монитора до глаза рыбы составляло 30–40 см. Работы проводили в основном в боковых полях зрения животного в довольном широком угле: свыше 60° по вертикали и 40° по горизонтали. Область стимуляции на экране монитора была ограничена квадратом со стороной 11 угловых градусов, размер области и ее положение на экране можно было изменять. В области стимуляции отображались программно-генерируемые стимулы (движущиеся границы, полосы, мерцающие пятна и другие), остальная часть монитора оставалась неизменной с постоянной яркостью. В данной работе использовали только “ахроматические” цвета (черный, белый, многочисленные градации серого). Командный модуль был предназначен для графического представления результатов on-line, экспресс-обработки и для оперативного управления параметрами стимуляции и регистрации. Регистрирующий модуль соединяли через АЦП (аналогово-цифровой преобразователь; частота дискретизации 25 кГц) и усилитель с микроэлектродом. Модуль служил для регистрации реакций нейронов, выведения картин импульсной активности на экран, прослушивания реакций при помощи динамики и записи в память результатов эксперимента. В процессе опыта велся автопротокол, кроме того, производилась off-line обработка данных по разработанной ранее схеме. В данной работе методика описана кратко. Подробно методика описана в статье (Максимов и др., 2005).
Регистрация клеточных реакций
Регистрация одиночных реакций от аксональных терминалей ГК сетчатки и ТН в TO живой рыбы происходила при помощи внеклеточного заключенного в стекло металлического микроэлектрода (диаметр платиновой шляпки 2–3 мкм, сопротивление не более 300 кОм) (Gesteland et al., 1959). Электрод погружали под визуальным контролем микроманипулятором (MP-225, Sutter Instrument), реакции просматривались и прослушивались при помощи осциллографа (С1-73) и громкоговорителя соответственно. Шум на входе значительно уменьшался при контакте электрода с жидкостью над поверхностью тектума. Далее электрод аккуратно погружали по градиенту звука до получения стабильного одиночного отведения. Глубина записи оценивалась с использованием показаний на экране микроманипулятора. Об одиночности отведения судили по высоте и стабильности амплитуды импульсов, а также по стабильному звуковому тембру. Величина спайков одиночного элемента составляла порядка 200–500 мкВ (для реакций ГК) и превышала шум в несколько раз.
РЕЗУЛЬТАТЫ
Общие сведения о тектальных нейронах
В ходе эксперимента в ретино-реципиентном слое ТО реакции ТН встречаются реже, чем реакции аксональных терминалей ГК. В нашей обширной базе данных содержатся тысячи записей о ГК и сотни о ТН. Одиночные отведения реакций аксональных терминалей ГК и ТН отличаются по ряду характеристик импульсной активности: амплитуде и форме импульсов, размерам рецептивных полей. Типичный ответ ТН, зарегистрированный в ТО живой рыбы, показан на рис. 2, а на примере дирекционально-избирательного ТН с предпочтительным направлением движения стимула от хвоста к голове (каудоростральное направление). Стимулом являлась широкая черная полоса, превышающая размер области стимуляции, движущаяся по светлому фону области стимуляции при темной периферии. Реакция наблюдается и на вход, и на выход контрастной границы (т.е. на изменение контраста стимула, увеличения или уменьшения относительно фона), соответственно, это элемент on-off типа. Можно также отметить, что у импульсной активности ТН есть характерная особенность – амплитуда спайков существенно уменьшается при увеличении частоты их возникновения в разряде (рис. 2, а; пример выделен стрелкой).
Рис. 2.
Характеристики импульсной активности ТН на примере каудорострального ДИ ТН. а – импульсная активность ТН в ответ на стимуляцию; б – форма усредненного импульса ТН в расширенной временной шкале; в – полярные диаграммы; г – положение рыбы.
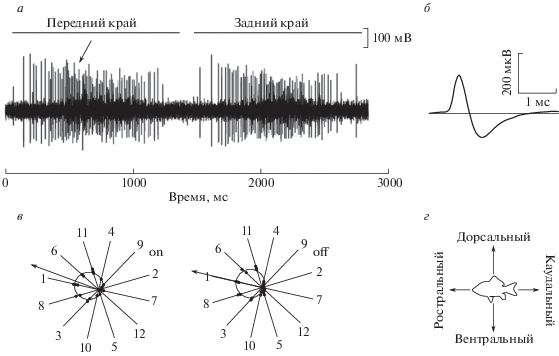
На рис. 2, б представлена форма спайка ТН – двухфазная. Подобная форма импульса характерна для регистрации от тела клетки. У ГК в свою очередь спайки трехфазные с отклонением в отрицательную сторону в начале (Максимова и др., 2012).
О предпочтительном направлении движения для данного нейрона можно судить по полярным диаграммам (рис. 2, в). Полярные диаграммы – это зависимость числа импульсов в реакции от направления движения стимула. На левой панели представлена диаграмма ответов на выход темного стимула из РП элемента – реакция на посветление РП (on-реакция), на правой – на вход темного стимула в РП элемента – реакция на затемнение РП (off-реакция).
Длительный разряд указывает на большой размер рецептивного поля (РП) тектального нейрона (рис. 2, а), что является еще одним различием между ДИ ТН и ДИ ГК: у тектальных нейронов РП намного больше, чем у ГК (размер РП ретинальных элементов порядка 4.5°, РП тектальных нейронов может быть до 60°). Это заметно, поскольку залп ответа ГК всегда помещается в окно области стимуляции (квадрат со стороной 11°), в то время как залп нейрона может быть ограничен этим окном, так как его РП больше (Maximova et al., 2012).
Поверхностные тектальные нейроны
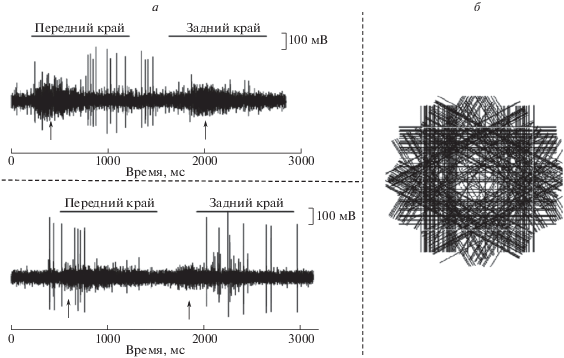
Помимо дирекционально-избирательных тектальных нейронов в ТО встречаются реакции так же ТН другого типа – не имеющие дирекциональной избирательности. В ходе эксперимента при погружении электрода в ТО их реакции появляются первыми и достигают максимальной амплитуды на той же глубине, что и ответы ДИ ГК с каудоростральным предпочтительным направлением. Мы предполагаем, что регистрируем реакцию описанных в литературе ГАМК-эргических SIN, поэтому в дальнейшем будем называть такие поверхностные тектальные нейроны “SIN” (предположительно SIN). В сравнении с ДИ ГК, у “SIN” гораздо меньше импульсов в разряде, помимо этого импульсы в ответ на предъявление стандартных тестирующих стимулов нерегулярные (рис. 3, а). Стимулами являлись белая (а – верхняя панель) и черная (нижняя панель) широкие полосы, превышающие размер области стимуляции, движущиеся по светло-серому фону области стимуляции и темной периферии. Стрелками отмечены импульсные активности ДИ ГК, через РП которой движутся стимулы.
Рис. 3.
Сравнение импульсной активности одновременно регистрируемых аксональных терминалей ГК и “SIN”. а – импульсная активность “SIN” и ДИ ГК в ответ на стимуляцию; б – запись импульсной активности “SIN” при совпадении центра его РП с центром РП ДИ ГК (каждая черная черта – наличие импульса в ответ на движение стимула в данном направлении).
Если ДИ ТН мы могли исследовать уже отработанной системой стимуляции ГК, иногда только требовалось увеличить область стимуляции, то для таких ТН в ходе электрофизиологических экспериментов еще не была подобрана адекватная стимуляция. Реакции на различные стимулы могут появляться при зрительной стимуляции почти на всей площади экрана монитора, поэтому можно сказать, что РП “SIN” большое.
Реперной точкой для картирования РП “SIN” может служить положение РП ДИ ГК. Эти нейроны (“SIN”) реагируют на выход стимула из области их рецептивного поля, что видно на рис. 3, б, где отсутствуют импульсы в центральной части области стимуляции. Такая картина импульсной активности получается только, когда центры РП ДИ ГК и “SIN” совпадают. В данном случае стимулом являлась светлая движущаяся граница при темном фоне области стимуляции.
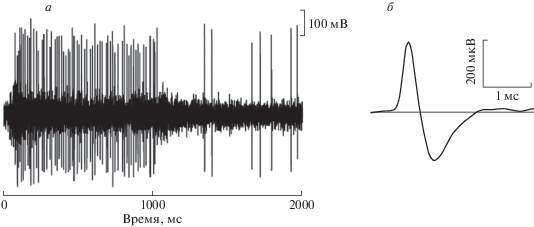
Процесс подбора адекватной стимуляции при отсутствии каких-либо сведений о нейроне (ГК, ТН) в общем случае начинается со стимуляции от руки. Для первоначальной стимуляции был выбран стимул черная полоса (черная картонная полоска). Полоску помещали на периферии предполагаемого центра поля нейрона, и при ее выдвижении от окна области стимуляции к краям экрана монитора наблюдался регулярный мощный разряд тектального нейрона. На рис. 4, а представлен регулярный разряд “SIN”, который впервые удалось вызвать и записать при стимуляции описанным выше способом.
Рис. 4.
Импульсная активность поверхностного ТН – “SIN”. а – “регулярная” импульсная активность “SIN” при стимуляции черной полосой (черная картонная полоска), предъявляемой “от руки”; б – двухфазная форма импульса “SIN”.
При этом в ходе эксперимента было отмечено, что наиболее ярко выраженные ответы возникают при движении стимула от области стимуляции, в границах которой предположительно заключен центр РП “SIN” к краям экрана монитора. Исходя из этого была создана схема стимуляции, представленная на рис. 5: область стимуляции перемещали от центрального положения далее по его периметру.
Рис. 5.
Схематичное изображение экрана монитора с импульсной активностью “SIN”. Описание рисунка в тексте.
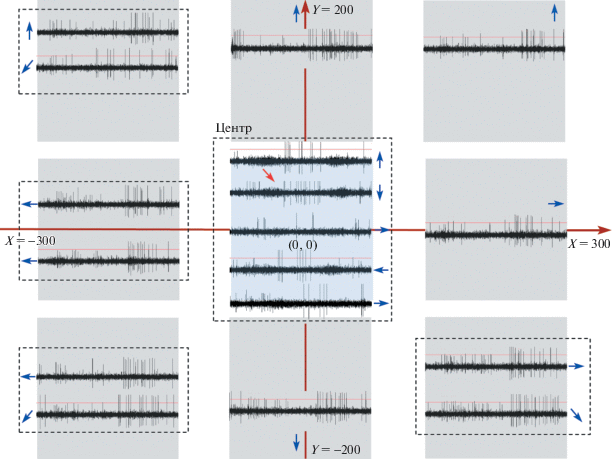
Центральное положение окна области стимуляции представлено голубым квадратом, оно являлось как начальным, так и конечным положением области стимуляции. От центра окно последовательно перемещали по координатной сетке (х, у; темно-красные оси) вправо и далее по часовой стрелке по периметру центрального положения – серые квадраты. Черным пунктиром объединены импульсные активности ТН, относящиеся к одному положению окна на координатной сетке. Во время эксперимента голубая и серые области прилегают друг к другу вплотную, разнесение на данной схеме сделано во избежание наложения картин импульсной активности.
В каждом из положений области стимуляции производились стимуляция нейрона и запись его реакции в ответ на движение стимула к периферии экрана монитора, в угловых позициях использовалось несколько направлений движения стимула. Стимулом являлась широкая черная полоса, превышающая размер области стимуляции, движущаяся по светлому фону области стимуляции при темной периферии. Направления движений стимула при данном положении области стимуляции отмечено синими стрелками.
В результате последовательного перемещения окна стимуляции и записи реакций “SIN” получались карты импульсной активности нейрона, пример такой карты представлен на рис. 5.
На рис. 5 реакции, отводимые от аксональной терминали ДИ ГК, видны как расширение фоновой полосы шума, а импульсы ТН имеют большую амплитуду. Так как область стимуляции сцентрирована относительно одновременно регистрируемой каудоростральной ДИ ГК, на средней записи в центральной пунктирной рамке отсутствует ретинальная активность, поскольку стимул двигался в рострокаудальном направлении (противоположном предпочтительному для данной ДИ ГК). Регулярные реакции “SIN” видны в ответ на посветление дальней периферии рецептивного поля при неизменном освещении его центра (импульсы меньшей амплитуды принадлежат другому нейрону).
ОБСУЖДЕНИЕ
В ходе экспериментов мы время от времени регистрируем реакции нейронов тектума на разных уровнях ТО, но мы не имеем возможности метить нейроны, от которых происходит регистрация клеточной активности. Поэтому для построения гипотез и высказывания предположений о функциях ТН, реакции которых мы регистрируем, мы опираемся на литературные данные с использованием иных методик. Чаще всего это данные, полученные на мальках данио с использованием кальциевого имаджинга. Однако так же существуют работы, выполненные с использованием генетических методов визуализации нейронов, и регистрация электрической активности отдельных нейронов пэтч-клампом.
Согласно данным, полученным нами ранее, ДИ ТН карасей и карпов по результатам статистического анализа можно разделить на две группы – более поверхностные на глубинах порядка 100 мкм и более глубокие – на глубине порядка 300 мкм (Aliper et al., 2019; Damjanović et al., 2019).
При этом мы наблюдаем двухфазную форму импульса, характерную для регистрации от тела нейрона (Maximova et al., 2012). Таким образом, вероятно, аксональные окончания ГК образуют синапсы не на теле глубоких ДИ ТН, а на их восходящих дендритах. В морфологических работах было показано, что существуют нейроны с телами в перивентрикулярном слое ТО и восходящими в ретино-реципиентный слой дендритами (Gabriel et al., 2012; Nikolaou et al., 2015). Такие нейроны – глутаматергические интернейроны с дендритными ветвлениями в SFGS (Robles et al., 2011).
Дирекционально-избирательные тектальные нейроны, по всей видимости, объединяют входы от ДИ ГК. ДИ ТН трех типов (у карасей и карпов) с теми же предпочтительными направлениями движения стимула, что и у ДИ ГК, получают информацию напрямую от соответствующих ДИ ГК. Четвертый тип ДИ ТН, выделяющий рострокаудальное направление, вероятно, комбинирует неким образом поступающую к нему от ГК информацию.
Можно предположить различные варианты возникновения четвертого, рострокаудального, направления. Во-первых, селективность по данному направлению может быть сформирована путем комбинирования входных сигналов от вентродорсальных и дорсовентральных ДИ ГК сетчатки. Во-вторых, возможно, что рострокаудальное предпочтительное направление формируется полностью на уровне тектума с использованием входной информации от ГК без ДИ (Grama, Engert, 2012). В таком случае это происходит при помощи асимметричного торможения в ТО – Грама и соавт. предположили, что существует особый тип ингибирующего тектального интернейрона. Такой интернейрон ассиметрично связан с ДИ ТН и реагирует на стимулы, движущиеся в нулевом направлении (т.е. в противоположном относительно предпочтительного).
У Danio rerio ДИ ТН также можно разделить на четыре физиологических подтипа с различными предпочтительными направлениями, сходными с теми, что были зарегистрированы у взрослых карасей и карпов (Hunter et al., 2013). В том числе и рострокаудальные ДИ ТН, явно не присутствующие во входных сигналах сетчатки.
В SO помимо аксонов ГК расположены также тела поверхностных ТН – в англоязычной литературе SIN – superficial inhibitory neurons. Эти нейроны являются ГАМК-эргическими (Bene et al., 2010). Они обнаруживаются и на препаратах, окрашенных по Гольджи (Lazareviċ et al., 1998), и различными методами визуализации, например кальциевым имаджингом (Barker, Baier, 2013; Bene et al., 2010). О функциях SIN в литературе существует несколько гипотез, которые по большей части основаны на предположении о наличии сходства SIN и звездчатых амакриновых клеток сетчатки (ЗАК). Морфологически их сходство заключается в наличии крупного центрально симметричного дендритного ветвления, расположенного только в одном слое. Некоторые авторы утверждают, что SIN обладают дирекциональной избирательностью (Hunter et al., 2013; Yin et al., 2019). Однако за все время проведения электрофизиологических экспериментов мы не видели у поверхностных ТН, которые мы считаем предположительно SIN (“SIN”), предпочтений в направлении движения стимула.
Согласно одной из гипотез, проводящей аналогию между SIN и ЗАК, SIN могли бы обеспечивать торможение зрительного поля между двумя подтипами нейронов, настроенных на крупные и мелкие объекты (Preuss et al., 2014). Другими словами, ГАМК-эргические SIN рассматривают как часть системы распознавания объектов различных размеров в поле зрения, что является ключевым моментом для запуска подходящей поведенческой программы.
Другая гипотеза предполагает, что SIN, функционируя по принципу ЗАК, участвуют в формировании связей, позволяющих выделять рострокаудальное направление. В этом случае SIN должны формировать удаленные связи с ДИ ТН, которые расположены глубже в ТО. Известно, что перивентрикулярные нейроны как раз посылают длинные дендриты в верхние слои тектума, такие как SO и SFGS. Таким образом, SIN могут формировать ГАМК-эргические синапсы на дендритах ДИ ТН, так же как ЗАК формируют на дендритах ДИ ГК.
Еще одна гипотеза так же связана с выделением признаков объекта, однако на другом уровне: предполагается, что SIN могут участвовать в выделении наиболее значимого стимула в своем поле зрения (pop-out стимул) по механизму “winner-take-all” (Preuss et al., 2014). Данный механизм работает при наличии в поле зрения нескольких конкурирующих стимулов, выбор между ними происходит за счет латерального торможения соседних областей ТО, которые получают ретинальные проекции от разных частей поля зрения.
При помощи этой гипотезы можно попытаться дать объяснение картине, наблюдаемой на рис. 5. Данная карта импульсной активности является наиболее удачным вариантом из восьми сделанных для различных “SIN” (всего было зарегистрировано и проанализировано порядка 20 “SIN”). Для остальных нейронов карту сделать сложнее, так как не была точно разработана схема стимуляции, из-за чего положения окна стимуляции не были точно выверены, а записи реакций были частично пропущены.
Можно предположить, что каждый импульс поверхностного ТН (“SIN”) – это момент выделения ГАМК, т.е. торможение. “SIN” в центральной части области стимуляции, расположенной по положению центра РП ДИ ГК off-типа, не выдает регулярной импульсации, т.е. не оказывает тормозных влияний, таким образом пропуская сигнал от этого ДИ ГК off-типа дальше. Как заметно на визуализации импульсной активности, одновременно с активностью ДИ ГК спайков ТН либо нет, либо очень мало (рис. 5, пример отмечен красной стрелкой). Однако на периферии картина иная: возникают регулярные залпы “SIN”, которые в случае существования в этой области поля зрения рыбы иных стимулов затормозят реакции ГК, “смотрящих” на них. Следовательно, “SIN” как бы пропускает информацию от ГК-детектора признака о наиболее значимом стимуле (pop-out стимул) в поле зрения в данный момент.
Мы получили первые регулярные ответы при одном из многочисленных испробованных способов стимуляции. Данный прогресс являлся стимулом для продолжения экспериментальной деятельности в этом направлении. Очевидно, что для оптимизации экспериментальной работы и получения большего количества визуализаций импульсной активности “SIN” необходимо создание нового программного инструмента. Такой инструмент позволил бы автоматически обмерять реакции “SIN” на движение стимула в периферической области РП. Например, можно представить инструмент следующим образом: стимул в форме черного кольца изначально расположен в области стимуляции, где предположительно заключен центр РП нейрона, далее кольцо увеличивается в диаметре и освобождает более светлую периферию. Так мы имитируем движение стимула от границ области стимуляции (и центра РП) к периферии, но только со всех сторон относительно области стимуляции (на рис. 5, от голубого центрального квадрата к периферии экрана). Такая стимуляция подтвердит или опровергнет нашу трактовку причины появления реакции “SIN”.
Тектальные нейроны, таким образом, связаны как минимум с некоторыми типами ретинальных элементов, такими как ДИ ГК. Помимо этого ТН реагируют на маленькие стимулы (размером чуть больше 1°) так же, как и собственно ретинальные детекторы пятна. Однако в тектальной активности нами практически не было отмечено активности, связанной с ориентационно-избирательными ГК (детекторы ориентированных линий: горизонтальных и вертикальных), несмотря на то, что часть ДИ ТН расположена на одном с ними уровне (Aliper et al., 2019). В литературе есть данные кальциевого имиджинга об ориентационно-избирательных нейронах в ТО (Hunter et al., 2013).
Необходимо дальнейшее изучение функций тектальных нейронов, расположенных в ТО на различных уровнях. Для лучшего понимания роли “SIN”, которые мы считаем предположительно SIN, нужно определить, с какими ретинальными элементами, а также с какими ТН других типов они образуют связи собственно в тектуме. Кроме того, создание программного инструмента для стимуляции таких “SIN”, вероятно, позволит выявить адекватную стимуляцию для ТН такого типа, что приблизит нас к пониманию функций данных нейронов.
Исследование выполнено при поддержке РФФИ (грант № 20-015-00063).
Список литературы
Максимов В.В., Максимова Е.М., Максимов П.В. Классификация дирекционально-избирательных элементов, регистрируемых в тектуме карася. Сенсорные системы. 2005. Т. 19. № 4. С. 322–335.
Максимов В.В., Максимова Е.М., Максимов П.В. Классификация ориентационно-избирательных элементов, проецирующихся в тектум карася. Сенсорные системы. 2009. Т. 23. № 1. С. 13–23.
Aliper A.T., Zaichikova A.A., Damjanović I., Maximov P.V., Kasparson A.A., Gačić Z., Maximova E.M. Updated functional segregation of retinal ganglion cell projections in the tectum of a cyprinid fish – further elaboration based on microelectrode recordings. Fish Physiol. Biochem. 2019. V. 45. № 2. P. 773–792.
Barker A.J., Baier H. SINs and SOMs: neural microcircuits for size tuning in the zebrafish and mouse visual pathway. Front. Neural Circuits. 2013. V. 7. P. 89.
Barker A.J., Baier H. Sensorimotor decision making in the zebrafish tectum. Curr. Biol. 2015. V. 25. № 21. P. 2804–2814.
Ben-Tov M., Donchin O., Ben-Shahar O., Segev R. Pop–out in visual search of moving targets in the archer fish. Nat. Commun. 2015. V. 6. № 1. P. 1–11.
Bene F. Del, Wyart C., Robles E., Tran A., Looger L., Scott E.K., Isacoff E.Y., Baier H. Filtering of visual information in the tectum by an identified neural circuit. Science. 2010. V. 330. № 6004. P. 669–673.
Damjanović I., Maximova E.M., Maximov V.V. On the organization of receptive fields of orientation-selective units recorded in the fish tectum. J. Integr. Neurosci. 2009. V. 8. P. 323–344.
Damjanović I., Maximov P., Aliper A., Zaichikova A., Gačić Z., Maximova E. Putative targets of direction-selective retinal ganglion cells in the tectum opticum of cyprinid fish. Brain Research. 2019. V. 1708. 1 April 2019. P. 20–26.
Gabriel J.P., Trivedi C.A., Maurer C.M., Ryu S., Bollmann J.H. Layer-Specific Targeting of Direction-Selective Neurons in the Zebrafish Optic Tectum. Neuron. 2012. V. 76. № 6. P. 1147–1160.
Gesteland R.C., Lettvin J.Y., Howland B., Howland B., Pitts W.H. Comments on Microelectrodes. Proc. IRE. 1959. V. 47. № 11. P. 1856–1862.
Grama A., Engert F. Direction selectivity in the larval zebrafish tectum is mediated by asymmetric inhibition. Front. Neural Circuits. 2012. V. 6. № September. P. 59.
Hunter P.R., Lowe A.S., Thompson I.D., Meyer M.P. Emergent properties of the optic tectum revealed by population analysis of direction and orientation selectivity. J. Neurosci. 2013a. V. 33. № 35. P. 13940–13945.
Kardamakis A.A., Saitoh K., Grillner S. Tectal microcircuit generating visual selection commands on gaze–controlling neurons. Proc. Natl. Acad. Sci. 2015. V. 112. № 15. P. E1956–E1965.
Kinoshita M., Ito E. Roles of periventricular neurons in retinotectal transmission in the optic tectum. Prog. Neurobiol. 2006. V. 79. № 2. P. 112–121.
Lazareviċ L., Rogač L. and Rakiċ L. Citoarchitetonic analysis of tectum opticum in Serranus scriba. Iugoslavica Physiologica et Pharmacologica Acta. 1998. V. 34 (2). P. 335–341.
Maximov V.V., Maximova E.M., Maximov P.V. Direction selectivity in the goldfish tectum revisited. Ann. N. Y. Acad Sci. 2005. V. 1048. P. 198–205.
Maximova E., Pushchin I., Maximov P., Maximov V. Presynaptic and postsynaptic single–unit responses in the goldfish tectum as revealed by a reversible synaptic transmission blocker. J. Integr. Neurosci. 2012. V. 11. № 2. P. 183–191.
Nevin L.M., Robles E., Baier H., Scott E.K. Focusing on optic tectum circuitry through the lens of genetics. BMC Biol. 2010. V. 8. № 1. P. 126.
Nikolaou N., Lowe A.S., Walker A.S., Abbas F., Hunter P.R., Thompson I.D., Meyer M.P. Parametric Functional Maps of Visual Inputs to the Tectum. Neuron. 2012. V. 76. № 2. P. 317–324.
Nikolaou N., Meyer M.P. Lamination Speeds the Functional Development of Visual Circuits. Neuron. 2015. V. 88. № 5. P. 999–1013.
Northmore D.P.M. The Optic Tectum. In Encyclopedia of Fish Physiology: From Genome to Environment. Под ред. Farrell A.P. Elsevier. 2011. P. 131–142.
Preuss S.J., Trivedi C.A., Berg-Maurer C.M. Vom, Ryu S., Bollmann J.H. Classification of object size in retinotectal microcircuits. Curr. Biol. 2014. V. 24. № 20. P. 2376–2385.
Robles E., Filosa A., Baier H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. J. Neurosci. 2013. V. 33. № 11. P. 5027–5039.
Robles E., Smith S.J., Baier H. Characterization of genetically targeted neuron types in the zebrafish optic tectum. Front. Neural Circuits. 2011. V. 5. № FEB.
Walker A.S., Burrone J., Meyer M.P. Functional imaging in the zebrafish retinotectal system using RGECO. Front. Neural Circuits. 2013. V. 7. P. 34.
Yin C., Li X., Du J. Optic tectal superficial interneurons detect motion in larval zebrafish. Protein Cell. 2019. V. 10. P. 238–248.
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


