Сенсорные системы, 2023, T. 37, № 2, стр. 130-137
Реакция имаго огневки Ostrinia scapulalis на световые стимулы в ветровом тоннеле
М. И. Жуковская 1, *, О. Г. Селицкая 2, А. В. Щеникова 2, А. А. Мильцын 2, И. В. Грушевая 2, А. Г. Конончук 2, А. Н. Фролов 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, пр. Тореза, 44, Россия
2 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, г. Пушкин, ш. Подбельского, д. 3, Россия
* E-mail: mzhukovskaya@yahoo.com
Поступила в редакцию 19.01.2023
После доработки 13.02.2023
Принята к публикации 16.03.2023
- EDN: QTCPSV
- DOI: 10.31857/S0235009223020063
Аннотация
Привлечение ночных насекомых светом – известный феномен с неизвестными физиологическими механизмами. Бабочки из надсемейства огневкообразных Pyraloidea характеризуются наиболее выраженной реакцией на свет, однако спектральные предпочтения этих насекомых не изучены. Огневка Ostrinia scapulalis, обитающая на двудольных растениях, вредитель конопли и хмеля, является предковой формой для восточного и европейского кукурузных мотыльков, широко распространенных вредителей кукурузы. При помощи ветрового тоннеля, модифицированного для подачи света, тестировали ответы самцов и самок на световые стимулы с максимумами эмиссии 532, 440 и 365 нм и освещенностью 2 лк, создаваемой в месте выпуска насекомого, способных стимулировать как фоторецепторы сложных глаз (с максимумами чувствительности 352, 413, 480 и 530 нм), так и простых глазков – оцеллей, чувствительность которых имеет главный пик в ультрафиолете и дополнительный в зеленой области спектра (360 и 520 нм). Оказалось, что наиболее привлекательным стимулом был ультрафиолет. На зеленый свет реагировал небольшой процент насекомых, при этом демонстрировавших реакцию замирания вблизи источника света. Наименее привлекательным был синий свет, который также вызывал замирания. Таким образом, лёт O. scapulalis вызывается коротковолновым светом. Эта реакция больше соответствует чувствительности оцеллей, чем сложных глаз. Синее или зеленое излучение приводит к реакции маскинга.
ВВЕДЕНИЕ
Щетконогий мотылек Ostrinia scapulalis (Wlk.) – ночное насекомое семейства огневок-травянок (Crambidae), ближайшими родственниками которого являются такие широко распространенные вредители сельскохозяйственных культур, как европейский O. nubilalis (Hbn.) и восточный O. furnacalis (Gn.) стеблевые кукурузные мотыльки (Mutuura, Munroe, 1970). Так, O. nubilalis является серьезным вредителем кукурузы в Европе, Северной Африке и Северной Америке, O. furnacalis повреждает ее в Азии и Австралазии, в то время как O. scapulalis питается различными видами двудольных растений-хозяев в Европе и Азии, повреждая возделываемые бобовые культуры Vigna spp., хмель Humulus lupulus L., коноплю Cannabis sativa L., а также ряд дикорастущих и сорных видов, таких как полынь обыкновенная Artemisia vulgaris L., дурнишник зобовидный Xanthium strumarium L., циклахена дурнишниколистная Cyclachaena xanthiifolia (Nutt.) Fresen, амброзия полыннолистная Ambrosia artemisiifolia L. и многих других (Mutuura, Munroe, 1970; Фролов, 1984; Ishikawa et al., 1999; Frolov et al., 2007). Питание на двудольных видах кормовых растений – анцестральный признак в роде Ostrinia (Yang et al., 2021). Результаты поведенческих и электрофизиологических экспериментов дают основание предполагать наличие сенсорных преадаптаций к освоению злаковых растений-хозяев у сохранившего предковые трофические связи с двудольными растениями-хозяевами O. scapulalis (Щеникова и др., 2020). Хотя O. nubilalis и O. scapulalis характеризуются идентичным полиморфизмом феромонного сигнала у самок (Huang et al., 2002; Takanashi et al., 2005), в условиях симпатрии оба вида сохраняют свою идентичность, несмотря на то, что межвидовые гибриды вполне жизнеспособны и способны в условиях лаборатории производить плодовитое потомство (Фролов, 1984). Морфологически эти виды очень схожи, и их до сих пор путают (Frolov et al., 2007), поэтому неудивительно, что хотя O. scapulalis является весьма опасным вредителем, поведение и сенсорные системы этого насекомого все еще остаются практически неизученными.
Привлечение светом насекомых, ведущих сумеречно-ночной образ жизни, широко используется для их сбора, хотя механизмы такого поведения до сих пор слабо изучены (Жуковская и др., 2022; Фролов, 2022), что во многом обусловлено сложностью создания источников света с заданными характеристиками.
Мотыльки обладают глазами двух типов – парой больших фасеточных сложных глаз и парой простых глазков – оцеллей (Belušič et al., 2017). Сложные глаза Ostrinia относятся к суперпозиционному типу, характерному для многих ночных насекомых, и способны увеличивать чувствительность за счет уменьшения разрешающей способности глаза посредством миграции экранирующего пигмента вдоль оси омматидия. Омматидии сложного глаза состоят из 12 фоторецепторных клеток, относящихся к четырем спектральным классам с максимумами чувствительности 352, 413, 480 и 530 нм, при этом две клетки нижнего яруса имеют черты поляризационных детекторов (Belušič et al., 2017; Chen et al., 2019). Суммарная чувствительность глаза, измеренная при помощи электроретинографии, имеет наибольшее значение в зеленой части спектра (Belušič et al., 2017). Парные оцелли, расположенные на темени, вблизи дорзального края сложных глаз показывают главный пик чувствительности в ультрафиолетовой и небольшой – в зеленой области спектра (Belušič et al., 2017). Такое строение фоторецепторных органов указывает на существенную роль света разных длин волн в поведении этих насекомых, однако, ранее полученные данные указывают лишь на привлечение имаго УФ-светом (Грушевая и др., 2019; Фролов и др., 2021). Вероятно, разнообразие зрительных пигментов и фоторецепторов было унаследовано ими от предковых форм, поскольку в надсемействе Pyraloidea, к которому относится щетконогий мотылек, встречаются виды с дневной активностью (Kawahara et al., 2018), более того, сообщается, что брачное поведение некоторых видов рода Ostrinia, а именно, O. marginalis Wlk. и O. peregrinalis (Ev.), обитающих в высоких широтах, а также O. orientalis Mutuura et Munroe из Японии, происходит в дневное время (Ishikawa et al., 1999). Не исключено, что ведущие ночной образ жизни мотыльки могут использовать цветовое зрение и в сумеречное, и ночное время, как ранее было показано для бражников Deilephila elpenor L., Hyles galii (Rott.) и H. lineata (F.), и пчелы-плотника Xylocopa tranquebarica (F.), причем не только для поиска цветов с нектаром, но и для ориентации при перелетах (Kelber et al., 2002, 2003; Somanathan et al., 2008; Warrant, Somanathan, 2022). Щетконогий мотылек, как и кукурузные мотыльки, ведет, в основном, ночной образ жизни (Huang et al., 1997), хотя наблюдения, сделанные на островах Амами, расположенных южнее острова Кюсю, свидетельствуют, что мотыльки этого вида спаривались в дневное время (Ishikawa et al., 1999). Известно, что имаго чешуекрылых при поиске пригодных для развития своего потомства растений-хозяев ориентируются помимо запаховых стимулов на зрительные сигналы (Jakobsson et al., 2017).
Цель настоящей работы – изучение поведенческих ответов имаго щетконогого мотылька O. scapulalis на световые сигналы разных спектральных диапазонов в лабораторных экспериментах.
МАТЕРИАЛЫ И МЕТОДЫ
Перезимовавших пронимф (неактивных гусениц последнего возраста) O. scapulalis собирали весной 2022 г. в растительных остатках полыни в окр. пос. Заря (ранее Жарынь) Смоленской области. Собранный живой материал помещали в 0.5 л стеклянные сосуды с гофрированными листами писчей бумаги. Для постдиапаузной реактивации пронимф бумажные вкладыши с насекомыми в сосудах обильно смачивали дистиллированной водой, а затем переносили в климатическую камеру MLR-352, Sanyo (Panasonic), где поддерживали температуру 25 ± 2°C и фоторежим 18:6 ч, освещение включалось ежедневно в 18:00 ч. В опытах использовали девственных самцов и самок в возрасте 3–5 дней. За час до начала эксперимента бабочек рассаживали поодиночке в чашки Петри стандартного размера и держали до проведения экспериментов в полной темноте. Эксперименты проводили с одиночными насекомыми. Первыми тестировали самцов и лишь затем самок с целью предотвращения возможного влияния полового феромона самок на самцов.
Внутри изготовленного из плексигласа ветрового тоннеля (150 × 70 × 70 см) создавался поток воздуха со скоростью 0.2–0.3 м/с (рис. 1) (Royer, McNeil, 1993).
Рис. 1.
Схема установки.
Направление потока воздуха обозначено стрелкой. LED – светодиод, mesh – сетчатая стенка, через которую отсасывается воздух.
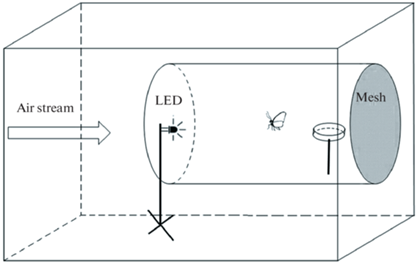
Для обеспечения ламинарности течения воздуха в туннеле размещена прозрачная труба длиной 1.00 м и диаметром 0.40 м. Источник света помещали в начале трубы, чашку Петри с насекомым – в конце на высоте 0.1 м от пола трубы. Освещенность начального месторасположения насекомых в туннеле обеспечивалась светодиодами с максимумами излучения 532, 440 и 365 нм на уровне 2.0 лк (контроль освещенности обеспечивали при помощи люксметра Ю16 с фотоэлементом Ф102). В контрольных экспериментах эти светодиоды не включали. Эксперименты проводили во время темновой фазы суточного цикла – времени максимальной активности этих насекомых. После периода адаптации (3 мин) верхнюю крышку чашки с насекомым осторожно снимали и включали световой стимул. Наблюдения проводили при красном (650 нм) освещении 0.7 люкс, температуре воздуха 25 ± 2°С в течение 10 мин. Регистрировали время взлета; направленность движения в сторону источника света или от него; посадку у источника света. Каждое насекомое в эксперименте использовали только однократно.
Полученные данные статистически обрабатывали с использованием параметрических (критерий Стьюдента) и непараметрических (точный тест Фишера, критерий Манна–Уитни, Хи-квадрат) методов в программе MS Excel и при помощи онлайн-калькулятора http://vassarstats.net/.
РЕЗУЛЬТАТЫ
Ответные реакции на свет самцов и самок щетконогого мотылька статистически не отличались (критерий Хи-квадрат, р > 0.05 для всех случаев, табл. 1), поэтому в дальнейшем данные анализировали без учета пола особей.
Таблица 1.
Количества прореагировавших и непрореагировавших самцов и самок Ostrinia scapulalis на свет в ветровом тоннеле
| Свет | Реакция насекомых | Количество | |
|---|---|---|---|
| Cамки | Cамцы | ||
| Зеленый | Взлет | 4 | 8 |
| Полет к источнику | 4 | 8 | |
| Посадка у источника | 3 | 4 | |
| Полет от источника | 0 | 0 | |
| Нет реакции | 16 | 22 | |
| Всего имаго в опыте | 20 | 30 | |
| Синий | Взлет | 1 | 2 |
| Полет к источнику | 1 | 1 | |
| Посадка у источника | 0 | 0 | |
| Полет от источника | 0 | 1 | |
| Нет реакции | 11 | 10 | |
| Всего имаго в опыте | 12 | 12 | |
| Ультра-фиолет | Взлет | 20 | 19 |
| Полет к источнику | 20 | 18 | |
| Посадка у источника | 13 | 14 | |
| Полет от источника | 0 | 1 | |
| Нет реакции | 12 | 17 | |
| Всего имаго в опыте | 32 | 36 | |
| Контроль | Взлет | 1 | 1 |
| Полет к источнику | 1 | 1 | |
| Посадка у источника | 0 | 0 | |
| Полет от источника | 0 | 0 | |
| Нет реакции | 9 | 11 | |
| Всего имаго в опыте | 10 | 12 | |
Оказалось, что ответы бабочек на УФ-излучение существенно превосходят ответы как на зеленый, так и на синий свет (рис. 2), а именно, 57% от общего количества протестированных особей отвечали взлетом на УФ-свет, что существенно больше, чем на зеленый и синий свет (в обоих случаях р < 0.001, точный критерий Фишера).
Рис. 2.
Доли имаго, прореагировавших на свет разных спектральных характеристик.
Статистически достоверные различия (точный критерий Фишера, p < 0.001) обнаружены между реакциями на УФ vs зеленый УФ и vs синий свет.

Пропорции особей, реагирующих на синий и зеленый свет, не различались между собой (р > 0.05, точный критерий Фишера). Большинство взлетевших насекомых направлялись к источнику света. При предъявлении синего или зеленого света особи, садившиеся на освещенные поверхности, часто демонстрировали полную неподвижность, в ответ на ультрафиолет насекомые ненадолго останавливались у источника, многократно взлетали, кружа над источником.
Латентный период ответов также различался для УФ и видимого освещения. Так, время взлета для зеленого света было значительно больше, чем для УФ (p < 0.05, критерий Манна–Уитни) (рис. 3).
Рис. 3.
Латентный период реакции на свет разных частей спектра (с) у мотыльков O. scapulalis.
Звездочкой обозначены достоверные различия (p < 0.05, критерий Манна–Уитни).
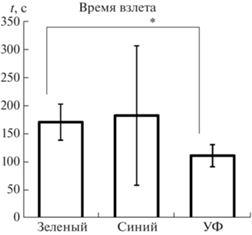
Поскольку на синий свет прореагировали только три мотылька, статистическое сравнение этой серии с остальными оказалось невозможным.
ОБСУЖДЕНИЕ
Известно, что свет привлекает многих насекомых, принадлежащих к различным таксономическим группам (Pachkin et al., 2022). Однако расширение видового состава исследуемых видов приводит к накоплению данных о значительном разнообразии в спектральных характеристиках света, привлекающего насекомых. Так, восточная луговая совка, Mythimna separata (Wlk.), предпочитает зеленый свет (520 нм) (Kim et al., 2018). Стеблевая рисовая огневка Scirpophaga incertulas (Wlk.) лучше всего летит на УФ-свет (365 нм), а рисовая листовертка Cnaphalocrocis medinalis (Gn.) предпочитала более фиолетовый 400 нм свет (Chiranjeevi, Velmathi, 2021). Зеленая рисовая цикадка Nephotettix cincticeps (Uhler) демонстрирует положительный фототаксис в пределах широкого диапазона длин волн, от 480 до 740 нм, который, по-видимому, обеспечивается зеленочувствительным зрительным пигментом с максимумом поглощения около 520 нм (Wakakuwa et al., 2014).
Ветровой тоннель издавна используется для изучения поведенческих реакций насекомых на ольфакторные стимулы (Miller, Roelofs, 1978; Cardé, Hagaman, 1979; Baker, Linn, 1984; Colvin et al., 1989; Charlton et al., 1993). Очевидно, что направленный поток воздуха в наших экспериментах облегчает запуск полета вследствие стимуляции ветрочувствительных рецепторов (Свидерский, 1980; Möhl, 1989) и позволяет моделировать условия тестирования в лаборатории, приближенные к естественным. Изучение аттрактивности зрительных стимулов чаще всего проводится в лабораторных условиях без потока воздуха (Wakakuwa et al., 2014; Kim et al., 2018; Chiranjeevi, Velmathi, 2021), однако, показано, что ветер облегчает ответы на зеленый свет у белокрылки Bemisia tabaci (Gennadius) (Isaacs et al., 1999).
Полученные нами данные свидетельствуют о высокой аттрактивности УФ-света для имаго O. scapulalis по сравнению с более длинноволновым светом, воспринимаемым их фоторецепторами. Синий и зеленый свет не вызывали достоверного положительного фототаксиса, несмотря на присутствие фоторецепторов, воспринимающих такое излучение (Belušič et al., 2017). Синий и зеленый световые стимулы, хоть и вызывали у небольшой части мотыльков полет к источнику света, но их поведение при этом кардинально отличалось, а именно, насекомые садились на освещенные поверхности и оставались неподвижными. Такое поведение говорит в пользу реакции маскинга, т.е. проявлении поведения, характерного для дневной фазы цикла при освещении ночью (Mrosovsky, 1999; Новикова, Жуковская, 2017) и может быть связано с механизмами биологических часов. К сожалению, в литературе отсутствуют данные о спектральных характеристиках света, синхронизирующего суточные ритмы у мотыльков рода Ostrinia, однако известно, что по крайней мере у некоторых Lepidoptera циркадным фоторецептором служит пигмент криптохром в клетках мозга (Brady et al., 2021), активируемый голубым светом.
Поскольку ультрафиолет оказался наиболее привлекательным стимулом, можно предположить существенную роль оцеллей в лёте мотыльков на свет в ночных условиях, в которых суммация сигнала с большого числа фоторецепторов позволяет инициировать ответ на свет низкой интенсивности, такие как лунный свет под пологом растительности или свет звезд (Mizunami, 1995). В экспериментах с закрашиванием и удалением оцеллей было показано, что эти органы позволяют оценивать пороговую освещенность для начала летной активности у имаго совки Trichoplusia ni (Hbn.) (Eaton et al., 1983). Кроме того, более быстрая, чем от фоторецепторов сложных глаз, обработка сигнала от оцеллярных нейронов и передача информации в грудные ганглии позволяют насекомому выравнивать положение тела в полете при слабом освещении (Van Kleef et al., 2008).
Исследование выполнено за счет гранта Российского научного фонда (проект № 22-26-00199).
Список литературы
Грушевая И.В., Конончук А.Г., Малыш С.М., Мильцын А.А., Фролов А.Н. Светодиодная ловушка для мониторинга кукурузного мотылька Ostrinia nubilalis: результаты испытания в Краснодарском крае. Вестник защиты растений. 2019. Т. 102. № 4. С. 49–54. https://doi.org/10.31993/2308-6459-2019-4-102-49-54
Жуковская М.И., Северина И.Ю., Новикова Е.С. Световое антропогенное загрязнение: действие на насекомых. Биосфера. 2022. Т. 14. № 2. С. 126–136. https://doi.org/10.24855/biosfera.v14i2.669
Новикова Е.С., Жуковская М.И. Реакция замирания под действием яркого света у американского таракана, Periplaneta americana. Сенсорные системы. 2017. Т. 31. № 1. С. 44–50.
Свидерский В.Л. Полет насекомого. М.: Наука, 1980. С. 136.
Фролов А.Н. Биотаксономический анализ вредных видов рода Ostrinia Hbn. Этология насекомых. Труды Всесоюзного энтомологического общества. Л.: Наука, 1984. Т. 66. С. 4–100.
Фролов А.Н. Управление поведением вредных насекомых: световые, химические сигналы и их совместное действие. Энтомологическое обозрение. 2022. Т. 101. № 3. С. 453–502. https://doi.org/10.31857/S0367144522030017
Фролов А.Н., Грушевая И.В., Конончук А.Г. Современные типы ловушек для мониторинга чешуекрылых на примере кукурузного мотылька. Монография. СПб. Наукоемкие технологии, 2021. С. 120.
Щеникова А.В., Жуковская М.И., Селицкая О.Г., Грушевая И.В., Фролов А.Н. Чувствительность обонятельной системы у видов-двойников рода Ostrinia: преадаптация к освоению нового растения-хозяина? Журнал эволюционной биохимии и физиологии. 2020. Т. 56. № 7. С. 723–729. https://doi.org/10.31857/S004445292007253x
Baker T.C., Linn C.E. Jr. Wind tunnels in pheromone research. Techniques in pheromone research. Eds Hummel H.E., Miller T.A. New York. Springer, 1984. Ch. 3. P. 75–110. https://doi.org/10.1007/978-1-4612-5220-7_3
Belušič G., Šporar K., Meglič A. Extreme polarisation sensitivity in the retina of the corn borer moth Ostrinia. J. Exp. Biol. 2017. V. 220. № 11. P. 2047–2056. https://doi.org/10.1242/jeb.153718
Brady D., Saviane A., Cappellozza S., Sandrelli F. The circadian clock in Lepidoptera. Front. Physiol. 2021. V. 12. https://doi.org/10.3389/fphys.2021.776826
Cardé R.T., Hagaman T.E. Behavioral responses of the gypsy moth in a wind tunnel to air-borne enantiomers of disparlure. Environ. Entomol. 1979. V. 8. № 3. P. 475–484. https://doi.org/10.1093/ee/8.3.475
Charlton R.E., Kanno H., Collins R.D., Cardé R.T. Influence of pheromone concentration and ambient temperature on flight of the gypsy moth, Lymantria dispar (L), in a sustained-flight wind tunnel. Physiol. Entomol. 1993. V. 18 № 4. P. 349–362. https://doi.org/10.1111/j.1365-3032.1993.tb00608.x
Chen Q.X., Chen Y.W., Li W.L. Ultrastructural comparison of the compound eyes of the Asian corn borer Ostrinia furnacalis (Lepidoptera: Crambidae) under light/dark adaptation. Arthropod Struct. Dev. 2019. V. 53. P. 100901. https://doi.org/10.1016/j.asd.2019.100901
Chiranjeevi M., Velmathi G. Phototactic behavior of yellow stemborer and rice leaf folder moths to surface mount device-light emitting diodes of various wavelengths. Int. J. Appl. Sci. 2021. V. 19. № 1. P. 1–9. https://doi.org/10.6703/IJASE.202203_19(1).005
Colvin J., Brady J., Gibson G. Visually-guided, upwind turning behaviour of free-flying tsetse flies in odour-laden wind: a wind-tunnel study. Physiol. Entomol. 1989. V. 14. № 1. P. 31–39. https://doi.org/10.1111/j.1365-3032.1989.tb00934.x
Eaton J.L., Tignor K.R., Holtzman G.I. Role of moth ocelli in timing flight initiation at dusk. Physiol. Entomol. 1983. V. 8. № 4. P. 371–375. https://doi.org/10.1111/j.1365-3032.1983. tb00370.x
Frolov A.N., Bourguet D., Ponsard S. Reconsidering the taxomony of several Ostrinia species in the light of reproductive isolation: a tale for Ernst Mayr. Biol. J. Linn. Soc. 2007. V. 91. № 1. P. 49–72. https://doi.org/10.1111/j.1095-8312.2007.00779.x
Huang Y., Tatsuki S., Kim C.G., Hoshizaki S., Yoshiyasu Y., Honda H., Ishikawa Y. Identification of sex pheromone of adzuki bean borer, Ostrinia scapulalis. J. Chem. Ecol. 1997. V. 23. № 12. P. 2791–2802. https://doi.org/10.1023/A:1022567111508
Huang Y., Takanashi T., Hoshizaki S., Tatsuki S., Ishikawa Y. Female sex pheromone polymorphism in adzuki bean borer, Ostrinia scapulalis, is similar to that in European corn borer, O. nubilalis. J. Chem. Ecol. 2002. V. 28. № 3. P. 533–539. https://doi.org/10.1023/A:1014540011854
Ishikawa Y., Takanashi T., Kim C.G., Hoshizaki S., Tatsuki S., Huang Y. Ostrinia spp. in Japan: their host plants and sex pheromones. Entomol. Exp. Appl. 1999. V. 91. P. 237–244. https://doi.org/10.1007/978-94-017-1890-5_30
Isaacs R., Willis M.A., Byrne D.N. Modulation of whitefly take-off and flight orientation by wind speed and visual cues. Physiol. Entomol. 1999.V. 24 № 4. P. 311–318. https://doi.org/10.1046/j.1365-3032.00144.x
Jakobsson J., Henze M.J., Svensson G.P., Lind O., Anderbrant O. Visual cues of oviposition sites and spectral sensitivity of Cydia strobilella L. Journal of Insect Physiology. 2017. V. 101. P. 161–168. https://doi.org/10.1016/j.jinsphys.2017.06.006
Kawahara A.Y., Plotkin D., Hamilton C.A., Gough H., St Laurent R., Owens H.L., Homziak N.T., Barber J.R. Diel behavior in moths and butterflies: a synthesis of data illuminates the evolution of temporal activity. Org. Divers. Evol. 2018. V. 18. № 1. P. 13–27. https://doi.org/10.1007/s13127-017-0350-6
Kelber A., Balkenius A., Warrant E.J. Scotopic colour vision in nocturnal hawkmoths. Nature. 2002. V. 419. P. 922–925. https://doi.org/10.1038/nature01065
Kelber A., Balkenius A., Warrant E.J. Colour vision in diurnal and nocturnal hawkmoths. Integr. Comp. Biol. 2003. V. 43. P. 571–579. https://doi.org/10.1093/icb/43.4.571
Kim K.N., Song H.S., Li C.S., Huang Q.Y., Lei C.L. Effect of several factors on the phototactic response of the oriental armyworm, Mythimna separata (Lepidoptera: Noctuidae). J. Asia Pac. Entomol. 2018. V. 21. P. 952–957. https://doi.org/10.1016/j.aspen.2018.07.010
Miller J.R., Roelofs W.L. Sustained-flight tunnel for measuring insect responses to wind-borne sex pheromones. J. Chem. Ecol. 1978. V. 4. № 2. P. 187–198. https://doi.org/10.1007/BF00988054
Mizunami M. Functional diversity of neural organization in insect ocellar systems. Vision Res. 1995. V. 35 № 4. P. 443–452. https://doi.org/10.1016/0042-6989(94)00192-O
Möhl B. Sense organs and the control of flight. Insect flight. Ed. G. J. Goldsworthy. New York. CRC Press London, 1989. P. 75–97.
Mrosovsky N. Masking: history, definitions, and measurement. Chronobiol. Int. 1999. V. 16. № 4. P. 415–429. https://doi.org/10.3109/07420529908998717
Mutuura A., Munroe E. Taxonomy and distribution of the European corn borer and allied species: genus Ostrinia (Lepidoptera: Pyralidae). Mem. Ent. Soc. Can. 1970. V. 102. S71. P. 1–112. https://doi.org/10.4039/entm10271fv
Pachkin A., Kremneva O., Leptyagin D., Ponomarev A., Danilov R. Light traps to study insect species diversity in soybean crops. Agronomy. 2022. V. 12. № 10. https://doi.org/10.3390/agronomy12102337
Royer L., McNeil J.N. Effect of relative humidity conditions on responsiveness of European corn borer (Ostrinia nubilalis) males to female sex pheromone in a wind tunnel. J. Chem. Ecol. 1993. V. 19. P. 61–69.
Somanathan H., Borges R.M., Warrant E.J., Kelber A. Nocturnal bees learn landmark colours in starlight. Curr. Biol. 2008. V. 18. № 21. https://doi.org/10.1016/j.cub.2008.08.023
Takanashi T., Huang Y., Takahasi K.R., Hoshizaki S., Tatsuki S., Ishikawa Y. Genetic analysis and population survey of sex pheromone variation in the adzuki bean borer moth, Ostrinia scapulalis. Biol. J. Linn. Soc. 2005.V. 84. № 1. P. 143–160. https://doi.org/10.1111/j.1095-8312.2005.00421.x
Wakakuwa M., Stewart F., Matsumoto Y., Matsunaga S., Arikawa K. Physiological basis of phototaxis to near-infrared light in Nephotettix cincticeps. J. Comp. Physiol. A. 2014. V. 200. P. 527–536. https://doi.org/10.1007/s00359-014-0892-4
Van Kleef J., Berry R., Stange G. Directional selectivity in the simple eye of an insect. J. Neurosci. 2008. V. 28 (11). P. 2845–2855. https://doi.org/10.1523/JNEUROSCI.5556-07.2008
Warrant E., Somanathan H. Colour vision in nocturnal insects. Philos. Trans. R. Soc. B: Biol. Sci. 2022. V. 377. № 1862. https://doi.org/10.1098/rstb.2021.0285
Yang Z., Plotkin D., Landry J.F., Storer C., Kawahara A.Y. Revisiting the evolution of Ostrinia moths with phylogenomics (Pyraloidea: Crambidae: Pyraustinae). Syst. Entomol. 2021. V. 46. № 4. P. 827–838. https://doi.org/10.1111/syen.12491
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


