Теплоэнергетика, 2021, № 10, стр. 14-23
Уравнения растворимости соединений бора в условиях теплоносителя реакторных установок типа ВВЭР
Н. Л. Харитонова a, *, Ш. А. Гурбанова a, **
a Национальный исследовательский ядерный университет МИФИ
115409 Москва, Каширское шоссе, д. 31, Россия
* E-mail: nl.kharitonova@yandex.ru
** E-mail: gurbanova.s@list.ru
Поступила в редакцию 01.12.2020
После доработки 22.12.2020
Принята к публикации 20.01.2021
Аннотация
При расчетном анализе безопасности на атомных станциях с водо-водяными энергетическими реакторами (ВВЭР) для оценки риска кристаллизации соединений бора как в активной зоне реактора, так и в бассейне выдержки при различных аварийных режимах необходимы данные по растворимости этих соединений с оцененными показателями точности данных. В статье рассмотрены соединения борной кислоты, данные по растворимости которых представляют интерес при оценке потенциальных рисков их кристаллизации в целях обеспечения функции охлаждения активной зоны при авариях. Выполнена оценка форм существования твердых фаз боратов в системах H3BO3/HBO2/B2O3 + Н2О и LiBO2 + H2O при повышенных температурах. Проведена обработка экспериментальных данных по растворимости стабильных твердых фаз борной кислоты, а также боратов лития в воде в диапазоне температур от 273 до 350°С. Для системы H3BO3/HBO2/B2O3 + Н2О рассмотрены температурные интервалы равновесного существования твердых (кристаллических – индекс “кр”) фаз борной кислоты Н3ВО3(кр), НВО2(кр) и В2О3(кр). Для каждой из этих фаз получены формулы для расчета растворимости в воде в зависимости от абсолютной температуры. Для кристаллогидратов боратов лития с учетом различного количества присоединенных молекул воды выделены четыре температурные области, для каждой из которых с учетом фазовых превращений выведены формулы для определения температурных зависимостей растворимости. Для оценки точности соотношений для расчета растворимости, полученных на основе обработки совокупности экспериментальных данных, определены значения средней относительной погрешности. Продемонстрирована достаточная точность воспроизведения экспериментальных значений растворимости в системах H3BO3/B2O3 + H2O и LiBO2 + H2O с помощью указанных формул во всем рассмотренном диапазоне температур.
Для обоснования безопасности энергоблоков с ВВЭР и верификации проектных технических и технологических решений по основным, вспомогательным системам и системам безопасности необходимы расчетные модели, описывающие поведение соединений бора при различных сценариях развития аварийных ситуаций в целях определения мероприятий по их предотвращению, локализации, управлению и смягчению возможных последствий [1, 2]. При тяжелых запроектных авариях с длительным кипением теплоносителя существует риск кристаллизации соединений борной кислоты в активной зоне и подзонном пространстве ВВЭР [1–3]. Риск кристаллизации соединений бора зависит от химического состава этих соединений при конкретных параметрах теплоносителя и определяется достижением их концентраций (термодинамических активностей), превышающих предел растворимости [1–6]. Поэтому для оценки риска кристаллизации соединений бора при различных аварийных режимах требуются данные по растворимости соединений бора с оцененными показателями точности этих данных в широком диапазоне параметров состояния.
СОЕДИНЕНИЯ БОРА, РАСТВОРИМОСТЬ КОТОРЫХ ПРЕДСТАВЛЯЕТ ИНТЕРЕС ПРИ АНАЛИЗЕ АВАРИЙ
Состав теплоносителя I контура на энергоблоках с ВВЭР, в первую очередь, определяется присутствием соединений борной кислоты и щелочных металлов (калия, натрия, лития) [3, 4]. В теплоносителе в зависимости от температуры и химического состава, ионной силы и водородного показателя pH могут присутствовать многочисленные формы стабильных или метастабильных твердых фаз боратов. Минимально допустимые значения концентрации борной кислоты в теплоносителе, в воде бассейна выдержки и в баках борированных растворов систем безопасности реакторной установки устанавливаются исходя из необходимости обеспечения подкритического состояния11 реактора. Увеличение продолжительности топливных циклов и единичной мощности энергоблоков в проектах ВВЭР-1000/1200 приводит к необходимости повышать концентрацию борной кислоты в теплоносителе и в емкостях систем безопасности (в емкостях системы пассивного залива активной зоны, в баках хранения борного раствора системы и пр.) [4]. Следствием увеличения концентрации борной кислоты является повышение концентрации ионов калия (гидроксид калия дозируется для нейтрализации борной кислоты) и ионов лития [нарабатываются по реакции 10B (n, α) 7Li] и натрия (присутствует в дозируемых реагентах в виде примеси). Риск кристаллизации соединений бора в активной зоне реактора зависит от химического состава этих соединений при конкретных параметрах теплоносителя и обусловливается превышением их концентраций (термодинамических активностей) при определенном сочетании параметров предела растворимости. Увеличение начальных концентраций как самой борной кислоты, так и ее соединений (боратов калия, лития, натрия) повышает риск кристаллизации соединений борной кислоты в активной зоне реактора [4].
Интенсивность накопления/концентрирования соединений борной кислоты в водной фазе при кипении теплоносителя определяется (наряду с теплогидравлическими параметрами) значением видимого коэффициента распределения22 (Kр), характеризующего переход боратов из кипящей воды в равновесный с ней насыщенный пар. Значение Kр зависит от температуры, давления, а также от форм существования боратов в водном растворе, на которые, в первую очередь, влияет водородный показатель рН раствора. Увеличение рН25 (отрицательного десятичного логарифма равновесной концентрации ионов водорода в водном растворе при 25°С) с 6 до 11 при давлении 10 МПа (311°С) приводит к снижению коэффициента распределения с 11 до 2.5% (рис. 1) [5, 6]. Это обусловлено тем, что коэффициент распределения определяется формами существования продуктов диссоциации борной кислоты в растворе, которые также зависят от температуры, водородного показателя рН, ионной силы раствора (рис. 2).
Рис. 1.
Зависимость видимого коэффициента распределения Kр соединений борной кислоты между водой и равновесным с ней насыщенным паром от водородного показателя рН25 (при давлении 10 МПа) [6]. Коррекция рН с помощью: 1 – Na3PO4; 2 – NaOH; линия – аппроксимация экспериментальных данных
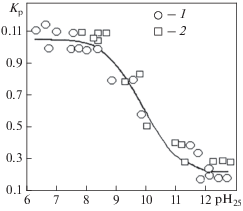
Рис. 2.
Распределение гидратированных форм диссоциации борной кислоты в зависимости от высокотемпературного водородного показателя ${\text{p}}{{{\text{H}}}_{{250}}}$ для температуры 250°С [6, 29, 30]. 1 – ${\text{B}}\left( {{\text{OH}}} \right)_{3}^{0};$ 2 – ${\text{B}}\left( {{\text{OH}}} \right)_{4}^{ - };$ 3 – ${{{\text{B}}}_{2}}\left( {{\text{OH}}} \right)_{7}^{ - };$ 4 – ${{{\text{B}}}_{3}}\left( {{\text{OH}}} \right)_{{10}}^{ - };$ 5 – ${{{\text{B}}}_{4}}\left( {{\text{OH}}} \right)_{{14}}^{{2 - }}$
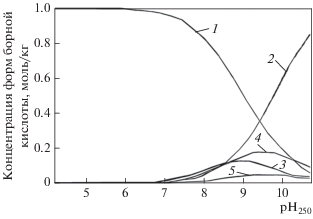
Диссоциация борной кислоты в водных растворах протекает с образованием полиборатных комплексов типа ${\text{B}}\left( {{\text{OH}}} \right)_{3}^{0},$ ${\text{B}}\left( {{\text{OH}}} \right)_{4}^{ - },$ ${{{\text{B}}}_{3}}\left( {{\text{OH}}} \right)_{{10}}^{ - },$ ${{{\text{B}}}_{2}}\left( {{\text{OH}}} \right)_{7}^{ - },$ ${{{\text{B}}}_{4}}\left( {{\text{OH}}} \right)_{{14}}^{{2 - }}$ в соответствии с химическими реакциями [5, 6]:
При рН25 < 6 в растворе преобладают нейтральные молекулы типа ${\text{В}}\left( {{\text{ОН}}} \right)_{3}^{0},$ а в присутствии щелочи – гидроксида калия/натрия (рН25 > 7) – начинают преобладать заряженные комплексы типа ${{{\text{B}}}_{3}}\left( {{\text{OH}}} \right)_{{10}}^{ - }$ и ${{{\text{B}}}_{4}}\left( {{\text{OH}}} \right)_{{14}}^{{2 - }},$ которые благодаря наличию электрического заряда сильнее удерживаются поляризованными молекулами воды в жидкой фазе и менее интенсивно переходят в пар (см. рис. 2) [5, 6].
При авариях с потерей теплоносителя истекающий в течь теплоноситель I контура и/или разбрызгиваемый через спринклерные сопла боратсодержащий раствор стекает по организованным уклонам на пол перекрытия, а затем попадает в баки-приямки защитной оболочки, которые выполняют при авариях роль водосборников. Когда гидроемкости и бак аварийного запаса раствора борной кислоты опорожнены, баки-приямки защитной оболочки служат для обеспечения непрерывной подачи теплоносителя в реактор с помощью насосов аварийного расхолаживания. Это должно обеспечить длительное охлаждение активной зоны путем рециркуляции теплоносителя реактора и/или работу спринклерного насоса для уменьшения давления и температуры в защитной оболочке. Если учитывать продолжительный период циркуляции теплоносителя при такой аварии по замкнутой схеме: баки-приямки – насосы систем безопасности – напорная магистраль насосов – корпус реактора (активная зона) – течь – баки-приямки, наличие кипения теплоносителя и низкую растворимость боратов в паровой фазе, то становится ясно, что существует риск накопления и осаждения в виде твердой фазы боратов в реакторе [1–3].
В целях подавления образования летучих форм йода на различных фазах аварии с потерей теплоносителя для аварийного охлаждения активной зоны, а также для впрыска под защитную оболочку используются “щелочные растворы борной кислоты”, содержащие борную кислоту, гидроксид калия и гидразин. В проектах ВВЭР реализованы технические решения, направленные на поддержание требуемого уровня рН25 в баках-приямках защитной оболочки. Для этого предусматривается подача подщелачивающего реагента (гидроксида калия/натрия) в баки-приямки и/или в баки аварийного запаса раствора борной кислоты. Для боратсодержащего раствора при работе насосов аварийного расхолаживания из приямка защитной оболочки регламентируется как концентрация борной кислоты (от 16 до 20 г/дм3), так и содержание ионов калия (до 2 г/дм3).
Таким образом, при авариях с потерей теплоносителя в реакторе могут концентрироваться не только борная кислота, но и бораты щелочных металлов. Кроме того, при авариях с разрушением I контура истекающий в течь теплоноситель и борированные растворы из систем безопасности, содержащие бораты калия/натрия/лития, контактируют с поверхностями элементов и конструкций под защитным ограждением. При этом наблюдается химическое взаимодействие этих растворов с конструкционными материалами (сталью, алюминиевыми сплавами и пр.) покровного слоя теплоизоляционной конструкции изолируемых объектов, с материалами теплоизоляции (стекловата, стеклоткань, штукатурные растворы с оклейкой поверхности штукатурки стеклотканью), с бетоном. Из-за протекания эрозионных и коррозионных процессов истекающий теплоноситель обогащается соединениями алюминия, силикатами кальция/натрия и пр. Поэтому состав водного раствора, который собирается в баках-приямках защитного ограждения при авариях, а затем в процессе рециркуляции концентрируется внутри реактора, будет представлять собой сложную многокомпонентную термодинамическую систему. Определение ранжированного перечня химических соединений, риск кристаллизации которых необходимо принимать во внимание в расчетных моделях, описывающих поведение боратов при различных сценариях развития аварийных ситуаций применительно к энергоблокам с ВВЭР, представляет собой отдельную задачу [1, 2].
Реализовать расчет растворимости боратных соединений в многокомпонентной системе, какой является теплоноситель, путем термодинамического моделирования достаточно сложно, поскольку для этого необходимо иметь основные термодинамические характеристики, такие как энергия Гиббса, энтальпия, энтропия и теплоемкость, для всех возможных типов боратных соединений (как растворенных компонентов, так и кристаллических фаз). Для многокомпонентных водных систем теплоносителя, содержащих борную кислоту и бораты в концентрациях, близких к насыщению, фазовые превращения, изменения кристаллического строения и свойств боратов в зависимости от температуры и химического состава водного раствора изучены недостаточно [1–6].
При использовании термодинамического моделирования для оценки риска образования боратных отложений при расчете следует учитывать эффекты неидеальности раствора, т.е. ионные (ион-ионные и ион-молекулярные), а также межмолекулярные взаимодействия. Для многокомпонентных боратных растворов, в которых ионная сила и концентрации борной кислоты и борат-ионов являются значительными, вклад специфического ионного взаимодействия представляет проблему для расчетного моделирования растворимости [5]. Ее решение особенно сложно для боратных растворов, содержащих несколько типов моно- и полимерных соединений, распределение которых может варьироваться в зависимости от условий, таких как температура, pH и концентрации этих соединений в растворе. Учитывая многообразие форм существования кристаллогидратов боратов в водных растворах и недостаточную изученность их термодинамических свойств, а также сложности моделирования процессов соосаждения нескольких фаз, определения коэффициентов термодинамической активности боратных соединений, авторы данной работы формулы для расчета растворимости борной кислоты/боратов лития получили путем обработки опубликованных к настоящему времени основных экспериментальных результатов. При отборе экспериментальных данных учитывались согласование оцениваемых результатов с данными других экспериментальных работ, качественное согласие с известными теоретическими закономерностями, значения погрешностей и тщательность выполненных измерений. Перечень рассматриваемых соединений ограничен в данной работе стабильными твердыми фазами соединений борной кислоты и боратов лития.
УРАВНЕНИЯ РАСТВОРИМОСТИ БОРНОЙ КИСЛОТЫ В ВОДЕ
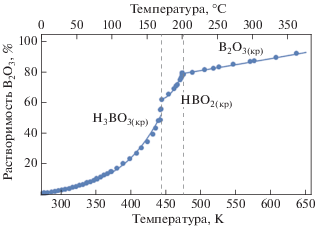
Равновесными твердыми фазами существования борной кислоты в системе H3BO3/B2O3–H2O в зависимости от температуры являются ортоборная кислота ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ три монотропных модификации метаборной кислоты ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ангидрид борной кислоты ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}$ [5–8].
Равновесная форма существования твердой фазы борной кислоты при прочих равных параметрах зависит от температуры следующим образом:
ортоборная кислота Н3ВО3(кр) существует при температурах до 171°C [7, 9] (до 170°C согласно данным работ [8, 10], до 181°C в соответствии с [11]);
при нагревании ортоборная кислота теряет воду и при температурах от 171 до 201°C [7, 9] (203°C [8, 10]) устойчивой формой существования становится метаборная кислота НВО2(кр);
при дальнейшем нагревании при температурах свыше 201°C из метаборной кислоты НВО2(кр) образуется оксид бора В2О3(кр) [7].
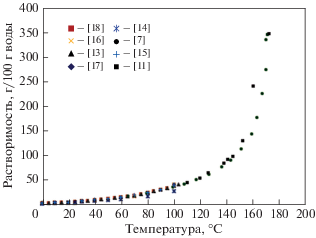
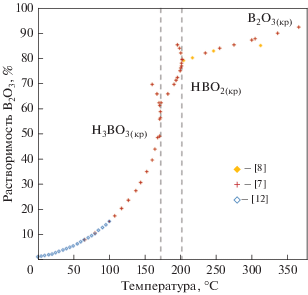
Экспериментальные данные по растворимости перечисленных твердых фаз в системе H3BO3/B2O3–H2O в зависимости от температуры, полученные авторами [7, 8, 11–18], показаны на рис. 3 и 4.
Данные о растворимости ангидрида борной кислоты В2О3(кр) при температурах более 201°C приведены в исследованиях [7, 8].
Результаты экспериментального определения растворимости соединений борной кислоты приводятся в [7, 8, 11–18] в различных единицах измерения концентрации: как в безразмерных (мольные доли, проценты), так и в размерных (моль на килограмм, грамм на литр раствора, грамм на литр растворителя). Для сравнения и оценки достоверности экспериментальных данных по растворимости, полученных авторами в разных экспериментах, значения концентраций были пересчитаны в целях приведения их к одним и тем же единицам измерения концентрации.
Для математического описания растворимости S стабильных твердых фаз борной кислоты ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}$ в зависимости от температуры приняты формулы, имеющие структуру
где Т – температура, К; ${{A}_{0}}$,…,${{A}_{n}}$ – коэффициенты.Для получения уравнений расчета растворимости решалась задача регрессии экспериментальных данных методом наименьших квадратов с помощью программного пакета Wolfram Mathematica [19].
Графики изменения растворимости равновесных твердых фаз борной кислоты [${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}$] в зависимости от температуры, рассчитанные с помощью формул (2)–(5), приведенные в табл. 1, и экспериментальные данные [7, 8, 11–18] представлены на рис. 5 и 6. Температурная зависимость растворимости твердых фаз борной кислоты характеризуется изломами, которые обусловлены фазовыми переходами, связанными с изменением их кристаллического строения.
Таблица 1.
Формулы для расчета растворимости борной кислоты в воде
| Равновесная
фаза борной кислоты |
Формула | Номер формулы | Температурный диапазон применимости, К (°С) | Источник экспериментальных данных |
|---|---|---|---|---|
| Н3ВО3(кр) | $\begin{gathered} S{\kern 1pt} ' = - 682.265 + 7.02052T - \\ - \,\,0.0244041{{T}^{2}} + 0.000028843{{T}^{3}} \\ \end{gathered} $ | (2) | 273.15–373.15 (0–100) | [7, 13, 15–18] |
| $\begin{gathered} S{\kern 1pt} ' = 1.38277 \times {{10}^{6}} - 13{\kern 1pt} {\kern 1pt} 866.9T + \\ + \,\,52.1225{{T}^{2}} - 0.0870367{{T}^{3}} + \\ + \,0.0000544849{{T}^{4}} \\ \end{gathered} $ | (3) | 373.15–444.15 (100–171) | [7, 11] | |
| НВО2(кр) | $\begin{gathered} S = 12.7813 - 0.371102T + \\ + \,\,0.00107401{{T}^{{\,2}}} \\ \end{gathered} $ | (4) | 444.15–476.15 (171–203) | [7] |
| В2О3(кр) | $\begin{gathered} S = 48.7499 + 0.054126T + \\ + \,\,0.0000215715{{T}^{2}} \\ \end{gathered} $ | (5) | 476.15–623.15 (203–350) | [7, 8] |
Рис. 5.
Влияние температуры на растворимость Н3ВО3(кр) в воде при температурах до 444 К (171°C). Значками показаны литературные данные, линия – расчет по формуле (2) для диапазона температур 273.15–373.15 К (0–100°C) и (3) для температур 373.15–444.15 К (100–171°C)
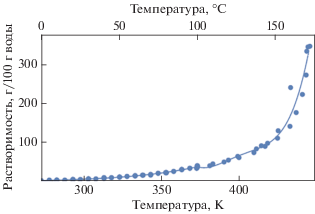
Рис. 6.
Влияние температуры на растворимость ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}$ при температурах до 623.15 К (350°C). Значками показаны литературные данные, линия – расчет по формуле (4) для диапазона температур 444.15–476.15 К (171–203°C) и (5) для температур 476.15–623.15 К (203–350°C)
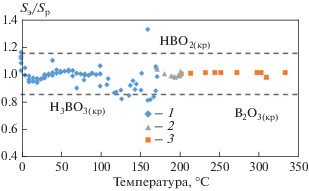
На рис. 7 приведена зависимость отношения принятых для анализа экспериментальных ${{S}_{{\text{э}}}}$ и рассчитанных по формулам (2)–(5) ${{S}_{{\text{р}}}}$ значений растворимости равновесных твердых фаз борной кислоты ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}.$
Рис. 7.
Оценка точности расчета растворимости ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}}$ (1), ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ (2) и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}$ (3) по формулам (2)–(5) в диапазоне температур от 0 до 350°C
Для оценки точности соотношений для расчета растворимости, полученных на основе обработки совокупности данных измерений, были определены значения средней относительной погрешности $\bar {A}$ по формуле
(6)
$\bar {A} = \frac{1}{N}\sum {\frac{{\left| {{{S}_{{\text{э}}}} - {{S}_{{\text{р}}}}} \right|}}{{{{S}_{{\text{э}}}}}}} \times 100\% .$При определении средней относительной погрешности расчета растворимости борной кислоты было установлено, что:
до 100°C полученные авторами [7, 13, 15–18] данные по растворимости борной кислоты в форме ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}}$ удовлетворительно согласуются между собой (см. рис. 3), а средняя относительная погрешность расчета растворимости по (2) для температур ниже 100°С не превышает 3%;
в диапазоне температур от 171 до 203°С относительная погрешность расчета растворимости ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ по (4) в сравнении с экспериментальными данными [7] составляет не более 1.5%;
при температурах от 203 до 350°С относительная погрешность расчета растворимости ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}$ по (5) в сравнении с экспериментальными данными [7, 8] не превышает 0.7%;
погрешность расчета растворимости борной кислоты в форме ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}}$ по (3) для совокупности экспериментальных данных [7, 11] в диапазоне температур 373.15–444.15 К (100–171°С) составляет примерно 13%. Такая относительно высокая погрешность может быть объяснена проблемой оценки состава равновесных твердых фаз и возможной нестабильностью метаборной кислоты ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ в водном растворе в этом температурном диапазоне.
В [7, 11] при температурах выше 100°С в растворе идентифицировано наличие всех трех твердых фаз борной кислоты ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}},$ тогда как в [20] при экспериментальном изучении констант диссоциации борной кислоты в водных растворах при температурах до 623 К указывается на наличие только фазы ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}}.$ Существование метаборной кислоты ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ в [20] подтверждено не было.
РАСТВОРИМОСТЬ БОРАТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ В ВОДНОМ РАСТВОРЕ ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ
Среди боратов щелочных металлов: лития, натрия, калия (далее эти металлы, обозначаются буквой M) – существуют различные группы солей, различающиеся значением молярного соотношения оксидов (М2О : В2О3). Для боратов известны следующие модификации кристаллического строения: метабораты (М2О : В2О3 = 1 : 1); тетрабораты (М2О : В2О3 = 1 : 2); пентабораты (М2О : В2О3 = 1 : 5). Сведения о фазовых равновесиях в водно-солевых системах, содержащих эти соединения, крайне ограничены [4–6, 9, 21–28]. Бораты щелочных металлов (калия, натрия, лития) могут присутствовать в теплоносителе в зависимости от температуры и химического состава раствора, концентрации примесей, ионной силы и pH раствора в виде различных форм стабильных или метастабильных твердых фаз.
В водных растворах превращения борнокислых солей происходят в зависимости от рН раствора. В системах, содержащих метабораты, понижение рН раствора ведет к образованию тетра- и пентаборатов, а пентабораты с повышением рН раствора переходят в тетра- и метабораты [4–6, 28, 29]. Кроме того, бораты характеризуются способностью к образованию кристаллогидратов с различным количеством присоединенных молекул воды. Бораты натрия могут образовывать семь кристаллогидратов, бораты калия – четыре кристаллогидрата, а бораты лития – один кристаллогидрат. Энтальпия образования, энтропия и теплоемкость перечисленных кристаллических форм боратов различаются между собой [4–6, 28–30].
При проведении экспериментальных исследований растворимости боратов натрия [9, 15, 26, 29, 30] установлена возможность существования следующих твердых фаз кристаллогидратов: ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}\,\centerdot \,{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}\,\centerdot \,4{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}\,\centerdot \,8{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{7}}\,\centerdot \,2{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{7}}\,\centerdot \,4{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{7}}\,\centerdot \,5{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{7}}\centerdot 10{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ Na2O $\centerdot $ 5B2O3 $\centerdot $ 2H2O, Na2O$\centerdot $5B2O3$\centerdot $10H2O, ${\text{2N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}}\,\centerdot \,\,{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\,\centerdot \,\,{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{2N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}}\,\centerdot \,{\text{5}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\,\centerdot \,{\text{5}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ ${\text{2N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}}\,\centerdot \,{\text{5}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\,\centerdot \,{\text{7}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$
Равновесными твердыми фазами существования боратов калия в системе борная кислота – гидроксид калия – вода при температурах до 350°С являются метабораты калия KBO2 $\centerdot $ 4H2O(кр), ${\text{KB}}{{{\text{O}}}_{2}}\,\centerdot \,1.25{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{KB}}{{{\text{O}}}_{2}}\,\centerdot \,0.25{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{KB}}{{{\text{O}}}_{{2\left( {{\text{кр}}} \right)}}};$ тетрабораты калия ${{{\text{K}}}_{2}}{{{\text{B}}}_{4}}{{{\text{O}}}_{7}}$, ${{{\text{K}}}_{2}}{{{\text{B}}}_{4}}{{{\text{O}}}_{7}}\,\centerdot \,4{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ K2B4O7$\centerdot $2H2O(кр), ${{{\text{K}}}_{2}}{{{\text{B}}}_{4}}{{{\text{O}}}_{7}}\,\centerdot \,{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ и пентабораты калия ${\text{K}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}\,\centerdot \,4{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{K}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}\,\centerdot \,{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ KB5O8$\centerdot $0.5H2O(кр), ${\text{K}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}$ [9, 15, 26].
Все изложенное иллюстрирует сложность и многообразие фазовых превращений, изменений кристаллического строения и свойств боратов в зависимости от температуры и химического состава многокомпонентных водных систем типа H3BO3/B2O3 + H2O + M2O [4–6, 9, 21–29].
В данной работе анализ растворимости боратов щелочных металлов ограничен температурной зависимостью боратов лития (системой LiBO2 + + H2O) по следующим причинам:
растворимость боратных соединений лития существенно ниже, чем боратов калия и натрия (максимальной растворимостью среди метаборатов обладают бораты калия и смешанные натрий-калиевые композиции) [21–29];
по способности уменьшать растворимость борной кислоты в водно-солевых системах катионы распределяются в такой последовательности: K+ < Na+ < Li+ < Н+ [24, 26, 28, 29]. При увеличении концентрации лития в водном растворе растворимость борной кислоты снижается, т.е. риск осаждения повышается. Увеличение концентраций в растворе борной кислоты солей калия или натрия, напротив, приводит к росту растворимости борной кислоты [26, 28, 29];
при температурах свыше 150°С бораты лития, в отличие от борной кислоты, боратов калия и натрия, характеризуются отрицательным коэффициентом растворимости, т.е. их растворимость снижается при повышении температуры [9, 15, 21–24]. Увеличение растворимости боратов натрия и калия в водно-солевых системах с ростом температуры (вплоть до температуры их плавления) подтверждено в [26, 28, 29].
Для боратов лития в [9, 15, 21–24] указывается на возможность существования следующих твердых фаз: ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,8{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,2{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,0.5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{LiB}}{{{\text{O}}}_{{2{\text{(кр)}}}}},$ ${\text{L}}{{{\text{i}}}_{2}}{{{\text{B}}}_{4}}{{{\text{O}}}_{7}}\,\centerdot \,3{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{Li}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}\,\centerdot \,5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ ${\text{Li}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}\,\centerdot \,0.5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ причем при температурах до 150°С – преимущественно в форме ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,2{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ [9, 15, 21].
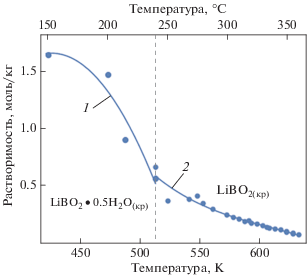
В интервале температур от 150 до 240°С преобладающей равновесной формой кристаллогидрата будет ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,0.5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}.$
Присутствие кристаллогидратов метабората лития ${\text{LiB}}{{{\text{O}}}_{{2{\text{(кр)}}}}}$ при температурах свыше 240°С установлено в работах [9, 22–24]. Данные по растворимости ${\text{LiB}}{{{\text{O}}}_{{2{\text{(кр)}}}}}$ в водном растворе при температурах до 360°С представлены в [22].
Борат лития в виде ${\text{Li}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}\,\centerdot \,5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ существует до температуры 130°С, выше которой равновесной формой становится ${\text{Li}}{{{\text{B}}}_{5}}{{{\text{O}}}_{8}}\,\centerdot \,0.5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}},$ данные по растворимости которой представлены в [9] для температур до 300°С.
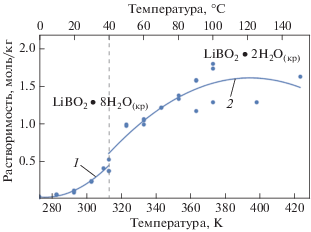
Результаты расчетов растворимости боратов лития при температурах до 150°С, полученные по формулам (7), (8) (табл. 2), и экспериментальные данные [9, 15, 21] приведены на рис. 8.
Таблица 2.
Формулы для расчета растворимости боратов лития в воде, моль/кг (воды)
| Равновесная фаза бората лития | Формула | Номер формулы | Температурный диапазон применимости, К (°С) | Источник эксперимен-тальных данных |
|---|---|---|---|---|
| ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,8{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ | $\begin{gathered} S = 23.4617--0.169602T + \\ + \,\,0.000307027{{T}^{2}} \\ \end{gathered} $ | (7) | Менее 313.15 (40) | [9, 15, 21] |
| ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,2{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ | $\begin{gathered} S = --21.8631 + 0.119086T-- \\ - \,\,0.000151033{{T}^{2}} \\ \end{gathered} $ | (8) | 313.15–423.15 (40–150) | [9, 15, 21] |
| ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,0.5{{{\text{H}}}_{2}}{{{\text{O}}}_{{{\text{(кр}})}}}$ | $\begin{gathered} S = --25.3618 + 0.126758T-- \\ - \,\,0.000148757{{T}^{2}} \\ \end{gathered} $ | (9) | 423.15–513.15 (150–240) | [9] |
| ${\text{LiB}}{{{\text{O}}}_{{2{\text{(кр}})}}}$ | $\begin{gathered} S = 48.4234--0.232528T + {\text{ }} \\ {\text{ + }}\,\,0.000377548{{T}^{2}}--2.06757 \times {{10}^{{ - 7}}}{{T}^{3}} \\ \end{gathered} $ | (10) | 513.15–623.15 (240–350) | [9, 22–24] |
Для температур более 150°С расчетные значения растворимости метаборатов лития ${\text{LiB}}{{{\text{O}}}_{{2\left( {{\text{кр}}} \right)}}}$ и LiBO2 $\centerdot $ 0.5H2O(кр) полученные по формулам (9), (10), а также экспериментальные данные, использованные для этой аппроксимации, показаны на рис. 9. Как видно из этого рисунка, при температурах выше 150°С растворимость этих боратов снижается при повышении температуры, т.е., в отличие от борной кислоты и боратов калия и натрия, бораты лития характеризуются отрицательным коэффициентом растворимости.
Рис. 9.
Влияние температуры на растворимость равновесных фаз в системе LiBO2 + H2O при температурах 423.15–623.15 К (от 150 до 350°C). Значками показаны литературные данные [9, 22–24]; расчет по формуле: 1 – (9) [для диапазона температур 423.15–513.15 К (150–240°C)]; 2 – (10) [513.15–623.15 К (240–350°C)]
При определении средней относительной погрешности расчета растворимости кристаллогидратов бората лития по (6) было установлено, что:
в диапазоне температур от 40 до 150°С погрешность расчета растворимости ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,2{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ по (8) для совокупности экспериментальных данных [9, 15, 21] не превышает 12%;
в диапазоне температур от 150 до 240°С относительная погрешность расчета растворимости ${\text{LiB}}{{{\text{O}}}_{2}}\,\centerdot \,0.5{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {{\text{кр}}} \right)}}}$ по (9) для экспериментальных данных [9, 15, 21] не превышает 10%;
для температур от 240 до 350°С погрешность расчета растворимости ${\text{LiB}}{{{\text{O}}}_{2}}_{{\left( {{\text{кр}}} \right)}}$ по формуле (10), полученной обработкой экспериментальных данных [9, 22–24], составляет не более 6%.
ВЫВОДЫ
1. Для развития расчетных моделей, описывающих распределение соединений бора в теплоносителе энергоблоков с ВВЭР при различных сценариях развития аварий, требуются данные по растворимости соединений бора. Определение ранжированного перечня химических соединений, риск кристаллизации которых необходимо принимать во внимание в расчетных моделях, описывающих поведение боратов при различных сценариях развития аварийных ситуаций применительно к энергоблокам с ВВЭР, представляет собой отдельную задачу.
2. В зависимости от температуры и химического состава многокомпонентных водных систем вида H3BO3/B2O3 + H2O + M2O (где M обозначены литий, натрий, калий) происходят многообразные фазовые превращения, изменения кристаллического строения и свойств боратов. Следует отметить, что их термодинамические свойства изучены недостаточно. Моделирование процессов соосаждения нескольких фаз и определения коэффициентов термодинамической активности боратных соединений является довольно сложной задачей.
3. Для системы H3BO3/HBO2/B2O3 + Н2О выделены температурные интервалы, соответствующие областям равновесного существования трех твердых фаз борной кислоты: ${{{\text{H}}}_{3}}{\text{B}}{{{\text{O}}}_{{3(кр)}}},$ ${\text{HB}}{{{\text{O}}}_{{2(кр)}}}$ и ${{{\text{B}}}_{2}}{{{\text{O}}}_{{3(кр)}}}.$ Для каждой из фаз на основе обработки опубликованных экспериментальных данных получены формулы для расчета растворимости в зависимости от абсолютной температуры, справедливые в интервале температур существования соответствующей равновесной твердой фазы.
4. Оценка предложенных формул для расчета растворимости в системах H3BO3/B2O3 + H2O и LiBO2 + H2O по рассчитанным значениям средней относительной погрешности продемонстрировала довольно высокую их точность при воспроизведении экспериментальных данных во всем рассмотренном диапазоне температур.
5. Полученные температурные зависимости растворимости боратных соединений в водных растворах полезны для валидации и верификации расчетных кодов, используемых при моделировании аварийных процессов и позволяющих расчетным путем выработать решения, обеспечивающие обоснованное отсутствие кристаллизации в реакторных установках типа ВВЭР.
Список литературы
OECD/NEA, Update Knowledge Base for Long-term Core Cooling Reliability, NEA/CSNI/R (2013)12. Nov. 2013.
IAEA-TECDOC-1908. Benchmarking of computational fluid dynamics codes for reactor vessel design. Vienna: International Atomic Energy Agency, 2020.
Экспериментальное определение теплофизических свойств борной кислоты для аварийных режимов ВВЭР / А.В. Морозов, А.П. Сорокин, А.В. Питык, А.Р. Сахипгареев, А.С. Сошкина, А.С. Шлепкин // Атомная энергия. 2018. Т. 125. Вып. 3. С. 159–164.
Шарафутдинов Р.Б., Харитонова Н.Л. Проблема оптимизации водно-химического режима I контура АЭС с ВВЭР в условиях увеличения длительности кампаний топливного цикла и повышения единичной мощности энергоблоков // Теплоэнергетика. 2011. № 5. С. 21–27.
Thermodynamic modeling of boric acid and selected metal borate systems / P. Wang, J.J. Kosinski, M.M. Lencka, A. Anderko, R.D. Springer // Pure Appl. Chem. 2013. V. 85. Is. 11. P. 2117–2144. https://doi.org/10.1351/PAC-CON-12-07-09
Cohen P. The ASME handbook on water technology for thermal power systems. N.Y., 1989.
Kracek F.C., Morey G.W., Merwin H.E. The system, water – boron oxide // Am. J. Sci. 1938. V. 35. P. 143–171.
McCulloch L. A crystalline boric oxide // J. Am. Chem. Soc. 1937. V. 59. P. 2650–2652.
Киргинцев А.И., Трушникова Л.Н., Лаврентьева В.Г. Растворимость неорганических веществ в воде: справ. Л.: Химия, 1972.
Von Stackelberg M., Quatram F., Dressel J. Die Flüchtigkeit der Borsäure mit Wasserdampf. Das System B2O3–Wasser // Z. Elektrochem. Ang. Phys. Chem. 1937. Bd. 43. № 1. S. 14–28. https://doi.org/10.1002/bbpc.19370430104
Benrath A. Über die Löslichkeit von Salzen und Salzgemischen bei Temperaturen oberhalb von 100°. IV // ZAAC. 1942. V. 249. Is. 3. P. 245–250. https://doi.org/10.1002/zaac.19422490303
Blasdale W.C., Slansky C.M. The solubility curves of boric acid and the borates of sodium // J. Am. Chem. Soc. 1939. V. 61. Is. 4. P. 917–920. https://doi.org/10.1021/ja01873a043
Nies N.P., Hulbert R.W. Solubility isotherms in the system sodium oxide-boric oxide-water. Revised solubility-temperature curves of boric acid, borax, sodium pentaborate, and sodium metaborate // J. Chem. Eng. Data. 1967. V. 12. Is. 3. P. 303–313. https://doi.org/10.1021/je60034a005
Nasini R., Ageno J. Solnbilità e idrati dell’ acido borico // Z. Phys. Chem. 1910. V. 69. P. 482–485. https://doi.org/10.1515/zpch-1909-6935
Smith R.A. Ullmann’s encyclopedia of chemical technology, boric oxide, boric acid, and borate. Wiley-VCH Verlag GmbH & Co. KGaA, 2002. V. 6. P. 187–204. https://doi.org/10.1002/14356007.a04_263
Perry’s chemical engineers’ handbook. 7th ed. / ed. by R.H. Perry and D.W. Green. N.Y.: McGraw-Hill, 1997.
Lange’s handbook of chemistry. 14th ed. / ed. by J.A. Dean. N.Y.: McGraw-Hill, 1992.
Solubilities: Inorganic and metal-organic compounds / Ed. by W.F. Linke. Washington, DC: American Chemical Society, 1958.
Wolfram Mathematica 11.2.0.0 http://www.wolframalpha.com/
Ionization of boric acid in water from 298 K to 623 K by AC conductivity and Raman spectroscopy / H. Arcis, J.P. Ferguson, L.M.S.G.A. Applegarth, G.H. Zimmerman, P.R. Tremaine // J. Chem. Thermodyn. 2017. V. 106. P. 187–198. https://doi.org/10.1016/j.jct.2016.11.007
Reburn W.T., Gale W.A. The system lithium oxide-boric oxide-water // J. Phys. Chem. 1955. V. 59. Is. 1. P. 19–24. https://doi.org/10.1021/j150523a007
Byers W.A., Lindsay W.T., Kunig R.H. Solubility of lithium monoborate in high temperature water // J. Solution Chem. 2000. V. 29. P. 541–559. https://doi.org/10.1023/A:1005194129783
Cohen P. Water coolant technology of power reactors. LaGrange Park, IL, American Nuclear Society, 1980. P. 223–224.
Alavia W., Lovera J., Graber T.A. Thermodynamic modeling of the solubility of boric acid in the systems boric acid + lithium sulfate + water, boric acid + sodium sulfate + water and boric acid + potassium sulfate + + water at 293.15–313.15 K // Fluid Phase Equilib. 2015. V. 398. P. 63–71. https://doi.org/10.1016/j.fluid.2015.04.012
Cohen P. Water coolant technology of power reactors. N.Y.: Gordon and Breach Science Publishers, 1969.
Урусова M.A., Валяшко В.М. Фазовые равновесия в гидротермальных системах, содержащих бораты натрия и калия // Журн. неорган. химии. 1993. Т. 38. С. 714–716.
Revision of the NaBO2–H2O phase diagram for optimized yield in the H2 generation through NaBH4 hydrolysis / J. Andrieux, L. Laversenne, O. Krol, R. Chiriac, Z. Bouajila, R. Tenu, C. Goutaudier // Int. J. Hydrogen Energy. 2012. V. 37. Is. 7. P. 5798–5810. https://doi.org/10.1016/j.ijhydene.2011.12.106
Temperature-induced transformation of the phase diagrams of ternary systems NaBO2–NaOH–H2O and KBO2–KOH–H2O / A.V. Churikov, K.V. Zapsis, V.V. Khramkov, M.A. Churikov, I.M. Gamayunova // J. Chem. Eng. Data. 2011. V. 56. Is. 3. P. 383–389. https://doi.org/10.1021/je1007422
Мартынова О.И., Харитонова Н.Л. Поведение растворов метаборатов лития в условиях глубокого упаривания // Теплоэнергетика. 1990. № 7. С. 53–56.
Mesmer R.E., Baes C.F., Jr., Sweeton F.H. Acidity measurements at elevated temperatures. IV: Apparent dissociation product of water in 1 m potassium chloride up to 292.deg // J. Phys. Chem. 1970. V. 74. Is. 9. P. 1937–1942. https://doi.org/10.1021/j100704a019
Дополнительные материалы отсутствуют.
Инструменты
Теплоэнергетика