Теплоэнергетика, 2022, № 3, стр. 80-85
Расчетная оценка массопереноса коррозионного водорода в парогенераторе типа “натрий‒вода” при химических промывках и в режиме эксплуатации
К. Г. Легких a, В. Б. Смыков a, *, В. Ф. Тяпков b
a Физико-энергетический институт им. А.И. Лейпунского
249033 Калужская обл., г. Обнинск, пл. Бондаренко,
д. 1, Россия
b Всероссийский научно-исследовательский институт по эксплуатации атомных электростанций
109507 г. Москва, Ферганская ул., д. 25, Россия
* E-mail: smykov@ippe.ru
Поступила в редакцию 15.07.2021
После доработки 19.07.2021
Принята к публикации 25.08.2021
- EDN: WVELAQ
- DOI: 10.1134/S0040363622030079
Аннотация
Для своевременного и оперативного обнаружения разгерметизации парогенератора типа “натрий‒вода” во II контуре осуществляется непрерывный контроль содержания водорода как продукта взаимодействия натрия с водой. В процессе эксплуатации парогенератора происходит накопление продуктов коррозии на поверхности конструкционного материала. Удаление отложений производится с помощью эксплуатационных химических промывок (ЭХП). Однако во время проведения ЭХП скорость коррозии значительно увеличивается, что приводит к возрастанию концентрации водорода в воде и натрии. Диффузия водорода из водного контура в натриевый через стенки трубок парогенератора может оказывать воздействие на материал (сталь) парогенератора путем наводороживания стали. При превышении установленных пределов по содержанию водорода в стали происходит ее охрупчивание, что может привести к течи парогенератора. Данная проблема вызывает опасение ввиду регулярного проведения ЭХП (каждый год производится отмывка одного парогенератора). Однако отказ от ЭХП неприемлем. Для того чтобы ответить на вопрос, критичен ли вклад ЭХП в наводороживание стали, необходимо оценить вклад массопереноса коррозионного водорода в эксплуатационный режим парогенератора. В статье представлены результаты анализа эксплуатационных данных реакторной установки БН-600 по содержанию водорода в отмывочном растворе и натрии II контура при проведении химической промывки, пассивации и пуске энергоблока. Проведена расчетно-аналитическая оценка поведения коррозионного водорода и его массопереноса в парогенератор при химических промывках. Выполнена оценка наводороживания металла труб парогенератора.
В связи с применением жидкого натрия в промежуточном контуре реакторной установки главным требованием к парогенератору является обеспечение межконтурной плотности в течение всего ресурса работы. Для своевременного и оперативного обнаружения разгерметизации парогенератора во II контуре осуществляется непрерывный контроль приборами ИВА содержания водорода как продукта взаимодействия натрия с водой, которое описывается уравнением
Опыт эксплуатации парогенераторов типа “натрий‒вода” показывает, что основным источником поступления водорода в натрий II контура является водородная деполяризация катода при электрохимической коррозии перлитных поверхностей со стороны воды
Концентрация водорода в воде и натрии увеличивается при химической промывке и пуске парогенератора, так как скорость коррозии металла при этом значительно возрастает. Определение преимущественной направленности транспорта водорода необходимо для оценки наводороживания металла (стали) труб парогенератора.
Металлическое состояние практически всех конструкционных металлов в водной среде является термодинамически неустойчивым, и при взаимодействии их с окислительным компонентом окружающей среды оно переходит в более устойчивое окисленное состояние. Реакция окисления металла сопровождается потерей электронов и образованием новых веществ – продуктов коррозии, состоящих из оксидов, гидроксидов, солей и др.
Электрохимическая коррозия металла протекает в присутствии электролита – проводника второго рода (ионопроводящей среды). При этом ионизация металла и восстановление окислительного компонента среды разделены на поверхности металла и протекают не в одном акте, а параллельно и зависят от электрохимического потенциала корродирующего металла. В водных растворах окислитель (водород в молекуле воды) при этом не входит в состав продукта коррозии железа. Электрохимическая коррозия подчиняется законам электрохимической кинетики и сопровождается протеканием электрического тока между анодом (зона растворения металла Fe0 → → Fe2+ + 2e‒) и катодом (зона восстановления окислителя 2H+ + 2e‒ → 2H → H2), что суммарно выражается в виде реакции
При этом необходимо отметить, что в короткозамкнутом электрохимическом элементе (сталь – проводник первого рода) скорости анодного и катодного процессов равны (в грамм-эквивалентах) и благодаря этому скорость коррозии можно измерять по изменению концентрации продуктов в водном растворе. Однако это сложно и неоперативно. Считается, что в водных средах парогенераторов проще и оперативнее отслеживать скорость коррозии по выделению водорода в воду. Но в парогенераторах типа “натрий‒вода” это справедливо только при химических промывках, а в эксплуатационном режиме наоборот – по изменению содержания водорода в натрии приборами ИВА [1].
Продукты коррозии стали образуют оксидную пленку на поверхности стали либо уносятся турбулентным потоком “вода–пар”. Образующийся коррозионный водород растворяется в воде либо адсорбируется в стали и диффундирует в решетке металла.
Водород, проникая в металл, может вызвать ухудшение его пластических свойств (водородная хрупкость), приводящее нередко к разрушению изделия, работающего при значительных (близких к пределу текучести металла), длительных или знакопеременных термических и механических нагрузках [2]. Параметры, характеризующие поведение водорода в металлах, зависят от его природы, степени чистоты и количества легирующих элементов. Одним из процессов взаимодействия водорода с металлом является диффузия водорода через него. Имеются другие представления о поведении водорода в металле: в порах, микротрещинах и других дефектах атомы водорода соединяются в молекулы. Со временем давление молекулярного водорода в поре растет, что может вызвать разрушение металла вследствие необратимой водородной хрупкости [3].
МЕХАНИЗМ ВОДОРОДОПРОНИЦАЕМОСТИ
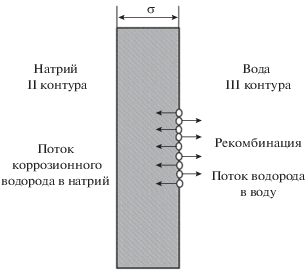
Для описания механизма водородопроницаемости стенок парогенератора использовали классическую схему проницаемости мембраны Ванга [3], которая состоит из следующих стадий:
диссоциация молекул газа и химическая адсорбция атомов на поверхности;
переход атомов газа с поверхности под поверхность, т.е. абсорбция;
транспорт атомов через перегородку с входной стороны к выходной, который в простейшем случае описывается диффузией;
переход атомов из-под поверхности на поверхность на выходной стороне;
рекомбинация атомов на поверхности и десорбция молекул с нее на выходной стороне мембраны.
В качестве мембраны рассматривали металл, в данном случае ‒ стенку трубы. Схема Ванга в упрощенном виде показана на рис. 1. Кроме классического процесса диссоциативной адсорбции на поверхности, иногда рассматривают процессы прямой абсорбции атомов после диссоциации и прямой рекомбинации атомов из-под поверхности, минуя хемосорбированное состояние, но необходимость введения этих процессов оправдана только при крайне высоких давлениях. В условиях равновесия схема Ванга приводит к известной изотерме Ленгмюра для адсорбции на поверхности и закону Сивертса для абсорбции в объеме.
В задачах по проницаемости предполагается, что потоки частиц в значительной степени термически активированы, т.е. зависят от энергетических барьеров, которые частицам приходится преодолевать для прыжка, и температуры. Перемещения атомов водорода в кристаллических структурах рассматриваются как случайные прыжки атомов из одного равновесного междоузельного положения в другое через некий барьер, называемый энергией активации для диффузии.
Совместное математическое описание динамики проницаемости несколько затруднительно в ряде случаев, поэтому обычно вводится условие локального равновесия между хемосорбированным состоянием на поверхности и абсорбированным состоянием непосредственно под поверхностью. Это позволяет записать скорость десорбции Jdes как некий эффективный коэффициент рекомбинации krec абсорбированных атомов, умноженный на квадрат концентрации атомов с под поверхностью:
Проницаемость часто описывают в одномерном приближении, поскольку в нем наиболее просто анализировать основные закономерности, которые качественно остаются справедливыми и для более сложных построений. В данном приближении проницаемость будет зависеть от растворимости, диффузии и эффектов на поверхности (абсорбции и десорбции). В стационарном случае, когда проницаемость некоторого переходного во времени режима достигла максимального уровня, в мембране устанавливается постоянный по глубине градиент концентрации, который вместе с коэффициентом диффузии определяет значение проникающего потока [4]. При изменении параметров системы (температуры, концентрации водорода в III контуре) наблюдается повышение содержания водорода в среде с меньшей его концентрацией (в данном случае в натрии). Выражение для времени запаздывания τ, с, появления водорода в натрии II контура можно записать в следующем виде:
где σс – толщина стенки трубы, м; DH – коэффициент диффузии водорода в стали 10Х2М, зависящий от температуры, м2/с.Так как содержание свободного водорода в натрии $С_{{\text{H}}}^{{{\text{Na}}}}$ (он химически связывается в гидрид натрия NaH) много меньше его содержания в воде $С_{{\text{H}}}^{w},$ проницаемость лимитируется диффузией водорода, поэтому другими стадиями можно пренебречь. Тогда выражение для потока водорода в натрий II контура $J_{{\text{H}}}^{{{\text{II}}}}$ можно представить в следующем виде:
(3)
$J_{{\text{H}}}^{{{\text{II}}}} = \frac{{{{D}_{{\text{H}}}}\Delta C}}{{{{\sigma }_{{\text{с}}}}}}{\text{,}}~$Скорость десорбции водорода в воду $J_{{\text{H}}}^{{{\text{III}}}}$ определяется по формуле
(4)
${{{\text{H}}}_{{ads}}} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }} + {\text{ }}{{e}^{ - }} \to {{{\text{H}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Значение константы рекомбинации вычисляют по формуле
(5)
${{k}_{{rec}}} = {\text{\;}}{{k}^{0}}\sqrt {\frac{{{{T}^{1}}}}{T}} ~{{{\text{e}}}^{{\left( {\frac{{ - E}}{{RT}}} \right)}}}{\text{,}}$С учетом уравнений (3), (4) выражение для концентрации водорода в III контуре примет следующий вид:
(6)
$С_{{\text{H}}}^{w} = {\text{\;}}\sqrt {\frac{{J_{{\text{H}}}^{{{\text{III}}}}}}{{{{k}_{{rec}}}}}} {\text{.}}$Выражение для потока водорода $J_{{\text{H}}}^{{{\text{III}}}}$ можно представить так:
С учетом формулы (7) уравнение (6) можно записать как
Так как содержание водорода в III контуре много больше его содержания в контуре II, будет справедливо записать выражение (3) в виде
(9)
$J_{{\text{H}}}^{{{\text{II}}}} = {\text{\;}}\frac{{{{D}_{{\text{H}}}}}}{{{{\sigma }_{{\text{с}}}}}}\sqrt {\frac{{{{v}_{{cor}}}}}{{Eq{{k}_{{rec}}}}}} {\text{.}}$Зная потоки водорода в III и II контурах, выражение для доли водорода ωН, перешедшего в натрий, можно представить в следующем виде:
РЕЗУЛЬТАТЫ РАСЧЕТА КОЭФФИЦИЕНТА И СКОРОСТИ ПОСТУПЛЕНИЯ ВОДОРОДА В НАТРИЙ II КОНТУРА
Расчет был выполнен на основании эксплуатационных данных в период проведения ЭХП с 1981 по 2020 г. на Белоярской АЭС. Общий вид зависимостей коэффициента и скорости поступления коррозионного водорода в натрий II контура при ЭХП показан на рис. 2. Из представленных диаграмм видно, что поток водорода в натрий II контура крайне мал, о чем косвенно свидетельствует довольно низкое значение коэффициента диффузии (примерно 3 × 10‒9 м2/с). В среднем в натрий II контура переходит около 4% водорода, который эффективно удаляется холодной ловушкой оксидов.
Рис. 2.
Зависимость коэффициента (а) и скорости (б) поступления коррозионного водорода в натрий II контура при эксплуатационных химических промывках. Номер петли: 1 ‒ 6; 2 ‒ 5; 3 ‒ 4
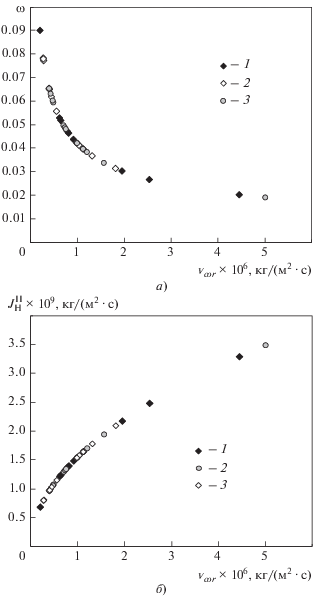
Для номинального режима работы испарителя парогенератора при температуре 673 K поток водорода в натрий II контура составил 3.72 × × 10‒11 кг/(м2 ∙ с), значение коэффициента поступления водорода было равно 0.65. Данное различие между номинальным режимом и режимом ЭХП [$J_{{{\text{H}}\,{\text{ЭХП}}}}^{{{\text{II}}}}$ = 3.49 × 10‒9 кг/(м2 ∙ с), ${{\omega }_{{{\text{ЭХП}}}}}$ = 0.09] обусловлено разницей температур. Другими словами, чем выше температура, чем больше водорода попадает во II контур. Следовательно, режим ЭХП не вносит ощутимого вклада в общий поток водорода за всю эксплуатацию парогенератора. Темп поступления водорода в натрий соответствует естественному процессу коррозии во время ЭХП и свидетельствует о безопасной эксплуатации парогенератора.
ОЦЕНКА НАВОДОРОЖИВАНИЯ СТАЛИ
Наводороживание – это внедрение водорода в металл из водных растворов или газонасыщенной водной среды, содержащей наводороживающий агент, под воздействием постоянного тока (гальваностатический режим), или постоянного электродного потенциала (потенциостатический режим), или путем коррозионных процессов.
Суммарная реакция выделения водорода выглядит следующим образом:
(11)
${{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }} + {{e}^{ - }} \to {{{\text{H}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Она включает в себя следующие стадии:
разряд
(12)
${{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }} + {{e}^{ - }} \to {{{\text{H}}}_{{ads}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O;}}$рекомбинацию
(13)
${{{\text{H}}}_{{ads}}} + {{{\text{H}}}_{{ads}}}{\text{ }} \to \,\,\,{{{\text{H}}}_{{\text{2}}}}{\text{;}}$электрохимическую десорбцию
(14)
${{{\text{H}}}_{{ads}}} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }} + {{e}^{ - }} \to {{{\text{H}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$На основании многочисленных исследований [5] можно полагать, что водород растворяется в окто- и тетрапорах кристаллической решетки металлов в атомарном состоянии, скапливается в порах и дефектах в молекулярной форме, вступает в химическое взаимодействие с различными элементами и фазами, имеющимися в металлах и сплавах, а также адсорбируется внутри металла на поверхностях микрополостей, пор, микротрещин.
Водородное охрупчивание в условиях статического нагружения металла приводит к снижению его длительной прочности. Наводороживание не всегда заканчивается разрушением металла. Присутствие водорода в кристаллической решетке ведет к потере пластичности (т.е. к хрупкости) металла, но только довольно большие растягивающие нагрузки или значительные внутренние напряжения могут привести к его растрескиванию, которое обычно протекает как транскристаллитный процесс. После металлургического передела и противофлокенной обработки 100 г перлитной стали, растворенной в матрице, занимают объем, равный приблизительно 1 см3 [6, 7].
Из уравнения (3) можно выразить разность ΔС, которая является концентрацией водорода в стали $C_{{\text{H}}}^{{{\text{ст}}}}{\text{:}}$
(15)
$C_{{\text{H}}}^{{{\text{ст}}}} = {\text{\;}}\frac{{J_{{\text{H}}}^{{{\text{II}}}}{{\sigma }_{{\text{с}}}}}}{{{{D}_{{\text{H}}}}}}{\text{.}}$При $J_{{\text{H}}}^{{{\text{II}}}}$ = 3.49 × 10‒9 кг/(м2 ∙ с) концентрация водорода в трубном пучке, изготовленном из стали 10Х2М, испарителя ПГН-200М БН-600 при ЭХП составила 2.57 × 10‒3 кг/м3.
Массовую долю водорода в стали вычисляют по формуле
(16)
${{g}_{{\text{H}}}} = {\text{\;}}\frac{{C_{{\text{Н}}}^{{{\text{ст}}}}}}{{{{\rho }_{{{\text{ст}}}}}}}{\text{,}}$При ρст = 7800 кг/м3 доля водорода в стали составляет 3.3 × 10‒8 кг/100 г стали, или 0.4 см3/100 г стали. Допустимый диапазон значений наводороживания низколегированной стали составляет 1‒2 см3/100 г стали [5]. Следовательно, при режиме ЭХП опасное накопление водорода в стали не происходит.
ВЫВОДЫ
1. Основным источником водорода в сопряженных контурах парогенератора типа “натрий–вода” является процесс электрохимической коррозии теплообменных поверхностей пароводяного контура.
2. За время эксплуатационной химической промывки в натрий II контура переходит примерно 4% коррозионного водорода. В эксплуатационном режиме, например при пуске и выходе на мощность, доля коррозионного водорода, поступающего по механизму диффузии в натрий II контура, повышается до 65% и более.
3. Содержание растворенного водорода в воде III контура практически не влияет на проникновение коррозионного водорода в натрий. Механизм водородопроницаемости в данной системе имеет электрохимическое происхождение и рассматривается как поток атомов водорода через мембрану (конструкционная сталь).
4. При наибольшем потоке водорода в натрий [3.49 × 10‒9 кг/(м2 ∙ с)] наводороживание стали 10Х2М незначительно. Максимальное содержание водорода, растворенного в стали, составляет 0.4 см3/100 г стали, поэтому нет оснований опасаться водородного охрупчивания стали парогенератора при проведении химических промывок.
Список литературы
Смыков В.Б., Ермолаев Н.П. Массоперенос коррозионного водорода в парогенераторе типа натрий-вода // ВАНТ. Сер. Атомное материаловедение. 1987. Вып. 1 (24). С. 3‒13.
Проницаемость водорода через металлы / А.А. Писарев, И.В. Цветков, Е.Д. Маренков, С.С. Ярко. М.: МИФИ, 2008.
Волгина Н., Ильюхина М., Королев М. Изучение изменения физико-механических свойств, наводороживания и топографии растрескивания стали в процессе испытания трубопроводов со стресс-коррозионными повреждениями // Междунар. науч.-практ. конф. по проблеме “Безопасность трубопроводов”. Москва, 1995 г. С. 165‒179.
Физическое материаловедение. В 6 т. / под общ. ред. Б. Калина. М.: МИФИ, 2007.
Вайнман А.Б., Филимонов О.В. Водородное охрупчивание парогенерирующих труб котлов. М.: Энергия, 1980.
Шаповалов В.И., Трофименко В.В. Флокены и контроль водорода в стали. М.: Металлургия, 1987.
Водород в металлах / под ред. Г. Алефельда, И. Фёлькля. В 2 т. М.: Мир, 1981.
Дополнительные материалы отсутствуют.
Инструменты
Теплоэнергетика