Теплофизика высоких температур, 2020, T. 58, № 1, стр. 41-46
Термодинамические свойства ванадия в конденсированном состоянии
В. И. Линева 1, 2, М. А. Синева 1, И. В. Морозов 1, 2, *, Г. В. Белов 1, 3
1 Объединенный институт высоких температур РАН
Москва, Россия
2 Московский физико-технический институт (государственный университет)
Долгопрудный, Россия
3 Химический факультет МГУ им. М.В. Ломоносова
Москва, Россия
* E-mail: morozov@ihed.ras.ru
Поступила в редакцию 27.03.2019
После доработки 27.08.2019
Принята к публикации 22.10.2019
Аннотация
В работе выполнен анализ всех имеющихся в литературе экспериментальных данных и основных обзорных работ по термодинамическим свойствам чистого ванадия в конденсированном состоянии. На основе проведенного анализа предложена новая зависимость теплоемкости от температуры в диапазоне $298.15$–$2650$ К при стандартном давлении, представленная единственным уравнением для твердой фазы. Полученный результат подготовлен для добавления в информационную систему ИВТАНТЕРМО.
ВВЕДЕНИЕ
Ванадий – пластичный металл, используемый преимущественно в металлургии в качестве легирующей добавки при производстве сплавов. Исследование свойств данного вещества началось с его открытия в середине XIX века и продолжается по сей день.
Весомый вклад в систематизацию экспериментальных данных по термодинамическим свойствам ванадия был сделан авторами справочника “Термодинамические свойства индивидуальных веществ” (ТСИВ) [1]. В частности, в 1982 г. ими было предложено уравнение для теплоемкости ванадия в конденсированной фазе. Наряду с данными по термодинамическим свойствам других индивидуальных веществ, результат был внесен в информационную систему ИВТАНТЕРМО [2, 3]. В 2010 г. информация в ИВТАНТЕРМО была обновлена в соответствии с новыми экспериментальными данными и опубликована в электронном виде на веб-сайте химического факультета МГУ [4] в виде 5-го и 6-го томов справочника ТСИВ. В 2017 г. в обзоре, выполненном Дж. Арбластером [5], предложена новая зависимость теплоемкости ванадия от температуры для конденсированного состояния.
Уравнения для теплоемкости, представленные в указанных источниках, существенно отличаются друг от друга. В связи с этим при подготовке новой версии информационной системы ИВТАНТЕРМО, получившей название “ИВТАНТЕРМО-онлайн” [6], возникла необходимость провести повторный анализ и уточнить данные по термодинамическим свойствам ванадия.
Экспериментальные данные для ванадия в конденсированном состоянии опубликованы преимущественно в виде таблиц, содержащих информацию об изобарной теплоемкости или приращении энтальпии при различных температурах. В связи с этим возникает задача совместной обработки двух типов данных и объединения результатов различных экспериментов с целью получения гладкой температурной зависимости термодинамических функций для всей исследуемой области.
Одним из наиболее часто используемых способов аппроксимации данных по приращениям энтальпии является метод Шомейта [7]. Именно этот метод с некоторыми дополнениями был использован при подготовке справочника ТСИВ [1], системы ИВТАНТЕРМО, а также других термодинамических баз данных, в частности проекта Chemistry WebBook Национального института стандартов США [8].
Задача совместной обработки данных по приращениям энтальпии и теплоемкостям является нетривиальной. Численное дифференцирование зависимости $\Delta H(T)$ с последующей совместной обработкой значений ${{({{\partial H} \mathord{\left/ {\vphantom {{\partial H} {\partial T}}} \right. \kern-0em} {\partial T}})}_{p}}$ и прямых измерений теплоемкости, хотя и используется в некоторых работах, часто приводит к потере точности результата. Более надежным способом является отдельная обработка данных по приращениям энтальпии методом Шомейта с последующим аналитическим дифференцированием аппроксимирующих функций и совместной обработкой полученных значений ${{({{\partial H} \mathord{\left/ {\vphantom {{\partial H} {\partial T}}} \right. \kern-0em} {\partial T}})}_{p}}$ с результатами прямых измерений ${{C}_{p}}(T).$ При этом значения ${{({{\partial H} \mathord{\left/ {\vphantom {{\partial H} {\partial T}}} \right. \kern-0em} {\partial T}})}_{p}}$ представляются снова в виде последовательности точек с определенным температурным шагом. Выбор этого шага влияет на статистический вес энтальпийных данных по отношению к данным по теплоемкости.
Указанный алгоритм был реализован в программе “CondensedThermoFit”, разработанной в ОИВТ РАН [9]. Данная программа апробирована при анализе термодинамических свойств диоксида урана в конденсированном состоянии [10] и используется в настоящей работе. Результат аппроксимации, получаемый с помощью “CondensedThermoFit”, подходит для экспорта в базу данных ИВТАНТЕРМО-онлайн.
ОБЗОР ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
В справочнике ТСИВ [1] термодинамические свойства чистого ванадия в конденсированном состоянии описываются уравнениями:
(1)
$\begin{gathered} 298.15\,\,{\text{K}} < T \leqslant {{T}_{{{\text{пл}}}}}, \\ C_{p}^{ \circ }(T) = 25.806 + 0.909 \times {{10}^{{ - 3}}}T + \\ + \,\,3.245 \times {{10}^{{ - 6}}}{{T}^{2}} - 1.676 \times {{10}^{5}}{{T}^{{ - 2}}}, \\ \end{gathered} $(2)
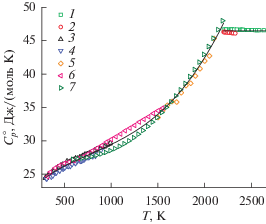
$T > {{T}_{{{\text{пл}}}}},\,\,\,\,C_{p}^{ \circ }(T) = 45.6\,\,{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{моль}}\;{\text{К}})}}} \right. \kern-0em} {({\text{моль}}\;{\text{К}})}}.$Для получения уравнения (1) использовались измерения приращений энтальпии, проведенные в [11–13], а также результаты измерений теплоемкости, выполненных в [14, 15]. Вышеперечисленные данные изображены на рис. 1 (кривая I). Результаты прямых измерений теплоемкости [14, 15] представлены в исходном виде, а данные измерений приращения энтальпии [11–13] преобразованы в соответствующие зависимости $C_{p}^{ \circ }(T)$ с помощью метода Шомейта. Значение теплоемкости жидкой фазы выбрано на основании рекомендации [21].
Рис. 1.
Зависимость теплоемкости ванадия в конденсированном состоянии от температуры: 1 – обобщение экспериментальных зависимостей $\Delta H(T)$ из [11–13, 16], 2 – результаты прямых измерений теплоемкости из [16, 17], 3 – [18], 4 – [19], 5 – [14], 6 – [20], 7 – [15]; результаты аппроксимации и анализа экспериментальных данных: I – уравнения (1), (2), [1]; II – (3), (4), [4]; III – (5)–(7), [5]; IV – [8].
Анализ экспериментальных данных с применением программы “CondensedThermoFit” позволил установить, что, несмотря на фактически экспоненциальный рост теплоемкости в области $1500$–$2000$ К, предложенная авторами [1] зависимость проходит намного ниже экспериментальных данных. Можно предположить, что данный результат вызван большой плотностью точек в начале температурного интервала, оказывающей сильное влияние на характер кривой, что является особенностью использованного метода Шомейта. Таким образом, из-за невысокой точности (1), (2) не могут быть использованы в качестве справочных данных.
Значение теплоемкости кристаллического ванадия, представленное в [4], отличается от бумажной версии справочника [1]:
(3)
$\begin{gathered} 298.15\,\,{\text{K}} < T \leqslant {{T}_{{{\text{пл}}}}},\,\,\,\,C_{p}^{ \circ }(T) = 26.122 + \\ + \,\,0.637 \times {{10}^{{ - 3}}}T + 3.057 \times {{10}^{{ - 6}}}{{T}^{2}} - \\ - \,\,0.187 \times {{10}^{6}}{{T}^{{ - 2}}}, \\ \end{gathered} $Уравнение (3) также было получено методом Шомейта, но на основании уже других работ, а именно, на основании измерений инкрементов энтальпии, выполненных в [12, 16], а также на измерениях теплоемкости ванадия [14, 19]. Для ванадия в жидком состоянии принято значение теплоемкости, полученное в [16]. Зависимость (3) хорошо согласуется с экспериментальными данными, использованными в более раннем варианте справочника [1]. Это позволило предположить, что при публикации данных в электронной версии справочника [4] вместо зависимости, описывающей новые данные, была предложена уточненная версия результатов, представленных в справочнике 1982 г. [1].
Иной вариант обработки экспериментальных данных представлен в работе [5]. Автор отказался от рассмотрения измерений приращения энтальпии ванадия, отдавая предпочтение прямым измерениям теплоемкости, выполненным в [19, 20]. При этом температурную зависимость теплоемкости для твердой фазы не удалось описать одним уравнением, и она представлена различными выражениями в двух интервалах:
(5)
$\begin{gathered} 298.15\,\,{\text{K}} < T \leqslant 1478\,\,{\text{K}}, \\ C_{p}^{^\circ }(T) = 26.3612 + 3.35842 \times {{10}^{{ - 4}}}T + \\ + \,\,3.19617 \times {{10}^{{ - 6}}}{{T}^{2}} - 209{\kern 1pt} 380{{T}^{{ - 2}}}, \\ \end{gathered} $(6)
$\begin{gathered} 1478\,\,{\text{K}} < T \leqslant {{T}_{{{\text{пл}}}}},\,\,\,\,C_{p}^{ \circ }(T) = 56.3414 - \\ - \,\,3.83985 \times {{10}^{{ - 2}}}T + 1.56354 \times {{10}^{{ - 5}}}{{T}^{2}}, \\ \end{gathered} $Значение теплоемкости ванадия в жидком состоянии (7) получено путем осреднения данных [16, 18]. Несмотря на то что для получения зависимостей (5), (6) автор не использовал большую часть работ, упомянутых в [4], при высоких температурах его результат лучше согласуется с представленными в этих работах данными, чем аппроксимация ТСИВ. Следует отметить, что в [5] скачкообразное изменение теплоемкости в точке плавления имеет другой знак, в отличие от [1, 4].
Тем не менее по причине отсутствия анализа всей совокупности экспериментальных данных работа [5] не соответствует принципу создания компетентно подтвержденных баз данных [22], а значит, не может быть использована в системе ИВТАНТЕРМО-онлайн.
ОБРАБОТКА ДАННЫХ ПО ПРИРАЩЕНИЯМ ЭНТАЛЬПИИ
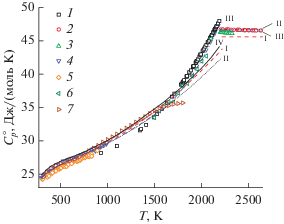
Обработка измерений приращений энтальпии в программе “CondensedThermoFit” начинается с рассмотрения экспериментальных данных в твердой фазе, представленных в [11–13, 16] (рис. 2а). Экспериментальные данные [11] расходятся с остальными более чем на 5% при температуре выше 1300 К. Поскольку эта работа опубликована в 1934 г. и не содержит информации об использованной методике измерений, данные [11] при температуре выше 1300 К исключены из рассмотрения. Результаты остальных работ, список которых приведен в табл. 1 с типом данных $\Delta H,$ обработаны методом Шомейта.
Рис. 2.
Обработка экспериментальных данных по приращениям энтальпии методом Шомейта: (а) – экспериментальные данные 1 – [11]; 2 – [12]; 3, 6 – [16]; 4 – [13]; 5 – [17]; 7 – [18] и результаты аппроксимации I – твердая фаза, II – жидкая фаза, уравнение (9) по данным [16, 17], III – жидкая фаза, (10) по данным [18]; (б) – отклонения экспериментальных данных от результатов аппроксимации с указанием уровня погрешности входных данных, использованного при обработке (см. табл. 1).

Таблица 1.
Экспериментальные данные, использованные при обработке, с указанием их относительных погрешностей
| Ссылка | Год | Тип данных | Чистота образца, % | Погрешность по данным эксперимента, % | Погрешность, принятая при обработке, % |
|---|---|---|---|---|---|
| [16] [17] [11] [18] [13] [12] |
1991 1995 1934 1972 1979 1977 |
$\Delta H$ | 99.99 99.9 – 99.94 – 99.94 |
1 5 0.2 0.11 5 0.57 |
1 5 0.5 0.5 5 1 |
| [20] | 1974 | ${{C}_{p}}$ | 99.99+ | 3 | – |
| [19] | 1982 | 99.995 | 0.5 | – | |
| [15] | 1965 | 99.74 | 2 | – | |
| [14] | 1973 | 99.93 | – | – |
Для обработки использовался взвешенный метод наименьших квадратов с весами $w = {1 \mathord{\left/ {\vphantom {1 {{{{(\delta F)}}^{2}}}}} \right. \kern-0em} {{{{(\delta F)}}^{2}}}},$ где $\delta F$ — погрешность вспомогательной функции Шомейта, рассчитанная на основе погрешности исходных экспериментальных данных. Значения относительных погрешностей округлялись до 0.5% в сторону увеличения (табл. 1). В результате аппроксимации получены следующие уравнения (кривая I на рис. 2а):
(8)
$\begin{gathered} \Delta H^\circ (T) = - 11{\kern 1pt} 082.6 + 33.193T - 6.476 \times \\ \times \,\,{{10}^{{ - 3}}}{{T}^{2}} + 5.018 \times {{10}^{5}}{{T}^{{ - 1}}} + 2.978 \times {{10}^{{ - 6}}}{{T}^{3}}, \\ C_{p}^{ \circ }(T) = 33.198 - 12.953 \times {{10}^{{ - 3}}}T - \\ - \,\,5.018 \times {{10}^{5}}{{T}^{{ - 2}}} + 8.933 \times {{10}^{{ - 6}}}{{T}^{2}}. \\ \end{gathered} $Аналогичным образом обработаны и экспериментальные данные для жидкой фазы [16–18]. Результаты авторов [16, 17] расходились с результатами [18] более чем на 5%. В связи с этим каждый из наборов данных аппроксимирован отдельной кривой. Зависимость, полученная из данных [16, 17], аппроксимирована уравнением (кривая II на рис. 2а)
(9)
$\begin{gathered} \Delta H^\circ (T) = - 21{\kern 1pt} 543 + 48.452T - 2.859 \times {{10}^{{ - 4}}}{{T}^{2}} + \\ + \,\,{{2.12 \times {{{10}}^{6}}} \mathord{\left/ {\vphantom {{2.12 \times {{{10}}^{6}}} T}} \right. \kern-0em} T}. \\ \end{gathered} $Зависимость, полученная из данных [18], аппроксимирована уравнением (кривая III на рис. 2а)
(10)
$\begin{gathered} \Delta H^\circ (T) = - 22{\kern 1pt} 925 + 51.124T - 9.82 \times {{10}^{{ - 4}}}{{T}^{2}} + \\ + \,\,{{2.316 \times {{{10}}^{6}}} \mathord{\left/ {\vphantom {{2.316 \times {{{10}}^{6}}} T}} \right. \kern-0em} T}. \\ \end{gathered} $При обработке данных по теплоемкости использованы следующие уравнения, полученные из (9), (10) соответственно:
(11)
$C_{p}^{ \circ }(T) = 48.452 - 5.719 \times {{10}^{{ - 4}}}T - 2.12 \times {{10}^{6}}{{T}^{{ - 2}}},$(12)
$\begin{gathered} C_{p}^{ \circ }(T) = 51.124 - 1.964 \times {{10}^{{ - 3}}}T - \\ - \,\,2.316 \times {{10}^{6}}{{T}^{{ - 2}}}. \\ \end{gathered} $При этом учтены и представленные авторами результаты для переохлажденной жидкости.
Отклонение экспериментальных данных по приращениям энтальпии от аппроксимационных кривых показано на рис. 2б. Также представлены погрешности экспериментальных данных, использованные при обработке (погрешности показаны только для некоторых точек из каждого набора данных). Для некоторых данных отклонение от аппроксимационной кривой превышает погрешность, указанную в экспериментальных работах, что может говорить о наличии неучтенных систематических ошибок в экспериментах, связанных, например, с недостаточно высокой чистотой образца.
ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ ПО ТЕПЛОЕМКОСТИ
Согласно описанной выше методике результаты обработки данных по приращениям энтальпии (8), (11) и (12) были снова представлены в виде набора точек $C_{p}^{ \circ }(T)$ и рассмотрены совместно с прямыми измерениями теплоемкости [14, 15, 19, 20] (рис. 3). Как видно из рис. 1, в области $T > 1500$ К объем данных по прямым измерениям теплоемкости (точки 6) существенно меньше, чем полученный в результате обработки приращений энтальпии (точки 1). В связи с этим при данных температурах использовался другой температурный шаг для представления кривой (8) в виде точек $C_{p}^{ \circ }(T),$ а именно 50 K.
В результате анализа полного набора экспериментальных данных установлено, что измерения [15] в интервале $1600$–$1800$ К расходятся с основным набором данных более чем на 7%. Такой результат, вероятно, обоснован снижением точности использованного метода измерений (адиабатической калориметрии) при повышении температуры. Таким образом, данные [15] выше 1600 К были исключены из рассмотрения.
По итоговому набору экспериментальных данных, представленному в табл. 1, проведены две кривые для твердой и жидкой фаз. Аппроксимация теплоемкостных данных совместно с результатом обработки данных по энтальпии производилась при помощи невзвешенного метода наименьших квадратов. В случае твердой фазы полученная зависимость представляет собой полином третьей степени, а для жидкой фазы – константу:
(13)
$\begin{gathered} 298.15\,\,{\text{K}} < T \leqslant {{T}_{{{\text{пл}}}}},\,\,\,\,C_{p}^{^\circ }(T) = 21.70353 + \\ + \,\,12.21982 \times \,\,{{10}^{{ - 3}}}T - 7.903896 \times {{10}^{{ - 6}}}{{T}^{2}} + \\ + \,\,3.481344 \times {{10}^{{ - 9}}}{{T}^{3}} - 22804.04{{T}^{{ - 2}}}, \\ \end{gathered} $Таблица 2.
Сравнение значений основных термодинамических функций, полученных в различных работах
| T, K | $C_{p}^{ \circ },$ Дж/(моль K) | $\Phi ^\circ ,$ Дж/(моль K) | ||||||
|---|---|---|---|---|---|---|---|---|
| данная работа | [5] | отличие, % | [4] | отличие, % | данная работа | [4] | отличие, % | |
| 298.15 500 1000 1500 2000 2200 2500 |
24.480 26.181 29.478 33.989 42.373 47.397 46.550 |
24.390 26.491 29.684 33.923 42.086 47.540 46.471 |
–0.37 1.18 0.70 –0.19 –0.68 0.30 –0.17 |
24.480 26.457 29.629 33.873 39.577 42.281 46.720 |
0.00 1.05 0.51 –0.34 –6.60 –10.79 0.37 |
13.309 22.348 37.299 47.387 55.316 58.158 62.945 |
13.309 22.370 37.407 47.550 55.486 58.294 63.508 |
0.00 0.10 0.29 0.34 0.31 0.23 0.89 |
В [4] указаны абсолютные погрешности вычисленных значений приведенной энергии Гиббса, которые авторы оценивают в 0.2, 0.4, 0.6 Дж К–1 моль–1 при температурах 298.15, 1000 и 2000 К соответственно. Значения приведенной энергии Гиббса, полученные в данной работе при тех же температурах (табл. 2), отличаются от справочных значений на 0.63, 0.74, 0.80 Дж К–1 моль–1 соответственно. Эти отличия также являются значимыми.
Сложность определения погрешностей значений термодинамических функций (13), (14) заключается в том, что представленный в данной работе метод включает в себя два этапа аппроксимации, на каждом из которых погрешность может быть определена по известным формулам погрешности метода наименьших квадратов. Доверительный интервал (для уровня 95%), полученный при аппроксимации теплоемкости для температур 298.15, 1000 и 2000 К, составляет 0.5, 0.25 и 0.2% соответственно. С учетом погрешностей входных экспериментальных данных и ошибок аппроксимации приращения энтальпии оценка погрешностей теплоемкости в указанных точках равна 1, 0.5 и 0.5%.
Энтальпия фазового перехода ванадия из твердого состояния в жидкое рассчитана как разность кривых, аппроксимирующих энтальпию твердой и жидкой фаз, в точке плавления. С учетом осредненной по абсолютным отклонениям результата от экспериментальных точек погрешности каждой из двух аппроксимаций общая погрешность энтальпии фазового перехода оценена в пределах 2%. Полученное значение в сравнении с экспериментальными данными [12, 16] представлено в табл. 3. Разность между расчетным и экспериментальным значениями укладывается в заявленную погрешность.
ЗАКЛЮЧЕНИЕ
С использованием программы “CondensedThermoFit” проведен анализ найденных в литературе экспериментальных данных и основных обзорных работ по термодинамическим свойствам чистого ванадия. Показано, что наиболее точно имеющиеся экспериментальные данные описываются уравнением из работы Арбластера [5]. Предложена новая зависимость термодинамических функций от температуры в диапазоне 298.15–2650 К, представленная единственным уравнением для твердой фазы. Полученный результат подготовлен для добавления в базу данных ИВТАНТЕРМО-онлайн.
Авторы выражают благодарность Е.Л. Осиной, Л.Н. Горохову и Дж. Арбластеру за плодотворную дискуссию и помощь в подготовке работы.
Список литературы
Гурвич Л.В., Вейц И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Спр. изд. / Под ред. Глушко В.П. Т. 4. М.: Наука, 1981. 624 с.
Гурвич Л.В. ИВТАНТЕРМО – автоматизированная система данных о термодинамических свойствах веществ // Вестник АН СССР. 1983. № 3. С. 54.
Belov G.V., Iorish V.S., Yungman V.S. IVTANTHERMO for Windows – Database on Thermodynamic Properties and Related Software // Calphad. 1999. V. 23. № 2. P. 173.
Термодинамические свойства индивидуальных веществ (электр. изд.). Т. 6. URL: http:// www.chem.msu.su/rus/tsiv/
Arblaster J.W. Thermodynamic Properties of Vanadium // J. Phase Equilib. Diffus. 2017. V. 38. № 1. P. 51.
Belov G.V., Dyahkov S.A., Levashov P.R. et al. The IVTANTHERMO-Online Database for Thermodynamic Properties of Individual Substances with Web Interface // J. Phys. Conf. Ser. 2018. V. 946. № 1. P. 012120.
Shomate C.H. High-temperature Heat Contents of Magnesium Nitrate, Calcium Nitrate, and Barium Nitrate // J. Am. Chem. Soc. 1944. V. 66. № 6. P. 928.
Chemistry WebBook, The National Institute of Standards and Technology web site. URL: http://webbook.nist.gov/chemistry/
Belov G.V., Morozov I.V., Sineva M.A. et al. Simultaneous Analysis of the Enthalpy Increment and Heat Capacity Data Measurements for Updating the IVTANTHERMO Database // J. Phys. Conf. Ser. 2019. V. 1385. P. 012025.
Аристова Н.М., Белов Г.В., Морозов И.В., Синева М.А. Термодинамические свойства диоксида урана в конденсированном состоянии // ТВТ. 2018. Т. 56. № 5. С. 677.
Jaeger F.M., Veenstra W.A. The Exact Measurement of the Specific Heats of Solid Substances at High Temperatures. VI. The Specific Heats of Vanadium, Niobium, Tantalum, and Molybdenum // Recl. Trav. Chim. Pays-Bas. 1934. V. 53. № 8. P. 677.
Березин Б.Я., Чеховской В.Я. Энтальпия и теплоемкость ниобия и ванадия в области от 298.15 К до температур плавления // ТВТ. 1977. Т. 15. № 4. С. 772.
Gathers G.R., Shaner J.W., Hixson R.S., Young D.A. Very High Temperature Thermo-physical Properties of Solid and Liquid Vanadium and Iridium // High Temp.–High Press. 1979. V. 11. № 6. P. 653.
Чеховской В.Я., Калинкина Р.Г. Истинная теплоемкость ванадия в интервале температур 300–900 К // ТВТ. 1973. Т. 11. № 4. С. 885.
Kohlhaas R., Braun M., Vollmer O. Die Atomwärme von Titan, Vanadin und Chrom im Bereich hoher Temperaturen // Z. Naturforsch. A. 1965. Bd. 20. № 8. S. 1077.
Lin R., Frohberg M.G. Enthalpy Measurements on Solid and Liquid Vanadium by Levitation Calorimetry // Z. Metallkd. 1991. Bd. 82. № 1. S. 48.
Schaefers K., Rösner-Kuhn M., Frohberg M.G. Enthalpy Measurements of Undercooled Melts by Levitation Calorimetry: the Pure Metals Nickel, Iron, Vanadium, and Niobium // Mater. Sci. Eng. A. 1995. V. 197. № 1. P. 83.
Berezin B.Ya., Chekhovskoi V.Ya., Sheindlin A.E. Enthalpy and Specific Heat of Molten Vanadium // High Temp. Sci. 1972. V. 4. № 6. P. 478.
Takahashi Y., Nakamura J.I., Smith J.F. Laser-Flash Calorimetry III. Heat Capacity of Vanadium from 80 to 1000 K // J. Chem. Thermodyn. 1982. V. 14. № 10. P. 977.
Cezairliyan A., Righini F., McClure J.L. Simultaneous Measurements of Heat Capacity, Electrical Resistivity, and Hemispherical Total Emittance by a Pulse Heating Technique: Vanadium, 1500 to 2100 K // J. Res. NBS A. 1974. V. 78. № 4. P. 509.
Чеховской В.Я. Энтальпия, теплоемкость, теплота и энтропия плавления некоторых тугоплавких металлов // Обзоры по теплофизическим свойствам веществ. М.: Изд-во АН СССР, 1979. № 6.
Gurvich L.V. Reference Books and Data Banks on the Thermodynamic Properties of Individual Substances // Pure Appl. Chem. 1989. V. 61. № 6. P. 1027.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур