Теплофизика высоких температур, 2020, T. 58, № 1, стр. 25-32
Конверсия природного газа импульсным барьерным разрядом при атмосферном давлении
В. Е. Маланичев 1, *, М. В. Малашин 1, В. Ю. Хомич 1
1 Институт электрофизики и электроэнергетики РАН
Санкт-Петербург, Россия
* E-mail: mve.191@gmail.com
Поступила в редакцию 05.04.2019
После доработки 10.07.2019
Принята к публикации 22.10.2019
Аннотация
В статье моделировался и исследовался экспериментально процесс взаимодействия барьерного разряда с природным газом в плазмохимическом реакторе с коаксиальной конфигурацией электродов. Полученные зависимости концентрации углеводородов от средней удельной энергии, которая вкладывалась в разряд, носят линейный характер. Предложено объяснение наблюдаемых результатов.
ВВЕДЕНИЕ
Плазма барьерного разряда (БР) характеризуется как неравновесная с значительным превышением температуры электронов над температурой ионов. Барьерный разряд рассматривается как перспективный инструмент для инициации химических реакций, которые в традиционных промышленных технологиях требуют повышенных температур и давлений газовой среды либо применения катализаторов.
В настоящей работе БР применялся для инициации химических превращений в природном газе. Такое исследование актуально, так как обработка природного газа может использоваться в качестве предварительного этапа в процессе парциального окисления метана и способствовать увеличению выхода синтез-газа, как было показано в работе [1]. Также обработка природного газа барьерным разрядом позволяет получить прямой синтез более сложных углеводородов из метана [2]. С целью достижения лучших показателей вышеперечисленных процессов необходимо детальное понимание механизма воздействия барьерного разряда на природный газ.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
На рис. 1 представлена схема экспериментальной установки. Применяемый в исследовании плазмохимический реактор (ПХР) состоит из диэлектрической трубки 1 (боросиликатное стекло) с внешним диаметром 25 мм и толщиной стенки 1.5 мм, внутри которой находится заземленный стержень из латуни 2 диаметром 18 мм. Внешний электрод 3 длиной 115 мм выполнен из алюминиевой фольги, которая плотно прилегает к внешней стенке диэлектрической трубки. На него с помощью специального генератора 4 [3] подавались прямоугольные униполярные высоковольтные импульсы частотой 4 кГц, амплитудой 15 кВ и длительностью 60 мкс. Регистрация электрофизических параметров производилась с помощью осциллографа 5, посредствам высоковольтного щупа 6 (Tektronix P6015A) и пояса Роговского 7.
Рис. 1.
Экспериментальная установка: 1 – диэлектрик (стекло), 2 – внутренний заземленный электрод, 3 – внешний электрод, 4 – генератор высоковольтных импульсов, 5 – осциллограф, 6 – высоковольтный пробник напряжения, 7 – датчик тока (пояс Роговского), 8 – баллон с исходным газом, 9 – вентиль, 10 – регулятор расхода газа, 11 – измеритель состава выходного газа (хроматограф/масс-анализатор), R – токоограничивающий резистор (100 Ом).

В плазмохимический реактор подавался природный газ (CH4 – 93.8 об. %, C2H6 – 3.7 об. %, С3Н8 – 1.1 об. % и незначительное количество азота, кислорода, аргона и др.). Расход Gng изменялся от 0.4 до 18 л/мин. После прохождения области разряда продукты реакции анализировались либо газовым хроматографом, либо квадрупольным масс-спектрометром MKS Instruments – Cirrus™300. Хроматограф имеет три параллельных аналитических канала, что позволяет одновременно анализировать все компоненты газа. Хроматограф оснащен тремя детекторами: одним пламенно-ионизационным и двумя детекторами по теплопроводности. В системе использовались набивная колонка с молекулярными ситами CaA, колонка с Porapak Q и капиллярная колонка HP-PLOT Al2O3/KCl, соединенная с пламенно-ионизационным детектором. Масс-спектрометр измерял ионный ток для соотношения массы к заряду от 1 до 48.
ОПИСАНИЕ РАСЧЕТНОЙ МОДЕЛИ
Для оценки ожидаемых результатов конверсии природного газа проведено численное моделирование. При расчете использовалась модель, имитирующая электрический пробой в газе атмосферного давления. Для геометрии модели реактора (рис. 2а) рассчитывались изменения приведенной напряженности электрического поля, концентрации и энергии электронов и ионов и других частиц вдоль радиуса r. Задавались следующие исходные данные: расстояние между заземленным электродом и диэлектриком АB = 1.5 мм, толщина диэлектрика ВС = 2 мм, потенциал в точке А φA = 0 (внутренний электрод заземлен), временная зависимость напряжения в точке С от времени UC(t) (рис. 2б), исходный состав подаваемого в ПХР газа (CH4 – 93.8 об. %, C2H6 – 3.7 об. %, С3Н8 – 1.1 об. %), давление PПХР = 1 атм, температура газа Т = 20°С. Список реакций представлен в таблице.
Рис. 2.
Схема газоразрядной ячейки (а): 1 – внутренний заземленный электрод, 2 – диэлектрик, 3 – внешний электрод; форма импульсов напряжения, прикладываемых к внешнему электроду (б): Т = 250 мкс, τ = 60 мкс, τ1 = τ2 = 100 нс.
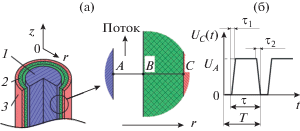
Таблица 1.
Список реакций, которые учитывались в модели
| Взаимодействие электрона с нейтральными частицами | |||||
| процесс | источник | процесс | источник | ||
| упругие соударения | диссоциация | ||||
| CH3 + e → CH3 + e | Морган1 | CH4 + e → CH3 + H + e | [6] | ||
| CH4 + e → CH4 + e | » | CH4 + e → CH2 + H2 + e | [6] | ||
| C2H4 + e → C2H4 + e | » | CH4 + e → CH + H2 + H + e | [6] | ||
| C2H6 + e → C2H6 + e | » | CH4 + e → C + 2H2 + e | [6] | ||
| Ионизация | C2H4 + e → C2H3 + H + e | [7] | |||
| CH4 + e → ${\text{CH}}_{4}^{ + }$ + 2e | [6] | C2H4 + e → C2H2 + H2 + e | [7] | ||
| C2H4 + e → ${{{\text{C}}}_{2}}{\text{H}}_{4}^{ + }$ + 2e | [7] | C2H6 + e → C2H5 + H + e | [7] | ||
| C2H4 + e → ${{{\text{C}}}_{2}}{\text{H}}_{3}^{ + }$ + H + 2e | [7] | C2H6 + e → C2H4 + H2 + e | [7] | ||
| C2H6 + e → ${{{\text{C}}}_{2}}{\text{H}}_{6}^{ + }$ + 2e | [7] | C3H6 + e → C2H4 + CH2 + e | [7] | ||
| C2H6 + e → ${\text{CH}}_{3}^{ + }$ + CH3 + 2e | [7] | C3H6 + e → C2H3 + CH3 + e | [7] | ||
| C3H6 + e → ${{{\text{C}}}_{2}}{\text{H}}_{4}^{ + }$ + CH2 + 2e | [7] | C3H6 + e → C2H2 + CH4 + e | [7] | ||
| C3H6 + e → ${\text{CH}}_{{\text{2}}}^{ + }$ + C2H4 + 2e | [7] | C3H7 + e → C2H4 + CH3 + e | [7] | ||
| C3H7 + e → ${{{\text{C}}}_{2}}{\text{H}}_{4}^{ + }$ + CH3 + 2e | [7] | C3H7 + e → C3H6 + H + e | [7] | ||
| C3H7 + e → ${\text{CH}}_{{\text{3}}}^{ + }$ + C2H4 + 2e | [7] | ||||
| Взаимодействие нейтральных частиц | |||||
| Процесс | Коэффициент скорости реакции | Источник | |||
| CH + H2 → CH2 + H | 2.34 × 10–12 см3/(молекула с) | [8] | |||
| CH2 + H2 → H + CH3 | 6.91 × 10–15 см3/(молекула с) | [8] | |||
| CH2 + CH4 → CH3 + CH3 | 5.00 × 10–14 см3/(молекула с) | [8] | |||
| CH2 + C2H3 → C2H2 + CH3 | 3.01 × 10–11 см3/(молекула с) | [8] | |||
| CH2 + C2H5 → C2H4 + CH3 | 3.01 × 10–11 см3/(молекула с) | [8] | |||
| CH2 + C3H7 → C3H6 + CH3 | 3.01 × 10–12 см3/(молекула с) | [8] | |||
| CH2 + C3H8 → C3H7 + CH3 | 1.02 × 10–20 см3/(молекула с) | [8] | |||
| CH3 + C2H4 → C2H3 + CH4 | 5.74 × 10–18 см3/(молекула с) | [8] | |||
| CH3 + C3H7 → C3H6 + CH4 | 3.07 × 10–12 см3/(молекула с) | [8] | |||
| C2H4 + H → C2H3 + H2 | 4.00 × 10–12 см3/(молекула с) | [8] | |||
| CH4 + H → CH3 + H2 | 2.26 × 10–18 см3/(молекула с) | [8] | |||
| CH4 + C2H5 → C2H6 + CH3 | 1.17 × 10–21 см3/(молекула с) | [8] | |||
| CH4 + C3H7 → C3H8 + CH3 | 1.33 × 10–21 см3/(молекула с) | [8] | |||
| C2H3 + C3H7 → C3H6 + C2H4 | 2.01 × 10–12 см3/(молекула с) | [8] | |||
| C2H3 + C3H8 → C3H7 + C2H4 | 7.15 × 10–17 см3/(молекула с) | [8] | |||
| C2H4 + H → C2H3 + H2 | 1.73 × 10–18 см3/(молекула с) | [8] | |||
| C2H4 + C2H5 → C2H6 + C2H3 | 2.13 × 10–23 см3/(молекула с) | [8] | |||
| C2H5 + H → CH3 + CH3 | 5.99 × 10–11 см3/(молекула с) | [8] | |||
| C2H5 + H2 → C2H6 + H | 2.89 × 10–19 см3/(молекула с) | [8] | |||
| C2H5 + C2H5 → C2H6 + C2H4 | 2.41 × 10–12 см3/(молекула с) | [8] | |||
| Процесс | Коэффициент скорости реакции | Источник | |||
| C2H5 + C3H7 → C2H4 + C3H8 | 1.91 × 10–12 см3/(молекула с) | [9] | |||
| C2H5 + C3H7 → C2H6 + C3H6 | 2.41 × 10–12 см3/(молекула с) | [9] | |||
| C2H5 + C3H8 → C3H7 + C2H6 | 1.61 × 10–15 см3/(молекула с) | [8] | |||
| C2H6 + C3H7 → C3H8 + C2H5 | 4.20 × 10–20 см3/(молекула с) | [8] | |||
| C3H7 + C3H7 → C3H6 + C3H8 | 2.81 × 10–12 см3/(молекула с) | [8] | |||
| C3H8 + H → C3H7 + H2 | 4.23 × 10–15 см3/(молекула с) | [8] | |||
| CH3 + CH3 + CH4 → C2H6 + CH4 | 1.56 × 10–26 см6/(молекула2 с) | [10] | |||
| CH3 + CH4 + C2H3 → C3H6 + CH4 | 4.91 × 10–30 см6/(молекула2 с) | [11] | |||
| CH3 + CH4 + C2H5 → C3H8 + CH4 | 1.00 × 10–28 см6/(молекула2 с) | [11] | |||
| CH4 + C2H5 + H → C2H6 + CH4 | 9.20 × 10–30 см6/(молекула2 с) | [11] | |||
| CH4 + C2H4 + H → C2H5 + CH4 | 3.66 × 10–30 см6/(молекула2 с) | [11] | |||
| CH4 + C2H2 + H → C2H3 + CH4 | 2.81 × 10–31 см6/(молекула2 с) | [8] | |||
| Взаимодействие нейтральных частиц с ионами | |||||
| ${\text{CH}}_{2}^{ + }$ + CH4 → ${{{\text{C}}}_{2}}{\text{H}}_{4}^{ + }$ + H2 | 8.40 × 10–10 см3/(молекула с) | [12] | |||
| ${\text{CH}}_{4}^{ + }$ + C2H4 → ${{{\text{C}}}_{2}}{\text{H}}_{5}^{ + }$ + CH3 | 4.23 × 10–10 см3/(молекула с) | [12] | |||
| ${{{\text{C}}}_{2}}{\text{H}}_{3}^{ + }$ + C2H6 → ${{{\text{C}}}_{2}}{\text{H}}_{5}^{ + }$ + C2H4 | 2.91 × 10–10 см3/(молекула с) | [12] | |||
| ${{{\text{C}}}_{2}}{\text{H}}_{3}^{ + }$ + C2H4 → ${{{\text{C}}}_{2}}{\text{H}}_{5}^{ + }$ + C2H2 | 8.90 × 10–10 см3/(молекула с) | [12] | |||
1 Данные взяты из базы данных “Морган” www.lxcat.net/Morgan от 3 января 2019.
Поскольку электрический пробой является сложным процессом и межэлектродный зазор намного меньше протяженности электродов, рассматривалась одномерная осесимметричная модель. Зависимость плотности электронов от времени вычислялась решением уравнения
Здесь M – количество реакций, xj – мольная доля исходного вещества для реакции j, Nn – концентрация нейтральных частиц (м–3), kj – коэффициент скорости реакции j (м3/с)
В данном уравнении γ = (2/me)0.5, me – масса электрона (кг), ε – энергия (эВ), σj – поперечное сечение столкновений (м2), f$\left( \varepsilon \right)$ – функция распределения электронов по энергиям (эВ–1.5).
Зависимость электрического потенциала в каждой точке зазора от времени определялась решением уравнения Пуассона
где ε0 – электрическая постоянная (Ф/м), φ – электрический потенциал (В), P – вектор электрической поляризации (Кл/м2), ρ – объемная плотность заряда (Кл/м3). Удельная подвижность электронов μeN рассчитывалась решением уравненияЗдесь N – общая концентрация частиц в газе (м–3), qe – заряд электрона (Кл), f0 – изотропная часть функции распределения электронов, иногда называемая “функцией вероятности энергии электронов” (эВ–1.5) [4]. Коэффициент диффузии электронов определяется уравнением
В случае тяжелых частиц (ионов и нейтральных) уравнение, включающее вектор плотности диффузионного потока ${{{\mathbf{j}}}_{i}} = \rho {{w}_{i}}{{{\mathbf{V}}}_{i}}$ (кг с–1 м–2) для i-го компонента, имеет вид
Здесь ρ – плотность газовой смеси (кг/м3); wi – массовая доля i-го компонента; u – вектор скорости потока частиц, усредненный по массе (м/с); Ri – слагаемое, отображающее уменьшение или увеличение i-го компонента вследствие ионизации, диссоциации или рекомбинации (кг м–3 с–1); ${{{\mathbf{V}}}_{i}} = ~{{D}_{i}}{{{\mathbf{d}}}_{i}}$ – скорость диффузии частиц i, где Di – коэффициент диффузии (м2/с) i-го компонента, di – движущая сила в диффузии (1/м) [5]. Из соотношения Эйнштейна
где kB – постоянная Больцмана (Дж/К), qi – заряд ионизованных частиц. Таким образом, учтен перенос частиц в сторону стенок разрядного промежутка вследствие диффузии в многокомпонентной среде [5]. Также при расчете как одно из граничных условий вводился процесс вторичной электронной эмиссии для точки А (рис. 2а) В точке B учитывался процесс накопления заряда:Здесь ρS – плотность заряда на поверхности (Кл/м2); nJion, nJe – нормальные составляющие ионного и электронного токов (А/м2).
Для моделирования химических превращений, инициируемых и стимулируемых БР, использовалось 23 разновидности частиц (заряженные частицы: e, ${\text{CH}}_{{\text{2}}}^{ + },$ ${\text{CH}}_{{\text{4}}}^{ + },$ ${{{\text{C}}}_{{\text{2}}}}{\text{H}}_{{\text{3}}}^{ + },$ ${{{\text{C}}}_{{\text{2}}}}{\text{H}}_{{\text{4}}}^{ + },$ ${{{\text{C}}}_{{\text{2}}}}{\text{H}}_{{\text{5}}}^{ + },$ ${{{\text{C}}}_{{\text{2}}}}{\text{H}}_{{\text{6}}}^{ + },$ ${{{\text{C}}}_{{\text{3}}}}{\text{H}}_{{\text{8}}}^{ + };$ нейтральные частицы: H, H2, C, CH, CH2, CH3, CH4, C2H2, C2H3, C2H4, C2H5, C2H6, C3H6, C3H7, C3H8), которые участвовали в 70 реакциях, приведенных в таблице. Учитывались реакции, обладающие наибольшей скоростью [10]. Условно они были разделены на четыре группы: взаимодействие электронов с нейтральными частицами, взаимодействие нейтральных частиц между собой, взаимодействие нейтральных частиц и ионов, рекомбинация ионов на поверхности. В таблице представлены все, за исключением последней. Рассматриваемая система уравнений решалась методом конечных элементов. В каждый последующий шаг по времени использовались химический состав и электрофизические параметры, полученные в результате расчета предыдущего шага.
ЭКСПЕРИМЕНТ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
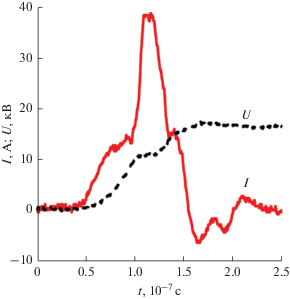
Эксперимент заключался в изменении формы горения барьерного разряда от мультиканальной до объемной при изменении скорости обновления газовой среды в разрядном промежутке ПХР при постоянных параметрах питающего напряжения. При больших расходах разряд горел с большей степенью однородности по объему (более детально это исследовалось в [13–16]), суммарный ток разряда при этом менялся слабо. Энергия в импульсе составляла около 19 мДж при средней мощности Pdis = 75.2 Вт. Типичная осциллограмма тока и напряжения на переднем фронте представлена на рис. 3.
Частота, форма и амплитуда импульсов напряжения в экспериментах не менялись, но, как отмечено выше, изменялся расход газа. По этой причине средняя удельная энергия Esp изменялась от 0.05 до 3.25 эВ на молекулу.
На рис. 4 представлены приведенная напряженность электрического поля и концентрация электронов в зависимости от координаты r в моменты нарастания импульса напряжения и спада. Данная зависимость является типичной для каждого импульса напряжения, и ее количественные значения от импульса к импульсу отличаются незначительно. Значение приведенного электрического поля в области диэлектрика (справа на графике) меньше нуля, что связано с оседанием электронов на диэлектрической стенке. Форма графика в районе значений r = 9–9.25 мм обусловлена наработкой электронов при ударной ионизации.
Рис. 4.
Зависимости приведенного электрического поля (а) и концентрации электронов (б) в разрядном промежутке от координаты r при нарастании (1) и спаде (2) импульса напряжения.

В процессе взаимодействия разряда с метаном происходит диссоциация метана на CH3 и H. Это наиболее вероятная реакция диссоциации метана. Распределение концентрации радикала CH3 в зазоре в момент разряда на переднем фронте импульса напряжения (ПФИН) и на заднем фронте (ЗФИН) показаны на рис. 5а. На рис. 5б приведена зависимость усредненной по зазору концентрации метила от времени в диапазоне, который соответствует четырем прямоугольным импульсам напряжения. В момент нарастания и спада импульса в зазоре развивается разряд. Восемь пиков на графике отвечают этому процессу. Такая зависимость связана с тем, что во время развития разряда создается большое количество электронов с энергией выше пороговой для ионизации и диссоциации. Это способствует активному протеканию химических процессов. После завершения разряда происходят рекомбинация ионов и соединение активных радикалов. В результате возникают стабильные химические соединения, отличные от исходных.
Рис. 5.
Зависимость концентрации CH3 в разрядном промежутке от координаты r в моменты нарастания (1) и спада (2) импульса напряжения (а) и зависимость усредненной по координате r концентрации CH3 от времени (б).

Изменение концентрации H2 в зазоре в зависимости от координаты r при различных энерговкладах представлено на рис. 6. Энерговклад 0.8 эВ на молекулу соответствует энерговкладу при одном импульсе напряжения. Бóльшая концентрация водорода в левой стороне графика объясняется тем, что в этой части зазора во время разряда концентрация высокоэнергетичных электронов выше.
Рис. 6.
Зависимость концентрации H2 в разрядном промежутке от координаты r при различных энерговкладах: 1 – 4.9 Дж/г (0.8 мэВ/молекула), 2 – 9.8 (1.6), 3 – 14.6 (2.4), 4 – 19.5 (3.3).

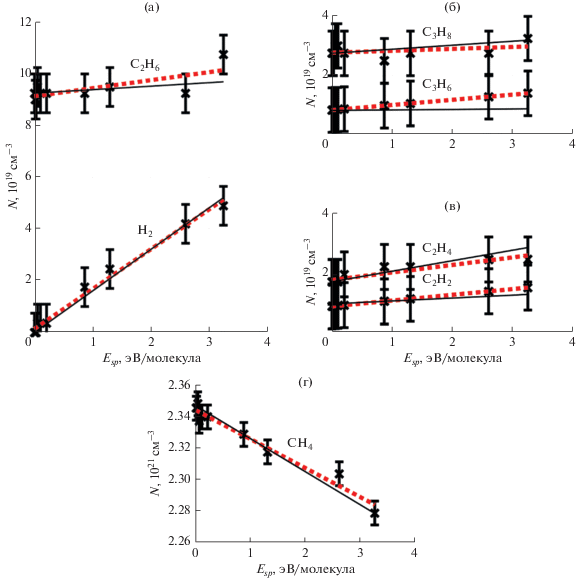
На рис. 7 приведены экспериментальные зависимости концентраций различных молекул от удельного энерговклада, которые наилучшим образом аппроксимируются линейной функцией (сплошные линии). Результаты численного моделирования (пунктир) близки к экспериментальным. Данные как эксперимента, так и моделирования показывают, что воздействие БР на природный газ приводит к образованию более сложных углеводородов. Конверсия метана при наибольшем энерговкладе составляла 3.68% селективности: H2 – 7.02%, C2H2 – 11.56%, C2H4 – 14.76%, C2H6 – 30.51%, C3H6 – 16.84%, C3H8 – 15.01%. Сумма по селективности равна 95.70% и отличается от 100% из-за того, что при анализе не учитывались осаждения на электрод и диэлектрик. Более детально этот вопрос исследовался в [17]. Полученные результаты хорошо согласуются с данными смежных исследований [18, 19], которые были проведены в области бóльших удельных энергий (от 7 до 9 эВ на молекулу); при этом конверсия метана изменялась от 9.5 до 18%.
Рис. 7.
Зависимость концентрации молекул С2H6 и H2 (а), С3H8 и С3H6 (б), С2H4 и С2H2 (в), СH4 (г) от среднего удельного энерговклада: сплошная линия – аппроксимация экспериментальных результатов, пунктир – данные моделирования.
Необходимо отметить, что явной зависимости конверсии метана, а также количества продуктов на выходе от степени однородности разряда выявлено не было. Ожидалось, что в более однородном по объему разряде плазмохимические реакции будут протекать эффективнее, так как при одинаковом суммарном токе через разряд плотность тока уменьшится, а значит, увеличится напряженность поля в межэлектродном зазоре. При повышенной напряженности электрического поля электроны в разряде обладают большей энергией и с большей вероятностью инициируют химические реакции. Такой эффект не был зарегистрирован экспериментально. Для объяснения причины этого необходимо рассмотреть этапы развития барьерного разряда [2, 20]. Условно можно выделить четыре этапа: первый – лавинный пробой в сторону анода, второй – развитие стримера в сторону катода, после достижения стримером катода третий – формирование устойчивого проводящего канала и заключительный четвертый этап – релаксация проводящего канала. На протяжении первых двух этапов в межэлектродном зазоре сохраняются высокие значения напряженности электрического поля (в это время эффективно разгоняются электроны) по сравнению с третьим и, тем более, четвертым этапами. Однако время первых двух этапов составляет порядка 5% от общего времени разряда. Таким образом, больше энергии в разряд вкладывается во время третьего этапа, но так как напряжение в зазоре в этот момент небольшое, то энергетический спектр электронов смещается в область более низких энергий, приводящих, главным образом, к нагреву среды. Безусловно, нагрев среды также увеличивает конверсию метана и концентрацию продуктов на выходе, но этот эффект слабо зависит от степени однородности разряда, а в основном от средней вкладываемой энергии, что хорошо видно из результатов эксперимента.
ЗАКЛЮЧЕНИЕ
Проведены моделирование и экспериментальное исследование процесса взаимодействия барьерного разряда с природным газом. Получены зависимости конверсии метана и концентрации продуктов на выходе от средней удельной энергии. Наилучшим образом эти зависимости аппроксимируются линейной функцией. Это связано с тем, что при воздействии разряда на газ, преобладает термический механизм инициации и стимуляции химических реакций. В процессе воздействия разряда на природный газ все продукты были получены путем конверсии метана в более сложные углеводороды. Основные продукты процесса взаимодействия при энерговкладе 3.25 эВ/молекула в порядке убывания селективности: этан – 30.51%, пропилен – 16.84%, пропан – 15.01%, этилен – 14.76%, ацетилен – 11.56%, водород – 7.02%. Конверсия метана при таком энерговкладе достигала 3.68%.
Список литературы
Маланичев В.Е., Малашин М.В., Мошкунов С.И., Небогаткин С.В., Хомич В.Ю., Шмелев В.М. Исследование стимулирования барьерным разрядом плазмохимических реакций // Письма в ЖТФ. 2017. Т. 43. № 10. С. 12.
Маланичев В.Е., Малашин М.В., Попов В.Е., Субботин Д.И., Суров А.В., Хомич В.Ю., Шаповалова О.В., Шмелев В.М. Термическая стимуляция как преобладающий механизм конверсии метана в барьерном разряде // Хим. физика. 2018. Т. 37. № 11. С. 31.
Малашин М.В., Мошкунов С.И., Хомич В.Ю. Генератор накачки лазера на парах меди на основе высоковольтного твердотельного коммутатора // Прикл. физика. 2010. № 5. С. 102.
Lieberman M.A., Lichtenberg A.J. Principles of Plasma Discharges and Materials Processing. Hoboken: John Wiley & Sons, Inc., 2005. 800 p.
Bird R.B., Stewart W.E., Lightfoot E.N. Transport Phenomena. N.Y.: John Wiley & Sons, Inc., 2006. 928 p.
Janev R.K., Reiter D. Collision Processes of CHy and ${\text{CH}}_{y}^{ + }$ Hydrocarbons with Plasma Electrons and Protons // Phys. Plasmas. 2002. V. 9. № 9. P. 4071.
Janev R.K., Reiter D. Collision Processes of C2,3Hy and ${{{\text{C}}}_{{2,3}}}{\text{H}}_{y}^{ + }$ Hydrocarbons with Electrons and Protons // Phys. Plasmas. 2004. V. 11. № 2. P. 780.
Manion J.A., Huie R.E., Levin R.D. et al. NIST Che-mical Kinetics Database, NIST Standard Reference Database 17, Version 7.0 (Web Version), Release 1.6.8. Gaithersburg, Maryland, 2015. http://kinetics.nist.gov/
Tsang W. Chemical Kinetic Data Base for Combustion Chemistry. Part 3. Propane // J. Phys. Chem. Ref. Data. 1988. V. 17. № 2. P. 887.
Baulch D.L., Cobos C.J., Cox R.A., Esser C., Frank P., Just T., Kerr J.A., Pilling M.J., Troe J., Walker R.W., Warnatz J. Evaluated Kinetic Data for Combustion Modelling // J. Phys. Chem. Ref. Data. 1992. V. 21. № 3. P. 411.
Bie C.D., Verheyde B., Martens T., Dijk J., Paulussen S., Bogaerts A. Fluid Modeling of the Conversion of Methane into Higher Hydrocarbons in an Atmospheric Pressure Dielectric Barrier Discharge // Plasma Processes Polym. 2011. V. 8. P. 1033.
Woodall J., Agúndez M., Markwick-Kemper A.J., Millar T.J. The UMIST Database for Astrochemistry 2006 // Astron. Astrophys. 2007. V. 466. № 3. P. 1197.
Khomich V.Yu., Malanichev V.E., Malashin M.V., Moshkunov S.I. Dielectric Barrier Discharge Uniformity Enhancement by Air Flow // IEEE Trans. Plasma Sci. 2016. V. 44. № 8. P. 1349.
Малашин М.В., Мошкунов С.И., Хомич В.Ю., Шершунова Е.А. Об однородности диффузного барьерного разряда в атмосферном воздухе между плоскими цилиндрическими электродами // Письма в ЖТФ. 2015. Т. 41. № 9. С. 54.
Shershunova E.A., Malashin M., Moshkunov S., Khomich V. Diffuse DBD in Atmospheric Air at Different Applied Pulse Widths // Acta Polytechnica. 2015. V. 55. № 1. P. 59.
Chernyshev S.L., Gamirullin M.D., Kuryachii A.P., Litvinov V.M., Manuilovich S.V., Rusyanov D.A., Khomich V.Y., Moshkunov S.I., Rebrov I.E., Yamshchikov V.A. Electrogasdynamic Laminar Flow Control on a Swept Wing // Aerosp. Sci. Technol. 2016. V. 59. P. 155.
Farouk T., Farouk B., Gutsol A., Fridman A. Atmospheric Pressure Methane–Hydrogen DC Micro-Glow Discharge for Thin Film Deposition // J. Phys. D: Appl. Phys. 2008. V. 41. № 17. P. 5202.
Kado S., Urasaki K., Sekine Y., Fujimoto K., Nozaki T., Okazaki K. Reaction Mechanism of Methane Activation Using Non-equilibrium Pulsed Discharge at Room Temperature // Fuel. 2003. V. 82. № 18. P. 2291.
Li X.-S., Zhu A.-M., Wang K.-J., Xu Y., Song Z.-M. Methane Conversion to C2 Hydrocarbons and Hydrogen in Atmospheric Non-Thermal Plasmas Generated by Different Electric Discharge Techniques // Catalysis Today. 2004. V. 98. № 4. P. 617.
Brandenburg R. Dielectric Barrier Discharges: Progress on Plasma Sources and on the Understanding of Regimes and Single Filaments // Plasma Sources Sci. Technol. 2017. V. 26. № 5. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур