Теплофизика высоких температур, 2020, T. 58, № 1, стр. 51-54
Теплопроводность хлоридов щелочных металлов: расчет методом молекулярной динамики
Д. О. Закирьянов 1, *, Н. К. Ткачев 1
1 Институт высокотемпературной электрохимии УрО РАН
г. Екатеринбург, Россия
* E-mail: dmitry.usu.ph@yandex.ru
Поступила в редакцию 14.06.2018
После доработки 10.01.2019
Принята к публикации 22.10.2019
Аннотация
Методом классической молекулярной динамики рассчитаны коэффициенты теплопроводности расплавленных солей MCl (M = Li, Na, K, Rb, Cs) в температурном интервале двухсот градусов выше температур плавления. Моделируемая система представляла собой 4000 неэквивалентных ионов (по 2000 ионов металла и хлора) с периодическими граничными условиями. При моделировании использовался потенциал Борна–Майера с кулоновским термом. Показано, что теплопроводность хлоридов щелочных металлов снижается при увеличении порядкового номера катиона в ряду Li+ → Na+ → K+ → Rb+ → Cs+, при этом для всех расплавов коэффициент теплопроводности слабо зависит от температуры.
ВВЕДЕНИЕ
Экспериментальные данные о теплопроводности расплавленных хлоридов щелочных металлов имеют противоречивый характер. Наиболее подробные сведения о данном свойстве впервые были представлены в работе Смирнова и соавторов [1]. В этом исследовании методом коаксиальных цилиндров измерена теплопроводность галогенидов щелочных металлов в различных интервалах температур выше точки плавления. Показано, что в ряду LiCl → NaCl → KCl → RbCl → → CsCl коэффициент теплопроводности λ снижается при движении слева направо. Так, λLiCl = = 0.93 и λCsCl = 0.36 Вт/(м К) при 1070 К. Кроме того, обнаружено, что для всех исследованных систем теплопроводность увеличивается с ростом температуры. Однако в [2], где исследовалась температуропроводность методом принудительного релеевского рассеяния, установлено, что коэффициент теплопроводности хлоридов щелочных металлов слабо убывает с повышением температуры. Сами значения теплопроводности заметно меньше, чем в [1]: например, в области 1070 К λLiCl ≈ 0.6 и λCsCl ≈ 0.18.
Проводились также теоретические расчеты коэффициентов теплопроводности хлоридов щелочных металлов. Наибольшее распространение получила классическая молекулярная динамика. Так, в работе [3] с помощью равновесной молекулярной динамики по формулам Грина–Кубо были рассчитаны коэффициенты теплопроводности λNaCl и λKCl для расплавленных систем. Авторы использовали потенциал Борна–Майера–Хаггинса–Тоси–Фуми для описания парных взаимодействий. Система из 216 ионов в периодических граничных условиях моделировалась в ансамбле NVE на отрезке времени 5 нс с шагом 1 фс. Рассчитанные коэффициенты теплопроводности в целом подтверждают данные [2], на 10–20% превышая экспериментальные значения. Воспроизводился и небольшой отрицательный наклон [1] температурной зависимости коэффициента теплопроводности. Таким образом, для задачи расчета коэффициента теплопроводности относительно простое описание системы через парные потенциалы и классическую молекулярную динамику способно давать качественно и количественно согласующиеся с экспериментом результаты.
Работы последних лет по расчету коэффициента теплопроводности рассматривали в основном смешанные системы или (и) более сложные теоретические модели. В частности, в [4] использовались потенциалы, учитывающие поляризацию электронных оболочек под действием окружения. В рамках этой работы также получен отрицательный наклон зависимости λ(Т) для NaCl. Из результатов этой работы нельзя сделать вывод о том или ином влиянии поляризационных вкладов в парное взаимодействие ионов на теплопроводность солевого расплава, так как сопоставления с расчетами для более простых моделей парного взаимодействия не проводилось. Также в литературе не удалось обнаружить данных о молекулярно-динамических расчетах коэффициентов теплопроводности других расплавленных хлоридов (лития, рубидия и цезия). Таким образом, представляет определенный интерес сопоставление данных о теплопроводности, полученных методом молекулярной динамики, с результатами экспериментов для всего ряда расплавленных хлоридов щелочных металлов МCl (M = Li, Na, K, Rb, Cs).
Целью настоящей работы является расчет коэффициента теплопроводности в зависимости от температуры и катионного состава соли в ряду LiCl → NaCl → KCl → RbCl → CsCl методом классической молекулярной динамики для описания экспериментально наблюдаемого уменьшения теплопроводности в ряду соединений.
МЕТОДИКА
Опыт других авторов показывает, что коэффициент теплопроводности расплавленных хлоридов хорошо воспроизводится в рамках классической молекулярной динамики. В данной работе все расчеты проводились с использованием этого метода в программном пакете LAMMPS [5].
Проведенные для систем из 1280 и 4000 ионов предварительные расчеты показали, что флуктуации регистрируемой величины – градиента температуры – около своего среднего значения с течением времени существенно уменьшаются во втором случае. Для достижения приемлемой точности при расчете градиента температуры взято значение числа частиц N = 4000. В каждом расчете моделируемая система состояла из 2000 ионов щелочного металла и 2000 ионов хлора, помещенных в прямоугольный ящик с пропорциями измерений 1 : 1 : 4 и с периодическими граничными условиями вдоль всех направлений.
Для описания взаимодействий между ионами использовался парный потенциал Борна–Майера [6, 7] с кулоновским термом
Такой выбор модельного парного потенциала обусловлен стремлением описать снижение коэффициента теплопроводности в первую очередь с увеличением размера катиона, так как именно это и задает борн-майеровское отталкивание. Пренебрежение ван-дер-ваальсовским притяжением (по сравнению с распространенной моделью Борна–Майера–Хаггинса) обусловлено его малым вкладом в свойства расплавленной соли при температурах порядка 103 К. Хотя параметризация потенциала Борна–Майера используемыми здесь параметрами Фуми и Тоси применялась для твердых тел, данное описание хорошо работает и для жидких систем. В частности, для галогенидов щелочных металлов это было показано в работе по расчету температур плавления [8]. Кроме того, параметры Фуми и Тоси уже с успехом использовались для описания теплопроводности [3]. Значения параметров A и ρ взяты из работ [9, 10] и приведены в табл. 1.
Таблица 1.
Параметры парного потенциала
| LiCl | RbCl | |||||
|---|---|---|---|---|---|---|
| пары ионов | ++ | +– | – – | ++ | +– | – – |
| A | 49.9 | 324.6 | 3482.8 | 5135 | 4146 | 3482.8 |
| ρ | 0.342 | 0.342 | 0.317 | 0.337 | 0.337 | 0.317 |
| NaCl | CsCl | |||||
| пары ионов | ++ | +– | – – | ++ | +– | – – |
| A | 423.8 | 1254.5 | 3482.8 | 11 815.7 | 6288.3 | 3482.8 |
| ρ | 0.317 | 0.317 | 0.317 | 0.337 | 0.337 | 0.317 |
| KCl | ||||||
| пары ионов | ++ | +– | – – | |||
| A | 1154.1 | 1785 | 3482.8 | |||
| ρ | 0.337 | 0.337 | 0.317 | |||
Заряды ионов полагались равными q+ = +e и q– = –e, где e – элементарный заряд. С учетом факторов размера системы и вычислительной “стоимости” расчета дистанция обрезания потенциала принята rcutoff = 12 Å. Временнóй шаг моделирования составлял 2.5 фс для LiCl и 10 фс для NaCl, KCl, RbCl и CsCl.
Теплопроводность рассчитывалась следующим образом. На первом этапе систему приводили в равновесие при заданной температуре расплава Т в ансамбле NPT в течение 2 × 104 шагов. Затем система разбивалась на 20 одинаковых по толщине слоев по оси z и далее моделировалась в ансамбле NVE. Первый и одиннадцатый слои соответственно подвергались нагреву и охлаждению на $\Delta E$ = 3 эВ/пс для моделирования потока тепла (рис. 1), который можно вычислить по формуле
где S – площадь плоскости слоя, перпендикулярной оси z.Нагрев и охлаждение частей системы приводят к установлению температурного градиента, величина которого обратно пропорциональна коэффициенту теплопроводности
где ${{l}_{z}}$ – длина моделируемого ящика вдоль оси z. Данные о градиенте температур регистрировались после 104 шагов моделирования с включенным источником и стоком тепла на протяжении 5 × 104 шагов (125 пс для LiCl и 500 пс для остальных хлоридов) и осреднялись по времени. С использованием усредненных значений вычислялся коэффициент теплопроводности по формуле (1). Средняя температура при моделировании в ансамбле NVE может незначительно отличаться от заданной в предварительно уравновешивающем моделировании в ансамбле NPT. Это связано в первую очередь с конечным размером системы, допускающим флуктуации температуры даже при включенном термостате.Для каждой системы проведено 11 или 12 расчетов в интервале 200 градусов выше соответствующих температур плавления хлоридов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
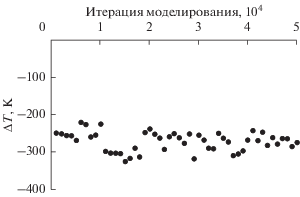
На рис. 2 приведен пример поведения градиента температуры в течение всего времени его регистрации. Обнаружено, что во всех случаях градиент температуры флуктуирует около среднего значения, не демонстрируя трендов к росту или снижению.
Рассчитанные коэффициенты теплопроводности расплавленных хлоридов щелочных металлов представлены на рис. 3. Видно, что теплопроводность в исследуемом ряду расплавов уменьшается. Во всех случаях коэффициент теплопроводности слабо уменьшается с ростом температуры.
Полученные значения λ хорошо согласуются с данными работ [2, 3]. При этом рассчитанная зависимость λ(Т) расплавов NaCl и KCl практически совпадает с полученной в эксперименте [2]. Для LiCl и RbCl расчетные значения завышены относительно экспериментальных примерно на 0.15 и 0.05 Вт м–1 К–1 соответственно, в то время как в случае CsCl рассчитанный коэффициент теплопроводности во всем моделируемом температурном интервале меньше полученных в [2] значений примерно на 0.05 Вт м–1 К–1. Несмотря на использованный более простой вид парного потенциала, результаты настоящей работы точнее воспроизводят экспериментальные данные, чем расчет [3] по формулам Грина–Кубо. Вероятно, хорошее согласие полученных результатов связано с достаточно большим размером моделируемой системы.
Расчеты данной работы показывают, что расплавленные хлориды щелочных металлов можно отнести к тому классу жидкостей, в которых теплопроводность падает с ростом температуры. В теории передачи теплоты, предложенной Предводителевым [11], изменение коэффициента теплопроводности с температурой определяется главным образом изменяющейся при этом плотностью системы. Малый наклон температурной зависимости, таким образом, можно связывать со слабым уменьшением плотности расплава при повышении температуры.
Зависимость коэффициента теплопроводности расплава от температуры обычно описывают линейной эмпирической зависимостью
По рассчитанным значениям получены параметры λ0 и b для всех исследуемых расплавов. Значения параметров приведены в табл. 2.
Таблица 2.
Параметры формулы (2) для различных расплавленных солей
| Соль | λ0, Вт м–1 К–1 | b × 104, Вт м–1 К–2 | Температурный интервал, К |
|---|---|---|---|
| LiCl | 0.991 | –2.56 | 890–1110 |
| NaCl | 0.876 | –3.13 | 1075–1275 |
| KCl | 0.611 | –2.3 | 1080–1310 |
| RbCl | 0.442 | –1.46 | 1050–1270 |
| CsCl | 0.233 | –0.83 | 970–1290 |
Полученные в рамках настоящей работы результаты дают основания полагать, что предложенный подход (включая вид парного потенциала и размер моделируемой системы) может быть успешно применен для расчета коэффициентов теплопроводности более сложных, в том числе бинарных, систем.
ЗАКЛЮЧЕНИЕ
Проведен молекулярно-динамический расчет коэффициентов теплопроводности расплавленных хлоридов щелочных металлов МCl (M = Li, Na, K, Rb, Cs) для температур от точки плавления до значений, на 200 градусов превышающих температуры плавления. Показано, что теплопроводность расплавов уменьшается в ряду LiCl → NaCl → → KCl → RbCl → CsCl, а с ростом температуры для каждого расплава уменьшается слабо, что хорошо согласуется с экспериментальными данными.
Список литературы
Smirnov M.V., Khokhlov V.A., Filatov E.S. Thermal Conductivity of Molten Alkali Halides and Their Mixtures // Electrochimica Acta. 1987. V. 32. № 3. P. 1019.
Nagasaka Y., Nakazawa N., Nagashima A. Experimental Determination of the Thermal Diffusivity of Molten Alkali Halides by the Forced Rayleigh Scattering Method. I. Molten LiCl, NaCl, KCl, RbCl, and CsCl // Int. J. Thermophys. 1992. V. 13. № 4. P. 555.
Galamba N., Nieto de Castro C.A. Thermal Conductivity of Molten Alkali Halides from Equilibrium Molecular Dynamics Simulations // J. Chem. Phys. 2004. V. 120. № 18. P. 8676.
Salanne M., Marrocchelli D., Merlet C., Ohtori N., Madden P.A. Thermal Conductivity of Ionic Systems from Equilibrium Molecular Dynamics // J. Phys.: Condens. Matter. 2011. V. 23. P. 102101.
Plimpton S. Fast Parallel Algorithms for Short-Range Molecular Dynamics // J. Comp. Phys. 1995. V. 117. P. 1.
Born M., Mayer J.E. Zur Gittertheorie der Ionenkristalle // Z. Physik. 1932. Bd. 75. S. 1.
Bleick W.E., Mayer J.E. The Mutual Repulsive Potential of Closed Shells // J. Chem. Phys. 1934. V. 2. P. 252.
Aragones J.L., Sanz E., Valeriani C., Vega C. Calculation of the Melting Point of Alkali Halides by Means of Computer Simulations // J. Chem. Phys. 2012. V. 137. P. 104 507.
Fumi F.G., Tosi M.P. Ionic Sizes and Born Repulsive Parameters in the NaCl-type Alkali Halides-I: The Huggins–Mayer and Pauling Forms // J. Phys. Chem. Solids. 1964. V. 25. № 4. P. 31.
Fumi F.G., Tosi M.P. Born Model Treatment of the Polymorphic Transitions of the Alkali Halides // J. Phys. Chem. Solids. 1962. V. 23. № 4. P. 359.
Предводителев А.С. О некоторых инвариантных количествах в теории теплопроводности и вязкости жидкостей // ЖФХ. 1948. Т. 22. № 3. С. 339.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур