Теплофизика высоких температур, 2020, T. 58, № 3, стр. 469-472
Супрамолекулярные аспекты в межмолекулярном взаимодействии
Ю. А. Неручев 1, *, М. Ф. Болотников 2, **
1 Курский государственный университет
г. Курск, Россия
2 Ульмский университет
г. Ульм, Германия
* E-mail: yuan2003@mail.ru
** E-mail: mikhail.bolotnikov@uni-ulm.de
Поступила в редакцию 26.07.2019
После доработки 30.10.2019
Принята к публикации 24.12.2019
Аннотация
Предложены соотношения, описывающие давление насыщенного и перегретого пара простых и неполярных веществ. Показано, что доминирующий вклад в энергию взаимодействия частиц пара вносят нековалентные дальнодействующие химические силы связи – силы Менделеева. Величина энергии связи пропорциональна критической температуре вещества.
ВВЕДЕНИЕ
Анализ проблем физики жидкости указывает на отсутствие всеобъемлющего понимания причин, приводящих к неудачам многочисленные попытки установления адекватных связей макроскопических свойств жидкости с микроструктурой ее частиц.
Д.И. Менделеев первым [1] обратил внимание на то, что при описании свойств жидких систем уделяется недостаточно внимания химическим аспектам межмолекулярного взаимодействия. К аналогичному выводу в своих многочисленных работах, например [2–4], пришел М.И. Шахпаронов. Он предложил особо выделить межмолекулярные силы, ответственные за ассоциацию частиц среды, которые назвал силами Менделеева [4].
В работе [5] теоретически и экспериментально показано проявление супрамолекулярного взаимодействия в органических системах. Необходимость пересмотра существующих представлений о характере межмолекулярных сил и структуре конденсированного вещества отмечают авторы публикаций [6–9], пытаясь объяснить его специфические особенности на базе новых идей. В этих условиях естественной задачей исследователей является анализ последствий учета влияния супрамолекулярных сил на теплофизические свойства различных фаз вещества.
В данной работе рассматривается влияние супрамолекулярных химических и традиционных межмолекулярных сил на теплофизические свойства жидкой и паровой фаз простых веществ.
Представления о существовании в жидкости квазикристаллических микроструктур, проявляющихся наличием ближнего порядка [10–12], позволяют объяснить целый ряд ее уникальных свойств, в частности аномальный ход изохорной теплоемкости простой жидкости, обусловленный ее кластерной структурой [13]. Такие особенности структуры жидкости связаны с существованием слабого химического взаимодействия, вызванного различными нековалентными процессами [5–9], и силами связи – силами Менделеева.
Присутствие в жидкости кластеров, их число $N$ и среднее число частиц в кластере можно количественно оценить с помощью предложенного авторами [13, 14] соотношения
(1)
$T{{\left( {\frac{{\partial p}}{{\partial T}}} \right)}_{V}} = \frac{{NkT}}{V} - \frac{{{{E}_{P}}}}{V}.$Важной особенностью соотношения (1) является присутствие в нем энергии взаимодействия частиц, а не ее производной, как это имеет место в уравнениях типа уравнения Ван-дер-Ваальса. Кроме того, определяемое (1) полное давление представляется суммой входящих в него величин, а не разностью, что является его структурным преимуществом. Такие особенности уравнения (1) обеспечивают ему существенно более высокую точность описания теплофизических свойств вещества при одних и тех же исходных условиях и одних и тех же физических моделях. Уравнение (1) не содержит эмпирических параметров, ограничивающих область применения, и естественным образом связывает теплофизические свойства конденсированных систем с надежно определяемыми экспериментально термодинамическими величинами.
Результаты использования уравнения (1) для описания теплофизических свойств углеводородов [14, 15] и их галогенозамещенных [16, 17] в широкой области параметров состояния показывают, что в жидкой фазе указанных веществ доминируют дисперсионные силы притяжения $(m = 6),$ энергия которых пропорциональна квадрату плотности $\left| {{{E}_{d}}} \right| = B{{\rho }^{2}}.$ Силы отталкивания характеризуются более высокой степенью $(n = 12).$ В силу этого энергия, связанная с ними, пропорциональна плотности в четвертой степени. Однако всеобъемлющее описание теплофизических свойств указанных веществ в широкой области параметров состояния возможно лишь при учете дальнодействующих химических сил связи (сил Менделеева). На возможность существования таких сил в жидкой и твердой фазах обращали внимание и другие исследователи [18, 19].
Природу этих сил в углеводородной среде авторы [5] связывают с нековалентным взаимодействием С–Н…С–Н-связей, обусловленным специфическим распределением электронной плотности вблизи π-электронов. Предполагается, что химические силы связи такой природы приводят к попарному взаимодействию частиц. Энергия связи каждой пары оценивается по соотношению
Следует обратить внимание на то, что значения констант дисперсионных сил $B$ и сил связи $b$ определяются критическими параметрами вещества с помощью приведенных ниже формул:
(2)
${{T}_{{{\text{cr}}}}}\left( {\frac{{\partial p}}{{\partial T}}} \right)_{V}^{{{\text{cr}}}} = B\rho _{{{\text{cr}}}}^{3} + \frac{{R{{T}_{{{\text{cr}}}}}}}{M}{{\rho }_{{{\text{cr}}}}},\,\,\,\,b = \frac{{R{{T}_{{{\text{cr}}}}}}}{{2M\rho _{{{\text{cr}}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {\text{3}}}} \right. \kern-0em} {\text{3}}}}}}}.$Эти формулы непосредственно следуют из (1) и условия распада димерных образований ${{\varepsilon }_{b}} = k{{T}_{{{\text{cr}}}}}$ в критической области [14]. Здесь $M$ – молярная масса вещества.
ДАВЛЕНИЕ ПАРА НА КРИВОЙ РАВНОВЕСИЯ
Предполагается, что в паровой фазе кластеры представляют собой димерные образования, которые в значительной степени диссоциированы. Действие дисперсионных сил притяжения и сил отталкивания из-за больших расстояний между частицами значительно ослаблено, и возникают благоприятные условия для изучения вклада в энергию межмолекулярного взаимодействия дальнодействующих сил связи.
Для решения данной задачи обратимся к соотношению, определяющему давление в системе взаимодействующих частиц:
(3)
$p = \frac{{1 + \delta }}{2}\frac{{RT}}{M}\rho - \frac{1}{3}\delta b{{\rho }^{{{4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3}}}} - 2B{{\rho }^{3}} + 4\delta a{{\rho }^{5}}.$(5)
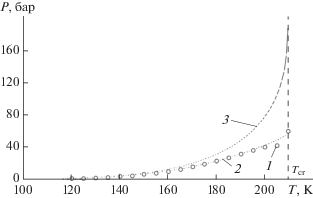
$K = C{\kern 1pt} {\text{exp}}({{{{T}_{{{\text{cr}}}}}} \mathord{\left/ {\vphantom {{{{T}_{{{\text{cr}}}}}} {T)\rho }}} \right. \kern-0em} {T)\rho }}{{T}^{{{{ - 3} \mathord{\left/ {\vphantom {{ - 3} 2}} \right. \kern-0em} 2}}}}.$Рис. 1.
Давление насыщенных паров метана: 1 – расчет по (3), 2 – данные [21], 3 – данные модели идеального газа.

Рассчитанные значения давления насыщенных паров в полной мере согласуются со справочными данными. Исключение составляют величины давления в критической точке и в непосредственной близости от нее, где велика неопределенность в оценке расстояния между частицами.
ДАВЛЕНИЕ ПАРА В ОДНОФАЗНОЙ ОБЛАСТИ
С помощью соотношений (3) и (4) рассчитаны давления пара простых веществ вдали от кривой равновесия вдоль произвольно выбранных изохор. Расчеты проведены для изохор аргона, ксенона, неона, азота и других веществ. Полученные результаты сопоставлены с данными расчетов давления пара по формуле, полученной интегрированием (1) и заменой в ней энергии взаимодействия соотношениями, представляющими зависимость от плотности ее отдельных частей
(6)
$\begin{gathered} p = {{p}_{s}} + \left( {B\rho _{s}^{3} + \delta b\rho _{s}^{{{4 \mathord{\left/ {\vphantom {4 3}} \right. \kern-0em} 3}}} - \delta a\rho _{s}^{5}} \right)\ln ({T \mathord{\left/ {\vphantom {T {{{T}_{s}}}}} \right. \kern-0em} {{{T}_{s}}}}) + \\ + \,\,\frac{{1 + \delta }}{2}\frac{{R{{\rho }_{s}}}}{M}(T - {{T}_{s}}). \\ \end{gathered} $Здесь нижний индекс s означает величину для пара на кривой равновесия жидкость–пар.
Анализ полученных результатов показывает, что предсказываемые формулами (3) и (6) значения давления пара и их зависимость от температуры согласуются с данными, представленными в [21] (таблице). К сожалению, структура формулы (6) не позволяет оценить величину давления пара на кривой равновесия. С этой задачей вполне удовлетворительно справляется формула (3).
Таблица 1.
Давление пара аргона на изохоре $\rho = 103.561\,\,{{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}$
| T, K | P, бар | Ошибка, % | T, K | P, бар | Ошибка, % | ||
|---|---|---|---|---|---|---|---|
| NIST | расчет (5) | NIST | расчет (5) | ||||
| 130 | 20.3 | 20.3 | 0.0 | 430 | 93.7 | 93.3 | –0.4 |
| 150 | 25.6 | 25.2 | –1.5 | 450 | 98.5 | 98.0 | –0.5 |
| 170 | 30.7 | 30.2 | –1.7 | 470 | 103.2 | 102.7 | –0.5 |
| 190 | 35.7 | 35.2 | –1.6 | 490 | 108.0 | 107.4 | –0.5 |
| 210 | 40.7 | 40.1 | –1.3 | 510 | 112.7 | 112.1 | –0.6 |
| 230 | 45.6 | 45.1 | –1.1 | 530 | 117.5 | 116.8 | –0.6 |
| 250 | 50.5 | 50.0 | –0.9 | 550 | 122.2 | 121.4 | –0.6 |
| 270 | 55.3 | 54.9 | –0.8 | 570 | 126.9 | 126.1 | –0.7 |
| 290 | 60.2 | 59.8 | –0.6 | 590 | 131.7 | 130.7 | –0.7 |
| 310 | 65.0 | 64.6 | –0.6 | 610 | 136.4 | 135.3 | –0.8 |
| 330 | 69.8 | 69.5 | –0.5 | 630 | 141.1 | 139.9 | –0.8 |
| 350 | 74.6 | 74.3 | –0.4 | 650 | 145.8 | 144.5 | –0.9 |
| 370 | 79.4 | 79.1 | –0.4 | 670 | 150.5 | 149.1 | –0.9 |
| 390 | 84.2 | 83.8 | –0.4 | 690 | 155.2 | 153.7 | –1.0 |
| 410 | 88.9 | 88.6 | –0.4 | 700 | 157.6 | 156.0 | –1.0 |
Согласие значений давления пара, рассчитанных с помощью соотношений (3) и (6), в одно из которых входит величина энергии межмолекулярных сил, а в другое – ее производная, свидетельствует о том, что принятая зависимость энергии сил Менделеева от расстояния между частицами вполне реалистична. Это значит, что силы Менделеева ведут себя как дальнодействующие химические силы связи и их вклад в энергию межмолекулярного взаимодействия в паровой фазе является доминирующим.
Эти выводы полностью согласуются с представлениями Д.И. Менделеева о необходимости учета влияния на межмолекулярное взаимодействие химических процессов, протекающих в среде. Из полученных результатов следует также, что мерой интенсивности сил связи является критическая температура [6]. Она определяет величину энергии сил связи (супрамолекулярного “родства”) частиц. Именно эти силы формируют в среде ближний порядок [5–9] и условия для резкого возрастания интенсивности дисперсионных сил притяжения, приводящих к критическому переходу пар–жидкость – образованию плотной конденсированной фазы вещества (жидкости).
ЗАКЛЮЧЕНИЕ
Предложены альтернативная модель и соотношения, описывающие теплофизические свойства вещества в паровой фазе. Эти соотношения свидетельствуют о том, что решающий вклад в процессы, протекающие в паре, вносят супрамолекулярные дальнодействующие силы связи – силы Менделеева. При этом критическая температура выступает в качестве меры “родства” частиц. Можно предполагать, что силы Менделеева определяют и другие процессы самоорганизации материи.
Список литературы
Менделеев Д.И. Растворы. М.: Академия наук СССР, 1959. 401 с.
Шахпаронов М.И. Введение в современную теорию растворов. М.: Высшая школа, 1976. 296 с.
Шахпаронов М.И. Взаимодействия между молекулами. М.: МГУ, 1972. С. 66.
Сперкач В.С., Шахпаронов М.И. Теория вязкости жидкостей. Объемная и сдвиговая вязкость жидких аргона, криптона, ксенона, азота и кислорода // ЖФХ. 1986. V. 60. № 8. P. 1891.
Hobza P., Muller-Dethlefs K. Non-Covalent Interactions: Theory and Experiment. Manchester: R. Soc. Chem., 2010. P. 225.
Hunter C.A. Van der Waals Interactions in Non-polar Liquids // Chem. Sci. 2013. V. 4. P. 834.
Trachenko K., Brazhkin V.V. Duality of Liquids. Sci. Rep. https://www.nature.com/articles/srep02188
Bolmatov D., Brazhkin V.V., Trachenko K. The Phonon Theory of Liquid Thermodynamics. Sci. Rep. https://www.nature.com/articles/srep00421
Cipcigan F.S., Crain J., Sokhan V.P., Martyna G.J. Electronic Coarse Graining: Predictive Atomistic Modeling of Condensed Matter // Rev. Mod. Phys. 2019. V. 91. https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.91.025003
Eisenstein A., Gingrich N.S. The Diffraction of X-Rays by Argon in the Liquid, Vapor, and Critical Regions // Phys. Rev. 1942. V. 62. P. 261.
Temperley N.H.V., Rowlinson J.S., Rushbrooke G.S. Physics of Simple Liquids. Amsterdam: North Holland, 1968.
Hobza P., Zahradnik R. Intermolecular Complexes. The Role of van der Waals System in Physical Chemistry and in the Biodisciplines // Phys. Theor. Chem. 1988. V. 52. P. 307.
Неручев Ю.А., Болотников М.Ф., Радченко А.К. Изохорная теплоемкость и кластерная структура простой жидкости // ТВТ. 2018. Т. 56. № 5. P. 699.
Неручев Ю.А., Болотников М.Ф. Кроссоверные соотношения для “простых” систем в критической области // ТВТ. 2008. Т. 46. № 1. P. 45.
Радченко А.K., Шахов А.В., Неручев Ю.А. Кластеры в “простых” и нормальных жидкостях // XV рос. конф. (с междун. участием) по теплофизическим свойствам вещества (РКТС-15). Т. 1. М., 2018.
Рышкова О.С. Исследования равновесных свойств жидких 1-бромалканов на основе акустических измерений. Дис. … канд. физ.-мат. наук. Курск: ЮЗГУ, 2010.
Коротковский В.И. Теплофизические свойства высокомолекулярных жидкостей и их галогенозамещенных. Дис. … канд. физ.-мат. наук. Курск: ЮЗГУ, 2013.
Китайгородский А.И. Молекулярные кристаллы. М.: Наука, 1971. 424 с.
Китайгородский А.И. Молекулярные силы. М.: Знание, 1978. 64 с.
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. М.: ГИФМЛ, 1972. 720 с.
Webbook NIST, 2018. https://webbook.nist.gov
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур