Теплофизика высоких температур, 2021, T. 59, № 2, стр. 178-182
Фазовые равновесия и критические свойства системы [xН2О + (1 – x)С7Н16], х = 0.355 мол. долей
В. А. Мирская, Н. В. Ибавов *, Д. А. Назаревич
Институт физики им. Х.И. Амирханова ДФИЦ РАН
Махачкала, Россия
* E-mail: nabi79@mail.ru
Поступила в редакцию 12.03.2020
После доработки 08.05.2020
Принята к публикации 18.06.2020
Аннотация
На автоматизированной экспериментальной установке, созданной на основе высокотемпературного адиабатного калориметра-пьезометра, исследована температурная зависимость изохорной теплоемкости двойной расслаивающейся системы н-гептан–вода с содержанием воды x = 0.355 мол. долей в диапазоне плотностей 149.9–399.8 кг/м3 и температур 397.15–550.15 К, включая области фазовых переходов и критическую область. Определены критические параметры и параметры образования азеотропа системы.
ВВЕДЕНИЕ
Исследуемая бинарная смесь н-гептан + вода является сложной системой, состоящей из компонентов различной природы: полярного (вода) и неполярного н-гептана. Изучение таких систем интересно для развития теории растворов, а именно влияния примеси полярного компонента (воды) на свойства н-алкана. Изучение водоуглеродных систем актуально и с практической точки зрения. Как известно, углеводороды ряда н-алканов являются основными компонентами нефтей и газоконденсатного флюида. В условиях пластового залегания нефть неизбежно контактирует с водой, что оказывает влияние на закономерности изменения их теплофизических свойств.
В литературе имеется ряд работ, посвященных исследованию термодинамических свойств системы н-алкан–вода. Большинство исследований были проведены в окрестности верхней критической линии с использованием методики оптической ячейки высокого давления и пьезометров постоянного объема [1–5]. Проведенный анализ литературных данных показал, что в публикациях практически отсутствуют данные о калорических исследованиях этих систем, кроме исследований, которые проводятся в Институте физики им. Х.И. Амирханова ДФИЦ РАН [6–8].
Настоящая работа является продолжением экспериментального исследования ранее изученной системы н-гептан–вода составов х = 0.0532, х = 0.147 и х = 0.295 мол. долей воды [7–10] в сторону увеличения концентрации полярного компонента. В данной работе на основе эксперимента по измерению изохорной теплоемкости исследована система [xH2O + (1 – x)C7H16] для х = = 0.355 мол. долей полярного компонента в широких диапазонах параметров состояния, в трехфазной, двухфазной и однофазной областях.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА И РЕЗУЛЬТАТЫ
Измерения температурных зависимостей теплоемкости и давления по изохорам проведены на экспериментальной установке по измерению изохорной теплоемкости и PVT-свойств с использованием метода высокотемпературного адиабатного калориметра-пьезометра [11]. Методика экспериментального исследования подробно описана в работах [12, 13].
В данном исследовании в качестве измерительной ячейки был использован сферический калориметр, изготовленный из нержавеющей стали марки 1Х18Н9Т.
Начальный объем калориметрического сосуда V0 определялся калибровкой по деаэрированному бидистилляту воды по данным [14]. В условиях комнатной температуры Т0 = 296.15 К и атмосферного давления Р0 объем калориметра V0 составил 423.57 ± 0.05 см3. Изменение объема калориметра вследствие термического и барического расширения VPT учитывалось внесением соответствующих поправок:
где α = (17 × 10–6) ± 0.3 К–1 – коэффициент линейного расширения материала калориметра при нормальной температуре. Поправка ΔVP рассчитана по формуле Лава для тонкостенной сферы [15] (β = 22.978 × 10–4 МПа–1). Таким образом, погрешность определения объема калориметра с учетом погрешностей в поправках ΔVT и ΔVP изменяется от 0.05% до 0.09% в интервале температур 300–650 К и давлений до 25 МПа. Исследуемую систему приготавливали на основе бидистиллята воды и н-гептана марки “эталонный” взвешиванием компонентов на аналитических весах с погрешностью 5 × 10–5–5 × 10–3 г. Значение плотности ρ вычислялось по отношению массы залитого образца к объему калориметра ρ = = m/VPT . Погрешность определения плотности с учетом поправок изменения объема калориметра вследствие термического и барического расширения не превышала 0.1%.Приготовленная смесь помещалась в измерительную ячейку с помощью системы высокого вакуума. На погрешность определения состава смеси влияет несколько факторов, которые сводились к минимуму, насколько возможно. Во-первых, измерительная система имеет малый балластный объем (объем заливочного капилляра и вентиля ≈1.3 см3) – менее 0.5% объема самого калориметра. Во-вторых, чтобы исключить ошибки в определении состава смеси при заливке, пикнометр с готовой смесью взвешивался до и после заливки. Оставшаяся после заливки часть смеси в пикнометре еще раз взвешивалась через 15 мин, т.е. после испарения гептана, таким образом определялось количество воды, оставшееся в пикнометре после заливки. В-третьих, была обеспечена точность взвешивания и калибровки калориметрического сосуда. С учетом всех перечисленных ошибок оценена погрешность определения состава смеси порядка ±0.002 мол. долей.
Величина изохорной теплоемкости Cv исследуемого образца смеси рассчитывалась по соотношению
где ΔQ – количество тепла, вводимое в калориметр; ΔT – изменение температуры; Qk – тепловой эквивалент калориметра; m – количество образца смеси, соответствующее исследуемой изохоре. Тепловой эквивалент калориметра определялся экспериментально посредством веществ с хорошо изученными теплофизическими свойствами в интервале рабочих температур и давлений. В качестве градуировочных веществ применялись вода и н-гептан [14, 16], поскольку эти вещества подробно исследованы различными авторами. Для калориметра, используемого в данной работе, среднее значение теплового эквивалента в экспериментальной области температур составило 245 Дж/К. Погрешность определения Qk в зависимости от области исследования не превышала 0.5–1.0%.В результате анализа было установлено [16], что методика исследования и применяемая аппаратура позволяют с учетом погрешностей отнесения, поправок на нестрогую изохоричность и др. измерять теплоемкость Cv с погрешностью 1–3% в зависимости от области исследования. Температура измерялась малогабаритным платиновым термометром сопротивления ПТС-10 с погрешностью 0.01 К. Термометр периодически (раз в два года) калибровался в реперных точках. Для измерения давления использовался датчик давления Курант ДИ-В. Курант ДИ-В – цифровой, высокотемпературный (до 350°C), малогабаритный тензопреобразователь избыточного давления. Диапазон измеряемого давления составляет 0–20 MПa с погрешностью 0.15%.
Температурные зависимости теплоемкости и давления системы [(1 − x)C7H16 + xH2O] измерялись по семи изохорам в интервале плотностей 149.9–399.8 кг/м3 и температур в интервале 397.15– 550.15 К.
В нормальных условиях смесь является бинарной расслаивающейся системой, состоящей из трех фаз: жидкость1 – L1 (н-гептан), жидкость 2 – L2 (вода) и пар – V. Измерения по изохорам начинались из области трехфазного состояния L1L2V в сторону увеличения температуры.
Как было отмечено ранее [9], температурная зависимость изохорной теплоемкости системы н-гептан–вода характеризуется двумя скачками (рис. 1), которые соответствуют фазовым переходам жидкость–пар (LG) и жидкость–жидкость (LL): резким при фазовом переходе жидкость–пар и размытым в некотором температурном интервале ΔТ при фазовом переходе жидкость–жидкость. На температурной зависимости давления P = f(T) при повышении температуры наблюдаются изломы и изгибы (рис. 2а), которые соответствуют фазовым переходам жидкость–пар и жидкость–жидкость.
Рис. 1.
Температурная зависимость изохорной теплоемкости системы [хН2О + (1 – х)С7Н16] по различным изохорам: (а) – 149.9; (б) – 399.8; (в) – 299.8; (г) 1 – 199.8, 2 – 179.8, 3 – 190.1 кг/м3.
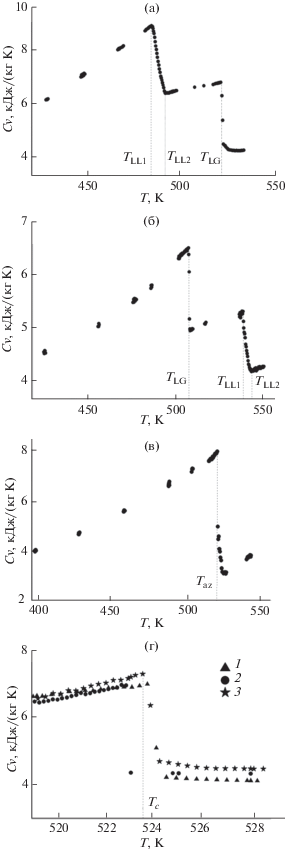
Рис. 2.
Температурные зависимости: (а) – давления, ρ = = 149.9 кг/м3; (б)–(г) – производной (∂P/∂T)ρ системы [хН2О + (1 – х)С7Н16], х = 0.355 мол. долей по различным изохорам: (б) – 179.8, (в) – 190.1, (г) – 199.7 кг/м3.
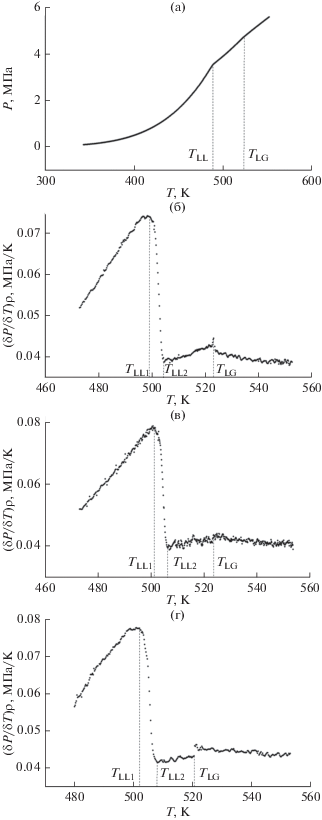
Непрерывная запись давления и температуры в калориметре во время эксперимента по измерению изохорной теплоемкости дает возможность воспроизводить зависимости производных давления (∂P/∂T)ρ от температуры, которые с хорошей точностью позволяют определять (Ts, Ps)-параметры фазовых переходов (рис. 2б–2г).
Таким образом, используемая методика и экспериментальная установка дают возможность определять параметры фазовых переходов (Ts, Ps) несколькими способами: по скачкам на температурной зависимости изохорной теплоемкости, по изломам и изгибам на температурной зависимости давления и по скачкам на температурной зависимости производной (∂P/∂T)ρ. Анализ экспериментальных данных показал, что результаты применения этих трех способов находятся в хорошем согласии.
По определенным описанными выше методами параметрам фазовых переходов (Ts, Ps) на рис. 3 построены линии фазовых равновесий ρ = f(T) жидкость–жидкость (LL) и жидкость–пар (LG).
Рис. 3.
Кривые фазового равновесия системы [хН2О + + (1 – х)С7Н16]: 1 – жидкость–газ, 2 – LL1, 3 – LL2.
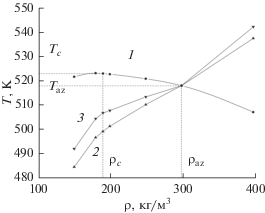
Для системы [хН2О + (1 – х)С7Н16], х = 0.355 мол. долей обнаружена изохора ρ = ρaz, на температурной зависимости изохорной теплоемкости которой наблюдается один скачок теплоемкости (рис. 1в), т.е. система переходит из трехфазного состояния сразу в однофазное (рис. 3), минуя двухфазную область. Это состояние соответствует состоянию азеотропа. Определены параметры (ρаz, Тaz, Paz) образования азеотропа (таблица). Такие же изохоры ρ = ρaz были обнаружены ранее для концентраций х = 0.147 и 0.295 мол. долей [9, 10] с параметрами, указанными в таблице. С увеличением концентрации полярного компонента в н-гептане плотность, соответствующая состоянию азеотропа ρaz, смещается в сторону меньших значений, а температура Тaz и давление Paz увеличиваются.
Значения параметров образования азеотропа и критических параметров системы [хН2О + (1 – х)С7Н16] для различных концентраций х = const
| x = 0.355 мол. долей | x = 0.147 мол. долей | x = 0.295 мол. долей | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ρaz, кг/м3 | Тaz, К | Paz, МПа | Тс, К | Pс, МПа | ρaz, кг/м3 | Тaz, К | Paz, МПа | ρaz, кг/м3 | Тaz, К | Paz, МПа |
| 299.8 | 518.62 | 6.16 | 523.64 | 5.44 | 464.2 | 485.65 | 3.30 | 361.1 | 515.50 | 5.81 |
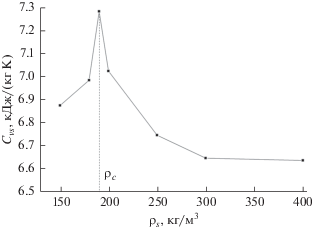
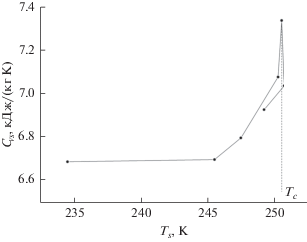
Для исследованной системы определены (Тс, Pс) критические параметры. В качестве критерия определения критических параметров системы принимались условия максимального значения величины изохорной теплоемкости в критической точке [17].
Как показано на рис. 4, максимум изохорной теплоемкости Cvs на пограничной кривой Сvs(ρs) приходится на критическую изохору ρc (рис. 1г), а максимум на кривой зависимости Сvs(Тs) (рис. 5) – на критическую температуру Tс. Дополнительным критерием определения критической точки также является отсутствие излома в переходе жидкость–пар на температурной зависимости давления Р(Т), и вследствие этого происходит обнуление скачка производной (∂P/∂T)ρ в этом переходе на критической изохоре [18]. На рис. 2 изображена температурная зависимость (∂P/∂T)ρ по докритической изохоре ρ < ρc. Как видно, скачок производной в переходе LG отрицательный. На послекритической изохоре ρ > ρc (рис. 2г) этот скачок меняет знак, и на критической изохоре (ρ = ρc, рис. 2в) скачок (∂P/∂T)ρ в переходе LG становится равным нулю. Значения критических параметров, полученных вышеописанными методами, отображены в таблице. Добавление 0.355 мол. долей воды в н-гептан приводит к снижению критической температуры н-гептана (540.15 К) на 16.5 К и росту критического давления н-гептана (2.78 МПа).
ЗАКЛЮЧЕНИЕ
Получены экспериментальные данные о температурной зависимости изохорной теплоемкости в широких интервалах температур и плотностей в трехфазном, двухфазном и однофазном состояниях. Показано, что в бинарной системе, состоящей из полярного компонента – воды и неполярного – н-гептана, при повышении температуры вдоль изохор происходят два фазовых перехода – жидкость–жидкость и жидкость–пар, которые сопровождаются двумя скачками теплоемкости. Характер фазовых переходов и их очередность различаются в зависимости от плотности исследуемой смеси.
Определены параметры образования состояния азеотропа (ρaz, Тaz, Paz) и влияние концентрации полярного компонента в смеси на изменения значений этих параметров. Показано, что увеличение концентрации полярного компонента в системе н-гептан–вода приводит к увеличению температуры и давления образования состояния азеотропа.
С использованием свойства максимума теплоемкости на критической изохоре и особенностей на температурных зависимостях производной (∂P/∂T)ρ, описанных выше, определены критические параметры (Тс, Pс) системы н-гептан–вода с концентрацией х = 0.355 мол. долей воды. Добавление х = 0.355 мол. долей воды в н-гептан приводит к снижению критической температуры и росту критического давления н-гептана.
Список литературы
De Loos Th.W., Penders W.G., Lichtenthaler R.N. Phase Equilibria and Critical Phenomena in Fluid (n-Hexane + + Water) at High Pressures and Temperatures // J. Chem. Thermodyn. 1982. V. 14. P. 83.
Yiling T., Michelberger Th., Franck E.U. High-pressure Phase Equilibria and Critical Curves of (Water + n-Butane) and (Water + n-Hexane) at Temperatures to 700 K and Pressures to 300 MPa // J. Chem. Thermodyn. 1991. V. 23. P. 105.
Brunner E. Fluid Mixtures at High Pressures IX. Phase Separation and Critical Phenomena in 23 (n-Alkane + + Water) Mixtures // J. Chem. Thermodyn. 1990. V. 22. P. 335.
Расулов С.М., Оракова С.М., Абдулагатов И.М. Термодинамические и структурные свойства смеси н-гексан–вода вблизи критической точки чистого растворителя // ТВТ. 2015. Т. 53. № 4. С. 524.
Расулов С.М., Оракова С.М., Исаев И.А. Термические свойства и фазовые диаграммы водно-углеводородных систем // ТВТ. 2016. Т. 54. № 2. С. 223.
Bezgomonova E.I., Abdulagatov I.M., Stepanov G.V. Experimental Study of the One, Two, and Three-phase Isochoric Heat Capacities of n-Hexane + Water Mixtures near the Lower Critical Line. Part I. Experimental Result // J. Mol. Liquids. 2012. V. 175. P. 121.
Mirskaya V.A., Nazarevich D.A. Definition of Parameters Phase Equilibria and Identification of Phases of System Hydrocarbon Water on the Basis of Calorimetric Measurements // J. Therm. Anal. Calorim. 2008. V. 92. P. 701.
Мирская В.А., Ибавов Н.В., Назаревич Д.А. Изохорная теплоемкость и фазовые равновесия бинарной системы н-алкан–вода // Вестн. Казанск. технол. ун-та. 2014. Т. 17. № 24. С. 80.
Мирская В.А., Ибавов Н.В., Назаревич Д.А. Экспериментальное исследование изохорной теплоемкости бинарной системы н-гептан–вода // ТВТ. 2015. Т. 53. № 5. С. 692.
Mirskaya V.A., Ibavov N.V., Nazarevich D.A. Phase Transitions in Binary System of n-Heptane + Water // J. Therm. Anal. Calorim. 2018. V. 133. P. 1109.
Степанов Г.В., Полихрониди Н.Г., Мирская В.А. Методика экспериментального исследования изохорной теплоемкости жидкостей и газов. Методика ГСССД. Зарегистрирована ВНИЦ СМВ. № ГСССД МЭ 115-03, 2003. 87 с.
Мирская В.А., Назаревич Д.А., Ибавов Н.В. Автоматизированная экспериментальная установка для исследования комплекса теплофизических свойств жидкостей и газов // ТВТ. 2016. Т. 54. № 2. С. 237.
Mirskaya V.A., Nazarevich D.A., Ibavov N.V. Method of Pressure Measurement Using an Experimental Setup for Investigating a Collection of Thermophysical Properties of Liquids and Gases // Measurement Techniques. 2017. V. 60. № 9. P. 906.
Александров А.А., Григорьев Б.А. Таблицы теплофизических свойств воды и водяного пара. Спр. М.: МЭИ, 1998. С. 168.
Love A.E.H. Mathematical Theory of Elasticity. London, 1927. P. 600.
Амирханов Х.И., Алибеков Б.Г., Вихров Д.И., Мирская В.А. Изохорная теплоемкость и другие калорические свойства углеводородов метанового ряда. Махачкала: Дагкнигоиздат, 1981. С. 254.
Амирханов Х.И., Полихрониди Н.Г., Алибеков Б.Г., Батырова Р.Г. Об одном методе определения критических параметров вещества // Теплоэнергетика. 1972. № 1. С. 61.
Воронов В.П., Городетский В.В. Прямая экспериментальная проверка гипотезы изоморфизма критических явлений // Письма в ЖЭТФ. 2000. Т. 72. Вып. 10. С. 740.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур