Теплофизика высоких температур, 2021, T. 59, № 6, стр. 960-963
Влияние запаздывания на эволюцию эпидемий
А. М. Игнатов 1, *, С. А. Тригер 2, Е. Б. Чернявский 2
1 Институт общей физики им. А.М. Прохорова РАН
Москва, Россия
2 Объединенный институт высоких температур РАН
Москва, Россия
* E-mail: satron@mail.ru
Поступила в редакцию 28.09.2021
После доработки 04.11.2021
Принята к публикации 23.11.2021
Аннотация
На основе дискретной модели распространения инфекции в замкнутой популяции найдена соответствующая ей форма дифференциальных уравнений с запаздыванием. Показано, что развитие эпидемии определяется четырьмя ключевыми параметрами: количеством заразных, средним числом опасных контактов одного заразного человека в день, вероятностью заражения в результате такого контакта и средней длиной отрезка времени, в течение которого заболевший способен заражать. Решение зависит также от размера популяции и от начального количества зараженных. Четыре названных параметра имеют ясный смысл и связаны с известной концепцией репродуктивного числа в непрерывных моделях SIR и SEIR. Условия насыщения эпидемии установлены путем решения полученных дифференциальных уравнений. Показано, что из-за длительного вирусоносительства, характерного для COVID-19, предлагаемые здесь решения существенно отличаются от модели SIR.
ВВЕДЕНИЕ
Большинство существующих моделей распространения инфекции моделируют спонтанное развитие эпидемии и описывают все ее стадии. Есть два типа таких моделей: модели SIS и модели SIR и SEIR. Первые относятся к пионерской работе [1] и используют предположение, что выздоровевшие люди могут немедленно снова заразиться. Модели SIR построены на предположении, что выздоровевшие имеют иммунитет и выпадают из эпидемии (см., например, [2]). Модели SIS используются в математической эпидемиологии [3]. Обзор приведен в [4] (см. также приведенные там ссылки). Баланс между восприимчивыми к инфекции и инфицированными членами популяции при различных условиях передачи инфекции является предметом исследования в [5]. В настоящее время эти базовые модели развиваются с учетом процесса вакцинации [6–9].
Модели SIR (“восприимчивый–заразный–удаленный”) и SEIR (“восприимчивый–зараженный–заразный–удаленный”) предполагают иммунитет выздоровевших людей ([10, 11] и ссылки в них), как и в предлагаемой модели. Однако возможность немедленного выздоровления, содержащаяся в моделях типа SIR и SEIR, весьма сомнительна для заболевания COVID-19. Наличие в этих моделях производной числа инфекционных людей по времени dI/dt определяется, в частности, членом –γI (где γ–1 – средняя продолжительность заболевания). Следовательно, существует вероятность немедленного выздоровления, что противоречит данным о течении COVID-19.
В данной работе учтены некоторые особенности COVID-19, следующие из недавней дискретной модели эпидемии [12]. Важной особенностью используемой модели является запаздывание, учитывающее подтвержденное клиническими данными длительное вирусоносительство. В отличие от запаздывания, рассматриваемого в [13], предлагаемая модель с запаздыванием предполагает, что переболевший является иммунным и в этом отношении соответствует модели SIR, а не SIS. В то же время рассматриваемая модель запаздывания не предполагает выделения отдельной категории скрытых вирусоносителей (см., например, SEIR-модель с запаздыванием в [14]). Скрытые носители вируса могут заражать окружающих без запаздывания и в этом смысле подобны инфицированным, в отличие от модели SEIR. Цель данной работы заключается в получении простой оценки для минимальной величины насыщения эпидемии в условиях модели, приближенной к реальности, где есть лишь носители вируса, способные заражать в течение времени d вне зависимости от своего субъективного состояния, иммунные переболевшие и не иммунные здоровые, способные заразиться. Различие между зараженными и заразными для вируса SARS-CoV-2 и его мутантов в данной модели не предполагается существенным. Вследствие этого, в отличие от моделей типа SIR, рассматриваемая модель для замкнутой популяции имеет три независимых параметра. Один из них – средняя продолжительность заболевания d, понимаемая как продолжительность того времени, в течение которого зараженный заразен. Другой параметр, скорость передачи инфекции p, подобен числу репродуктивности R0 в моделях SIR. Параметр p есть произведение p = nck, где nc – среднее количество опасных контактов в день для одного инфицированного человека, а k – средняя восприимчивость к вирусу здорового человека.
ОПИСАНИЕ МОДЕЛИ И РЕЗУЛЬТАТЫ РАСЧЕТА
Поскольку уже на ранней стадии эпидемии власти прибегают к изоляции, здесь рассматриваются замкнутые популяции (странa, регион, город и т.д.). При этом необходимо знать исходное состояние популяции, а именно количество инфицированных в начале эпидемии.
Согласно [12], дискретные уравнения, описывающие эпидемию день за днем (как и официальная статистика [8], которая здесь учитывается), имеют при l > d вид
(1)
$\begin{gathered} {{N}_{T}}\left( l \right) = {{N}_{T}}\left( {l - 1} \right) + {{N}_{I}}\left( l \right){{n}_{c}}k\left[ {1 - {{N}_{T}}\left( l \right){\text{/}}N} \right], \\ {{N}_{I}}\left( l \right) = {{N}_{T}}\left( l \right) - {{N}_{T}}\left( {l--d + 1} \right), \\ \end{gathered} $Исключая NI(l), получаем нелинейное уравнение относительно NT(l):
(2)
$\begin{gathered} {{N}_{T}}\left( l \right) = {{N}_{T}}\left( {l - 1} \right) + \\ + \,\,\left\{ {{{N}_{T}}\left( l \right) - {{N}_{T}}\left( {l--d + 1} \right)} \right\}{{n}_{c}}k\left[ {1 - {{N}_{T}}\left( l \right){\text{/}}N} \right]. \\ \end{gathered} $На рис. 1 показаны кривые, соответствующие уравнениям (1) для свободно текущей эпидемии в ограниченной популяции, как процент от ее численности. Использованы параметры p = 0.15 (черные кривые), 0.13 (темно-серые), 0.11 (светло-серые) и d = 14 суток. Ось x показывает число суток после первого заражения, ось y – долю затронутых членов популяции. Для расчетов использовалось начальное условие NI(l = 1) = NT(l = 1) = 1 + nck. Теория (рис. 1) описывает достижение коллективного иммунитета, зависящего от характерных параметров. Можно строго показать, что учет специальных карантинных мероприятий сводится к замене в уравнениях (1), (2) nck → nlk, где фактор nl отражает снижение среднесуточного числа опасных контактов вследствие принятых карантинных мер.
Рис. 1.
Общее число заражений (тонкие кривые, выходящие на насыщение) и текущее количество зараженных (кривые с максимумами), вычисленные по формуле (1) дискретной модели [12] как функции прошедших с начала эпидемии дней.

В уравнении (2) можно перейти от дискретного времени l к непрерывному времени. Для этого обозначим t = Δt(l – 1), где Δt – единица времени, равная одному дню, и положим NT(l) = x(t)N, NT(l) – NT(l – 1) = x'(t)N. Тогда уравнение (2) переписывается как
где θ(t) – ступенчатая функция Хевисайда, а T = d –1. Здесь предполагается, что время по-прежнему измеряется в днях, т.е. Δt = 1, иначе коэффициент p следует перенормировать.На начальной стадии эпидемии 0 ≤ t ≤ T уравнение (3) имеет вид
а его решение равно(5)
${{x}_{0}}\left( t \right) = \frac{{\epsilon {{{\text{e}}}^{{pt}}}}}{{\epsilon {{{\text{e}}}^{{pt}}} - \epsilon + 1}},$Решение (5) служит начальной функцией для уравнения (3), т.е. x(t) = x0(t) при 0 ≤ t ≤ T.
Есть два стационарных решения уравнения (4), а именно неустойчивое решение x0(t) = 0 и устойчивое решение x0(t) = 1, которое является пределом x0(t) (5) при t → ∞. Напротив, дифференциальное уравнение с запаздыванием (3) имеет произвольное стационарное решение x(t) = C при t > T (0 ≤ C ≤ 1). Очевидно, что в течение длительного времени любое решение уравнения (3) стремится к некоторому стационарному стабильному значению насыщения, как показано на рис. 1.
Минимальное значение насыщения можно оценить путем линеаризации уравнения (3) вблизи произвольного стационарного решения x(t) = C. Пусть x(t) = C + Δx(t), тогда линеаризованное уравнение Δx'(t) = p (1 – C)[ Δx(t) – Δx(t – T)]. Полагая, что Δx(t) = exp(λt/T), приходим к характеристическому уравнению
Один из корней этого уравнения – λ = 0. Другой действительный корень уравнения (6) отрицательный λ < 0, если Tp(1 – C) < 1. Другими словами, стационарное решение x(t) = C устойчиво, если
(7)
$C > \left\{ \begin{gathered} 0,~Tp \leqslant 1, \hfill \\ 1 - ~\frac{1}{{Tp}},\,\,\,\,Tp > 1. \hfill \\ \end{gathered} \right.$Следовательно, значение насыщения x∞(p) = = $\mathop {\lim }\limits_{t \to \infty } x\left( t \right)$ должно превышать значение, заданное уравнением (7). На рис. 2 показана зависимость асимптотического значения решения уравне-ния (3) от pT, вычисленная для двух значений начального возмущения ϵ = 10–6 и 5 × 10–2. Если pT < 1, значительного роста эпидемий нет. Для больших значений pT уровень насыщения всегда больше, чем значение, заданное уравнением (7), и стремится к единице при pT $ \gg $ 1. При достаточно малом значении $\epsilon \ll $ 1 функция x∞(p) стремится к универсальной кривой, не зависящей от начального возмущения (например, кривая 1 на рис. 2). Однако время, необходимое для достижения значения насыщения, зависит от начального возмущения.
Рис. 2.
Зависимость значения уровня насыщения эпидемии x∞ от pT: 1 – ϵ = 10–6, 2 – 5 × 10–2, 3 задается уравнением (7).

Сравним полученные результаты с предсказаниями модели SIR (см., например, [11]). В рамках этой модели динамика роста доли заразившихся с начала эпидемии может быть записана как dx(t)/dt = F(x(t)), где
(8)
$F\left( x \right) = p\left( {1 - x} \right)\left( {\frac{{{\text{lg}}\left( {1 - x} \right)}}{{pT}} + x + \epsilon } \right).$Примеры роста эпидемии, рассчитанные с использованием предложенной модели (3) и SIR-модели (8), показаны на рис. 3. Для достаточно малого начального возмущения ϵ модель SIR предсказывает примерно вдвое большее время насыщения.
Рис. 3.
Сравнение двух моделей ϵ = 10–5, p = 0.1, T = 13: 1 – модель SIR, 2 – уравнение с запаздыванием (3).
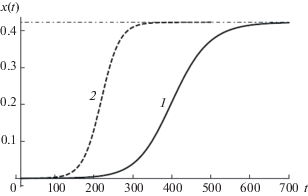
Как уже упоминалось, существует бесконечное количество стационарных состояний уравнения с запаздыванием (3). Напротив, помимо корня x = 1, существует только один корень уравнения F(x1) = = 0, который можно записать как x1(ϵ, pT) = 1 + + W(–pTe–pT(ϵ + 1))/(pT), где W(z) – функция Ламберта [15]. Легко проверить, что стационарное состояние устойчиво, т.е. F '(x1) > 0. Численно установлено, что для наиболее интересного случая малого начального возмущения ε $ \ll $ 1 уровни насыщения, заданные обеими моделями, практически равны.
Реальное течение эпидемии требует учета характерных особенностей COVID-19, что важно для определения стратегии карантинных мероприятий. Вместо модели SIR-типа, основанной на обыкновенных дифференциальных уравнениях, получено дифференциальное уравнение с запаздыванием, вызванным большой продолжительностью COVID-19.
Данная работа ограничена закрытыми популяциями (страна, регион, город и т.д.). Конечно, между рассматриваемыми популяциями существует постоянный обмен. Однако уже на ранней стадии эпидемии власти используют меры изоляции, чтобы свести такие потоки к минимуму. Точно рассчитать трансграничную передачу инфекции до карантина невозможно. Эту первую стадию эпидемии можно условно назвать свободно текущей эпидемией, когда карантинные меры практически отсутствуют. Анализ влияния потока людей между регионами на эпидемию – отдельная задача, которую можно рассмотреть, в том числе на основе предложенной модели.
Существенно, что полученные результаты позволяют изучить влияние карантинных мероприятий в общем виде через зависящую от времени “функцию внешнего воздействия” путем замены p на функцию времени p(t) по аналогии с дискретной моделью [12], где функции nl(p(l)) находились на основе реальных статистических данных по заболеваемости в ряде стран. Роль различных карантинных мер и количественная оценка их влияния все еще не ясны и обсуждаются. Тем не менее, рассматриваемая модель позволяет найти эту функцию на начальном этапе свободного течения эпидемии обратным расчетом [12] на основе имеющихся дискретных статистических данных [16].
ЗАКЛЮЧЕНИЕ
Результаты таких расчетов с функцией p(t) могут быть использованы для оценки воздействия карантинных мер и вакцинации для отдельных регионов и стран в целом, поскольку известны даты и типы правил административных карантинных ограничений и кампаний вакцинации. Это способ понять эффективность вводимых ограничений. В настоящей работе анализ устойчивости решений ограничен постоянным значением p для оценки того, как насыщение зависит от этой величины.
Также показано и исследовано появление коллективного иммунитета в условиях карантина. Это свойство рассматриваемой детерминированной модели с запаздывающим процессом перехода от подмножества носителей вируса V к подмножеству выздоровевших людей R, которое, как отмечено выше, отличается от известных SIR- и SEIR-моделей, включая и их модификации с запаздыванием [13, 14]. Запаздывание является характерной особенностью COVID-19, хотя в менее выраженной форме может наблюдаться и при иных инфекциях. Показано, как коллективный иммунитет может поддерживаться на низком уровне.
Представленная теория может описать весь эпидемический процесс, в том числе новые волны заражений COVID-19, наблюдаемые в настоящее время, и периодическое изменение баланса между карантинными мерами и снижением карантинных ограничений.
Список литературы
Kermack W.O., McKendrick A.G. A Contribution to the Mathematical Theory of Epidemics // Proc. Royal Soc. A. 1927. V. 115. P. 700. https://doi.org/10.1098/rspa.1927.0118
Brauer F., Castillo-Chavez C. Mathematical Models in Population Biology and Epidemiology. Springer, 2000.
Ball F. Stochastic and Deterministic Models for SIS Epidemics Among a Population Partitioned into Households // Math. Biosci. 1999. V. 156. P. 41.
Bedford J., Farrar J., Ihekweazu C., Kang G., Koopmans M., Nkengasong J. A New Twenty-first Century Science for Effective Epidemic Response // Nature. 2019. V. 575. P. 130.
Frey F., Ziebert F., Schwarz U. Stochastic Dynamics of Nanoparticle and Virus Uptake // Phys. Rev. Lett. 2019. V. 122. P. 088102.
Гринчук П.С., Фисенко С.П. Физическая кинетика и моделирование распространения эпидемий // ИФЖ. 2021. Т. 94. Вып. 1. С. 1.
Шнип А.И. Кинетическая модель динамики эпидемий и ее тестирование на данных распространения эпидемии COVID-19 // ИФЖ. 2021. Т. 94. Вып. 1. С. 9.
Гринчук П.С., Фисенко С.П., Шнип А.И. Математическое моделирование влияния вакцинации на распространение эпидемии COVID-19 // Электронный препринт, апрель 2021. https://doi.org/10.13140/RG.2.2.35536.64004
Rella S.A., Kulikova Y.A., Dermitzakis E.T. et al. Rates of SARS-CoV-2 Transmission and Vaccination Impact the Fate Vaccine-resistant Strains // Sci. Rep. 2021. V. 11. P. 15729.
Murray J.D. Mathematical Biology. N.Y.: Springer, 1993.
Sander L.M., Warren C.P., Sokolov I.M. Epidemics, Disorder, and Percolation // Physica A: Statistical Mechanics and Its Applications. 2003. V. 325. № 1.
Trigger S.A., Czerniawski E.B. Equation for Epidemic Spread with the Quarantine Measures: Application to COVID-19 // Physica Scripta. 2020. V. 95. P. 105 001.
Arino J., van den Driessche P. Time Delays in Epidemic Models. In: Delay Differential Equations and Applications / Eds. Arino O. et al. Springer, 2006. P. 539.
Wanjun Xia1, Soumen Kundu, Sarit Maitra. Dynamics of a Delayed SEIQ Epidemic Model // Advances in Difference Equations. 2018. V. 336.
Weisstein E.W., Lambert W. Function, MathWorld Wolfram Web Resource. http://mathworld.wolfram.com/LambertW-Function.html
Worldometer counter. https://www.worldometers.info/coronavirus/2020
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


