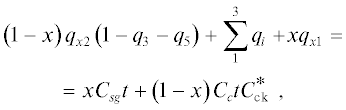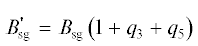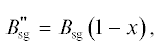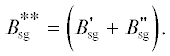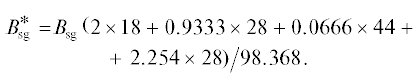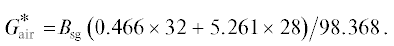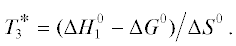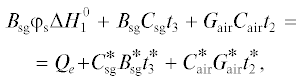Теоретические основы химической технологии, 2019, T. 53, № 1, стр. 78-86
Минитеплоэлектроцентраль на основе реактора для воздушной конверсии метана и электрохимического генератора
А. М. Дубинин 1, С. Е. Щеклеин 1, *
1 Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: s.e.shcheklein@urfu.ru
Поступила в редакцию 25.09.2017
После доработки 16.08.2018
Принята к публикации 19.07.2018
Аннотация
Синтез-газ для электрохимического генератора производится в термохимическом реакторе с автотермической воздушной конверсией метана (природного газа). На основе тепловых балансов реактора, батареи твердооксидных топливных элементов и котла-утилизатора, предназначенного для подогрева первичного, вторичного, катодного воздуха и метана, рассчитаны: температура в аноде, электродвижущая сила топливного элемента, электрический коэффициент полезного действия брутто-электрохимического генератора, доля водорода, окисленного в аноде твердооксидного топливного элемента, удельные расходы метана на производство электрической и тепловой энергии.
ВВЕДЕНИЕ
Современные энергетические технологии, основанные на использовании цикла Ренкина, не позволяют рассчитывать на эффективность процесса существенно выше 30–40% [1]. Принципиальный прогресс может быть достигнут с использованием технологий прямого преобразования энергии с помощью электрохимических элементов [2]. В ряде работ рассматриваются способы использования электрохимических элементов, работающих на водороде, получаемом путем конверсии органического топлива [2, 3], что требует создания промежуточной технологии получения и очистки получаемого водорода, а в ряде случаев и окислителя (кислорода).
В данной работе представлен проект минитеплоэлектроцентрали (МТЭЦ), где прямое преобразование энергии химических реакций окисления в электричество реализуют в топливном элементе, где в качестве окислителя используется воздух, а в качестве топлива – синтез-газ, полученный воздушной конверсией метана (природного газа). Для этих целей наиболее удобными являются высокотемпературные твердоокисные топливные элементы (ТОТЭ), так как они наименее чувствительны к составу используемого топлива и окислителя. В ряде стран мира разработаны и используются топливные элементы планарной или коаксиальной конструкции, из которых формируется батарея электрохимического генератора (ЭХГ), например, с катализаторами из Ni-YSZ в аноде и катоде и электролитом между ними из (ZrO2)0.9(SC2O)0.1 [4, 5].
Представленная в данной работе методика позволяет прогнозировать необходимые параметры ЭХГ: температуру в аноде, электродвижущую силу (ЭДС) планарного элемента, электрический коэффициент полезного действия (КПД) (брутто), долю водорода, окисленного в аноде ТОТЭ при работе ЭХГ на продуктах воздушной конверсии метана без рециркуляции анодных газов, а также удельные расходы топлива на производство электроэнергии и отпуск теплоты в тепловые сети.
ПРИНЦИПИАЛЬНАЯ И ТЕХНОЛОГИЧЕСКАЯ МОДЕЛИ ПРОЦЕССА
Принципиальная схема преобразования природного газа в синтез-газ, получаемый в процессе автотермической воздушной конверсии, для обеспечения работы электрохимического генератора приведена на рисунке.
Основой для производства синтез-газа является термохимический реактор (1) [6]. Схема включает воздуходувку (2), охладитель синтез-газа с 1060 до 725°С (3), механический фильтр для улавливания электрокорунда (4), инвертор и потребитель электрической энергии (5), электрохимический генератор на базе ТОТЭ планарной конструкции для прямого преобразования реакции окисления водорода кислородом воздуха в электрическую энергию (6), котел-утилизатор (7) для нагрева первичного, вторичного, катодного воздуха и природного газа продуктами сгорания, уходящими из ТОТЭ и камеры сгорания реактора, газопровод (8) (Надым–Пунга–Н. Тура–Екатеринбург–Челябинск. Теплота сгорания $Q_{{\text{н }}}^{{\text{р }}}$ = = 49 090 кДж/кг), цеолит NaA для удаления сероводорода из газа (9), сетевой подогреватель для снабжения потребителей горячей водой (10).
В работе [7] рассмотрено более 220 вариантов работы ТОТЭ по двум схемам с рециркуляцией анодных газов и без нее. Сделан вывод о слабом влиянии схемы на эффективность установки. Поэтому далее рассматривается наиболее простой вариант технологической схемы без рециркуляции анодных газов и прямоточном движении горючего и окислителя.
МОДЕЛИРОВАНИЕ ПРОЦЕССОВ В АВТОТЕРМИЧЕСКОМ КАТАЛИТИЧЕСКОМ РЕАКТОРЕ
В реакционном объеме катализатора КСН-2 протекает гетерогенная реакция метана с воздухом при коэффициенте расхода воздуха α = 0.3 (для предотвращения сажеобразования) с образованием синтез-газа по стехиометрическому уравнению
(1)
$\begin{gathered} {\text{С }}{{{\text{H}}}_{4}} + 0.3\left( {2{{{\text{O}}}_{2}} + 7.52{{{\text{N}}}_{2}}} \right) = \\ = \,\,0.0666{\text{C}}{{{\text{O}}}_{2}} + 0.1334{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,0.9333{\text{CO}} + 1.866{{{\text{H}}}_{{\text{2}}}} + 2.256{{{\text{N}}}_{2}} \\ \end{gathered} $с экзотермическим эффектом qx1 = –884 кДж на 1 кг синтез-газа. Состав синтез-газа: ${{r}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ = 1.27; ${{r}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ = = 2.54; rCO =17.76; ${{r}_{{{{{\text{H}}}_{2}}}}}$ = 35.5; ${{r}_{{{{{\text{N}}}_{2}}}}}$ = 42.93 об. %.
На входе метана 16 кг, воздуха 82.368 кг. На выходе синтез-газа 98.368 кг. Теплоты экзотермической реакции (1) достаточно для нагрева продуктов реакции только до 494°С (по тепловому балансу реакции). Поэтому в псевдоожиженном слое дисперсного промежуточного теплоносителя (электрокорунда размером 0.32 мм) организована камера для сжигания части синтез-газа. Сжигание происходит с коэффициентом избытка воздуха α = = 1.25 по стехиометрическому уравнению
(2)
$\begin{gathered} 0.0666{\text{C}}{{{\text{O}}}_{2}} + 0.1334{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 0.9333{\text{CO}} + \\ + \,\,1.866{{{\text{H}}}_{2}} + 2.256{{{\text{N}}}_{2}} + 1.25(1.4{{{\text{О }}}_{2}} + 5.264{{{\text{N}}}_{2}}) = \\ = \,\,{\text{С }}{{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 0.35{{{\text{O}}}_{2}} + {\text{ }}8.836{{{\text{N}}}_{2}}. \\ \end{gathered} $Состав продуктов сгорания: ${{r}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ = 8.2; ${{r}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ = = 16.4; ${{r}_{{{{{\text{O}}}_{2}}}}}$ = 2.9; ${{r}_{{{{{\text{N}}}_{2}}}}}$ = 72.5 об. %. Экзотермический эффект реакции (2) qx2 = –7282 кДж на 1 кг синтез-газа.
Масса воздуха на входе [уравнение (2)] 240.24 кг, продуктов окисления 338.608 кг. Кроме этого, в реактор вводится нагретый до t1 = 200°C в котле-утилизаторе первичный, вторичный воздух и метан. Теплота, вносимая первичным воздухом, составляет Qair1 = (82.368/98.368)Cairt1 кДж на 1 кг синтез-газа.
Теплота, вносимая вторичным воздухом, равна qair2 = (240.24/98.368)Cairt1(1 – x), кДж на 1 кг воздуха. Теплота, вносимая метаном, составляет qм = (16/98.368)Cмt1 кДж на 1 кг метана, где Cair и Cм – истинные удельные изобарные теплоемкости воздуха и метана при температуре t1 = 200°С равны 1.024 и 2.806 кДж/(кг К) соответственно.
Уравнение теплового баланса реактора для воздушной конверсии метана:
где q3 и q5 – относительные потери с химическим недожогом (0.05) и в окружающую среду через тепловую изоляцию реактора (0.15); $\sum\limits_1^3 {{{q}_{i}}} $ = = ${{q}_{{{\text{в }}1}}} + {{q}_{{{\text{в }}2}}} + {{q}_{{\text{м }}}} = 751\quad$ кДж/кг синтез-газа; Csg и Cс – истинные удельные изобарные теплоемкости синтез-газа и продуктов сгорания при температуре на выходе из реактора, $C_{{{\text{ck}}}}^{*}$ = 338.608/98.368 = = 3.44 – корректирующий коэффициент перевода удельной теплоемкости продуктов сгорания (Cс) из кДж/кг продуктов сгорания в кДж/кг синтез-газа, x – доля синтез-газа, полезно отводимого из реактора; $\quad\left( {1 - x} \right)\quad$ окисленного в камере сгорания реактора.Подстановка в уравнение (3) доли x = 0.9 дает температуру 1060°C; Csg = 1.718 кДж/(кг К); Cс = = 1.35 кДж/(кг К).
В левой части уравнения (3) приход теплоты от сгорания части синтез-газа $\left( {1 - x} \right){{q}_{{x2}}}\left( {1 - {{q}_{3}} - {{q}_{5}}} \right)$ с учетом потерь от химического недожога и в окружающую среду, от нагретого в котле-утилизаторе первичного, вторичного воздуха и метана $\sum\limits_1^3 {{{q}_{i}}} ,\quad$ от экзотермической реакции (1) xqx1, в правой – расход теплоты на подогрев продуктов сгорания $\left( {1 - x} \right){{C}_{{\text{с }}}}tC_{{{\text{ck}}}}^{*}$ и подогрев продуктов конверсии $x{{C}_{{{\text{sg}}}}}t.$
Для производства ${{Q}_{{\text{e}}}}$ = 10 кВт электрической энергии в ЭХГ, работающем на синтез-газе с теплотой сгорания qх2 = 7282 кДж на 1 кг синтез-газа с электрическим КПД η = 50% [8], по предварительному расчету потребуется синтез-газа
(4)
${{B}_{{{\text{sg}}}}} = {{{{Q}_{{\text{e}}}}} \mathord{\left/ {\vphantom {{{{Q}_{{\text{e}}}}} {({{q}_{{x2}}}{\eta })}}} \right. \kern-0em} {({{q}_{{x2}}}{\eta })}}.$Кроме этого, с учетом компенсации тепловых потерь в реакторе с химическим недожогом и в окружающую среду
и нагревом продуктов конверсии и сгорания
в реакторе должно образовываться синтез-газа
Для производства такого количества синтез-газа в реактор следует подать:
метана
первичного воздуха
вторичного воздуха
(10)
$\quad{{G}_{{{\text{air}}2}}} = {{G}_{{\text{м }}}}{\;}\frac{{240.24}}{{16}}\left( {1 - x} \right).$Из реактора следует вывести:
продуктов сгорания
(11)
$\quad{{G}_{{\text{c}}}} = {{G}_{{\text{м }}}}{\;}\frac{{338.608}}{{16}}\left( {1 - x} \right),$синтез-газа ${{B}_{{{\text{sg}}}}}.$
Материальный баланс сходится. Химический КПД реактора:
МОДЕЛИРОВАНИЕ ПРОЦЕССОВ В ЭЛЕКТРОХИМИЧЕСКОМ ГЕНЕРАТОРЕ
Определение характеристик продуктов окисления водорода. Согласно [9] доля в ЭДС от реакции окисления СО в аноде ТОТЭ составляет менее 1% от доли окисления водорода и в расчетах ею пренебрегают. В аноде ТОТЭ окисляется только водород. Реакция водяного газа CO + Н2О $ \rightleftarrows $ CO2 + Н2 не может быть донором водорода, поскольку она протекает только на железохромовом катализаторе [10], которого в анодном канале нет.
В аноде ТОТЭ окисление водорода из синтез-газа кислородом, приходящим из электролита, описывается стехиометрическим уравнением (в предположении, что весь водород окислился)
(13)
$\begin{gathered} 0.0666{\text{C}}{{{\text{O}}}_{2}} + 0.1334{{{\text{H}}}_{{\text{2}}}}{\text{О }} + 0.9333{\text{С О }} + 1.866{{{\text{Н }}}_{2}} + \\ + \,\,2.256{{{\text{N}}}_{2}} + 0.9345{{{\text{О }}}_{2}} = 2{{{\text{Н }}}_{{\text{2}}}}{\text{О }} + \\ + \,\,0.9333{\text{С О }} + 0.0666{\text{С }}{{{\text{О }}}_{2}} + 2.256{{{\text{N}}}_{2}} \\ \end{gathered} $с экзотермическим эффектом $\Delta H_{1}^{0} = - 4588$ кДж/кг синтез-газа.
Масса синтез-газа на выходе из анодного канала 128.35 кг. Состав синтез-газа на выходе из анодного канала: $\quad{{r}_{{{\text{CO}}\quad}}}$ = 17.76; ${{r}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ = 1.27; ${{r}_{{{{{\text{N}}}_{2}}}}}$ = 42.97; ${{r}_{{{{{\text{H}}}_{2}}{\text{O}}\quad}}}$ = 38 (об. %).
Расход синтез-газа на выходе из анодного канала:
Расход обедненного кислородом воздуха на выходе из катодного канала:
Изменение энтропии реакции (13) $\Delta {{S}^{0}}$ = = –0.835 кДж/кг синтез-газа. Убыль энергии Гиббса для реакции (13) при стандартных параметрах $\Delta {{G}^{0}}$ = −5505 кДж/кг синтез-газа. Температура в аноде на основании [11]
Результат удовлетворительно согласуется с данными работы [8]. ЭДС одного планарного элемента при $T_{3}^{*}$ = 1098 K [11]:
(17)
$\quad{{E}_{e}} = {{ - \Delta G} \mathord{\left/ {\vphantom {{ - \Delta G} {2F}}} \right. \kern-0em} {2F}},$Истинная удельная теплоемкость синтез-газа на выходе из анодного канала при $t_{3}^{*}$ = 825°С $C_{{{\text{sg}}}}^{*}$ = = 1.51 кДж/К на 1 кг синтез-газа, а воздуха на выходе из катодного канала при $t_{2}^{*}$ = 725°С, $C_{{{\text{air}}}}^{*}$ = = 1.135 кДж/К на 1 кг синтез-газа.
Топливные элементы обычно работают при изобарно-изотермических условиях. Работа в изобарно-изотермическом процессе равна убыли свободной энергии Гиббса [11], а электрическая мощность равна убыли свободной энергии Гиббса $\Delta G{\text{*}}$ кДж/кг синтез-газа при температуре 1098 К, умноженной на расход синтез-газа Bsg:
(18)
$\Delta {{G}^{*}} = 1.866{{\Delta G} \mathord{\left/ {\vphantom {{\Delta G} {98.368}}} \right. \kern-0em} {98.368}},$С другой стороны, электрическая мощность равна [8]
Приравнивая эти выражения, определяем электрический КПД (брутто):
(20)
$\eta = {{{{Q}_{e}}} \mathord{\left/ {\vphantom {{{{Q}_{e}}} {({{В }_{{sg}}}{{q}_{{x1}}})}}} \right. \kern-0em} {({{В }_{{sg}}}{{q}_{{x1}}})}}.$Результат удовлетворительно согласуется с данными работы [9].
Рис. 1.
Принципиальная схема ТЭЦ на основе автотермического реактора для воздушной конверсии метана и ЭХГ: 1 – термохимический реактор; 2 – воздуходувка; 3 – охладитель синтез-газа; 4 – механический фильтр; 5 – приемник электрической энергии; 6 – ЭХГ на базе ТОТЭ; 7 – котел- утилизатор; 8 – ввод природного газа; 9 – фильтр на базе цеолита (NaA); 10 – сетевой подогреватель; 11 – датчики расхода; 12 – датчики температуры; I – ввод метана; II – ввод воздуха; III – вывод электроэнергии; IV – вывод уходящих газов.
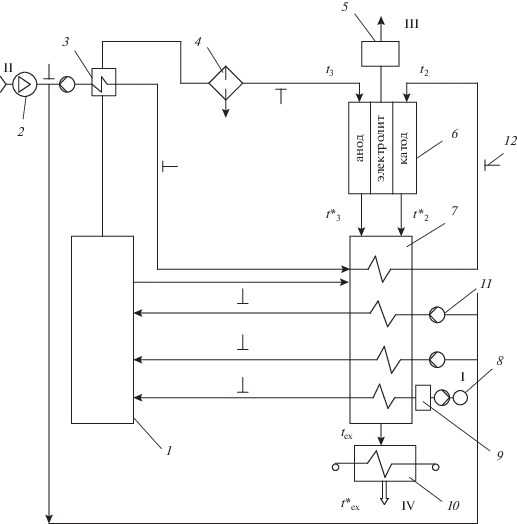
Процесс в электрохимической части энергетической установки. Необходимый для полного окисления синтез-газа расход воздуха, поступающего в катодный канал, определяется из стехиометрического уравнения
(21)
$\begin{gathered} 1.334{{{\text{Н }}}_{{\text{2}}}}{\text{О }} + 0.9333{\text{С О }} + 0.0666{\text{С }}{{{\text{О }}}_{2}} + \\ + \,\,1.866{{{\text{Н }}}_{2}} + 1.4{{{\text{О }}}_{2}} + 5.264{{{\text{N}}}_{2}} = \\ = \,\,2{{{\text{Н }}}_{{\text{2}}}}{\text{О }} + {\text{С }}{{{\text{О }}}_{2}} + 7.52{{{\text{N}}}_{2}},\quad \\ \end{gathered} $(22)
$\quad{{G}_{{{\text{air}}}}} = {{В }_{{{\text{sg}}}}}(1.4 \times 32 + 5.246 \times {{28)} \mathord{\left/ {\vphantom {{28)} {98.638}}} \right. \kern-0em} {98.638}}.$Истинная удельная теплоемкость воздуха на входе в катодный канал при t2 = 625°С, ${{C}_{{{\text{air}}}}}$ = = 1.122 кДж/(К кг воздуха).
Уравнение сохранения мощности батареи ТОТЭ. Мощность, выделенная при окислении водорода в аноде ТОТЭ, ${{В }_{{{\text{sg}}}}}{{\varphi }_{{\text{s}}}}\Delta H_{1}^{0},$ внесенная синтез-газом ${{В }_{{{\text{sg}}}}}{{С }_{{{\text{sg}}}}}{{t}_{3}},$ выходящим из охладителя (см. рисунок), и воздухом, поступающим из котла-утилизатора в ТОТЭ, ${{G}_{{{\text{air}}}}}{{С }_{{{\text{air}}}}}{{t}_{2}},$ равна электрической мощности, отводимой от ЭХГ, Qe, частично окисленным синтез-газом, выходящим из анодного канала, $C_{{{\text{sg}}}}^{*}В _{{{\text{sg}}}}^{*}t_{3}^{*},$ и воздухом, выходящим из катодного канала, $C_{{{\text{air}}}}^{*}G_{{{\text{air}}}}^{*}t_{2}^{*}\,:$
где ${{{\varphi }}_{{\text{s}}}}$ – доля окисленного водорода в аноде ТОТЭ; Csg – удельная истинная теплоемкость синтез-газа при постоянном давлении, равная 1.73 кДж/К на 1 кг синтез-газа при температуре ${{t}_{3}}\quad$ = 725°С; ${{t}_{3}}\quad$ – температура синтез-газа на входе в анодный канал. Температура воздуха на выходе из катодного канала $t_{2}^{*}$ принимается на 100оС меньше $t_{3}^{*}$ для охлаждения катода, т.е. $t_{2}^{*}$ = 825 – 100 = 725°С, а t2 принимается на 100°С меньше ${{t}_{3}},$ т.е. 725 – 100 = 625°С. Из уравнения (23) определяем ${{{\varphi }}_{{\text{s}}}}\,:$(24)
$\begin{gathered} {{\varphi }_{{\text{s}}}} = ({{Q}_{{\text{e}}}} + C_{{{\text{sg}}}}^{*}B_{{{\text{sg}}}}^{*}t_{3}^{*} + C_{{{\text{air}}}}^{*}G_{{{\text{air}}}}^{*}t_{2}^{*} - \\ - \,\,{{G}_{{{\text{air}}}}}{{С }_{{{\text{air}}}}}{{t}_{2}} - {{{{B}_{{{\text{sg}}}}}{{C}_{{{\text{sg}}}}}{{t}_{3}})} \mathord{\left/ {\vphantom {{{{B}_{{{\text{sg}}}}}{{C}_{{{\text{sg}}}}}{{t}_{3}})} {({{B}_{{{\text{sg}}}}}\Delta H_{1}^{0})}}} \right. \kern-0em} {({{B}_{{{\text{sg}}}}}\Delta H_{1}^{0})}}. \\ \end{gathered} $Подстановка в уравнение (24) использованных ранее величин дает значение ${{{\varphi }}_{{\text{s}}}}$ = 0.85 (85%) (см. табл. 1).
Величина доли окисленного водорода в аноде удовлетворительно согласуется с опубликованными данными [8].
МОДЕЛИРОВАНИЕ ПРОЦЕССОВ В КОТЛЕ-УТИЛИЗАТОРЕ
Процессы в котле-утилизаторе (КУ). В КУ окисляется выходящий из анодного канала оксид углерода воздухом, обедненным кислородом, выходящим из катодного канала, по стехиометрическому уравнению
(25)
$\begin{gathered} 2{{{\text{H}}}_{2}}{\text{О }} + 0.9333{\text{С О }} + 0.0666{\text{С }}{{{\text{О }}}_{2}} + 0.466{{{\text{О }}}_{2}} + \\ + \,\,2.256{{{\text{N}}}_{2}} + 5.264{{{\text{N}}}_{2}} = 2{{{\text{Н }}}_{{\text{2}}}}{\text{О }} + {\text{С }}{{{\text{О }}}_{2}} + 7.52{{{\text{N}}}_{2}} \\ \end{gathered} $и окисление недоокисленного водорода в анодном канале с выделением мощности $\left( {1 - {{{\varphi }}_{{\text{s}}}}} \right)\Delta H_{1}^{0}{{B}_{{{\text{sg}}}}}.$
Экзотермический эффект реакции (25) $\Delta H_{2}^{0}$ = = –2694 кДж/кг синтез-газа.
Баланс мощности котла-утилизатора. Мощность, приходящая с продуктами окисления водорода из анодного канала $C_{{{\text{sg}}}}^{*}B_{{{\text{sg}}}}^{*}t_{3}^{*},$ с воздухом из катодного канала $C_{{{\text{air}}}}^{*}G_{{{\text{air}}}}^{*}t_{2}^{*},$ выделившаяся при окислении не окисленного в аноде ТОТЭ водорода $\left( {1 - {{\varphi }_{{\text{s}}}}} \right)\Delta H_{1}^{0}{{B}_{{{\text{sg}}}}},$ а также от окисления в анодном газе оксида углерода $\Delta H_{2}^{0}{{B}_{{{\text{sg}}}}},$ поступающих в КУ с продуктами, приходящими из камеры сгорания реактора ${{G}_{{\text{с }}}}{{C}_{{\text{с }}}}t,$ с воздухом, приходящим из охладителя синтез-газа ${{G}_{{{\text{air}}}}}{{C}_{{{\text{air}}}}}t_{{{\text{air}}}}^{*},$ с воздухом для камеры сгорания реактора ${{G}_{{{\text{air}}}}}_{2}{{C}_{{{\text{air}}}}}{{t}_{{{\text{air}}}}},$ с воздухом для конверсии метана ${{G}_{{{\text{air}}}}}_{1}{{C}_{{{\text{air}}}}}{{t}_{{{\text{air}}}}},$ с метаном для реактора ${{G}_{{\text{м }}}}{{C}_{{\text{м }}}}{{t}_{{\text{м }}}},$ затрачивается на нагрев катодного воздуха ${{G}_{{{\text{air}}}}}{{C}_{{{\text{air}}}}}{{t}_{2}},$ воздуха для конверсии метана ${{G}_{{{\text{ai}}{{{\text{r}}}_{1}}}}}{{C}_{{{\text{air}}}}}{{t}_{1}},$ воздуха для камеры сгорания реактора ${{G}_{{{\text{ai}}{{{\text{r}}}_{2}}}}}{{C}_{{{\text{air}}}}}{{t}_{1}},$ метана для реактора ${{G}_{{{\text{м }}\quad}}}\quadС _{{\text{м }}}^{*}{{t}_{1}}$ и на нагрев уходящих продуктов сгорания из КУ ${{G}_{{{\text{ex}}}}}{{C}_{{{\text{ex}}}}}{{t}_{{{\text{ex}}}}}$ (${{t}_{{{\text{air}}}}}$ = 20°С, tм = 20°С, Gex = 9.873 × 10–3 кг/с, ${{C}_{{{\text{ex}}}}}$ = = 1.49 кДж/(К кг), $t_{{{\text{air}}}}^{*}$ = 360°С (получена из уравнения теплового баланса охладителя (3) (см. рисунок):
(26)
$\begin{gathered} C_{{{\text{sg}}}}^{*}B_{{{\text{sg}}}}^{*}t_{3}^{*} + C_{{{\text{air}}}}^{*}G_{{{\text{air}}}}^{*}t_{2}^{*} + \left( {1 - {{{\varphi }}_{{\text{s}}}}} \right)\Delta H_{1}^{0}{{B}_{{{\text{sg}}}}} + \\ + \,\,\Delta H_{2}^{0}{{B}_{{{\text{sg}}}}} + {{G}_{{\text{с }}}}{{C}_{{\text{с }}}}t = {{G}_{{{\text{air}}}}}{{C}_{{{\text{air}}}}}({{t}_{2}} - t_{{{\text{air}}}}^{*}) + \\ + \,\,{{G}_{{{\text{ai}}{{{\text{r}}}_{1}}\quad}}}{{С }_{{{\text{air}}}}}({{t}_{1}} - \quad{{t}_{{{\text{air}}}}}) + {{G}_{{{\text{ai}}{{{\text{r}}}_{2}}\quad}}}{{С }_{{{\text{air}}}}}({{t}_{1}} - \quad{{t}_{{{\text{air}}}}}) + \\ + \,\,{{G}_{{\text{м }}}}(C_{{\text{м }}}^{*}{{t}_{1}} - \quad{{C}_{{\text{м }}}}{{t}_{{\text{м }}}}) + {{G}_{{{\text{ex}}}}}{{C}_{{{\text{ex}}}}}{{t}_{{{\text{ex}}}}}. \\ \end{gathered} $Подстановка в уравнение (26) ранее использованных величин дает значение ${{t}_{{{\text{ex}}}}}$ = 1174°С (см. табл. 1).
Таблица 1.
Результаты расчетов для номинального режима работы на мощности 9.77 кВт
| Характеристика | Обозна-чение | Размерность | Фор-мула | Расчетное выражение | Значение |
|---|---|---|---|---|---|
| Расход синтез-газа | ${{B}_{{{\text{sg}}}}}$ | кг/с | (4) | 10/(7282 × 0.5) | 2.75 × 10–3 |
| Расход синтез-газа для компенсации потерь | 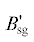 |
кг/с | (5) | 2.75 × 10–3(1 + 0.05 + 0.15) | 3.3 × 10–3 |
| Расход синтез-газа для нагрева продуктов конверсии, сгорания и метана | 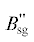 |
кг/с | (6) | 2.75 × 10–3(1 – 0.9) | 0.275 × 10–3 |
| Общий расход синтез-газа | 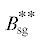 |
кг/с | (7) | (3.3 + 0.275) × 10–3 | 3.575 × 10–3 |
| Расход метана в реактор | Gм | кг/с | (8) | 3.575 × 10–3(16/98.368) | 0.58 × 10–3 |
| Расход первичного воздуха | ${{G}_{{{\text{air}}1}}}$ | кг/с | (9) | 0.58 × 10–3(82.368/16) | 2.98 × 10–3 |
| Расход вторичного воздуха | ${{{\text{G}}}_{{{\text{air}}2}}}$ | кг/с | (10) | 0.58 × 10–3 × 240.24(1 – 0.9)/16 | 0.87 × 10–3 |
| Выход продуктов сгорания из реактора | Gс | кг/с | (11) | 0.58 × 10–3 × 338.608(1 – 0.9)/16 | 1.23 × 10–3 |
| Химический КПД реактора | ${{{\eta }}_{{{\text{ch}}}}}$ | % | (12) | 2.75 × 10–3 × 7282 × 100/(0.58 × 10–3 × × 49090) | 70 |
| Расход синтез-газа на выходе из анодного канала | 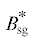 |
кг/с | (14 | 2.75 × 10–3 (128.1744/98.368) | 3.586 × 10–3 |
| Расход воздуха на выходе из катодного канала | $G_{{{\text{air}}}}^{*}$ | кг/с | (15) | 2.75 × 10– 3(162.18/98.368) | 4.537 × 10–3 |
| Температура продуктов окисления водорода в аноде | $T_{3}^{*}$ | К | (16) | (–4588 + 5505)/(–0.835) | 1098 |
| ЭДС одного планарного элемента (при 1098 К) | Ee | В | (17) | 187 000/(2 × 9.648 × 104) | 0.969 |
| Убыль свободной энергии Гиббса | ΔG* | кДж/кг | (18) | (1.866 × 187 000)/98.368 | 3551 |
| Электрическая мощность ЭХГ | Qe | кВт | (19) | 3551 × 2.75 × 10–3 | 9.77 |
| Электрический КПД (брутто) ЭХГ | ${\eta }$ | % | (20) | 9.77/(2.75 × 10–3 × 7282) | 48.8 |
| Расход воздуха в катодный канал | ${{G}_{{{\text{air}}}}}$ | кг/с | (22) | 2.75 × 10–3(1.4 × 32 + 5.246 × 28)/98.368 | 5.373 × 10–3 |
| Доля окисленного в аноде водорода | ${{{\varphi }}_{{\text{s}}}}$ | % | (24) | (9.77 + 1.51 × 3.586 × 10–3 × 825 + 1.135 × × 4.537 × 10–3 × 725–5.373 × 10–3 × 1.122 × × 625 –2.75 × 10–3 × 1.73 × 725)/( 2.75 × 10–3 × × 4588) | 85 |
| Температура уходящих из котла-утилизатора газов | ${{t}_{{{\text{ex}}}}}$ | oC | (26) | [1.51 × 3.586 × 10–3 × 825 + 1.135 × 4.537 × × 10–3 × 725 + (1 – 0.85) × 4588 × 2.75 × × 10–3 + 2694 × 2.75 × 10–3 + 1.75 × 10–3 × × 1.135 × 1060 –5.73 × 10–3 × 1.122(625 – 360) – – 3.05 × 10–3 × 1.024 × (200 – 20)– 0.87 × × 10–3 × 1.024 (200 – 20) – 0.58 × 10–3 × × (3.529 × 200 – 2.165 × 20)]/(9.873 × 10–3 × × 1.49) | 1174 |
| Мощность сетевого подогревателя | Qnh | кВт | (27) | 9.873 × 10–3 × 1.49(1174–120) | 15.5 |
| Коэффициент использования топлива на ТЭЦ | ${{{\eta }}_{{{\text{ut}}}}}$ | (%) | (28) | (9.77+ 15.5)/(0.58 × 10–3 × 49 090) | 0.89 |
| Абсолютный расход натурального топлива на выработку электроэнергии | Be | кг н.т./ч | (29) | 9.77 × 1 × 3600/(0.89 × 49 090) | 0.8 |
| Удельный расход условного топлива на выработку электроэнергии | Be | кг у.т./(кВт ч) | (30) | 0.8 × 49 090/( 9.77 × 29 330) | 0.137 |
| Абсолютный расход натурального топлива на выработку тепловой энергии | Bh | кг н.т./ч | (31) | 15.5 × 1 × 3600/(0.89 × 49 090) | 1.27 |
| Удельный расход условного топлива на выработку тепловой энергии | Bh | кг у.т./ГДж | (32) | 1.27 × 106 × 49 090/(15.5 × 1 × 3600 × 29 330) | 38 |
| Расход топлива на тепловые потери за сетевым подогревателем | ΔGм | кг н.т./с | (33) | 0.58 × 10–3 – (0.8 + 1.27)/3600 | 0.005 × 10–3 |
Предполагается, что батарея ТОТЭ и котел-утилизатор идеально теплоизолированы, а химический недожог в котле-утилизаторе равен нулю. Массовый расход на входе в реактор 9.87 кг/с, на выходе из котла-утилизатора 9.87 кг/с.
Мощность сетевого подогревателя для нагрева сетевой воды на нужды горячего водоснабжения теплопотребителей:
(27)
$\quad{{Q}_{{{\text{nh}}}}} = {{G}_{{{\text{ex}}}}}{{C}_{{{\text{ex}}}}}({{t}_{{{\text{ex}}}}} - t_{{{\text{ex}}}}^{*})\quad,$ЭНЕРГЕТИЧЕСКИЕ ПОКАЗАТЕЛИ МТЭЦ
Коэффициент использования энергии метана:
(28)
${{{\eta }}_{{{\text{ut}}}}} = {{({{Q}_{{\text{e}}}} + {{Q}_{{{\text{nh}}}}})} \mathord{\left/ {\vphantom {{({{Q}_{{\text{e}}}} + {{Q}_{{{\text{nh}}}}})} {(Q_{{{\text{low}}}}^{{\text{r}}}{{G}_{{\text{м }}}})}}} \right. \kern-0em} {(Q_{{{\text{low}}}}^{{\text{r}}}{{G}_{{\text{м }}}})}}.$Разделение расхода топлива между производством электрической и тепловой энергии.
Абсолютный расход натурального топлива на производство электрической энергии:
(29)
$\quad{{B}_{{\text{e}}}} = {{Q}_{{\text{e}}}} \times 1 \times {{3600} \mathord{\left/ {\vphantom {{3600} {(Q_{{{\text{low}}}}^{{\text{r}}}{{{\eta }}_{{{\text{ut}}}}})}}} \right. \kern-0em} {(Q_{{{\text{low}}}}^{{\text{r}}}{{{\eta }}_{{{\text{ut}}}}})}}.$Удельный расход условного топлива на производство электрической энергии:
(30)
${{b}_{{\text{e}}}} = {{{{B}_{{\text{e}}}}Q_{{{\text{low}}}}^{{\text{r}}}} \mathord{\left/ {\vphantom {{{{B}_{{\text{e}}}}Q_{{{\text{low}}}}^{{\text{r}}}} {({{Q}_{{\text{e}}}}{{Q}_{{{\text{r}}.{\text{f}}.}}})}}} \right. \kern-0em} {({{Q}_{{\text{e}}}}{{Q}_{{{\text{r}}.{\text{f}}.}}})}}.$Абсолютный расход топлива на производство тепловой энергии:
(31)
$\quad{{B}_{{\text{h}}}} = {{Q}_{{{\text{nh}}}}} \times 1 \times {{3600} \mathord{\left/ {\vphantom {{3600} {(Q_{{{\text{low}}}}^{{\text{r}}}{{{\eta }}_{{{\text{ut}}}}})}}} \right. \kern-0em} {(Q_{{{\text{low}}}}^{{\text{r}}}{{{\eta }}_{{{\text{ut}}}}})}}.$Удельный расход условного топлива на производство тепловой энергии:
(32)
$\quad{{b}_{{\text{h}}}} = {{B}_{{\text{h}}}} \times {{10}^{6}} \times {{Q_{{{\text{low}}}}^{{\text{r}}}} \mathord{\left/ {\vphantom {{Q_{{{\text{low}}}}^{{\text{r}}}} {({{Q}_{{{\text{nh}}}}}}}} \right. \kern-0em} {({{Q}_{{{\text{nh}}}}}}} \times 1 \times 3600 \times {{Q}_{{{\text{r}}.{\text{f}}.}}}).$Остальной расход топлива
(33)
$\quad\Delta {{G}_{{\text{м }}}} = {{G}_{{\text{м }}}} - {{\left( {{{B}_{{\text{e}}}} + {{B}_{{\text{h}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{B}_{{\text{e}}}} + {{B}_{{\text{h}}}}} \right)} {3600}}} \right. \kern-0em} {3600}}$тратится на тепловые потери с уходящими газами после сетевых подогревателей.
Результаты численных расчетов сведены в таблицу.
ЗАКЛЮЧЕНИЕ
Показана принципиальная возможность применения автотермического реактора с заторможенным псевдоожиженным слоем электрокорунда для производства синтез-газа воздушной конверсией природного газа, используемого для работы электрохимического генератора на базе ТОТЭ.
Расчетные исследования показали, что температура продуктов окисления водорода на выходе из анода ТОТЭ 825°С, электрический КПД (брутто) ЭХГ 48.8%, ЭДС топливного элемента ${{E}_{{\text{e}}}}$ = = 0.969 В, доля водорода, окисленного в аноде ТОТЭ 85%. Полученные результаты удовлетворительно согласуются с литературными данными.
Удельный расход условного топлива в МТЭЦ на производство электрической энергии 0.137 кг у.т./(кВт ч) и на производство тепловой энергии 38 кг у.т./ГДж, что превосходит уровень современных ТЭЦ с циклом Ренкина.
ОБОЗНАЧЕНИЯ
| B | абсолютный расход натурального топлива, кг/с |
| b | удельный расход топлива, кг/(кВт ч) или кг/ГДж |
| C | удельная истинная массовая изобарная теплоемкость, кДж/(К кг) |
| F | число Фарадея, Кл/моль |
| G | расход реагентов, кг/с |
| ${\Delta }{{G}^{{\text{o}}}}$ | приращение энергии Гиббса при стандартных условиях для реакции окисления водорода, кДж/кг |
| $\quad\Delta H_{1}^{0}$ | теплота окисления водорода в синтез-газе, кДж/кг синтез-газа |
| $\Delta H_{2}^{0}$ | теплота окисления оксида углерода и метана в синтез-газе, кДж/кг синтез-газа |
| h | энтальпия, кДж/кг |
| ${{Q}_{{\text{e}}}}$ | электрическая мощность ЭХГ, кВт |
| ${{q}_{{x1}}},{{q}_{{x2}}}$ | экзотермический эффект соответственно реакций (1) и (2), кДж/кг |
| ${{q}_{3}},\quad{{q}_{5}}$ | потери теплоты с химическим недожогом и в окружающую среду, кДж/кДж |
| q | удельная теплота, кДж/кг |
| ri | объемная доля компонента в газовой смеси, м3/м3 |
| ${\Delta }S^\circ $ | изменение энтропии при стандартных условиях, кДж/кг |
| T | температура, К |
| t | температура, °С |
| $x$ | доля полезно отводимого синтез-газа из реактора |
| α | коэффициент (расхода) избытка воздуха |
| η | коэффициент полезного действия |
| ηut | коэффициент использования топлива на ТЭЦ |
| φ | объемная доля водорода |
ИНДЕКСЫ
| air | воздух |
| с | продукты сгорания |
| ch | химический |
| e | электрическая энергия |
| ex | уходящие газы |
| h | тепловая энергия |
| low | нижний |
| nh | сетевой подогреватель |
| sg | синтез-газ |
| х1 | для реакции по уравнению (1) |
| х2 | для реакции по уравнению (2) |
| * | на выходе из анодного и катодного каналов |
| ° | при стандартных условиях |
Список литературы
Дэвинс Д. Энергия. М.: Энергоатомиздат, 1985.
Longwell J.P., Rubin E.S., Wilson J. Coal: Energy for the Future // Progress in Energy and Combustion Sci. 1995. V. 21. № 4. P. 269.
Dubinin A.M., Tuponogov V.G., Ikonnikov I.C. Modeling the process of producing hydrogen from methane // Theor. Found. Chem. Eng. 2013. V. 47. № 6. P. 697. [Дубинин А.М., Тупоногов В.Г., Иконников И.С. Моделирование процесса производства водорода из метана // Теорет. основы хим. технологии. 2013. Т. 47. № 6. С. 634.]
Takeguchi T., Kani Y., Yano T., Kikuchi R. et al. Study on steam reforming of CH4 and C2 hydrocarbons and carbon deposition on Ni-YSZ cermets // J. Power Sources. 2012. V. 112. P. 588.
Halinen M., Thomann O., Kiviaho I. Effect of anode off-gas recycling on reforming of natural gas for solid oxide fuel cell system // Fuel Cells. 2012. V. 12. № 5. P. 754.
Дубинин А.М., Щеклеин С.Е., Тупоногов В.Г., Лабинцев Е.С. Автотермическая воздушная конверсия метана // Альтернативная энергетика и экология. 2016. № 15–18. С. 86.
Peters R., Deja R., Blum L., Pennanen J., Kiviaho J., Hakala T. Analysis of Solid-Oxide Fuel Cell System Concepts with Anode Recycling // Int. J. Hydrogen Energy. 2013. V. 38. P. 6809.
Munts V.A., Volkova Yu.V., Plotnikov N.S., Dubinin A.M., Tuponogov V.G., Chernyshev V.A. Studying the characteristics of a 5kW power installation on solid-oxide fuel cells with steam reforming of natural gas // Therm. Eng. 2015. V. 62. № 11. P. 779. [Мунц В.А., Волкова Ю.В., Плотников Н.С., Тупоногов В.Г., Чернышев В.А. Исследование характеристик энергетической установки 5 кВт на твердоокисных топливных элементах с паровым риформингом природного газа // Теплоэнергетика. 2015. № 11. С. 15.]
Коровин Н.А. Топливные элементы и электрохимические энергоустановки. М.: Изд-во МЭИ, 2005.
Баскаков А.П., Дубинин А.М., Тупоногов В.Г., Филиппов Д.В. О механизме паровой газификации угля // Промышленная энергетика. 2008. № 4. С. 40.
Баскаков А.П., Волкова Ю.В. Физико-химические основы тепловых процессов. М.: Теплотехник, 2013.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии