Теоретические основы химической технологии, 2019, T. 53, № 1, стр. 3-14
Технология периодической реакционной дистилляции на примере получения бромдифторуксусной кислоты
Е. В. Лупачев 1, *, А. В. Полковниченко 1, 2, С. Я. Квашнин 1, В. А. Лотхов 1, Н. Н. Кулов 1, **
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 МИРЭА – Российский технологический университет (Институт тонких химических технологий)
Москва, Россия
* E-mail: egorlu91@gmail.com
** E-mail: kulov@igic.ras.ru
Поступила в редакцию 01.10.2018
После доработки 04.10.2018
Принята к публикации 03.10.2018
Аннотация
Проведено экспериментальное исследование процесса каталитической дистилляции с реакцией в кубе колонны при переэтерификации метилового и этилового эфиров бромдифторуксусной кислоты трифторуксусной кислотой. В качестве катализатора использовали серную кислоту. Эксперименты проводили при различных нагрузках на куб колонны. По результатам экспериментов получена бромдифторуксусная кислота чистотой выше 97.0 мол. %, выход по продукту составил 87.4%.
ВВЕДЕНИЕ
Фторорганические соединения редко встречаются в природе, а перфторированные не встречаются вовсе и являются исключительно продуктами синтеза. Область их применения на сегодняшний день весьма широка [1]: медицина и фармацевтика [2–4], пищевая промышленность [5], агрохимия [4], бытовая химия [6], текстильная промышленность [7], машиностроение [8], оптика [9], электроника [9]. Это обусловлено во многом уникальными свойствами фторорганических соединений: высокой по сравнению с углеводородными аналогами стабильностью, низкой оптической плотностью, лиофильностью, негорючестью, водо-, масло- и грязеотталкивающими свойствами [6, 10]. Глубоко фторированные соединения, как правило, являются биоэнертными, благодаря чему они нашли применение в производстве искусственных органов и сосудов [10]. Не раз отмечалось, что чем большая доля атомов водорода в углеродной цепи замещена на фтор, тем ярче проявляются эти свойства [10].
Рассматриваемая в настоящей работе бромдифторуксусная кислота (BrCF2COOH) является востребованным в промышленности полупродуктом, используемым, в частности, для получения полимеров со специфическими свойствами, а также при синтезе ряда лекарственных препаратов. Производные BrCF2COOH широко используются в органическом синтезе [11–13].
Традиционный метод получения фторорганических кислот [14, 15] является многостадийным процессом, требующим больших капитальных и энергетических затрат. Интенсифицировать этот процесс можно заменив финальные стадии технологического процесса, а именно получение кислоты из ее эфира совмещенным процессом переэтерификации в колонне каталитической дистилляции. Преимуществами такого совмещения являются возможность преодоления термодинамических ограничений, накладываемых химическим равновесием и азеотропией, повышение селективности реакций, а также снижение энергетических и капитальных затрат [16]. В традиционном методе перевод эфира в кислоту осуществляется следующим образом [17]: щелочной гидролиз эфира, отгонка образовавшегося спирта, сушка соли фторорганической кислоты, обработка соли серной кислотой, выделение фторорганической кислоты из раствора. По этой технологии выход BrCF2COOH составляет всего 59%. Это многостадийный процесс, требующий большого числа аппаратов и вспомогательных реагентов.
Настоящее исследование является продолжением цикла работ [18, 19], посвященных исследованию каталитической дистилляции для совершенствования технологии бромдифторуксусной кислоты.
Цель настоящей работы – экспериментальное изучение процесса каталитической дистилляции на колонне периодического действия при получении BrCF2COOH из ее метилового и этилового эфиров и сопоставление эффективности традиционного и совмещенного процессов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Подбор реагента для осуществления реакции переэтерификации. Основные требование к реагенту для переэтерификации сводятся к его устойчивости по отношению к реакционной среде, стабильности при температурах проведения процесса и обеспечению наименьшей температуры кипения эфира в реакционной системе для организации отбора этого побочного продукта в голове колонны в виде дистиллята. Следует отметить, что для рассматриваемой технологии применимы практически все органические кислоты, температуры кипения эфиров которых значительно ниже температур кипения соответствующих эфиров бромдифторуксусной кислоты.
В настоящей работе реакцию переэтерификации метилового эфира бромдифторуксусной кислоты (BrCF2COOCH3) и этилового эфира бромдифторуксусной кислоты (BrCF2COOC2H5) в BrCF2COOH проводили с использованием ряда органических кислот.
Оказалось, что использование нефторированных органических кислот приводит к протеканию побочных реакций разложения этих кислот и их эфиров с образованием воды при накоплении BrCF2COOH в кубе колонны.
В частности, для муравьиной и уксусной кислот эксперименты показали, что в условиях совмещенного процесса каталитической дистилляции протекают побочные реакции разложения эфиров и их кислот с образованием диоксида углерода и воды. Увеличение компонентности системы и усложнение протекающих процессов при использовании рассмотренных кислот накладывают дополнительные ограничения на фазовое равновесие системы, что обусловлено образованием азеотропов с водой и смещением равновесия химической реакции в сторону образования реагентов.
Альтернативным вариантом использования в качестве реагентов переэтерификации выступают фторированные аналоги низкомолекулярных органических кислот, которые более стабильны в реакционной среде и имеют более низкие температуры кипения.
В качестве реагента была выбрана трифторуксусная кислота (CF3COOH) как наиболее доступная и дешевая. Экспериментальные данные по химическому равновесию и кинетике реакции переэтерификации BrCF2COOCH3 в BrCF2COOH с использованием CF3COOH представлены в работе [18]. Уравнения реакций переэтерификации метилового и этилового эфиров бромдифторуксусной кислоты в BrCF2COOH с использованием CF3COOH имеют следующий вид:
(1)
$\begin{gathered} {\text{BrC}}{{{\text{F}}}_{{\text{2}}}}{\text{COOC}}{{{\text{H}}}_{{\text{3}}}}\left( {{{{\text{A}}}_{{\text{1}}}}} \right) + {\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOH }}\left( {\text{B}} \right) \leftrightarrow \\ \leftrightarrow \,\,{\text{BrC}}{{{\text{F}}}_{{\text{2}}}}{\text{COOH }}\left( {\text{C}} \right) + {\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOC}}{{{\text{H}}}_{{\text{3}}}}\left( {{{{\text{D}}}_{{\text{1}}}}} \right), \\ \end{gathered} $(2)
$\begin{gathered} {\text{BrC}}{{{\text{F}}}_{{\text{2}}}}{\text{COO}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}\left( {{{{\text{A}}}_{{\text{2}}}}} \right) + {\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOH }}\left( {\text{B}} \right) \leftrightarrow \\ \leftrightarrow \,\,{\text{BrC}}{{{\text{F}}}_{{\text{2}}}}{\text{COOH }}\left( {\text{C}} \right) + {\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COO}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}\left( {{{{\text{D}}}_{{\text{2}}}}} \right). \\ \end{gathered} $Экспериментальные данные по химическому равновесию реакции переэтерификации BrCF2COOC2H5 в BrCF2COOH с использованием CF3COOH показали, что значение константы равновесия для реакции (2) в диапазоне температур 50–80°С составляет Кр = 1.1.
Выбор катализатора. Во многих промышленных процессах, использующих каталитическую дистилляцию, применяются твердофазные катализаторы [16]. Однако для условий рассматриваемой системы встает вопрос подбора катализатора, устойчивого к агрессивной реакционной среде и повышенным температурам процесса. Такая задача должна быть предметом отдельного исследования.
В настоящей работе используется легкодоступная и устойчивая к реакционной среде серная кислота, которая применялась для рассматриваемого процесса в [18].
Реактивы. В качестве реактивов использовали: BrCF2COOCH3, BrCF2COOC2H5, а также CF3COOH. Вещества были дополнительно очищены в лаборатории путем ректификации. Чистота веществ составляла 99.0 мол. % и более. Контроль чистоты эфиров осуществлялся на газовом хроматографе GC2010 Plus Shimadzu с пламенноионизационным детектором, газноситель – азот. Контроль чистоты кислот и их смесей проводили с помощью ЯМР по спектру 19F. В качестве стандарта применяли трихлорфторметан. Чистота H2SO4 составила 99.8 мол. %. Данные по чистым веществам при нормальных условиях приведены в табл. 1.
Таблица 1.
Экспериментальные и литературные данные по исходным веществам и продуктам реакции
| Вещества | Плотность, г/см3 | Температура кипения, оС | Молярная масса, г/моль | ||
|---|---|---|---|---|---|
| лит. | эксп. | лит. | эксп. | ||
| BrCF2COOCH3 | 1.7125 | – | 96.0 | 102.0 | 188.96 |
| CF3COOH | 1.485 | – | 72.0–73.0 | 71.5 | 114.02 |
| BrCF2COOH | – | 2.42 | 139.0–140.0 | 145.0 | 174.93 |
| CF3COOCH3 | 1.283 | – | 43.5 | 43.0 | 128.05 |
| BrCF2COOC2H5 | 1.583 | – | 116.0 | 115.0 | 202.98 |
| CF3COOC2H5 | 1.192 | – | 61.0 | 62.0 | 142.08 |
| H2SO4 | 1.8365 | – | 332.4 | – | 98.078 |
Экспериментальные установки. Эксперименты проводили на ректификационных колоннах периодического действия при атмосферном давлении. Схемы колонн представлены на рис. 1.
Рис. 1.
Схемы колонн периодической дистилляции: (а) – колонна каталитической дистилляции эффективностью в 11 теоретических ступеней; (б) – колонна периодической дистилляции эффективностью в 9 теоретических ступеней с возможностью отбора проб пара из куба колонны; 1 – куб колонны (трехгорлая колба); 2 – жидкая фаза в кубе колонны (смесь сырья, продуктов реакции и катализатора); 3 – штуцер для загрузки сырья; 4 – термометр; 5 – колонна (насадка спирали Фенске); 6 – термометр; 7 – обратный холодильник; 8 – карман; 9 – кран для отбора дистиллята; 10 – холодильник дистиллята; 11 – обмотка для обогрева куба (нихромовая спираль), 12 – термометр; 13 – кран для отбора проб пара над кубом.
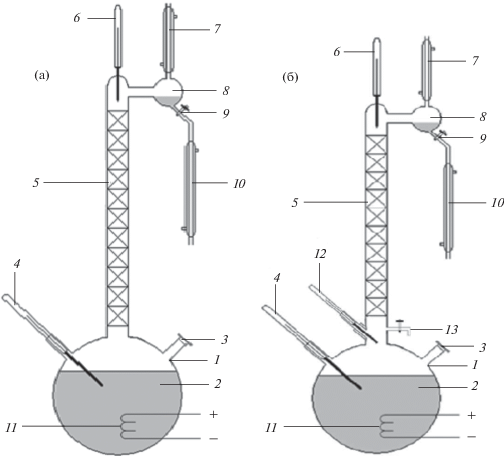
Конструктивные параметры колонн каталитической дистилляции приведены в табл. 2.
Таблица 2.
Конструктивные параметры работы колонн периодической дистилляции
| Параметры | Рис. 1а | Рис. 1б |
|---|---|---|
| Задержка в дефлегматоре, моль | 0.19 | 0.2 |
| Задержка на насадке, моль | – | 0.5 |
| Объем куба, л | 0.5 | 0.5 |
| Высота колонны, см | 38 | 26 |
| Диаметр колонны, см | 2.5 | 2.5 |
| Характеристики насадки | Спираль Фенске 2.5 мм стеклянные | Спираль Фенске 2.5 мм стеклянные |
| Количество теоретических тарелок | 11 | 9 |
| Модельная смесь | Гептан–бензол | Гептан–бензол |
ОПРЕДЕЛЕНИЕ ВЫХОДА ПО BrСF2COOH В РЕАКЦИОННО-РЕКТИФИКАЦИОННОМ ПРОЦЕССЕ
Методика проведения эксперимента. В реактор с мешалкой загружали смесь эфира (BrCF2COOCH3 или BrCF2COOC2H5) с CF3COOH. В качестве катализатора использовали H2SO4. Процесс проводили до значения конверсии реагентов более 47%. Заметим, что величине константы химического равновесия реакций (1) и (2) Кр = 1.1 [18], соответствует равновесное значение конверсии 52.3%. Полученную реакционную смесь загружали в куб периодической ректификационной колонны эффективностью 11 теоретических тарелок (рис. 1а). Установка работала в безотборном режиме до установления постоянных температур в дистилляте и в кубе колонны, после чего производили отбор фракций дистиллята в заданных диапазонах температур. Кубовый остаток подвергали кристаллизации при комнатной температуре.
В качестве примера подробно рассмотрим эксперимент по получению бромдифторуксусной кислоты из его метилового эфира.
В реактор с мешалкой загружали 1670.0 г BrCF2COOСH3, 850.0 г СF3COOH и 17.9 г H2SO4. Смесь кипятили 18 ч и 45 мин. За это время температура смеси в реакторе изменялась от 90.0 до 70.6°С. Процесс проводили до конверсии реагентов 49.8%. Полученная смесь была загружена в периодическую ректификационную колонну (рис. 1а) эффективностью 11 теоретических тарелок. Нагрузка на куб колонны (рис. 1а) увеличивалась по ходу проведения процесса. Колонна работала в безотборном режиме до установления в голове аппарата температуры 43.5°С, соответствующей температуре кипения чистого СF3COOCH3. Поток пара по колонне в начале процесса составил G = = 0.076 моль/мин. Далее в течение 3.5 ч через выбранные промежутки времени проводили отбор жидкости из дефлегматора. Поток пара по колонне при этом снизился до G = 0.063 моль/мин. Масса дистиллята в первой фракции составила 480.0 г, концентрация CF3COOСH3 в полученной фракции 99.92 мол. %. После этого отбор дистиллята проводили по описанной выше схеме в течение 4 ч. В ходе процесса была увеличена нагрузка на куб колонны. Поток пара по колонне при этом составил G = 0.057 моль/мин. Масса дистиллята во второй фракции составила 260 г, концентрация CF3COOСH3 в полученной фракции составила 98.5 мол. %. Затем в течение 2.5 ч был проведен отбор третьей фракции дистиллята. При этом температура в голове колонны выросла с 43.5 до 97.0°С, а поток пара по колонне снизился до G = = 0.042 моль/мин. Масса отобранной фракции составила 270 г.
Общая масса кубового остатка составила 1410 г. В процессе остывания проходила частичная кристаллизация продукта. Остывший кубовый остаток был разделен на две фракции: жидкую массой 530 г и кристаллическую массой 880 г.
В качестве продуктовых были приняты фракции дистиллята с концентрацией CF3COOСH3 не менее 99.0 мол. % и фракции куба с концентрацией BrСF2COOH не менее 97.0 мол. %. Прочие фракции рассматривали как промежуточные. Составы продуктовой фракции дистиллята и состав кубового остатка, соответствующие этому эксперименту, представлены в табл. 3.
Таблица 3.
Составы фракций на колонне каталитической дистилляции (рис. 1а) в эксперименте № 1
| Вещества | χD, мол. % | xW, мол. % | |
|---|---|---|---|
| Жидкая фаза | Твердая фаза | ||
| BrCF2COOСH3 | 0.08 | 33.7 | 1.8 |
| BrСF2COOH | 66.3 | 98.2 | |
| CF3COOH | 0 | 0 | |
| CF3COOCH3 | 99.92 | 0 | 0 |
| Масса фракции, г | 480 | 530 | 880 |
| Масса продукта в фракции, г | 479.6 | 1205.1 | |
Для увеличения выхода BrСF2COOH жидкую фазу кубового остатка (табл. 3) охлаждали при ‒4.0°С. В результате смесь частично закристаллизовалась. Данные по составу закристаллизовавшейся фазы приведены в табл. 4.
Таблица 4.
Состав кристаллической твердой фазы
| Вещества | xW, мол. % |
|---|---|
| BrCF2COOСH3 | 10.9 |
| BrСF2COOH | 89.1 |
| Масса фракции, г | 530 |
Теоретически возможный выход BrСF2COOH при 100% конверсии реагентов составляет 1300 г. Общая масса BrСF2COOH в кубовом остатке по результатам табл. 3 составляет 1205.1 г, что соответствует выходу по продукту 92.7%. Однако требованию к чистоте BrСF2COOH более 97.0 мол. % отвечает лишь кристаллическая фаза кубового продукта, приведенная в табл. 3. Таким образом, по продуктовой фракции куба в рассматриваемом эксперименте получаем выход продукта, равный 66.4%. Результаты экспериментов представлены в табл. 5.
Таблица 5.
Результаты экспериментов по определению выхода BrCF2COOH для систем BrCF2COOСH3 + + СF3COOH (1) и BrCF2COOС2H5 + СF3COOH (2) на колонне каталитической дистилляции
| Система | 1 | 2 | |||
|---|---|---|---|---|---|
| Эксперимент № | 1 | 2 | 3 | 4 | |
| Исходная смесь mi, г | СF3COOH | 850 | 670 | 660 | 700 |
| Эфир бромдифторуксусной кислоты | 1670 | 1100 | 1100 | 1240 | |
| Н2SO4 | 17.9 | 8.9 | 8.8 | 9.7 | |
| Максимально теоретически возможный выход BrCF2COOH, г | 1300 | 1030 | 1010 | 1060 | |
| Промежуточные фракции, г | 1160 | 480 | 310 | 760 | |
| Продуктовые фракции | mD, г | 480 | 360 | 550 | 250 |
| $x_{{{\text{э ф и р т р и ф т о р у к с у с н о й к и с л о т ы }}}}^{{\text{D}}},$ мол. % | 99.92 | 99.9 | 99.85 | 99.79 | |
| mW, г | 880 | 930 | 900 | 930 | |
| $x_{{{\text{BrC}}{{{\text{F}}}_{{\text{2}}}}{\text{COOH}}}}^{{\text{W}}},$ мол. % | 98.2 | 97.0 | 97.3 | 97.2 | |
| Выход BrCF2COOH, % | 66.4 | 87.4 | 86.5 | 84.9 | |
Теоретически возможный выход BrСF2COOH при 100% конверсии реагентов определяли по уравнению
где ni – количество реагента, находящегося в недостатке, моль, MC – молярная масса BrCF2COOH.Фактический выход BrCF2COOH рассчитали по уравнению
где $m_{{\Pr }}^{{\text{W}}}$ – масса продуктовой фракции куба, $X_{{\text{C}}}^{{\text{W}}}$ – концентрация BrCF2COOH в продуктовой фракции куба, масс. д.Анализ полученных данных. Результаты экспериментов, приведенных в табл. 3 и 5, показывают принципиальную возможность получения в виде кубового продукта BrCF2COOH требуемой чистоты. Варьированием режима отбора, соотношения реагентов и нагрузки на куб колонны удалось достичь выхода по BrCF2COOH 66.4–87.4% для системы (1) и 85.1% для системы (2) (табл. 5) по сравнению с выходом по продукту 59% в традиционном процессе.
ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ВЫХОДА КОЛОННЫ КАТАЛИТИЧЕСКОЙ ДИСТИЛЛЯЦИИ В СТАЦИОНАРНЫЙ РЕЖИМ ПРИ ПОЛНОЙ ФЛЕГМЕ
Для уменьшения количества аппаратов, использованных в рассматриваемом процессе, можно отказаться от реактора с мешалкой и осуществлять все химические превращения в кубе колонны. Задавшись температурой и чистотой дистиллята в качестве выходных параметров можно контролировать время начала отбора продуктовых фракций. Таким образом, на первом этапе ректификационная колонна будет работать в режиме полной флегмы до достижения заданного состава дистиллята. С целью определения времени выхода колонны в стационарный режим и динамики изменений состава дистиллята во времени был проведен ряд экспериментов на насадочной колонне эффективностью 9 теоретических ступеней (рис. 1б) в режиме полной флегмы.
Методика проведения эксперимента. Смесь BrCF2COOСH3 или BrCF2COOC2H5 с СF3COOH загружали в куб колонны при молярном соотношении 1 : 1. В качестве катализатора добавляли серную кислоту в количестве 5 мол. %. Конструкционные параметры колонны каталитической дистилляции (рис. 1б) приведены в табл. 2. Начало эксперимента относили к моменту появления флегмы в колонне.
Экспериментальные данные по периодическому совмещенному процессу для реакционной системы BrCF2COOСH3 + СF3COOH в режиме полной флегмы представлены в табл. 6 и 7.
Таблица 6.
Экспериментальные данные по составам дистиллята, пара над кубом и кубовой жидкости в зависимости от времени проведения эксперимента для системы BrCF2COOСH3 + СF3COOH при нагрузке 71 Вт, уравнение реакции (1), работы колонны (рис. 1б) при полной флегме
| t, мин | 0 | 10 | 20 | 60 | 120 | 180 | |
|---|---|---|---|---|---|---|---|
| Дистиллят, мол. д | Т, °С | – | 54.0 | 44.6 | 43.6 | 43.6 | 43.6 |
| BrCF2COOCH3 | 0.0579 | 0.0693 | 0.0647 | 0.0114 | 0 | 0 | |
| CF3COOH | 0.5663 | 0.5404 | 0.5043 | 0.1034 | 0 | 0 | |
| BrCF2COOH | 0 | 0 | 0 | 0 | 0 | 0 | |
| CF3COOCH3 | 0.3758 | 0.3903 | 0.4310 | 0.8852 | 1 | 1 | |
| Пар над кубом, мол. д | Т, °С | – | 83.0 | 81.0 | 75.5 | 77.0 | 78.0 |
| BrCF2COOCH3 | 0.2535 | 0.1941 | 0.1641 | 0.1262 | 0.1183 | 0.1244 | |
| CF3COOH | 0.4411 | 0.3771 | 0.3086 | 0.2127 | 0.2223 | 0.2113 | |
| BrCF2COOH | 0.0194 | 0.0274 | 0.0329 | 0.0326 | 0.0368 | 0.0402 | |
| CF3COOCH3 | 0.2860 | 0.4014 | 0.4944 | 0.6285 | 0.6226 | 0.6241 | |
| Куб, мол. д | Т, °С | – | 89.5 | 88.7 | 86.2 | 86.6 | 88.0 |
| BrCF2COOCH3 | 0.3855 | 0.3381 | 0.2997 | 0.2458 | 0.2355 | 0.2364 | |
| CF3COOH | 0.3280 | 0.3150 | 0.2821 | 0.2314 | 0.2199 | 0.2135 | |
| BrCF2COOH | 0.1917 | 0.2430 | 0.2949 | 0.3686 | 0.3899 | 0.4087 | |
| CF3COOCH3 | 0.0947 | 0.1039 | 0.1233 | 0.1542 | 0.1547 | 0.1414 | |
Таблица 7.
Экспериментальные данные по составам дистиллята, пара над кубом и кубовой жидкости в зависимости от времени проведения эксперимента для системы BrCF2COOСH3 + СF3COOH при нагрузке 60 Вт, уравнение реакции (1), работы колонны (рис. 1б) при полной флегме
| t, мин | 0 | 13 | 43 | 103 | 163 | 193 | |
|---|---|---|---|---|---|---|---|
| Дистиллят, мол. д | Т, °С | 71.9 | 50.3 | 43.0 | 42.6 | 42.6 | 42.6 |
| BrCF2COOCH3 | 0.0200 | 0.0241 | 0.0221 | 0.0150 | 0 | 0 | |
| CF3COOH | 0.5831 | 0.5932 | 0.5704 | 0.4067 | 0.0976 | 0 | |
| BrCF2COOH | 0 | 0 | 0 | 0 | 0 | 0 | |
| CF3COOCH3 | 0.3969 | 0.3826 | 0.4075 | 0.5783 | 0.9024 | 1 | |
| Пар над кубом, мол. д | Т, °С | 81.5 | 85.0 | 80.0 | 75.5 | 75.0 | 75.5 |
| BrCF2COOCH3 | 0.2783 | 0.2412 | 0.1757 | 0.1318 | 0.1251 | 0.1298 | |
| CF3COOH | 0.5119 | 0.4870 | 0.3504 | 0.2610 | 0.2269 | 0.2295 | |
| BrCF2COOH | 0.0166 | 0.0267 | 0.0362 | 0.0380 | 0.0417 | 0.0451 | |
| CF3COOCH3 | 0.1932 | 0.2451 | 0.4376 | 0.5692 | 0.6063 | 0.5956 | |
| Куб, мол. д | BrCF2COOCH3 | 0.4230 | 0.4093 | 0.3086 | 0.2614 | 0.2494 | 0.2450 |
| CF3COOH | 0.3565 | 0.3551 | 0.2793 | 0.2271 | 0.2328 | 0.2261 | |
| BrCF2COOH | 0.1357 | 0.1543 | 0.2759 | 0.3354 | 0.3563 | 0.3639 | |
| CF3COOCH3 | 0.0847 | 0.0813 | 0.1362 | 0.1761 | 0.1615 | 0.1650 | |
Экспериментальные данные по периодическому совмещенному процессу для реакционной системы BrCF2COOС2H5 + СF3COOH в режиме полной флегмы представлены в табл. 8 и 9.
Таблица 8.
Экспериментальные данные по составам дистиллята, пара над кубом и кубовой жидкости в зависимости от времени проведения эксперимента для системы BrCF2COOС2H5 + СF3COOH при нагрузке 60 Вт, уравнение реакции (2), работы колонны (рис. 1б) при полной флегме
| t, мин | 0 | 5 | 15 | 30 | 60 | 90 | 120 | |
|---|---|---|---|---|---|---|---|---|
| Дистиллят, мол. д | Т, °С | 79.0 | 73.0 | 68.0 | 65.0 | 63.0 | 63.0 | 63.0 |
| BrCF2COOC2H5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| CF3COOH | 0.8498 | 0.8174 | 0.7791 | 0.5559 | 0.3172 | 0.1688 | 0.0799 | |
| BrCF2COOH | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| CF3COOC2H5 | 0.1502 | 0.1826 | 0.2209 | 0.4441 | 0.6828 | 0.8312 | 0.9201 | |
| Пар над кубом, мол. д | Т, °С | 91.0 | 90.0 | 86.0 | 86.0 | 86.0 | 86.0 | 86.0 |
| BrCF2COOC2H5 | 0.1683 | 0.1580 | 0.1608 | 0.1044 | 0.1013 | 0.0891 | 0.1014 | |
| CF3COOH | 0.4959 | 0.4058 | 0.3246 | 0.2833 | 0.2717 | 0.2711 | 0.2783 | |
| BrCF2COOH | 0.0319 | 0.0335 | 0.0422 | 0.0475 | 0.0534 | 0.0685 | 0.0580 | |
| CF3COOC2H5 | 0.3038 | 0.4027 | 0.4724 | 0.5648 | 0.5737 | 0.5712 | 0.5623 | |
| Куб, мол. д | Т, °С | 99.7 | 99.4 | 97.7 | 97.2 | 98.4 | 98.7 | 99.1 |
| BrCF2COOC2H5 | 0.4123 | 0.3812 | 0.3175 | 0.2833 | 0.2621 | 0.2483 | 0.2562 | |
| CF3COOH | 0.3167 | 0.2656 | 0.2419 | 0.2278 | 0.2182 | 0.2049 | 0.2123 | |
| BrCF2COOH | 0.1653 | 0.2078 | 0.2756 | 0.3144 | 0.3487 | 0.3880 | 0.3704 | |
| CF3COOC2H5 | 0.1058 | 0.1454 | 0.1649 | 0.1746 | 0.1710 | 0.1588 | 0.1611 | |
Таблица 9.
Экспериментальные данные по составам дистиллята, пара над кубом и кубовой жидкости в зависимости от времени проведения эксперимента для системы BrCF2COOС2H5 + СF3COOH при нагрузке 71 Вт, уравнение реакции (2), работы колонны (рис. 1б) при полной флегме
| t, мин | 0 | 5 | 15 | 30 | 60 | 90 | 120 | |
|---|---|---|---|---|---|---|---|---|
| Дистиллят, мол. д |
Т, °С | 81.2 | 70.4 | 66.4 | 63.2 | 62.6 | 62.4 | 62.6 |
| BrCF2COOC2H5 | 0.0159 | 0.0215 | 0.0282 | 0.0139 | 0.0068 | 0 | 0 | |
| CF3COOH | 0.7502 | 0.7187 | 0.6833 | 0.5224 | 0.3040 | 0.0993 | 0 | |
| BrCF2COOH | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| CF3COOC2H5 | 0.2340 | 0.2598 | 0.2885 | 0.4636 | 0.6891 | 0.9007 | 1 | |
| Пар над кубом, мол. д | Т, °С | 91.0 | 89.0 | 86.0 | 86.0 | 85.5 | 85.5 | 86.0 |
| BrCF2COOC2H5 | 0.1765 | 0.1629 | 0.1345 | 0.1177 | 0.1092 | 0.0958 | 0.1010 | |
| CF3COOH | 0.4998 | 0.4460 | 0.3716 | 0.3225 | 0.2946 | 0.2796 | 0.2933 | |
| BrCF2COOH | 0.0366 | 0.0395 | 0.0523 | 0.0614 | 0.0633 | 0.0606 | 0.0619 | |
| CF3COOC2H5 | 0.2871 | 0.3516 | 0.4416 | 0.4984 | 0.5329 | 0.5640 | 0.5437 | |
| Куб, мол. д. |
Т, °С | 100.3 | 99.9 | 98.7 | 98.6 | 98.7 | 98.9 | 99.9 |
| BrCF2COOC2H5 | 0.3998 | 0.3649 | 0.2968 | 0.2665 | 0.2583 | 0.2651 | 0.2592 | |
| CF3COOH | 0.3054 | 0.2685 | 0.2464 | 0.2244 | 0.2181 | 0.2190 | 0.2174 | |
| BrCF2COOH | 0.1751 | 0.2277 | 0.2988 | 0.3365 | 0.3526 | 0.3545 | 0.3673 | |
| CF3COOC2H5 | 0.1197 | 0.1389 | 0.1580 | 0.1726 | 0.1710 | 0.1614 | 0.1562 | |
На рис. 2–5 показана зависимость скорости выхода колонны в стационарный режим в зависимости от выбранного реагента и нагрузки на колонну.
Рис. 2.
Экспериментальные данные по составам дистиллята (а), пара над кубом (б) и куба (в) в зависимости от времени проведения эксперимента для системы BrCF2COOСH3 + СF3COOH при нагрузке 71 Вт на куб колонны, уравнение реакции (1): а – метиловый эфир трифторуксусной кислоты, б – трифторуксусная кислота, в – метиловый эфир бромдифторуксусной кислоты, г – бромдифторуксусная кислота.
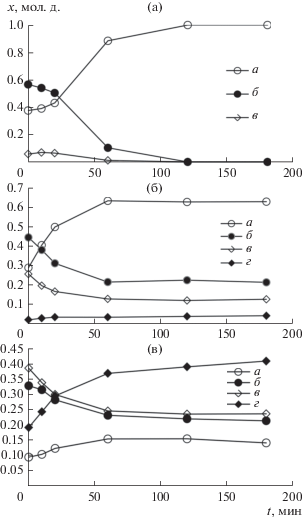
Рис. 3.
Экспериментальные данные по составам дистиллята (а), пара над кубом (б) и куба (в) в зависимости от времени проведения эксперимента для системы BrCF2COOСH3 + СF3COOH при нагрузке 60 Вт на куб колонны, уравнение реакции (1): а – метиловый эфир трифторуксусной кислоты, б – трифторуксусная кислота, в – метиловый эфир бромдифторуксусной кислоты, г – бромдифторуксусная кислота.
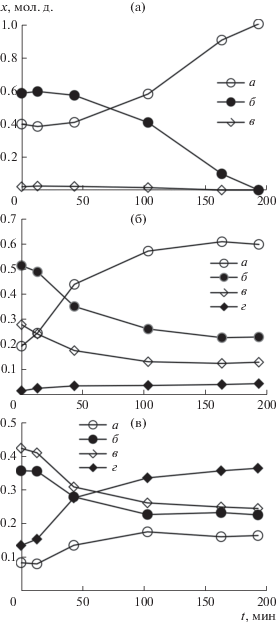
Рис. 4.
Экспериментальные данные по составам дистиллята (а), пара над кубом (б) и куба (в) в зависимости от времени проведения эксперимента для системы BrCF2COOС2H5 + СF3COOH при нагрузке 60 Вт на куб колонны, уравнение реакции (2): а – этиловый эфир трифторуксусной кислоты, б – трифторуксусная кислота, в – этиловый эфир бромдифторуксусной кислоты, г – бромдифторуксусная кислота.
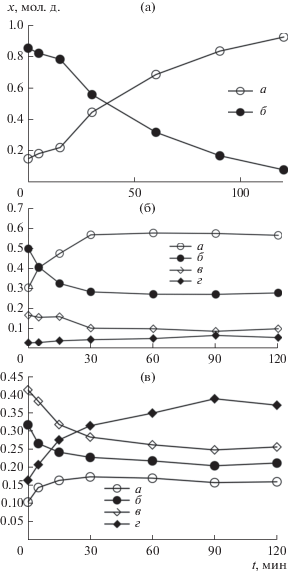
Рис. 5.
Экспериментальные данные по составам дистиллята (а), пара над кубом (б) и куба (в) в зависимости от времени проведения эксперимента для системы BrCF2COOС2H5 + СF3COOH при нагрузке 71 Вт на куб колонны, уравнение реакции (2): а – этиловый эфир трифторуксусной кислоты, б – трифторуксусная кислота, в – этиловый эфир бромдифторуксусной кислоты, г – бромдифторуксусная кислота.
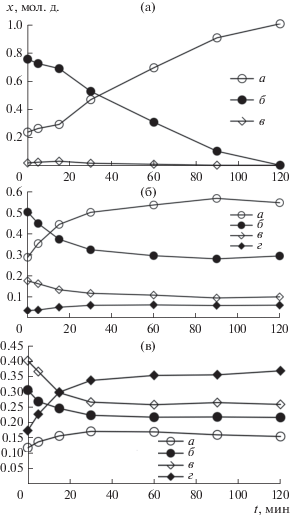
Анализ полученных данных. Для нагрузок 60 и 71 Вт изучена скорость выхода на стационарный режим. Оказалось, что при увеличении нагрузки с 60 до 71 Вт система (1) выходит на стационарный режим в 1.7 раза быстрее. Для системы (2) влияние изменения нагрузок с 60 до 71 Вт не было обнаружено.
СРАВНЕНИЕ МЕТОДОВ ПОЛУЧЕНИЯ BrCF2COOH ИЗ ЕЕ МЕТИЛОВОГО И ЭТИЛОВОГО ЭФИРОВ
При использовании метилового эфира бромдифторуксусной кислоты температура в кубе колонны изменялась в диапазоне от 70.6 до 140.0°С, температура потока дистиллята от 43.5 до 112.0°С. Для этилового эфира бромдифторуксусной кислоты изменения температуры были следующими: в кубе колонны от 91.0 до 140.0°С, в потоке дистиллята от 61.0 до 120.0°С. По этой причине при равных потоках пара и количестве вещества в кубе колонны процесс получения бромдифторуксусной кислоты из ее этилового эфира может оказаться более энергоемким, чем из ее метилового эфира.
В общем случае для совмещенных процессов фактический выход по кубовому продукту можно представить в виде функции количества и состава отобранного из колонны дистиллята:
Так, наибольшее приближение фактического выхода к теоретически возможному можно получить, отбирая фракцию дистиллята, максимально приближенную по составу к чистому побочному продукту ($x_{{{\text{п р о д у к т }}}}^{{\text{D}}} \to 1$), минимизировав при этом отбор реагентов ($x_{{{\text{р е а г е н т о в }}}}^{{\text{D}}} \to 0$).
Для реализации такой задачи необходимо правильно подобрать режим работы колонны. Очевидно, что для систем (1) и (2) режимы работы колонны будут различны. Для системы (2) при прочих равных условиях наилучший вариант реализуется при большем флегмовом числе, чем в системе (1). В данном случае критерием выбора системы является минимум энергетических затрат. С другой стороны, при интенсификации работы колонны, приводящей к уменьшению ее высоты, можно добиться снижения капитальных затрат.
Выход продуктовой фракции дистиллята при неизменной эффективности колонны для системы (1) примерно на 20% выше, чем для системы (2). Это может быть связано с различием между фазовыми портретами систем.
Исследование фазового равновесия для системы (1) при атмосферном давлении [19] показало отсутствие азеотропов, т.е. термодинамических ограничений на разделение смеси (рис. 6а). В данном случае вне зависимости от точки концентрационного симплекса, в которой находится система, дистиллят будет обогащаться по СF3COOCH3.
Рис. 6.
Фазовое равновесие в системах: (а) – система (1); (б) – система (2); синий цвет – многообразие химического взаимодействия; желтый цвет – разделяющее многообразие; I – первая подобласть разделения; II – вторая подобласть разделения.
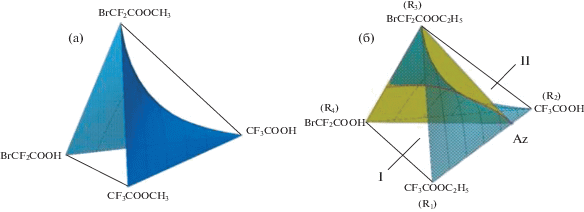
Исследование фазового равновесия в системе (2) (рис. 6б) позволило обнаружить наличие отрицательного азеотропа Az– в бинарной системе CF3COOC2H5 (R1)–CF3COOH (R2) с Ткип = 75°С и хR1 = 0.2 мол. д., что накладывает термодинамические ограничения на разделение смеси (2). Из-за наличия азеотропа область дистилляции в системе (2) разбивается на две подобласти (R1Az–R3R4 – I; Az–R2R3R4 – II). Границей между ними выступает криволинейное разделяющее двумерное многообразие Az–R3R4. В данном случае подобласть концентрационного пространства (рис. 6б), в которой находится реакционная смесь, будет определять по какому компоненту, CF3COOC2H5 или CF3COOH, будет обогащаться дистиллят. Это обусловлено тем, что в подобласти I самым легколетучим компонентом будет CF3COOC2H5, а в подобласти II – CF3COOH.
Наличие такого ограничения на разделение в системе II может приводить к наблюдаемому снижению выхода по верхнему продукту.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ РАБОТЫ КУБА КОЛОННЫ КАТАЛИТИЧЕСКОЙ ДИСТИЛЛЯЦИИ ДЛЯ ПОЛУЧЕНИЯ BrCF2COOH
Моделирование работы куба колонны периодической каталитической дистилляции для системы (1) проводили в программном комплексе Aspen Batch Modeler V.9.
Данные по фазовому равновесию и свойствам чистых компонентов исследуемой системы были интегрированы в программный комплекс Aspen Batch Modeler V.9 из Aspen Plus V.9.
Скорость химической реакции рассчитывается по уравнению
где [A], [B], [C], [D] – концентрации реагентов и продуктов, кмоль/кмоль, kf – константа скорости прямой реакции; kr – константа скорости обратной реакции; kf/kr = Kp= 1.1. Базис скорости химической реакции моль/см3 с.Константа скорости прямой реакции рассчитывается по уравнению
где Ar – константа Аррениуса; Еa – энергия активации, Дж/моль; R – газовая постоянная, равная 8.314 Дж/(моль К); Т – температура, K. Данные о химическом равновесии и кинетике реакции были получены ранее в работе [18]. Константа Аррениуса пересчитана под базис программного комплекса. Полученное в результате значение константы Аррениуса Ar = 6.412 (моль см3 с)–1. Значение энергии активации в зависимости от концентрации катализатора рассчитывали по следующему уравнению, полученному на основании данных работы [18]:(8)
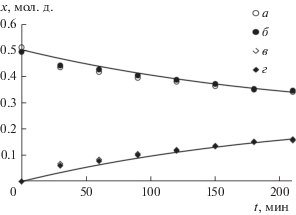
${{Е }_{{\text{a}}}} = 47\,063--199\,000[{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}}],$Полученная модель химической кинетики адекватно описывает экспериментальные данные [18]. На рис. 7 представлено сравнение экспериментальных и рассчитанных в программном комплексе Aspen Batch Modeler V.9 данных для 80°С и концентрации катализатора 0.5 мол. %.
ЗАКЛЮЧЕНИЕ
На основании проведенного исследования была показана эффективность использования каталитической дистилляции для получения фторорганических кислот. Этот подход может служить основой для реализации новой технологии получения фторорганических эфиров и кислот.
В результате эксперимента показана принципиальная возможность реализации процесса получения бромдифторуксусной кислоты методом реакционной дистилляции. Удалось достичь выхода 87.4% по кубовому продукту с чистотой не менее 97.0 мол. %, что существенно превышает выход 59% по традиционной технологии. Было сокращено количество стадий процесса с 5 до 1 и число аппаратов в технологической схеме с 4 до 1. Уменьшено количество вспомогательных реагентов и получен дополнительный товарный продукт в виде эфиров трифторуксусной кислоты заданной чистоты 99.0 мол. % и более. Экспериментально доказано, что колонны эффективностью в 9 теоретических тарелок достаточно для реализации описанного выше процесса.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-03-00608).
ОБОЗНАЧЕНИЯ
| Ar | константа Аррениуса, (моль см3 с)–1 |
| Ea | энергия активации, Дж/моль |
| G | поток пара по колонне, моль/мин |
| Кр | константа химического равновесия реакции |
| kf | константа скорости прямой химической реакции, (моль см3 с)–1 |
| kr | константа скорости обратной реакции, (моль см3 с)–1 |
| Mi | молярная масса, г/моль |
| Xi | концентрация вещества, масс. д. |
| mi | масса, г |
| mmax | теоретически возможный выход, г |
| R | газовая постоянная, 8.314 Дж/(моль К) |
| r | скорость реакции, мол. д./с |
| T | температура, K |
| xi | концентрация вещества, мол. д. |
| η | выход по продукту |
ИНДЕКСЫ
Список литературы
Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Second Edition / Eds. Kirsch P. Weinheim: Wiley-VCH, 2013.
Максимов Б.Н., Барабанов В.Г., Серушкин И.Л. Промышленные фторорганические продукты. Справочник. Л.: Химия, 1990.
Le Bars D. Fluorine-18 and medical imaging: Radiopharmaceuticals for positron emission tomography // J. Fluorine Chemistry. 2006. V. 127. P. 1488.
Müller K., Faeh C., Diederich F. Fluorine in pharmaceuticals: looking beyond intuition // Science. 2007. V. 317. № 5846. P. 1881.
Исикава Н., Кобаяси Е. Фтор. Химия и применение. Пер. с японск. М.: Мир, 1982.
Новое в технологии соединений фтора / Под ред. Исикавы Н. Пер. с японск. М.: Мир, 1984.
Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров. Учебное пособие. М.: Наука: МАИК “Наука/Интерпериодика”, 2002.
Горбунова Т.И., Бажин Д.Н., Запевалов А.Я., Коршунов Л.Г., Бекетов И.В., Салоутин В.И. Антифрикционные свойства фторсодержащих сложных эфиров полиолов // Fluorine Notes. 2012. № 1(80).
Smith C.E., Smith P.S., Thomas R.L., Robins E.G., Collings J.C., Dai C., Scott A.J., Borwick S., Batsanov A.S., Watt S.W., Clark S.J., Viney C., Howard J.A.K., Cleggc W., Marder T.B. Arene-perfluoroarene interactions in crystal engineering: Structural preferences in polyfluorinated tolans // J. Mater. Chem. 2004. V. 14. P. 413.
Шеппард У., Шартс К. Органическая химия фтора. Пер. с англ. М.: Мир, 1972.
Дильман А.Д., Левин В.В. Новые реакции с участием дифторкарбена // 10-я Всероссийская конференция “Химия фтора”. М., 2015.
Дильман А.Д. Дифторкарбены как строительный материал // 11-я Всероссийская конференция “Химия фтора”. М., 2016.
Новиков М.А. Катализируемые соединениями меди превращения гем-фторхлор- и гем-фторбромциклопропанов с раскрытием цикла. Дис. … канд. хим. наук. М., 2016.
Фтор и его соединения. Т. 1 / Под ред. Саймонса Дж. М.: Изд-во иностранной литературы, 1956.
Фтор и его соединения. Т. 2 / Под ред. Саймонса Дж. М.: Изд-во иностранной литературы, 1956.
Reactive Distillation. Status and Future Directions / Eds. Sundmacher K., Kirnle A. Weinheim: Wiley-VCH, 2002.
Синтезы фторорганических соединений. М.: ЗАО НПО “ПиМ-Инвест”, 2005.
Kvashnin S.Ya., Lupachev E.V., Lotkhov V.A., Kuritsyn N.N., Kulov N.N. Chemical equilibrium and the kinetics of transesterification reactions of fluoroorganic esters and acids // Theor. Found. Chem. Eng. 2017. V. 51. № 6. P. 1012. [Квашнин С.Я., Лупачев Е.В., Лотхов В.А., Курицын Н.Н., Кулов Н.Н. Химическое равновесие и кинетика реакций переэтерификации фторорганических эфиров и кислот // Теорет. основы. хим. технологии. 2017. Т. 51. № 6. С. 669.]
Lupachev E.V., Zakhlevniy A.V., Kvashnin S.Ya., Lot-khov V.A., Kulov N.N. Vapor–liquid equilibrium of binary components of the BrCF2COOCH3–CF3COOH–BrCF2COOH–CF3COOCH3 quaternary system // Theor. Found. Chem. Eng. 2018. V. 52. №. 3. P. 295. [Лупачев Е.В., Захлевный А.В., Квашнин С.Я., Лотхов В.А., Кулов Н.Н. Парожидкостное равновесие бинарных составляющих четырехкомпонентной системы BrCF2COOCH3–CF3COOH–BrCF2COOH–CF3COOCH3 // Теорет. основы хим. технологии. 2018. Т. 52. № 3. С. 239.]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии