Теоретические основы химической технологии, 2020, T. 54, № 6, стр. 733-737
Тандемная масс-спектрометрия в технологии определения аралозидов композиции фитоадаптогенов
И. В. Казеев a, *, О. А. Бочарова a, В. Е. Шевченко a, Р. В. Карпова a, Е. В. Бочаров a, Е. В. Уютова b, О. П. Шейченко b, В. Г. Кучеряну c, М. А. Барышникова a
a Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения Российской Федерации
Москва, Россия
b Всероссийский научно-исследовательский институт лекарственных и ароматических растений
Москва, Россия
c Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
* E-mail: ilya_delta@mail.ru
Поступила в редакцию 14.04.2020
После доработки 14.05.2020
Принята к публикации 15.05.2020
Аннотация
Исследованы возможности тандемной масс-спектрометрии для технологии анализа аралозидов в фармацевтической композиции “Мультифитоадаптоген” (МФА) и экстракте корней аралии маньчжурской (входящего в состав МФА). Хроматографирование проводили на колонке ACQUITY UPLC BEH C18 в градиентном режиме. Использовали тройной квадрупольный масс-спектрометр TSQ Vantage с электрораспылительной ионизацией. В МФА, так же как и в экстракте корней аралии маньчжурской, были идентифицированы аралозиды А, В, С и/или их изомеры.
ВВЕДЕНИЕ
В последнее время очевидной становится перспективность применения нетоксичных иммуномодуляторов, в частности фитоадаптогенов, для профилактических воздействий, а также в составе комплексной терапии при злокачественных новообразованиях. Их действие направлено на восстановление защитных систем организма, в том числе иммуноадгезионных механизмов [1–6].
Вместе с тем актуальной является технологическая проблема стандартизации, особенно многокомпонентных фитокомплексов. Важным остается и обоснование фармакологической активности препаратов с учетом их химического состава [7].
Фармацевтическая композиция фитоадаптогенов “Мультифитоадаптоген” (МФА) содержит компоненты экстрактов 40 растений, включенных в Государственную фармакопею РФ, в том числе адаптогенов женьшеня, аралии, элеутерококка, родиолы розовой, заманихи, лимонника. Выявлены антимутагенные, противоопухолевые, радиопротекторные, гормономодулирующие, антиоксидантные, нейропротекторные, иммуномодулирующие, в том числе противовоспалительные и интерфероногенные эффекты МФА [8–16]. Эффективность МФА, вероятно, обусловлена комплексом биологически активных веществ (БАВ), входящих в его состав.
Для стандартизации и контроля качества МФА проводятся исследования по определению БАВ, входящих в его состав. В ранее проведенных работах с применением обращенно-фазовой высокоэффективной жидкостной хроматографии с УФ-детектором, хромато-масс-спектрометрии, ЯМР-спектрометрии в МФА были определены полифенольные соединения (флавоноиды и др.), эфирные масла, аминокислоты и витамины [17, 18].
Весьма важным моментом дальнейшего анализа компонентов МФА является определение тритерпеновых сапонинов, основных БАВ, в частности женьшеня, аралии, заманихи и других фитоадаптогенов. Тритерпеновым сапонинам свойственна многообразная фармакологическая активность, в том числе противоопухолевая, антиоксидантная, иммуномодулирующая [19].
Учитывая многокомпонентный состав МФА, для идентификации тритерпеновых сапонинов представляется перспективным применение высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (ВЭЖХ-МС/МС). Этот метод отличается высокой специфичностью, точностью и возможностью определения веществ в минимальных количествах.
В предыдущих исследованиях среди компонентов МФА методом ВЭЖХ-МС/МС были идентифицированы гинзенозиды Rb1, Rb2, Rc, Rd, Rg1, Rg2, Re, Rf, Ro, которые представляют собой основные тритерпеновые сапонины корней женьшеня [20].
Кроме того, в состав МФА входит экстракт корней аралии маньчжурской – Aralia mandshurica Rupr. et Maxim; cем. аралиевые – Araliaceae. Известно, что корни этого растения содержат аралозиды – тритерпеновые сапонины пентациклического ряда, производные олеанана.
Введение компонентов экстракта аралии в состав МФА было оправдано тем, что аралозиды обладают комплексом свойств, значимых для онкологических заболеваний и болезней старения. Так, показано, что аралозиды регулируют ключевые медиаторы ответа на стресс, в том числе нейропептид Y, кортизол, оксид азота, стресс-активируемую протеинкиназу JNK и транскрипционный фактор DAF-16. Обладают цитотоксической активностью против опухолевых клеточных линий. Проявляют кардиопротекторный, гиполипидемический, антидиабетический, антиоксидантный эффекты. Повышают реактивность, лабильность и работоспособность нервных клеток [19].
В связи с этим следующим этапом анализа тритерпеновых сапонинов в составе МФА стало определение аралозидов.
Цель данного исследования – выявление аралозидов в МФА методом ВЭЖХ-МС/МС.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
В работе исследовали 2 образца: МФА, а также экстракт корней аралии, входящий в состав МФА. Оба образца были получены по одинаковой технологии (удельный вес сырья, температурный и временной режим экстрагирования, состав экстрагента, соотношение сырье : экстрагент). Для приготовления экстрактов использовали сертифицированное сырье.
Образец МФА смешивали с метанолом в соотношении 1 : 2 и центрифугировали в течение 5 мин при 13 000 об./мин. Надосадочную жидкость пропускали через фильтр с диаметром пор 0.22 мкм и центрифугировали при 13 000 об./мин в течение 1 мин.
Аликвоту (1 мл) экстракта аралии упаривали на роторном испарителе Concentrator 5301 (Eppendorf, Германия) при 30°С досуха. Остаток растворяли в 100 мкл метанола и центрифугировали при 13 000 об/мин в течение 1 мин.
Анализ образцов проводили с использованием тройного квадрупольного масс-спектрометра TSQ Vantage (серии Thermo Scientific TSQ), соединенного с ВЭЖХ-хроматографом Accela.
Условия хроматографического анализа: колонка ACQUITY UPLC BEH C18 (1.7 мкм, 2.1 × × 100 мм, Waters); состав подвижной фазы: фаза А – 100% вода и 0.1% муравьиная кислота (FA); фаза Б – 95% ацетонитрил, 5% вода и 0.1% FA.
Для анализа экстрактов применяли длинный градиент подачи подвижной фазы (в % фазы Б): 0–68 мин (0–60%), 68–70 мин (60–100%), 70–75 мин (100%), 75–80 мин (0%). Образцы в объеме 5 мкл вводили в петлю инжектора объемом 25 мкл (мобильная фаза – 20 мкл), скорость потока 450 мкл/мин.
Ионизацию осуществляли с помощью электроспрея. Условия ионизации: отрицательная полярность, напряжение капилляра спрея 4 кВ, газ (создающий спрей) – 60 psi (фунтов на квадратный дюйм), обтекающий газ – 15 отн. ед., температура капилляра – 270°С. Спектры в режиме полного сканирования и режиме сканирования отдельных ионов были сняты в диапазоне 150–1500 Да, время сканирования – 0.1 с.
Масс-спектры получали прямым вводом пробы через шприц со скоростью 5 мкл/мин; давление газа в камере соударений составило 0.9 торр. Напряжение в камере соударений было подобрано для каждого соединения отдельно.
Анализ данных литературы о химическом составе корней аралии маньчжурской показал основные БАВ этого растения. В табл. 1 приведены некоторые из них, относящиеся к пентациклическим тритерпеновым сапонинам (производным олеаноловой кислоты) [21 ] . Например, аралозид А представляет собой олеаноловую кислоту с последовательно присоединенными остатками глюкозы, арабинозы и глюкуроновой кислоты. У аралозида В в качестве радикалов, кроме глюкозы, присутствуют два остатка арабинозы. У аралозида С – остатки галактозы и ксилозы.
Таблица 1.
Основные аралозиды (тритерпеновые сапонины) аралии маньчжурской и их изомеры
| № | Соединение | Молекулярная формула | Молекулярная масса |
|---|---|---|---|
| 1 | Аралозид А | C47H74O18 | 927 |
| 2 | Стипулеанозид R1 (изомер аралозида А) | C47H74O18 | 927 |
| 3 | Chikusetsusaponin Ib (изомер аралозида А) | C47H74O18 | 927 |
| 4 | Элатозид A (изомер аралозида А) | C47H74O18 | 927 |
| 5 | Аралозид В | C52H82O22 | 1059 |
| 6 | Аралозид С | C53H84O23 | 1089 |
| 7 | Стипулеанозид R2 (изомер аралозида С) | C53H84O23 | 1089 |
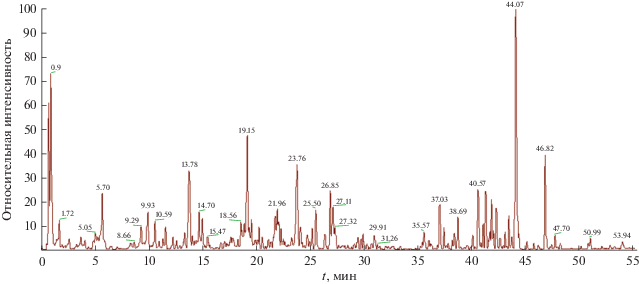
Для выявления аралозидов в экстракте аралии, входящем в состав МФА, была получена хроматограмма экстракта с использованием длинного градиента подачи мобильной фазы, снятая в режиме полного сканирования ионов (рис. 1).
В табл. 2 представлены результаты тандемной масс-спектрометрии экстракта аралии (t и m/z для основного молекулярного иона, а также для фрагментов молекулярного иона), а также молекулярная масса вещества.
Таблица 2.
Результаты тандемной масс-спектрометрии экстракта аралии (t, m/z для основного молекулярного иона, а также для фрагментов молекулярного иона), а также молекулярная масса по данным литературы
| Соединение, молекулярная формула |
t, мин | m/z | Молекулярная масса |
|---|---|---|---|
| Аралозид А Стипулеанозид R1 Chikusetsusaponin Ib Элатозид A C47H74O18 |
43.9; 52.3; 53.1; 54.4 | 925.32 [M–H]– 763.25 [M–H–Glc]– 455 Agl |
927.1 |
| Аралозид В C52H82O22 |
42.1–42.6 | 1057 [M–H]– 924.66 [M–H–Ara]– 455 Agl |
1059.2 |
| Аралозид С Стипулеанозид R2 C53H84O23 |
41.3–43.0 | 1087.6 [M–H]– 925.36 [M–H–Glc]– 455 Agl |
1089.2 |
Как видно из рис. 1 и табл. 2, доминирующим компонентом экстракта аралии является соединение, дающее основной молекулярный ион с m/z = 925,4 (t = 43.9 мин). Сопоставляя эти данные со значением молекулярной массы из табл. 1, указанный пик можно отнести к аралозиду А.
На хроматограмме экстракта аралии можно видеть еще 3 пика с m/z = 925 (t = 52.3; 53.1; 54.4 мин). Эти пики могут соответствовать изомерам аралозида А. Можно предположить, что в экстракте аралии имеются все приведенные в табл. 1 соединения с молекулярной массой 927, дающие псевдомолекулярный ион [M–H]– c m/z = 925.4, а основной пик (t = 43.9 мин) принадлежит именно аралозиду А, одному из ведущих компонентов экстракта аралии по данным литературы.
Пик с m/z = 1087.6 (t = 41.3–43.0 мин), вероятно, содержащий аралозид С или его изомер, выглядит очень широким. Скорее всего, под ним скрываются несколько веществ, близких по молекулярной массе.
Аралозид В с m/z = 1057.5 был обнаружен на хроматограмме экстракта в режиме детектирования отдельных ионов. Ему соответствовал пик со временем удерживания t = 42.1–42.6 мин. В связи с этим можно полагать, что на хроматограмме экстракта аралии (см. рис. 1) пик с m/z = 1087.6 (t = 41.3–43.0 мин) содержит вместе с тем и аралозид В.
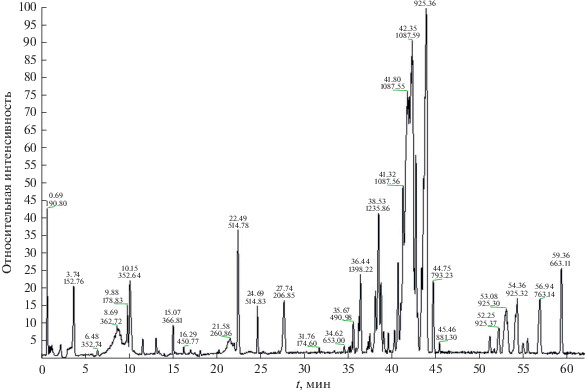
Хроматограмма полного ионного тока МФА представлена на рис. 2. В интервале t = 41.3–44.0 мин, а также при t = 52.3 и 53.1 мин приведены пики, которые могут соответствовать аралозидам А, В, С и/или их изомерам.
ЗАКЛЮЧЕНИЕ
В данной работе были использованы современные технологические подходы к изучению химического состава и стандартизации многокомпонентных экстрактов из лекарственного растительного сырья, в частности мультифитоадаптогена.
Результаты работы говорят в пользу того, что методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием в фармацевтической композиции “Мультифитоадаптоген” идентифицированы аралозиды А, В, С и/или их изомеры – тритерпеновые сапонины пентациклического ряда, производные олеаноловой кислоты.
ОБОЗНАЧЕНИЯ
СОКРАЩЕНИЯ
Список литературы
Гольдберг Е.Д., Разина Т.Г., Зуева Е.П., Амосова Е.Н., Крылова С.Г., Гольдберг В.Е. Растения в комплексной терапии опухолей. М.: РАМН, 2008.
Amsterdam J.D., Panossian A.G. Rhodiola rosea L. as a putative botanical antidepressant // Phytomedicine. 2016. V. 23. № 7. P. 770.
Shanmugam M.K., Lee J.H., Chai E.Z., Kanchi M.M., Kar S., Arfuso F., Dharmarajan A., Kumar A.P., Ramar P.S., Looi C.Y., Mustafa M.R., Tergaonkar V., Bishayee A., Ahn K.S., Sethi G. Cancer prevention and therapy through the modulation of transcription factors by bioactive natural compounds // Cancer Biol. 2016. V. 40–41. P. 35.
Hassan A.M., Abdel-Aziem S.H., El-Nekeety A.A., Abdel-Wahhab M.A. Panax ginseng extract modulates oxidative stress, DNA fragmentation and up-regulate gene expression in rats sub chronically treated with aflatoxin B1 and fumonisin B1 // Cytotechnology. 2015. V. 67. № 5. P. 861.
Shikov A.N., Pozharitskaya O.N., Makarov V.G., Wagner H., Verpoorte R., Heinrich M. Medicinal plants of the Russian Pharmacopoeia: their history and applications // J. Ethnopharmacol. 2014. V. 154. № 3. P. 481.
Бочарова О.А. Профилактическая онкология и фитоадаптогены // Вестн. Росс. акад. мед. наук. 2009. № 7. С. 41.
Богоявленский А.П., Алексюк П.Г., Турмагамбетова А.С. Актуальные проблемы стандартизации фитопрепаратов и растительного сырья для их производства // Фундам. исслед. 2013. № 6. С. 1184.
Бочарова О.А. Фармацевтическая композиция, проявляющая антимутагенное действие. Пат. 2477142 РФ // Бюлл. изобрет. 2013. № 7. С. 16.
Kurennaya O.N., Karpova R.V., Bocharova O.A., Kazeev I.V., Bocharov E.V. Antimutagenesis of Multiphytoadaptogene in Yeast Saccharomyces // Russ. J. Genet. 2013. V. 49. № 12. P. 1190. [Куренная О.Н., Карпова Р.В., Бочарова О.А., Казеев И.В., Бочаров Е.В., Королев В.Г. Антимутагенез мультифитоадаптогена в клетках дрожжей-сахаромицетов // Генетика. 2013. Т. 49. № 12. С. 1364.]
Бочарова О.А., Карпова Р.В., Матвеев В.Б., Аксенов А.А., Лыженкова М.А., Ершов Ф.И., Мезенцева М.В., Семернина В.В. Иммуномодулирующий и интерфероногенный эффекты комплексного фитоадаптогена при доброкачественной гиперплазии предстательной железы // Росс. биотерапевтический журн. 2004. Т. 3. № 1. С. 90.
Bocharov E.V., Kucheryanu V.G., Kryzhanovsky G.N., Belorustseva S.A., Bocharova O.A., Kudrin V.S. Effect of complex phytoadaptogen on MPTP-induced parkinson’s syndrome in mice // Bull. Exp. Biol. Med. 2006. V. 141. № 5. P. 560. [Бочаров Е.В., Кучеряну В.Г., Крыжановский Г.Н., Бочарова О.А., Кудрин В.С., Белорусцева С.А. Влияние комплексного фитоадаптогена на МФТП-индуцированный паркинсонический синдром у мышей // Бюлл. эксп. биол. мед. 2006. Т. 141. № 5. С. 495.]
Bocharova O.A., Davydov M.I., Klimenkov A.A., Baryshnikov A.Y., Karpova R.V., Chulkova S.V., Gorozhanskaya E.G., Ilyenko V.A. Prospects of using phytoadaptogen in the treatment of diffuse stomach cancer // Bull. Exp. Biol. Med. 2009. V. 48. № 1. P. 82. [Бочарова О.А., Давыдов М.И., Клименков А.А., Барышников А.Ю., Карпова Р.В., Чулкова С.В., Горожанская Э.Г., Ильенко В.А. Перспективы применения фитоадаптогена в лечении распространенного рака желудка // Бюлл. эксп. биол. мед. 2009. Т. 148. № 7. С. 96.]
Bocharova O.A., Bocharov E.V., Karpova R.V., Il’enko V.A., Kazeev I.V., Baryshnikov A.Y. Integrins LFA-1 and Mac-1 and cytokines IL-6 and IL-10 in high-cancer mice under the influence of phytoadaptogen // Bull. Exp. Biol. Med. 2014. V. 157. № 2. P. 258. [Бочарова О.А., Бочаров Е.В., Карпова Р.В., Ильенко В.А., Казеев И.В., Барышников А.Ю. LFA-1, Mac-1 интегрины и IL-6, -10 цитокины у высокораковых мышей под воздействием фитоадаптогена // Бюлл. эксп. биол. мед. 2014. Т. 157. № 2. С. 223.]
Bocharova O.A., Karpova R.V., Bocharov E.V., Solov’yov Yu.N. Effects of Phytoadaptogen on Hepatoma Development in Cancer-Prone CBA Mice // Bull. Exp. Biol. Med. 2015. V. 159. № 5. Р. 655. [Бочарова О.А., Карпова Р.В., Бочаров Е.В., Соловьев Ю.Н. Воздействие фитоадаптогена на возникновение гепатом у высокораковой линии мышей СВА // Бюлл. эксп. биол. мед. 2015. Т. 159. № 5. С. 615.]
Bocharov E.V., Karpova R.V., Bocharova O.A., Kucheryanu V.G., Shprakh Z.S. Effect of phytoadaptogen administration during early ontogeny on lifespan and somatic status of CBA mice with high incidence of tumors // Bull. Exp. Biol. Med. 2017. V. 163. № 6. Р. 789. [Бочаров Е.В., Карпова Р.В., Бочарова О.А., Кучеряну В.Г., Шпрах З.С. Продолжительность жизни и соматический статус высокораковых мышей при воздействии фитоадаптогена в раннем онтогенезе // Бюлл. эксп. биол. мед. 2017. Т. 163. № 6. С. 755.]
Бочаров Е.В., Бочарова О.А., Карпова Р.В., Кучеряну В.Г., Казеев И.В., Иноземцева Е.С., Соловьев Ю.Н., Шпрах З.С. Регуляция иммуноадгезивных взаимодействий мультифитоадаптогеном в профилактике спонтанных гепатокарцином // Росс. биотерапевтический журн. 2018. Т. 17. № 2. С. 69.
Шейченко О.П., Бочарова О.А., Крапивкин Б.А., Уютова Е.В., Карпова Р.В., Казеев И.В., Бочаров Е.В., Быков В.А. Исследование комплексного фитоадаптогена методом ВЭЖХ // Вопр. биол., мед. фарм. хим. 2012. № 10. С. 52.
Бочарова О.А., Барышников А.Ю. Фитоадаптогены в онкологии. М.: ЗооМедВет, 2004.
Shikov A.N., Pozharitskaya O.N., Makarov V.G. Aralia elata var. mandshurica (Rupr. & Maxim.) J.Wen: An overview of pharmacological studies // Phytomedicine. 2016. V. 23. № 12. P. 1409.
Карпова Р.В., Шевченко В.Е., Бочаров Е.В., Шейченко О.П., Бочарова О.А., Кучеряну В.Г., Быков В.А. Возможности использования высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией для количественного и качественного определения биологически активных веществ женьшеня в фитоэкстрактах // Росс. биотерапевтический журн. 2016. Т. 15. № 2. С. 36.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии