Теоретические основы химической технологии, 2020, T. 54, № 6, стр. 706-713
Разработка энергоэффективных технологий получения органических веществ на основе комплексного исследования реакционной и разделительной составляющей
А. В. Фролкова a, *, М. А. Маевский a, А. К. Фролкова a, Д. Б. Плетнев a
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
Москва, Россия
* E-mail: frolkova_nastya@mail.ru
Поступила в редакцию 23.04.2020
После доработки 10.07.2020
Принята к публикации 10.07.2020
Аннотация
Приведен анализ литературы по комплексному исследованию реакционной и разделительной составляющих технологий получения промышленных органических продуктов: циклогексанона, эпихлоргидрида, изопропилбензола, гликолей, метилизобутилкетона. Показаны пути возможного снижения энергозатрат за счет замены растворителей или изменения условий реакции, сочетания различных вариантов аппаратурного оформления обоих блоков. На примере смеси производства метилизобутилкетона показана зависимость энергозатрат схемы разделения от условий работы реакторного блока. Исследована структура диаграммы восьмикомпонентной системы, определены термодинамические ограничения на процесс ректификации. Для четырех составов исходной смеси (получаемых при различных условиях работы реактора) проведен расчет процесса ректификации (для схемы разделения закрепленной структуры), подобраны параметры работы колонн, обеспечивающие получение продуктов товарного качества при минимальных энергозатратах.
ВВЕДЕНИЕ
Технология основного органического синтеза относится к крупнотоннажным производствам, в результате которых получают широкий спектр соединений: мономеры для последующего синтеза высокомолекулярных соединений, органические полупродукты, растворители, антифризы и т.д. Любая химическая технология может быть представлена в виде совокупности производственных триад, состоящих из трех основных блоков: подготовка сырья, химическое превращение, разделение и очистка [1]. Все блоки связаны между собой прямыми и обратными связями (материальными и энергетическими потоками) и содержат определенное число аппаратов, в которых протекают химические, физические, физико-химические процессы. Каждому процессу свойственны свои ограничения: реакционным – термодинамические и кинетические (многомаршрутность реакций, наличие побочных реакций, невысокие скорости реакций и т.д.), разделительным – термодинамические, связанные с особенностями фазового поведения и физико-химическими свойствами разделяемых смесей (наличие азеотропов, сепаратрических многообразий, эвтектических точек, термолабильность). Структура блока химического превращения и разделительного блока тесно связана: в зависимости от условий протекания реакции, используемого сырья, растворителей могут образовываться смеси различного качественного и количественного состава. Определенному качественному составу реакционной смеси будет отвечать конкретная структура фазовой диаграммы (при закрепленных условиях). Если качественный состав смеси одинаков, но при различных условиях реакции может меняться соотношение между количествами компонентов, на выходе из блока химического превращения можно получить различные составы смеси, каждый из которых будет принадлежать области со своими особенностями протекания того или иного процесса. Одной из ключевых задач химической технологии органических веществ является поиск путей преодоления такого рода ограничений с целью создания энерго- и ресурсосберегающих технологий [1, 2]. Решение данной задачи должно осуществляться с использованием дедуктивного подхода, когда место и условия работы отдельно взятой составляющей (реакционной, разделительной) определяются общими свойствами и условиями функционирования всей химико-технологической схемы (ХТС) в целом. Декомпозиция ХТС с целью поиска оптимальных условий функционирования каждой из составляющих в отдельности, как показывает анализ литературы [1], не является эффективным методом.
Еще одной проблемой разработки ХТС получения органических продуктов является поливариантность, которая может быть связана с выбором исходного сырья, каталитической системы, растворителей, условий протекания реакции (давление, температура), выбора процессов разделения смеси, условий функционирования отдельных аппаратов и т.д. Причины возникновения поливариантности более подробно рассмотрены в работах [1, 3]. Сложность выбора оптимального технологического решения обуславливается большим числом альтернативных вариантов, характеризующихся различной структурой схем. В качестве примера можно привести схемы ректификационного разделения многокомпонентных зеотропных смесей [4], отличающиеся последовательностью выделения компонентов, фракций (использование первого, второго, промежуточного заданных разделений). При ректификации смеси различного состава каждая схема будет иметь свою область энергетического преимущества по сравнению с другими вариантами разделения.
Таким образом, актуальным является проведение исследований, позволяющих выработать критерии дискриминации вариантов технологических схем как на этапе их синтеза, так и на стадии оптимизации (параметрической или структурной [3]). В идеале оптимальным параметрам работы любой химико-технологической системы должны отвечать минимальные энергетические и капитальные затраты, максимальные выходы целевых продуктов, наиболее устойчивые режимы аппаратов, товарное качество продуктов, минимальная антропогенная нагрузка. Однако при оптимизации ХТС может возникнуть конкурентная ситуация между указанными параметрами. Эффективность работы ХТС оценивается различными количественными показателями: производительность, стоимость, капитальные, энергетические затраты [1]. В рамках настоящей работы рассматриваются энергетические затраты, поскольку последние представляют собой вторую по значимости статью в себестоимости продукции (после стоимости сырья, основных и вспомогательных материалов).
Ключевым вопросом разработки и/или совершенствования действующих производств являются вопросы энергосбережения. В США реализуется Национальная энергетическая стратегия до 2030 г., в соответствии с которой промышленный вектор страны к 2030 году должен стать на 15% энергоэффективнее. Согласно данным [5, 6] в Российской Федерации энергопотребление на тонну такой химической продукции как метанол, аммиак, карбамид в 1.5 раза, для процессов первичной переработки нефти – в 1.7 раза, каталитического крекинга – в 3.2 раза больше по сравнению с европейскими странами и США.
Технология органических веществ относится к энергоемким процессам. На блок разделения приходится в среднем около 7% общего годового энергопотребления развитых стран [6]. В первую очередь это связано с тем, что наиболее часто используемым методом разделения жидких смесей является ректификация – процесс, требующий значительных энергетических затрат. Достоинствами процесса является возможность получения продуктов высокой степени чистоты; снижение расходных норм сырья за счет регенерации непрореагировавших реагентов, вспомогательных веществ и возврата их в реакционный блок; переработки жидких отходов с целью получения дополнительных количеств и расширения ассортимента продуктов, имеющих товарную ценность. Эффективность разделения смесей во многих случаях определяет уровень энергетических и капитальных затрат для производства в целом [6].
Настоящая работа посвящена анализу результатов, в том числе полученных авторами, при комплексном исследовании реакционной и разделительной составляющей технологий конкретных органических продуктов и дальнейшему изучению влияния состава реакционной смеси на энергоемкость схем разделения.
АНАЛИЗ ТЕХНОЛОГИЙ ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ ПРОДУКТОВ
Комплексный анализ технологий проведен на примере решения ряда задач получения промышленно важных органических соединений:
циклогексанона, эпихлоргидрина (выбор растворителя для реакции и его влияние на структуру схемы разделения);
гликолей (поливариантность схем, взаимосвязь структуры реакционного и разделительного блоков);
метилизобутилкетона, изопропилбензола (выбор условий проведения реакции, связь состава реакционной смеси с энергозатратами схемы разделения).
В работе [7] приведены результаты анализа каталитического процесса получения циклогексанона (полупродукта в производстве капролактама). На сегодняшний день большую часть кетона производят из циклогексана из-за низкой себестоимости сырья. Однако такая технология не лишена недостатков, связанных с низкими показателями каталитического превращения (конверсии и селективности), образованием побочных продуктов, затрудняющих выделение целевого компонента. Кроме того, данный процесс характеризуется высокой энергоемкостью [7]. Перспективным методом получения циклогексанона может стать окисление циклогексена [8, 9]. Данный реагент является более дорогим по сравнению с циклогексаном, однако процесс, разработанный фирмой Asahi (гидрирование бензола до циклогексена), открывает новые источники доступного сырья. Реакцию окисления проводили в водной среде ацетонитрила (растворитель) [8–11] в более мягких условиях (25–100°С, атмосферное давление) по сравнению с окислением циклогексана. Процесс характеризовался высокими показателями химического превращения, побочные продукты отсутствовали. Можно констатировать, что на этом этапе были подобраны оптимальные параметры функционирования реакционного блока.
Однако при исследовании фазового поведения реакционной смеси, содержащей воду, реагент, целевой продукт и растворитель (ацетонитрил), установлено, что диаграмма парожидкостного равновесия (ПЖР) системы содержит азеотропы различной компонентности и сепаратрическую поверхность, разбивающую концентрационный симплекс на две области дистилляции [12]. Также было показано, что технологическая схема разделения смеси характеризуется сложной структурой и высокой энергоемкостью. Кроме того, выделение циклогексанона в дистилляте колонны не представлялось возможным (данный компонент обладает максимальной температурой кипения – 155°С), что негативным образом сказывалось на качестве получаемого продукта. Еще одна проблема данной технологии – регенерация катализатора: в смеси присутствуют компоненты с ограниченной взаимной растворимостью и на диаграмме расслаивания имеется область с тремя жидкими фазами [13], между которыми происходит перераспределение катализатора (катионного комплекса палладия (II)).
Был поставлен вопрос замены ацетонитрила другим растворителем, к которому предъявлялись жесткие требования: температура кипения выше 155°С, отсутствие новых азеотропов, термическая устойчивость, химическая инертность, легкость регенерации. В качестве альтернативных веществ рассматривали диметилсульфоксид, диметилацетамид, N-метил-2-пирролидон, ионные жидкости [11, 14–16]. На первом этапе анализировалась возможность выделения циклогексанона товарного качества из реакционной смеси и проводилась дискриминация растворителей: диметилацетамид и диметилсульфоксид были исключены из-за трудности их отделения от кетона [14]. N‑метил-2-пирролидон доказал свою состоятельность (предложено несколько энергоэффективных схем разделения смеси) [15]. И в настоящее время проводятся лабораторные исследования реакции окисления циклогексена в присутствии N‑метил-2-пирролидона.
Еще один пример влияния качественного состава разделяемой смеси (за счет замены растворителя реакции) на структуру схемы разделения рассмотрим для технологии получения эпихлоргидрина эпоксидированием аллилхлорида [17–19].
Данный метод также может стать альтернативой промышленным (хлоргидринным) способам получения данного соединения как метод, позволяющий снизить антропогенную нагрузку. Реакцию эпоксидирования аллилхлорида проводят в среде растворителя, в качестве которого могут рассматриваться низшие спирты (метанол, этанол, пропанол-1, пропанол-2, бутанол-1). Авторами [18, 19] исследован механизм реакции, определены основные показатели процесса. Выход целевого продукта (при 30% концентрации перекиси водорода) в присутствии указанных растворителей варьируется от 29.1 до 23.9%, причем большие значения выхода, как и начальная скорость образования эпихлоргидрина выше для метанола, этанола и пропанола-2. Содержание спирта в реакционной смеси не должно быть ниже 55 мас. % (растворитель является гомогенизатором), и не должно превышать 60 мас. %. Верхний предел обуславливается усложнением технологической схемы разделения [19]. Для дальнейшей разработки схемы получения эпихлоргидрина авторы [18, 19] выбрали метанол. Следует отметить, что в работе рассматривалась единственная структура схемы разделения.
В работах [20, 21] проведен термодинамико-топологический анализ структур диаграмм фазового равновесия [22, 23] пятикомпонентных систем, образующихся в результате получения эпихлоргидрина из аллилхлорида в присутствии каждого из вышеупомянутых спиртов. Уже на основе данного исследования из дальнейшего рассмотрения были исключены этанол, пропанол-1 и бутанол-1 [20], поскольку их присутствие в реакционных смесях требует более сложных и энергоемких схем разделения по сравнению с двумя другими системами. Для разделения реакционных смесей с метанолом и пропанолом-2 предложены новые схемы [21]. В результате расчета ректификации определены параметры работы колонн, отвечающие минимальным энергозатратам и обеспечивающие получение всех веществ требуемого качества (соответствие ГОСТ). Энергоемкость схемы разделения смеси с пропанолом-2 на 11% ниже по сравнению с метанольной системой, что позволило рекомендовать пропанол-2 как конкурентоспособный растворитель. Кроме того, авторы [21] установили, что увеличение концентрации спирта (пропанола-2) до 68 мас. % позволит еще упростить технологическую схему разделения за счет структурной оптимизации.
Комплексный подход применен при оптимизации реакционного блока и блока разделения (включающего выпарные установки и ректификационные колонны) для процесса получения гликолей некаталитической термической гидратацией окиси этилена водой [24]. Рассмотрено два варианта исполнения реакторных блоков (различная последовательность реакторов и теплообменников); два варианта схем двухкорпусных выпарных установок (прямоточного и противоточного типа), для которых выделены области рационального применения вакуума. На основе критерия минимальных энергозатрат, при которых достигается максимальный выход гликолей, для каждого типа реакторной установки подобран эффективный вариант разделения. Исследовано влияние расходов окиси этилена и воды на выход целевых продуктов реакции и показатели производства в целом. Авторами предложены технические решения, обеспечивающие снижение энергозатрат промышленных установок.
В работах [25–27] рассматривается влияние условий работы блока химического превращения на структуру и энергозатраты схемы разделения смеси получения изопропилбензола [25, 26] и метилизобутилкетона [27]. Исследуется влияние температурного режима реактора и соотношения количеств реагентов на состав смеси. В этом случае при неизменной структуре фазовой диаграммы системы на выходе из реакционного блока меняется в зависимости от величины конверсии реагентов состав смеси, подаваемой на разделение, и его принадлежность одной из подобластей ректификации [28]. В результате совместной оптимизации реакционного и разделительного блоков подобраны условия работы реактора алкилирования бензола (температура 114°С, соотношение количеств бензола и пропилена 2.5) [26], при которых образуется смесь такого состава, разделение которой происходит с наименьшими энергозатратами.
В работе [27] рассматривается газофазный процесс получения метилизобутилкетона (МИБК) из ацетона и водорода, при этом конверсия ацетона может меняться в диапазоне от 20 до 78%, селективность по МИБК – от 40 до 73% в зависимости от температурного режима реактора (диапазон изменения температуры 200–350°С) (табл. 1).
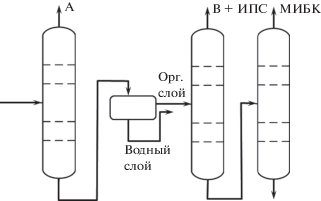
Недостатком процесса является образование большого числа побочных продуктов. Смесь, подаваемая на разделение, содержит ацетон (А), изопропанол (ИПС), воду (В), метилизобутилкетон (МИБК), мезитилоксид (МО), мезитилен (М), диацетоновый спирт (ДАС), диизобутилкетон (ДИБК). Авторы [27] предполагают, что при высокой конверсии ацетона и селективности по МИБК примеси остальных компонентов будут незначительны, что может затруднить их выделение из реакционной смеси и негативным образом сказаться на энергозатратах. Данное предположение вполне оправданно, однако, пока не нашло подтверждения (в работе [27] приведен расчет схемы разделения только для одного состава (при температуре реактора 350°С)). По этой причине в рамках настоящей работы поставлена задача оценки влияния количественного состава исходной смеси на энергозатраты конкретной схемы разделения (рис. 1).
Рассматривается схема, приведенная в [27]: на первой стадии, отделяется ацетон, далее в сепараторе происходит расслаивание кубового потока (вода отделяется в виде водного слоя, во второй колонне остаток воды вместе с изопропанолом выделяется в дистилляте (данный поток также содержит метилизобутилкетон, примеси мезитилена и ацетона), в третьей колонне происходит отделение товарного МИБК (99.81%) от тяжелокипящих примесей.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ФАЗОВОГО РАВНОВЕСИЯ И РАСЧЕТ ПРОЦЕССА РЕКТИФИКАЦИИ
В качестве метода исследования выбран вычислительный эксперимент с использованием программного комплекса Aspen Plus V.10.0. Моделирование проводится на базе уравнения NRTL, поскольку реакционная смесь содержит компоненты с ограниченной взаимной растворимостью. Восьмикомпонентная система содержит 28 бинарных составляющих. Параметры модели взяты из базы данных программного комплекса для составляющих А – ИПС (В, МИБК, МО), В – ИПС (МИБК, М, ДАС, ДИБК), для составляющей В – МО из работы [29], для остальных – оценены с использованием модели UFAC (Universal Functional Activity Coefficient) в виду отсутствия экспериментальных данных о фазовом равновесии. Адекватность математического моделирования проверялась путем сопоставления экспериментальных и расчетных азеотропных характеристик, а также данных о равновесии жидкость–жидкость в бинарных составляющих. Результаты сравнения приведены в табл. 2 и 3.
Таблица 2.
Сравнение экспериментальных [30–37] и расчетных азеотропных характеристик системы А–ИПС–В–МИБК–МО–М–ДАС–ДИБК при 101.3 кПа
| Азеотроп (1-2-3) | Расчетные значения | Ошибки описания, % | ||
|---|---|---|---|---|
| Ткип, °С | х1 (x2), мол. % | температуры | состава | |
| ИПС–В | 80.18 | 67.28 | 0.1 | 1.29 |
| В–МИБК | 88.39 | 64.89 | 0.62 | 1.08 |
| В–МО | 92.24 | 74.64 | 0.07 | 1.74 |
| В–М | 96.61 | 88.43 | 0.64 | – |
| В–ДАС | 99.92 | 97.56 | 0.42 | 0.38 |
| В–ДИБК | 97.20 | 90.36 | 0.21 | 4.57 |
| М–ДАС | 155.50 | 62.07 | – | – |
| ДАС–ДИБК | 158.89 | 46.81 | – | – |
| ИПС–В–МО | 80.04 | 61.22 (34.75) | – | – |
| В–М–ДИБК | 97.27 | 90.51 (2.17) | – | – |
| М–ДАС–ДИБК | 158.98 | 7.55 (47.44) | – | – |
Таблица 3.
Сравнение экспериментальных [29, 38–42] и расчетных данных о составах равновесных жидких фаз в бинарных составляющих системы при 101.3 кПа
| Бинарная составляющая 1-2 | Расчетные значения | Ошибки описания состава, % | |||
|---|---|---|---|---|---|
| Т, °С | $x_{1}^{'}$, мол. % | $x_{2}^{{''}}$, мол. % | водной фазы | органической фазы | |
| В–МИБК | 25 | 99.65 | 90.59 | 0.10 | 0.19 |
| В–МО | 25 | 99.71 | 80.59 | 0.35 | 1.42 |
| В–М* | 30 | 99.99 | 99.74 | 0.01 | 0.00 |
| В–ДИБК | 25 | 99.99 | 96.93 | 2.46 | 0.02 |
Относительные ошибки описания экспериментальных данных находятся в допустимых пределах (не превышают 5%), что свидетельствует о корректности вычислительного эксперимента.
Исследуемая восьмикомпонентная система (в скобках указаны температуры кипения чистых веществ) А (56.2) – ИПС (81.6) – вода (100.0) – МИБК (116.0) – МО (129.5) – М (164.6) – ДАС (168.1) – ДИБК (169.4) содержит 11 азеотропов: 8 бинарных и 3 тройных. Неустойчивым узлом на диаграмме ПЖР является ацетон (не образует азеотропов и обладает минимальной температурой кипения). Устойчивыми узлами являются точки чистых компонентов – вода, ДАС и ДИБК. Следовательно, структура фазовой диаграммы (октатопа размерности 7) содержит три области дистилляции (ректификации в режиме полного орошения), границами которых выступают две шестимерные сепаратрические гиперповерхности. Данные гиперповерхности порождаются седлами первого порядка – бинарными азеотропами вода – ДАС, вода – ДИБК (каждый из указанных бинарных азеотропов входит в состав шести трехкомпонентных составляющих, относительно которых является точкой седловидного типа) [43].
Структура технологической схемы разделения (рис. 1) вполне оправдана: на первом этапе отделяется легкокипящий ацетон, далее из системы следует удалить воду, поскольку она участвует в образовании большинства азеотропов. Остатки воды удаляются вместе с изопропанолом (данный поток содержит также МИБК и примеси А, МО). Важно, что целевой компонент – МИБК – можно выделить в дистилляте, т.е. получить продукт высокого качества.
Расчет процесса ректификации для различных исходных составов смеси (при разных условиях работы реактора: 350°С – состав 1; 300°С – состав 2; 250°С – состав 3; 200°С – состав 4) проводится при производительности по МИБК в 34.5 кмоль/ч (табл. 4).
Таблица 4.
Количество (кмоль/ч) и составы (мол. %) исходной смеси
| Количество смеси | 126.1 | 145.5 | 307.6 | 927.9 |
| Состав | Состав 1 | Состав 2 | Состав 3 | Состав 4 |
| А | 20.16 | 30.44 | 59.3 | 79.9 |
| ИПС | 4.27 | 7.66 | 10.74 | 8.37 |
| В | 40.27 | 33.22 | 15.52 | 6.05 |
| МИБК | 28.54 | 23.74 | 11.23 | 4.18 |
| МО | 0.87 | 0.72 | 0.92 | 0.63 |
| М | 0.71 | 0.6 | 0.35 | 0.14 |
| ДАС | 1.62 | 0.79 | 0.23 | 0.03 |
| ДИБК | 3.56 | 2.83 | 1.71 | 0.7 |
В результате расчета процесса ректификации (табл. 5) выбраны параметры работы колонн, отвечающие минимальным энергозатратам кипятильников колонн, при которых возможно получение ацетона с чистотой не ниже 99.1 мол. %, а МИБК – 99.8 мол. %.
Таблица 5.
Параметры работы колонн схемы, приведенной на рис. 1, для различных исходных составов (составы указаны в мол. %)
| Колонна | P, кПа | ЧТТ | ТП | R | Q, МДж | Количество дистиллята, кмоль/ч | Количество кубового продукта, кмоль/ч |
|---|---|---|---|---|---|---|---|
| Состав 1 (ΣЧТТ = 98; ΣQ = 10946.16 МДж) | |||||||
| 1 | 81.06 | 37 | 21 | 4.3 | 4121.94 | 25.41 | 100.96 |
| 2 | 101.3 | 21 | 8 | 0.6 | 1846.46 | 12.00 | 41.94 |
| 3 | 101.3 | 40 | 19 | 3.2 | 4977.76 | 33.88 | 8.06 |
| Состав 2 (ΣЧТТ = 106; ΣQ = 11681.77 МДж) | |||||||
| 1 | 81.06 | 38 | 28 | 2.9 | 4642.25 | 44.29 | 101.21 |
| 2 | 101.3 | 28 | 21 | 0.71 | 2265.55 | 17.25 | 40.24 |
| 3 | 101.3 | 40 | 19 | 3.1 | 4773.97 | 33.27 | 6.97 |
| Состав 3 (ΣЧТТ = 112; ΣQ = 28147.71 МДж) | |||||||
| 1 | 70.93 | 38 | 32 | 1.7 | 15423.0 | 182.41 | 125.19 |
| 2 | 101.3 | 34 | 29 | 1.6 | 6394.38 | 47.2 | 43.31 |
| 3 | 101.3 | 40 | 20 | 4.4 | 6330.33 | 33.57 | 9.74 |
| Состав 4 (ΣЧТТ = 102; ΣQ = 84110.81 МДж) | |||||||
| 1 | 70.93 | 33 | 26 | 1.7 | 61519.7 | 741.39 | 186.51 |
| 2 | 101.3 | 29 | 24 | 1.2 | 14525.1 | 137.5 | 47.86 |
| 3 | 101.3 | 40 | 20 | 5.8 | 8065.51 | 34.01 | 13.85 |
Первая колонна работает при пониженном давлении, что связано с необходимостью повышения относительной летучести пары компонентов ацетон–вода и выделением ацетона требуемой чистоты. Часть целевого продукта присутствует в потоке дистиллята второй колонны (потери МИБК – до 5% от исходного количества данного вещества в исходной смеси). При увеличении содержания ацетона и уменьшении концентраций остальных компонентов в смеси (при снижении конверсии ацетона как реагента) снижается эффективность использования сепаратора жидкость–жидкость, поскольку уменьшается количество водного слоя и увеличивается содержание в нем других компонентов. При этом резко возрастают энергозатраты на выделение целевого компонента.
При разделении смеси составов 1 и 2 (температура реактора 350 и 300°С) энергозатраты на разделение будут близки, а, следовательно, без учета энергозатрат вспомогательного оборудования, капитальных затрат, затрат на сырье и т.д. нельзя дать однозначный ответ о предпочтительности того или другого варианта. Однако можно утверждать, что дальнейшее понижение температуры в реакторе, приводящее к увеличению содержания ацетона в смеси, нецелесообразно. Это приведет к резкому росту энергозатрат на выделение МИБК, что негативным образом скажется на технологии в целом.
В расчетном эксперименте, нами было показано, что за счет параметрической оптимизации удалось снизить энергозатраты схемы разделения состава 1 по сравнению с результатами [27].
ЗАКЛЮЧЕНИЕ
На примере процессов получения ряда важных органических продуктов показана необходимость комплексного исследования реакционного и разделительного блока при разработке энергоэффективных технологий. При использовании такого подхода показаны пути возможного снижения энергозатрат за счет: 1) замены растворителя как реакционной среды (получение циклогексанона, эпихлоргидрина); 2) сочетания различных вариантов аппаратурного оформления обоих блоков (получение гликолей); 3) выбора условий химического превращения, приводящих к формированию состава реакционной смеси, разделение которой требует меньших энергозатрат (получение изопропилбензола, метилизобутилкетона).
Для технологии получения метилизобутилкетона предложен вариант разделения и определены статические параметры работы колонн, обеспечивающие снижение энергозатрат по сравнению с описанными в литературе.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках государственного задания по теме № 0706-2020-0020.
ОБОЗНАЧЕНИЯ
| P | давление, кПа |
| Q | энергопотребление, МДж |
| T | температура, °С |
| x | мольный состав компонента в жидкой фазе |
| х' | мольный состав компонента в водном слое |
| х'' | мольный состав компонента в органическом слое |
ИНДЕКСЫ
Список литературы
Тимофеев В.С., Серафимов Л.А., Тимошенко А.В. Принципы технологии основного органического и нефтехимического синтеза. М.: Высшая школа, 2010.
Pavlov S.Yu., Kerimov R.M., Kulov N.N. Improvement of chemical engineering processes using system analysis // Theor. Found. Chem. Eng. 2014. V. 48. № 2. P. 117.
Серафимов Л.А., Тимофеев В.С., Фролкова А.К. Качественные исследования технологических процессов и производств как этап их интенсификации на основе математического моделирования с помощью ЭВМ // Интенсиф. технол. процессов: матер., технол., оборуд. 2009. № 6. С. 9.
Львов С.В. Некоторые вопросы ректификации бинарных и многокомпонентных смесей. М.: АН СССР, 1960.
Определяя стратегии химической отрасли. К 60-летию ОАО “НИИТЭХИМ”. М.: НИИТЭХИМ, 2018.
Кулов Н.Н. инженерные проблемы повышения энергетической эффективности химико-технологических процессов и аппаратов // Сборник пленарных докладов. МНТФ “Первые Косыгинские чтения”. 2017. С. 26.
Frolkova A.K., Mayevskii M.A., Oshanina I.V., Frol-kova A.V. Cyclohexanone: The Main Methods of Obtaining and Extracting Target Products from a Reaction Mixture // Theor. Found. Chem. Eng. 2018. V. 52. № 4. P. 653. [Фролкова А.К., Маевский М.А., Ошанина И.В., Фролкова А.В. Циклогексанон. Основные методы получения и выделения целевого продукта из реакционной смеси // Хим. технол. 2017. Т. 18. № 6. С. 242.]
Темкин О.Н., Брук Л.Г., Кацман Е.А. и др. Кинетические оссобенности реакции окисления циклогексена п-хинонами в водно-органических растворах катионных комплексов палладия (II) // Кинет. катал. 2010. Т. 51. № 5. С. 715.
Темкин О.Н., Фролкова А.В., Захарова Д.С., Брук Л.Г. и др. Влияние состава бинарного растворителя CH3CN-H2O на кинетику окисления циклогексена п-бензохиноном в растворах катионных комплексов палладия (II) // Тонкие хим. технол. 2015. Т. 10. № 3. С. 77.
Martynov I.V., Efremov G.E., Bovyrina E.A. The Mechanism and Kinetic Models of the Catalytic Oxidation of Ethylene by p-Benzoquinone in Aqueous–Acetonitrile Solutions of Pd(II) Cationic Complexes // Kinet. Catal. 2018. V. 59. P. 436. [Мартынов И.В., Ефремов Г.Е., Бовырина Е.А., Кацман Е.А., Темкин О.Н. Механизм и кинетические модели каталитического окисления этилена пара-бензохиноном в водно-ацетонитрильных растворах катионных комплексов Pd(II) // Кинет. катал. 2018. Т. 59. № 4. С. 427.]
Efremov G.E., Bovyrina E.A., Podtyagina A.V. Oshanina I.V., Temkin O.N. Ethylene and Cyclohexene Oxidation by p-Benzoquinone, Hydrogen Peroxide, and Oxygen in the Solutions of Cationic Pd(II) Complexes in Acetonitrile–Water and Ionic Liquid–Water Binary Solvents // Kinet. Catal. 2019. V. 60. P. 52. [Ефремов Г.Е., Бовырина Е.А., Подтягина А.В., Ошанина И.В., Темкин О.Н. Окисление этилена и циклогексена n-бензохиноном, пероксидом водорода и кислородом в растворах катионных комплексов Pd(II) в бинарных растворителях ацетонитрил–вода и ионная жидкость–вода // Кинет. катал. 2019. Т. 60. № 1. С. 54.]
Фролкова А.В., Балбенов С.А., Фролкова А.К., Акишина А.А. Исследование фазового равновесия в системе вода–ацетонитрил–циклогексен–циклогексанон // Изв. Акад. наук. Сер. хим. 2015. № 10. С. 2330.
Frolkova A., Zakharova D., Frolkova A., Balbenov S. Liquid–liquid and liquid–liquid equilibrium for ternary system water–acetonitrile–cyclohexene at 298.15 K // Fluid Phase Equilib. 2016. V. 408. P. 10.
Frolkova A.V., Mayevskiy M.A., Frolkova A.K. Analysis of Phase Equilibrium Diagrams of Cyclohexene + Water + Cyclohexanone + Solvent System // J. Chem. Eng. Data. 2018. V. 63. № 3. P. 679.
Frolkova A.V., Mayevskiy M.A., Smirnov A.Y. Phase Equilibrium of Systems Cyclohexene + Water + Cyclohexanone + N-Methyl-2-pyrrolidone (+Acetonitrile) // J. Chem. Eng. Data. 2019. V. 64. № 6. P. 2888.
Zhuchkov V., Frolkova A., Nazanskiy S. Experimental measurements of mutual solubility of cyclohexanone, cyclohexene and ionic liquid // Chem. Pap. 2018. V. 72. P. 1107.
Сулимов А.В., Данов С.М., Овчарова А.В., Обрывалина А.Н., Теляшев Р.Г., Овчаров А.А., Балашов А.Л. Инновационные процессы получения эпихлоргидрина // Нефтегазохимия. 2013. № 1. С. 32.
Данов С.М., Сулимов А.В., Сулимова А.В. Влияние природы растворителя на процесс эпоксидирования аллилхлорида пероксидом водорода на титан-содержащем силикате // Ж. прикл. хим. 2008. Т. 81. № 11. С. 1847.
Овчарова А.В. Разработка технологии получения эпихлоргидрина. Автореф. дис. … канд. хим. наук. М.: РХТУ им. Д.И. Менделеева, 2012.
Frolkova A.V., Okhlopkova E.A., Frolkova A.K. Phase Equilibrium of Reaction Mixtures for the Production of Epichlorohydrin in the Presence of Solvents // Theor. Found. Chem. Eng. 2019. V. 53. P. 185. [Фролкова А.В., Охлопкова Е.А., Фролкова А.К. Фазовое равновесие реакционных смесей получения эпихлоргидрина в присутствии растворителей // Теор. осн. хим. технол. 2019. Т. 53. № 2. С. 138.]
Okhlopkova E.A., Frolkova A.V. Comparative Analysis of Separation Schemes of Reaction Mixtures of Epichlorohydrin Production in the Presence of Various Solvents // Theor. Found. Chem. Eng. 2019. V. 53. P. 1028. [Охлопкова Е.А., Фролкова А.В. Сравнительный анализ схем разделения реакционных смесей получения эпихлоргидрина в присутствии различных растворителей // Теор. осн. хим. технол. 2019. Т. 53. № 6. С. 681.]
Serafimov L.A. Thermodynamic and Topological Analysis of Heterogeneous Equilibrium Diagrams of Multicomponent Mixtures // Zh. Fiz. Khim. 2002. V. 76. № 8. P. 1351.
Serafimov L.A. State of the art in the thermodynamic and topological analysis of phase diagrams // Theor. Found. Chem. Eng. 2009. V. 43. P. 268.
Латыйпов Р.М., Осипов Э.В., Теляков Э.Ш. Системный анализ аппаратурно-технологического оформления производств гликолей // Теор. осн. хим. технол. 2017. Т. 51. № 6. С. 637.
Чудинова А.А., Нурмаканова А.Е., Салищева А.А., Ивашкина Е.Н., Гавриков А.А. Влияние технологических параметров работы реактора алкилирования на концентрацию н-пропилбензола в продуктовой смеси // Хим. интересах устойч. развит. 2014. № 22. С. 569.
Чудинова А.А. Оптимизация работы реактора и блока ректификационного разделения продуктов процесса жидкофазного алкилирования бензола пропиленом для повышения качества и увеличения выхода изопропилбензола. Автореф. дис. … канд. техн. наук. Томск: НИТПУ, 2016.
Al-Rabiah A.A., Bagabas A.A., Akhmedov V.M. Low pressure one-step gas-phase process for production of methyl isobutyl ketone. Pat. 2532642 EP. 2017.
Жаров В.Т., Серафимов Л.А. Физико-химические основы дистилляции и ректификации. Л.: Химия, 1975.
Liu D., Li L., Lv R., Chen Y. Liquid−Liquid Equilibria for the Ternary System Mesityl Oxide + Phenol + Water at 298.15, 313.15, and 323.15 K // J. Chem. Eng. Data. 2016. V. 61. № 7. P. 2493.
Rawat B.S., Krlshna S. Isobaric Vapor-Liquid Equilibria for the Partially Miscible System of Water-Methyl Isobutyl Ketone // J. Chem. Eng. Data. 1984. V. 29. № 4. P. 403.
Огородников С.К., Лестева Т.М., Коган В.Б. Азеотропные смеси. Л.: Химия, 1971.
Tochigi K., Inoue H., Kojima K. Determination of azeotropes in binary systems at reduced pressures // Fluid Phase Equilib. 1985. V. 22. P. 343.
Jungho C., Jong-Ki J. Optimization study on the azeotropic distillation process for isopropyl alcohol dehydration // Korean J. Chem. Eng. 2006. V. 23. № 1. P. 1.
Tae-hwan C., Kenji O., Kazuo K. Measurement of vapor-liquid equilibrium for systems with limited miscibility // Fluid Phase Equilib. 1983. V. 11. P. 137.
Feng Y., Song H., Xiao M., Lin K., Guo K., Gai H. Development of Phenols Recovery Process from Coal Gasification Wastewater with Mesityl Oxide as a Novel Extractant // J. Cleaner Prod. 2017. V. 166. P. 1314.
Hack C.W., Van Winkle M. Vapor-Liquid Equilibria of the Diacetone Alcohol-Water System at Subatmospheric Pressures // Ind. Eng. Chem. 1954. V. 46. № 11. P. 2392.
Yakhyaev M.A., Gutenkov V.S., Cardona C.A., Pisarenko Yu.A. Development of Reaction-Rectification Process of Obtaining Mesityl Oxide. II. Analysis of Statics and Modeling of the Process // Fine Chem. Technol. 2019. V. 14. № 2. P. 23 [Яхьяев М.А., Гутенков В.С., Кардона К.А., Писаренко Ю.А. Разработка реакционно-ректификационного процесса получения окиси мезитила. II. Анализ статики и моделирование процесса // Тонкие хим. технол. 2019. Т. 14. № 2. С. 23.]
Yang C., Qian Y., Guo J., Chen J., Peng J. Liquid−Liquid Equilibria for the Ternary System Methyl Isobutyl Ketone + m‑Benzenediol + Water // J. Chem. Eng. Data. 2014. V. 59. P. 3324.
Yang C., Qian Y., Jiang Y., Zhang L. Liquid–liquid equilibria for the quaternary system methyl isobutyl ketone–water–phenol–hydroquinone // Fluid Phase Equilib. 2007. V. 258. P. 73.
Tan Y., Guo C., Qian Y., Yang S. Liquid−Liquid Equilibrium for Ternary Systems of 2‑Pentanone/ Mesityl Oxide + Catechol + Water at 298.2, 318.2, and 333.2 K // J. Chem. Eng. Data. 2018. V. 63. № 8. P. 3117.
Chen H., Wagner J. Mutual Solubilities of Alkylbenzene + + Water Systems at Temperatures from 303 to 373 K: Ethylbenzene, p-Xylene, 1,3,5=Trimethylbenzene, and Butylbenzene // J. Chem. Eng. Data. 2018. V. 39. P. 679.
Ozmen D. (Liquid + liquid) equilibria of (water + propionic acid + methyl isoamyl ketone or diisobutyl ketone or ethyl isoamyl keton) at T = 298.2K // Fluid Phase Equilib. 2006. V. 250. P. 70.
Serafimov L., Frolkova A. Determination of vapor—liquid equilibrium diagrams of multicomponent systems // Chem. Pap. 2016. V. 70. P. 1578.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии