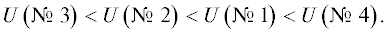Теоретические основы химической технологии, 2021, T. 55, № 5, стр. 642-651
Разработка электродных наноматериалов для щелочного электролиза воды
М. В. Лебедева a, А. П. Антропов a, А. В. Рагуткин a, Н. К. Зайцев a, Н. А. Яштулов a, *
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
Москва, Россия
* E-mail: yashtulovna@mail.ru
Поступила в редакцию 08.04.2021
После доработки 27.04.2021
Принята к публикации 27.04.2021
Аннотация
Разработаны энергоэффективные биметаллические электродные нанокомпозитные материалы для мембранно-электродных блоков процесса щелочного электролиза воды. Исследование наноматериалов осуществлялось методами атомно-силовой, растровой и высокоразрешающей просвечивающей электронной микроскопии. Оценка энергоэффективности генерации водорода и кислорода производилась на испытательном стенде щелочного электролиза воды. Установлена оптимальная загрузка платиновых металлов и температурный режим работы мембранно-электродных блоков для достижения повышенных параметров плотности тока, ресурса работы щелочного электролизера воды, а также наименьших значений перенапряжения генерации водорода и кислорода. В данной работе продемонстрирована возможность разработки мембранно-электродных блоков для щелочного электролиза воды на основе электродов из пористого никеля, модифицированных биметаллическими наночастицами платина–никель и палладий–никель.
ВВЕДЕНИЕ
В промышленных установках электролиза воды реакции выделения водорода и, особенно, кислорода протекают с высокими энергозатратами вследствие электродных перенапряжений, что вызывает интенсивную деградацию электрокатализаторов, в том числе металлов платиновой группы, и приводит к увеличению их удельного расхода [1–3]. Для обеспечения длительного ресурса работы электролизеров в промышленных масштабах возникает необходимость загрузки катализаторов с многократным запасом [4–10]. Электролиз воды является практически единственным процессом непосредственного получения водорода и кислорода высокой степени чистоты [1–3, 11–18]. Водород высокой степени чистоты (более 99.9%) требуется в качестве высокоэффективного энергоносителя в каталитических процессах альтернативных источников энергии. Генерация кислорода высокой степени чистоты необходима для систем жизнедеятельности автономных объектов, в том числе пилотируемых подводных и аэрокосмических аппаратов, в медицине, например для приборов искусственной вентиляции легких. К наиболее перспективным автономным источникам тока для энергоснабжения процессов и аппаратов химической технологии следует отнести водородно-кислородные топливные элементы повышенной мощности. Топливные элементы позволяют осуществлять стабильное и бесперебойное энергоснабжение процессов и аппаратов химической технологии в аварийных и резервных режимах эксплуатации [5, 7, 10].
Для электрохимического преобразования воды в водород и кислород применяют три разновидности процесса электролиза: щелочной электролиз воды (ЩЭВ), электролиз с протонообменной мембраной и электролиз с твердым оксидным электролитом. Среди различных вариантов доступных химико-технологических установок ЩЭВ является наиболее оптимальным и распространенным вариантом при функционировании топливных элементов [1–3, 11, 12, 15, 18, 19]. При щелочном электролизе воды согласно уравнениям (1) и (2) на катоде выделяется водород, а на аноде – кислород:
(1)
${\text{катод}}{\kern 1pt} :{\text{ }}2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\bar {e}} \to {{{\text{H}}}_{2}} + 2{\text{O}}{{{\text{H}}}^{-}};\,\,\,{{E}^{0}} = -0.8280\,\,{\text{В}},$(2)
$анод:2O{{H}^{ - }} - 2\bar {e} \to 1{{} \mathord{\left/ {\vphantom {{} {}}} \right. \kern-0em} {}}2{{O}_{2}} + {{H}_{2}}O;{{E}^{0}} = 0.4011B,$(3)
${\text{электрохимическая реакция}}{\kern 1pt} :{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {{{\text{H}}}_{2}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}};\,\,{{E}^{0}} = 1.2291{\text{ В}}.$К преимуществам электролизеров ЩЭВ можно отнести высокую чистоту генерируемых водорода и кислорода, экологическую бозопасность, высокую плотность тока и, следовательно, высокую производительность, возможность работы при высоких температурах и давлениях. Главными недостатками электролизеров ЩЭВ являются высокое энергопотребление и деградация электрокатализаторов, что ограничивает ресурс и стабильность работы электролизной системы. В связи с этим актуальной задачей становится разработка высокоэффективных электродов на основе матриц-носителей с высокой активной поверхностью и минимальной загрузкой металлов платиновой группы. Кроме металлов платиновой группы при ЩЭВ используются катализаторы, содержащие никель, железо, кобальт, марганец, в том числе в наноразмерном состоянии [12, 13, 16–21]. Одним из перспективных направлений повышения каталитической активности при снижении загрузки платиновых металлов является применение в качестве матриц-носителей пористого никеля [12, 13, 16–22]. Пористый никель характеризуется высокими показателями площади удельной поверхности, электронной проводимости, стабильности и относительно низкой стоимостью. В данной работе пористый никель формировался темплатным синтезом в размерозадающей маске металлического алюминия [23]. Модификация поверхности пористого никеля проводилась каталитически активными наночастицами платины, палладия и никеля с малой загрузкой платиновых металлов. Цель исследования состояла в разработке энергоэффективных биметаллических электродных нанокомпозитных материалов для мембранно-электродных блоков процесса щелочного электролиза воды.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез электродных материалов. Биметаллические нанокомпозиты платина–никель (Pt–Ni) и палладий–никель (Pd–Ni) на матричной подложке из пористого никеля (ПН) были синтезированы в качестве электродов ЩЭВ. Метод синтеза представляет собой совместное восстановление солей платины и никеля, а также солей палладия и никеля в водных пулах обращенных микроэмульсий. Для стабилизации микроэмульсии использовали неионогенный ПАВ – Тритон Х-100 (Sigma Aldrich, США). Циклогексан служил масляным компонентом растворов микроэмульсий. Водный раствор тетрагидробората натрия NaBH4 применяли в качестве восстановителя [5, 8, 9]. Прекурсорами для синтеза наночастиц выступали водные растворы K2PtCl4, PdCl2 и NiCl2 (Sigma Aldrich, США). Мольное соотношение биметаллических частиц составляло 1 : 1. Микроэмульсии перемешивали с помощью магнитной мешалки с использованием ультразвукового (УЗ) воздействия в течение 3–5 мин. Значение коэффициента солюбилизации (ω), равное мольному соотношению вода : ПАВ, варьировали от 1.5 до 8.
В качестве матрицы композитных электродов использовали пористый никель толщиной 2 мм, средний размер пор – 10–45 мкм, синтезированный на основе реплики металлического алюминия [23]. Для модификации поверхности образцы ПН помещали в колбу с водно-органическим раствором биметаллических наночастиц платиновых металлов и подвергали УЗ-воздействию в течение 7 мин. Затем модифицированный ПН отмывали от следов поверхностно-активного вещества и растворителя этиловым спиртом и дистиллированной водой.
Методы исследования наноматериалов. Определение структуры и размеров наночастиц проводили с помощью атомно-силовой микроскопии на приборе NTegra Prima (NT-MDT, Россия). Для исследования поверхности электродов применялся растровый электронный микроскоп JSM-7401F (Jеol, Япония) с анализатором INCA (Oxford Instruments, Англия), а также просвечивающий электронный микроскоп высокого разрешения Zeiss Libra 200FE (Carl Zeiss, Германия).
Установка щелочного электролиза воды. Для оценки электрокаталитических параметров использовалась сертифицированная установка электролизера 600 Electrolyzer Test System (600 ETS) (Scribner Associates, Inc., США). Установка 600 ETS состоит из следующих компонентов: контроллер (600 ETS Controller) с многодиапазонным потенциостатом со встроенным анализатором частот для измерений импеданса и высокочастотных измерений; программируемый источник питания (100 А, +5 В); стенд с подачей продувочного газа, резервуаром для электролита и насосом, контролем расхода продуктов H2 и O2, резервуарами для сбора конденсата и регулятором обратного давления; модуль 892e Data Expansion для дополнительного контроля температуры, включая датчики контроля содержания H2 и O2.
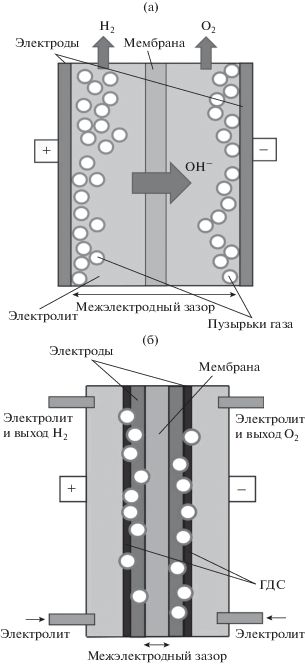
Электрическое подключение контроллера к испытательному стенду осуществлялось с помощью следующих элементов: а) базовых кабелей для положительного тока (I+) и отрицательного тока (I–); б) силовых кабелей для: общего напряжения всей установки – положительное напряжение (V+) и отрицательное напряжение (V–) и вспомогательного напряжения – положительный (В+) и отрицательный (В–) кабель (рис. 1).
Рис. 1.
Схема подключения двухэлектродной (а) и трехэлектродной (б) ячейки: В – вспомогательный электрод, С – электрод сравнения, СК – силовой кабель, “+” – положительный электрод (анод), “–” – отрицательный электрод (катод).
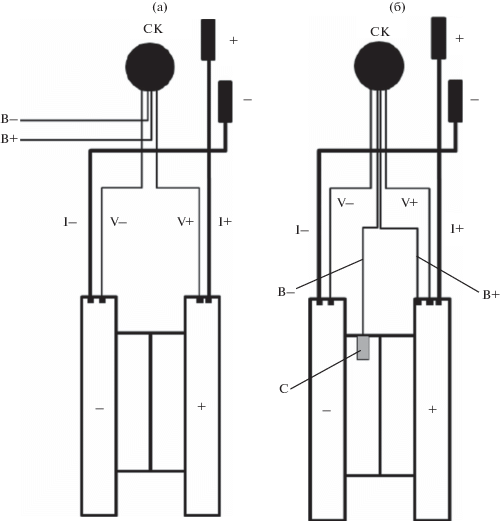
Силовой кабель отрицательного напряжения (В–) подключается к электроду сравнения. Силовой кабель положительного напряжения должен быть соединен непосредственно с положительной торцевой пластиной или коллектором тока, поскольку он обеспечивает контрольную точку измерений потенциалов электродов электролизных ячеек ЩЭВ (рис. 1а, 1б).
Основным компонентом электролизной ячейки является мембранно-электродный блок (МЭБ). МЭБ состоит из полимерной мембраны (диафрагмы), анодного и катодного каталитических слоев, газодиффузионных электродов. Кроме МЭБ электролизная ячейка содержит коллекторы тока, фланцы циркуляции электролита, гофрированные газоотводы водорода и кислорода, штуцеры подвода и отвода теплоносителя к МЭБ, прокладки и уплотнители.
При исследовании ЩЭВ применялись два варианта конфигураций схем подключения электролизной ячейки к установке электролизера 600 ETS – двух- либо трехэлектродный вариант. Регистрация данных вольтамперных характеристик и ресурсных испытаний МЭБ в составе ячеек электролизеров генерации водорода и кислорода проводилась по двухэлектродной схеме (рис. 1а, 1б).
Параметры напряжения на электродах при выделении водорода на катоде и выделении кислорода на аноде были получены с помощью трехэлектродной схемы подключения (рис. 1б), конфигурация которой включает в себя электрод сравнения и вспомогательный электрод – платиновую пластину (рис. 1б). Трехэлектродная ячейка дает возможность одновременно проводить измерения напряжения как на отрицательном, так и положительном электроде (“half-cell” тест). При оценке электрокаталитической активности катодов использовался хлоридсеребряный электрод сравнения, для анодов – ртутно-оксидный электрод сравнения.
Сборка мембранно-электродного блока. Мембранно-электродные блоки ЩЭВ состояли из газодиффузионных биметаллических электродов на основе ПН с размерами 7 × 7 см и коммерческой анионообменной мембраны Sustainion® X37-50 (Fuel Cell Store, США), спрессованной между анодом и катодом [14]. Температура МЭБ контролировалась с помощью внешнего электронагревателя (25–80°С). Для приготовления 7 М раствора электролита использовался гидроксид калия KOH х.ч. по ГОСТ 24363-80 и деионизованная вода. Стабильность работы МЭБ в процессе электролиза воды проверялась при плотностях тока от 0.05 до 0.6 А/см2 на установке 600 ETS.
В современных электролизерах преимущественно применяются конструкции МЭБ двух типов – стандартный (рис. 2а) и с “нулевым зазором” (рис. 2б) [19, 21]. Конструкция с “нулевым зазором” эффективно используется при высоких плотностях тока в электролизерах с повышенной производительностью. К недостаткам электролизеров с “нулевым зазором” следует отнести необходимость эффективного удаления газообразных продуктов от электродов. В настоящей работе использовали стандартный вариант (рис. 2а), отличающийся простотой сборки и минимальной деградацией электролита. Реализация необходимого газоотвода водорода и кислорода от электродов обеспечивалась применением в качестве электродных матриц пористого никеля с развитой системой пор.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
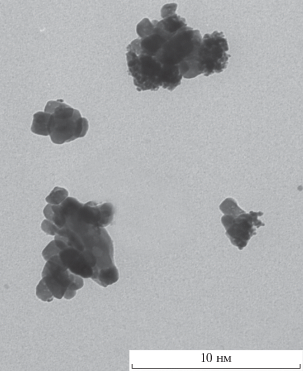
Исследования параметров электролизеров ЩЭВ проводились для электродных материалов на основе матриц ПН, модифицированных биметаллическими наночастицами платины, палладия и никеля. Электродные биметаллические наночастицы платина–никель для анода и палладий–никель для катода получали одновременным восстановлением соответствующих ионов металлов в водных пулах обращенных микроэмульсий. Под действием ультразвуковой обработки наночастицы адсорбировались в микропорах электродной матрицы пористого никеля. На рис. 3–5 в качестве примеров приведены микрофотографии биметаллических наночастиц Pt–Ni и Pd–Ni при различных ω, которые обосновывают формирование биметаллических нанокомпозитов определенных размеров, приведенных в табл. 1.
Таблица 1.
Размеры нанокомпозитов на основе ПН по данным РЭМ и ВРПЭМ
| Нанокомпозит | d, нм | |||
|---|---|---|---|---|
| ω = 1.5 | ω = 3 | ω = 5 | ω = 8 | |
| Pt–Ni/ПН | 2.6–3.4 | 3.3–3.9 | 3.7–4.4 | 3.8–7.0 |
| Pd–Ni/ПН | 2.1–2.7 | 2.8–3.5 | 3.2–4.0 | 4.1–6.4 |
| Pt–ПН | 3.3–4.8 | 4.0–5.6 | 4.9–6.5 | 5.5–8.3 |
| Pd–ПН | 2.5–3.7 | 3.2–4.4 | 3.6–5.3 | 4.8–7.1 |
На рис. 3 представлена микрофотография атомно-силовой микроскопии (АСМ) биметаллических наночастиц палладий–никель при коэффициенте солюбилизации ω = 3. Размеры наночастиц при ω = 3 составляют 2.5–4 нм. По мере увеличения коэффициента солюбилизации ω до 8 размеры наночастиц палладий–никель и платина–никель возрастали до 6–8 нм. Варьируя условия синтеза при изменении величины коэффициента солюбилизации ω, можно контролировать размер наночастиц.
На рис. 4 приведена микрофотография растровой электронной микроскопии (РЭМ) образца пористого никеля, модифицированного биметаллическими наночастицами платина–никель. Размер микропор никеля варьируется от 10 до 45 мкм. Массовая загрузка платины и никеля составляет 1.0 мг/см2. Для подтверждения внедрения наночастиц платины и палладия в объем ПН проведено исследование нанокомпозитов методами высокоразрешающей просвечивающей электронной микроскопии (ВРПЭМ) и энергодисперсионной рентгеновской спектроскопии (EDAX).
На рис. 5 представлен снимок, полученный методом ВРПЭМ, пористого никеля, модифицированного наночастицами платина–никель, синтезированных при коэффициенте солюбилизации ω = 8.
В табл. 1 приведены размеры нанокомпозитов на основе платиновых металлов и никеля по данным методов РЭМ и ВРПЭМ.
Данные табл. 1 показывают, что размеры биметаллических наночастиц платина–никель и палладий–никель в составе пористого никеля возрастают при увеличении коэффициента ω от 1.5 до 8. Биметаллические наночастицы имеют меньшие размеры, чем соответствующие монометаллические, вероятно, вследствие отличия атомных радиусов платиновых металлов и никеля.
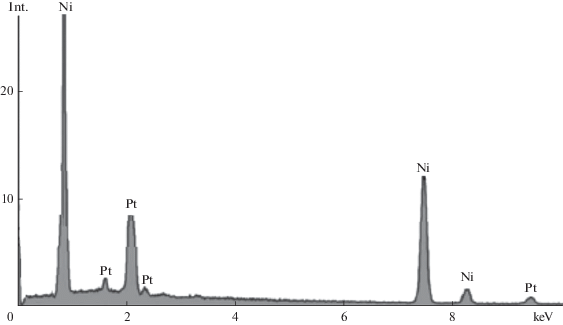
На EDAX-спектре биметаллического композита Pt–Ni/ПН (рис. 6) четко видно наличие пиков платины и никеля. Результаты EDAX свидетельствуют об образовании электродных биметаллических нанокомпозитов Pt–Ni/ПН и Pd–Ni/ПН в микропорах ПН и отсутствии оксидных форм металлов.
В работе проведено исследование влияния загрузки биметаллических катализаторов Pt–Ni, Pd–Ni на основе ПН на стабильность и величину перенапряжения в мембранно-электродных блоках щелочных электролизеров воды.
Одной из основных характеристик работы мембранно-электродных блоков является показатель удельного энергопотребления процесса ЩЭВ (W, (кВт ч)/(м3 Н2)), который определяется величиной мощности процесса электролиза (P, кВт), затрачиваемой на единицу объема генерируемого водорода:
где I – сила тока в МЭБ, А; Uн – величина номинального напряжения процесса электролиза, В.При прохождении через МЭБ электрического тока потенциал каждого из электродов изменяется из-за дополнительных энергозатрат при компенсации замедленного переноса электрических зарядов. Таким образом, увеличение плотности тока вызывает увеличение напряжения и энергозатрат процесса электролиза. Изменение потенциала электрода, вызванное протеканием через систему электрического тока, относительно его величины в отсутствие тока называется перенапряжением:
где Uj – напряжение при протекании электрического тока, U0 – напряжение в отсутствие электрического тока. Перенапряжение η выделения водорода и кислорода можно рассчитать по уравнению Тафеля [24 ] : где j – рабочая плотность тока, А/см2; j0 – плотность тока обмена, А/см2; b – константа, зависящая от температуры, В. Перенапряжение реакции выделения водорода и кислорода определяет как величину напряжения МЭБ, так и энергопотребление процесса ЩЭВ в целом.На рис. 7 и 8 представлены экспериментальные зависимости перенапряжения выделения кислорода и водорода от плотности тока для образцов гладкого и пористого никеля, а также биметаллических нанокатализаторов Pt–Ni и Pd–Ni. Рисунок 7 демонстрирует значительное снижение величины катодного перенапряжения выделения водорода для электродов на основе палладия по сравнению с немодифицированным ПН (до 120 мВ) и, особенно, образца электрода на основе гладкого полированного никеля (до 330 мВ). В соответствии с рис. 8 наблюдается существенное снижение величины анодного перенапряжения выделения кислорода для электродов на основе платины по сравнению с немодифицированным ПН (до 180 мВ) и, особенно, образца электрода на основе гладкого полированного никеля (до 350–450 мВ).
Рис. 7.
Поляризационные кривые катодного выделения водорода для электродов: а – из гладкого никеля (анод и катод); б – на основе ПН (анод и катод); в – анод на основе ПН с наночастицами платины (ms = 0.8 мг/см2), катод на основе ПН с наночастицами палладия (ms = 0.4 мг/см2); г – анод на основе ПН с наночастицами платины (ms = = 1.5 мг/см2), катод на основе ПН с наночастицами палладия (ms = 1.0 мг/см2). Электролит – 7 М КОН, t = 80°C, p = 1 бар.
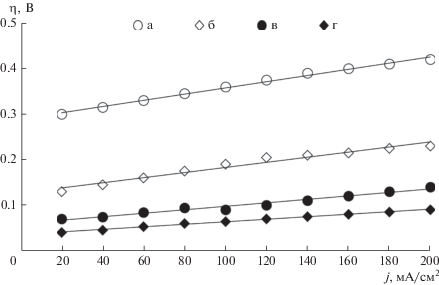
Уменьшение величины перенапряжения выделения водорода (рис. 7) и кислорода (рис. 8 ) для биметаллических электродов относительно монометаллических никелевых электродов вызвано увеличением токов обмена j0 (уравнение (4)) при использовании электрокатализаторов в высокоактивном наноразмерном состоянии [17, 24 ] . В результате величину наименьшего анодного и катодного перенапряжения продемонстрировали электроды на основе ПН, модифицированные биметаллическими наночастицами платины и палладия.
Рис. 8.
Поляризационные кривые анодного выделения кислорода для электродов: а – из гладкого никеля (анод и катод); б – на основе ПН (анод и катод); в – анод на основе ПН с наночастицами платины (ms = 0.8 мг/см2), катод на основе ПН с наночастицами палладия (ms = 0.4 мг/см2); г – анод на основе ПН с наночастицами платины (ms = = 1.5 мг/см2), катод на основе ПН с наночастицами палладия (ms = 1.0 мг/см2). Электролит – 7 М КОН, t = 80°C, p = 1 бар.
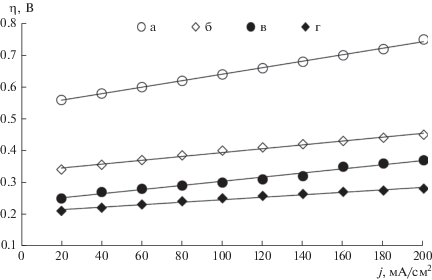
Для дальнейших испытаний стабильности генерации водорода и кислорода были рассмотрены четыре варианта МЭБ с различной загрузкой платины и палладия на аноде и катоде соответственно. Испытания МЭБ проводились в течение 160 ч при повышенных температурах (60 и 80°С) и высоких плотностях тока от 100 до 500 мА/см2, характерных для промышленных электролизеров ЩЭВ:
вариант 1: загрузка платинового катализатора (анод) ms = 0.8 мг/см2, загрузка палладиевого катализатора (катод) ms = 0.4 мг/см2;
вариант 2: загрузка платинового катализатора (анод) ms = 1.0 мг/см2, загрузка палладиевого катализатора (катод) ms = 1.0 мг/см2;
вариант 3: загрузка платинового катализатора (анод) ms = 1.5 мг/см2, загрузка палладиевого катализатора (катод) ms = 1.0 мг/см2;
вариант 4: загрузка платинового катализатора (анод) ms = 0.5 мг/см2, загрузка палладиевого катализатора (катод) ms = 0.5 мг/см2.
Средние размеры наночастиц платины и палладия составили 2–4 и 3–5 нм соответственно.
На рис. 9 и в табл. 2 представлены экспериментальные зависимости напряжения вариантов МЭБ во времени при температуре 80 и 60°С и фиксированной плотности тока 500 мА/см2.
Рис. 9.
Зависимость напряжения вариантов МЭБ от времени работы ЩЭВ при плотности тока 500 мА/см2 (температура 80оС): а – вариант 1, б – вариант 2, в – вариант 3, г – вариант 4.
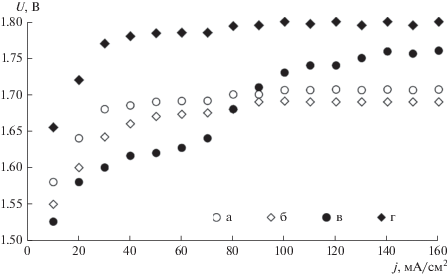
Таблица 2.
Зависимость напряжения четырех вариантов МЭБ от времени работы при плотности тока 500 мА/см2 (температура 60°С)
| Время работы, ч | Варианты МЭБ | |||
|---|---|---|---|---|
| № 1 | № 2 | № 3 | № 4 | |
| 10 | 1.631 | 1.604 | 1.576 | 1.708 |
| 20 | 1.690 | 1.642 | 1.602 | 1.755 |
| 30 | 1.705 | 1.659 | 1.619 | 1.801 |
| 40 | 1.722 | 1.676 | 1.627 | 1.817 |
| 50 | 1.730 | 1.683 | 1.638 | 1.820 |
| 60 | 1.731 | 1.690 | 1.656 | 1.821 |
| 70 | 1.744 | 1.708 | 1.701 | 1.834 |
| 80 | 1.753 | 1.723 | 1.755 | 1.844 |
| 90 | 1.750 | 1.731 | 1.788 | 1.846 |
| 100 | 1.756 | 1.741 | 1.798 | 1.850 |
| 150 | 1.764 | 1.744 | 1.810 | 1.845 |
Каждый из четырех вариантов МЭБ продемонстрировал сходные тенденции при изменении температуры от 60 (рис. 9) до 80°С (табл. 2). Напряжение на каждом варианте МЭБ уменьшалось при увеличении температуры в соответствии с теоретическим значением температурного коэффициента процесса электролиза воды при фиксированной плотности тока:
В первой стадии ресурсных испытаний (до 70–80 ч) значения напряжения во всех четырех вариантах загрузки МЭБ соответствовали содержанию электрокаталитически активных металлов платиновой группы. При повышении содержания металлов платиновой группы напряжение на МЭБ уменьшалось в следующем ряду:
Однако на второй стадии ресурсных испытаний (более 80–90 ч) напряжение на МЭБ в варианте № 3 с максимальным содержанием платины и палладия возрастало до 1.72–1.74 при 80°С. В то же время величина напряжения МЭБ варианта № 2 с повышенным содержанием палладия на катоде практически совпадала с напряжением МЭБ варианта № 1 (1.68–1.69 В) с меньшим содержанием палладия при 80°С. При длительных режимах работы (более 110–120 ч) наблюдалась стабилизация напряжений всех МЭБ в диапазоне 1.68–1.80 В при 80°С и 1.74–1.85 при 60°С. Минимальная величина напряжения при относительно низкой загрузке платиновых металлов и стабильность при ресурсных испытаниях характерна для варианта № 1 МЭБ ЩЭВ.
Возрастание напряжения МЭБ образцов № 2 и 3 с повышенным содержанием платины и палладия в диапазоне 70–110 ч ресурсных испытаний объясняется по данным ВРЭПЭМ, РЭМ и энергодисперсионного анализа частичной агломерацией биметаллических наночастиц платина–никель и палладий–никель. Агломерация наночастиц приводит к уменьшению их каталитической активности и дестабилизации при выделении газообразных водорода и кислорода.
В результате проведенных экспериментальных исследований мембранно-электродных блоков на основе пористого никеля с биметаллическими наночастицами платины, палладия и никеля установлен оптимальный состав платиновых металлов, позволяющий реализовать минимальные показатели энергопотребления щелочного электролиза воды.
ЗАКЛЮЧЕНИЕ
Разработаны нанокомпозитные биметаллические электроды платина–никель и палладий–никель на матрице-подложке из пористого никеля для щелочных электролизеров воды. Установлено оптимальное содержание платиновых металлов на биметаллических электродах – 0.8 мг/см2 платины на аноде и 0.4 мг/см2 палладия на катоде, которые продемонстрировали высокую стабильность работы при минимальных значениях напряжения в мембранно-электродном блоке.
При испытаниях мембранно-электродных блоков на основе нанокомпозитных никелевых электродов наблюдается существенное снижение перенапряжений выделения водорода и кислорода, что обеспечивает уменьшение удельного энергопотребления при повышенных температурах до 80оС и высоких плотностях тока до 500 мА/см2, соответствующих промышленным установкам щелочного электролиза воды генерации водорода и кислорода высокой степени чистоты.
Работа выполнена в рамках государственного задания Российской Федерации № 0706-2020-0020.
Список литературы
Burton N.A., Padilla R.V., Rose A., Habibullah H. Increasing the efficiency of hydrogen production from solar powered water electrolysis // Renewable Sustainable Energy Rev. 2021. V. 135. Article number 110255.
Zeng K., Zhang D. Recent progress in alkaline water electrolysis for hydrogen production and applications // Prog. Energy Combust. Sci. 2010. V. 36. P. 307.
Haverkort J.W., Rajaei H. Electro-osmotic flow and the limiting current in alkaline water electrolysis // J. Power Sources Adv. 2020. V. 6. Article number 100034.
Smirnov S.E., Yashtulov N.A., Putsylov I.A., Smirnov S.S., Lebedeva M.V. Polysulfone Copolymer as Polymer Electrolyte for Alkaline Fuel Cell and Li-Ion Battery Applications // J. Eng. Appl. Sci. (Faisalabad, Pak.). 2019. V. 14. № 9. P. 2928.
Антропов А.П., Рагуткин А.В., Лебедевa М.В., Яштулов Н.А. Нанокомпозитные микромощные альтернативные источники энергии для электронной техники // Теплоэнергетика. 2021. Т. 68. № 1. С. 21. [Antropov A.P., Ragutkin A.V., Lebedeva M.V., Yashtulov N.A. Nanocomposite micro-powerful alternative energy sources for electronic equipment // Therm. Eng. 2021. V. 68. № 1. P. 21.]
Кудж С.А., Цветков В.Я., Фролов В.В. Многоуровневая подготовка специалистов в области энергосбережения и энергоэффективности // Дистанционное виртуальное обучение. 2014. № 12(90). С. 13. [Kudzh S.A., Tsvetkov V.Ya., Frolov V.V. Multilevel training of specialists in the field of energy saving and energy efficiency // Remote Virtual Train. 2014. № 12(90). P. 13.]
Попель О.С., Тарасенко А.Б. Сравнительный анализ систем длительного аккумулирования энергии для источников резервного и аварийного питания, а также энергоустановок на возобновляемых источниках энергии // Теплоэнергетика. 2012. Т. 59. № 11. С. 61. [Popel O.S., Tarasenko A.B. Comparative analysis of long-term energy storage systems for backup and emergency power sources, as well as power installations based on renewable energy sources // Therm. Eng. 2012. V. 59. № 11. P. 61.]
Yashtulov N.A., Lebedeva M.V., Patrikeev L.N., Zaitcev N.K. New polymer-graphene nanocomposite electrodes with platinum-palladium nanoparticles for chemical power sources // eXPRESS Polym. Lett. 2019. V. 13. № 8. P. 739.
Ragutkin A.V., Antropov A.P., Lebedeva M.V., Sigov A.S., Yashtulov N.A. Formation technology of effective electrode materials based porous silicon with platinum metal nanoparticles for autonomous energy systems // IOP Conf. Ser.: Mater. Sci. Eng. 2020. V. 744. Article number 012001.
Яштулов Н.А., Лебедева М.В. Водородная энергетика возобновляемых источников тока // Росс. технол. журн. 2017. Т. 5. № 3. С. 58. [Yashtulov N.A., Lebedeva M.V. Hydrogen energy of renewable power sources // Russ. Technol. J. 2017. V. 5. № 3. P. 58.]
Delvaux A., Lumbeeck G., Idrissi H., Proost J. Effect of microstructure and internal stress on hydrogen absorption into Ni thin film electrodes during alkaline water electrolysis // Electrochim. Acta. 2020. V. 340. Article number 135970.
Jiang X.G., Zhang Y.P., Song C., Xie Y.C., Liu T.K., Deng C.M., Zhang N.N. Performance of nickel electrode for alkaline water electrolysis prepared by high pressure cold spray // Int. J. Hydrogen Energy. 2020. V. 45. P. 33007.
Mayerhöfer B., McLaughlin D., Böhm T., Hegelheimer M., Seeberger D., Thiele S. Bipolar Membrane Electrode Assemblies for Water Electrolysis // ACS Appl. Energy Mater. 2020. V. 3. № 10. P. 9635.
Liu Z., Sajjad S.D., Gao Y., Yang H., Kaczur J.J., Masel R.I. The effect of membrane on an alkaline water electrolyzer // Int. J. Hydrogen Energy. 2017. V. 42. P. 29661.
López-Fernández E., Gil-Rostra J., Espinós J.P., González-Elipe A.R., de Lucas Consuegra A., Yubero F. Chemistry and Electrocatalytic Activity of Nanostructured Nickel Electrodes for Water Electrolysis // ACS Catal. 2020. V. 10. № 11. P. 6159.
Koj M., Qian J., Turek T. Novel alkaline water electrolysis with nickel-iron gas diffusion electrode for oxygen evolution // Int. J. Hydrogen Energy. 2019. V. 44. P. 29862.
Le Formal F., Yerly L., Potapova Mensi E., Da Costa X.P., Boudoire F., Guijarro N., Spodaryk M., Züttel A., Sivula K. Influence of Composition on Performance in Metallic Iron–Nickel–Cobalt Ternary Anodes for Alkaline Water Electrolysis // ACS Catal. 2020. V. 10. № 20. P. 12139.
Rauscher T., Bernäcker C.I., Mühle U., Kieback B., Röntzsch L. The effect of Fe as constituent in Ni-base alloys on the oxygen evolution reaction in alkaline solutions at high current densities // Int. J. Hydrogen Energy. 2019. V. 44. P. 6392.
Gabler A., Müller C.I., Rauscher T., Köhring M., Kieback B., Röntzsch L. Ultrashort pulse laser-structured nickel surfaces as hydrogen evolution electrodes for alkaline water electrolysis // Int. J. Hydrogen Energy. 2017. V. 42. P. 10826.
Wang S., Zou X., Lu Y., Rao S., Xie X., Pang Z. Electrodeposition of nano-nickel in deep eutectic solvents for hydrogen evolution reaction in alkaline solution // Int. J. Hydrogen Energy. 2018. V. 43. P. 15673.
Kraglund M.R., Aili D., Jankova K., Christensen E., Li Q., Jensen J.O. Zero-gap alkaline water electrolysis using ion-solvating polymer electrolyte membranes at reduced KOH concentrations // J. Electrochem. Soc. 2016. V. 163. P. F3125.
Sulka G.D., Brzozka A., Liu L. Fabrication of diameter-modulated and ultrathin porous nanowires in anodic aluminum oxide templates // Electrochim. Acta. 2011. V. 56. P. 4972.
Антропов А.П., Зайцев Н.К., Рябков Е.Д., Яштулов Н.А., Мудракова П.Н. Химико-технологический подход к созданию нановорсистых (ультрадисперсных) каталитически активных материалов // Тонкие хим. технол. 2021. Т. 16. № 2. С. 105. [Antropov A.P., Zaitsev N.K., Ryabkov E.D., Yashtulov N.A., Mudrakova P.N. Manufacturing of nanopillar (ultra-dispersed) catalytically active materials through chemical engineering // Fine Chem. Technol. 2021. V. 16. № 2. P. 105.]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии