Теоретические основы химической технологии, 2021, T. 55, № 6, стр. 780-792
Тандемная масс-спектрометрия для анализа гинзенозидов в фитоадаптогенной композиции с противоопухолевыми свойствами
И. В. Казеев a, *, О. А. Бочарова a, В. Е. Шевченко a, Р. В. Карпова a, Е. В. Бочаров a, О. П. Шейченко b, В. Г. Кучеряну c, М. А. Барышникова a, В. Б. Матвеев a
a Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина Министерства здравоохранения Российской Федерации
Москва, Россия
b Всероссийский научно-исследовательский институт лекарственных и ароматических растений
Москва, Россия
c Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
* E-mail: ilya_delta@mail.ru
Поступила в редакцию 08.04.2021
После доработки 20.05.2021
Принята к публикации 21.05.2021
Аннотация
Представлены результаты анализа гинзенозидов в фитоадаптогенной композиции “Мультифитоадаптоген” (МФА) с противоопухолевыми свойствами методом высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-МС/МС). Для идентификации гинзенозидов использовали коммерческие стандарты гинзенозидов, а также данные литературы. В составе МФА были выявлены гинзенозиды Rb1, Rb2, Rc, Rd, Rg1, Rg2, Re, Rf, Ro. Результаты могут быть использованы для стандартизации и контроля качества фитокомплексов, в состав которых входят тритерпеновые гликозиды.
ВВЕДЕНИЕ
Классические фитоадаптогены (Panax ginseng, Rhodiola rosea, Aralia mandshurica, Oplopanax elatus, Eleutherococcus senticosus, Leuzea carthamoides, Schisandra chinensis и др.) обладают комплексным защитным действием на организм, повышая его противоопухолевую устойчивость. Однако к отдельным фитоадаптогенам может развиваться устойчивость. Ее можно преодолеть при использовании нескольких фитоадаптогенов в композиции. Поэтому разработка многокомпонентных фитоадаптогенных комплексов, основанных на принципе рационального сочетания биологически активных веществ, является актуальной и научно значимой. В последнее время становится очевидным перспективность применения нетоксичных фитоадаптогенов для профилактики, а также в составе комплексной терапии при злокачественных новообразованиях. Их действие направлено на восстановление защитных систем организма, в том числе адгезионных механизмов в ткани-мишени и в процессах иммунореактивности [1–6].
Вместе с тем актуальным является обоснование фармакологической активности препаратов с учетом их химического состава. Важной остается и проблема стандартизации, особенно многокомпонентных фитокомплексов [7].
В связи с этим была разработана фармацевтическая композиция “Мультифитоадаптоген” (MФА). В ее состав входят компоненты 40 экстрактов лекарственных растений из Государственной фармакопеи Российской Федерации, включая женьшень Panax ginseng, Eleutherococcus senticosus, Rhodíola rósea, Aralia mandshúrica, Oplopánax elátus, Schizandraa chinensis.
In vitro на клетках дрожжей S. cerevisiae MФА проявил антимутагенный эффект. Добавление препарата в среду культивирования снижало появление устойчивых к канаванину клеток в 6.4 раза, мутаций в локусах ADE4–ADE8 – более чем в 100 раз. MФА также снижал частоту мутаций, индуцированных УФ-излучением и азотистой кислотой, в 3.7 и 33 раза соответственно. In vivo показана радиопротекторная активность MФА на мышах и собаках при различных режимах γ-облучения и применения препарата, средняя продолжительность жизни животных увеличилась от 26.7 до 40%. На модели спонтанного гепатоканцерогенеза у мышей-самцов СВА профилактическое и лечебное воздействие МФА приводило к долговременному усилению экспрессии лейкоцитарных интегринов LFA-1 и Mac-1, обеспечивающих контактные взаимодействия иммунных эффекторов и клеток-мишеней. Последнее способствовало инфильтрации спонтанных гепатокарцином лимфоцитами, а также деструкции опухолевой ткани. В результате получено снижение частоты возникновения (на 31%) количества и размеров наследственных опухолей, а также повышение средней продолжительности жизни (на 17 и 24% соответственно) и соматического статуса животных [7].
Эффективность МФА, вероятно, обусловлена комплексом биологически активных веществ, входящих в его состав. Ранее были определены компоненты фитомикса с использованием ЯМР-спектроскопии, установлен состав летучих веществ при использовании хромато-масс-спектрометрии, а также полифенольных соединений и аминокислот с применением обращенно-фазовой высокоэффективной жидкостной хроматографии с УФ-детектором [8–10]. С помощью ВЭЖХ-МС/МС анализа в MФА выявлены биологически активные вещества из аралии маньчжурской – аралозиды А, Б, С [11].
Для дальнейшего анализа химических компонентов МФА актуальным является определение гинзенозидов, группы биологически активных веществ женьшеня [12].
Учитывая многокомпонентность состава MФА, для идентификации гинзенозидов перспективным представляется применение тандемной масс-спектрометрии (ВЭЖХ-МС/МС) [13].
Женьшень Panax ginseng C. A. Mey., “Корень жизни” (семейство Аралиевых), – многолетнее травянистое растение. Включает в себя 12 видов, произрастающих в Азии и Северной Америке. В традиционной китайской медицине женьшень используется около 5000 лет, благодаря его полезным и целебным свойствам. Обширные доклинические и клинические данные в мировой научной литературе за последние несколько лет подтвердили благотворное влияние женьшеня на центральную нервную систему, при метаболических, инфекционных и опухолевых заболеваниях. Традиционная китайская медицина утверждает, что препараты женьшеня продлевают жизнь и молодость. Фармакологическая активность обусловлена содержанием тритерпеновых гликозидов даммаранного ряда, или сапонинов, которые называются гинзенозидами [12].
Таким образом, целью данного исследования является качественный и количественный анализ гинзенозидов в MФА методом ВЭЖХ-МС/МС.
МАТЕРИАЛЫ И МЕТОДЫ
В работе исследовали образцы MФА и экстракта женьшеня, полученные одинаковым способом (удельный вес сырья, температурный и временной режим экстрагирования, состав экстрагента и т.п.). Образцы MФА и экстракта женьшеня были приготовлены с использованием высококачественного сертифицированного сырья. Анализ MФА и экстракта женьшеня проводили с использованием тройного квадрупольного масс-спектрометра TSQ Vantage (серии Thermo Scientific TSQ), соединенного с ВЭЖХ-хроматографом Accela, снабженного колонкой ACQUITY UPLC BEH C18 (1.7 мкм, 2.1 × 100 мм, Waters).
В работе использовали коммерческие стандарты гинзенозидов Rb1, Rb2, Rc, Rd, Rg1, Rh1 и Rh2 (ChromaDex), стандарт ланатозид С (в качестве внутреннего стандарта), а также метанол (Sigma-Aldrich) и ацетонитрил (Reiden-deHaen) для ВЭЖХ.
Стандарты гинзенозидов Rg1, Rc, Rb1, Rb2, Rd, Rh1 и Rh2 растворяли в метаноле, концентрация растворов 1.0 мг/мл. Из каждого раствора отбирали 100 мкл и переносили в чистую пробирку, затем доводили до объема 1 мл метанолом. Получали раствор смеси стандартов с концентрацией 0.1 мг/мл каждого стандарта.
Калибровочные растворы стандартов готовили на основе метанола с концентрациями 3.3, 5, 10, 12.5, 16.7, 20, 25, 50, 100, 125, 166.7, 200, 250 и 500 мкг/мл. Каждый образец содержал 1 мкг ланатозида С. Калибровочные кривые строили в координатах “отношение площади пика стандарта гинзенозида к площади пика внутреннего стандарта – концентрация стандарта гинзенозида”.
Растворы вводили в прибор трижды: на первый, второй и пятый день приготовления раствора смеси стандартов. Образцы хранили при температуре 4°С. Относительное стандартное отклонение для образцов, взятых в один день, составляло 0.5–2.7%, для разных дней – 0.4–3.2%. Общее количество снятых проб для каждого гинзенозида составило 18–20.
Образец экстракта женьшеня разводили метанолом в 100 раз, после чего пропускали через фильтр с диаметром пор 0.22 мкм. Образцы фитомикса смешивали с метанолом в соотношении 1 : 2 и центрифугировали в течение 5 мин при 13 000 об/мин. Надосадочную жидкость пропускали через фильтр с диаметром пор 0.22 мкм и центрифугировали при 13 000 об/мин в течение 1 мин.
Условия хроматографирования: фаза А – 100% вода и 0.1% муравьиная кислота (FA); фаза В – 95% ацетонитрил, 5% вода и 0.1% FA.
Для анализа стандартов гинзенозидов, экстракта женьшеня и MФА использовали градиент подачи подвижной фазы 0–15 мин (21–60% фазы В), 15–18 мин (60–100% фазы В), 18–25 мин (100% фазы В), 25–33 мин (21% фазы В). Образцы в объеме 5 мкл вводили в петлю инжектора объемом 25 мкл (подвижная фаза – 20 мкл) со скоростью потока 450 мкл/мин.
Ионизацию осуществляли с помощью электроспрея. Условия ионизации: отрицательная полярность, напряжение капилляра спрея 4 кВ, газ (создающий спрей) – 60 фунтов на квадратный дюйм (1 фунт на квадратный дюйм = 6894.757 Па), обтекающий газ – 15 отн. ед., температура капилляра – 270°С. Спектры в режиме полного сканирования ионов и в выбранном режиме ионного мониторинга (SIM) были сняты в диапазоне 150–1500 Да, время сканирования – 0.1 с.
МС/МС-спектры стандартов и соединений в экстракте получали прямым вводом пробы через шприц со скоростью 5 мкл/мин; давление газа в камере соударений 0.9 мторр (1 торр = 1 мм рт. ст. = = 133.322 Па). Напряжение в камере соударений было подобрано для каждого соединения отдельно.
Для количественного определения гинзенозидов анализировали образцы смеси стандартов, экстракта женьшеня и MФА в режиме SIM-сканирования.
Идентификацию гинзенозидов в MФА также проводили с учетом данных литературы об их масс-спектрах и хроматографических свойствах.
Статистический анализ результатов проводили с использованием программы STATISTICA 6.0. Для результатов количественного определения гинзенозидов просчитывали среднее значение и относительное стандартное отклонение по выборке.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлена хроматограмма полного ионного тока смеси стандартов гинзенозидов Rg1, Rb1, Rh1, Rc, Rb2, Rd и Rh2 (в соответствии с очередностью выхода). В табл. 1 и 2 для каждого гинзенозида приведены молекулярная и структурная формулы, молекулярный вес, время удерживания, масс-спектры для основного молекулярного иона, а также для фрагментов молекулярного иона, полученных в результате тандемной масс-спектрометрии.
Рис. 1.
Хроматограмма полного ионного тока смеси стандартов гинзенозидов. По оси абсцисс – время удерживания (мин); по оси ординат – интенсивность пика (отн. ед.).
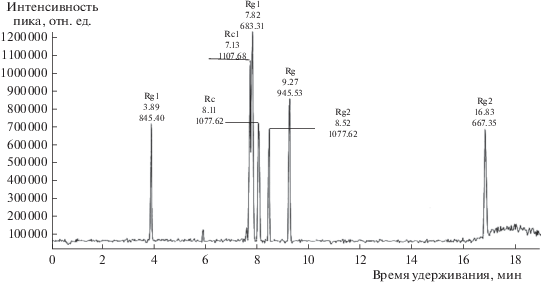
Таблица 1.
Хроматографическое и масс-спектрометрическое исследование стандартов гинзенозидов
| № пика |
Молекулярная формула | Молекулярный вес, Да | Время удерживания, мин | Масс-спектр (m/z) |
|---|---|---|---|---|
| 1 | Rg1 (C42H72O14) |
801 | 3.89 | 845.5 [M + FA-H]–; 799.5 [M-H]–; 637.5 [M-H-Glc]–; 475.3 Agl |
| 2 | Rb1 (C54H92O23) |
1109.3 | 7.73 | 1107.78 [M-H]–; 783.2 [M-H-2Glc]–; 621.5 [M-H-3Glc]–; 459.25 Agl |
| 3 | Rh1 (C36H62O9) |
639 | 7.82 | 683.35 [M + FA-H]–; 637.4 [M-H]–; 475.2 Agl |
| 4 | Rc (C53H90O22) |
1079.3 | 8.11 | 1077.62 [M-H]–; 945.6 [M-H-Araf]–; 783.2 [M-H-Araf-Glc]–; 621.3 [M-H-Araf-2Glc]–; 455.2 Agl |
| 5 | Rb2 (C53H90O22) |
1079.3 | 8.52 | 1077.62 [M-H]–; 945.6 [M-H-Arap]–; 783.2 [M-H-Arap-Glc]–; 621.3 [M-H-Arap-2Glc]–; 455.2 Agl |
| 6 | Rd (C48H82O18) |
947.2 | 9.27 | 945.34 [M-H]–; 783.19 [M-H-Glc]–; 621.6 [M-H-2Glc]–; 459.4 Agl |
| 7 | Rh2 (C36H62O8) |
623 | 16.83 | 667.43 [M + FA-H]–; 621.49 [M-H]–; 459.04 Agl |
Таблица 2.
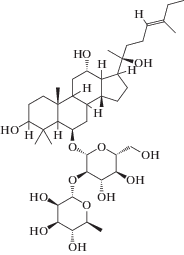
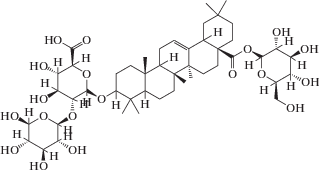
Молекулярные и структурные формулы стандартов гинзенозидов
| № пика | Молекулярная формула | Структурная формула |
|---|---|---|
| 1 | Rg1 (C42H72O14) |
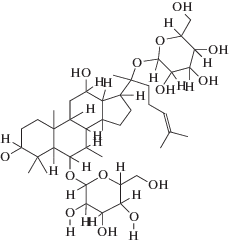 |
| 2 | Rb1 (C54H92O23) |
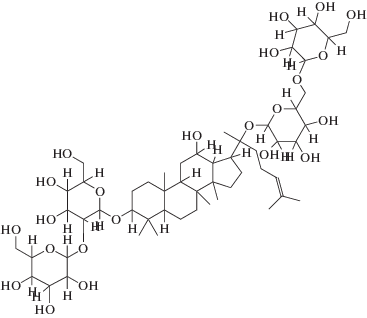 |
| 3 | Rh1 (C36H62O9) |
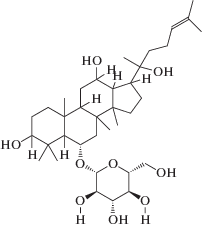 |
| 4 | Rc (C53H90O22) |
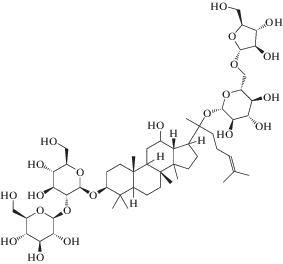 |
| 5 | Rb2 (C53H90O22) |
 |
| 6 | Rd (C48H82O18) |
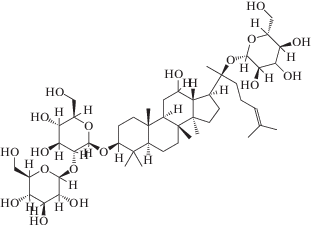 |
| 7 | Rh2 (C36H62O8) |
 |
Как следует из данных табл. 1, при первичной ионизации (в режиме регистрации отрицательных ионов) гинзенозиды с большим молекулярным весом (Rb1, Rb2, Rc, Rd) образовывали квазимолекулярные ионы [М-Н]-, гинзенозиды с меньшим молекулярным весом (Rg1, Rh1 и Rh2) – образовывали ионы-аддукты [M + FA-H]– c муравьиной кислотой (FA), входящей в состав мобильной фазы.
Полученные данные МС/МС (при вторичной ионизации и фрагментации молекулярных ионов) хорошо согласуются с молекулярными и структурными формулами гинзенозидов. Результаты анализа фрагментов ионов и сопоставление их с молекулярной и структурной формулами для каждого гинзенозида также приведены в табл. 1 и 2. Фрагменты гинзенозидов образуются в основном за счет последовательного отщепления молекул сахаров (глюкозы, арабинозы). Конечные фрагменты соответствуют агликонам 20(S)-протопанаксадиолу (для гинзенозидов Rb1, Rb2, Rc, Rd, Rh2) и 20(S)-протопанаксатриолу (для гинзенозидов Rg1, Rh1).
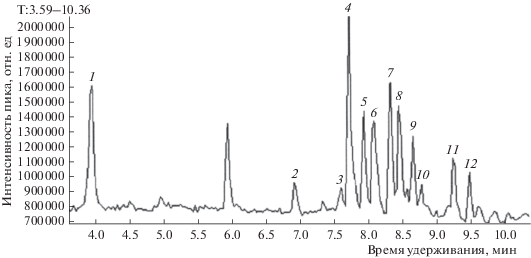
На рис. 2 представлена хроматограмма полного ионного тока экстракта женьшеня, полученная в режиме SIM. Она содержит не менее 12 пиков, которые можно отнести к гинзенозидам. Пик со временем удерживания 6 мин соответствует внутреннему стандарту ланатозиду С. В экстракте женьшеня при сопоставлении времени удерживания и масс-спектров со стандартами гинзенозидов были идентифицированы гинзенозиды Rg1, Rb1, Rc, Rb2, Rd (пики 1, 4, 6, 8 и 11 соответственно). Гинзенозиды Rh1 и Rh2 выявлены не были.
Хроматограмма полного ионного тока МФА получена в режиме полного сканирования ионов (рис. 3), а также в режиме SIM-сканирования. Их массы соответствовали массам молекулярных ионов гинзенозидов: 1) 845–846 (Rg1); 2) 945–946 (Rd); 3) 1077–1078 (Rc и Rb2); 4) 1107–1108 (Rb1) (рис. 4).
Рис. 3.
Хроматограмма полного ионного тока МФА. Ось абсцисс – время удерживания (мин); ось ординат – интенсивность пика (отн. ед.).
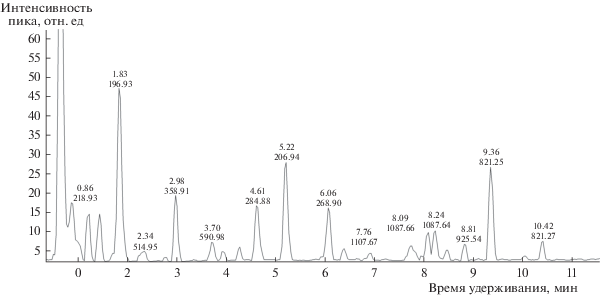
Рис. 4.
Хроматограммы МФА в режиме SIM-сканирования отдельных ионов с массами 845–846 (а), 945–946 (б), 1077–1078 (в) и 1107–1108 (г). Ось абсцисс – время удерживания (мин); ось ординат – интенсивность пика (отн. ед.).

В результате сопоставления времени удерживания и масс-спектров со стандартами в составе МФА были идентифицированы гинзенозиды Rb1, Rb2, Rc, Rd, Rg1, такие же, как и в экстракте женьшеня.
Для количественного содержания гинзенозидов в препаратах для каждого гинзенозида были построены калибровочные кривые с использованием в качестве внутреннего стандарта ланатозида С (табл. 3). Как видно из табл. 3, коэффициент корреляции r для всех полученных калибровочных кривых превышал 0.98.
Таблица 3.
Калибровочные кривые и коэффициенты корреляции для стандартов гинзенозидов
| Гинзенозид | Уравнение калибровочной кривой | Коэффициент корреляции r |
|---|---|---|
| Rb1 | y = 0.0202x + 0.1484 | 0.9900 |
| Rb2 | y = 0.0091x – 0.0255 | 0.9897 |
| Rc | y = 0.0108x – 0.0112 | 0.9918 |
| Rd | y = 0.0220x + 0.0985 | 0.9907 |
| Rg1 | y = 0.0122x – 0.0322 | 0.9902 |
По результатам качественного и количественного анализа (с использованием коммерческих стандартов) в МФА определены следующие гинзенозиды: Rb1, Rb2, Rc, Rd, Rg1 (табл. 4).
Таблица 4.
Качественный и количественный состав гинзенозидов МФА
| № | Гинзенозид | Количественное содержание, мкг/мл (xср ± Δxср) |
|---|---|---|
| 1 | Rb1 | 339.801 ± 2.324 |
| 2 | Rb2 | 432.531 ± 3.162 |
| 3 | Rc | 279.293 ± 1.898 |
| 4 | Rd | 112.462 ± 0.841 |
| 5 | Rg1 | 278.343 ± 1.717 |
Вместе с тем данные научной литературы, посвященной составу экстрактов женьшеня [14–19], указывают на наличие в МФА гинзенозидов, представленных в табл. 5–7.
Таблица 5.
ВЭЖХ-МС-определение гинзенозидов в экстракте женьшеня на основании данных литературы [19–24] (номера пиков соответствуют данным рис. 2)
| № пика | Время удерживания, мин | Гинзенозид | [M-H]– | [M + FA-H]– | [M-CO2-H]– |
|---|---|---|---|---|---|
| 1 | 3.95 | Re | 945 | – | – |
| 2 | 6.91 | Rf | 799 | 845 | – |
| 4 | 7.79 | Rg2 | 783 | – | – |
| 5 | 7.94 | Malonyl-Rb1 | – | – | 1149 |
| 7 | 8.33 | Ro | 955 | – | – |
| 12 | 9.48 | Malonyl-Rd | – | – | 987 |
Таблица 6.
Хроматографические и масс-спектрометрические данные изучения гинзенозидов в экстракте женьшеня с учетов данных литературы (номера пиков соответствуют данным рис. 2)
| № пика | Молекулярная формула гинзенозида | Молекулярный вес, Да | Масс-спектр (m/z) |
|---|---|---|---|
| 1 | Re (C48H82O18) |
947.15 | 945.3 [M-H]–; 799.1 [M-H-Rha]–; 783.2 [M-H-Glc]–; 637.1 [M-H-Glc-Rha]–; 475.1 Agl |
| 2 | Rf (C42H72O14) |
801.01 | 845.5 [M + FA-H]–; 799.5 [M-H]–; 637.5 [M-H-Glc]–; 475.3 Agl |
| 4 | Rg2 (C42H72O13) |
785.01 | 783.2 [M-H]–; 636.8 [M-H-Rha]–; 621.1 [M-H-Glc]–; 475.1 Agl |
| 7 | Ro (C48H76O19) |
957.1 | 955.3 [M-H]–; 793.1 [M-H-Glc]–; 631.1 [M-H-2Glc]–; 613.2 [M-H-2Glc-H2O]– |
Сравнение литературных и полученных нами экспериментальных данных позволило (по данным МС/МС) с высокой степенью вероятности определить гинзенозиды Re, Rf, Rg2 и Ro в экстракте женьшеня (см. табл. 5–7), а также оценить их присутствие в МФА (по соответствию масс-ионов и времен удерживания на хроматограммах экстракта женьшеня и МФА).
Так, с использованием коммерческих стандартов и данных научной литературы основные биологически активные соединения женьшеня были идентифицированы в фитоформуле МФА: гинзенозиды Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, Rg2 и Ro.
Обсуждая полученные результаты, следует отметить, что среди выявленных гинзегозидов Rb1 и Rb2, как известно из научной литературы, проявляют иммуномодулирующую активность [20], что также показано и для МФА в наших работах [7, 21]. Нейропротекторные и антиоксидантные свойства по литературным данным присущи как гинзенозидам Rb1, Rb2 Rc, Rd, Re, Rf, Rg1 Rg2 [22, 23], так и МФА [7]. Радиопротекторная и антимутагенная активность показана в научной литературе, например, для гинзенозида Rb1 [24], также она выявлена и для МФА [7]. Противоопухолевая активность гинзенозида Rd при раке желудка продемонстрирована в [25], аналогичные исследования проведены и для МФА [26]. Противоопухолевая активность в отношении рака легких, в частности, и при метастазировании показана для гинзенозидов Rb1, Rb2, Rd, Rg1 и Ro [27–29], а также и для МФА [7]. Таким образом, биологическая активность, продемонстрированная в научной литературе для идентифицированных гинзенозидов Rb1, Rb2, Rc, Rd, Re, Rf, Rg1, Rg2 и Ro, совпадает с выявленной для МФА в наших работах, что позволяет обосновать доказанные свойства препарата.
В то же время научная литература свидетельствует о том, что гинзенозиды, идентифицированные в МФА, обладают противоопухолевой активностью в отношении глиобластомы (Rd) [30], колоректального (Rd) [28] и рака молочной железы (Rd) [31]. Данные литературы также демонстрируют, что Ro заметно подавляет опухолевый рост экспериментальной В16 in vivo и проявляет антиангиогенную активность в отношении опухоли [32]. Гинзенозид Rd подавляет лекарственную устойчивость к цитостатикам при лечении рака легкого, повышая эффективность противоопухолевой терапии [33]. В научной литературе также рассматриваются защитные эффекты гинзенозидов Rb1, Rb2, Rc, Rd, Rg1 и Re на ишемию миокарда [34] и антидиабетические свойства [35] гинзенозидов Rb1 и Rg1. Поэтому есть основания полагать, что МФА, содержащий идентифицированные гинзенозиды, может обладать аналогичными свойствами. Последнее может стать предметом будущих исследований.
ЗАКЛЮЧЕНИЕ
Метод тандемной масс-спектрометрии ВЭЖХ/ МС-МС был успешно применен для определения Rb1, Rb2, Rc, Rd, Rg1, Rg2, Re, Rf, Ro гинзенозидов в качестве составляющих оригинальной фармацевтической композиции “Мультифитоадаптоген”. Хроматограммы и спектры, полученные в ходе исследования, могут быть использованы для стандартизации МФА. Результаты также важны для обоснования биологической активности МФА с учетом составляющей группы гинзенозидов. Кроме того, на основе известной биологической активности идентифицированных гинзенозидов могут быть предсказаны новые свойства МФА, что может служить предметом будущих исследований. Вместе с тем показана возможность стандартизации комплексных фитопрепаратов, в состав которых входят соединения из группы тритерпеновых гликозидов.
Работа выполнена при частичной поддержке грантов Комиссии по биомедицинским инновациям и технологиям Министерства науки Российской Федерации.
Список литературы
Бочарова О.А., Карпова Р.В., Бочаров Е.В., Вершинская А.А., Барышникова М.А., Казеев И.В., Кучеряну В.Г., Киселевский М.В. и др. Фитоадаптогены в биотерапии опухолей и гериатрии (часть 1) // Росс. биотерапевтический журн. 2020. Т. 19. № 2. С. 13. [Bocharova O.A., Karpova R.V., Bocharov E.V., Vershinskaya A.A., Baryshnikova M.A., Kazeev I.V., Kucheryanu V.G., Kiselevsky M.V. et al. Phytoadaptogens in biotherapy of tumors and geriatrics (Part 1) // Russ. Biother. J. 2020. V. 19. № 2. P. 13.]
Бочарова О.А., Карпова Р.В., Бочаров Е.В., Вершинская А.А., Барышникова М.А., Казеев И.В., Кучеряну В.Г., Киселевский М.В. Фитоадаптогены в биотерапии опухолей и гериатрии (часть 2) // Росс. биотерапевтический журн. 2020. Т. 19. № 3. С. 12. [Bocharova O.A., Karpova R.V., Bocharov E.V., Vershinskaya A.A., Baryshnikova M.A., Kazeev I.V., Kucheryanu V.G., Kiselevsky M.V. Phytoadaptogens in biotherapy of tumors and geriatrics (Part 2) // Russ. Biother. J. 2020. V. 19. № 3. P. 12.]
Liu T., Zhao L., Hou H. et al. Ginsenoside 20(S)-Rg3 suppresses ovarian cancer migration via hypoxia-inducible factor 1 alpha and nuclear factor-kappa B signals // Tumor Biol. 2017. V. 39. № 5. https://doi.org/10.1177/1010428317692225
Vinh L.B., Park J.U., Duy L.X. et al. Ginsenosides from Korean red ginseng modulate T cell function via the regulation of NF-AT-mediated IL-2 production // Food Sci. Biotechnol. 2019. V. 28. № 1. P. 237. https://doi.org/10.1007/s10068-018-0428-8
Meng Q., Pan J., Liu Y. et al. Anti-tumour effects of polysaccharide extracted from Acanthopanax senticosus and cell-mediated immunity // Exp. Ther. Med. 2018. V. 15. № 2. P. 1694. https://doi.org/10.3892/etm.2017.5568
Le H.T., Nguyen H.T., Min H.Y., Hyun S.Y., Kwon S., Lee Y., Van Le T.H., Lee J., Park J.H., Lee H.-Y. Panaxynol, a natural Hsp90 inhibitor, effectively targets both lung cancer stem and non-stem cells // Cancer Lett. (N. Y., NY, U. S.). 2018. V. 412. P. 297. https://doi.org/10.1016/j.canlet.2017.10.013
Бочарова О.А., Карпова Р.В., Бочаров Е.В., Вершинская А.А., Барышникова М.А., Казеев И.В., Кучеряну В.Г., Киселевский М.В., Матвеев В.Б. Изыскание фитоадаптогенов и возможности использования фитокомплексов // Росс. биотерапевтический ж. 2020. Т. 19. № 4. С. 35. [Bocharova O.A., Karpova R.V., Bocharov E.V., Vershinskaya A.A., Baryshnikova M.A., Kazeev I.V., Kucheryanu V.G., Kiselevsky M.V., Matveev V.B. Research of new phytoadaptogens and possibilities of herbal formulas application // Russ. Biother. J. 2020. V. 19. № 4. P. 35.]
Шейченко В.И., Бочарова О.А., Шейченко О.П., Бочаров Е.В., Быков В.А. Аналитические возможности метода ЯМР для определения компонентов препарата Фитомикс-40 // Завод. лаб. Диагн. матер. 2006. Т. 72. № 8. С. 15. [Sheychenko V.I., Bocharova O.A., Sheychenko O.P., Bocharov E.V., Bykov V.A. Analytical capabilities of the NMR method for determining the components of Phitomix-40 // Ind. Lab. Diagn. Mater. 2006. V. 72. № 8. P. 15.]
Шейченко О.П., Бочарова О.А., Шейченко В.И., Толкачев О.Н., Бочаров Е.В., Карпова Р.В., Быков В.А. Возможность использования электронных спектров поглощения для стандартизации многокомпонентного препарата “Фитомикс-40” // Вопр. биол., мед. фарм. хим. 2007. Т. 5. № 2. С. 20. [Sheychenko O.P., Bocharova O.A., Sheychenko V.I., Tolkachev O.N., Bocharov E.V., Karpova R.V., Bykov V.A. Possibility of using electronic absorption spectra for standardization of the multicomponent preparation “Phytomix-40” // Probl. Biol., Med. Pharm. Chem. 2007. V. 5. № 2. P. 20.]
Шейченко О.П., Бочарова О.А., Крапивкин Б.А., Уютова Е.В., Карпова Р.В., Казеев И.В., Бочаров Е.В., Быков В.А. Исследование комплексного фитоадаптогена методом ВЭЖХ // Вопр. биол., мед. фарм. хим. 2012. Т. 10. С. 52. [Sheychenko O.P., Bocharova O.A., Krapivkin B.A., Uyutova E.V., Karpova R.V., Kazeev I.V., Bocharov E.V., Bykov V.A. Investigation of complex phytoadaptogen by HPLC // Probl. Biol., Med. Pharm. Chem. 2012. V. 10. P. 52.]
Казеев И.В., Бочарова О.А., Шевченко В.Е., Карпова Р.В., Бочаров Е.В., Уютова Е.В., Шейченко О.П., Кучеряну В.Г., Барышникова М.А. Тандемная масс-спектрометрия в технологии определения аралозидов композиции фитоадаптогенов // Теор. осн. хим. технол. 2020. Т. 54. № 6. С. 733. [Kazeev I.V., Bocharova O.A., Shevchenko V.E., Karpova R.V., Bocharov E.V., Uyutova E.V., Sheychenko O.P., Kucheryanu V.G., Baryshnikova M.A. Tandem mass spectrometry in the technology of determining aralosides of phytoadaptogene compositions // Theor. Found. Chem. Eng. 2020. V. 54. № 6. P. 1242.]
Mancuso C., Santangelo R. Panax ginseng and Panax quinquefolius: From pharmacology to toxicology // Food Chem. Toxicol. 2017. V. 107. Part A. P. 362. https://doi.org/10.1016/j.fct.2017.07.019
Taira S., Uematsu K., Kaneko D., Katano H. Mass spectrometry imaging: applications to food science // Anal. Sci. 2014. V. 30. № 2. P. 197.
Liu Z., Li Y., Li X., Ruan C.-C., Wang L.-J., Sun G.-Z. The effects of dynamic changes of malonyl ginsenosides on evaluation and quality control of Panax ginseng C.A. Meyer // J. Pharm. Biomed. Anal. 2012. V. 64–65. P. 56.
Morinaga O., Uto T., Yuan C.S. et al. Evaluation of a new eastern blotting technique for the analysis of ginsenoside Re in American ginseng berry pulp extracts // Fitoterapia. 2010. V. 81. № 4. P. 284.
Zhao Q., Zheng X., Jiang J. et al. Determination of ginsenoside Rg3 in human plasma and urine by high performance liquid chromatography-tandem mass spectrometry // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2010. V. 878. № 24. P. 2266.
Lee S.M., Bae B.-S., Park H.-W., Ahn N.-G. et al. Characterization of Korean Red Ginseng (Panax ginseng Meyer): History, preparation method, and chemical composition // J. Ginseng Res. 2015. V. 39. № 4. P. 384. https://doi.org/10.1016/j.jgr.2015.04.009
Lv W.J., Liu C., Li Y.F., Chen W.Q. et al. Systems Pharmacology and Microbiome Dissection of Shen Ling Bai Zhu San Reveal Multiscale Treatment Strategy for IBD // Oxid. Med. Cell. Longevity. 2019. V. 2019. Article number 8194804. https://doi.org/10.1155/2019/8194804
Shi Z.Y., Zeng J.Z., Wong A.S.T. Chemical Structures and Pharmacological Profiles of Ginseng Saponins // Molecules. 2019. V. 24. № 13. P. 2443. https://doi.org/10.3390/molecules24132443
Nguyen N.H., Nguyen C.T. Pharmacological effects of ginseng on infectious diseases // Inflammopharmacology. 2019. V. 27. № 5. P. 871. https://doi.org/10.1007/s10787-019-00630-4
Bocharova O.A., Bocharov E.V., Karpova R.V., Il’Enko V.A., Kazeev I.V., Baryshnikov A.Y. Integrins LFA-1 and Mac-1 and cytokines IL-6 and IL-10 in high-cancer mice under influence of phytoadaptogen // Bull. Exp. Biol. Med. 2014. V. 157. № 2. P. 258. https://doi.org/10.1007/s10517-014-2539-4
Kim D.H., Kim D.W., Jung B.H., Lee J.H., Lee H., Hwang G.S., Kang K.S., Lee J.W. Ginsenoside Rb2 suppresses the glutamate-mediated oxidative stress in neuronal cell // J. Ginseng Res. 2019. V. 43. № 2. P. 326. https://doi.org/10.1016/j.jgr.2018.12.002
Chen J., Li M., Qu D., Sun Y. Neuroprotective Effects of Red Ginseng Saponins in Scopolamine-Treated Rats and Activity Screening Based on Pharmacokinetics // Molecules. 2019. V. 24. № 11. P. 2136. https://doi.org/10.3390/molecules24112136
Alessio N., Capasso S., Di Bernardo G., Cappabianca S., Casale F., Calarco A., Cipollaro M., Peluso G., Galderisi U. Mesenchymal stromal cells having inactivated RB1 survive following low irradiation and accumulate damaged DNA: Hints for side effects following radiotherapy // Cell Cycle. 2017. V. 16. № 3. P. 251. https://doi.org/10.1080/15384101.2016.1175798
Tian Y.Z., Liu Y.P., Tian S.C., Ge S.Y., Wu Y.J., Zhang B.L. Antitumor activity of ginsenoside Rd in gastric cancer via up-regulation of Caspase-3 and Caspase-9 // Pharmazie. 2020. V. 75. № 4. P. 147. https://doi.org/10.1691/ph.2020.9931
Bocharova O.A., Davydov M.I., Klimenkov A.A., Baryshnikov A.Y., Karpova R.V., Chulkova S.V., Gorozhanskaya E.G., Ilyenko V.A. Prospects of using phytoadaptogen in the treatment of diffuse stomach cancer // Bull. Exp. Biol. Med. 2009. V. 148. № 1. P. 82.
Lee D.G., Jang S.I., Kim Y.R., Yang K.E., Yoon S.J., Lee Z.W., An H.J., Jang I.S., Choi J.S., Yoo H.S. Anti-proliferative effects of ginsenosides extracted from mountain ginseng on lung cancer // Chin. J. Integr. Med. 2016. V. 22. № 5. P. 344. https://doi.org/10.1007/s11655-014-1789-8
Phi L.T.H., Sari I.N., Wijaya Y.T., Kim K.S., Park K., Cho A.E., Kwon H.Y. Ginsenoside Rd Inhibits the Metastasis of Colorectal Cancer via Epidermal Growth Factor Receptor Signaling Axis // IUBMB Life. 2019. V. 71. № 5. P. 601. https://doi.org/10.1002/iub.1984
Zhou X., Liu H., Zhang M., Li C., Li G. Spectrum-effect relationship between UPLC fingerprints and anti-lung cancer effect of Panax ginseng // Phytochem. Anal. 2020. V. 32. № 3. P. 339. https://doi.org/10.1002/pca.2980
Liu G.M., Lu T.C., Sun M.L., Jia W.Y., Ji X., Luo Y.G. Ginsenoside Rd Inhibits Glioblastoma Cell Proliferation by Up-Regulating the Expression of miR-144-5p // Biol. Pharm. Bull. 2020. V. 43. № 10. P. 1534. https://doi.org/10.1248/bpb.b20-00338
Zhang E., Shi H., Yang L., Wu X., Wang Z. Ginsenoside Rd regulates the Akt/mTOR/p70S6K signaling cascade and suppresses angiogenesis and breast tumor growth // Oncol. Rep. 2017. V. 38. № 1. P. 359. https://doi.org/10.3892/or.2017.5652
Zheng S.W., Xiao S.Y., Wang J., Hou W., Wang Y.P. Inhibitory Effects of Ginsenoside Ro on the Growth of B16F10 Melanoma via Its Metabolites // Molecules. 2019. V. 24. № 16. P. 2985. https://doi.org/10.3390/molecules24162985
Chian S., Zhao Y., Xu M., Yu X., Ke X., Gao R., Yin L. Ginsenoside Rd reverses cisplatin resistance in non-small-cell lung cancer A549 cells by downregulating the nuclear factor erythroid 2-related factor 2 pathway // Anti-Cancer Drugs. 2019. V. 30. № 8. P. 838. https://doi.org/10.1097/CAD.0000000000000781
Wang J., Wang H., Mou X., Luan M., Zhang X., He X., Zhao F., Meng Q. The Advances on the Protective Effects of Ginsenosides on Myocardial Ischemia and Ischemia-Reperfusion Injury // Mini-Rev. Med. Chem. 2020. V. 20. № 16. P. 1610. https://doi.org/10.2174/1389557520666200619115444
Bai L., Gao J., Wei F., Zhao J., Wang D., Wei J. Therapeutic Potential of Ginsenosides as an Adjuvant Treatment for Diabetes // Front. Pharmacol. 2018. V. 9. P. 423. https://doi.org/10.3389/fphar.2018.00423
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии