Теоретические основы химической технологии, 2022, T. 56, № 4, стр. 464-473
Теоретические и экспериментальные исследования эффекта образования анодных зон в объеме катодно-поляризованного трехмерного электрода из углеродного волокнистого материала
В. К. Варенцов a, А. Н. Кошев b, *
a Институт химии твердого тела и механохимии Сибирского отделения РАН
Новосибирск, Россия
b Пензенский государственный университет архитектуры и строительства
Пенза, Россия
* E-mail: koshev@pguas.ru
Поступила в редакцию 02.12.2021
После доработки 04.12.2021
Принята к публикации 14.12.2021
- EDN: BEYBTV
- DOI: 10.31857/S0040357122040078
Аннотация
В статье обобщены результаты многолетних теоретических, экспериментальных и технологических исследований авторов, посвященные эффекту образования анодных зон на катодно-поляризованных проточных электродах из углеродных волокнистых материалов в течение электродных восстановительно-окислительных реакций. При этом, наибольшее внимание уделено процессам электроосаждения металлов и сплавов.
ВВЕДЕНИЕ
Теория и практика трехмерных электродных систем охватывает широкий спектр электрохимических технологий: химические источники электрической энергии, получение композиционных и нанокомпозиционных материалов, электросинтез органических соединений, электроосаждение металлов и их соединений, электроизвлечение металлов из растворов переработки минерального и техногенного сырья, обезвреживание токсичных веществ в промышленных растворах (в том числе в сточных водах), и др. [1, 2].
Одним из важных и интересных вопросов, имеющих практическое и теоретическое значение является эффект анодных зон (АЗ), образующихся в процессе электролиза на катодно-поляризованных трехмерных электродах, как и эффект образования катодных зон на анодно-поляризованных трехмерных электродах. Наибольшее внимание в литературе уделено первому эффекту – возникновению анодных зон на катодно-поляризованных трехмерных электродах в процессе осаждения металлов [2].
Понятие анодных зон на катодно- поляризованном пористом электроде, по-видимому, впервые предложено Даниель–Беком [3, 4] при рассмотрении электрохимических процессов в химических источниках тока: “Повторный переход тока в электролит и затем опять в твердую фазу возможен лишь при очень большой величине плотности тока и при сильной поляризации электрода…”.
Из этого следует, что при протекании электрохимических процессов в проточном трехмерном электроде (ПТЭ) при определенных условиях возможно изменение знака направления тока в объеме электрода и образование анодных зон на катодно- поляризованном ПТЭ. Таким образом, этот эффект является следствием процессов, протекающих в объеме электрода.
Через значительный промежуток времени представления об анодных зонах были развиты в связи с использованием проточных трехмерных электродов для различных окислительно-восстановительных процессов.
Для электродов с дискретной электропроводной матрицей, на которых фиксировались анодные зоны, следует указать работы [5–7]. В этих работах возможность образования анодных показана на примере электроосаждения меди на насыпном электроде, различная электропроводность которого создавалась соотношением металлических, графитовых и пластиковых частиц. Образование анодных зон авторы связывают с омическими потерями в электроде. В работе [6] существование анодных зон на псевдоожиженном электроде объясняется образованием биполярных зон в объеме электрода. Следует отметить, что понятие анодных зон на катодно-поляризованном ПТЭ в указанных статьях связывают в первую очередь с отсутствием осадка металла на участках электрода.
Эффект образования анодных зон на катодно-поляризованных проточных трехмерных электродах из углеродных волокнистых материалов (УВМ), т.е. на электродах с непрерывной электропроводной матрицей впервые теоретически предсказан и экспериментально подтвержден в наших работах, например, в [2].
Вопрос возможности образования анодных зон на катодах из УВМ после наших публикаций прошел стадию от категоричного отрицания возможности образования таких зон [8] до последующего ряда публикаций этих же авторов, в которых они рассматривают условия возникновения анодных зон [9] и опровергают свои ранее полученные результаты. К сожалению, эти публикации не внесли ничего принципиально нового в понимание условий и причин образования анодных зон на катодно- поляризованных УВЭ. Приведенные данные и большинство выводов подтверждают ранее полученные нами результаты исследований или являются очевидными.
В настоящей статье обобщены результаты наших теоретических, экспериментальных и технологических исследований, связанных с эффектом образования анодных зон на катодно-поляризованных трехмерных электродах из УВМ в процессах электроосаждения металлов из различных растворов.
Несмотря на существующие экспериментальные доказательства возможность возникновения анодных зон катодно-поляризованном ПТЭ и установление условий их образования, принципиальное значение имеет теоретическое обоснование данного явления и условий к нему приводящих посредством физико – математического моделирования электрохимических процессов в ПТЭ.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ РАСПРЕДЕЛЕНИЯ ПОЛЯРИЗАЦИИ ПО ТОЛЩИНЕ ПРОТОЧНЫХ ТРЕХМЕРНЫХ ЭЛЕКТРОДОВ
Обобщенные модели процессов электроосаждения нескольких металлов в ПТЭ с катодами из УВМ с учетом изменяющихся во времени характеристиках процесса и электрода опубликованы в работах [1, 2, 10]. Нетрудно доказать, что при протекании в объеме ПТЭ двух и более реакций, отличающихся равновесными потенциалами, в том числе при совместном осаждении двух и более различных металлов, для некоторых из них возможно появление областей с анодной парциальной поляризацией, при катодном осаждении основного металла по всей толщине ПТЭ. Такой эффект не реализуется в случае протекания на электроде единственно возможной реакции, например, осаждения одного металла, если параметры электрода и процесса однородны и не меняются в течение электрохимического процесса.
Представляется интересным рассмотреть процессы осаждения одного металла при параллельных направлениях протока раствора и линий электрического тока, что, как правило, реализуется в электрохимических системах с ПТЭ, совместно с реакциями восстановление кислорода и ионов водорода, обычно сопутствующими осаждению, а также в случаях изменяющихся во времени свойствах электрода и электрохимических реакций.
Распределение на ПТЭ потенциала U, концентрации электроактивных компонентов Ci, i = 1, 2, 3 (С1 – концентрация ионов металла, С2 – молекулярного кислорода, С3 – ионов водорода), парциальных плотностей тока Jsi и скорости протока электролита – v по толщине электрода описываются дифференциальными и алгебраическими уравнениями с одной пространственной координатой х и временной координатой t:
(1)
$\begin{gathered} F\sum {{z}_{i}}\frac{{\partial {{C}_{i}}}}{{\partial t}} = \frac{{ - \partial \left( {\left( {\frac{{ - {{\kappa }_{{\text{Т}}}}{{\kappa }_{{\text{Ж}}}}}}{{{{\kappa }_{{\text{Т}}}} + {{\kappa }_{{\text{Ж}}}}}}} \right)\frac{{\partial U}}{{\partial x}}} \right)}}{{\partial x}} - \\ - \,\,vF\sum {{z}_{i}}\frac{{\partial {{C}_{i}}}}{{\partial x}} - F\frac{{\partial v}}{{\partial x}}\sum {{z}_{i}}{{C}_{i}}, \\ \end{gathered} $(4)
$\begin{gathered} {{C}_{i}}\left( {0,\tau } \right) = C{{0}_{i}},\,\,\,\,{{C}_{i}}\left( {x,0} \right) = C{{0}_{i}}, \\ \frac{{\partial U}}{{\partial x}}\left( {0,t} \right) = {{ - I\left( t \right)} \mathord{\left/ {\vphantom {{ - I\left( t \right)} {{{\kappa }_{{\text{T}}}}}}} \right. \kern-0em} {{{\kappa }_{{\text{T}}}}}},\,\,\,\,\frac{{\partial U}}{{\partial x}}\left( {L,t} \right) = {{I\left( t \right)} \mathord{\left/ {\vphantom {{I\left( t \right)} {{{\kappa }_{{\text{Ж}}}}}}} \right. \kern-0em} {{{\kappa }_{{\text{Ж}}}}}}. \\ \end{gathered} $Необходимо отметить, что как кинетические характеристики процессов восстановления ионов металла, кислорода и водорода, такие как токи обмена и равновесные потенциалы, так и электрохимические характеристики электролита и электрода, такие, как удельные электропроводности, коэффициенты массопереноса и удельная реакционная поверхность, могут существенно зависеть от времени процесса и координаты точки на ПТЭ. Этот вопрос достаточно подробно исследован в работах [1, 2], где приведены уравнения и формулы для расчета перечисленных параметров.
Если изменение концентраций реагентов и других электрохимических и технологических параметров во времени происходит достаточно медленно, то описываемая электрохимическая система при ее математическом описании допускает использование квазистационарной математической модели и уравнение (1) преобразуется к виду:
(5)
$\frac{{d\left( {\left( {\frac{{{{\kappa }_{{\text{Т}}}}{{\kappa }_{{\text{Ж}}}}}}{{{{\kappa }_{{\text{Т}}}} + {{\kappa }_{{\text{Ж}}}}}}} \right)\frac{{dU}}{{dx}}} \right)}}{{dx}} = {\text{ + \;}}{{S}_{v}}\left( x \right){{J}_{s}}\left( x \right) - \frac{{dv}}{{dx}}zFC\left( x \right).$Рассмотрим случаи, когда можно пренебречь изменением распределения электропроводностей твердой и жидкой фаз, скорости протока раствора и других параметров процесса по толщине электрода. Примем также для такой простейшей электрохимической системы незначительным падение концентрации ионов металла в элементарном объеме электролита за время его прохода через ПТЭ. Тогда уравнение (5) и условия (3), (4) можно записать относительно поляризации электрода $\eta \left( x \right) = U\left( x \right) - \Phi R$:
(6)
$\frac{{{{d}^{2}}\eta }}{{d{{x}^{2}}}} = \left( {\frac{1}{{{{\kappa }_{{\text{T}}}}}} + \frac{1}{{{{\kappa }_{{\text{Ж}}}}}}} \right){{S}_{v}}{{J}_{s}},$(7)
$\frac{{d\eta }}{{dx}}\left( 0 \right) = \frac{{ - I}}{{{{\kappa }_{T}}}};\,\,\,\,\frac{{d\eta }}{{dx}}\left( L \right) = \frac{I}{{{{\kappa }_{Ж}}}};$(8)
$\begin{gathered} {{J}_{s}}\left( x \right)j0\left( {{{e}^{{A\eta \left( x \right)}}} - {{e}^{{ - В\eta \left( x \right)}}}} \right),\,\,\,\,А = {{\alpha zF} \mathord{\left/ {\vphantom {{\alpha zF} {RT}}} \right. \kern-0em} {RT}}, \\ В = \left( {1 - {\text{ }}\alpha } \right){{zF} \mathord{\left/ {\vphantom {{zF} {RT}}} \right. \kern-0em} {RT}}. \\ \end{gathered} $Анализ уравнений (6)–(8) приведен в работе [1]. Показано, что при больших значениях габаритной плотности тока I функция η(x*) в точке минимума х* является убывающей при возрастании I, однако, не может принимать отрицательные или нулевые значения, так как нулевые начальные условия на функцию η(х*) = 0 и производную в точке минимума $\frac{{d\eta }}{{dx}}$(х*) = 0 приводят к нулевому решение краевой задачи (6)–(8): η(х) ≡ 0, что неверно. Таким образом, простейшая математическая модель электродного процесса в ПТЭ не описывает ситуацию, при которой возможно образование анодной зоны.
Представляет интерес решение вопроса образование анодных зон при катодной поляризации ПТЭ в случае распределенной электропроводности материала катода по толщине ПТЭ. Экспериментальные исследования показывают наличие таких зон [1], однако введение в математическую модель (6)–(8) распределенных электропроводностей электрода и раствора приводит к модели:
(9)
$\frac{{d\left( {\left( {\frac{{ - {{\kappa }_{{\text{Т}}}}{{\kappa }_{{\text{Ж}}}}}}{{{{\kappa }_{{\text{Т}}}} + {{\kappa }_{{\text{Ж}}}}}}} \right)\frac{{d\eta }}{{dx}}} \right)}}{{dx}} = {{S}_{v}}{{J}_{s}},$для которой справедливы предыдущие выводы о невозможности перехода поляризации электрода в анодную область.
Рассмотрим математическую модель однокомпонентного электролиза, когда стационарный электродный потенциал реакции восстановления металла зависит от концентрации электроактивного компонента:
(10)
$\eta \left( x \right) = U\left( x \right) - E0 - \frac{{RT}}{{nF}}{\text{ln}}\frac{{C\left( x \right)}}{{C0}},$E0 – стандартный электродный потенциал:
(11)
$\begin{gathered} \frac{{{{d}^{2}}\eta }}{{d{{x}^{2}}}} + \frac{{RT}}{{ZF}}\left( {\frac{1}{{C\left( x \right)}}\frac{{{{d}^{2}}C}}{{d{{x}^{2}}}} - \frac{1}{{{{{\left( {C\left( x \right)} \right)}}^{2}}}}{{{\left( {\frac{{dC}}{{dx}}} \right)}}^{2}}} \right) = \\ = \left( {\frac{1}{{{{{{\kappa }}}_{{\text{T}}}}}} + \frac{1}{{{{\kappa }_{{\text{Ж}}}}}}} \right){{S}_{v}}{{J}_{s}}, \\ \end{gathered} $Нетрудно показать, что использование зависимости (10) в математической модели (11), как и ранее, для случая электровосстановления одного компонента на ПТЭ поляризация электрода не может принимать отрицательных значений. Однако, как показано в работе [1], использование формулы (10), т.е. зависимости стационарного электродного потенциала от концентрации металла в электролите в случае присутствия в растворе двух или более электроактивных компонентов может привести к ситуации, при которой произойдет смена знака поляризации для одного (или нескольких) компонентов, т.е. хотя бы по одному из компонентов возможно образование анодной зоны.
В случае изменений поверхностных свойств ПТЭ в течение электролиза нельзя отрицать возможной зависимости стационарного электродного потенциала от координаты точки на электроде:
Тогда уравнение (6) должно быть записано в виде:
(14)
$\frac{{{{d}^{2}}\eta }}{{d{{x}^{2}}}} + \frac{{{{d}^{2}}{{\phi }_{R}}}}{{d{{x}^{2}}}} = {{S}_{v}}\left( {\frac{1}{{{{\kappa }_{{\text{Т}}}}}} + \frac{1}{{{{\kappa }_{{\text{Ж}}}}}}} \right)j\left( \eta \right).$Для такой математической модели интерес может представлять полиномиальная зависимость стационарного потенциала от координаты на электроде. Так, для параболической зависимости ${{\varphi }_{R}}\left( x \right) = a{{x}^{2}} + bx + c$ уравнение (14) запишется в виде:
(15)
$\frac{{{{d}^{2}}\eta }}{{d{{x}^{2}}}} + 2a = {{S}_{v}}\left( {\frac{1}{{{{\kappa }_{{\text{Т}}}}}} + \frac{1}{{{{\kappa }_{{\text{Ж}}}}}}} \right)j\left( \eta \right)$с граничными условиями:
(17)
$\begin{gathered} \frac{{\partial \eta }}{{\partial x}}\left( 0 \right) + b = {{ - I} \mathord{\left/ {\vphantom {{ - I} {{{\kappa }_{{\text{T}}}}}}} \right. \kern-0em} {{{\kappa }_{{\text{T}}}}}}, \\ \frac{{\partial \eta }}{{\partial x}}\left( L \right) + b = {I \mathord{\left/ {\vphantom {I {{{\kappa }_{{\text{Ж}}}}}}} \right. \kern-0em} {{{\kappa }_{{\text{Ж}}}}}},\,\,\,\,\eta \left( 0 \right) = с. \\ \end{gathered} $Для такой задачи теоретически возможно решение, при котором зависимость поляризации от координаты по толщине ПТЭ меняет знак, то есть восстановительный процесс переходит в окислительный. Стационарный потенциал может оказаться не постоянной величиной, если свойства материала, из которого формируется ПТЭ распределены по толщине ПТЭ, например, когда электрод сформирован из слоев, состоящих из углеграфитовых материалов с разными свойствами и в других случаях формирования ПТЭ, [1]. Другой причиной зависимости ${{\phi }_{R}} = {{\phi }_{R}}\left( {x,t} \right)$ от координаты и времени может оказаться изменение свойств электродного материала в процессе электролиза металла. Очевидно, что в этих случаях необходимо использовать полную математическую модель, учитывающую описанные ситуации.
В соответствие с результатами, приведенными в данном разделе, численные исследования проведены нами для случая, когда на ПТЭ реализуются реакции электро-восстановления ионов одного металла, кислорода и (или) ионов водорода с учетом изменения основных параметров системы электрод-раствор в процессе электролиза.
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАСПРЕДЕЛЕНИЯ ПРОЦЕССА ЭЛЕКТРОВОССТАНОВЛЕНИЯ ИОНОВ МЕДИ ИЗ СЕРНОКИСЛОГО ЭЛЕКТРОЛИТА
Расчеты и экспериментальные исследования процессов в ПТЭ были выполнены для двух электрохимических систем, отличающихся свойствами УВМ материала катода: НТМ-200 и АНМ [1]. Свойства выбранных материалов существенно отличаются друг от друга, в частности разные порядки имеют их удельные электропроводности (0.21 и 0.015 См/см), различными являются радиусы углеграфитовых волокон и другие параметры электродов и процессов. Такой выбор нам представляется наиболее информативным при анализе результатов и формулировании общих выводов.
Приведем исследования распределения потенциала электрода в окрестности точки минимума для электрохимической системы с параметрами процесса и электрода, соответствующими материалу марки НТМ-200, в частности, κT = = 0.21 См/см – начальная удельная электропроводность УВМ, ε = 0.93 – начальная пористость УВМ, r = 4.5 мкм – начальный радиус волокна УВМ, ρ = 1.8 г/см3 – плотность углеграфитового волокна, SV = 270 см2/см3 – начальная удельная реакционная поверхность УВМ. Начальная объемная скорость протока раствора v = 0.5 см/с, концентрация ионов меди в электролите – 0.16 × × 10–3 Г/см3, концентрация кислорода – 0.3 × × 10–5 Г/см3, толщина электрода – 1 см, κЖ = = 0.1 См/см – начальная удельная электропроводность раствора; αCU = 0.5, αН = 0.5, αО = 0.5 – коэффициенты переноса соответственно для реакции восстановления ионов меди, водорода и молекулярного кислорода; j0,O = 10–10 А/см2 – токи обмена; ${{\phi }_{{R,{\text{Cu}}}}} = 0.337$ В, ${{\phi }_{{R,{\text{Н}}}}} = 0.0$ В, ${{\phi }_{{R,{\text{О}}}}} = 0.525$ В – равновесный потенциал реакции восстановления ионов меди, водорода, молекулярного кислорода.
На рис. 1 приведены результаты расчетов минимальных значений поляризации электрода для различных плотностей габаритного тока в различные моменты времени электролиза без участия побочных реакций восстановления ионов водорода и молекулярного кислорода.
Рис. 1.
Значение минимума поляризации реакции электровосстановления ионов меди: (а) – от времени t. Кривые 1–5 рассчитаны для различных плотностей габаритных токов: 0.03; 0.05; 0.07; 0.094; 0.11 А/см2, соответственно; (б) – от плотности габаритного тока J. Кривые 1–6 рассчитаны для различного времени электролиза 10, 20, 30, 40, 50, 60 мин, соответственно.

Результаты показывают, что минимальные значения поляризация электрода в течение всего выбранного временного интервала электролиза не переходят в анодную область при росте габаритной плотности, что подтверждает ранее сделанные теоретические выводы для однокомпонентных электрохимических систем.
С течением времени электролиза при выбранных габаритных плотностях тока значения минимума поляризации существенно уменьшаются. Это обстоятельство обусловлено изменениями характеристик электрода и процесса, причем данное свойство наиболее выражено для высоких габаритных плотностей тока.
В конце электролиза (60 мин) с ростом габаритного тока минимум поляризации возрастает, стабилизируется, а затем существенно уменьшается, что также подтверждает теоретические выводы.
Следующая серия расчетов выполнена для той же электрохимической системы, когда в математическом описании процесса присутствуют уравнения и соотношения, позволяющие учитывать возможные реакции электровосстановления ионов меди, кислорода и ионов водорода. Некоторые результаты расчетов для такой системы приведены на рис. 2.
Рис. 2.
Распределение поляризации реакции электровосстановления ионов меди в окрестности точки минимума: (а) – при плотности габаритного тока 0.38 А/см2; (б) при плотности габаритного тока 0.39 А/см2. Кривые 1–3 рассчитаны для 10, 20, 60 мин электролиза, соответственно. N – номера точек, равномерно распределенных по толщине ПТЭ (всего 21 точка), толщина электрода – 1 см.

Результаты расчета распределения поляризации, представленного на рис. 2 наглядно иллюстрируют, как минимум поляризации с течением времени в процессе электролиза переходит в анодную область, а затем возвращается в катодную. При этом уже в начальной фазе электролиза поляризация в окрестности своего минимума может оказаться в анодной области, а затем перейти в катодную. Отметим, что, потенциал электрода остается во всех точках в катодной области в течение всего времени электролиза.
Таким образом, подтверждено, что при исследовании электрохимических процессов, связанных с образованием анодных зон на катодно- поляризованном электроде, необходимо использовать математические модели электрохимических процессов в ПТЭ, где учтены, как минимум, две электрохимических реакции на электроде и изменяющиеся во времени характеристики системы электрод–электролит.
Результаты расчетов, приведенные на рис. 3а, 3б и рис. 4а, 4б выполнены для системы электрод–раствор, когда в ПТЭ использовался углеграфитовый материал марки АНМ [1], с параметрами: SV = 160 см2/см3; κT = 0.015 См/см, ε = 0.97, r = 6.1 мкм, ρ = 1.55 г/см3, κЖ = 0.1 См/см; v = = 1 см/с, αCU = 0.5, αН = 0.5, αО = 0.5; j0,CU = 2 × × 10–3, А/см2; j0, H = 10–8, А/см2; j0,O = 10–10 А/см2 – токи обмена; ${{\phi }_{{R,{\text{Cu}}}}} = 0.{\text{337}}$ В, ${{\phi }_{{R,{\text{Н}}}}} = 0.0$ В, ϕR,O = = 0.525 В; толщина ПТЭ – 5 см.
Рис. 3.
(а) – Распределение отношение массы меди к массе УВМ по толщине электрода: 1–3 – рассчитанные значения, соответственно, через 18, 90 и 180 мин электролиза, 4 – экспериментальные данные при длительности электролиза 180 мин (б) – кривые 1, 2, 3 – кривые распределения поляризации реакции восстановления ионов меди по толщине ПТЭ, полученные расчетным путем, соответственно для 18-ой, 90-ой и 180-ой мин электролиза.
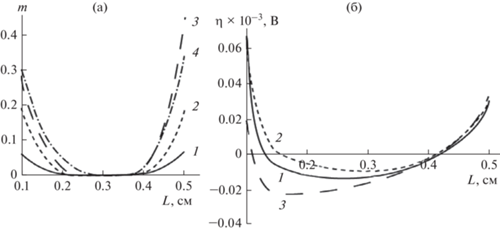
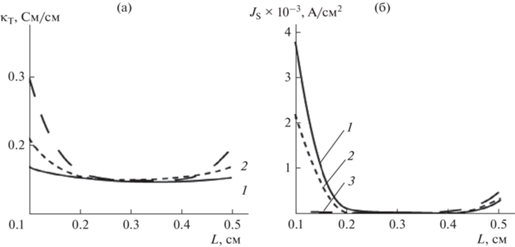
Рис. 4.
(а) – Кривые 1, 2, 3 – кривые распределения электропроводности по толщине электрода, рассчитанные, соответственно, через 18, 90 и 180 мин электролиза. (б) – кривые распределения плотности тока реакции восстановления кислорода по толщине электрода, рассчитанные для тех же временных точек.
Электроосаждение меди осуществляли из сернокислого раствора при плотности габаритного тока – 500 А/м2, концентрация меди в растворе – 2.5 × 10–3 моль/л, серной кислоты 0.5 моль/л. Для этой системы начальные значения электропроводности материала электрода малы, в силу чего представляется интересным численно исследовать поведение процесса именно для такой системы в динамике, при постепенном заполнении ПТЭ металлом.
На рис. 3а и 3б приведены результаты расчетных и экспериментальных исследований распределения меди и поляризации реакции восстановления ионов меди по толщине ПТЭ для различных временных интервалов электроосаждения меди.
На рис. 4а и 4б приведены результаты расчетов распределения электропроводности электрода и плотности поляризующего тока с учетом парциальной кислородной реакции в различные моменты времени электролиза.
В первую очередь отметим хорошее согласование расчетных и экспериментальных данных, (рис. 3а, а также теоретических представлений [2], (рис. 3б, рис. 4), что свидетельствует о работоспособности вышеописанной модели.
Следует обратить внимание на существенный рост электропроводности ПТЭ на тыльной и фронтальной сторонах электрода с течением времени электролиза. За счет этого эффекта происходит смещение электрохимических реакций восстановления ионов металла и кислорода на фронтальную сторону электрода. Снижение потенциала на тыльной стороне электрода приводит к существенному снижению парциального тока восстановления кислорода и к общему снижению вклада парциального тока кислородной реакции в суммарный ток электрохимической реакции.
Представленные в этой статье и другие многочисленные расчеты показывают, что возникновение и исчезновение анодных зон зависит от характера распределения всего электрохимического процесса по толщине ПТЭ. Можно, например, заметить (рис. 3б и 4б, что поляризация в точке минимума имеет максимальное значение, когда парциальный токи электрохимических реакций наиболее равномерно распределены по толщине проточного трехмерного электрода.
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ЭФФЕКТА ОБРАЗОВАНИЯ АНОДНЫХ ЗОН ПРИ ЭЛЕКТРООСАЖДЕНИИ МЕТАЛЛОВ НА ТРЕХМЕРНЫХ ЭЛЕКТРОДАХ ИЗ УГЛЕРОДНЫХ ВОЛОКНИСТЫХ МАТЕРИАЛОВ
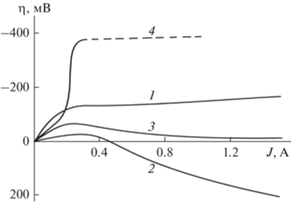
Ниже приведены некоторые из полученных нами результатов, (рис. 5, 6), доказывающие наличие АЗ на катодно-поляризованном электроде из УВМ. Экспериментально подтверждено образование таких зон двумя методами: непосредственным измерением потенциала по толщине электрода (рис. 5) и измерением изменения количества металла, выделившегося на углеродном волокнистом электроде (УВЭ) по его толщине (рис. 6). Приведенные на рис. 6 результаты показывают, что при определенных условиях электролиза в средней части электрода происходит растворение предварительного осажденного медного осадка и перераспределение его на тыльную и фронтальную стороны электрода. На рис. 5 и 7 приведены результаты, полученные расчетным методом с использование описанных выше математических моделей. Явления, связанные с растворение ранее осажденного металла на УВЭ или перемещением осадка металла по объему электрода, наблюдались нами при осаждении золота, серебра, палладия, кадмия и других металлов при разработке технологических процессов [1, 2].
Рис. 5.
Распределение поляризации по толщине электрода при исходных концентрациях ионов меди в растворе (моль/л): 10–2 (1, 2); 10–3 (3); 10–4 (4), толщина электрода 2 см. Кривая 1 получена расчетным методом.

Рис. 6.
Распределение меди по толщине катода из УВМ при электролизе из раствора сернокислой меди. Габаритная плотность тока 1.5 А/см2.
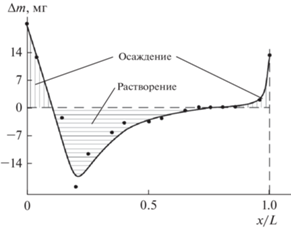
Рис. 7.
Влияние габаритной плотности тока на поляризацию катода из УВМ. 1 – тыльная сторона; 2 – расстояние от токоподвода 0.7 см; 3 – расстояние от токоподвода 1.4 см; 4 – фронтальная сторона.
Возникновение АЗ на катоде из УВМ изучено и подтверждено экспериментально, в зависимости от условий электролиза свойств системы электрод-раствор (габаритной плотности тока, скорости и направления протока раствора в электрод относительно вектора тока), при различном соотношения электропроводностей твердой и жидкой фаз ПТЭ, толщины электрода, а также с изменяющейся по толщине электрода (в исходном состоянии) электропроводности. Рассмотрены также случаи, когда осаждается один или два металла, исходное сопротивление электрода в начальной фазе электролиза постоянно по толщине электрода, а также изменяется дискретно или непрерывно [1]. При этом для электродов с переменной по толщине электрода электропроводностью вероятность образования АЗ больше, чем для электродов с постоянной исходной электропроводностью.
Образование анодных зон может играть отрицательно значение при решении практических задач. Например, при осаждении металлов как с целью их извлечения, так нанесения на УВМ с целью получения композитов образование АЗ характеризует ограничения на параметры процесса и состав обрабатываемого раствора, концентрацию электроактивных компонентов.
Остановимся несколько подробней на результатах исследований и возможных причинах возникновения и исчезновения анодных зон на катодно-поляризованном ПТЭ, в частности, в процессах осаждения металлов на УВЭ.
Скорость и вероятность протекания того или иного процесса по толщине УВЭ имеет распределенный характер по толщине и будет определяться профилем потенциала и зависящем от него профилем поляризации индивидуальных электрохимических реакций. Профиль потенциала определяется омическими свойствами системы, т.е. сопротивлением материала электрода, раствора и сопротивлением электрохимической реакции, проявляющемся в поляризации и реализующимся на границе твердая–жидкая фаза ПТЭ.
Распределение электрохимического процесса по толщине электрода происходит в соответствие с соотношением перечисленных сопротивлений. Очевидно, что соотношение этих сопротивлений в процессе электролиза будет меняться по следующим причинам. Во-первых, за счет поляризационного сопротивлении, которое зависит от локальной плотности тока и будет разным на различных участках электрода (в соответствие с распределением профиля поляризации). Во-вторых, за счет изменения сопротивления твердой фазы электрода в результате осаждения металла или сплава. В-третьих, за счет изменения сопротивления раствора в результате возможного газовыделения, например водорода. А также в результате зарастания порового пространства металлом эффективное сопротивления раствора будет меняться. Следует также учитывать возможность изменения сопротивления УВМ при катодной и анодной поляризации в процессах, не сопровождающихся выделением металла [2], а также возможность образования кротко замкнутых электрохимических систем (КЭС) в процессе осаждения металла на УВМ [1, 2].
Очевидно, что все эти явления обусловлены перераспределением параметров, характеризующих электрохимический процесс (потенциала, поляризации, локальных плотностей токов и концентрации электроактивных компонентов) по толщине электрода. Ясно также, что эти изменения носят локальный характер. Например, как осаждение металла, так и выделение газообразного водорода и изменение сопротивления углеграфитовой основы электрода, в процессах не сопровождающихся выделением металла, в первую очередь реализуется на краях электрода [1]. Не вызывает сомнения также факт, что изменение абсолютных значений рассмотренных сопротивлений и их соотношений зависит от исходных параметров системы электрод–раствор, природы электрохимических реакций, условий электролиза.
Большой объем экспериментальных и расчетных данных показал, что вероятность образования анодных зон на катодах из УВМ возрастает с ростом толщины электрода, габаритной плотности тока, увеличением концентрации электроактивных компонентов, уменьшением электропроводности материала электрода и раствора, уменьшением поляризуемости электрохимической реакции, увеличением тока обмена парциальных реакций. В реальных системах, например, при осаждении металлов на катоды из УВМ образование анодных зон наблюдается как при малых, так и больших токовых нагрузках, высоких скоростях протока раствора, а также при высокой концентрации ионов металла и низкой электропроводности раствора и материала электрода.
На распределение процесса по толщине электрода будет влиять вольт-амперная характеристика электрохимической реакции. Различные участки трехмерного электрода будут отвечать различных участкам поляризационной кривой (в общем случае). Для реальных процессов наиболее вероятно следующая картина: на краях электрода электрохимический процесс выделения металла реализуется на предельном диффузионном токе и (или) сопровождается выделением водорода, в то время как в средней части электрода значения потенциала соответствуют начальному участку вольт-амперной кривой. При этом сопротивление различных участков системы электрод–раствор будет различным. Все это подтверждено расчетами и экспериментальными данными для систем, содержащих два-четыре электроактивных компонента, например, медь–водород, медь–водород–кислород, серебро–водород, золото–серебро–водород–кислород. [1, 2].
Важным, с позиций рассматриваемого вопроса – образования анодных зон на катодно-поляризованном электроде, является вероятность изменения электропроводности участков электрода и свойств УВМ, на которых не выделился металл, до его осаждения [2]. При анодном растворении металла с УВЭ, а также за счет работы КЭС возможно изменение электропроводности УВМ по его толщине, причем в разной степени. Все это может привести к перераспределению поляризации по толщине электрода в ходе осаждения металла, а, следовательно, исходя из приведенных ранее рассуждений, к возникновению анодных зон. Результаты экспериментальных исследований показали, что предварительная катодная или анодная поляризация УВМ в индифферентном электролите, приводящая к образованию профиля электропроводности по толщине электрода, существенно влияет на распределение потенциала, следовательно и металла, по толщине электрода. При этом возможно образование анодной зоны [1].
Применение методов математического моделирования позволило выявить ряд интересных явлений на связанных с АЗ катодно- поляризованных УВЭ, которые были подтверждены экспериментально. Показано, что АЗ могут как возникать, так и исчезать в процессе осаждения металлов. Совместное осаждение двух металлов может привести к тому, что один из металлов (обычно более электроотрицательный) перестает осаждаться на отдельных участках электрода, в то время как более электроположительный – осаждается по всей толщине электрода. Это связано с изменением соотношения электропроводностей раствора и электрода от исходных значений, а также наличия поляризационного сопротивления.
Возможность образования катодных зон при анодной поляризации УВЭ установлена при анодной лабилизации сульфатных комплексов иридия из сернокислых растворов [1].
Анализ результатов исследования причин и условий возникновения АЗ на трехмерном катодно-поляризованном электроде из УВМ, а также результаты технологических исследований и практического использования этих электродов в различных технологических процесса позволяют определить следующие условия (ситуации), при которых могут возникать АЗ:
1. Высокие значения силы тока, проходящего через электрод, для разных ситуаций, определяющих исходное состояние системы электрод–раствор: удельные электропроводности твердой и жидкой фаз ПТЭ (κT = κG), удельная электропроводность твердой фазы ПТЭ больше (меньше) удельной электропроводности жидкой фазы ПТЭ (κT 〈 〉 κG), κT и κG изменяющиеся по толщине электрода.
2. Изменение κT и κG в процессе электролиза за счет: а) электроосаждения металла или сплава металлов, б) за счет газонаполнения объема электрода, в) за счет поляризационного сопротивления электродных реакций.
3. Изменение сопротивления материала углеродного электрода в процессе электролиза за счет: а) образования или восстановления оксидных соединений на поверхности волокон УВМ, б) образования соединений с графитом в том числе межслоевых.
4. Изменение природы электродного материала за счет: а) осаждения металла или сплава металлов, б) электродной поляризации без выделения металла В результате процессов, связанных с п. 3. а) и б) возможно изменение кинетических параметров электродных реакций: токов обмена, стационарных потенциалов, перенапряжения выделения водорода, кислорода металла на УВМ и металле.
5. Образование короткозамкнутой электрохимической системы металл–раствор электролита – УВМ.
6. Ведение процесса электролиза на УВЭ с исходной переменной по толщине электрода электропроводностью.
7. Ведение процесса электролиза в условиях реверса протока раствора сквозь объем электрода.
8. Ведение процесса электролиза при нестационарном токовом режиме.
Возникновение анодных зон также будет определяться взаимным расположением векторов тока и скорости протока раствора сквозь объем проточного трехмерного электрода и месторасположением токоподвода к УВЭ.
ЗАКЛЮЧЕНИЕ
Результаты теоретических, экспериментальных и технологических исследований показали, что анодные зоны на катодно-поляризованных ПТЭ могут образовываться и исчезать в процессе электролиза при наличии в растворе минимум двух электроактивных компонентов. Это связано с изменением равномерности распределения электрохимических процессов по толщине ПТЭ в результате изменения соотношения электропроводностей твердой и жидкой фаз ПТЭ и сопротивления электрохимической реакции: чем равномернее распределены процессы, тем меньше вероятность образования АЗ в объеме проточного объемно пористого электрода. Проведенные исследования позволили сформулировать основные условия, обуславливающие образование анодных зон в объеме проточного трехмерного электрода в процессе электролиза из растворов, содержащих два и более электроактивных компонента.
Список литературы
Варенцов В.К., Кошев А.Н., Варенцова В.И., Кузина В.В. Окислительно-восстановительные процессы на проточных трехмерных электродах. Математическое моделирование. Теория. Эксперимент. Пенза, ПГУАС, 2020.
Варенцов В.К., Кошев А.Н., Варенцова В.И., Кузина В.В. Углеродные волокнистые электроды: свойства, модификация, процессы и электролизеры. Математическое моделирование и оптимизация. Пенза: ПГУАС, 2021.
Даниель-Бек В.С. К вопросу о поляризации пористых электродов // Журн. физической химии. 1948. Т. 22. С. 697.
Даниель-Бек В.С. Влияние сопротивления твердой фазы на распределение потенциала и тока в электроде // Электрохимия. 1966. Т. 2. Вып. 6. С. 672.
Шваб Н.А., Каздобин К.А. Распределение скорости восстановления меди по высоте псевдоожиженного электрода // Укр. хим. журн. 1982. Т. 48. С. 37.
Wang Yung-Yun, Tseng Chi-Hwi, Wan Chi-Chao, Mao Kao-Wen. An experimental study of packed bed electrode with copper particles // J. Electrochem. Soc. 1982. V. 129. P. 347.
Wang Yund-Yun, Lu Shu-Hua, Wan Chi-Chao, Mao Kao-Wen. Effect of paticle conductivity of a packet bed reactor on the electrowinning of copper // Hydromet. 1982, V. 8. P. 231.
Поддубный Н.П., Маслий А.И. О невозможности образования анодных зон внутри пористого электрода с постоянными электропроводностями фаз // Сибирский химический журнал. 1991. Вып. 3. С. 108.
Маслий А.И., Поддубный Н.П. Об условиях возникновения анодных зон на катодно-поляризованном объемно-пористомпроточном электроде // Электрохимия. 1991. Т.27. № 6. С. 744.
Varentsov V.K., Koshev A.N., Sukhov I.F. Mathematical Modeling and Experimental Studies of the Electrodeposition of Gold and Silver from Sulfuric Acid Thiourea Solutions on Flow-Through 3D Electrode Taking into Account its Nonstationary State. Theoretical Foundations of Chemical Engineering. 2018. Т. 52. № 4. С. 495–505. [Варенцов В.К., Кошев А.Н., Сухов И.Ф. Процессы совместного электроосаждения золота и серебра из сернокислых растворов на проточном электроде. // Теоретические основы химической технологии. 2018. Т. 52. № 4. С. 391.]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


