Успехи современной биологии, 2019, T. 139, № 2, стр. 147-160
Аллелопатические взаимоотношения растений и микроорганизмов в почвенных экосистемах
Ю. М. Поляк 1, 2, *, В. И. Сухаревич 1
1 Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: yuliapolyak@mail.ru
Поступила в редакцию 20.08.2018
После доработки 20.08.2018
Принята к публикации 31.10.2018
Аннотация
Аллелопатия – одна из форм экологической конкуренции между организмами – широко распространена в природе. За последние десятилетия получены существенные результаты, касающиеся выделения и идентификации продуктов метаболизма растений и микроорганизмов, обладающих аллелопатической активностью, их роли в почвенных экосистемах. В настоящем обзоре рассматриваются аллелопатические свойства растений и микроорганизмов, основные функции и механизмы действия аллелохимикатов, их устойчивость в почве. Обсуждается роль аллелопатических взаимоотношений в биоценозах, особенности проявления аллелопатической активности при изменении условий окружающей среды и антропогенном воздействии. Рассматривается возможность использования аллелопатии для контроля фитопатогенов, перспективные направления дальнейших исследований.
ВВЕДЕНИЕ
Аллелопатия – природное явление, которое оказывает значительное влияние на функционирование биоценозов. Феномен аллелопатии включает различные типы химических взаимодействий между организмами и осуществляется путем образования и выделения ими в среду метаболитов, обладающих аллелопатической активностью (Elijarrat, Barcelo, 2001; Inderjit, Mukerji, 2006). Термин “аллопатия” чаще всего используется для характеристики взаимоотношений между растениями, но он также широко используется и для описания взаимоотношений между микроорганизмами, и между растениями и микроорганизмами (Weir et al., 2004; Cipollini et al., 2012).
По химическому составу аллелопатические вещества варьируют от простых углеводородов до сложных полициклических ароматических фенолов, терпенов, флавоноидов, полиацетиленов, жирных кислот. Хиноны и фенольные соединения являются наиболее распространенными фитотоксинами (Inderjit, 1996; Latif et al., 2017). Флавоноиды играют многофункциональную роль в защите растений. Однако в результате микробиологической трансформации аллелохимикатов образуются новые продукты с иными биологическими свойствами (Jilani et al., 2008; Aslam et al., 2017).
Аллелопатия связана с конкуренцией за ресурсы и в значительной степени зависит от таких факторов, как структура почвы, влажность, температура, наличие питательных веществ, концентрация аллелохимикатов, их устойчивость и подверженность микробиологическому воздействию (Назаров, Широков, 2014; Einhellig, 1995; Perry et al., 2007; Inderjit et al., 2008). Все это усугубляет проблему отделения аллелопатического эффекта от действия других факторов окружающей среды (Pellissier, Souto, 1999; Inderjit et al., 2011). В то же время, понимание динамики экологического состояния почвы и ее биоты является чрезвычайно важным для сохранения почвенного покрова, повышения плодородия почв и реабилитации нарушенных земель в условиях антропогенного воздействия.
Исторически изучение проявлений аллелопатии было сфокусировано на проблемах агроценозов, взаимоотношениях между посевами и сорняками (Pellissier, Souto, 1999; Tesio, Ferrero, 2010). В значительной степени это связано с необходимостью поиска альтернативы гербицидам, оказывающим негативное влияние на природную среду и человека (Einhellig, 1995; Patni et al., 2018).
Несмотря на интенсивное изучение феномена аллелопатии в последние десятилетия, полученные результаты ограничены или дискуссионны, что особенно касается почвенных процессов (Weidenhamer, 1989; Blanco, 2007). Некоторые авторы относятся к информации о проявлении аллелопатических эффектов скептически, т.к. исследования проводятся главным образом в лабораторных условиях, не аналогичных природным (Inderjit, 2002; Jose et al., 2006). Изучение аллелопатии преимущественно в лабораторных, контролируемых условиях, обусловлено тем, что в природных биоценозах на этот процесс одновременно влияют многие биотические и абиотические факторы, что затрудняет интерпретацию полученных результатов (Ehlers, 2011).
Для решения многих вопросов такого природного феномена как аллелопатия, имеющего существенную практическую и научную значимость, необходимы дальнейшие исследования в этой области. В настоящем обзоре рассматриваются аллелопатические свойства растений и микроорганизмов, основные функции аллелохимикатов и роль аллелопатических взаимоотношений в биоценозах, особенности проявления аллелопатии при изменении условий окружающей среды и антропогенном воздействии, возможность использования аллелопатии для контроля фитопатогенов.
АЛЛЕЛОПАТИЧЕСКИЕ СВОЙСТВА РАСТЕНИЙ
Роль аллелопатии во взаимоотношениях растений
Аллелопатия – одно из важнейших явлений, определяющих характер взаимоотношений растений. Растения, обладающие аллелопатической активностью, выделяют различные метаболиты, создавая, таким образом, вокруг себя специфическую среду, которая для одних видов может быть токсичной, для других – благоприятной, для третьих – индифферентной (Кондратьев и др., 2014; Anaya et al., 2012).
С практической точки зрения, особого внимания заслуживают метаболиты, которые прямо или косвенно подавляют размножение, рост или выживание конкурентных видов растений. Такая аллелопатическая активность продемонстрирована для растений различных видов во многих исследованиях (Hierro, Callaway, 2003; Cheng F., Cheng Z., 2015). Однако, при изучении одних и тех же инвазивных видов, в ряде случаев, получены прямо противоположные результаты (Bais et al., 2003; Blair et al., 2006). По мнению многих авторов, основной причиной такого рода противоречий могут быть различия в методологии исследований (Lankau, 2010; Ehlers, 2011).
Взаимное влияние растений в фитоценозах осуществляется, главным образом, через корневые системы (Наумов, 1988). Метаболиты растений, обладающие аллелопатической активностью, оказывают влияние на скорость роста и размножения растений, функции микоризы, развитие микроорганизмов (Blanco, 2007).
Процессы проникновения аллелопатических веществ в растения сложны и многообразны. Полагают, что чаще всего они попадают в растения-акцепторы через корневую систему с входящим потоком воды и питательных веществ (Putnam, 1986). У некоторых растений при этом наблюдаются патологические изменения в области ксилемной части проводящих пучков. Так, у растений-акцепторов Salicornia europaea происходит интенсивная лигнификация проводящих путей под действием обладающих аллелопатическими свойствами метаболитов полыни Artemisia santonica, кермека Limonium gmelinii и др. (Симагина, Лысякова, 2010).
На клеточном уровне действие метаболитов, обладающих аллелопатической активностью, проявляется в изменении проницаемости мембран, фотохимической активности хлоропластов, концентрации хлорофилла, влиянии на скорость деления митохондрий, функцию рибосом, то есть в целом, на функционирование клеток (Wink, Twardowski, 1992; Einhellig, 2004). Под действием аллелохимикатов происходит изменение активности мембранных белков и внутриклеточных ферментов, особенно, ферментов антиоксидантной защиты (Li et al., 2011).
Например, окислительный стресс, вызванный 2-бензоксазолиноном (BОА) у растения семейства бобовых Phaseolus aureus, сопровождается увеличением содержания малондиальдегида, пролина, перекиси водорода и повышенной активностью антиоксидантных ферментов, в т.ч. аскорбатпероксидазы, супероксиддисмутазы, гваяколпероксидазы, каталазы и глютатион редуктазы (Batish et al., 2006). Таким образом, действие аллелохимикатов может проявляться как на уровне молекулярных и ультраструктурных изменений клетки, так и на уровне биохимических и физиологических процессов.
Аллелопатические вещества растений
В настоящее время, аллелопатическкая активность выявлена лишь у небольшого числа из идентифицированных продуктов метаболизма растений. В корнях и ризосфере растений обнаружены фенольные соединения, терпеноиды, алкалоиды, стероиды и др. метаболиты, обладающие аллелопатической активностью (Inderjit, Mukerji, 2006). Некоторые растительные аллелохимикаты представлены в таблице 1.
Таблица 1.
Примеры аллелопатических веществ растений (Latif et al., 2017)
| Вещество | Структура | Механизм действия |
|---|---|---|
| Фенольные соединения | ||
| Коричная кислота | 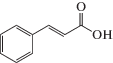 |
Влияние на проницаемость мембран, гормональную активность, дыхание, фотосинтетическую активность, синтез органических соединений |
| Бензойная кислота | 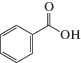 |
|
| Терпеноиды | ||
| 1,8-цинеол | 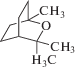 |
Влияние на все стадии митоза, дыхание, проницаемость мембран |
| Тимол |  |
|
| Алкалоиды | ||
| Берберин | 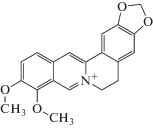 |
Изменение структуры ДНК, влияние на активность ферментов, синтез белков, проницаемость мембран |
| Папаверин | 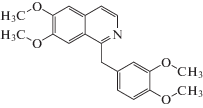 |
|
| Циклические гидроксамовые кислоты | ||
| BOA | 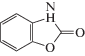 |
Влияние на активность АТФазы, ковалентная модификация белков |
| DIMBOA | 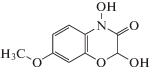 |
|
Особая роль отводится фенольным соединениям, т.к. именно они, являясь наиболее распространенными токсинами высших растений, в значительной степени обусловливают аллелопатическую напряженность в фитоценозах (Гродзинский, 1965). Число известных в настоящее время продуктов метаболизма, относящихся к фенольным соединениям, составляет более 8000 (Latif et al., 2017). Накапливаясь в почве, оксибензойные и оксикоричные кислоты, дигидрохалконы, кумарины, флавоноиды и др. биологически активные вещества этой группы ингибируют прорастание семян и рост растений.
Обширную группу растительных химикатов составляют терпеноиды (табл. 1). Углеродный скелет терпеноидов образован из изопреновых звеньев, число которых может быть различным: от полу- и монотерпенов (1 и 2 изопреновых звена соответственно) до политерпенов (более 8 изопреновых звеньев). По мнению некоторых авторов, значительное структурное разнообразие этой группы химических соединений способствует активному регулированию экологических взаимоотношений в биоценозах (Bardin et al., 2015). К настоящему времени описано более 24 000 терпеноидов, многие из которых, являясь продуктами метаболизма разных растений (от трав до деревьев), могут оказывать как ингибирующее, так и стимулирующее действие на растения и микроорганизмы (Ehlers, 2011).
В аллелопатических взаимодействиях важное место занимают алкалоиды, которые представляют собой гетероциклические азотсодержащие соединения (табл. 1). В настоящее время идентифицировано более 20 000 вторичных метаболитов, относящихся к этой группе (Yang, Stockigt, 2010). Широкое распространение алкалоидов основано на их ключевой роли в защите растений от травоядных животных, других растений и микроорганизмов. Так, синтез никотина дикорастущим табаком р. Nicotiana усиливается при поедании и повреждении растения травоядными животными, при этом никотин проявляет аллелопатическую активность и по отношению к другим распространенным однолетним сорным растениям (Quinn et al., 2014).
Многие растения семейства злаковых синтезируют глюкозиды циклических гидроксамовых кислот, обладающие бактерицидными, фунгицидными и фитотоксическими свойствами. Основные представители соединений этой группы – DIBOA (2,4-дигидрокси-1,4-бензоксазин-3-он) и DIMBOA (2,4-дигидрокси-7-метокси-1,4-бензоксазин-3-он), преобразуются ферментами растений в агликоны, которые проявляют аллелопатическую активность (Latif et al., 2017).
Разложение агликонов приводит к образованию МBОА (6-метокси-2-бензоксазолинон) и BОА (2-бензоксазолинон), также проявляющих аллелопатические свойства (табл. 1). Бензоксазолиноны выполняют функцию защиты растений от вредителей и фитопатогенов. Обладающие аллелопатической активностью метаболиты растений могут выполнять и иные задачи, в т.ч. регулировать активность почвенной биоты, ослаблять, усиливать или модифицировать ее функции, создавая благоприятные условия для роста растений.
Факторы, оказывающие влияние на образование аллелопатических веществ
Образование аллелопатических веществ и эффект от их действия зависят от многих биогенных и абиогенных факторов окружающей среды. Растения, которые растут в почве, обогащенной азотом, образуют меньше биологически активных метаболитов, чем растущие в бедной почве (Tang et al., 1995). Первым данное предположение сделал Коэпп с соавт. (Koeppe et al., 1976), выявившие высокий уровень аллелопатической активности растений при дефиците фосфора и влаги.
При дефиците фосфора корни люпина Lupinus angustifolius выделяют флавоноид генистеин, который является предшественником в биосинтезе антимикробных фитоалексинов и фитоантисипинов (Weisskopf et al., 2006; Zeng et al., 2008). Предполагают, что выделение этих веществ в ризосферу играет важную роль в обеспечении растений фосфором, ограничивая микробное разложение цитрата, с помощью которого происходит мобилизация труднодоступного фосфора (Sugiyama, Yazaki, 2012).
К стрессовым условиям, которые могут стимулировать проявление аллелопатических свойств, относятся УФ излучение, водный стресс, температура (Baldwin, 1989; Reigosa et al., 2002). Стимуляция может происходить как при высокой температуре (Melkiana, 1992), так и при низкой (Koeppe, 1970). Температура оказывает влияние на такие важнейшие характеристики, как активность ферментов и вязкость клеточных мембран.
Значимую роль в синтезе аллелопатических веществ играет тип почвы. В почве с крупной грануляцией, хорошо аэрируемой, аллелохимикатов образуется больше, чем в почве с плотной структурой (Inderjit, Dakshini, 1994). К биотическим факторам стимуляции относятся патогены, паразиты, вредители растений, а также взаимодействие с другими растениями (Baldwin, 1989; Rivoal et al., 2011).
Из представленной информации следует, что растения более интенсивно образуют вещества, обладающие аллелопатической активностью, в неблагоприятных условиях среды.
Аллелопатия в лесных экосистемах
Аллелопатия широко распространена в лесах, оказывает влияние на их рост и развитие (Blanco, 2007). Это явление наблюдается у многих видов древесных растений, как в лесах умеренного климата, так и в северных, тропических, а также в эвкалиптовых лесах Австралии. Интенсивность образования и эффективность действия биологически активных веществ древесных растений существенно зависит от свойств почвы и других условий окружающей среды (Weidenhamer, 1989).
Аллелопатия играет важную роль в управлении лесами и улучшении их качества (Мосина, Мерзлая, 2013; Mallik, 2003; Blanco, 2007). В настоящее время исследования этого феномена в лесных экосистемах, в силу его практической и научной значимости, проводятся во многих странах. Однако, несмотря на важность и широкое распространение аллелопатии в лесных экосистемах, информация по этой проблеме в настоящее время весьма ограничена, разрознена, часто противоречива. По мнению многих авторов, это связано c проявлением аллелопатии в комбинации с другими механизмами действия, а также с трудностями разделения аллелопатического действия и влияния других факторов, особенно пищевой конкуренции (Wardle et al., 1998; Kimmins, 2004).
АЛЛЕЛОПАТИЧЕСКИЕ СВОЙСТВА МИКРООРГАНИЗМОВ
Микробиологический контроль фитопатогенов
Интерес к аллелопатическим свойствам почвенных микроорганизмов существенно возрос в последние десятилетия, в связи с активной разработкой методов защиты растений от фитопатогенов, в основе которых лежит регуляция аллелопатической активности растений в фитоценозах (Гродзинский 1991; Максимов и др., 2011; Aslam et al., 2017).
С практической точки зрения, микробиологический контроль фитопатогенов представляет собой альтернативу химическим средствам защиты растений (ХСЗР), применяемым для этих же целей (Javaid, Shoaib, 2013). Эффективность ХСЗР достаточно высока, однако пестициды уничтожают не только фитопатогены, но и полезные виды микроорганизмов, кроме того, большинство из них слабо утилизируются почвенной микробиотой, накапливаются в продуктах питания и обладают высокой канцерогенностью (Максимов и др., 2011; Patni et al., 2018). В отличие от ХСЗР, действие микробиологических препаратов основано на регулировании численности патогенных микроорганизмов, формировании конкурентных взаимоотношений с аборигенными микроорганизмами и индуцировании природной системной устойчивости.
Исследования многих авторов показали, что антагонистами фитопатогенов могут быть филогенетически различные микроорганизмы. Основная часть исследований в области микробной аллелопатии выполнена с микромицетами и бактериями, меньшая часть – с актиномицетами, несмотря на то, что именно они являются основным источником антибиотиков в природе (Podile, Kishore, 2006; Postolaky et al., 2012; Gerbore et al., 2014). На основе грибов – представителей родов Ampelomyces, Candida, Coniothyrium, Trichoderma, бактерий – родов Agrobacterium, Pseudomonas, Bacillus, Streptomyces созданы коммерческие биопрепараты.
Аллелопатическая активность бактерий
Бактерии, обладающие полезными для растений свойствами, принято обозначать аббревиатурой PGPR (plant-growth-promoting-rhizobacteria) или СРРМ (стимулирующие рост растений микроорганизмы). В США PGPR зарегистрированы как биопестициды (Slininger et al., 2003).
Различные метаболиты, выделяемые корнями растений, снабжают питательными веществами микроорганизмы, образующие с ними тесную ассоциацию – в тканях корневой системы, на поверхности корней и в окружающей их почве (Боронин, 1998). В ризосфере доминируют Гр– бактерии, относящиеся к роду Pseudomonas, – P. pulida, P. fluorescens, P. aureotaciens, P. corrugata и др. Эти бактерии также являются объектом агробиотехнологии. На их основе разрабатывают природные средства защиты растений от фитопатогенов, биостимуляторы роста и продуктивности растений (Соколов, Литвишко, 1993; Podile, Kishore, 2006). Обработка посевного материала, корней, проростков растений некоторыми штаммами PGPR псевдомонад может в значительной степени снизить заболеваемость растений и увеличить их урожайность (Боронин, 1998).
Среди бактерий, колонизирующих корни растений (ризобактерии), по характеру их действия выделяют полезные, вредные и нейтральные (Dobbelaere et al., 2003). В основе бактериального антагонизма лежат многие факторы, в т.ч. образование антибиотиков и сидерофоров; синтез гидролитических ферментов (хитиназы, глюконазы, протеазы, липазы), способных лизировать клетки других бактерий или грибов; конкуренция за питательные вещества на поверхности корневой системы растений; регуляция уровня растительного гормона этилена с участием фермента АЦК-деаминазы в ответ на стрессовое воздействие фитопатогенов (Максимов и др. 2011, 2018; van Loon, 2007).
Антибиотики, бактериоцины и сидерофоры относятся к числу наиболее эффективных биологически активных метаболитов, действие которых ограничивает (или полностью прекращает) распространение фитопатогенов (Beneduzi et al., 2012). Внимание исследователей к сидерофорам (комплексонам железа) связано с тем, что одним из ограничивающих факторов роста фитопатогенных микроорганизмов является низкая биодоступность ионов железа.
Многие авторы отмечают важную роль антифунгальных антибиотиков в антагонистических взаимоотношениях (Haas, Keel, 2003). Образование одного или нескольких антибиотиков – наиболее общий и распространенный способ контроля фитопатогенов (Glick et al., 2007). Так, Streptomyces hygroscopicus является продуцентом трех активных против фитопатогенов антибиотиков – гелдамицина, нигерицина и хидантоцидина (Inderjit, Mukerji, 2006).
Среди антибиотиков, синтезируемых псевдомонадами, – флороглюцин, производные феназина, пиолютеорин, пирролнитрин; представителями рода Bacillus – итурин A, сурфактин, цвиттермицин A; агробактериями – агросин 84 и др. (Ulloa-Ogaz et al., 2015). Действие каждого антибиотика осуществляется по свойственному ему механизму: одни влияют на функции рибосом, другие – на клеточные мембраны или иные компоненты клетки (Reid et al., 2002). В целом, микробные антибиотики проявляют антивирусное, антибактериальное, инсектицидное, антигельминтное, антиоксидантное действия, способствующие росту растений (Dilantha et al., 2005).
Многие непатогенные бактерии проявляют аллелопатическую активность по отношению к высшим растениям (табл. 2). Однако, несмотря на то, что в настоящее время известно значительное число бактериальных аллелохимикатов, в качестве гербицидов применяют лишь единицы, в т.ч. фосфинотрицин – продукт метаболизма S. viridochromogenes, и биалафос – продукт метаболизма S. hygroscopicus (Schwartz et al., 2004). Это объясняется тем, что в полевых условиях аллелопатическая активность большинства препаратов оказывается значительно более слабой, чем в условиях лаборатории (Barazani, Friedman, 2001).
Таблица 2.
Аллелопатическая активность бактерий по отношению к высшим растениям
| Бактерии | Аллелохимикаты | Чувствительные растения | Концентрация | Эффект* (%) | Источник |
|---|---|---|---|---|---|
| Pseudomonas sp. | HCN | Картофель Solanum tuberosum | 0.13 мг л–1 | 40 | Bakker, Schippers, 1987 |
| Bradyrhizobium japonicum | Ризобиотоксин, индол-3-уксусная кислота | н/о | н/о | н/о | Minamisawa, Fukai, 1991 |
| Thermoactino-mycete sp. | 5'- деоксигуанозин | Ряска малая Lemna minor |
100 мг л–1 | н/о | Isaac et al., 1991 |
| Streptomyces hygroscopicus | Гелдамицин, нигерицин | Кресс-салат Lepidium sativum | 1–2 мг л–1 | 50 | Heisey, Putnam, 1986 |
| Streptomyces hygroscopicus | Хидантоцидин | Ползучий сорняк Digitaria ischaemum, горчица полевая Sinapis arvensis и др. | 500 мг л–1 | 100 | Nakajima et al., 1991 |
| Streptomyces sp. | Бластицидин, 5-гидроксиметил-бластицидин |
Коровий горох Vigna sinensis, мокрица Stellaria media, вероника Veronica persica | 100 мг м–2 | 64–98 | Scacchi et al., 1992 |
| Streptomyces sp. | Фтоксазолины B, C, D |
Редька Raphanus sativus, сорго Sorghum bicolor | 63–250 мг на пробирку | 40–90 | Shioimi et al., 1995 |
| Streptomyces chromofuscus | Гербоксидиен | Кукуруза Zea mays, рапс Brassica napus, гречиха Fagopyrum sagittatum | 6.9 мг м–2 | 100 | Miller-Wideman et al., 1992 |
Биологически активные вещества, образуемые грибами
Важнейшим компонентом почвенного микробного сообщества являются грибы, биомасса которых превышает 50% от общей биомассы почвенных микроорганизмов (Звягинцев, 1999). В процессе метаболизма грибы синтезируют многие биологически активные вещества, в т.ч. ферменты, антибиотики, различные токсины.
Особое внимание уделяется токсинам грибов, обладающим бактерицидным и фунгицидным действием. В общебиологическом смысле токсины грибов рассматривают как антибиотики (Егоров, 2004). Продуцентами токсинов могут быть представители самых разных систематических групп, в том числе несовершенные грибы, аскомицеты, зигомицеты, оомицеты, энтомопатогенные грибы и др.
Токсины грибов могут поражать различные организмы – растения, животных, грибы и бактерии (Battilani et al., 2016). Многие микотоксины токсичны и для микроорганизмов, и для растений, и для человека. Широким спектром биологического действия обладают токсины дейтеромицетов родов Penicillium, Aspergillu и Fusarium, некоторые из которых представлены в табл. 3.
Таблица 3.
Токсины грибов и спектр их биологического действия по данным (Свистова и др., 2004)
| Микотоксины | Продуценты | Биологическое действие |
|---|---|---|
| Рубротоксин | Penicillium rubrum, P. funiculosum |
Фунгицидное, фитотоксическое, зоотоксическое |
| Стеригматоцистин | Aspergillus ustus, A. nidulans, A. versicolor |
Бактерицидное, фитотоксическое, зоотоксическое |
| Патулин | P. daleae, P. expansum A. clavatus |
Фунгицидное, бактерицидное, фитотоксическое, зоотоксическое |
| Цитринин | P. citrinum, A. pseudoterreus |
Фунгицидное, бактерицидное, фитотоксическое, зоотоксическое |
| Охратоксин | A. ochraceus, A. clavatus, P. veridicatum |
Фунгицидное, бактерицидное, фитотоксическое, зоотоксическое |
| Фумигатин | A. fumigates, A. flavus |
Фунгицидное, фитотоксическое, амебоцидное |
| Триходермин | Trichoderma spp. | Фунгицидное, зоотоксическое |
| Фузариевая кислота | Fusarium solani, F. oxysporum |
Фунгицидное, бактерицидное, фитотоксическое |
Cреди токсинов грибов наиболее часто встречаются циклические терпеноиды, поликетиды, циклические полипептиды (Daguerre et al., 2014). К поликетидам относятся многие сильные микотоксины, обладающие не только зоотоксическими, но и фитотоксическими свойствами, в т.ч. альтернариол (Alternaria tenuissima), афлатоксин (Aspergillus fumigatus), зеараленон (Fusarium spp.), патулин, цитринин (Penicillium spp.) и др. (Берестецкий, 2008).
Механизм действия токсинов различен. Основными мишенями токсического действия микотоксинов являются компоненты клеточных мембран, в т.ч. структурные и транспортные белки и ферменты (Берестецкий, 2008; Duke, Dayan, 2011). При этом, одни токсины увеличивают активность окислительных ферментов и дыхания у растений, другие – ингибируют процессы дыхания и фотосинтеза, закупоривают проводящую систему, ослабляют водный баланс растений (Мирчинк, 1988; Билай, 1989). У прокариот грибные токсины могут подавлять дыхание и активность фосфорилирования (Егоров, 2004).
В функционировании системы почва—микробное сообщество—растения микромицеты-токсинообразователи получают дополнительные преимущества, что обеспечивает им победу в обостряющейся конкурентной борьбе (Свистова и др., 2004). Аккумуляция таких грибов в почве вызывает токсикоз, в результате которого снижается продуктивность растений. Этот феномен в агрокультуре известен как “утомление” почвы (Берестецкий, 1978).
Фитотоксины грибов заметно различаются по стабильности (Vanhoutte et al., 2016). Так, фитотоксины Rhizopus stoloniter быстро инактивируются в почве, активность фитотоксинов Penicillum daleae, Aspergillum ustus, Trichoderma harzianum сохраняется дольше, а фитотоксины T. flavus и, особенно A. clavatus, длительное время проявляют высокую активность (Свистова и др., 2003).
Аллелопатические функции ферментов
Важную аллелопатическую функцию выполняют литические ферменты микроорганизмов. Клеточные стенки грибов состоят преимущественно из хитина и глюкана, поэтому основные литические ферменты грибов – это хитиназы и глюканазы. Вместе с протеазами, литические ферменты являются необходимой составляющей процесса микопаразитизма (Daguerre et al., 2014). Микопаразитизм (или гиперпаразитизм) основан на использовании ресурсов одного гриба другим в паразитических целях. Синтез хитиназ, глюканаз и протеаз позволяет грибу-паразиту растворять клеточную стенку и проникать в гифы фитопатогенных грибов.
Например, β-1,3-глюканаза, синтезируемая Clonostachys rosea и другими грибами, разрушает клеточные стенки возбудителя корневой гнили Pythium aphanidermatum и возбудителя фузариоза Fusarium oxysporum (Chernin, Chet, 2002; Kamensky et al., 2003; Chatterton, Punja, 2009). Хитиназа Serratia plymuthica гидролизует клеточные стенки и ингибирует образование спор у плесневых грибов Botrytis cinerea, вызывающих многочисленные заболевания растений. При совместном действии хитинолитических и глюканолитических ферментов наблюдается значительный синергический эффект, особенно при совокупном действии эндохитиназ и β-1,3-глюканаз (Steyaert et al., 2004).
Протеазы грибов участвуют не только в разрушении клеточных стенок организма-хозяина, но и в инактивации ферментов патогена, ответственных за инфекционный процесс (Daguerre et al., 2014). Высокий уровень синтеза протеаз может вызвать деградацию других ферментов, которые важны для регуляции микопаразитизма (Flores et al., 1997). В процессе микопаразитизма продукты разложения клеточной стенки действуют как стимуляторы литических ферментов в системе паразит–патоген. Следует заметить, что эти ферменты имеются не только у грибов, но и у бактерий и высших растений (Коломбет, 2007).
Полагают, что в основе воздействия микроорганизмов-антагонистов на фитопатогенные грибы могут лежать аллелопатические взаимоотношения (антибиоз), микопаразитизм, а также их совместное действие, отражающее сложный характер микробных взаимодействий в почве (Benhamou et al., 2012).
Так, при антагонизме Trichoderma harzianum и Botritis cinerea, наблюдается синергизм между пептидными антибиотиками (пептаиболами) и β-1,3-глюканазами, хитиназами и протеазами, участвующими в гидролизе клеточной стенки (Schirmbock et al., 1994). По мнению авторов, пептидные антибиотики ингибируют мембраносвязанную синтетазу β-1,3-глюкана хозяина, подавляют ресинтез β-глюкана клеточной стенки и поддерживают разрушающее действие β-глюканаз, что приводит к возникновению синергетического эффекта и усилению фунгицидной активности.
Влияние факторов окружающей среды на аллелопатическую активность микроорганизмов
Аллелопатическая активность микроорганизмов, как и растений, в значительной степени зависит от биотических и абиотических факторов среды, в том числе от численности микроорганизмов в почве (Friedman et al., 1989; Reigosa et al., 1999). Характер действия биологически активных метаболитов на высшие растения определяется их концентрацией в почве, а, следовательно, численностью микроорганизмов, образующих биологически активные вещества.
При взаимодействии фитопатогенов и их антагонистов важную роль играют температура, уровень кислотности и тип почвы, сорт и линия растений (Коломбет, 2007). В условиях стресса, вызванного недостатком питательных веществ, изменением влажности почвы, аллелопатический эффект может усиливаться (Barazani, Friedman, 2001).
Увеличение аллелопатической активности происходит и под влиянием антропогенных факторов, в том числе при загрязнении почвы нефтепродуктами, пестицидами, тяжелыми металлами (Свистова и др., 2004; Поляк и др., 2017). В загрязненных экосистемах, в связи с возрастанием роли “метаболического регулирования” структуры микробного сообщества почвы, накапливается значительное число видов микроскопических грибов, обладающих широким спектром фунгицидного, антибиотического и фитотоксического действия (Свистова и др., 2004).
ТРАНСФОРМАЦИЯ АЛЛЕЛОХИМИКАТОВ МИКРООРГАНИЗМАМИ
Микробное сообщество почвы оказывает существенное влияние на аллелопатические взаимоотношения в почве, активно участвуя в их разложении. Микроорганизмы-деструкторы аллелопатически активных веществ выявлены как среди почвенных бактерий, так и среди грибов (табл. 4). В большинстве случаев, в результате превращения биологически активных веществ в менее токсичные соединения (или их полной утилизации), происходит снижение аллелопатической активности, но возможен и прямо противоположный эффект (Cipollini et al., 2012).
Таблица 4.
Микроорганизмы-деструкторы аллелопатически активных веществ
| Микроорганизмы | Аллелопатически активные вещества | Источник |
|---|---|---|
| Грибы | ||
| Phomopsis liquidambari | Коричная кислота | Xie, Dai, 2015 |
| Cephalosporium furcatum, Mortierella ramanniana, Rhodotorula rubra, Mucor sp., Trichoderma sp. |
Феруловая кислота | Turner, Rice, 1975 |
| Rhodotorula glutinis | p-кумаровая кислота | Zhang et al., 2010 |
| Chaetosphaeria sp. | 2-бензоксазолинон, 2-гидрокси-1,4-бензоксазин-3-он |
Zikmundova et al., 2002 |
| Helotiales sp. | Бензойная кислота, p-оксибензойная кислота, ванилиновая кислота |
Liu et al., 2018 |
| Cephalosporium aphidicola | Цедрол | Hanson, Nasir, 1993, Gand et al., 1995 |
| Бактерии | ||
| Pseudomonas putida | p-оксибензойная кислота | Chen et al., 2015 |
| Klebsiella oxytoca, Erwinia uredovora |
Гидрокоричная кислота | Hashidoko et al., 1993 |
| Pseudomonas putida, Pseudomonas nitroreducens | p-кумаровая кислота | Zhang et al., 2010 |
| Streptomyces setonii | Коричная, p-кумаровая и феруловая кислоты |
Sutherland et al., 1983 |
| Streptomyces bottropensis | (-)-цис-карвеол | Nishimura et al., 1983 |
| Matsuebacter sp. | Галлиевая кислота | Müller et al., 2007 |
| Acinetobacter calcoaceticus | Бензоксазол, (+)-катехин | Chase et al., 1991, Arunachalam et al., 2003 |
Микроорганизмы могут усиливать действие аллелопатических веществ путем трансформации в более токсичные продукты (Inderjit, 2005; Cipollini et al., 2012). Так, бактерии Acinetobacter calcoaceticus способны трансформировать 2-бензоксазолинон в более токсичные для растений 2,2'-оксо-1,1'-азобензол (AZOB) и его метоксипроизводные (Macías et al., 2008).
В то же время, в процессе утилизации микроорганизмами биологически активных соединений фенольной природы происходит снижение уровня фитотоксичности почвы (Jilani et al., 2008). Почвенные микроорганизмы снижают концентрацию в почве таких высокотоксичных веществ, как катехины и 8-оксихинолин, выделяемых корнями Centaurea maculosa и C. diffusa (Ehlers, Thompson, 2004; Perry et al., 2007; Inderjit et al., 2008). При исследовании антибактериальной и антифунгальной активности растений семейства Lamiaceae было установлено, что некоторые бактерии разлагают образуемые растениями монотерпены и используют их в своем метаболизме (Vokou et al., 2002; Kalemba, Kunicka, 2003).
Некоторые микроорганизмы способны разлагать токсины фитопатогенов (McCormick, 2013; Vanhoutte et al., 2016). Представители грибов р. Trichoderma разлагают токсины возбудителей болезней виноградной лозы (эутипин, D-3-фениллактиковую кислоту, 4-гидроксибензальдегид), вызывающие некроз древесины, причем это свойство является видоспецифичным (Коломбет, 2007). Так, штамм T. album Preuss разлагает эутипин с образованием нетоксичного спирта эутипинола, другой штамм Trichoderma обладает способностью к биодеградации эутипина и 4-гидроксибензальдегида, а штамм T. atroviride разлагает все три токсина.
Эти и многие другие результаты свидетельствуют о важной и многообразной роли микроорганизмов в почве, чем, по-видимому, и объясняется интерес к изучению их аллелопатических свойств (Blanco, 2007). Способность микроорганизмов к деградации токсинов фитопатогенов может быть использована для борьбы с заболеваниями растений.
ЗАКЛЮЧЕНИЕ
Аллелопатия – природный процесс, который происходит в любой почвенной экосистеме. За последние десятилетия получены существенные результаты, касающиеся выделения и идентификации метаболитов растений и микроорганизмов с аллелопатическими свойствами, их роли в природных биоценозах. Сложность проведения такого рода исследований связана с влиянием на аллелопатическую активность многих биотических и абиотических факторов среды, что приводит к определенной разрозненности и противоречивости результатов.
Особо следует отметить негативное влияние на аллелопатические взаимоотношения растений и микроорганизмов химических средств защиты растений – гербицидов, фунгицидов, нематоцидов. Они изменяют физико-химические свойства почв, вызывают дисбаланс почвенных микроорганизмов. В значительной степени, этим определяется интерес к практическому применению аллелопатии как способу сокращения количества агрохимикатов, вносимых в почву.
По мнению ряда авторов, перспективным направлением исследований является использование феномена аллелопатии для увеличения урожая, создания устойчивых культур, контроля за сорной растительностью (Einhellig, 1995; Beneduzi et al., 2012). Некоторые успехи уже достигнуты при выращивании сельскохозяйственных культур, например кукурузы, пшеницы, овса, ячменя, гороха, сои, томатов и др. (Gray, Smith, 2005). Ведущая роль в решении этих задач принадлежит почвенным микроорганизмам – грибам и бактериям.
К важнейшим направлениям дальнейших исследований относятся (Einhellig, 1995; Zak et al., 2003; Inderjit et al., 2011; Aslam et al., 2017):
– характеристика свойств аллелохимикатов, определение механизмов их действия на молекулярном и физиологическом уровнях;
– повышение аллелопатической активности сельскохозяйственных культур;
– изучение влияния природных и антропогенных факторов на образование, устойчивость и активность соединений, обладающих аллелопатической активностью;
– разработка новых методов исследования аллелопатических веществ растений и микроорганизмов. Особенно полезными при изучении взаимодействий сложных биологических систем могут стать современные молекулярные методы исследования, такие, как метаболомный анализ (Latif et al., 2017).
Все это позволит лучше понять взаимоотношения растений и микроорганизмов, определяющие их роль в микробно-растительных ассоциациях и в системах паразит–хозяин в природе. Сложность проблемы аллелопатии в целом, и каждой из ее задач в отдельности, свидетельствует о необходимости интенсивных исследований в данной области учеными разных стран.
Список литературы
Берестецкий О.А. Фитотоксины почвенных микроорганизмов и их экологическая роль / Фитотоксические свойства почвенных микроорганизмов. Л.: ВНИИ с.х. микробиологии, 1978. С. 7–31.
Берестецкий А.О. Фитотоксины грибов: от фундаментальных исследований – к практическому использованию (Обзор) // Прикл. биохим. микробиол. 2008. Т. 44. № 5. С. 501–514.
Билай В.И. Основы общей микологии. Киев: Вища школа, 1989. 392 с.
Боронин А.М. Ризосферные бактерии рода Pseudomonas, способствующие росту и развитию растений // Соровский образов. журн. 1998. № 10. С. 25–31.
Гродзинский А.М. Аллелопатия в жизни растений и их сообществ. Киев: Наукова думка, 1965. 198 с.
Гродзинский А.М. Аллелопатия растений и почвоутомление: избранные труды. Киев: Наукова думка, 1991. 432 с.
Егоров Н.С. Основы учения об антибиотиках. М.: Изд-во МГУ, Наука, 2004. 528 с.
Звягинцев Д.Г. Структурно-функциональная роль почвы в биосфере. М.: Геос, 1999. 278 с.
Назаров В.В., Широков А.И. Предварительные результаты изучения аллелопатического действия некоторых орхидных in vitro // Уч. записки Таврического нац. ун-та им. В. И. Вернадского. 2014. Т. 27. № 5. С. 102–109.
Коломбет Л.В. Грибы рода Trichoderma – продуценты биопрепаратов для растениеводства / Ред. Ю.Т. Дьяков, Ю.В. Сергеев // Микология сегодня. Т. 1. М.: Нац. акад. микологии, 2007. С. 323–371.
Кондратьев М., Карпова Г., Ларикова Ю. Взаимосвязи и взаимоотношения в растительных сообществах. М.: РГАУ–МСХА, 2014. 300 с.
Максимов И.В., Абизгильдина Р.Р., Пусенкова Л.И. Стимулирующие рост растений микроорганизмы как альтернатива химическим средствам защиты от патогенов (обзор) // Прикл. биохим. микробиол. 2011. Т. 47. № 4. С. 373–385.
Максимов И.В., Максимова Т.И., Сарварова Е.Р., Благова Д.К. Эндофитные бактерии как агенты для биопестицидов нового поколения (обзор) // Прикл. биохим. микробиол. 2018. Т. 54. № 2. С. 134–148.
Мирчинк Т.Г. Почвенная микология. М.: МГУ, 1988. 220 с.
Мосина Л.В., Мерзлая Г.Е. Экологическая оценка влияния органических и минеральных удобрений на микрофлору дерново-подзолистой почвы и продуктивность агроценозов в экстремальных погодных условиях // Изв. ТСХА. 2013. Вып. 5. С. 5–18.
Наумов Г.Ф. Аллелопатические свойства выделений прорастающих семян полевых культур и их сельскохозяйственное значение / Аллелопатия и продуктивность растений. Харьков: Харьк. СХИ им. В.В. Докучаева, 1988. С. 5–12.
Поляк Ю.М., Бакина Л.Г., Маячкина Н.В., Галдиянц А.А. Роль аллелопатических взаимодействий в структурных и функциональных изменениях антропогенно-нарушенных почв // Гумус и почвообразование. 2017. № 21. С. 65–69.
Свистова И.Д., Щербаков А.П., Фролова Л.О. Фитотоксическая активность сапрофитных микромицетов чернозема: специфичность, сорбция и стабильность фитотоксинов в почве // Прикл. биохим. микробиол. 2003. Т. 39. № 4. С. 441–445.
Свистова И.Д., Щербаков А.П., Фролова Л.О. Токсины микромицетов чернозема: спектр антибиотического действия и роль в формировании микробного сообщества // Почвоведение. 2004. № 10. С. 1220–1227.
Симагина Н.О., Лысякова Н.Ю. Влияние аллелопатических взаимодействий на лигнификацию анатомических структур однолетних галофитов // Экосистемы, их оптимизация и охрана. 2010. Вып. 2. С. 75–83.
Соколов М.С., Литвишко Е.В. Биологическая защита растений в США // Защита растений. 1993. № 11. С. 18–20.
Anaya A.L., Saucedo-García A., Contreras-Ramos S.M., Cruz-Ortega R. Plant-mycorrhizae and endophytic fungi interactions: broad spectrum of allelopathy studies // Allelopathy / Eds Z.A. Cheema, M. Farooq, A. Wahid. 2013. P. 55–80.
Arunachalam M., Mohan N., Sugadev R. et al. Degradation of (+)-catechin by Acinetobacter calcoaceticus MTC 127 // Biochim. Biophys. Acta. 2003. V. 1621. P. 261–265.
Aslam F., Khaliq A., Matloob A. et al. Allelopathy in agro-ecosystems: a critical review of wheat allelopathy – concepts and implications // Chemoecology. 2017. V. 27. P. 1–24.
Bais H.P., Vepachedu R., Gilroy S. et al. Allelopathy and exotic plant invasion: from molecules and genes to species interactions // Science. 2003. V. 301. P. 1377–1380.
Baldwin I.T. Mechanism of damage-induced alkaloid production in wild tobacco // J. Chem. Ecol. 1989. V. 15. P. 1661–1680.
Bakker A.W., Schippers B. Microbial cyanide production in the rhizosphere in relation to potato yield reduction and Pseudomonas spp. – mediated plant growth-stimulation // Soil Biol. Biochem. 1987. V. 19. P. 451–457.
Barazani O., Friedman J. Allelopathic bacteria and their impact on higher plants // Crit. Rev. Microbiol. 2001. V. 27. P. 41–55.
Bardin M., Ajouz S., Comby M. et al. Is the efficacy of biological control against plant diseases likely to be more durable than that of chemical pesticides? // Front. Plant Sci. 2015. V. 6. P. 566. DOI: https://doi.org/10.3389/fpls.2015.00566
Batish D.R., Singh H.P., Setia N. et al. 2-Benzoxazolinone (BOA) induced oxidative stress, lipid per-oxidation and changes in some antioxidant enzyme activities in mung bean (Phaseolus aureus) // Plant Physiol. Biochem. 2006. V. 44. P. 819–827.
Battilani P., Stroka J., Magan N. Foreword: mycotoxins in a changing world // World Mycotoxin J. 2016. V. 9. P. 647–651.
Beneduzi A., Ambrosini A., Passaglia L.M.P. Plant growth-promoting rhizobacteria (PGPR): Their potential as antagonists and biocontrol agents // Gen. Mol. Biol. 2012. V. 35. 4 (Suppl). P. 1044–1051.
Blair A.C., Nissen S.J., Brunk G.R., Hufbauer R.A. A lack of evidence for an ecological role of the putative allelochemical (+/–)-catechin in spotted knapweed invasion success // J. Chem. Ecol. 2006. V. 32. P. 2327–2331.
Blanco J.A. The representation of allelopathy in ecosystem-level forest models // Ecol. Modell. 2007. V. 209. P. 65–77.
Chase W.R., Nair M.G., Putnam A.R., Mishra S.K. 2,2'-oxo-1,1'-azobenzene: microbial transformation of rye (Secale cereale L.) allelochemicals in field soils by Acinetobacter calcoaceticus: III // J. Chem. Ecol. 1991. V. 17. P. 1575–1584.
Chatterton S., Punja Z.K. Chitinase and β-1,3-glucanase enzyme production by the mycoparasite Clonostachys rosea f. catenulata against fungal plant pathogens // Can. J. Microbiol. 2009. V. 55 (4). P. 356–367.
Cheng F., Cheng Z. Research progress on the use of plant allelopathy in agriculture and the physiological and ecological mechanisms of allelopathy // Front. Plant Sci. 2015. V. 6. P. 1020.
Chernin L., Chet I. Microbial enzymes in biocontrol of plant pathogens and pests / Eds. R. Burns, R. Dick // Enzymes in the environment: activity, ecology, and applications. Netherlands: Marcel Dekker, 2002. P. 171–225.
Cipollini D., Rigsby C.M., Barto E.K. Microbes as targets and mediators of allelopathy in plants // J. Chem. Ecol. 2012. V. 38. P. 714–727.
Daguerre Y., Siegel K., Edel-Hermann V., Steinberg C. Fungal proteins and genes associated with biocontrol mechanisms of soil-borne pathogens: a review // Fung. Biol. Rev. 2014. V. 28. P. 97–125.
Dilantha W.G., Nakkeeran S., Zhang Y. Biosynthesis of antibiotics by PGPR and its relation in biocontrol of plant diseases // PGPR: biocontrol and biofertilization / Ed. Z.A. Siddiqui. Dordrecht: Springer, 2005. P. 67–109.
Dobbelaere S., Vanderleyden J., Okon Y. Plant growthpromoting effects of diazotrophs in the rhizosphere // CRC Crit. Rev. Plant Sci. 2003. V. 22. P. 107–149.
Duke S.O., Dayan F.E. Modes of action of microbially-produced phytotoxins // Toxins. 2011. V. 3(8). P. 1038–1064.
Ehlers B.K., Thompson J. Do co-occurring plant species adapt to one another? The response of Bromus erectus to the presence of different Thymus vulgaris chemotypes // Oecologia. 2004. V. 141. P. 511–518.
Ehlers B.K. Soil microorganisms alleviate the allelochemical affects of a thyme monoterpene on the performance of an associated grass species // PLoS One. 2011. V. 6. P. e26321.
Einhellig F.A. Allelopathy: current status and future goals // Allelopathy: organisms, processes, and applications / Eds Inderjit, K.M.M. Dakshini, F.A. Einhellig. Washington DC: Am. Chem. Society, 1995. P. 1–24.
Einhellig F.A. Mode of allelochemical action of phenolic compounds // Allelopathy, chemistry and mode of action of allelochemicals / Eds F.A. Macıas, J.C.G. Galindo, J.M.G. Molinillo, H.G. Gutter. Boca Raton: CRC Press, 2004. 372 p.
Elijarrat E., Barcelo D. Sample handling and analysis of allelochemical compounds in plants // Trends Anal. Chem. 2001. V. 20. P. 584–590.
Flores A., Chet I., Herrera-Estrella A. Improved biocontrol activity of Trichoderma harzianum strains by over-expression of the proteinase encoding gene prb1 // Curr. Genet. 1997. V. 31. P. 30–37.
Friedman J., Hutchins A., Li C.Y., Perry D.A. Actinomycetes inducing phytotoxic or fungistatic activity in Douglas-fir forest and in an adjacent area of repeated regeneration failure in Southwestern Oregon // Biologia Plantarum. 1989. V. 31(6). P. 487–495.
Gand E., Hanson J.R., Nasir H. The biotransformation of 8‑epicedrol and some relatives by Cephalosporium aphicola // Phytochemistry. 1995. V. 39. P. 1081–1084.
Gerbore J., Benhamou N., Vallance J. et al. Biological control of plant pathogens: advantages and limitations seen through the case study of Pythium oligandrum // Environ. Sci. Pollut. Res. 2014. V. 21. P. 4847–4860.
Glick B.R., Cheng Z., Czarny J., Duan J. Promotion of plant growth by ACC deaminase-producing soil bacteria // Eur. J. Plant Pathol. 2007. V. 119. P. 329–339.
Gray E.J., Smith D.L. Intracellular and extracellular PGPR: commonalities and distinctions in the plant-bacterium signaling processes // Soil Biol. Biochem. 2005. V. 37. P. 395–412.
Haas D., Keel C. Regulation of antibiotic production in root-colonizing Pseudomonas spp. and relevance for biological control of plant disease // Annu. Rev. Phytopathol. 2003. V. 41. P. 117–153.
Hanson J.R., Nasir H. Biotransformation of sesquiterpenoid, cedrol, by Cephalosporium aphidicola // Phytochemistry. 1993. V. 33. P. 835–837.
Hashidoko Y., Urashima M., Yoshida T., Mizutani J. Decarboxylative conversion of hydrocinnamic acids by Klebsiella oxytoca and Erwinia uredovora, epiphytic bacteria of Polymnia sonchifolia leaf, possibly associated with formation of microflora on the damaged leaves // Biosci. Biotech. Biochem. 1993. V. 57. P. 215–219.
Heisey R.M., Putnam A.R. Herbicidal effects of geldanamycin and nigericin, antibiotics from Streptomyces hygroscopicus // J. Nat. Prod. 1986. V. 49. P. 859–865.
Hierro J.L., Callaway R.M. Allelopathy and exotic plant invasion // Plant Soil. 2003. V. 256. P. 29–39.
Inderjit, Dakshini K.M.M. Allelopathic effect of Pluchea lanceolata (Asteraceae) on characteristics of four soils and tomato and mustard growth // Am. J. Bot. 1994. V. 81. P. 799–804.
Inderjit. Plant phenolics in allelopathy // Bot. Rev. 1996. V. 62 (2). P. 186–202.
Inderjit. Multifaceted approach to study allelochemicals in an ecosystem / Eds M.J. Reigosa, N. Pedrol // Allelopathy: from molecules to ecosystems. Plymouth: Science Publishers Inc., 2002. P. 271–276.
Inderjit. Soil microorganisms: an important determinant of allelopathic activity // Plant Soil. 2005. V. 274. P. 227–236.
Inderjit, Mukerji K.G. Allelochemicals: biological control of plant pathogens and diseases. Dordrecht: Springer, 2006. 208 p.
Inderjit, Pollock J.L., Callaway R.M., Holben W. Phytotoxic effects of (6)-catechin in vitro, in soil, and in the field // PLoS One. 2008. V. 3. P. e2536.
Inderjit, Wardle D.A., Karban R., Callaway R.M. The ecosystem and evolutionary contexts of allelopathy // Trends Ecol. Evolut. 2011. V. 26. P. 655–662.
Isaac B.G., Ayer S.W., Letendre L.J., Stonard R.J. Herbicidal nucleosides from microbial sources // J. Antibiot. 1991. V. 44. P. 729–732.
Javaid A., Shoaib A. Allelopathy for the management of phytopathogens // Allelopathy: current trends and future applications / Eds. Z.A. Cheema, M. Farooq, A. Wahid. Berlin, Germany: Springer Publishers, 2013. P. 299–319.
Jilani G., Mahmood S., Chaudhry A.N. et al. Allelochemicals: sources, toxicity and microbial transformation in soil — a review // Ann. Microbiol. 2008. V. 58. P. 351–357.
Jose S., Williams R., Zamora D. Belowground ecological interactions in mixed-species forest plantations // For. Ecol. Manage. 2006. V. 233. P. 231–239.
Kalemba D., Kunicka A. Antibacterial and antifungal properties of essential oils // Curr. Med. Chem. 2003. V. 10(10). P. 813–829.
Kamensky M., Ovadis M., Chet I., Chernin L. Soil-borne strain IC14 of Serratia plymuthica with multiple mechanisms of antifungal activity provides biocontrol of Botrytis cinerea and Scelrotinia sclerotiorum diseases // Soil Biol. Biochem. 2003. V. 35. P. 323–331.
Kimmins J.P. Forest ecology: A foundation for sustainable forest management and environmental ethics in forestry. N.J.: Pearson Prentice Hall, 2004. 611 p.
Koeppe D.E., Rohrbaugh L.M., Rice E.L., Wender S.H. The effect of age and chilling temperatures on the concentration of scopolin and caffeovlouinic acids in tobacco // Physiol. Plant. 1970. V. 23. P. 258–266.
Koeppe D.E., Southwick L.M., Bittell J.E. The relationship of tissue chlorogenic acid concentration and leaching of phenolics from sunflowers grown under varying phosphate nutrient conditions // Can. J. Bot. 1976. V. 54. P. 593–599.
Lankau R. Soil microbial communities alter allelopathic competition between Alliaria petiolata and a native species // Biol. Invas. 2010. V. 12. P. 2059–2068.
Latif S., Chiapusio G., Weston L.A. Chapter Two – Allelopathy and the role of allelochemicals in plant defense // Adv. Bot. Res. 2017. V. 82. P. 19–54.
Li X., Wang J., Huang D. et al. Allelopathic potential of Artemisia frigida and successional changes of plant communities in the northern China steppe // Plant Soil. 2011. V. 341. P. 383–398.
Liu S., Qin F., Yu S. Eucalyptus urophylla root-associated fungi can counteract the negative influence of phenolic acid allelochemicals // Appl. Soil Ecol. 2018. V. 127. P. 1–7.
Mallik A.U. Conifer regeneration problems in boreal and temperate forest with ericaceous understory: role of disturbance, seedbed limitation, and keystone change // Crit. Rev. Plant Sci. 2003. V. 22. P. 341–366.
Macías F.A., Oliveros-Bastidas A., Marín D. et al. Plant biocommunicators: their phytotoxicity, degradation studies and potential use as herbicide models // Phytochem. Rev. 2008. V. 7. P. 179–194.
McCormick S.P. Microbial detoxification of mycotoxins // J. Chem. Ecol. 2013. V. 39. P. 907–918.
Melkiana N.P. Allelopathy in forest and agroecosystems in the Himalayan region / Eds S.J.H. Rizvi, V. Rizvi // Allelopathy: basic and applied aspects. London: Chapman & Hall, 1992. P. 371–388.
Miller-Wideman M., Makkar N., Tran M. et al. Herboxidiene, a new herbicidal substance from Streptomyces chromofuscus A 7847 // J. Antibiot. 1992. V. 45. P. 914–921.
Minamisawa K., Fukai K. Production of indole-3-acetic acid by Bradyrhizobium japonicum: a correlation with genotype grouping and rhizobitoxine production // Plant Cell Physiol. 1991. V. 32. P. 1–9.
Müller N., Hempel M., Philipp B., Gross E.M. Degradation of gallic acid and hydrolysable polyphenols is constitutively activated in the freshwater plant-associated bacterium Matsuebacter sp. FB25 // Aquat. Microb. Ecol. 2007. V. 47 (1). P. 83–90.
Nakajima M., Itoi K., Takamatsu Y., Kinoshita T. et al. Hydantocidin: a new compound with herbicidal activity from Streptomyces hygroscopicus // J. Antibiot. 1991. V. 44. P. 293–300.
Nishimura H., Hiramoto S., Mizutani J. et al. Structure and biological activity of bottrospicatol, a novel monoterpene produced by microbial transformation of (–)-cis-carveol // Agric. Biol. Chem. 1983. V. 47. P. 2697–2699.
Patni B., Chandra H., Mishra A.P. et al. Rice allelopathy in weed management – an integrated approach // Cell Mol. Biol. 2018. V. 64(8). P. 84–93.
Pellissier F., Souto X.C. Allelopathy in northern temperate and boreal semi-natural woodland // Crit. Rev. Plant Sci. 1999. V. 18. P. 637–652.
Perry L., Thelen G., Ridenour W. et al. Concentrations of the allelochemical (+/–)-catechin in Centaurea maculosa soils // J. Chem. Ecol. 2007. V. 33. P. 2337–2344.
Podile A.R., Kishore G.K. Plant growth-promoting rhizobacteria / Ed. S.S. Gnanamanickam // Plant-associated bacteria. Netherlands: Springer, 2006. P. 195–230.
Postolaky O., Syrbu T., Poiras N. et al. Streptomycetes and micromycetes as perspective antagonists of fungal phytopathogens // Commun. Agric. Appl. Biol. Sci. 2012. V. 77(3). P. 249–257.
Putnam A.R., Tang C.S. Allelopathy: state of the science / The science of allelopathy. N.Y.: John Wiley and Sons, 1986. P. 1–19.
Quinn J.C., Kessell A., Weston L.A. Secondary plant products causing photosensitization in grazing herbivores: their structure, activity and regulation // Int. J. Mol. Sci. 2014. V. 15 (1). P. 1441–1465.
Reid T.C., Hausbeck M.K., Kizilkaya K. Use of fungicides and biological controls in the suppression of Fusarium crown and root rot of asparagus under greenhouse and growth chamber conditions // Plant Diseases. 2002. V. 86. P. 493–498.
Reigosa M.J., Sanchez-Moreiras A.M., Gonzalez L. Ecophysiological approach in allelopathy // Crit. Rev. Plant Sci. 1999. V. 18. P. 577–608.
Reigosa M.J., Pedrol N., Sanchez-Moreiras A.M., Gonzalez L. Stress and allelopathy // Allelopathy: from molecules to ecosystems / Eds M.J. Reigosa, N. Pedrol. Plymouth: Sci. Publlishers Inc., 2002. P. 231–256.
Rivoal A., Fernandez C., Greff S. et al. Does competition stress decrease allelopathic potential? // Biochem. Syst. Ecol. 2011. V. 39. P. 401–407.
Scacchi A., Bortolo R., Cassani G. et al. Detection, characterization and phytotoxic activity of the nucleoside antibiotics, blasticidin S and 5-hydroxylmethyl-blasticidin S // J. Plant Growth Regul. 1992. V. 11. P. 39–46.
Schirmbock M., Lorito M., Wang Y.L. et al. Parallel formation and synergism of hydrolytic enzymes and peptaibol antibiotics, molecular mechanisms involved in the antagonistic action of Trichoderma harzianum against phytopathogenic fungi // Appl. Environ. Microbiol. 1994. V. 60 (12). P. 4364–4370.
Schwartz D., Berger S., Heinzelmann E. et al. Biosynthetic gene cluster of the herbicide phosphinothricin tripeptide from Streptomyces viridochromogenes Tü494 // Appl. Environ. Microbiol. 2004. V. 70 (12). P. 7093–7102.
Shioimi K., Ara N., Shinos M. et al. New antibiotics phthoxazolins B, C, and D produced by Streptomyces sp. KO-7888 // J. Antibiot. 1995. V. 48. P. 714–719.
Slininger P.J., Behle R.W., Jackson M.A., Schisler D.A. Discovery and development of biological agents to control crop pests // Neotrop. Entomol. 2003. V. 32 (2). P. 183–195.
Steyaert J.M., Stewart A., Jaspers M.V. et al. Co-expression of two genes, a chitinase (chit42) and proteinase (prb1), implicated in mycoparasitism by Trichoderma hamatum // Mycologia. 2004. V. 96. P. 1245–1252.
Sugiyama A., Yazaki K. Root exudates of legume plants and their involvement in interactions with soil microbes // Secretions and exudates in biological systems / Eds J.M. Vivanco, F. Baluška. Berlin, Heidelberg: Springer, 2012. P. 27–48.
Tang C.-H., Cai W.-F., Kohl K., Nishimote R.K. Plant stress and allelopathy // Allelopathy, organisms, processes and applications / Eds Inderjit, K.M.M. Dakshini, F.A. Einhellig. Washington DC: Am. Chem. Society, 1995. P. 142–157.
Tesio F., Ferrero A. Allelopathy, a chance for sustainable weed management // Int. J. Sustain. Dev. & World Ecol. 2010. V. 17 (5). P. 377–389.
Turner J.A., Rice E.L. Microbiological decomposition of ferulic acids in soil // J. Chem. Ecol. 1975. V. 1. P. 41–58.
Ulloa-Ogaz A.L., Muñoz-Castellanos L.N., Nevarez-Moorillon G.V. Biocontrol of phytopathogens: antibiotic production as mechanism of control // The battle against microbial pathogens: basic science, technological advances and educational programs / Ed. A. Mendez-Vilas. Spain: Formatex Res. Center, 2015. P. 305–309.
Xie X.G., Dai C.C. Biodegradation of a model allelochemical cinnamic acid by a novel endophytic fungus Phomopsis liquidambari // Int. Biodeter. Biodegrad. 2015. V. 104. P. 498–507.
Vanhoutte I., Audenaert K., De Gelder L. Biodegradation of mycotoxins: tales from known and unexplored worlds // Front. Microbiol. 2016. V. 7. P. 561.
van Loon L.C. Plant responses to plant growth-promoting rhizobacteria // Eur. J. Plant Pathol. 2007. V. 119. P. 243–254.
Vokou D., Chalkos D., Karamanlidou G., Yiangou M. Activation of soil respiration and shift of the microbial population balance in soil as a response to Lavandula stoecha essential oil // J. Chem. Ecol. 2002. V. 28. P. 755–768.
Wardle D.A., Nilsson M.-C., Gallet C., Zackrisson O. An ecosystem-level perspective of allelopathy // Biol. Rev. 1998. V. 73. P. 305–319.
Weidenhamer J.D., Hartnett D.C., Romeo J.T. Density-dependent phytotoxicity: distinguishing resource competition and allelopathic interference in plants // J. Appl. Ecol. 1989. V. 26. P. 613–624.
Weir T.L., Park S.W., Vivanco J.M. Biochemical and physiological mechanisms mediated by allelochemicals // Curr. Opin. Plant Biol. 2004. V. 7. P. 472–479.
Weisskopf L., Tomasi N., Santelia D. et al. Isoflavonoid exudation from white lupine roots is influenced by phosphate supply, root type and cluster-root stage // New Phytol. 2006. V. 171 (3). P. 657–668.
Wink M., Twardowski T. Allelochemical properties of alkaloids. Effects on plants, bacteria and protein biosynthesis // Allelopathy: basic and applied aspects / Eds S.J.H. Rizvi, V. Rizvi. London: Chapman & Hall, 1992. P. 129–150.
Yang L., Stockigt J. Trends for diverse production strategies of plant medicinal alkaloids // Nat. Prod. Rep. 2010. V. 27 (10). P. 1469–1479.
Zak D.R., Holmes W.E., White D.C. et al. Plant diversity, soil microbial communities, and ecosystem function: are there any links? // Ecology. 2003. V. 84 (8). P. 2042–2050.
Zeng R.S., Mallik A.U., Luo S.M. Allelopathy in sustainable agriculture and forestry. N.Y.: Springer-Verlag, 2008. 412 p.
Zhang Z.Y., Pan L.P., Li H.H. Isolation, identification and characterization of soil microbes which degrade phenolic allelochemicals // J. Appl. Microbiol. 2010. V. 108 (5). P. 1839–1849.
Zikmundova M., Drandarov K., Bigler L. et al. Biotransformation of 2-benzoxazolinone and 2-hydroxy-1,4-benzoxazin-3-one by endophytic fungi isolated from Aphelandra tetragona // Appl. Environ. Microbiol. 2002. V. 68 (10). P. 4863–4870.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


