Успехи современной биологии, 2019, T. 139, № 2, стр. 184-195
Соматический эмбриогенез видов рода Pinus в культуре in vitro
А. С. Шуклина 1, *, И. Н. Третьякова 1
1 Институт леса им. В.Н. Сукачева СО РАН – обособленное подразделение ФИЦ КНЦ СО РАН
Красноярск, Россия
* E-mail: Alla.saymova@yandex.ru
Поступила в редакцию 21.08.2018
После доработки 18.09.2018
Принята к публикации 25.09.2018
Аннотация
Настоящий обзор посвящен микроклональному размножению видов рода Pinus через соматический эмбриогенез, в основе которого лежит свойство тотипотентности клеток растений. Рассмотрены особенности каждого этапа соматического эмбриогенеза и ряд проблем, которые необходимо преодолевать для получения здоровых сформированных соматических регенерантов. Также рассмотрены виды сосен, которые показали успешную криоконсервацию. Метод является альтернативой традиционной селекции в лесном хозяйстве.
ВВЕДЕНИЕ
Биотехнология соматического эмбриогенеза хвойных видов постоянно развивается с момента ее открытия. Анализ литературы показал, что с 2000 года около 50 журналов опубликовали статьи, посвященные совершенствованию протоколов соматического эмбриогенеза для хвойных. Из них примерно 40 публикаций – по видам, для которых технология соматического эмбриогенеза описана впервые, – это ясный показатель важности такой технологии для клонального размножения хвойных. (Klimaszewska et al., 2016). Виды сосновых являются экономически важными древесными видами с широким распространением по всему северному полушарию. Биотехнология соматического эмбриогенеза перспективна для массового размножения сосен и позволяет производить клоны сосновых для промышленных целей и для лесовосстановления.
Первое упоминание о соматическом эмбриогенезе хвойных видов было сделано к концу 70-х–началу 80-х гг. прошлого века. Авторы описали эмбриоподобные структуры, не способные к дальнейшему развитию, в культуре клеток Pinus banksiana (Durzan, Chalupa, 1976), Pseudotsuga menziesii и Picea glauca (Durzan, 1980). Только спустя несколько лет из незрелых зиготических зародышей Picea abies были получены зрелые соматические зародыши, способные к прорастанию (Chalupa, 1985; Hakman, 1985). Соматические зародыши являются аналогами зиготических, они способны к прорастанию и формированию растений-регенерантов (Lelu et al., 1994). Этот первый успех привлек внимание многих исследователей, и к настоящему моменту соматические зародыши или растения-регенеранты получены у 34 видов рода Pinus (табл. 1).
Таблица 1.
Виды рода Pinus, у которых получен соматический эмбриогенез
| Вид | Ссылка на первое упоминание в литературе | Питательная среда | Стадия морфогенеза |
|---|---|---|---|
| P. radiata | Smith et al., 1985 | EDM | СЗ, РГ, КР |
| P. lambertiana | Gupta, Durzan, 1986 | Модификация DCR | СЗ, РГ |
| P. taeda | Gupta, Durzan, 1987; Becwar et al., 1990 | DCR, MSG, модификация P6 и WV5; LP | СЗ, РГ, КР |
| P. elliottii | Jain et al., 1989 | LPM, WPMG, MNCI | СЗ, РГ |
| P. strobus | Finer et al., 1989 | DCR, LV и их модификации | СЗ, РГ, КР |
| P. caribaea Morelet | Laine, David, 1990 | LPG | СЗ, РГ, КР |
| P. nigra | Salajova, Salaj, 1992 | DCR | СЗ, РГ, КР |
| P. palustris | Nagmani et al., 1993 | MSG, DCR, GD | CЗ |
| P. patula | Jones, et al., 1993 | Модификация DCR | СЗ, РГ, КР |
| P. pinaster | Bercetche, Paques, 1995 | DCR, LV и их модификации | СЗ, РГ, КР |
| P. serotina | Dunstan et al., 1995 | MSG | СЗ |
| P. massoniana | Huang et al., 1995 | DCR | СЗ, РГ |
| P. sylvestris | Kainonen-Mettala et al., 1996 |
DCR, MSG, LV и их модификации | СЗ, РГ, КР |
| P. koraiensis | Bozhkov et al., 1997 | DCR, LV | СЗ |
| P. banksiana | Park et al., 1999 | mLV | СЗ, РГ, КР |
| P. monticola | Percy et al., 2000 | mLV | СЗ, РГ, КР |
| P. roxburghii (longifolia) Sarg. | Arya et al., 2000 | DCR | СЗ, РГ, КР |
| P. densiflora | Taniguchi, 2001; Ishii et al., 2001 |
P6 | СЗ, РГ |
| P. thunbergii | Taniguchi, 2001; Ishii et al., 2001 |
Модификации DCR, LP |
СЗ, РГ |
| P. kesiya | Malabadi et al., 2002 | Модификации ½ MS, ½ DCR | СЗ, РГ |
| P. brutia TEN | Yildrim et al., 2006 | DCR | СЗ, РГ |
| P. armandii | Maruyama et al., 2007 | ½ EM | СЗ, РГ |
| P. bungeana Zucc.ex Endl. |
Zang et al., 2007 | DCR1 | СЗ |
| P. geradiana | Malabadi, Nataraja, 2007b | ½ MSG | СЗ, РГ |
| P. heldreichii | Stojicic et al., 2007 | GD | СЗ |
| P. rigida × P. taeda | Kim, Moon, 2007 | Модификации P6 и LV | СЗ, РГ |
| P. wallichiana | Malabadi, Nataraja, 2007a | MSG | СЗ, РГ |
| P. pinea | Carneros et al., 2009 | Модификация ½ LV | СЗ, РГ |
| P. contorta | Park et al., 2010 | DCR | СЗ, РГ |
| P. oocarpa | Lara-Chavez et al., 2011 | PO | СЗ, РГ |
| P. luchuensis | Hosoi, Maruyama, 2012 | Модификация EM | СЗ, РГ, КР |
| P. pumilla | Третьякова, Шуваев, 2015 | ½ LV | СЗ, РГ |
| P. uncinata | Vlašínová et al., 2017 | DCR | СЗ, РГ |
| P. elliottii × P. caribaea | Nunes et al., 2018 | mDCR | СЗ, РГ, КР |
Соматический эмбриогенез – асексуальный способ микроклонального размножения, основанный на тотипотентности растительных клеток, и позволяет образовывать множественные, генетически идентичные соматические зародыши, избегая ожидания следующего вегетативного сезона (Третьякова и др., 2014). Использование питательных сред, содержащих соответствующий баланс микро- и макроэлементов, витаминов и регуляторов роста растений, может стимулировать формирование зародышей непосредственно из эксплантированной ткани (прямой соматический эмбриогенез) или индуцировать пролиферацию эмбриогенного каллуса (непрямой соматический эмбриогенез) (Quiroz-Figueroa et al., 2006; Pulianmackal et al., 2014). Экспланты, из которых наиболее вероятен прямой эмбриогенез, включают: микроспоры, яйцеклетки, зиготические и соматические зародыши и сеянцы. Различие между прямым и непрямым соматическим эмбриогенезом неясно. Основная проблема заключается в том, что, согласно более ранней гипотезе, прямой эмбриогенез должен происходить из эмбриогенно-предопределенных клеток. Напротив, непрямой соматический эмбриогенез должен происходить из недетерминированных клеток, и сначала необходимо сформировать недифференцированный каллус (Sharp et al., 1980). Однако на самом деле образующийся каллус является либо эмбриогенным, либо нет.
Обычно легко отличить эмбриогенный каллус от неэмбриогенного на основе его морфологии и цвета (von Arnold et al., 2002). Цитологический анализ полученного каллуса способствует отбору эмбриогенных культур для их дальнейшей пролиферации. Соматические зародыши используются как модельная система в эмбриологических исследованиях (von Arnold et al., 2002; Tret’yakova, Park, 2018).
Протоколы инициации эмбриогенных культур, состоящих из эмбрионально-суспензорной массы в настоящее время разработаны для 34 видов Pinus. Однако на стадии инициации существуют определенные трудности: короткое временное “окно”, в течение которого экспланты вводятся в культуру in vitro, низкие частоты инициации эмбриогенного каллуса. При созревании соматических зародышей возникают нарушения в развитии доменов зародышей и слабое развитие корней у соматических регенерантов (Miguel et al., 2004; Carneros et al., 2009; Lara-Chavez et al., 2011; Montalbán et al., 2013). Кроме того, успех инициации ограничивается генотипами деревьев, экспланты которых обладают компетентностью к соматическому эмбриогенезу.
Соматический эмбриогенез в культуре in vitro у представителей рода Pinus, так же, как и зиготический эмбриогенез – процесс многоступенчатый, проходящий стадию проэмбрионального развития, раннего и позднего эмбриогенеза, заканчивающийся формированием биполярной структуры зародыша, несущего на одном конце гипокотиля семядоли, а на другом – зародышевый корешок (Третьякова, 2008).
Процесс соматического эмбриогенеза хвойных проходит через четыре этапа: инициация, пролиферация, созревание и прорастание. Дополнительный этап – криоконсервация – может быть добавлен, когда необходимо хранение эмбриогенных культур (Pullman, Bucalo, 2011).
Целью данной статьи является проведение анализа исследований, посвященных биотехнологии соматического эмбриогенеза видов рода Pinus.
ИНИЦАЦИЯ СОМАТИЧЕСКОГО ЭМБРИОГЕНЕЗА
Инициация эмбриональной массы может происходить из различных эксплантов: незрелых мегагаметофитов или извлеченных незрелых зиготических зародышей (P. strobus, P. pinaster, P. sylvestris, P. caribaea, P. taeda, P. monticola, P. lambertiana); извлеченных зрелых зародышей (P. geradiana, P. kesiya, P. koraiensis, P. massoniana, P. nigra, P. strobus, P. taeda, P. wallichiana); вегетативных апексов побегов от взрослых деревьев (P. kesiya, P. sylvestris, P. patula, P. roxburghii). После поверхностной стерилизации экспланты помещают на среду индукции.
У большинства сосен инициация соматического эмбриогенеза ограничивается введением эксплантов в первые несколько недель развития зародышей до появления зачатка семядолей (Finer et al., 1989; Becwar et al., 1990; Lelu et al., 1999; Park et al., 1999; Salajova et al., 1999; Percy et al., 2000; Pullman, Bucalo, 2011). Подчеркивая особую важность определения стадии развития зиготических зародышей, при которой их необходимо вводить в культуру для успешной инициации соматического эмбриогенеза, Пульман и Вэб (Pullman, Webb, 1994) разработали систему стадий развития зиготического зародыша (рис. 1). Стасолла и Йенг также подтверждают, что строгое требование ювенальных эксплантов, часто эмбрионального происхождения, указывает на то, что у представителей рода Pinus сложно достигнуть перенаправления программы развития в культуре in vitro (Stasolla, Yeung, 2003).
Рис. 1.
Стадии развития зиготического зародыша у P. taeda. Стадии 2–4 оптимальны для инициации эмбриогенных тканей (по Cairney, Pullman, 2007).

Ряд авторов, изучая проблему неподатливости (recalcitrance) хвойных видов к микроклональному размножению в культуре in vitro, предложили рассмотреть некоторые причины таких трудностей и пути их решения (Bonga, 2010, 2016) (табл. 2).
Таблица 2.
Возможные причины неподатливости растений к микроклональному размножению in vitro и пути решения этих проблем (Bonga et al., 2010)
| Проблема | Решение |
|---|---|
| Раннее начало неподатливости | Для некоторых хвойных деревьев только зиготические зародыши на поликливажной стадии способны к соматическому эмбриогенезу |
| Неоднородное распределение неподатливых тканей в дереве | Использовать поросли или корневые проростки, соматические ткани вблизи мейотических тканей в момент мейоза, апикальную меристему побега с минимальным количеством зачатков хвои |
| Сроки отбора эксплантов | Экспланты побегов от веток, собранных ранней весной или в конце вегетации более отзывчивы |
| Естественный апомиксис хвойных остается малоисследованным | Генетический механизм апомиксиса изучается, и регуляция экспрессии генов у неподатливых видов может стать реальностью |
| У взрослых индивидуумов цитоплазма сохраняет ядро соматических клеток, не способных программировать соматический эмбриогенез | Перепрограммирование ядра путем переноса его в цитоплазму яйцеклеток, у которых удалено ядро, может приводить к активации эмбриогенной программы у многих организмов |
| Особенности цитоплазмы могут влиять на регенеративную способность | В андрогенезе упрощение цитоплазматической структуры часто предшествует образованию эмбриоидов |
| Неспособность клеток делиться асимметрично | Некоторые из факторов, стимулирующих асимметричное деление, были идентифицированы и использовались экспериментально |
| Межклеточный контакт может препятствовать экспрессии эмбриогенной программы | Разрушение плазмодесм путем введения каллозы или другими способами иногда приводит к соматическому эмбриогенезу |
| Эмбриогенный генетический механизм не может быть активирован обычными способами | Генетическая трансформация может привести к эктопической экспрессии генов, запускающих инициацию зародышей |
Состав культуральной среды приобретает особое значение в соматическом эмбриогенезе, так как заменяет содержимое мегагаметофита, обеспечивая достаточное количество азота и углерода (Pullman, Bucalo, 2014). Наиболее распространенными базовыми средами для рода Pinus являются среды DCR (Gupta, Durzan, 1985), Litvay (Litvay et al., 1985; Nagmani, Bonga, 1985) и MSG (Becwar et al., 1990). Среды автоклавируются при 121°C в течение 20 мин. Как правило, эти среды после охлаждения до 55°C дополняются фильтр-стерилизованным раствором L-глютамина, гидролизатом казеина и аскорбиновой кислоты или только L-глютамином в качестве единственного источника органического азота.
Наиболее часто добавляемыми регуляторами роста растений для индукции соматического эмбриогенеза у сосен являются 2,4-дихлорфеноксиуксусная кислота (2,4-Д) и 6-бензиладенин (БА) (Klimaszewska et al., 2000). Иногда используются и другие регуляторы роста: кинетин вместо БА для P. halepensis (Montalbán et al., 2013) или в комбинации с БА для P. taeda (Pullman, Johnson, 2002), ауксин-1-нафталинуксусная кислота (НУК) вместо 2,4-Д для P. taeda (Pullman, Johnson, 2002) или комбинация с 2,4-Д для P. halepensis (Montalbán et al., 2013).
В качестве основного источника углерода используются: сахароза для P. halepensis (Montalbán et al., 2013), P. pinaster (Lelu-Walter et al., 2006), P. pinea (Carneros et al., 2009), P. strobus (Klimaszewska et al., 2001) и P. pumilla (Третьякова, Шуваев, 2015) и/или мальтоза для P. densifora (Maruyama et al., 2005), P. kesiya (Choudhury et al., 2008), P. patula (Jones, van Staden, 2001) и P. taeda (Pullman, Johnson, 2002) в концентрациях от 10 г/л для P. armandii (Maruyama et al., 2007) и P. luchuensis (Hosoi, Maruyama, 2012) до 30 г/л для P. bungeana (Zhang et al., 2007), P. pinaster (Lelu-Walter et al., 2006) и P. radiata (Montalbán et al., 2012; Hargreaves et al., 2009).
Иногда для оптимизации инициации соматического эмбриогенеза питательные среды дополняются нетрадиционными компонентами: абсцизовой кислотой (АБК) – для P. taeda, P. serotina, P. palustris, P. elliottii, P. rigida и их гибридов (Aitken-Christie, Parkes, 1996; Handley, 1997, 1999; Pullman et al., 2003b; Pullman, Skryabina, 2007); брассиностероидами – для P. taeda и P. wallichiana (Pullman et al., 2003c; Malabadi, Nataraja, 2007a); триаконтанолом – для P. roxburghii и P. patula (Malabadi, van Staden, 2005); путресцином – для P. geradiana (Malabadi, Nataraja, 2007b); ингибиторами гиббереллина – для P. taeda и P. elliottii (Pullman et al., 2005c). Для P. taeda используются: ANO3, высокие уровни миоинозитола (до 20 г/л), глутамин, 2-этансульфоновая кислота (MES как стабилизатор рН), биотин, фолиевая кислота, витамины Е и В12, α-кетоглютаровая кислота, D-ксилол и D-хиро-инозитол, ингибиторы этилена (Pullman et al., 2005a). Добавление дополнительного жидкого слоя спустя 14 дней помещения эксплантов P. taeda на среду инициации увеличивало количество инициированных культур. Данная методика позволяет добавить к питательной среде гормоны или изменить рН без нарушения тканей (Pullman et al., 2007).
Существует еще ряд факторов, которые могут улучшить этап инициации соматического эмбриогенеза. Предобработка шишек низкими положительными температурами (4–5°С) в течение 1–3 недель благотворно влияет на индукцию соматического эмбриогенеза для ряда видов сосен: P. sylvestris (Häggman et al., 1999); P. radiata (Montalbán et al., 2015). Кроме того, холодовая обработка позволяет преодолеть узкое “окно” компетенции эксплантов, которые необходимо ввести в культуру за короткий промежуток времени после сбора шишек (Park, 2002; Salajova, Salaj, 2005; Yildirim et al., 2006).
Контроль факторов окружающей среды также приводит к улучшениям показателей частоты инициации, включая рН (для рода Pinus доводится до значения 5.7–5.8), водный потенциал, выбор желирующего агента к среде, адсорбция нежелательных компонентов среды добавлением активированного угля.
Показателем успешной инициации служит формирование белого или прозрачного волокнистого эмбриогенного каллуса, состоящего из отдельных клеток, клеточных скоплений или даже ранних соматических зародышей (Klimaszewska, Cyr, 2002; von Arnold et al., 2002).
Важно отметить, что в процессе эксперимента часто происходит отбор определенных клеточных линий, способных преодолеть все стадии и сформировать полноценное растение (Gupta, Pullman, 1990). Многие авторы отмечали строгую генотипическую зависимость различных клеточных линий по способности к соматическому эмбриогенезу (Klimaszewska, Cyr, 2002).
ПРОЛИФЕРАЦИЯ И ПОДДЕРЖАНИЕ ЭМБРИОГЕННЫХ КУЛЬТУР
После инициации эмбриогенные культуры, состоящие из глобулярных зародышей и суспензоров (эмбрионально-суспензорная масса), перемещаются на среду пролиферации или среду поддержания, которая содержит пониженную концентрацию гормонов, чаще всего в два раза уменьшается содержание цитокининов. Чтобы продолжить кливажную полиэмбрионию и мультипликацию соматических зародышей, необходимы пересадки пролиферирующих культур каждые 12–21 сут на твердую или жидкую среду пролиферации. Жидкая среда имеет преимущество высоких скоростей роста, уменьшенной неоднородности, простоты подготовки клеток к криоконсервации (Pullmun, Bucalo, 2011).
При пересадке эмбрионально-суспензорной массы коричневая и дегенерирующая эмбриогенная ткань удаляется вместе с неэмбриогенной тканью, образующей каллус (часто твердый и зеленый). Этот процесс отбора важен для поддержания эмбриогенной ткани по мере старения культуры (Pullman, Bucalo, 2011).
Как индукция, так и пролиферация эмбриональной массы не требует света, поэтому культуры выдерживаются в темноте при температуре 24–25°С.
СОЗРЕВАНИЕ СОМАТИЧЕСКИХ ЗАРОДЫШЕЙ
Созревание соматических зародышей – это процесс гистологической дифференциации незрелых (ранних) зародышей, в результате чего происходит формирование семядолей, зародышевого корешка и других органов и тканей, характерных для зрелого зародыша. Для полного созревания зародыш должен достигнуть морфологической и физиологической зрелости (Stasolla et al., 2002).
Для созревания соматических зародышей у большинства представителей рода Pinus требуется проведение определенной предобработки эксплантов до пересадки на среду созревания. Чтобы остановить пролиферацию и запустить переход от глобулярных зародышей эмбрионально-суспензорной массы к соматическим зародышам, необходимо предварительное культивирование эксплантов на безгормональной среде с добавлением активированного угля в течение 3–7 сут (Klimaszewska, Cyr, 2002; Smertenko et al., 2003). Добавление активированного угля контролирует гормональный баланс и адсорбирует нежелательные компоненты (Pullman, Bucalo, 2011).
Далее для созревания соматических зародышей эмбриогенные культуры переносятся на базовые питательные среды без ауксинов и цитокининов, но с добавлением АБК. Большинство сред созревания для рода Pinus содержат 60–480 мM АБК (Klimaszewska et al., 2007). Но есть примеры, когда созревание успешно проходит при меньших концентрациях АБК, например для P. taeda –19.6–37.8 мM (Vales et al., 2007), P. kesiya – 30мM (Choudhury et al., 2008).
Осмотические условия, по-видимому, контролируют развитие зародышей у многих видов растений (Bradford, 1994). Параметры отношения воды были частично исследованы для зиготических и соматических зародышей P. resinosa, P. taeda и P. strobus (Gates, Greenwood, 1991; Klimaszewska et al., 2000; Dumont-BeBoux et al., 1996). Эти исследования показывают, что значения водного потенциала в тканях семян намного больше (в ммоль/кг), чем значения, которые измеряются в растительной ткани в культуре in vitro. Поэтому неудивительно, что одной только АБК часто не хватает для предотвращения преждевременного созревания соматических зародышей, необходимо изменение водного потенциала среды путем добавления осмотических веществ (Attree, Fowke, 1993).
В этот период водный потенциал снижается одновременно за счет увеличения концентрации сахаров и создания осмотического стресса или включения полиэтиленгликоля (Attree et al., 1991). Альтернативным методом воздействия на развитие соматических зародышей является увеличение концентрации желирующего компонента в среде с АБК, что увеличивает упругость питательной среды и снижает доступность воды в клетки (Lelu et al., 1995; Klimaszewska et al., 2000; Stasolla et al., 2002). Комбинации этих компонентов также используются. Умеренное высушивание пролиферирующей ткани вызывает 50%-ную потерю воды, что стимулирует созревание у P. kesiya и P. patula (Malabadi et al., 2004; Malabadi, van Staden, 2005). Интересно отметить, что подобное явление наблюдается и при формировании зародыша хвойных in vivo, когда происходит резкое обезвоживание семян и теряется до 90% воды (Кулаева, 1995). В этот период содержание АБК в семенах достигает максимального значения и вызывает затормаживание метаболических процессов и их переход в состояние покоя (Finkelstein, Lynch, 2000).
Увеличение числа семядольных зародышей у P. oocarpa, P. taeda, P. menziesii происходило на модифицированных средах для созревания, в которых уровни бора, кальция, калия, железа и других микроэлементов были аналогичны уровням в зиготических зародышах (Pullman, Skryabina, 2007; Lara-Chavez et al., 2011).
Обычно культуры хранятся в темноте или на свету низкой интенсивности при 16-часовом фотопериоде и температуре 24°C (Montalbán et al., 2016).
Cоматические зародыши развиваются на среде с высокой концентрацией желирующего компонента в течение 6–15 недель, при этом эмбриональная масса не требует перехода на свежую среду в течение всего периода созревания.
Важно отметить, что дальнейшее развитие соматических зародышей схоже с основным ходом зиготического эмбриогенеза семейства Pinaceae (Singh, 1978; Yeung et al., 1998; Yeung, Stasolla, 2000).
ПРОРАСТАНИЕ СОМАТИЧЕСКИХ ЗАРОДЫШЕЙ И АДАПТАЦИЯ РЕГЕНЕРАНТОВ
Соматические зародыши обычно прорастают на полутвердых средах, лишенных регуляторов роста растений и с пониженным содержанием солей, сахаров и питательных веществ. Часто добавляют активированный уголь для удаления остаточных экзогенных гормонов.
Несколько обработок увеличивают прорастание соматических зародышей сосен, в том числе: высушивание зародышей перед прорастанием (Hay, Charest, 1999), прямое или косвенное воздействие эктомикоризного гриба Psolithus tinctorius (Niemi, Haggman, 2002; Häggman et al., 2005), добавление в среды окислительно-восстановительных компонентов (Stasolla, Yeung, 1999), а также стратификация – выдерживание при 4°С в течение нескольких недель (Gupta et al., 2005; Klimaszewska et al., 2007).
Частичное высыхание зрелых соматических зародышей до прорастания было описано для P. thunberghii, P. densiflora, P. armandii (Maruyama, Hosoi, 2012), P. patula (Jones, van Staden, 2001), P. nigra (Salajova, Salaj, 2005) и P. oocarpa (Lara-Chavez et al., 2011). Высушивание может проводиться при 25°С в ламинарном шкафу в течение 0–4 ч (быстрый метод) или при высокой относительной влажности, помещая зародыши на фильтровальные диски диаметром более 30 мм в палетки, в которых некоторые лунки заполняют 5–6 мл стерильной воды, плотно закрывают и оставляют в темноте при 25°C на 0–3 недели (медленный метод) (Maruyama, Hosoi, 2012).
Соматические зародыши P. elliotii (Liao, Amerson, 1995) подвергают стратификации для увеличения частоты прорастания. Чашки Петри наклоняют под углом приблизительно 45–60° с находящимися в них культурами соматических зародышей с эмбриональными корешками, направленными вниз.
У P. radiata (Montalbán et al., 2010), P. halepensis (Montalbán et al., 2013) и P. nigra (Salajova, Salaj, 2005) культуры выдерживают при 21–24°C и 16‑часовом фотопериоде при 40 мкмоль/м2/с в течение 1–2 недель, а затем при 120 мкмоль/м2/с – под светом холодных белых флуоресцентных ламп (Montalblán et al., 2016). У P. taeda, P. elliottii, P. palustris и гибрида P. elliottii × P. palustris ускорение роста корней и прорастания проводилось под воздействием красного света (Merkle et al., 2006).
Пульман и Джонсон (Pullman, Johnson, 2002) оптимизировали процесс прорастания для P. taeda, сравнив процессы соматического и зиготического эмбриогенеза и определив наиболее подходящую стадию переноса соматических зародышей на среду прорастания. По данным этих авторов было показано, что оптимальной является стадия № 5, когда становится видимой верхушечная апикальная меристема, что идентично примерно 45 сут развития зиготического зародыша от момента оплодотворения (рис. 1).
Через 6–8 недель выдерживания регенерантов на среде прорастания культуры еще один раз переносят на свежую среду прорастания. Спустя еще 6–8 недель соматические растения переносят в колбы со стерильной почвенной смесью и помещают в ростовую камеру. В качестве смеси используют торф : перлит, соотношение 3 : 1 и 7 : 3 в P. radiata (Montalbán et al., 2010) и P. halepensis (Montalbán et al, 2013) соответственно, сосновую кору в P. patula (Jones, van Staden, 2001), вермикулит в P. kesiya (Choudhury et al., 2008), торф : вермикулит (3 : 1) у P. pinaster (Lelu-Walter et al., 2006) и перлит : торф : вермикулит (1 : 1 : 1) в P. taeda (Tang et al., 2001) и P. rigida x taeda (Kim, Moon, 2007).
Адаптация проростков проходит в теплице в контролируемых условиях. При этом первые 2 недели после пересадки рекомендуется поддерживать влажность 90–95% с постепенным ее понижением (De Diego et al., 2010).
После периода роста в теплице растения пересаживают в питомники или лесные участки. Обычно у клоновых деревьев наблюдается единообразие в форме и росте (Timmis, 1998).
КРИОКОНСЕРВАЦИЯ ЭМБРИОГЕННЫХ ТКАНЕЙ
Криоконсервация, то есть хранение материала в жидком азоте при –196°С, является единственным безопасным и рентабельным вариантом для долгосрочной консервации гермоплазмы растений (Engelmann, 2004).
Недавний прогресс в соматическом эмбриогенезе сосновых видов, производство генетически модифицированных растений и попытки к развитию плантационного лесовыращивания подчеркивают необходимость сохранения гермоплазмы растений вместе с созданием функциональных протоколов криоконсервации (Häggman et al., 2000).
Хорошо известно, что эмбриогенные клеточные линии хвойных растений могут оставаться стабильными в течение многих лет, но рост и эмбриогенный потенциал могут меняться со временем или могут быть потеряны после нескольких месяцев субкультивирования (Häggman et al., 2000). Энгельманом было предложено использовать криоконсервацию для криоселекции, то есть для выбора материала со специфическими свойствами, а также как инструмент “омоложения” культуры с уменьшающимся потенциалом пролиферации (Engelmann, 2004).
Большинство протоколов криоконсервации являются модификациями метода (Kartha et al., 1988), разработанного для белой ели. В табл. 1 перечислены виды сосен, которые показали успешную криоконсервацию.
Основной задачей исследователей, стремящихся сохранить эмбриогенные ткани, является постепенное уменьшение свободной воды в эмбриогенных клетках и предотвращение формирования межклеточного льда при помощи метода медленной заморозки (Klimaszewska, Cyr, 2002). При этом большинство исследователей используют специальную предобработку пролиферирующих культур или зрелых соматических зародышей, для чего они помещаются на среду с меньшим осмотическим потенциалом на один-два дня. В качестве вещества, снижающего осмотический потенциал, чаще всего используется 5–10%-ный раствор диметилсульфоксида. Далее колбы с культурами постепенно (на 0.1–0.5°C в минуту) охлаждают до –80°C и погружают в жидкий азот на хранение.
Для регенерации культуры в течение 2–3 мин оттаивают при температуре 37°C и после высыхания раствора переносят на свежую среду. Обычно рост культур возобновляется спустя 1–2 нед.
Криоконсервация позволяет надолго сохранить эмбриогенные культуры и соматические зародыши и таким образом способствует длительному хранению генетических ресурсов. После размораживания соматические зародыши способны формировать здоровые растения-регенеранты. Разработка метода криоконсервации может также способствовать сохранению генофонда ценных видов растений.
ЗАКЛЮЧЕНИЕ
Таким образом, соматический эмбриогенез в культуре in vitro у представителей рода Pinus проходит через следующие стадии: инициация и пролиферация эмбрионально-суспезорной массы, созревание соматических зародышей, прорастание соматических зародышей и адаптация регенерантов в природных условиях. Для разных видов создаются модификации основных питательных сред, которые увеличивают частоту инициации и конечный выход зрелых соматических зародышей и регенерантов. Также играет роль контроль физических условий, таких как температура, влажность, освещенность на разных этапах соматического эмбриогенеза. Вся процедура соматического эмбриогенеза у сосен продолжается около года. Однако, несмотря на кажущуюся сложность и длительность данного процесса, возможность получения большого количества селективного безвирусного материала может покрыть все издержки (Klimaszewska, Cyr, 2002).
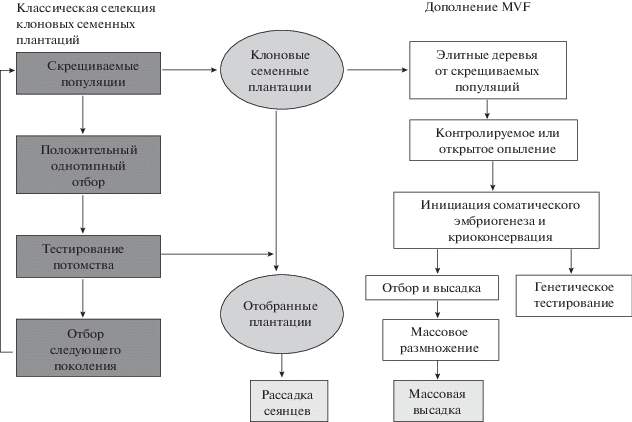
В ряде стран (США, Канада, Франция) метод соматического эмбриогенеза считается одним из наиболее перспективных для плантационного лесовыращивания. На основе данной биотехнологии была разработана программа Multy-Varietal Forestry (MVF) (рис. 2). Эта технология позволяет решать основные современные проблемы плантационного лесовыращивания: повышения продуктивности семенных плантаций; устойчивости к вредителям; адаптации деревьев в связи с изменениями климата; восстановления исчезающих видов (Park et al., 2014).
Список литературы
Кулаева О.Н. Восприятие и преобразование гормонального сигнала у растений // Физиол. раст. 1995. Т. 42. С. 661–671.
Третьякова И.Н. Сходство и различия зиготического и соматического эмбриогенеза сибирских видов хвойных // Фундаментальные и прикладные проблемы ботаники в начале XXI века / Мат. Всерос. конф. (Петрозаводск, 22–27 сентября 2008 г.). Часть 1: Структурная ботаника. Эмбриология и репродуктивная биология. Петрозаводск: Карельский научный центр РАН, 2008. С. 298–300.
Третьякова И.Н., Шуваев Д.Н. Соматический эмбриогенез Pinus pumila и продуктивность эмбриогенных линий при длительном культивировании in vitro // Онтогенез. 2015. Т. 46. № 5. С. 327–337.
Третьякова И.Н., Ворошилова Е.В., Шуваев Д.Н. Каллусогенез и индукция соматического эмбриогенеза у гибридных семян Pinus sibirica // Физиол. раст. 2014. Т. 61. № 2. С. 297–303.
Aitken-Christie J., Parkes B.D. Improved embryogenesis process for initiation and maturation. International application under the patent cooperation treaty. WO 96/37096. 1996.
Arya S., Kalia R.K., Arya I.D. Induction of somatic embryogenesis in Pinus roxburghii Sarg // Plant Cell Rep. 2000. V. 19. P. 775–780.
Attree S.M., Fowke L.C. Embryogeny of gymnosperms: advances in synthetic seed technology of conifers // Plant Cell Tiss. Org. Cult. 1993. V. 35. P. 1–35.
Attree S.M., Moore D., Sawhney D., Fowke L.C. Enhanced maturation and desiccation tolerance of white spruce (Picea glauca [Moench] Voss) somatic embryos: effects of a non-plasmolysing water stress and abscisic acid // Ann. Bot. 1991. V. 68. P. 519–525.
Becwar M.R., Nagmani R., Wann S.R. Initiation of embryogenic cultures and somatic embryo development in loblolly pine (Pinus taeda) // Can. J. For. Res. 1990. V. 20. P. 810–817.
Bercetche J., Paques M. Somatic embryogenesis in maritime pine (Pinus pinaster). Somatic embryogenesis in woody plants. Dordrecht: Kluwer Acad. Publishers, 1995. V. 3. 221 p.
Bonga J.M. Conifer clonal propagation in tree improvement programs. Vegetative propagation of forest trees. Seoul: Nat. Institute of Forest Science, 2016. P. 3–31.
Bonga J.M., Klimaszewska K., von Aderakas P. Recalcitrance in clonal propagation, in particular of conifers // Plant Cell Tiss. Org. Cult. 2010. V. 100. P. 241–254.
Bozhkov P.V., Ahn I.S., Park Y.G. Two alternative pathways of somatic embryo origin from polyembryonic mature stored seeds of Pinus koraiensis Sieb. et Zucc. // Can. J. Bot. 1997. V. 75. P. 509–512.
Bradford K.J. Water stress and the water relations of seed development: a critical review // Crop Sci. 1994. V. 34. P. 1–11.
Cairney J., Pullman G.S. The cellular and molecular biology of conifer embryogenesis // New Phytol. 2007. V. 176. P. 511–536.
Carneros E., Celestino C., Klimaszewska K. et al. Plant regeneration in Stone pine (Pinus pinea L.) by somatic embryogenesis // Plant Cell Tiss. Org. Cult. 2009. V. 98. P. 165–178.
Chalupa W. Somatic embryogenesis and plantlet regeneration from cultured immature and mature embryos of Picea abies (L.) // Karst. Comm. Inst. For. Cech. 1985. V. 14. P. 57–63.
Choudhury H., Kumaria S., Tandon P. Induction and maturation of somatic embryos from intact megagametophyte explants in Khasi pine (Pinus kesiya Royle ex. Gord.) // Curr. Sci. 2008. V. 95(10). P. 1433–1438.
De Diego N., Montalbán I.A., Moncaleán P. In vitro regeneration of adult Pinus sylvestris L. trees // S. Afr. J. Bot. 2010. V. 76. P. 158–162.
Dumont-BeBoux N., Mazari A., Livingston N.J. et al. Water relations parameters and tissue development in somatic and zygotic embryos of three pinaceous conifers // Am. J. Bot. 1996. V. 83. P. 992–996.
Durzan D.J. Progress and promise in forest genetics // Paper Science and Technology: The Cutting Edge, 50th Anniversary, May 9–10, 1979. Wisconsin, Appleton: The Institute of Paper Chemistry, 1980. P. 31–60.
Durzan D.J., Chalupa V. Growth and metabolism of cells and tissue of jack pine (Pinus banksiana). III. Growth of cells in liquid suspension cultures in light and darkness // Can. J. Bot. 1976. V. 54. P. 456–467.
Engelmann F. Plant cryopreservation: progress and prospects // In Vitro Cell Dev. Biol. Plant. 2004. V. 40. P. 427–433.
Finer J.J., Kriebel H.B., Becwar M.R. Initiation of embryogenic callus and suspension cultures of eastern white pine (Pinus strobus L.) // Plant Cell Rep. 1989. V. 8. P. 203–206.
Finkelstein R.R., Lynch T.J. Abscisic acid inhibition of radicle emergence but not seedling growth is suppressed by sugars // Plant Physiol. 2000. V. 122. C. 1179–1186.
Gates J.C., Greenwood M.S. The physical and chemical environment of the developing embryo of Pinus resinosa // Am. J. Bot. 1991. V. 78. P. 1002–1009.
Gupta P.K, Durzan D.J. Shoot multiplication from mature trees of Douglas fir (Pseudotsuga menziesii) and sugar pine (Pinus lambertiana) // Plant Cell Rep. 1985. V. 4. P. 177–179.
Gupta P.K., Durzan D.J. Somatic polyembryogenesis from callus of mature sugar pine embryos // Biotechnology. 1986. V. 4. P. 643–645.
Gupta P.K., Durzan D.J. Biotechnology of somatic polyembryogenesis and plantlet regeneration in loblolly pine // Biotechnology. 1987. V. 5. P. 147–151.
Gupta P.K., Pullman G.S. Method for reproducing coniferous plants by somatic embryogenesis. Пат. № 4.957.866 США. 1990. 201 p.
Gupta P.K., Holmstrom D.G., Larson B., Zucati J. Development and stratification of pine somatic embryos using a liquid system. Пат. № 20050026281 США. 2005.
Häggman H., Aronen T., Ryynanen L. Cryopreservation of embryogenic cultures of conifers // Somatic embryogenesis in woody plants. V. 6. Dordrecht: Kluwer Acad. Publishers, 2000. P. 707–728.
Häggman H., Jokela A., Krajnakova J., Kauppi A. et al. Somatic embryogenesis of Scots pine: cold treatment and characteristics of explants affecting induction // J. Exp. Bot. 1999. V. 50. P. 1769–1778
Häggman H., Vuosku J., Sarjala T. et al. Somatic embryogenesis of pine species: from functional genomics to plantation forestry. Plant cell monograph. V. 2. Berlin: Springer, 2005. P. 119–140.
Hakman I. The development of somatic embryos in tissue cultures initiated from immature embryos of Picea abies (Norway spruce) // Plant Sci. 1985. V. 38. P. 53–59.
Handley L.W. Method for regeneration of coniferous plants by somatic embryogenesis in culture media containing abscisic acid. Пат. № 567718514 США. 1997.
Handley L.W. Method for regeneration of coniferous plants by somatic embryogenesis in culture media containing abscisic acid. Пат. № 58 561 915 США. 1999.
Hargreaves C.L., Reeves C.B., Find J.I. et al. Improving initiation, genotype capture, and family representation in somatic embryogenesis of Pinus radiata by a combination of zygotic embryo maturity, media, and explant preparation // Can. J. Forest Res. 2009. V. 39. P. 1566–1574.
Hay E.I., Charest P.J. Somatic embryo germination and desiccation tolerance in conifers // Somatic embryogenesis in woody plants. V. 4. Dordrecht: Kluwer Acad. Publishers, 1999. 61 p.
Hosoi Y., Maruyama T.E. Plant regeneration from embryogenic tissue of Pinus luchuensis Mayr, an endemic species in Ryukyu Island, Japan // Plant Biotechnol. 2012. V. 29. P. 401–406.
Huang J.-Q., Wei Z.-M., Xu Z.-H. Somatic embryogenesis and plantlet regeneration from callus of mature zygotic embryos of masson pine // Acta Bot. Sin. 1995. V. 37. P. 289–294.
Ishii K., Maruyama K., Hosoi Y. Somatic embryogenesis of Japanese conifers. Molecular breeding of woody plants. Amsterdam: Elsevier science, 2001. 297 p.
Jain M., Dong N., Newton R.J. Somatic embryogenesis in slash pine (Pinus elliottii) from immature embryos cultured in vitro // Plant Sci. 1989. V. 65. P. 233–241.
Jones N.B., van Staden J., Bayley A.D. Somatic embryogenesis in Pinus patula // Plant Physiol. 1993. V. 142. P. 366–372.
Jones N.B., van Staden J. Improved somatic embryo production from embryogenic tissue of Pinus patula // In Vitro Cell Dev. Biol. Plant. 2001. V. 37. P. 543–549.
Kartha K., Fowke L., Leung N. et al. Induction of somatic embryos and plantlets from cryopreserved cell cultures of white spruce (Picea glauca) // J. Plant Physiol. 1988. V. 132. P. 529–539.
Keinonen-Mettala K., Jalonen P., Eurola P. et al. Somatic embryogenesis of Pinus sylvestris // Scand. J. For. Res. 1996. V. 11. P. 242–250.
Kim Y.W., Moon H.K. Regeneration of plant by somatic embryogenesis in Pinus rigida x P. taeda // In Vitro Cell Dev. Biol. Plant. 2007. V. 43. P. 335–342.
Klimaszewska K., Cyr D.R. Conifer somatic embryogenesis: I. Development // Dendrobiology. 2002. V. 48. P. 31–39.
Klimaszewska K., Bernier-Cardou M., Cyr D.R., Sutton B.C.S. Influence of gelling agents on culture medium gel strength, water availability, tissue water potential, and maturation response in embryogenic cultures of Pinus strobus L. // In Vitro Cell Dev. Biol. Plant. 2000. V. 36. P. 279–286.
Klimaszewska K., Hargreaves C., Lelu-Walter M.A., Trontin J.-F. Chapter 7: Advances in conifer somatic embryogenesis since year 2000 // In Vitro Embryogen. High. Plant. Meth. Mol. Biol. 2016. V. 1359. P. 131–166.
Klimaszewska K., Park Y.S, Overton C., Maceacheron I. Optimized somatic embryogenesis in Pinus strobus L. // In Vitro Cell Dev. Plant. 2001. V. 37. P. 392–399.
Klimaszewska K., Trontin J.-F., Becwar M. et al. Recent progress in somatic embryogenesis of four Pinus spp. // Tree Forest. Sci. Biotechnol. V. 1. 2007. P.11–25.
Laine E., David A. Somatic embryogenesis in immature embryos and protoplasts of Pinus caribaea // Plant Sci. 1990. V. 69. P. 215–224.
Lara-Chavez A., Flinn B. S., Egertsdotter U. Initiation of somatic embryogenesis from immature zygotic embryos of Oocarpa pine (Pinus oocarpa Schiede ex Schlectendal) // Tree Physiol. V. 31. 2011. P. 539–554.
Lelu M.A. Somatic embryogenesis from immature and mature zygotic embryos and from cotyledons and needles of somatic plantlets of Larix / Eds M.A. Lelu, K. Klimaszewska, P.J. Charest // Can. J. For. Res. 1994. V. 24. № 1. P. 100–106.
Lelu M.A., Bastien C., Drugeault A. et al. Somatic embryogenesis and plantlet development in Pinus sylvestris and Pinus pinaster on medium with and without plant growth regulators // Physiologia Plantarum. 1999. V. 105. P. 719–728.
Lelu M.A., Klimaszewska K., Pflaum G., Bastien C. Effect of maturation duration on desiccation tolerance in hybrid larch (Larix Leptoeuropaea Dengler) somatic embryos // In Vitro Cell. Dev. Biol. 1995. V. 31. P. 15–20.
Lelu-Walter M.A., Bernier-Cardou M., Klimaszewska K. Simplified and improved somatic embryogenesis for clonal propagation of Pinus pinaster (Ait.) // Plant Cell Rep. 2006. V. 25. P. 767–776.
Liao Y., Amerson H.V. Slash pine (Pinus elliotii Engelm.) somatic embryogenesis II. Maturation of somatic embryos and plant regeneration // New For. 1995. V. 10. P. 165–182.
Litvay J.D., Verma D.C., Johnson M.A. Influence of loblolly pine (Pinus taeda L.) culture medium and its components on growth and somatic embryogenesis of the wild carrot (Daucus carota L.) // Plant Cell Rep. 1985. V. 4. P. 325–328.
Malabadi R.B, Nataraja K. 24-Epibrassinolide induces somatic embryogenesis in Pinus wallichiana A. B. Jacks. // J. Plant Sci. 2007a. V. 2. P. 171–178.
Malabadi R.B., Nataraja K. Putrescine influences somatic embryogenesis and plant regeneration in Pinus geradiana Wall. // Am. J. Plant Physiol. 2007b. V. 2. P. 107–114.
Malabadi R.B., van Staden J. Somatic embryogenesis from vegetative shoot apices of mature trees of Pinus patula // Tree Physiol. 2005. V. 25. P. 11–16.
Malabadi R.B., Choudhury H., Tandon P. Plant regeneration via somatic embryogenesis in Pinus kesiya (Royle ex. Grod.) // Appl. Biol. Res. 2002. V. 4. P. 1–10.
Malabadi R.B., Choudhury H., Tandon P. Initiation, maintenance and maturation of somatic embryos from thin apical dome sections in Pinus kesiya (Royle ex. Gord) promoted by partial desiccation and gellan gum // Sci. Hort. 2004. V. 102. P. 449–459.
Maruyama T.E., Hosoi Y. Postmaturation treatment improves and synchronizes somatic embryo germination of three species of Japanese pines // Plant Cell Tiss. Org. Cult. 2012. V. 110. P. 45–52.
Maruyama E., Hosoi Y., Ishii K. Propagation of Japanese red pine (Pinus densiflora Zieb. et Zucc.) via somatic embryogenesis // Propag. Ornam. Plants. 2005. V. 5. P. 199–204.
Maruyama E., Hosoi Y., Ishii K. Somatic embryogenesis and plant regeneration in yakutanegoyou, Pinus armandii Franch. var. amamiana (Koidz.) Hatusima, an endemic and endangered species in Japan // In Vitro Cell Dev. Biol. Plant. 2007. V. 43. P.28–34.
Merkle S.A., Montello P.M., Xia X. et al. Light quality treatments enhance somatic seedling production in three southern pine species // Tree Physiol. 2006. V. 26. P. 187–194.
Miguel C., Goncalves S., Tereso S. et al. Somatic embryogenesis from 20 open-pollinated families of Portuguese plus trees of maritime pine // Plant Cell Tiss. Org. Cult. 2004. V. 76. P. 121–130.
Montalbán I.A., De Diego N., Moncaleán P. Bottlenecks in Pinus radiata somatic embryogenesis: improving maturation and germination // Trees Struct. Funct. 2010. V. 24. P. 1061–1071.
Montalbán I.A., De Diego N., Moncaleán P. Enhancing initiation and proliferation in radiata pine (Pinus radiata D. Don) somatic embryogenesis through seed family screening, zygotic embryo staging and media adjustments // Acta Physiol. Plant. 2012. V. 34. P. 451–460.
Montalbán I.A., Garcia-Mendiguren O., Moncalean P. Chapter 21: Somatic embryogenesis in Pinus spp. / In vitro embryogenesis in higher plants // Meth. Mol. Biol. 2016. V. 1359. P. 405–416.
Montalbán I.A., Setién-Olarra A., Hargreaves C.L., Moncaleán P. Somatic embryogenesis in Pinus halepensis Mill.: an important ecological species from the Mediterranean forest // Trees Struct. Funct. 2013. V. 27. P. 1339–1351.
Nagmani R., Bonga J.M. Embryogenesis in sub-cultured callus of Larix deciduas // Can. J. For. Res. 1985. V. 15. P. 1088–1091.
Nagmani R., Diner A.M., Sharma G.C. Somatic embryogenesis in longleaf pine (Pinus palustris) // Can. J. For. Res. 1993. V. 23. P. 873–876.
Niemi K., Haggman H. Pisolithus tinctorius promotes germination and forms mycorrhizal structures in Scots pine somatic embryos in vitro // Mycorrhiza. 2002. V. 12. P. 263–267.
Nunes S., Marum L., Farinha N. et al. Somatic embryogenesis of hybrid Pinus elliottii var. elliottii x P. caribaea var. hondurensis and ploidy assessment of somatic plants // Plant Cell Tiss. Org. Cult. 2018. V. 132. P. 71–84.
Park J.-S., Bonga J., McCartney A., Adams G. Integration of tree biotechnologies into multi-varietal forestry // Proc. of the Third Internat. Conference of the IUFRO, unit 2.09.02 “Woody Plant Production Integrating Genetic and Vegetative Propagation Technologies”, 2014. P. 95–97.
Park S.-Y., Klimaszewska K., Park J.I.-Y., Mansfield S. Lodgepole pine: the first evidence of seed-based somatic embryogenesis and the expression of embryogenesis marker genes in shoot bud cultures of adult trees // Tree Physiol. 2010. V. 30. P. 1469–1478.
Park Y.S. Implementation of conifer somatic embryogenesis in clonal forestry: technical requirements and deployment considerations // Ann. For. Sci. 2002. V. 59. P. 651–656.
Park Y.S., Bonga J.M., Cameron S.I. et al. Somatic embryogenesis in Jack pine (Pinus banksiana Lamb) // Somatic embryogenesis in woody plants. 1999. V. 4. P. 491–504.
Percy R.E., Klimaszewska K., Cyr D.R. Evaluation of somatic embryogenesis for clonal propagation of western white pine // Can. J. For. Res. 2000. V. 30. P. 1867–1876.
Pulianmackal A.J., Kareem A.V.K., Durgaprasad K. et al. Competence and regulatory interactions during regeneration in plants // Front Plant Sci. 2014. V. 5. P. 1–16.
Pullman G.S., Bucalo K. Chapter 19: Pine somatic embryogenesis using zygotic embryos as explants / Plant Embryo Culture // Methods and Protocols, Meth. Mol. Biol. 2011. V. 710. P. 267–290.
Pullman G.S., Bucalo K. Pine somatic embryogenesis: analyses of seed tissue and medium to improve protocol development // New For. 2014. V. 45. P. 353–377.
Pullman G.S., Johnson S. Somatic embryogenesis in loblolly pine (Pinus taeda L.): improving culture initiation rates // Ann. For. Sci. 2002. V. 59. P. 663–668.
Pullman G.S., Skryabina A. Liquid medium and liquid overlays improve embryogenic tissue initiation in conifers // Plant Cell Rep. 2007. V. 26. P. 873–887.
Pullman G.S., Webb D.T. An embryo staging system for comparison of zygotic and somatic embryo development // TAPPI R&D division biological sciences symposium, Minnesota. 1994. P. 31–34.
Pullman G.S., Johnson S., van Tassel S., Zhang Y. Somatic embryogenesis in loblolly pine (Pinus taeda L.) and Douglas fir (Pseudotsuga menziesii): Improving culture initiation with MES pH buffer, biotin, and folic acid // Plant Cell Tiss. Org. Cult. 2005a. V. 80. P. 91–103.
Pullman G.S., Mein J., Johnson S., Zhang Y. Gibberellin inhibitors improve embryogenic tissue initiation in conifers // Plant Cell Rep. 2005b. V. 23. P. 596–605.
Pullman G.S., Montello P., Cairney J. et al. Loblolly pine (Pinus taeda L.) somatic embryogenesis: maturation improvements by metal analyses of zygotic and somatic embryos // Plant Sci. 2003a. V. 164. P. 955–969.
Pullman G.S., Namjoshi K., Zhang Y. Somatic embryogenesis in loblolly pine (Pinus taeda L.): improving culture initiation with abscisic acid, silver nitrate, and cytokinins adjustments // Plant Cell Rep. 2003b. V. 22. P. 85–95.
Pullman G.S., Zhang Y., Phan B. Brassinolide improves embryogenic tissue initiation in conifers and rice // Plant Cell Rep. 2003c. V. 22. P. 96–104.
Quiroz-Figueroa F.R., Rojas-Herrera R., Galaz-Avalos R.M., Loyola-Vargas V.M. Embryo production through somatic embryogenesis can be used to study cell differentiation in plants // Plant Cell Tiss. Org. Cult. 2006. V. 86. P. 285–301.
Salajova T., Salaj J. Somatic embryogenesis in European black pine (Pinus nigra Arn.) // Biol. Plant. 1992. V. 34. P. 213–218.
Salajova T., Salaj J., Kormutak A. Initiation of embryogenic tissues and plantlet regeneration from somatic embryos of Pinus nigra Arn. // Plant Sci. 1999. V. 145. P. 33–40.
Salajova T., Salaj J. Somatic embryogenesis in Pinus nigra: embryogenic tissue initiation, maturation and regeneration ability of established cell lines // Biol. Plant. 2005. V. 49. P. 333–339.
Sharp W.R., Sondahl M.R., Caldas L.A., Maraffa S.B. The physiology of in vitro asexual embryogenesis // Hort. Rev. 1980. V. 2. P. 268–310.
Singh H. Embryology of gymnosperms. Encyclopedia of plant anatomy. Berlin: Gebrüder Borntraeger, 1978. P. 192–198.
Smertenko A.P., Bozhkov P.V., Filonova L.H., Hussey P.J. Re-organisation of the cytoskeleton during developmental programmed cell death in Picea abies embryos // Plant J. 2003. V. 33. P. 813–824.
Smith D.R., Singh A.P., Wilton L. Zygotic embryos of Pinus radiata in vivo and in vitro // Proceedings of the international workshop on conifer tissue culture / Abstracts of the 3rd meeting International conifer tissue culture work group, Rotorua. 1985. P. 12–16.
Stasolla C., Yeung E.C. Ascorbic acid improves conversion of white spruce somatic embryos // In Vitro Cell. Dev. Biol. Plant. 1999. V. 35. P. 316–319.
Stasolla C., Yeung E.C. Recent advances in conifer somatic embryogenesis: improving somatic embryo quality // Plant Cell Tiss. Org. Cult. 2003. V. 74. P. 15–35.
Stasolla C., Kong L., Yeung E.C., Thorpe T.A. Maturation of somatic embryos in conifers: morphogenesis, physiology, biochemistry and molecular biology // In Vitro Cell. Dev. Biol. Plant. 2002. V. 38. P. 93–105.
Stojicic D., Uzelac B., Janosevic D. et al. Induction of somatic embryogenesis in Pinus heldreichii culture // Arch. Biol. Sci. Belgrade. 2007. V. 59. P. 199–202.
Tang W., Guo Z., Ouyang F. Plant regeneration from embryogenic cultures initiated from mature loblolly pine zygotic embryos // In Vitro Cell. Dev. Biol. Plant. 2001. V. 37. P. 558–563.
Taniguchi T. Plant regeneration from somatic embryos in Pinus thunbergii (Japanese black pine) and Pinus densiflora (Japanese red pine) // Molecular breeding of woody plants / Eds N. Morohoshi, A. Komamine. Amsterdam: Elsevier, 2001. 319 p.
Timmis R. Bioprocessing for tree production in the forest industry: conifer somatic embryogenesis // Biotechnol. Prog. 1998. V. 14. P. 156–166.
Tret’yakova I.N., Park M.E. Somatic polyembriogenesis of Larix sibirica in embryogenic in vitro culture // Rus. J. Dev. Biol. 2018. V. 49 (4). P. 222–233.
Vales T., Fang X., Ge L. et al. Improved somatic embryo maturation in loblolly pine by monitoring ABA-responsive gene expression // Plant Cell Rep. 2007. V. 26. P. 133–143.
Vlašínová H., Neděla V., Đorđević B., Havel L. Bottlenecks in bog pine multiplication by somatic embryogenesis and their visualization with the environmental scanning electron microscope // Protoplasma. 2017. V. 254. P. 1487–1497.
von Arnold S., Sabala I., Bozhkov P. et al. Developmental pathways of somatic embryogenesis // Plant Cell Tiss. Org. Cult. 2002. V. 69. P. 233–249.
Yeung E.C., Stasolla C. Somatic embryogenesis-apical meristem formation and conversion // Korean J. Plant Tiss. Cult. 2000. V. 27. P. 253–258.
Yildrim T., Kaya Z., Isik K. Induction of embryogenic tissue and maturation of somatic embryos in Pinus brutia TEN // Plant Cell Tiss. Org. Cult. 2006. V. 87. P. 67–76.
Zhang C.X., Li Q., Kong L. Induction, development and maturation of somatic embryos in Bunge’s pine (Pinus bungeana Zucc. ex Endl.) // Plant Cell Tiss. Org. Cult. 2007. V. 91. P. 273–280.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии