Успехи современной биологии, 2019, T. 139, № 4, стр. 338-351
Десатуразы жирных кислот растений: роль в жизнедеятельности растений и биотехнологический потенциал
М. А. Берестовой 1, *, О. С. Павленко 1, И. В. Голденкова-Павлова 1, **
1 Институт физиологии растений им. К.А. Тимирязева
Москва, Россия
* E-mail: m.berestovoy1181@gmail.com
** E-mail: irengold58@gmail.com
Поступила в редакцию 12.02.2019
После доработки 18.03.2019
Принята к публикации 18.03.2019
Аннотация
Десатуразы жирных кислот играют ключевую роль в поддержании гомеостаза клеточных мембран за счет превращения насыщенных жирных кислот мембранных липидов в ненасыщенные. Модуляция ненасыщенности жирных кислот клеточных мембран является одним из механизмов адаптации растений к стрессовым факторам среды как биотическим, так и абиотическим. Изучение механизмов функционирования десатураз, а также их локализации и особенностей экспрессии генов играет фундаментальную роль в понимании процессов адаптации растений, которые постоянно подвергаются различным неблагоприятным воздействиям окружающей среды. Помимо фундаментального, такие исследования имеют и практическое значение, поскольку позволяют расширить потенциал десатураз, заложить основы нового поколения трансгенов, в том числе и с использованием технологий геномного редактирования, и, как следствие, принести большую пользу человечеству в создании устойчивых к стрессовым воздействиям или с улучшенными питательными свойствами сельскохозяйственных культур (биофортификация).
ВВЕДЕНИЕ
Биологические мембраны, в целом, и их липидные компоненты, в частности, способны обеспечить защиту клетки от практически любого стрессового фактора. Сохранение функций мембран жизненно важно для клетки. В 1973 г. была предложена (Lyons, 1973) мембранная теория устойчивости, в соответствии с которой гибель растений при низких температурах и адаптация к ним связаны с жидкостными свойствами липидных бислоев внутриклеточных мембран.
Согласно текущему мнению, температурный и осмотический стрессы, а также нехватка воды вызывают изменения физических свойств клеточных мембран живых организмов. Липидный состав мембран определяет физико-химическое состояние мембраны, тогда как пространственная упаковка липидов определяет ее текучесть. Снижение температуры, как и повышение концентрации осмотически активных веществ, приводит к уменьшению текучести мембраны вследствие изменения пространственной организации липидов. Для поддержания определенного уровня текучести мембраны при низких температурах необходима модуляция уровня ненасыщенных жирных кислот (ЖК), поскольку температура их фазового перехода значительно ниже физиологических значений (Los et al., 2013). Основную роль в процессе поддержания текучести мембран, в том числе и во время действия стрессовых факторов, играют десатуразы ЖК. Десатуразы катализируют превращение одинарной (C–C) связи между атомами углерода в ацильных цепях ЖК в двойные (C=C) связи (Лось, 2001, 2014) и преобразовывают насыщенные ЖК в ненасыщенные.
В обзоре мы суммируем современные данные о строении, механизмах функционирования, локализации десатураз и контроле экспрессии их генов. Кроме того, мы демонстрируем и прикладной потенциал использования результатов научных исследований о десатуразах, прежде всего, для создания новых форм растений, устойчивых к неблагоприятным факторам окружающей среды, которым они постоянно подвергаются.
КЛАССИФИКАЦИЯ ДЕСАТУРАЗ
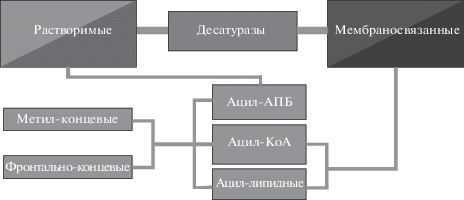
На данный момент предложены, как минимум, три классификации десатураз: 1) по состоянию (растворимые и мембраносвязанные десатуразы); 2) по переносчику субстрата (ацил-АПБ (ацил-переносящий белок), ацил-коэнзим А (ацил-КоА) и ацил-липидные десатуразы); 3) по месту введения двойной связи (фронтально-концевые Δ и метил-концевые ω). При рассмотрении существующих классификаций следует отметить их взаимосвязь. Например, ацил-АПБ, ацил-КоА, ацил-липидные можно отнести как к фронтально-концевым, так и метил-концевым (рис. 1).
Ниже рассмотрим подробнее каждую из классификаций десатураз, не забыв при этом коснуться структуры десатураз, механизмов их функционирования и локализации.
Растворимые десатуразы чаще всего локализованы в строме пластид высших растений (Lou, Shanklin, 2010; Lou et al., 2014). Для функционирования растворимых десатураз необходимо, чтобы субстрат (ЖК) был этерифицирован с АПБ, поэтому такие десатуразы чаще всего называют ацил-АПБ-десатуразами (Лось, 2014).
Растворимые десатуразы образованы 11 белковыми α-спиралями. Семь α-спиралей формируют пучок, внутри которого располагается субстрат-связывающая полость. Четыре белковые α-спирали формируют субстрат-связывающую полость (Moche et al., 2003; Guy et al., 2007). Два высоко- консервативных мотива E/DxxH связывают два атома трехвалентного железа и таким образом образуют каталитический комплекс, в котором один из атомов железа взаимодействует с глютаминовой кислотой Е143 и гистидином Н146, другой – с глютаминовой кислотой Е229 и гистидином Н232 (рис. 2) (Shanklin, Cahoon, 1998; Moche et al., 2003). Этот комплекс способен разрывать неактивированные С–Н связи с образованием двойных связей в цепях ЖК.
Рис. 2.
Кристаллическая структура растворимых ацил-АПБ-десатураз на примере Δ9-стеароил-(18:0)-АПБ-десатуразы клещевины обыкновенной (PBD 2XZ0). (а) – структура субъединицы Δ9-стеароил-(18:0)-АПБ-десатуразы, состоящая из 11 α-спиралей; на схеме отображен каталитический комплекс, включающий два атома трехвалентного железа; (б) – димер Δ9-стеароил-(18:0)-АПБ-десатуразы; каталитические комплексы выделены квадратами (по Shanklin, Cahoon, 1998; Moche et al., 2003).
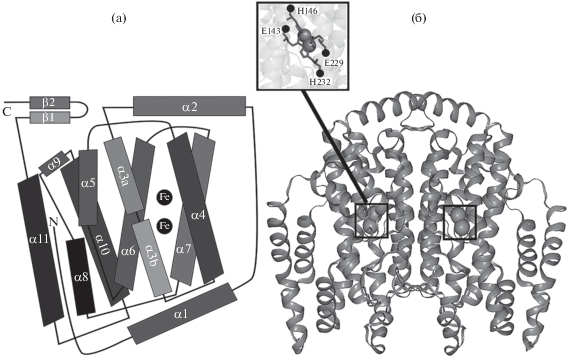
Каталитический комплекс находится в месте изгиба гидрофобного канала, уходящего от поверхности вглубь кристаллической структуры фермента, в который входит субстрат. Изменения в распределении зарядов в гидрофобном канале определяют глубину проникновения ЖК. Эти изменения влияют на специфичность десатуразы и положение, в котором образуется двойная связь, в зависимости от длины ЖК-цепи (Lindqvist et al., 1996).
Механизм функционирования растворимых десатураз во многом схож с другими негемовыми ферментами, активный сайт каталитического комплекса которых содержит два атома железа (2Fe-сайт) (Lindqvist et al., 1996; Moche et al., 2003; Shanklin et al., 2009). Для активации атомов кислорода в 2Fe-сайте необходимы доноры электронов (Shanklin et al., 2009). Все известные растворимые ацил-АПБ получают электроны от NADH через ферредоксины (Chazarreta-Cifre et al., 2011; Heinz, 2018). Тем не менее, путь, по которому электроны переносятся от ферредоксинов к 2Fe-сайту в каталитическом комплексе десатураз, до конца не изучен.
Анализ кристаллической структуры растворимых ацил-АПБ-десатураз показал, что растворимые десатуразы имеют димерную, четвертичную структуру (рис. 2) (Moche et al., 2003, Guy et al., 2007). Дополнительно установлено, что во время ферментативного цикла в результате окислительно-восстановительных реакций в ионах металлов в каждой субъединице происходят конформационные изменения аминокислотных остатков в каталитическом центре фермента (Shanklin et al., 2009).
Мембраносвязанные десатуразы
Семейство мембраносвязанных десатураз является более многочисленным и более разнообразным по сравнению с семейством растворимых десатураз. В клетках эукариот они обнаружены в ЭПР (эндоплазматическом ретикулуме), плазматической мембране и мембране пластид (Yadav et al., 1993; McCartney et al., 2004). У прокариот они локализованы в плазматической мембране, а каталитический комплекс – с цитозольной стороны мембраны (Diaz et al., 2002).
Мембраносвязанные десатуразы представляют собой интегральные мембранные белки, которые довольно сложно выделить, а их структуру охарактеризовать. В настоящее время существует мнение, что большинство мембраносвязанных десатураз имеют четырехдоменную структуру (Zäuner et al., 2012), однако существуют исключения. Например, Δ9-десатураза Pseudomonas состоит из трех доменов (Garba et al., 2018), а структура Δ5-ацил-липидной десатуразы Bacillus subtillis, Δ8-десатуразы сфинголипидов Brassica rapa и Δ6-десатуразы Monilesaurus rouxii включает шесть трансмембранных доменов (Diaz et al., 2002; Na-Ranong et al., 2006; Li et al., 2011).
Мембраносвязанные десатуразы содержат три консервативных гистидиновых мотива, которые, как полагают, ответственны за образование кластера из двух атомов металла в каталитическом комплексе, необходимого для поддержания каталитической активности фермента (Hernández et al., 2016; Dar et al., 2017).
Недавно определена структура мембраносвязанной стеароил-КоА-десатуразы 1 человека и мыши (рис. 3) (Bai et al., 2015; Wang et al., 2015). Полученные данные согласуются со структурной моделью, описанной ранее. Согласно данным, стеароил-КоА-десатураза состоит из цитозольного домена и четырех трансмембранных доменов. Одиннадцать α-спиральных сегментов (у стеароил-КоА-десатуразы 1 человека десять α-спиральных сегментов) образуют цитозольный домен десатуразы и пучок, формирующий субстрат-связывающую полость десатуразы, в глубине которого находится каталитический комплекс, включающий два атома цинка. Каталитический комплекс расположен в месте изгиба гидрофобного канала, как и у растворимых десатураз, но изгиб канала неглубоко погружен в пучок, формирующий субстрат-связывающую полость (Bai et al., 2015; Wang et al., 2015). Аналогично растворимым десатуразам, форма и специфичность субстрат-связывающей полости мембраносвязанных десатураз определяется местом расположения ацильной группы ЖК. Однако каталитический комплекс, состоящий из двух атомов металла, у мембраносвязанных десатураз координируется тремя консервативными гистидин богатыми мотивами и ранее неизвестным NxxxH гистидиновым мотивом (у стеароил-КоА-десатуразы 1 мыши), локализованными в цитозольном домене (Bai et al., 2015; Wang et al., 2015).
Рис. 3.
Структура и топология стеароил-КоА-десатуразы 1 мыши (по Bai et al., 2015). Кристаллическая структура стеароил-КоА-десатуразы 1 мыши показана по отношению к перпендикулярно ориентированной мембране, цитозоль клетки располагается сверху. Две черные сферы – ионы цинка, связанные с цитозольным доменом десатуразы. Цифры 1, 2, 3, 4 – трансмембранные домены.
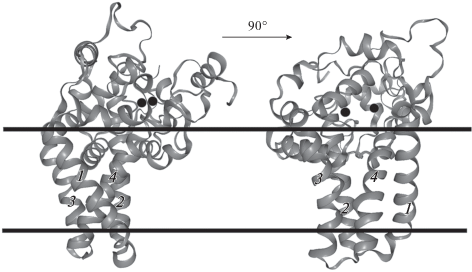
Несмотря на различия в металл-координирующих мотивах, механизм функционирования каталитического центра мембраносвязанных десатураз аналогичен механизму функционирования каталитического центра растворимых десатураз (Bai et al., 2015). Однако, в отличие от растворимых десатураз, использующих ферредоксины в качестве доноров (Wada et al., 1993; Chazarreta-Cifre et al., 2011), цитохром b5 является наиболее распространенным донором электронов для мембраносвязанных десатураз (Wada et al., 1993; Napier et al., 2003; Guillou et al., 2004; Gostinčar et al., 2010; Bai et al., 2015; Wang et al., 2015). Благодаря более доступному расположению каталитических сайтов мембраносвязанных десатураз, возможен прямой перенос электронов от цитохрома b5 к десатуразе (Bai et al., 2015; Wang et al., 2015).
Ацил-АПБ, ацил-КоА и ацил-липидные десатуразы
Еще одна классификация десатураз – разделение десатураз в зависимости от переносчика субстрата. Исходя из этой классификации, десатуразы могут быть разделены на три класса: ацил-АПБ-десатуразы, ацил-липидные десатуразы и ацил-КоА-десатуразы (Лось, 2001).
Ацил-АПБ-десатуразы обнаружены только в пластидах растений, где происходит de novo биосинтез ЖК, субстратом для этого типа десатураз служат ЖК, связанные с АПБ (Schultzet al., 2000; Zhang et al., 2015).
Ацил-КоА-десатуразы, как правило, связаны с мембраной и расположены в ЭПР эукариот. Ацил-КоА-десатуразы используют в качестве субстрата ЖК, связанные с коферментом А (Bai et al., 2015; Wang et al., 2015).
Субстратом для ацил-липидных десатураз являются ЖК, входящие в состав сложных липидов: гликоглицеролипидов, фосфоглицеролипидов и сфинголипидов (Лось, 2001). Ацил-липидные десатуразы локализованы преимущественно в ЭПР (Chen, Thelen, 2013; Mori et al., 2016).
При этом ацил-КоА-десатуразы, как и ацил-липидные десатуразы, относятся к классу Δ-десатураз или фронтально-концевых десатураз. Существует мнение, что все известные десатуразы млекопитающих являются ацил-КoA-десатуразами (Nakamura, Nara, 2004).
Дельта и омега десатуразы
Основываясь на сайт-специфичности (введение новообразованной связи C=C по отношению к концам ЖК-цепи и ранее введенным в молекулу ЖК C=C связям), десатуразы делят на две группы: Δ-десатуразы, или фронтально-концевые десатуразы, и ω-десатуразы, или метил-концевые десатуразы (Yadav et al., 1993; Aitzetmüller, Tsevegsüren, 1994; Hitz et al., 1994; Reed et al., 2000; López Alonso et al., 2003; Sperling et al., 2003; Buist, 2008).
Δ-десатуразы образуют как первую связь C=C в положении Δ9 ацильной группы, так и связи между существующей C=C связью и карбоксильным концом субстрата. Предполагают, что Δ9-десатуразы являются наиболее древними ферментами из всех десатураз, поскольку представлены во всех живых организмах. Кроме того, продукты десатурации Δ9-десатураз зачастую являются субстратами для других мембранных десатураз (López Alonso et al., 2003).
Другая группа десатураз, которая также известна как ω-десатуразы, или метил-концевые десатуразы, катализирует образование связи C=C между уже существующими C=C-связями и метильным концом ЖК-цепи.
ЭКСПРЕССИЯ И РЕГУЛЯЦИЯ ГЕНОВ, КОДИРУЮЩИХ ДЕСАТУРАЗЫ
Среди генов десатураз высших растений наиболее изучены гены модельного растения Arabidopsis thaliana. В частности, одним из первых клонированных генов десатураз был ген FAD2, который кодирует Δ12-ацил-липидную десатуразу (Okuley et al., 1994). В дальнейшем ортологи гена FAD2 были клонированы и охарактеризованы для множества других видов высших растений, включая сою (Schlueter et al., 2007; Lakhssassi et al., 2017), рапс (Jung et al., 2011; Yang et al., 2012), хлопчатник (Liu et al., 1999; Zhang et al., 2009), арахис (Pandey et al., 2014), лен (You et al., 2014) и люцерну (Zhang et al., 2018).
Десатуразы ЖК растений кодируются ядерными генами, однако, в основном, осуществляют десатурацию ЖК липидов в ЭПР и пластидах. При этом гены, кодирующие десатуразы, экспрессируются в большинстве растительных тканей, однако уровень их экспрессии может быть различен. Это убедительно продемонстрировано в ряде работ для генов ω3- и ω6-десатураз и Δ12-, Δ9-, Δ3-, Δ7-десатураз (Zhang et al., 2012; Dong et al., 2016; Chi et al., 2017).
Согласно экспериментальным данным, экспрессия генов десатураз ЖК может быть индуцирована гормонами, а также биотическими (фитопатогены различного происхождения) и абиотическими (температура, освещенность, концентрация осмотически активных веществ и солей) факторами воздействия (Harwood, 1998; Chi et al., 2017; Sui et al., 2018; Xue et al., 2018; Zhang et al., 2018) (рис. 4).
Рис. 4.
Схема регуляции экспрессии генов десатураз. FAD, FAB, SAD, SLD и DES – гены десатураз. Δ3–12 и ω3, ω6 – десатуразы. Каждому фактору активации экспрессии генов десатураз соответствует собственный знак.

В настоящее время убедительно доказана взаимосвязь между изменением температуры, концентрацией осмотических веществ и солей и экспрессией некоторых генов десатураз у высших растений. Например, при изучении влияния температуры на экспрессию генов десатураз продемонстрировано, что их экспрессия в большинстве случаев увеличивается в ответ на воздействие низких температур (Liu et al., 2015; Dong et al., 2016; Feng et al., 2017; Zhang et al., 2018), тогда как при повышении температуры отмечена обратная реакция (Dong et al., 2016; Zhang et al., 2018). Так, у люцерны Medicago truncatula под действием низких температур экспрессия генов FAD3 и FAD7 (кодируют ω3-десатуразы, локализованы в ЭПР и хлоропластах соответственно) значительно увеличивается по сравнению с растениями, выращенными в нормальных условиях. На основании этих результатов высказано предположение, что эти десатуразы могут играть ключевую роль в реакции растений на низкотемпературный стресс (Zhang et al., 2018). Сходные результаты получены при исследовании генов десатураз хлопчатника. Ген FAD7/8-1, кодирующий ω3-десатуразу, локализованную в хлоропластах, продемонстрировал повышенный профиль экспрессии в ответ на низкие температуры. При этом повышение экспрессии этого гена наблюдалось и в ответ на засуху (Yurchenko et al., 2014). Экспрессия большинства генов десатураз ЖК огурца усиливается в ответ на холод и подавляется высокой температурой. Так экспрессия генов десатураз FAD2 и FAD3 (кодируют Δ12- и ω3-десатуразы соответственно), белковые продукты которых локализованы в ЭПР, и генов десатураз FAD4, FAD5, FAD6, FAD7 (кодируют Δ3-, Δ7-, ω6- и ω3-десатуразы соответственно), белковые продукты которых локализованы в хлоропластах, повышается при снижении температуры. При этом высокие температуры вызывают репрессию экспрессии как генов FAB2, FAD4, FAD5, FAD6 десатураз (Δ9-, Δ3-, Δ7- и ω6-десатуразы), локализованных в ЭПР, так и генов FAD2, FAD3 десатураз (Δ12- и ω3-десатуразы), локализованных в хлоропластах (Dong et al., 2016).
Как указано выше, не только температурные изменения, но и солевой стресс также оказывает влияние на экспрессию генов десатураз. Например, у арахиса Arachis hypogaea при солевом стрессе (инкубация арахиса в присутствии NaCl в концентрации 250 мМ в течение 4 сут) наблюдется снижение экспрессии ω3-десатуразы и ее восстановление после снятия стрессового воздействия. Так, при солевом стрессе изменяется ЖК-состав, а именно: достоверно снижается содержание α-линоленовой кислоты (Sui et al., 2018), наряду со снижением активности супероксиддисмутазы (СОД) и аскорбатпероксидазы (АП) и с увеличением, вследствие этого, содержания супероксид-аниона $\left( {{{{\text{O}}}_{{{{{\text{2}}}^{{ - \bullet }}}}}}} \right)$ и перекиси водорода (H2O2). Роль экспрессии гена LeFAD3, кодирующего ω3-десатуразу, локализованную в ЭПР, в толерантности растений к солевому стрессу продемонстрирована на экспериментальных моделях трансгенных растений томатов (Wang et al., 2014). Так, солевой стресс не сказывается на ростовых характеристиках трансгенных растений томатов в отличие от растений дикого типа и трансгенных растений, которые экспрессировали антисмысловую последовательность гена LeFAD3. Эти результаты могут быть объяснены тем, что трансгенные растения томатов с конститутивной экспрессией гена десатуразы LeFAD3 способны к поддержанию целостности мембран при действии стрессового фактора, что подтверждено методом трансмиссионной электронной микроскопии (Wang et al., 2014). Таким образом, экспериментальные данные свидетельствуют о важной роли десатурации мембранных липидов, которая обусловлена экспрессией генов десатураз, в регуляции текучести мембран и в адаптации растений к изменению температуры и концентрации солей в почве.
В исследованиях экспрессии генов десатураз выяснена важная роль посттранскрипционных и посттрансляционных модификаций в регуляции функционирования десатураз (рис. 4). Согласно текущему мнению, изменение ЖК-состава липидов клеточных мембран растений при снижении температуры, по всей видимости, происходит также и за счет таких модификаций, а не только за счет увеличения уровня мРНК десатураз (Dar et al., 2017). На примере экспрессии в дрожжах семя-специфичных изоформ десатураз FAD2-1A и FAD2-1B из растений сои, отличающихся 24 аминокислотными остатками, продемонстрировано, что изоформа FAD2-1B более стабильна при повышенных температурах (Tang et al., 2005). У ω-десатураз FAD3 хлопчатника Gossypium raimondii и арабидопсиса A. thaliana, локализованных в ЭПР, также отмечено регулирование активности низкой температурой как на уровне транскрипции (снижение температуры приводит к увеличению мРНК, а затем накоплению соответствующего фермента (Wang, Xu, 2010; Liu et al., 2015)), так и на посттранскрипционном и посттрансляционном уровнях (изменения в 5'-нетранслируемой области мРНК гена десатуразы или аминокислотной последовательности в N-концевой области фермента увеличивают активность гена FAD3 и время полужизни продуктов этого гена при низких температурах (Tang et al., 2005; Wang, Xu, 2010).
Исследованы (Matsuda et al., 2005) посттрансляционные механизмы регуляции активности ω3-десатуразы, кодируемой геном FAD8, A. thaliana в ответ на изменение температуры. Так, убедительно продемонстрировано, что активность десатуразы регулируется за счет C-концевой области, а именно: активность этой десатуразы снижается при высокой температуре только в том случае, если десатураза содержит специфическую C-концевую область.
Согласно экспериментальным данным, фитогормоны также могут регулировать экспрессию генов десатураз и в ряде случаев в тканеспецифичной манере. Так, при обработке растений арахиса абсцизовой кислотой (АБК) уровень транскриптов ω3-десатуразы (локализация в хлоропластах), Δ12-десатуразы (локализация в ЭПР), Δ8- и Δ4-десатураз сфинголипидов увеличивается только в корнях (Chi et al., 2017). Противоположная закономерность отмечена при действии АБК на уровень экспрессии ω3-десатуразы чиа Salvia hispanica и периллы Perilla frutescens: экспрессия этих генов первоначально репрессируется, а затем восстанавливается через 48 ч. Воздействие салициловой кислотой (СК) и метилжасмонатом (МЖ) на растения S. hispanica и P. frutescens приводит к увеличению экспрессии генов FAD3, FAD7, FAD8 ω-десатураз (Xue et al., 2018). Убедительное экспериментальное подтверждение регулирования экспрессии генов десатураз фитогормонами продемонстрировано при изучении промотора гена FAD2 A. thaliana, кодирующего Δ12-десатуразу. В этом исследовании с использованием стратегии репортерных генов продемонстрировано, что активность промотора гена FAD2 снижается в листьях и корнях при действии 24-эпибрассинолида, АБК и СК. При этом эффект гормонов проявлялся в дозозависимой манере. Так, отмечено снижение активности промотора гена FAD2, пропорциональное увеличению концентрации СК. Высокие концентрации АБК или 24-эпибрассинолида снижали активность промотора в листьях и корнях, но малые количества этих гормонов вызывали снижение активности промотора только в корнях (Yuan et al., 2012). Таким образом, вышеизложенное свидетельствует о том, что экспрессия генов десатураз растений регулируется гормонами, при этом регуляция экспрессии этих генов тканеспецифична и проявляется в дозозависимой манере.
Возможность регуляции экспрессии генов десатураз фитогормонами в первую очередь говорит о возможном участии десатураз в процессах передачи сигналов. Так, десатуразы вовлечены в биосинтез промежуточных соединений, например, α-линоленовой кислоты, необходимой для биосинтеза жасмоната – гормона, играющего важную роль в развитии растений и в реакциях растений на стресс (Xue et al., 2018). По-видимому, регуляция экспрессии генов десатураз гормонами необходима не только для поддержания текучести мембран под воздействием стресса, но и для запуска дополнительных клеточных механизмов, необходимых для адаптации растений к действию стрессовых факторов как абиотического, так и биотического происхождения.
Согласно текущему мнению, такие биотические факторы как фитопатогены, а также поранения индуцируют экспрессию генов десатураз. В этот процесс индукции в качестве сигнальных молекул могут быть вовлечены и растительные гормоны (например, МЖ, АБК, этилен), и олигосахариды, и олигопептиды (Xue et al., 2018), а также такие ЖК, как линолевая и α-линоленовая (Dar et al., 2017). Модуляция экспрессии генов десатураз в этом случае может играть роль защитного механизма в обеспечении устойчивости растений к биотическим стрессовым факторам, что убедительно подтверждено в ряде исследований, в том числе и с использованием моделей трансгенных растений, экспрессирующих гетерологичные гены десатураз. Например, трансгенные растения томата, экспрессирующие ген стеароил-десатуразы грибного происхождения (Flammulina velutipes), проявляют повышенную устойчивость к воздействию фитопатогенов за счет увеличения выделения восков (Kamthan et al., 2012). Трансгенные растения картофеля, экспрессирующие Δ12-ацил-липидную десатуразу из цианобактерий Synechosystis sp. PCC 6803, помимо увеличения относительного содержания полиненасыщенных ЖК (линолевой и α-линоленовой), характеризуются высоким показателем устойчивости к возбудителю фитофтороза Phytophthora infestans по сравнению с исходной формой (Юрьева и др., 2014).
Убедительные экспериментальные подтверждения роли десатураз в защитных механизмах растений получены с использованием трансгенных технологий на мутантных растениях с дефицитом экспрессии разных генов десатураз. Например, экспрессия гена TaSSI2, кодирующего стеароил-АПБ-десатуразу пшеницы в растениях A. thaliana, риса, сои, мутантных по гену стеароил-АПБ-десатуразы (ssi2-мутанты), привела к повышению устойчивости растений к широкому кругу фитопатогенов, в том числе и к мучнистой росе (Song et al., 2013; Hu et al., 2018). Помимо устойчивости к биотическим факторам, перенос и экспрессия гена TaSSI2 в трансгенных растениях может быть перспективным подходом и к созданию растений, устойчивых к засухе, поскольку стеароил-АПБ-десатураза участвует в биосинтезе восков (Hu et al., 2018).
Согласно современным экспериментальным данным, поранения также увеличивают экспрессию генов десатураз у растений, приводя в месте поранения к накоплению триеновых кислот и жасмоната в хлоропластах (Лось, 2014). Триеновые кислоты в хлоропластах, например α-линоленовая кислота, играют роль предшественников в биосинтезе жасмоната, который в свою очередь является одним из ключевых участников в запуске защитных механизмов растений. Для иллюстрации процессов усиления экспрессии генов десатураз при поранении можно привести ген FAD7 портулака Portulaca oleracea, который кодирует ω3-десатуразу пластид. Он индуцируется поранением с параллельным увеличением содержания α-линоленовой кислоты (Teixeira et al., 2010). Достоверное увеличение экспрессии стеароил-АПБ-десатуразы, кодируемой геном CsSAD, отмечено и при поранениях растений чая (Ding et al., 2016). Экспрессия ω3-десатураз у S. hispanica и P. frutescens также усиливалась при раневом воздействии. При этом увеличение экспрессии генов ω-десатураз коррелирует с активацией биосинтеза и приводит к достоверному накоплению жасмоната (Xue et al., 2018).
Таким образом, в настоящее время убедительно продемонстрировано, что экспрессия генов десатураз регулируется действием различных стрессовых факторов и гормонов. Это позволяет внести их в список ключевых участников как процессов сигнализации, так и механизмов защиты и адаптации растений к биотическим и абиотическим факторам.
БИОТЕХНОЛОГИЧЕСКИЙ ПОТЕНЦИАЛ ДЕСАТУРАЗ
Исследования функционирования десатураз, а также их локализации и особенностей экспрессии их генов сыграли важную роль в понимании процессов адаптации растений. Фундаментальные знания, полученные в результате таких исследований, используются и могут быть использованы в дальнейшем для получения сельскохозяйственных культур с улучшенными питательными свойствами и устойчивых к разного рода стрессовым воздействиям. Конструирование таких растений стало возможно благодаря не только данным о структуре и экспрессии генов десатураз, но и разработке генно-инженерных подходов, в том числе и технологий геномного редактирования.
При создании растений, невосприимчивых к стрессовым воздействиям, и растений с улучшенными питательными свойствами учеными могут быть использованы несколько стратегий для достижения поставленной цели (таблица).
Таблица.
Биотехнологический потенциал десатураз
| Десатураза | Растение | Стратегия модификации | Свойства измененного растения | Источник |
|---|---|---|---|---|
| ω3 | Arabidopsis thaliana | Направленный мутагенез (нокаут) | Снижение ЖК 16:3 и 18:3 увеличило выживаемость при 30°C. | Routaboul et al., 2012 |
| Δ9 | Arabidopsis thaliana | Инсерционный мутагенез (нокаут) | Снижение ЖК 18:1. Морозоустойчивость | Chen, Thelen, 2016 |
| ω3 | Lycopersicon esculentum cv. Zhongshu 4 |
Подавление экспрессии | Увеличение ЖК 18:2, снижение ЖК 18:3. Низкая восприимчивость к 30–40°C | Wang et al., 2010 |
| ω3 | Solanum esculentum cv. Micro-Tom, Block | Посттранскрипционное замолкание генов | Увеличение моногалактозилдиацил глицеринов 36:4 и 34:4. Низкая восприимчивость к 30–40°C | Nakamura et al., 2016 |
| ω3 | Lycopersicon esculentum cv. Zhongshu 4 |
Увеличение экспрессии | Увеличение ЖК 18:3, снижение ЖК 18:2. Солеустойчивость | Wang et al., 2014 |
| ω3 | Lycopersicon esculentum cv. Zhongshu 4 |
Увеличение экспрессии | Увеличение ЖК 18:3, снижение ЖК 18:2. Морозоустойчивость | Yu et al., 2009 |
| Δ9 Sapium sebiferum |
Brassica napus | Гетерологичная экспрессия | Увеличение ЖК 18:2, ЖК 18:3. Морозоустойчивость | Peng et al., 2018 |
| ω3 Chorispora bungeana |
Nicotiana benthamiana | Гетерологичная экспрессия | Увеличение ЖК 18:3. Устойчивость к холоду, засухе, солевому стрессу | Shi et al., 2018 |
| Δ9 Solanum commersonii |
Solanum lycopersicum cv. Zhongshu 8 | Гетерологичная экспрессия | Увеличение ЖК 18:2. Устойчивость к холоду |
Li F. et al., 2015 |
| ω3 Brassica napus |
Solanum esculentum cv. Micro-Tom | Гетерологичная экспрессия | Увеличение ЖК 18:2, ЖК 18:3. Морозоустойчивость | Dominguez et al., 2010 |
| Δ9, Δ12 Synechococcus vulcanus |
Nicotiana tabacum | Гетерологичная экспрессия | Увеличение ЖК 18:3. Снижение ЖК 18:2. Устойчивость к холоду, солевому стрессу, патогенам | Герасименко и др., 2015 |
| Δ12 | Arachis hypogaea L. | Редактирование генома (TALEN) | Увеличение ЖК 18:1. Биофортификация | Wen et al., 2018 |
| Δ12 | Glycine max (L.) Merr. | Редактирование генома (TALEN) | Увеличение ЖК 18:1. Снижение ЖК 18:2, ЖК 18:3. Биофортификация | Demorest et al., 2016 |
| Фитоен десатураза | Musa cv. Rasthali | Редактирование генома (CRISPR/Cas9) | Альбинизм и изменение окраски | Kaur et al., 2018 |
| Δ12 | Brassica napus | Редактирование генома (CRISPR/Cas9) | Увеличение ЖК 18:1. Биофортификация | Okuzaki et al., 2018 |
Самые популярные и, можно сказать, ставшие уже классическими, стратегии – это:
1) мутагенез – обработка семян мутагенами, например этилметансульфонатом, с последующим отбором растений, соответствующих искомым свойствам;
2) инсерционный мутагенез – введение в целевой ген нуклеотидных последовательностей мобильных генетических элементов и Т-ДНК с целью получения линий с измененной экспрессией целевого гена – нокаут, замолкание гена, увеличение экспрессии с помощью специализированных промоторов, дополнительное введение генов, в том числе гетерологичных генов других видов.
Мутагенез применяют, как правило, для получения растений, дефектных по одному или нескольким генам, кодирующим десатуразы (таблица). Так, использование мутагенеза позволило получить мутанты A. thaliana, дефектные сразу по трем генам десатураз – FAD3-2, FAD7-2 и FAD8. У мутантов наблюдалось сниженное содержание ЖК с тремя двойными связями (16:3 и 18:3). При этом уменьшение количества ненасыщенных ЖК улучшило фотосинтетические свойства тилакоидных мембран и увеличило выживаемость растений при температуре свыше 30°C. Однако исследователям не удалось получить стабильной линии с ценным мутантным признаком (Routaboul et al., 2012).
Инсерционный мутагенез постепенно вытесняет традиционные способы получения растений с заданными свойствами – селекцию и мутагенез. Эта стратегия получила широкое применение для создания растений с измененным метаболизмом и невосприимчивых к стрессовым воздействиям (таблица). Так, например, данная стратегия позволила получить мутанты A. thaliana с нокаутным геном ADS1 (ацил-КоА-десатураза хлоропластов Δ9), которые демонстрировали невосприимчивость к пониженным температурам по сравнению с контрольными растениями, кроме того, анализ ЖК-состава показал снижение на 20% содержания ЖК 18:1 по сравнению с контролем (Chen, Thelen, 2016). Другой подход заключается в избирательном подавлении экспрессии целевого гена. Это может быть достигнуто за счет экспрессии антисмысловых последовательностей генов, кодирующих десатуразы. С помощью данного метода получены растения томата с выключенным геном LeFAD3 ω3-десатуразы. Для этих растений характерно изменение в ЖК-профиле (увеличенное количество ЖК 18:2 и сниженное количество ЖК 18:3), что привело к низкой восприимчивости к повышенным температурам (30–40°C) (Wang et al., 2010). За счет посттранскрипционного замолкания гена FAD7 получена другая линия томатов с такими же свойствами (Nakamura et al., 2016).
Использование специализированного промотора с целью увеличения экспрессии генов десатураз позволило получить растения, способные произрастать на засоленных почвах (таблица). Данный подход применен при создании трансгенных томатов с повышенной экспрессией гена LeFAD3 ω3-десатуразы, локализованной в ЭПР. Трансгенные растения обладали лучшими ростовыми характеристиками под воздействием солевого стресса по сравнению с нетрансформированными растениями (Wang et al., 2014). Увеличение экспрессии того же самого гена у томатов улучшает их выживаемость при низких температурах за счет повышения содержания α-линоленовой ЖК. Изменения в составе липидов обеспечило поддержание текучести мембран. Это напрямую повлияло на функционирование фотосинтетического аппарата растений (Yu et al., 2009).
Гетерологичная экспрессия генов десатураз может позволить получить большое количество видов, устойчивых к абиотическим стрессам. К примеру, гетерологичная экспрессия гена SsSAD, кодирующего стеароил-АПБ-десатуразу (Δ9) сального дерева Sapium sebiferum, в растениях рапса Brassica napus L. позволила изменить липидный метаболизм таким образом, что у B. napus увеличивалось содержание ЖК 18:2 и 18:3. Такое увеличение полиненасыщенных ЖК привело к существенному повышению морозоустойчивости растений (Peng et al., 2018). Удалось получить (Shi et al., 2018) растения трансгенного табака Nicotiana benthamian, экспрессирующие ген CbFAD3 микросомальной ω3-десатуразы криофита Chorispora bungeana. Экспрессия гена CbFAD3 в растениях табака конститутивно увеличивала содержание α-линоленовой ЖК как в листьях, так и в корнях. Это обеспечило поддержание текучести мембран и понижало восприимчивость растений к холоду, засухе и солевому стрессу (Shi et al., 2018). Трансгенные растения картофеля с повышенной экспрессией гена ScoSAD ацил-АПБ-десатуразы (Δ9) паслена Solanum commersonii продемонстрировали устойчивость к заморозкам, которая обусловлена высоким содержанием линолевой кислоты в растениях (Li F. et al., 2015). Введение генов двух ω3-десатураз (хлоропластной FAD3 и эндоплазматической FAD7, катализирующих превращение линолевой ЖК в α-линоленовую) рапса в растения томата привело к повышенной устойчивости томатов к низким температурам (Dominguez et al., 2010). Одновременная гетерологичная экспрессия генов двух других десатураз Δ9 и Δ12 S. vulcanus в N. tabacum привела к увеличению доли α-линоленовой кислоты с одновременным уменьшением уровня линолевой кислоты. Данные изменения в ЖК-составе растений могут улучшить устойчивость растений к абиотическим стрессам и патогенам. Кроме того, у трансгенных растений, экспрессирующих гены десатураз, увеличивалась активность СОД, это также может оказать положительное воздействие на устойчивость к солевому стрессу (Герасименко и др., 2015) (таблица).
Новейшим подходом, который может быть применен как для биофортификации (улучшения питательных свойств сельскохозяйственных культур) растений, так и для создания культур, способных произрастать в условиях постоянного воздействия различных стрессовых факторов, является направленное редактирование генома. Сегодня успешно применяются системы редактирования генома c помощью сайт-специфических нуклеаз. Cайт-специфические нуклеазы восстанавливают двухцепочечные разрывы ДНК в местах, где необходима модификация последовательности ДНК. На данный момент разработаны три системы редактирования генома TALEN (transcription activator-like effector nuclease), ZFN (zinc finger nuclease) и CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/CRISPR associated protein 9) (Gaj et al., 2013; Osakabe, Osakabe, 2015). Данные технологии стали мощным инструментом для внедрения полезных генетических изменений в различные сельскохозяйственные культуры (таблица).
В настоящий момент в литературных источниках недостаточно сведений о применении сайт-специфических нуклеаз непосредственно для целей создания сельскохозяйственных культур, устойчивых к стрессовым воздействиям, но имеющиеся материалы говорят о применимости данного похода. Однако есть некоторые достижения в области направленного редактирования генов десатураз в целях биофортификации растений и увеличения сроков хранения продуктов питания, в частности масел, полученных из таких растений (Haun et al., 2014; Demorest et al., 2016; Wen et al., 2018; Abe et al., 2018) (таблица).
Технология TALEN была использована для введения мутаций в ген FAD2 (Δ12-десатураза) сои и арахиса с целью его выключения и улучшения таким образом их питательных свойств и удлинения сроков хранения продуктов питания, произведенных на основе данных растений. Нокаут генов привел к значительному увеличению содержания олеиновой ЖК (18:1), снижению линолевой (18:2) и α-линоленовой (18:3) кислот (Haun et al., 2014; Demorest et al., (2016); Wen et al., 2018). Нокаут гена OsFAD2-1 риса, произведенный по той же технологии, позволил получить генетически стабильные растения с увеличенным в 0.5–2 раза содержанием олеиновой ЖК по сравнению с контрольными растениями (Abe et al., 2018).
Недавно была продемонстрирована принципиальная возможность использования ZFN для модификации генов десатураз растений (Bonawitz et al., 2018). В работе было успешно интегрировано несколько трансгенов в локус гена FAD2-1a культуры клеток ткани и эмбрионов сои. Была выявлена возможность применения технологии ZFN для улучшения питательных свойств сельскохозяйственных культур посредством целенаправленной интеграции трансгенов.
CRISPR/Cas9 – технология экономически более эффективная по сравнению с другими методами редактирования генома, находящая в последнее время все более широкое применение. Исследования по редактированию генома растений были выполнены как для однодольных, так и для двудольных растений: Nicotiana benthamiana (Li J.F. et al., 2015), N. tobaccum (Gao et al., 2014), A. thaliana (Li J.F. et al., 2014), Oryza sativa (Shan et al., 2014), а также сорго (Jiang et al., 2013). Сегодня использование CRISPR/Cas9 для редактирования генов десатураз ограничивается, в основном, модельными экспериментами. Для этих целей удобной мишенью оказался ген фитоен десатуразы PDS. Эта десатураза вводит две трансдвойные связи между одиннадцатым и двенадцатым атомами углерода фитоена (важного соединения в биосинтезе каротиноидов), превращая его в ζ-каротин. При выключении данного гена растения приобретают характерные фенотипические признаки: альбинизм или существенное изменение окраски растений. С помощью CRISPR/Cas9 получены модельные растения банана и маниока с нокаутом по гену фитоен десатуразы (Kaur et al., 2018; Odipio et al., 2018).
CRISPR/Cas9 удобна еще и тем, что может быть использована для растений, у которых ограничены возможности модификации вследствие сложности их размножениея семенами. Десертный банан сорта Кавендиш был модифицирован системой CRISPR/Cas9. В результате выключения гена PDS изменилась не только окраска растений, но и ростовые характеристики, в частности у растений наблюдался карликовый фенотип (Naim et al., 2018).
CRISPR/Cas9 успешно опробована на другом гене десатураз – FAD2. Удалось получить (Okuzaki et al., 2018) стабильную линию B. napus, имеющую модификации в гене FAD2 в виде удаления четырех пар оснований в последовательности гена. Эта модификация привела к значительному изменению содержания олеиновой ЖК.
Создание растений, пригодных для сельскохозяйственных целей, обладающих улучшенными адаптивными и питательными свойствами, с каждым годом приобретает все большую необходимость. Десатуразы жирных кислот в данном случае являются удобной мишенью для генно-инженерных манипуляций.
ЗАКЛЮЧЕНИЕ
Пространственная структура липидного бислоя клеточных мембран в значительной степени зависит от состава и степени десатурации ЖК, входящих в состав липидов. Для поддержания определенного уровня текучести мембран при низких температурах необходимы ненасыщенные ЖК, поскольку температура их фазового перехода значительно ниже физиологических значений. Насыщенные ЖК остаются плотно упакованными и сохраняют более высокую температуру плавления, что жизненно важно для клетки в условиях высоких температур и гипоосмотического шока. За превращение насыщенных ЖК в ненасыщенные отвечают специализированные ферменты – десатуразы.
В ответ на абиотический стресс (изменение температуры или осмолярности) в растительной клетке происходит активация сигнальных путей, приводящая в итоге к увеличению экспрессии генов, кодирующих десатуразы ЖК. Однако увеличение экспрессии генов десатураз наблюдается также под воздействием гормонов, факторов роста и патогенных инфекций. Все это говорит о важнейшей роли десатураз в механизме адаптации растений к изменяющимся условиям окружающей среды в целом.
От способности сельскохозяйственных культур к адаптации зависит их урожайность. Сегодня учеными проводятся работы по созданию новых видов растений с улучшенными питательными свойствами, а также способных произрастать в неблагоприятных условиях окружающей среды. Десатуразы в этом случае выступают удобной мишенью для манипуляций. Использование методов генной инженерии – как классических подходов (направленный и инсерционный мутагенезы), так и инновационных (TALEN, ZFN, CRISPR/Cas9) – позволяет решить задачу сохранения и увеличения урожайности сельскохозяйственных культур.
Список литературы
Герасименко И.М., Сахно Л.А., Кирпа Т.Н. и др. Характеристика растений Nicotiana tabacum, экспрессирующих гибридные гены Δ9- или Δ12-ацил-липидных десатураз цианобактерий и термостабильной лихеназы // Физиол. раст. 2015. Т. 62. № 3. С. 307–316.
Лось Д.А. Структура, регуляция эспрессии и функционирование десатураз жирных кислот // Успехи биол. химии. 2001. Т. 1. С. 163–198.
Лось Д.А. Десатуразы жирных кислот. М.: Научный мир, 2014. С. 18–30.
Юрьева Н.О., Кирсанова С.Н., Кукушкина Л.Н. и др. Экспрессия гена Δ12-ацил-липидной десатуразы Synechocystis sp. PCC 6803 повышает устойчивость растений картофеля к поражению фитофторой // Физиол. раст. 2014. Т. 61. С. 713–720.
Aitzetmüller K., Tsevegsüren N. Seed fatty acids, “front-end”-desaturases and chemotaxonomy – a case study in the Ranunculaceae // J. Plant Physiol. 1994. V. 143. № 4–5. P. 538–543.
Abe K., Araki E., Suzuki Y. et al. Production of high oleic/low linoleic rice by genome editing // Plant Physiol. Biochem. 2018. V. 131. P. 58–62.
Bai Y., McCoy J.G., Levin E.J. et al. X-ray structure of a mammalian stearoyl-CoA desaturase // Nature. 2015. V. 524. № 7564. P. 252–256.
Bonawitz N.D., Ainley W.M., Itaya A. et al. Zinc finger nuclease-mediated targeting of multiple transgenes to an endogenous soybean genomic locus via non-homologous end joining // Plant Biotechnol. J. 2018. V. 17 (4). P. 750–761.
Buist P.H. Chemistry of fatty acid desaturases // Wiley Encyclopedia of Chemical Biology. Hoboken: John Wiley & Sons, Inc. 2008. P. 3204.
Chazarreta-Cifre L., Martiarena L., De Mendoza D., Altabe S.G. Role of ferredoxin and flavodoxins in Bacillus subtilis fatty acid desaturation // J. Bacteriol. 2011. V. 193. № 16. P. 4043–4048.
Chen M., Thelen J.J. Acyl-lipid desaturase 2 is required for chilling and freezing tolerance in Arabidopsis // Plant Cell. 2013. V. 25. № 4. P. 1430–1444.
Chen M., Thelen J.J. Acyl-lipid desaturase 1 primes cold acclimation response in Arabidopsis // Physiol. Plant. 2016. V. 158. № 1. P. 11–22.
Chi X., Zhang Z., Chen N. et al. Isolation and functional analysis of fatty acid desaturase genes from peanut (Arachis hypogaea L.) // PLoS One. 2017. V. 12. № 12. P. e0189759.
Dar A.A., Choudhury A.R., Kancharla P.K., Arumugam N. The FAD2 gene in plants: occurrence, regulation, and role // Front. Plant Sci. 2017. V. 8. P. 1789.
Demorest Z.L., Coffman A., Baltes N.J. et al. Direct stacking of sequence-specific nuclease-induced mutations to produce high oleic and low linolenic soybean oil // BMC Plant Biol. 2016. V. 16. № 1. P. 225.
Diaz A.R., Mansilla M.C., Vila A.J., De Mendoza D. Membrane topology of the acyl-lipid desaturase from Bacillus subtilis // J. Biol. Chem. 2002. V. 277. № 50. P. 48 099–48 106.
Ding Z.T., Shen J.Z., Pan L.L. et al. CsSAD: a fatty acid desaturase gene involved in abiotic resistance in Camellia sinensis (L.) // Genet. Mol. Res. 2016. V. 15. № 1. P. 15 017 512.
Dominguez T., Hernández M.L., C. Pennycooke J.C. et al. Increasing ω-3 desaturase expression in tomato results in altered aroma profile and enhanced resistance to cold stress // Plant Physiol. 2010. V. 153. № 2. P. 655–665.
Dong C.-J., Cao N., Zhang Z.G., Shang Q.M. Characterization of the fatty acid desaturase genes in cucumber: structure, phylogeny, and expression patterns // PLoS One. 2016. V. 11. № 3. P. e0149917.
Feng J., Dong Y., Liu W. et al. Genome-wide identification of membrane-bound fatty acid desaturase genes in Gossypium hirsutum and their expressions during abiotic stress // Sci. Rep. 2017. V. 7. P. 45711.
Gaj T., Gersbach C.A., Barbas C.F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering // Tr. Biotechnol. 2013. V. 31. № 7. P. 397–405.
Gao J., Wang G., Ma S. et al. CRISPR/Cas9-mediated targeted mutagenesis in Nicotiana tabacum // Plant Mol. Biol. 2014. V. 87 (1–2). P. 99–110.
Garba L., Yussoff M.A., Halim K.B. et al. Homology modeling and docking studies of a Δ9-fatty acid desaturase from a cold-tolerant Pseudomonas sp. AMS8 // Peer J. 2018. V. 6. P. e4347.
Gostinčar C., Turk M., Gunde-Cimerman N. The evolution of fatty acid desaturases and cytochrome b5 in eukaryotes // J. Membr. Biol. 2010. V. 233. № 1–3. P. 63–72.
Guillou H., D’Andrea S., Rioux V. et al. Distinct roles of endoplasmic reticulum cytochrome b5 and fused cytochrome b5-like domain for rat Delta6-desaturase activity // J. Lipid Res. 2004. V. 45. № 1. P. 32–40.
Guy J.E., Whittle E., Kumaran D. et al. The crystal structure of the ivy Delta4-16:0-ACP desaturase reveals structural details of the oxidized active site and potential determinants of regioselectivity // J. Biol. Chem. 2007. V. 282. № 27. P. 19863–19871.
Harwood J.L. Plant lipid biosynthesis: fundamentals and agricultural applications // Cambridge: Cambridge Univ. Press, 1998. 112 c.
Haun W., Coffman A., Clasen B.M. et al. Improved soybean oil quality by targeted mutagenesis of the fatty acid desaturase 2 gene family // Plant Biotechnol. J. 2014. V. 12. № 7. P. 934–940.
Heinz E. Biosynthesis of polyunsaturated fatty acids // Lipid metabolism in plants / Ed. T.S. Moore. Boca Raton, L., N.Y.: CRC Press, 2018. P. 55–56.
Hernández M.L., Sicardo M.D., Martínez-Rivas J.M. Differential contribution of endoplasmic reticulum and chloroplast ω-3 fatty acid desaturase genes to the linolenic acid content of olive (Olea europaea) fruit // Plant Cell Physiol. 2016. V. 57. № 1. P. 138–151.
Hitz W.D., Carlson T.J., Booth J.R. et al. Cloning of a higher-plant plastid omega-6 fatty acid desaturase cDNA and its expression in a cyanobacterium // Plant Physiol. 1994. V. 105. № 2. P. 635–641.
Hu L., Mu J., Su P. et al. Multi-functional roles of TaSSI2 involved in Fusarium head blight and powdery mildew resistance and drought tolerance // J. Integr. Agric. 2018. V. 17. № 2. P. 368–380.
Jiang W., Zhou H., Bi H. et al. Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification in Arabidopsis, tobacco, sorghum and rice // Nucl. Acids Res. 2013. V. 41. P. 188.
Jung J.H., Kim H., Go Y.S. et al. Identification of functional BrFAD2-1 gene encoding microsomal delta-12 fatty acid desaturase from Brassica rapa and development of Brassica napus containing high oleic acid contents // Plant Cell Rep. 2011. V. 30. № 10. P. 1881–1892.
Kamthan A., Kamthan M., Azam M. et al. Expression of a fungal sterol desaturase improves tomato drought tolerance, pathogen resistance and nutritional quality // Sci. Rep. 2012. V. 2. № 1. P. 951.
Kaur N., Alok A., Shivani et al. CRISPR/Cas9-mediated efficient editing in phytoene desaturase (PDS) demonstrates precise manipulation in banana cv. Rasthali genome // Funct. Integr. Genomics. 2018. V. 18. № 1. P. 88–89.
Lakhssassi N., Zhou Z., Liu S. et al. Characterization of the FAD2 gene family in soybean reveals the limitations of gel-based TILLING in genes with high copy number // Front. Plant Sci. 2017. V. 8. P. 324.
Li F., Bian C.S., Xu J.X. et al. Cloning and functional characterization of SAD genes in potato // PLoS One. 2015. V. 10. № 3. P. e0122036.
Li J.F., Zhang D., Sheen J. Cas9-based genome editing in arabidopsis and tobacco // Meth. Enzymol. 2014. V. 546. P. 459–472.
Li J.F., Zhang D., Sheen J. Targeted plant genome editing via the CRISPR/Cas9 technology // Meth. Mol. Biol. 2015. V. 1284. P. 239–255.
Li S.F., Song L.Y., Zhang G.J. et al. Newly identified essential amino acid residues affecting Δ8-sphingolipid desaturase activity revealed by site-directed mutagenesis // Biochem. Biophys. Res. Comm. 2011. V. 416. № 1–2. P. 165–171.
Lindqvist Y., Huang W., Schneider G., Shanklin J. Crystal structure of delta9 stearoyl-acyl carrier protein desaturase from castor seed and its relationship to other di-iron proteins // EMBO J. 1996. V. 15. № 16. P. 4081–4092.
Liu Q., Singh S.P., Brubaker C.L. Molecular cloning and expression of a cDNA encoding a microsomal w-6 fatty acid desaturase from cotton (Gossypium hirsutum) // Aust. J. Plant Physiol. 1999. V. 26. № 2. P. 101.
Liu W., Li W., He Q. et al. Characterization of 19 genes encoding membrane-bound fatty acid desaturases and their expression profiles in Gossypium raimondii under low temperature // PLoS One. 2015. V. 10. № 4. P. e0123281.
López Alonso D., García-Maroto F., Rodríguez-Ruizet J. et al. Evolution of the membrane-bound fatty acid desaturases // Biochem. Syst. Ecol. 2003. V. 31. № 10. P. 1111–1124.
Los D.A., Mironov K.S., Allakhverdiev S.I. Regulatory role of membrane fluidity in gene expression and physiological functions // Photosynth. Res. 2013. V. 116. P. 489–509.
Lou Y., Shanklin J. Evidence that the yeast desaturase Ole1p exists as a dimer in vivo // J. Biol. Chem. 2010. V. 285. № 25. P. 19384–19390.
Lou Y., Schwender J., Shanklin J. FAD2 and FAD3 desaturases form heterodimers that facilitate metabolic channeling in vivo // J. Biol. Chem. 2014. V. 289. № 26. P. 17 996–18 007.
Lyons J.M. Chilling injury in plants // Ann. Rev. Plant Physiol. 1973. V. 24. № 1. P. 445–466.
Matsuda O., Sakamoto H., Hashimoto T., Iba K. A temperature-sensitive mechanism that regulates post-translational stability of a plastidial ω-3 fatty acid desaturase (FAD8) in Arabidopsis leaf tissues // J. Biol. Chem. 2005. V. 280. № 5. P. 3597–3604.
McCartney A.W., Dyer J.M., Dhanoa P.K. et al. Membrane-bound fatty acid desaturases are inserted co-translationally into the ER and contain different ER retrieval motifs at their carboxy termini // Plant J. 2004. V. 37. № 2. P. 156–73.
Moche M., Shanklin J., Ghoshal A., Lindqvist Y. Azide and acetate complexes plus two iron-depleted crystal structures of the di-iron enzyme Δ9 stearoyl-acyl carrier protein desaturase — implications for oxygen activation and catalytic intermediates // J. Biol. Chem. 2003. V. 278. P. 25 072–25 080.
Mori N., Moriyama T., Toyoshima M., Sato N. Construction of global acyl lipid metabolic map by comparative genomics and subcellular localization analysis in the red alga Cyanidioschyzon merolae // Front. Plant Sci. 2016. V. 7. P. 958.
Naim F., Dugdale B., Kleidon J. et al. Gene editing the phytoene desaturase alleles of Cavendish banana using CRISPR/Cas9 // Transgenic. Res. 2018. V. 27 (5). P. 451–460.
Nakamura M.T., Nara T.Y. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases // Ann. Rev. Nutr. 2004. V. 24. № 1. P. 345–376.
Nakamura S., Hondo K., Kawara T. et al. Conferring high-temperature tolerance to nontransgenic tomato scions using graft transmission of RNA silencing of the fatty acid desaturase gene // Plant Biotechnol. J. 2016. V. 14. № 2. P. 783–790.
Na-Ranong S., Laoteng K., Kittakoop P. et al. Targeted mutagenesis of a fatty acid Δ6-desaturase from Mucor rouxii: role of amino acid residues adjacent to histidine-rich motif II // Biochem. Biophys. Res. Comm. 2006. V. 339. № 4. P. 1029–1034.
Napier J.A., Michaelson L.V., Sayanova O. The role of cytochrome b5 fusion desaturases in the synthesis of polyunsaturated fatty acids // Prostagland. Leukot. Essent. Fatty Acids. 2003. V. 68. № 2. P. 135–43.
Odipio J., Alicai T., Ingelbrecht I. et al. Efficient CRISPR/Cas9 genome editing of phytoene desaturase in cassava // Front Plant Sci. 2018. V. 8. P. 1780.
Okuley J., Lightner J., Feldmann K. et al. Arabidopsis FAD2 gene encodes the enzyme that is essential for polyunsaturated lipid synthesis // Plant Cell online. 1994. V. 6. № 1. P. 147–158.
Okuzaki A., Ogawa T., Koizuka C. et al. CRISPR/Cas9-mediated genome editing of the fatty acid desaturase 2 gene in Brassica napus // Plant Physiol. Biochem. 2018. V. 131. P. 63–69.
Osakabe Y., Osakabe K. Genome editing with engineered nucleases in plants // Plant Cell Physiol. 2015. V. 56. № 3. P. 389–400.
Pandey M.K., Wang M.L., Qiao L. et al. Identification of QTLs associated with oil content and mapping FAD2 genes and their relative contribution to oil quality in peanut (Arachis hypogaea L.) // BMC Genet. 2014. V. 15. № 1. P. 133.
Peng D., Zhou B., Jiang Y. et al. Enhancing freezing tolerance of Brassica napus L. by overexpression of a stearoyl-acyl carrier protein desaturase gene (SAD) from Sapium sebiferum (L.) Roxb // Plant Sci. 2018. V. 272. P. 32–41.
Reed D.W., Schäfer U.A., Covello P.S. Characterization of the Brassica napus extraplastidial linoleate desaturase by expression in Saccharomyces cerevisiae // Plant Physiol. 2000. V. 122. № 3. P. 715–20.
Routaboul J.M., Skidmore C., Wallis J.G., Browse J. Arabidopsis mutants reveal that short- and long-term thermotolerance have different requirements for trienoic fatty acids // J. Exp. Bot. 2012. V. 63. № 3. P. 1435–1443.
Schlueter J.A., Vasylenko-Sanders I.F., Deshpande S. et al. The FAD2 gene family of soybean: insights into the structural and functional divergence of a paleopolyploid genome // Crop Sci. 2007. V. 47. Supp. 1. P. 14–26.
Schultz D.J., Suh M.C., Ohlrogge J.B. Stearoyl-acyl carrier protein and unusual acyl-acyl carrier protein desaturase activities are differentially influenced by ferredoxin // Plant Physiol. 2000. V. 124. № 2. P. 681–92.
Shan Q., Wang Y., Li J., Gao C. Genome editing in rice and wheat using the CRISPR/Cas system // Nat. Protoc. 2014. V. 9. P. 2395–2410.
Shanklin J., Cahoon E.B. Desaturation and related modifications of fatty acids 1 // Ann. Rev. Plant Physiol. Plant Mol. Biol. 1998. V. 49. № 1. P. 611–641.
Shanklin J., Guy J. E., Mishra G., Lindqvist Y. Desaturases: emerging models for understanding functional diversification of diiron-containing enzymes // J. Biol. Chem. 2009. V. 284. № 28. P. 18 559–18 563.
Shi Y., Yue X., An L. Integrated regulation triggered by a cryophyte ω-3 desaturase gene confers multiple-stress tolerance in tobacco // J. Exp. Bot. 2018. V. 69. № 8. P. 2131–2148.
Song N., Hu Z., Li Y. et al. Overexpression of a wheat stearoyl-ACP desaturase (SACPD) gene TaSSI2 in Arabidopsis ssi2 mutant compromise its resistance to powdery mildew // Gene. 2013. V. 524. № 2. P. 220–227.
Sperling P., Ternes P., Zank T.K. et al. The evolution of desaturases // Prostagland. Leukot. Essent. Fatty Acids. 2003. V. 68. № 2. P. 73–95.
Sui N., Wang Y., Liu S. et al. Transcriptomic and physiological evidence for the relationship between unsaturated fatty acid and salt stress in peanut // Front. Plant Sci. 2018. V. 9. P. 7.
Tang G.Q., Novitzky W.P., Carol Griffin H. et al. Oleate desaturase enzymes of soybean: evidence of regulation through differential stability and phosphorylation // Plant J. 2005. V. 44. № 3. P. 433–446.
Teixeira M.C., Carvalho I.S., Brodelius M. ω-3 fatty acid desaturase genes isolated from purslane (Portulaca oleracea L.): expression in different tissues and response to cold and wound stress // J. Agric. Food Chem. 2010. V. 58. № 3. P. 1870–1877.
Wada H., Schmidt H., Heinz E., Murata N. In vitro ferredoxin-dependent desaturation of fatty acids in cyanobacterial thylakoid membranes // J. Bacteriol. 1993. V. 175. № 2. P. 544–547.
Wang C.T., Xu Y.N. The 5' untranslated region of the FAD3 mRNA is required for its translational enhancement at low temperature in arabidopsis roots // Plant Sci. 2010. V. 179. № 3. P. 234–240
Wang H.S., Yu C., Tang X.F. et al. Antisense-mediated depletion of tomato endoplasmic reticulum omega-3 fatty acid desaturase enhances thermal tolerance // Plant Biotechnol. J. 2010. V. 52. № 6. P. 568–577.
Wang H., Wierzbicki S.A., Aegerter M. et al. A tomato endoplasmic reticulum (ER)-type omega-3 fatty acid desaturase (LeFAD3) functions in early seedling tolerance to salinity stress // Plant Cell Rep. 2014. V. 33. № 1. P. 131–142.
Wang H., Klein M.G., Zou H. et al. Crystal structure of human stearoyl–coenzyme A desaturase in complex with substrate // Nat. Struct. Mol. Biol. 2015. V. 22. № 7. P. 581–585.
Wen S., Liu H., Li X. et al. TALEN-mediated targeted mutagenesis of fatty acid desaturase 2 (FAD2) in peanut (Arachis hypogaea L.) promotes the accumulation of oleic acid // Plant Mol. Biol. 2018. V. 97. № 1–2. P. 177–185.
Xue Y., Chen B., Win A.N. et al. Omega-3 fatty acid desaturase gene family from two ω-3 sources, Salvia hispanica and Perilla frutescens: cloning, characterization and expression // PLoS One. 2018. V. 13. № 1. P. e0191432.
Yadav N.S., Wierzbicki A., Aegerter M. et al. Cloning of higher plant omega-3 fatty acid desaturases // Plant Physiol. 1993. V. 103. № 2. P. 467–476.
Yang Q., Fan C., Guo Z. et al. Identification of FAD2 and FAD3 genes in Brassica napus genome and development of allele-specific markers for high oleic and low linolenic acid contents // Theor. App. Genet. 2012. V. 125. № 4. P. 715–729.
You F.M., Li P., Kumar S. et al. Genome-wide identification and characterization of the gene families controlling fatty acid biosynthesis in flax (Linum usitatissimum L.) // J. Proteom. Bioinform. 2014. V. 7. № 10. P. 310–326.
Yu C., Wang H.S., Yang S. et al. Overexpression of endoplasmic reticulum omega-3 fatty acid desaturase gene improves chilling tolerance in tomato // Plant Physiol. Biochem. 2009. V. 47. № 11–12. P. 1102–1112.
Yuan S., Wu X., Liu Z. et al. Abiotic stresses and phytohormones regulate expression of FAD2 gene in Arabidopsis thaliana // J. Integr. Agric. 2012. V. 11. № 1. P. 62–72.
Yurchenko O.P., Park S., Ilut D.C. et al. Genome-wide analysis of the omega-3 fatty acid desaturase gene family in Gossypium // BMC Plant Biol. 2014. V. 14. № 1. P. 312.
Zäuner S., Jochum W., Bigorowski T., Benning C. A cytochrome b5-containing plastid-located fatty acid desaturase from Chlamydomonas reinhardtii // Eukaryot. Cell. 2012. V. 11. № 7. P. 856–863.
Zhang D., Pirtle I.L., Park S.J. et al. Identification and expression of a new delta-12 fatty acid desaturase (FAD2-4) gene in upland cotton and its functional expression in yeast and Arabidopsis thaliana plants // Plant Physiol. Biochem. 2009. V. 47. № 6. P. 462–471.
Zhang J., Zhu J.Q., Zhu Q. et al. Arabidopsis fatty acid desaturase FAD2 is required for salt tolerance during seed germination and early seedling growth // PLoS One. 2012. V. 7. № 1. P. e30355.
Zhang Y., Maximova S.N., Guiltinan M.J. Characterization of a stearoyl-acyl carrier protein desaturase gene family from chocolate tree, Theobroma cacao L. // Front. Plant Sci. 2015. V. 6. P. 239.
Zhang Z., Wei X., Liu W. et al. Genome-wide identification and expression analysis of the fatty acid desaturase genes in Medicago truncatula // Biochem. Biophys. Res. Commun. 2018. V. 499. № 2. P. 361–367.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии