Успехи современной биологии, 2020, T. 140, № 3, стр. 231-243
FОF1-АТФаза бактерий – наномотор для синтеза и гидролиза АТФ, механизм взаимодействия с макролидным антибиотиком олигомицином А
А. А. Ватлин 1, *, В. Н. Даниленко 1
1 Институт общей генетики им. Н.И. Вавилова РАН
Москва, Россия
* E-mail: vatlin_alexey123@mail.ru
Поступила в редакцию 13.01.2020
После доработки 20.01.2020
Принята к публикации 20.01.2020
Аннотация
FОF1-АТФ-синтаза является основным, высококонсервативным ферментом клеток эукариот или бактерий. Данный фермент у бактерий представляет из себя наномотор, состоящий из 8 видов различных субъединиц. F1-сектор содержит субъединицы α3, β3, γ, δ, ε, FО-сектор – субъединицы a, b2, c(10–15). Согласно современной номенклатуре, ротор FОF1-АТФ-синтазы состоит из γ-, ε-, c-субъединиц, статор молекулы фермента включает субъединицы α3, β3, δ, a, b2. Вращение комплекса ротора относительно субъединиц статора приводит к синтезу или гидролизу АТФ в F1-секторе с транслокацией протонов через a-субъединицу и c-кольцо FО-сектора. Наиболее известным ингибитором АТФ-синтазы является олигомицин А. Механизм действия олигомицина А заключается в селективном подавлении транслокации протонов в FОF1-АТФ-синтазе митохондрий эукариотов и цитоплазматическом комплексе FОF1-АТФ-синтазы актинобактерий, что приводит к нарушению энергетического обмена. Олигомицин А обладает цитотоксическим действием в отношении ряда патогенных бактерий, а также высокой противоопухолевой активностью благодаря инактивации FОF1-АТФ-синтазы – перспективной биомишени для современных лекарственных препаратов. Благодаря высокой консервативности и тому, что синтез АТФ в клетке является одним из центральных процессов, необходимых для жизнедеятельности клетки, данный фермент является перспективной биомишенью для новых антибактериальных препаратов, синтезированных на основе олигомицина А. В данной статье описываются последние данные о функционировании АТФ-синтазы в клетках бактерий и эукариот, а также последние работы по созданию новых антибактериальных препаратов на основе олигомицина А и его производных.
ВВЕДЕНИЕ
Мембраносвязанная FОF1-АТФ-синтаза (ЕС 3.6.3.14) – уникальный ферментный комплекс, обладающий бифункциональным каталитическим механизмом синтеза и гидролиза АТФ. Детальное изучение структуры и функционирования FОF1-АТФ-синтазы остается важной задачей современной биохимии. Нарушение функционирования АТФ-синтазного комплекса происходит при различных заболеваниях (Ahmad et al., 2013). Фермент состоит из двух структурно и функционально различных частей: интегрированного с мембраной ионтранслоцирующего FО-сектора и периферического F1-сектора, содержащего каталитические сайты для синтеза и гидролиза АТФ (Walker, 2013). Несмотря на разное строение FOF1-АТФ-синтаз у различных живых организмов данный фермент является высококонсервативным как у бактерий, так и у человека. В настоящее время функционирование FОF1-АТФ-синтазы рассматривается в контексте единого комплекса с другими ферментами, содержащимися в митохондриях эукариот и в клеточной стенке бактерий. Комплекс FОF1-АТФ-синтазы является перспективной молекулярной мишенью в инфекционной и противоопухолевой терапии. Наиболее известным ингибитором FОF1-АТФ-синтаз является олигомицин А. Олигомицин А, связываясь с С-субъединицей, селективно подавляет транслокацию протонов в FОF1-АТФ-синтазе митохондрий эукариотов и цитоплазматическом комплексе FОF1-АТФ-синтазы бактерий, что приводит к нарушению энергетического обмена (Shchepina et al., 2002; Cole, Alzari, 2005).
Детальное изучение структуры и функционирования FОF1-АТФ-синтазы остается важной задачей современной биохимии.
МАКРОЛИДНЫЕ АНТИБИОТИКИ – ИХ КЛАССИФИКАЦИЯ, МЕХАНИЗМЫ ДЕЙСТВИЯ
Термин “макролид” используется для описания препаратов, химическая структура которых представлена макроциклическим 12- или более членным лактонным кольцом (Mazzei et al., 1993). Этот класс соединений включает в себя множество биологически активных веществ, в том числе антибиотики, противогрибковые препараты, прокинетики и иммунодепрессанты. 14-, 15- и 16-членные макролиды являются широко используемым семейством антибиотиков. Они отлично проникают в ткани и обладают высокой противомикробной активностью, преимущественно в отношении грамположительных кокков и атипичных возбудителей (Bearden, Rodvold, 1999). Эритромицин А – 14-членный макролид, который был выделен более 50 лет назад из культур Streptomyces и был первым макролидным антибиотиком, внедренным в клиническую практику (Mazzei et al., 1993). К классу макролидных антибиотиков относят такие химические вещества как: азитромицин, кларитромицин, телитромицин, эритромицин, карбомицин, олеандомицин, спирамицин, тилозин, рокситромицин, олигомицин А и другие. Механизм действия макролидных антибиотиков основан на ингибировании синтеза белка в клетке. Макролидный антибиотик обратимо связывается с P-сайтом 50S-субъединицы бактериальной рибосомы. Считается, что ингибирование происходит благодаря предотвращению добавления следующей аминокислоты пептидилтрансферазой к растущему пептиду, присоединенному к тРНК (Tenson et al., 2003) (похожим механизмом действия обладает хлорамфеникол (Drainas et al., 1987)), а также ингибированию процесса трансляции. Другой потенциальный механизм заключается в преждевременной диссоциации пептидил-тРНК из рибосомы (Tenson et al., 2003).
Механизмы возникновения устойчивости к макролидным антибиотикам
После первого широкого применения антибактериальных препаратов в 1940-х гг. бактериальные патогены начали приобретать устойчивость к существующим лекарственным средствам, особенно в процессе чрезмерного использования антибиотиков. Сейчас можно выделить три основных механизма бактериальной устойчивости к антибиотикам:
1. Наличие фермента, который инактивирует антибиотик (к примеру, β-лактамаза, которая гидролизует β-лактамное кольцо пенициллинов);
2. Мутация в сайте-мишени рецептора, фермента или субъединицы рибосомы, что приводит к невозможности связывания антибиотика и его мишени;
3. Модификация или сверхэкспрессия транспортных белков, что приводит либо к непопаданию антибиотика внутрь клетки, либо его выбросу из клетки (Tenover, 2006).
Эти механизмы были обнаружены в штаммах, продуцирующих макролидные антибиотики, при этом в клетке часто одновременно работает несколько механизмов для защиты от антимикробного действия антибиотиков, которые они производят. При лечении заболеваний, вызываемых патогенными микроорганизмами, макролидными антибиотиками важно учитывать уровень чувствительности микроорганизмов к этим антибиотикам. В особенности соотношение активности веществ и их токсичности для человека. Лечение одним препаратом, особенно при несоблюдении сроков лечения, может вызвать возникновение лекарственно устойчивых форм у патогенных микроорганизмов, поэтому необходим комплексный подход к лечению заболеваний, вызванных ими. К примеру, модификация рибосомной мишени приводит к возникновению устойчивости к широкому ряду антибиотиков, для которых она является мишенью, а такие антибиотики могут относиться к разным химическим классам, в то время как выброс антибиотика из клетки и его инактивация могут приводить к устойчивости только к одному антибиотику (или к структурно похожим антибиотикам), так как влияет только на саму его молекулу.
Таким образом, существует острая необходимость создания новых стратегий для обнаружения и разработки эффективных антибиотиков, для преодоления широко распространенной и растущей устойчивости к антибиотикам. Одна из возможных стратегий заключается в поиске принципиально новых бактериальных белков, которые могут стать мишенями для новых классов антибиотиков. В особенности представляет интерес разработка антибиотиков, которые действовали бы не на одну биомишень в клетке, а на несколько одновременно.
Макролидные антибиотики класса олигомицинов
Антибиотики класса олигомицинов относятся к макролидам, содержащим 26-членный α, β-ненасыщенный лактон, сопряженный с диенами, конденсированными с бициклической спирокетальной кольцевой системой. Олигомицины А, В и С были изолированы из Streptomyces diastatochromogenes в 1954 г. (Smith et al., 1954). Основные продукты – А- , В- , С-олигомицины – при их синтезе клетками находятся в различных пропорциях в зависимости от штамма, условий культивирования и выделения (Kim et al., 1999).
На данный момент известно множество различных антибиотиков сходной структуры, относящихся к классу олигомицинов (А, B, C, E, F, рутамицин А, В и другие) (рис. 1). Механизм действия олигомицина А заключается в селективном подавлении транслокации протонов в FОF1-АТФ-синтазе митохондрий эукариотов и цитоплазматическом комплексе FОF1-АТФ-синтазы актинобактерий, что приводит к нарушению энергетического обмена. Олигомицин А обладает цитотоксическим действием в отношении ряда патогенных бактерий рода Actinobacterium благодаря инактивации FОF1-АТФ-синтазы – перспективной биомишени для современных лекарственных препаратов (Ahmad et al., 2013). По имеющимся данным олигомицин А имеет несколько неизученных биомишеней в бактериальной клетке, отличных от FOF1-АТФ-синтазы (Wender et al., 2006). Олигомицин А и его аналоги также демонстрируют стабильную противоопухолевую активность (Kobayashi et al., 1987; Yamazaki et al., 1992; Kim et al., 1997). Однако использование олигомицина А для химиотерапии инфекционных заболеваний ограничено его высокой токсичностью.
АТФ-СИНТАЗА – БИОМИШЕНЬ ДЕЙСТВИЯ ОЛИГОМИЦИНА А У ЭУКАРИОТ
АТФ-синтаза является основным комплексом производства клеточной энергии у всех животных, растений, и почти во всех микроорганизмах. Аденозинтрифосфат (АТФ) – универсальный источник энергии, который синтезируется АТФ-синтазой путем окисления или фосфорилирования в мембранах бактерий, митохондрий и хлоропластах. Общую последовательность реакции можно записать следующим образом:
Синтез АТФ требует наличия механического поворота, в котором субъединицы АТФ-синтазы вращаются со скоростью примерно 100 раз в секунду, чтобы синтезировать энергию путем окисления. АТФ-синтаза (ЕС 3.6.3.14) представляет собой общий термин для фермента, который может синтезировать АТФ из АДФ (аденозиндифосфат) и неорганического фосфата (Pi). АТФ-синтаза является одним из самых маленьких биологических наномоторов, найденных в живых организмах. Среднестатистический человек при нормальной жизни к 75 годам ориентировочно может сгенерировать около 2.0 млн кг АТФ из АДФ и Pi, а приблизительное количество используемой человеком АТФ в день может достигать 40 кг. Можно предположить, что каждая молекула АДФ в организме должна фосфорилироваться, а АТФ – дефосфорилироваться в среднем 1000 раз в день (Senior et al., 2002; Ahmad, Laughlin, 2010; Ahmad et al., 2011). Структурная и функциональная активность фермента АТФ-синтазы по существу одинакова у всех прокариот и эукариот (Boyer, 1997; García et al., 2000; Kabaleeswaran et al., 2006, 2009; Dibrova et al., 2010).
Общее число протонов, необходимых для синтеза одной молекулы АТФ у различных организмов, варьируется от трех до четырех, при этом в клетке это количество может изменяться в зависимости от физиологических потребностей (van Walraven et al., 1996; Schemidt et al., 1998; Yoshida et al., 2001).
АТФ-синтаза является одним из наиболее консервативных ферментов. Следовательно, АТФ-синтазы из внутренней мембраны митохондрий и тилакоидной мембраны хлоропластов имеют идентичные структурные и функциональные свойства относительно АТФ-синтазы бактерий, таким образом существует высокое сходство между эукариотической и бактериальной АТФ-синтазой (Kucharczyk et al., 2009).
Классификация различных АТФ-синтаз
Прежде чем обсуждать детальную структуру FОF1-АТФ-синтазы, было бы целесообразно кратко описать другие типы АТФаз. АТФ-синтазы F-типа (названные так в честь “phosphorylation Factor”, а также известные как FОF1-АТФазы и H+-transporting ATPases) являются чрезвычайно консервативными белками среди организмов и являются основными ферментами, осуществляющими синтез АТФ в живых системах. Данный фермент расположен в плазматических мембранах бактерий, в тилакоидных мембранах хлоропластов и во внутренних мембранах митохондрий. У некоторых бактерий также присутствуют Na+-transporting F-АТФ-синтазы.
АТФ-синтазы V-типа (названные в честь “Vacuole”) встречаются в эукариотических эндомембранных системах, например, в вакуолях, в аппарате Гольджи, эндосоме, лизосоме, в плазматической мембране прокариот и некоторых специализированных эукариотических клеток. V-АТФазы способные гидролизовать АТФ для работы протонного насоса, но не способные работать в обратном направлении – для синтеза АТФ (Gogarten et al., 1992; Nelson et al., 2000), встречаются только у архей и имеют функцию, аналогичную F-АТФазам. АТФазы А-типа, возможно, возникли как адаптация к различным потребностям клетки в более экстремальных условиях окружающей среды, с которыми сталкиваются некоторые виды архей.
АТФ-синтазы P-типа (P-АТФазы, также известные как E1-E2-АТФ-синтазы) встречаются у бактерий и в ряде плазматических мембран и органелл эукариот. Функция P-АТФазы заключается в транспорте различных соединений, в том числе ионов и фосфолипидов, через мембрану с использованием в качестве энергии гидролиза АТФ. Есть много различных классов P-АТФаз, каждый из которых вовлечен в транспорт конкретных типов ионов: Н+, Na+, K+, Mg2+, Са2+, Ag+ и Ag2+, Zn2+, Со2+, Pb2+, Ni2+, Cd2+, Cu+ и Cu2+.
АТФ-синтазы Е-типа (названные так в честь “Extracellular”) являются ферментами, связанными с мембранами клеточной поверхности, и обладают широкой субстратной специфичностью. Их функция состоит в гидролизе других нуклеозидтрифосфатов, кроме АТФ, а также внеклеточного АТФ (Wilms et al., 1996; Müller et al., 1999; Toyoshima et al., 2000).
FОF1-АТФ-синтаза эукариотических и прокариотических организмов
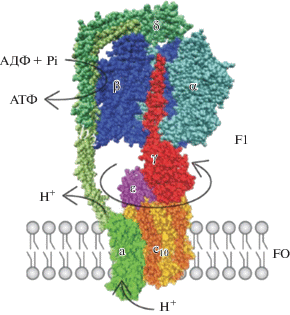
FОF1-АТФ-синтаза имеет продолжительную историю исследований. Частица F1 была впервые выделена группой Эфраима Рекера в 1961 г. Частица FО получила свое название вследствие ее ингибирования олигомицином в мембранной АТФ-синтазе. Наиболее простое строение FОF1-АТФ-синтазы у E. сoli. У прокариот она содержит восемь типов различных субъединиц (у млекопитающих количество субъединиц варьирует от 16 до 18), а именно α3, β3, γ, δ, ε, a, b2, c10. Общая молекулярная масса составляет ~580 кДа (варьирует от 550 до 650 кДа). F1 содержит субъединицы α3, β3, γ, δ, ε, а FО – субъединицы a, b2, c10 в стехиометрии 1 : 2 : 10–14 (рис. 2).
У млекопитающих дополнительные субъединицы расположены в основном в области F1. При этом, по литературным данным, FОF1-АТФ-синтаза дрожжей является самым сложноорганизованным ферментом и состоит из 20 типов различных субъединиц (Kabaleeswaran et al., 2009). У растений АТФ-синтаза находится в хлоропластах (CFОF1-АТФ-синтаза). Фермент встроен в тилакоидную мембрану; CF1-часть встроена в строму и является неотъемлемой структурой при ночных реакциях фотосинтеза (цикл Кальвина) и синтеза АТФ. В хлоропластах структура FОF1-АТФ-синтазы идентична, за исключением того, что есть две изоформы. В митохондриях присутствуют 7–9 дополнительных субъединиц в зависимости от вида, но они обладают слишком малой массой относительно всего фермента и имеют регуляторные функции (Senior, 1988; Karrasch, Walker, 1999; Devenish et al., 2000). Синтез и гидролиз АТФ происходит на трех каталитических сайтах в F1-секторе, в то время как перенос протона происходит через встроенный в мембрану FO-сектор. γ-Субъединица образует спиральную катушку, состоящую из альфа-спиралей, которая находится в центральном пространстве α3β3-шестиугольника. Протонный градиент запускает вращение по часовой стрелке (если смотреть со стороны наружной мембраны) γ-субъединицы, что приводит к синтезу АТФ, а вращение против часовой стрелки γ-субъединицы приводит к гидролизу АТФ. При каждом обороте γ-субъединицы на 360° синтезируются три молекулы АТФ.
Механизм синтеза и гидролиза АТФ
Когда молекула АТФ связывается с одним каталитическим участком, взаимодействие является высокостабильным, но тогда АТФ-гидролиз происходит очень медленно. Появление избытка АТФ приводит к связыванию во всех трех каталитических центрах, но с гораздо более низкой аффинностью субстрата на втором и третьем каталитических центрах. Kd для связывания АТФ на первом каталитическом центре составляет <1 нМ, тогда как на втором и третьем каталитическом центре составляет ~1 и 30 мкМ соответственно. При связывании третьего каталитического центра с АТФ интенсивность гидролиза АТФ увеличивается в 104–105 раз (Weber, Senior, 2000). Таким образом, F1-сектор состоит из трех α- и трех β-субъединиц (последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°), которые показывают строгую отрицательную кооперативность связывания субстрата и, в то же время, строгую положительную кооперативность ферментативной активности. В литературе это называется гипотезой изменения участка связывания (Boyer, 1993). Ключевой особенностью этой гипотезы является то, что три каталитических сайта (три пары αβ-субъединиц, которые содержат эти сайты) находятся каждый в разной конформации в любой момент времени. Один из них открыт и готов к связыванию АТФ (или АДФ + Pi), в то время как второй и третий являются частично открытыми и закрытыми соответственно. Связывание АТФ, в результате чего сайт становится закрытым, создает конформационные изменения, при которых остальные два сайта изменяются таким образом, что закрытый сайт становится частично открытым, а частично открытый становится полностью открытым. Таким образом, каждый сайт переключается между тремя состояниями как при гидролизе АТФ, так и при синтезе АТФ, но в другом направлении (рис. 3).
Рис. 3.
Гипотеза изменения участка связывания и вращение каталитического сайта связывания γ-субъединицей (по Capaldi et al., 2002, с изменениями).

Каждый каталитический сайт проходит во время цикла через три состояния: T, L и O. АТФ связывается с O-сайтом (открытый и пустой), чтобы превратить его в T-сайт (связанный с АТФ). После разрыва связи, сайт Т превращается в L-сайт (связанный с АДФ + Pi), в то время как АДФ + Pi разрывается с О-сайтом. В любое время, каждый из трех каталитических сайтов находится в состоянии O, T и L соответственно. Переключение этих состояний в каждом из участков приводит к гидролизу (или синтезу) одной молекулы АТФ и вращению γ-ротора на 120°. Этапы гидролиза или синтеза одной молекулы АТФ на трех сайтах связывания представлены на рисунке 3 (Capaldi et al., 2002). По имеющимся литературным данным, ротор состоит из γ-, ε-, c-субъединиц, а статор состоит из α3-, β3-, δ-, a-, b2-субъединиц (Diez et al., 2004; Itoh et al., 2004; Weber, 2006). Функция статора заключается в предотвращении совместного вращения каталитических центров и ротора.
В общей сложности на F1-секторе АТФ-синтазы существует шесть нуклеотидных участков связывания. Три каталитических участка в основном представлены в β-субъединице, а три некаталитических участка связывания – в λ-субъединице. Три каталитических участка связывания обозначаются как βTP, PDP и βE, и они были обнаружены методом рентгеновской кристаллографии на основе связывания АТФ, АДФ и Pi соответственно (Leslie, Walker, 2000; Menz et al., 2001). Pi первоначально связывается с βE (пустой сайт) для синтеза АТФ. Реакция синтеза происходит в трех каталитических центрах взаимозависимо и последовательно. Каждый каталитический сайт претерпевает конформационные изменения, что приводит к возникновению следующей реакции: субстрат (АДФ + + Pi)-связывание → синтез АТФ → выделение АТФ. В секторе FО происходит механическое вращение вала ротора, которое приводит к конформационным изменениям каталитических доменов в F1 для синтеза АТФ. Обратная реакция гидролиза АТФ вызывает обратные конформационные изменения сектора FО и, следовательно, меняет направление вращения вала ротора. Эти конформационные изменения в каталитических центрах связаны с вращением γ-субъединицы. Более глубокое понимание структуры и функции комплекса FОF1 могло бы осветить возможные пути развития АТФ-синтазы в качестве мишени молекулярного лекарственного средства и его применения в области нанотехнологий и наномедицины (Whitesides, 2003; Khataee H., Khataee A., 2009).
Следовательно, понимание структуры и каталитической функции АТФ-синтазы, в частности, каким образом связывание Pi приводит к образованию АТФ, имеет первостепенное значение для понимания процессов ингибирования работы фермента при связывании его с лекарственными средствами (Bullough et al., 1989; Gledhill, Walker, 2005; Hong, Pedersen, 2008).
Механизм связывания олигомицина А и C-субъединицы FОF1-АТФ-синтазы
Из-за широкого использования ингибиторов, подобных олигомицину, и существующего потенциала для обнаружения новых лекарственных средств на основе данного механизма (ингибирование С-субъединицы FОF1-АТФ-синтазы) изучение олигомицин-связывающего сайта представляет большой интерес.
С-субъединица АТФ-синтазы является интегрированным в мембрану белком, состоящим из двух спиралей, 1 и 2, которые проникают во внутреннюю митохондриальную мембрану. С-субъединица представляет из себя кольцо, состоящее из различного количества субъединиц в зависимости от вида. К примеру, у АТФ-синтазы дрожжей этот комплекс состоит из 10 субъединиц, а у АТФ-синтазы коров – из 8 субъединиц (Stock et al., 1999; Watt et al., 2010).
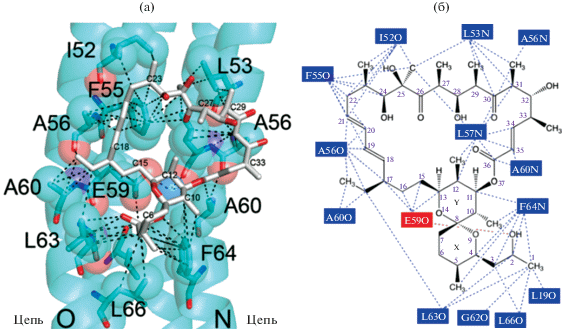
C-субъединица является существенным компонентом протонной турбины АТФ-синтазы, который преобразовывает электрохимическую энергию в механическое вращение, и наоборот. Неотъемлемой частью С-субъединицы является глутаминовая кислота (Glu59) в спирали 2, функция которой заключается в непосредственном движении протонов из цитозоля в митохондриальный матрикс во время синтеза АТФ. Боковая цепь карбоксильной группы Glu59 находится почти в середине спирали 2, располагаясь в липидном двойном слое. Она участвует в протонировании, обладая закрытой конформацией. Субъединица А формирует два протонных полуканала, с помощью которых протон переносится и связывается с карбоксильной группой Glu59 в открытой конформации, что делает возможным процесс протонирования и депротонирования (Pogoryelov et al., 2010; Fillingame, Steed, 2014). Олигомицин А связывается с двумя соседними субъединицами C-кольца, которое расположено на протонном канале, и блокирует основные карбоксильные группы, что приводит к ингибированию транслокации протонов. Молекула олигомицина А связывается с аминокислотным остатком Glu59 и препятствует связыванию боковой цепи карбоксильной группы с молекулой воды. Боковая цепь карбоксильной группы аминокислоты Glu59 образует водородную связь с молекулой воды, которая в свою очередь образует водородную связь с кислородом карбонильной группы Leu57 и кислородом карбонильной группы олигомицина О36. Таким образом, Glu59 образует водородную связь с олигомицином через связь с молекулой воды. Остальные взаимодействия между олигомицином и С-субъединицей происходят прежде всего за счет сил ван-дер-Ваальса (рис. 4). Межатомные расстояния между атомами С-субъединицы и олигомицином составляют 3.7–4.9 Å. Аминокислотный остаток Phe64 образует ряд соединений с шестью атомами углерода олигомицина, в том числе С2 и С3, которые имеют двойную связь с олигомицином А (Palmer, Potter, 2008), и, таким образом, также взаимодействовуют с помощью π–π-связей. Каждый из двух аминокислотных остатков Ala56 и Ala60 взаимодействует с противоположными концами молекулы олигомицина путем формирования связей между олигомицином и C-кольцом (цепи N и О). Остальные аминокислотные остатки взаимодействуют с олигомицином, образуя связь только с одной из С-субъединиц.
Рис. 4.
Взаимодействие атомов С-субъединицы с олигомицином А. (а) – атомы показаны в виде сфер, остатки показаны в виде палочек и находятся в пределах 5 Å от атомов в молекуле олигомицина. Пунктирные линии обозначают атомные расстояния в диапазоне 2.5–2.8 Å для трех водородных связей и 3.7–4.8 Å для предположительных сил ван-дер-Ваальса; (б) – взаимодействия между олигомицином А и С-кольцом. Остатки, для которых атом находится в пределах 4.8 Å, показаны пунктирными линиями (возможное взаимодействие) (по Symersky et al., 2012, с изменениями).
При рассмотрении механизма связывания недавно изученного препарата R207910 (TMC207), который ингибирует действие АТФ-синтазы и является высокоэффективным средством против микобактерий туберкулеза, было выявлено, что у штаммов, устойчивых к данному препарату, присутствуют три независимые мутации в гене, кодирующем С-субъединицу (Asp26Val, Ala61Pro, Ile64Met) (Andries et al., 2005; Koul et al., 2008).
В модели С-субъединицы дрожжей аминокислотный остаток Asp26 расположен в спирали 1 рядом с Gly25, который при возникновении мутации придает устойчивость к олигомицину и перекрестную устойчивость к связанным с ним лекарственным средствам (Nagley et al., 1986; Galanis et al., 1989). У дрожжей Ala61 находится рядом с Ala60. Ala60 взаимодействует с олигомицином в обеих молекулах С-субъединицы, которые образуют сайт связывания.
Мутация Ala(61)Pro вызывает излом в альфа-спирали и разрушает сайт связывания лекарственных средств. Аминокислотный остаток Ile64 соответствует Phe64 в дрожжах, который формирует критические связи с олигомицином. Хотя структура R207910 весьма отличается от олигомицина, это химическое соединение обладает некоторыми похожими химическими свойствами, что подтверждает схожесть сайта связывания олигомицина А и С-субъединицы митохондрий и бактерий. Кроме того, данный сайт связывания олигомицина А в C-субъединице может использоваться также другими ингибиторами бактериального С-кольца и, вероятно, для аналогичных ингибиторов, которые связываются с VО (аналог FО) АТФазы вакуолярного типа (Dröse, Altendorf, 1997), что потенциально может обеспечить получение еще одного целевого препарата.
Таким образом, изучение биомишеней олигомицина А и его производных является одним из важных направлений для создания на их базе новых лекарственных средств.
АНТИБИОТИК ОЛИГОМИЦИН А И ЕГО ПРОИЗВОДНЫЕ, МЕХАНИЗМЫ ИХ ДЕЙСТВИЯ У АКТИНОБАКТЕРИЙ
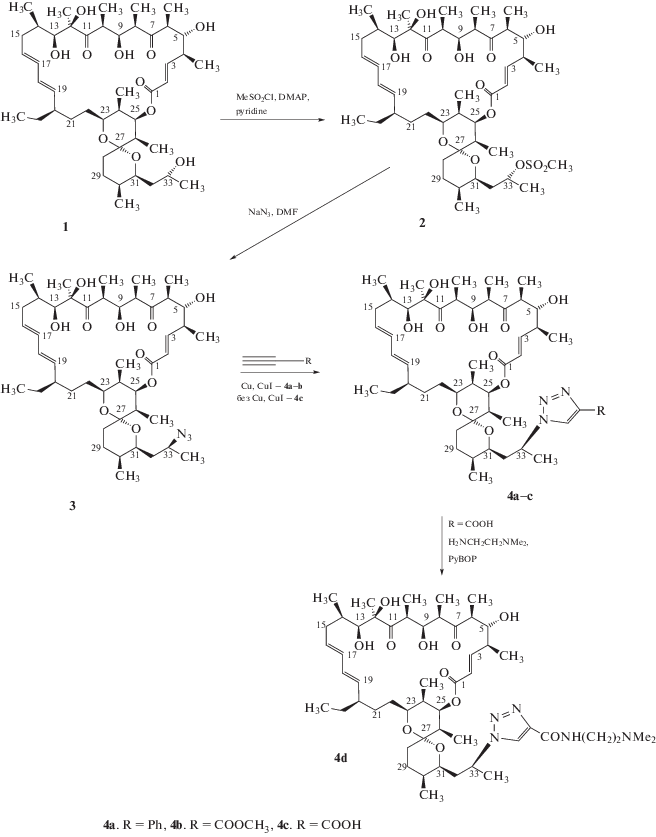
Олигомициноподобные антибиотики, относящиеся к группе макролидов, производят многие актинобактерии, в том числе Streptomyces sp. WK-6150 (Enomoto et al., 2001), S. virginiae 17 (Danilenko et al., 2012), Streptomyces sp. MCI-2225 (Kobayashi et al., 1987), S. libani (Kim et al., 1999), S. diastatochromogenes, S. diastaticus (Yang et al., 2010), Actinoalloteichus sp. NPS702 (Sato et al., 2012) и другие. Эти штаммы являются устойчивыми к действию олигомициноподобных антибиотиков, так как являются продуцентами антибиотиков этого класса. На данный момент механизмы чувствительности у различных чувствительных к олигомициноподобным антибиотикам штаммов остаются неизученными. К такому штамму можно отнести S. fradiae (xinghaiensis) ATCC 19609, который является сверхчувствительным к действию антибиотика олигомицина А (<0.001 нмоль/мл или 0.0005 нмоль/диск) (Alekseeva et al., 2009). Имеющиеся данные свидетельствуют о существовании в клетках нескольких мишеней действия олигомицина А (Wender et al., 2006). Можно предположить, что механизмы чувствительности штаммов актинобактерий к олигомицину А обусловлены несколькими биомишенями в клетке, способностью к проникновению антибиотика внутрь клетки, отсутствием механизма выброса антибиотика из клетки, отсутствием систем репарации клетки и другими. Для определения механизмов чувствительности, а также обнаружения дополнительных биомишеней и установления детального механизма взаимодействия с ними олигомицина А, в том числе с FОF1-АТФ-синтазой, в НИИНА им. Г.Ф. Гаузе были синтезированы новые полусинтетические производные олигомицина А, селективно модифицированные по фрагментам молекулы антибиотика (33 положение боковой цепи), которая участвует в связывании с С-субъединицей FОF1-АТФ-синтазы (рис. 5).
Рис. 5.
Схема синтеза 33-O-мезил олигомицин А (2), (33S)-азидо-33-дезоксиолигомицин (3) и 33-деокси-33-(1,2,3-триазол-1-ил) олигомицин A (4a–d) из олигомицина А (1) (по Lysenkova et al., 2013, с изменениями).
Синтез нитрон-олигомицина осуществляли действием на олигомицин А гидрохлорида гидроксиламина в пиридине в присутствии ацетата натрия (Lysenkova et al., 2009), (33S)-азидо-33-дезоксиолигомицин был синтезирован действием на 33-О-мезилолигомицина А азида натрия в диметилформамиде при 60–65°С, 33-О-мезил-олигомицин А синтезирован действием метансульфохлорида на олигомицин А в пиридине (Lysenkova et al., 2013), а также разработан новый способ химической модификации антибиотика олигомицина А в боковой цепи (рис. 6). Взаимодействием 33-О-мезилолигомицина с тиоцианатом калия синтезирован (33S)-33-дезокси-33-тиоцианатоолигомицин (рис. 6). (33S)-33-дезокси-33-тиоцианатоолигомицин показал несколько меньшую активность в отношении S. fradiae, чем исходный олигомицин А (Lysenkova et al., 2015).
Рис. 6.
Олигомицин А (1). 33-О-мезилат олигомицин А (2). Синтез (33S)-33-дезокси-33-тиоцианатоолигомицина (3).

Для проверки активности новосинтезированных производных олигомицина А была использована тест-система на основе бактерий S. fradiae (xinghaiensis) ATCC 19609, являющихся сверхчувствительными к олигомицину А. Было выявлено, что все полученные производные обладали сниженной активностью в отношении S. fradiae ATCC 19609, и при этом некоторые из них – меньшей токсичностью относительно олигомицина А.
Для дальнейшей разработки нового поколения химиотерапевтических средств необходимо выявление всех потенциальных внутриклеточных мишеней, а также исследование механизмов резистентности бактериальных клеток к действию олигомицина А и его производных.
Чувствительность и устойчивость к олигомицину А бактерий, включая актинобактерии
Большинство бактерий чувствительно к разным антибиотикам различных химических классов (Jorgensen et al., 2009). При определении чувствительности или устойчивости штамма к какому-либо антибиотику in vitro используют параметр минимальной ингибирующей концентрации (МИК): если МИК = 1–10 мкг/мл, то штамм считается чувствительным, и успешное терапевтическое лечение человека возможно; если МИК > > 100 мкг/мл, то штамм считается природно-устойчивым, и успешное терапевтическое лечение человека невозможно (Rodloff et al., 2008). Эукариотические штаммы, включая Saccharomyces cerevisiae, обладают чувствительностью к олигомицину А на уровне 25 мкг/мл (Park et al., 2011), в то время как грамотрицательные бактерии являются природно-устойчивыми к олигомицину А и его производным (Kim et al., 1997). Среди грамположительных есть чувствительные к олигомицину А и его производным, относящиеся к классу актинобактерий. Бактерии рода Streptomyces обладают разным уровнем чувствительности к олигомицину А. Для штамма S. albus ATCC 21132 МИК олигомицина А = 0.01 нм/диск (Lysenkova et al., 2015). Уровень чувствительности S. lividans 66, МИК которого = 1 нм/диск, несколько ниже (Alekseeva et al., 2009). Штамм S. fradiae (xinghaiensis) ATCC 19609 является сверхчувствительным к олигомицину А – МИК < 0.001 нмоль/мл (Lysenkova et al., 2015).
ЗАКЛЮЧЕНИЕ
S. fradiae (xinghaiensis) ATCC 19609 является сверхчувствительным к олигомицину А и выступает в качестве модельного объекта при изучении FОF1-АТФ-синтазы. FОF1-АТФ-синтаза является уникальной, универсальной машиной про- и эукариотических организмов, обеспечивающей их энергией благодаря синтезу АТФ в аэробных условиях и созданию трансмембранного протонного градиента в анаэробных условиях. FОF1-АТФ-синтаза является достаточно изученной наномашиной, чтобы приступить к созданию на ее основе природоподобной биотехнологической конструкции для осуществления транспорта протонов с целью приобретения нового источника энергии. Олигомицин А и его производные являются одной из классических химических молекул, которые в течение многих десятилетий используются для изучения функционирования FОF1-АТФ-синтазы. Ранее нам удалось обнаружить штамм S. fradiae (xinghaiensis) ATCC 19 609, чувствительный к антибиотику олигомицину А в наноколичествах (0.001 мкм/мл). Помимо этого, было показано, что функционирование FОF1-АТФ-синтазы может зависеть от фосфорилирования серинтреониновыми протеинкиназами. Синтезированы десятки новых полусинтетических производных олигомицина А с различным уровнем воздействия на FОF1-АТФ-синтазу. Выявлено, что помимо FОF1-АТФ-синтазы олигомицин А может воздействовать на системы репарации и репликации ДНК (Bekker et al., 2019). В совокупности полученные результаты позволяют на новом уровне приступить к изучению FОF1-АТФ-синтазы как наномашины для синтеза и гидролиза АТФ, чтобы использовать ее в дальнейшем в качестве биомишени для создания новых препаратов. Более углубленное изучение механизмов сверхчувствительности к олигомицину А и его производным S. fradiae (xinghaiensis) ATCC 19609 позволит использовать обнаруженные механизмы для выявления новых биомишеней в клетках бактерий при создании новых антибактериальных препаратов.
На важность АТФ-синтазы в качестве перспективной биомишени при разработке лекарственных средств также указывает тот факт, что многие антибиотики, такие как ефрапептин, ауровертин и олигомицин, ингибируют именно АТФ-синтазу. Ефрапептин и ауровертин ингибируют синтез и гидролиз АТФ (van Raaij et al., 1996). Олигомицин является мощным ингибитором АТФ-синтазы благодаря связыванию с комплексом FО, что приводит к блокировке протонной проводимости. По литературным данным было показано, что олигомицин индуцирует апоптотический ответ в культивированных лимфобластоидных клетках человека и других клетках млекопитающих в течение 12–18 ч, но при этом митохондриальные ингибиторы не вызывают апоптоз в клетках, в которых отсутствует митохондриальная дыхательная цепь (Wolvetang et al., 1994). Другое подобное исследование показало, что олигомицин взаимодействует с отдельными компонентами митохондрий, что в свою очередь может привести к апоптозу отдельных клеток из-за увеличения экспрессии СD14 (Mills et al., 1999). Таким образом, вполне возможно, что взаимодействия между АТФ-синтазой и другими ингибиторами могут играть значительную роль в механизмах апоптоза в митохондриях.
Список литературы
Ahmad Z., Laughlin T.F. Medicinal chemistry of ATP synthase: a potential drug target of dietary polyphenols and amphibian antimicrobial peptides // Curr. Med. Chem. 2010. V. 17. № 25. P. 2822–2836.
Ahmad Z., Okafor F., Laughlin T.F. Role of charged residues in the catalytic sites of Escherichia coli ATP synthase // J. Amino Acids. 2011. V. 2011. Art. 785741.
Ahmad Z., Okafor F., Azim S. et al. ATP synthase: a molecular therapeutic drug target for antimicrobial and antitumor peptides // Curr. Med. Chem. 2013. V. 20. № 15. P. 1956–1973.
Alekseeva M.G., Elizarov S.M., Bekker O.B. et al. F0F1 ATP synthase of Streptomyces: modulation of activity and oligomycin resistance by protein Ser/Thr kinases // Biochem. Suppl. Ser. A Membr. Cell Biol. 2009. V. 3. № 1. P. 16–23.
Andries K., Verhasselt P., Guillemont J. et al. A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis // Science. 2005. V. 307. № 5707. P. 223–227.
Bearden D.T., Rodvold K.A. Penetration of macrolides into pulmonary sites of infection // Infect. Med. 1999. V. 16. № 7. P. 480–484A.
Bekker O.B., Vatlin A.A., Zakharevich N.V. et al. Draft genome sequence of Streptomyces xinghaiensis (fradiae) OlgR, a strain resistant to oligomycin A // Microbiol. Res. Ann. 2019. V. 8. № 2. P. e01531-18.
Boyer P.D. The binding change mechanism for ATP synthase – some probabilities and possibilities // Biochim. Biophys. Acta. 1993. V. 1140. № 3. P. 215–250.
Boyer P.D. The ATP synthase – a splendid molecular machine // Ann. Rev. Biochem. 1997. V. 66. P. 717–749.
Bullough D.A., Ceccarelli E.A., Roise D., Allison W.S. Inhibition of the bovine-heart mitochondrial F1-ATPase by cationic dyes and amphipathic peptides // Biochim. Biophys. Acta. 1989. V. 975. № 3. P. 377–383.
Capaldi R.A., Aggeler R., Moser T.L. et al. Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor // Tr. Biochem. Sci. 2002. V. 27. № 3. P. 154–160.
Cole S.T., Alzari P.M. Microbiology. TB – a new target, a new drug // Science. 2005. V. 307. № 5707. P. 214–215.
Danilenko A.N., Bibikova M.V., Spiridonova I.A. et al. [Physico-chemical properties and structure of oligomycin SC-II, produced by Streptomyces virginiae 17] // Antibiot. i khimioterapiia = Antibiot. chemoterapy (sic). 2012. V. 57. № 11–12. P. 3–7.
Devenish R.J., Prescott M., Roucou X. et al. Insights into ATP synthase assembly and function through the molecular genetic manipulation of subunits of the yeast mitochondrial enzyme complex // Biochim. Biophys. Acta. 2000. V. 1458. № 2–3. P. 428–442.
Dibrova D.V., Galperin M.Y., Mulkidjanian A.Y. Characterization of the N-ATPase, a distinct, laterally transferred Na+-translocating form of the bacterial F-type membrane ATPase // Bioinformatics. 2010. V. 26. № 12. P. 1473–1476.
Diez M., Zimmermann B., Börsch M. et al. Proton-powered subunit rotation in single membrane-bound F0F1-ATP synthase // Nat. Struct. Mol. Biol. 2004. V. 11. № 2. P. 135–141.
Drainas D., Kalpaxis D.L., Coutsogeorgopoulos C. Inhibition of ribosomal peptidyltransferase by chloramphenicol. Kinetic studies // Eur. J. Biochem. 1987. V. 164. № 1. P. 53–58.
Dröse S., Altendorf K. Bafilomycins and concanamycins as inhibitors of V-ATPases and P-ATPases // J. Exp. Biol. 1997. V. 200. № Pt 1. P. 1–8.
Enomoto Y., Shiomi K., Matsumoto A. et al. Isolation of a new antibiotic oligomycin G produced by Streptomyces sp. WK-6150 // J. Antibiot. (Tokyo). 2001. V. 54. № 3. P. 308–313.
Fillingame R.H., Steed P.R. Half channels mediating H+ transport and the mechanism of gating in the Fo sector of Escherichia coli F1Fo ATP synthase // Biochim. Biophys. Actа. 2014. V. 1837. № 7. P. 1063–1068.
Galanis M., Mattoon J.R., Nagley P. Amino acid substitutions in mitochondrial ATP synthase subunit 9 of Saccharomyces cerevisiae leading to venturicidin or ossamycin resistance // FEBS Lett. 1989. V. 249. № 2. P. 333–336.
Gao Y.Q., Yang W., Karplus M. A structure-based model for the synthesis and hydrolysis of ATP by F1-ATPase // Cell. 2005. V. 123. № 2. P. 195–205.
García J.J., Ogilvie I., Robinson B.H. et al. Structure, functioning, and assembly of the ATP synthase in cells from patients with the T8993G mitochondrial DNA mutation. Comparison with the enzyme in Rho(0) cells completely lacking mtDNA // J. Biol. Chem. 2000. V. 275. № 15. P. 11075–11081.
Giguère S., Prescott J.F., Baggot J.D. et al. Antimicrobial therapy in veterinary medicine. Ames, Iowa; Oxford: Blackwell Publ., 2006. 626 p.
Gledhill J.R., Walker J.E. Inhibition sites in F1-ATPase from bovine heart mitochondria // Biochem. J. 2005. V. 386. Pt 3. P. 591–598.
Gogarten J.P., Starke T., Kibak H. et al. Evolution and isoforms of V-ATPase subunits // J. Exp. Biol. 1992. V. 172. P. 137–147.
Hong S., Pedersen P.L. ATP synthase and the actions of inhibitors utilized to study its roles in human health, disease, and other scientific areas // Microbiol. Mol. Biol. Rev. 2008. V. 72. № 4. P. 590–641.
Itoh H., Takahashi A., Adachi K. et al. Mechanically driven ATP synthesis by F1-ATPase // Nature. 2004. V. 427. № 6973. P. 465–468.
Jorgensen J.H., Ferraro M.J. Antimicrobial susceptibility testing: a review of general principles and contemporary practices // Clin. Infect. Dis. 2009. V. 49. № 11. P. 1749–1755.
Kabaleeswaran V., Puri N., Walker J.E. et al. Novel features of the rotary catalytic mechanism revealed in the structure of yeast F1 ATPase // EMBO J. 2006. V. 25. № 22. P. 5433–5442.
Kabaleeswaran V., Shen H, Symersky J. et al. Asymmetric structure of the yeast F1 ATPase in the absence of bound nucleotides // J. Biol. Chem. 2009. V. 284. № 16. P. 10546–10551.
Karrasch S., Walker J.E. Novel features in the structure of bovine ATP synthase // J. Mol. Biol. 1999. V. 290. № 2. P. 379–384.
Khataee H.R., Khataee A.R. Advances in F0F1-ATP synthase biological protein nanomotor: from mechanisms and strategies to potential applications // Nano. 2009. V. 4. № 2. P. 55–67.
Kim B.S., Moon S.S., Hwang B.K. Isolation, identification, and antifungal activity of a macrolide antibiotic, oligomycin A, produced by Streptomyces libani // Can. J. Bot. 1999. V . 77. P. 850–858.
Kim H.S., Band H.J., Lee S.Y. et al. 44-homooligomycin E, a new cytotoxic macrolide antibiotic from Streptomyces ostreogriseus // Biosci. Biotechnol. Biochem. 1997. V. 61. № 2. P. 378–380.
Kobayashi K., Nishino C., Ohya J. et al. Oligomycin E, a new antitumor antibiotic produced by Streptomyces sp. MCI-2225 // J. Antibiot. (Tokyo). 1987. V. 40. № 7. P. 1053–1057.
Koul A., Vranckx L., Dendouga N. et al. Diarylquinolines are bactericidal for dormant mycobacteria as a result of disturbed ATP homeostasis // J. Biol. Chem. 2008. V. 283. № 37. P. 25273–25280.
Kucharczyk R., Zick M., Bietenhader M. et al. Mitochondrial ATP synthase disorders: molecular mechanisms and the quest for curative therapeutic approaches // Biochim. Biophys. Acta. 2009. V. 1793. № 1. P. 186–199.
Leslie A.G., Walker J.E. Structural model of F1-ATPase and the implications for rotary catalysis // Philos. Trans. R. Soc. Lond. B Biol. Sci. 2000. V. 355. № 1396. P. 465–471.
Lysenkova L.N., Turchin K.F., Danilenko V.N. et al. The first examples of chemical modification of oligomycin A // J. Antibiot. (Tokyo). 2009. V. 63. P. 17–22.
Lysenkova L.N., Turchin K.F., Korolev A.M. et al. Synthesis and cytotoxicity of oligomycin A derivatives modified in the side chain // Bioorganic Med. Chem. 2013. V. 21. P. 2918–2924.
Lysenkova L.N., Godovikov I.A., Korolev A.M. et al. Synthesis and anti-actinomycotic activity of the oligomycin A thiocyanato derivative modified at 2-oxypropyl side chain // Macroheterocycles. 2015. V. 8. № 4. P. 424–428.
Mazzei T., Mini E., Novelli A.P.P., Periti P. Chemistry and mode of action of macrolides // J. Antimicrob. Chemother. 1993. V. 31. Suppl. С. P. 1–9.
Menz R.I., Walker J.E., Leslie A.G. Structure of bovine mitochondrial F(1)-ATPase with nucleotide bound to all three catalytic sites: implications for the mechanism of rotary catalysis // Cell. 2001. V. 106. № 3. P. 331–341.
Mills K.I., Woodgate L J., Gilkes A F. et al. Inhibition of mitochondrial function in HL60 cells is associated with an increased apoptosis and expression of CD14 // Biochem. Biophys. Res. Commun. 1999. V. 263. № 2. P. 294–300.
Müller V., Ruppert C., Lemker T. Structure and function of the A1A0-ATPases from methanogenic archaea // J. Bioenerg. Biomembr. 1999. V. 31. № 1. P. 15–27.
Nagley P., Hall R.M., Ooi B.G. Amino acid substitutions in mitochondrial ATPase subunit 9 of Saccharomyces cerevisiae leading to oligomycin or venturicidin resistance // FEBS Lett. 1986. V. 195. № 1–2. P. 159–163.
Nakata M., Ishiyama T., Akamatsu S. et al. Synthetic studies on oligomycins. Synthesis of the oligomycin B spiroketal and polypropionate portions // Bull. Chem. Soc. Jpn. 1995. V. 68. № 3. P. 967–989.
Nelson N., Perzov N., Cohen A. et al. The cellular biology of proton-motive force generation by V-ATPases // J. Exp. Biol. 2000. V. 203. Pt 1. P. 89–95.
Palmer R.A., Potter B.S. X-ray structures and absolute configurations of the antibiotics oligomycins A, B and C: inhibitors of ATP synthase // J. Chem. Crystallogr. 2008. V. 38. № 4. P. 243–253.
Park J.W., Park S.R., Han A.R. et al. Generation of reduced macrolide analogs by regio-specific biotransformation // J. Antibiot. (Tokyo). 2011. V. 64. № 1. P. 155–157.
Pogoryelov D., Krah A., Langer J.D. et al. Microscopic rotary mechanism of ion translocation in the Fo complex of ATP synthases // Nat. Chem. Biol. 2010. V. 6. № 12. P. 891–899.
Rodloff A., Bauer T., Ewig S. et al. Susceptible, intermediate, and resistant – the intensity of antibiotic action // Dtsch. Arztebl. Int. 2008. V. 105. № 39. P. 657–662.
Sato S. Iwata F., Yamada S., Katayama M. Neomaclafungins A–I: oligomycin-class macrolides from a marine-derived actinomycete // J. Nat. Prod. 2012. V. 75. № 11. P. 1974–1982.
Schemidt R.A., Qu J., Williams J.R., Brusilow W.S. Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli // J. Bacteriol. 1998. V. 180. № 12. P. 3205–3208.
Senior A.E. ATP synthesis by oxidative phosphorylation // Physiol. Rev. 1988. V. 68. № 1. P. 177–231.
Senior A.E., Nadanaciva S., Weber J. The molecular mechanism of ATP synthesis by F1F0-ATP synthase // Biochim. Biophys. Acta. 2002. V. 1553. № 3. P. 188–211.
Shchepina L.A., Pletjushkina O., Avetisyan A. et al. Oligomycin, inhibitor of the F0 part of H+-ATP-synthase, suppresses the TNF-induced apoptosis // Oncogene. 2002. V. 21. № 53. P. 8149–8157.
Smith R.M., Peterson W.H., McCoy E. Oligomycin, a new antifungal antibiotic // Antibiot. Chemother. (Northfield, Ill.). 1954. V. 4. № 9. P. 962–970.
Stock D., Leslie A.G., Walker J.E. Molecular architecture of the rotary motor in ATP synthase // Science. 1999. V. 286. № 5445. P. 1700–1705.
Symersky J., Osowski D., Walters D.E., Mueller D.M. Oligomycin frames a common drug-binding site in the ATP synthase // PNAS USA. 2012. V. 109. № 35. P. 13961–13965.
Tenover F.C. Mechanisms of antimicrobial resistance in bacteria // Am. J. Infect. Control. 2006. V. 34. № 5. Suppl. 1. P. S3–10; discussion S64–73.
Tenson T., Lovmar M., Ehrenberg M. The mechanism of action of macrolides, lincosamides and streptogramin B reveals the nascent peptide exit path in the ribosome // J. Mol. Biol. 2003. V. 330. № 5. P. 1005–1014.
Toyoshima C., Nomura H., Tsuda T. Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 A resolution // Nature. 2000. V. 405. № 6787. P. 647–655.
van Raaij M.J., Abrahams J.P., Leslie A.G., Walker J.E. The structure of bovine F1-ATPase complexed with the antibiotic inhibitor aurovertin B // PNAS USA. 1996. V. 93. № 14. P. 6913–6917.
van Walraven H.S., Strotmann H., Schwarz O., Rumberg B. The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four // FEBS Lett. 1996. V. 379. № 3. P. 309–313.
Walker J.E. The ATP synthase: the understood, the uncertain and the unknown // Biochem. Soc. Trans. 2013. V. 41. № 1. P. 1–16.
Watt I.N., Montgomery M.G., Runswick M.J. et al. Bioenergetic cost of making an adenosine triphosphate molecule in animal mitochondria // PNAS USA. 2010. V. 107. № 39. P. 16823–16827.
Weber J. ATP synthase: subunit-subunit interactions in the stator stalk // Biochim. Biophys. Acta. 2006. V. 1757. № 9–10. P. 1162–1170.
Weber J., Senior A.E. ATP synthase: what we know about ATP hydrolysis and what we do not know about ATP synthesis // Biochim. Biophys. Acta. 2000. V. 1458. № 2–3. P. 300–309.
Wender P.A., Jankowski O.D., Longcore K. et al. Correlation of F0F1-ATPase inhibition and antiproliferative activity of apoptolidin analogues // Org. Lett. 2006. V. 8. № 4. P. 589–592.
Whitesides G.M. The “right” size in nanobiotechnology // Nat. Biotechnol. 2003. V. 21. № 10. P. 1161–1165.
Wilms R., Freiberg C., Wegerle E. et al. Subunit structure and organization of the genes of the A1A0 ATPase from the archaeon Methanosarcina mazei Go1 // J. Biol. Chem. 1996. V. 271. № 31. P. 18843–18852.
Wolvetang E.J., Johnson K.L., Krauer K. et al. Mitochondrial respiratory chain inhibitors induce apoptosis // FEBS Lett. 1994. V. 339. № 1–2. P. 40–44.
Yamazaki M., Yamashita T., Harada T. et al. 44-homooligomycins A and B, new antitumor antibiotics from Streptomyces bottropensis. Producing organism, fermentation, isolation, structure elucidation and biological properties // J. Antibiot. (Tokyo). 1992. V. 45. № 2. P. 171–179.
Yang P.W., Li M.G., Zhao J.Y. et al. Oligomycins A and C, major secondary metabolites isolated from the newly isolated strain Streptomyces diastaticus // Folia Microbiol. (Praha). 2010. V. 55. № 1. P. 10–16.
Yoshida M., Muneyuki E., Hisabori T. ATP synthase – a marvellous rotary engine of the cell // Nat. Rev. Mol. Cell Biol. 2001. V. 2. № 9. P. 669–677.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии