Успехи современной биологии, 2021, T. 141, № 1, стр. 78-104
Гипотеза о механизмах эволюционного процесса и его канализации на примере позвоночных животных. Часть 1. Эволюция, связанная с высокой температурой тела
В. А. Черлин *
Дагестанский государственный университет
Махачкала, Россия
* E-mail: cherlin51@mail.ru
Поступила в редакцию 27.06.2020
После доработки 14.07.2020
Принята к публикации 14.09.2020
Аннотация
В статье приводятся материалы, иллюстрирующие принцип стабилизации высокой температуры тела в эволюции позвоночных животных. В эволюции у разных групп позвоночных, начиная с рыб, появлялись случаи эндотермного повышения температуры тела. Но анализ показал, что в разных группах позвоночных, от хрящевых и костных рыб до плацентарных млекопитающих и птиц, проявления эндотермии имеют разные происхождение и механизмы. И даже среди млекопитающих эндотермные проявления по своей природе неодинаковы. В различных филетических ветвях древних рептилий появлялись группы с повышенным уровнем базального метаболизма, биохимическими характеристиками и морфофизиологическими особенностями, сопровождавшимися повышением температуры тела. Косвенное доказательство этого – появление на спине у ряда групп древних рептилий из разных эволюционных ветвей дополнительных, больших по площади образований – плоских костных выростов, или кожных парусов, натянутых на сильно удлиненные остистые отростки спинных позвонков. Единственное адекватное объяснение их функции – эффективная отдача большого количества избыточного тепла, образовавшегося в результате эндогенного термогенеза. В статье проводится анализ эволюционного происхождения эндотермии, на большом материале доказывается объективность принципа стабилизации высокой температуры тела в эволюции позвоночных животных и то, что он является одной из первопричин и мощной направляющей силой их эволюции. Разбираются вопросы, зачем позвоночным животным нужна высокая температура тела и почему она нужна в первую очередь именно позвоночным.
ВВЕДЕНИЕ
Жизнь – невообразимо сложное, комплексное явление. И она находится в постоянной динамике, изменении, развитии, эволюции. Это, безусловно, единая сложная функциональная система, внутри которой протекает немыслимое количество сложнейших процессов на всех уровнях ее организации, начиная с самого элементарного (Черлин, 2012). Все эти процессы находятся в постоянном многоплановом взаимодействии друг с другом и с окружающей средой. Вероятно, жизнь – самое сложное явление во Вселенной!
Причины, факторы, движущие силы и реализующие механизмы процесса эволюции Жизни – предмет постоянных обсуждений и споров. Наши представления об этом процессе в большей или меньшей степени обоснованы, они базируются, с одной стороны, на описанных в литературе научных фактах, с другой – на анализе идей некоторых авторов, а с третьей – на материалах наших собственных научных исследований, на логических построениях и умозаключениях, сформировавшихся на их основе. Обвинить нашу концепцию в недостаточной обоснованности и экспериментальной неподтвержденности, безусловно, можно. Поэтому в данной статье мы решили изложить в целости, объяснить и подтвердить доступными фактами свою точку зрения на этот глобальный процесс.
ИСХОДНЫЙ МАТЕРИАЛ ДЛЯ РАЗМЫШЛЕНИЙ
В течение более чем сорока лет занимаясь вопросами термобиологии рептилий и эволюции терморегуляции у позвоночных животных, мы получили материалы, которые позволили прийти к ряду общих выводов о некоторых механизмах эволюционного процесса. В основе наших заключений лежит целый пласт явлений, связанных с направленностью эволюции позвоночных животных и механизмами этой направленности. Этот пласт явлений имеет в своей основе принцип стабилизации высокой температуры тела в эволюции позвоночных. Вполне возможно, что это не единственный, но, тем не менее, очень важный пласт биологических явлений, на примере которого можно проиллюстрировать специфический механизм, специфический путь течения эволюционного процесса. Но поскольку мы занимались именно термобиологией, то основной упор в нашем рассмотрении мы сделаем именно на проблемы, связанные с температурой.
Принцип стабилизации высокой температуры тела в эволюции позвоночных
Еще в 1940 г. в журнале “Успехи современной биологии” замечательный, но “неформатный” и отчасти поэтому забытый советский биолог Александр Владимирович Рюмин (Черлин и др., 2016) опубликовал статью о том, что в эволюции позвоночных животных наблюдается тенденция ко все большей стабилизации высокого уровня температуры тела (Рюмин, 1940). Выводы его статьи были хорошо обоснованы многочисленными опытами и анализом материала, а также литературными данными. Однако научной общественностью эта статья, практически, не была замечена. Мы, занимаясь проблемами термобиологии рептилий и эволюции терморегуляции у позвоночных, на основе своих собственных исследований вышли на такие же теоретические выводы. Но поскольку к тому времени мы еще не были знакомы с публикациями А.В. Рюмина (его работы, практически, никто не цитировал, о нем вообще почти никто не вспоминал), то подготовили и опубликовали (по случайности в том же самом журнале, что и Рюмин, – “Успехи современной биологии”) собственную статью на эту же тему (Черлин, 1990). Причем оказалось, что наши выводы почти полностью совпали с выводами А.В. Рюмина, к которым он пришел на 50 лет раньше нас!
Итак, принцип стабилизации высокой температуры тела в эволюции позвоночных животных: у позвоночных животных в процессе эволюции наблюдается направленность на все большую стабилизацию высокой температуры тела (Рюмин, 1940; Черлин, 1990, 2012).
Проявления принципа стабилизации
Рыбы как класс в целом живут при температурах воды (и тела) в диапазоне примерно от –2°С (Bargelloni et al., 1998) до в среднем 25–30°C (Голованов, 2013) и максимально до 52°С11 (Анисимова, Лавровский, 1983). У большинства рыб предпочитаемые температуры тела лежат в диапазоне от 20–25° до 30° (Голованов, 2013), хотя у большого числа холодолюбивых видов предпочитаемые температуры тела существенно ниже.
У амфибий ситуация с температурами жизнедеятельности очень сходна: многие виды активны при температурах тела 25–30° (Navas et al., 2013), некоторые – при 0–17°, например сибирский углозуб Salamandrella keyserlingii (Ярцев, Куранова, 2013), огненная саламандра Salamandra salamandra (Гуржий, 2006), японская гигантская саламандра (Okada et al., 2008), а у отдельных видов температура тела иногда доходит до 39° (Rausch et al., 2008). Термальные предпочтения, как и у рыб, выражены слабо.
Рептилиям для их успешной жизнедеятельности необходимо, чтобы в течение всего периода активности или его части, в ежедневной фазе покоя или в других состояниях, то есть хотя бы в течение части суток (и части года) животные имели возможность удерживать температуру тела в достаточно узком и высоком диапазоне – у многих групп примерно 28–37°, у других – 35–40°, у некоторых – 38–45° (Черлин, 2014).
У эндотермов (птиц и млекопитающих) за счет биохимических механизмов термогенеза температура тела более или менее стабильно высокая. У млекопитающих температура тела в среднем от 37 до 39.5°, у птиц она в среднем выше 37° и доходит у ряда видов до 42–45.5° (Шмидт-Ниельсен, 1982; Колтун, Русин, 2016). Причем эта стабилизация высокой температуры тела происходит уже, практически, в течение всех суток (лишь в ряде случаев несколько снижается во сне) и на протяжении большей части года (кроме зимнеспящих животных в гибернации). Другими словами, стабилизация высокой температуры тела становится у них постоянной и окончательной даже в очень широком спектре температурных условий внешней среды.
Одна из основных причин проявления принципа стабилизации – энергетическая оптимизация работы ферментов
По мнению А.В. Рюмина (Рюмин, 1940) и по нашему мнению тоже (Черлин, 1990, 2012), основной биологический смысл стабилизации высокой температуры тела в эволюции позвоночных животных заключается в энергетической оптимизации работы ферментов в организме животных.
Ферменты – важнейшие функциональные элементы всех живых систем, без которых жизнь как явление существовать не может. Температура очень сильно влияет на скорость и эффективность работы ферментов. В оптимальной температурной зоне ферменты работают максимально эффективно, то есть химические реакции с их участием происходят быстрее всего и с наименьшими затратами энергии, поскольку энергия реагирующих молекул может повышаться за счет высокой температуры, а не за счет специальных энергетически затратных биохимических механизмов (Биохимия, 2004). Таким образом, минимизация энергетических затрат при работе ферментов – одна из важнейших задач любой живой системы, которую организм старается решить, в частности, повышением температуры тела.
Логично было бы предположить: если живая система успешно функционирует, значит, ферменты должны были бы работать в ней в оптимальном или близком к нему режиме.
Однако, как ни странно, на деле ситуация обстоит далеко не так однозначно. Показано, что много пищеварительных, дыхательных и других важных ферментов у 13 видов рыб умеренной зоны имеют температурный оптимум22 работы в диапазоне от 30–40° до 50–60° (Коштоянц, Коржуев, 1934; Кузьмина, 1986), то есть при температурах однозначно более высоких, чем температуры тела рыб, с которыми они в природе реально живут и зачастую при которых они вообще могут выжить (Коштоянц, 1950; Ананичев, 1959; Кузьмина, 1986).
Температурный оптимум работы многих ферментов у рептилий, наоборот, чаще всего находится близко к диапазону температур тела, при котором эти животные нормально активны (Licht, 1964; Licht, Basu, 1967; Dawson, 1975).
Для большинства ферментов у теплокровных животных температурный оптимум их работы приходится на диапазон примерно 37–40° (Сравнительная физиология…, 1977; Биохимия, 2004), то есть почти полностью совпадает с зоной температур тела, c которой постоянно живут эти животные.
Таким образом, температура тела у рыб ниже оптимальной температурной зоны работы большинства важнейших ферментов на 30–50°. Для амфибий характерна примерно такая же разница, хотя отмечается некоторая тенденция к ее уменьшению, поскольку некоторые амфибии иногда греются. Температура тела рептилий в периоды активности и в другое время (обращаем внимание – периодически) подходит очень близко к оптимальному уровню работы ферментов. У птиц и млекопитающих с высокой температурой тела эти различия снижаются почти до 0° уже постоянно (Черлин, 2017; Cherlin, 2015).
Следовательно, температура тела у позвоночных животных в эволюции фактически все более приближается и стабилизируется на компромиссном достаточно высоком уровне, который “поджимается” снизу высокой оптимальной температурой работы многих ферментов, а сверху – деструкцией важных для жизнедеятельности организма белков и других соединений (особенно в нервной системе).
Другие возможные причины стабилизации высокой температуры тела
В литературе можно найти и другие обоснования возможных причин проявления принципа стабилизации высокой температуры тела.
Так, важным биологическим смыслом и причиной стабилизации высокой температуры тела в эволюции позвоночных можно считать установление оптимального равновесия между анаболическими и катаболическими процессами (Рюмин, 1940; Черлин, 1990). А.В. Рюмин предполагал, что такое равновесие фиксируется примерно при температуре около 37°. Это подтверждается и современными исследованиями (Эстерле, 2000).
Кроме того, А.В. Рюмин писал: “…основная закономерность в развитии холоднокровных позвоночных – это повышение оптимальной температуры тела до температуры, при которой возможно дальнейшее прогрессивное развитие” (Рюмин, 1939, с. 77). Он представил вполне определенные обоснования этого положения, но здесь его доводы мы пересказывать не будем.
Эволюционные последствия действия принципа стабилизации для позвоночных животных и механизмы его реализации. Эволюция эндотермии
Для того чтобы принцип стабилизации высокой температуры тела в эволюции позвоночных животных реализовался, возможны два пути: за счет преимущественно внешних (эктотермия) или преимущественно внутренних (эндотермия) источников тепла. При этом, в любом случае, нужно иметь возможность удовлетворить два условия: иметь способ подогрева тела (эктотермный или эндотермный) и способ регулирования его температуры.
Для эктотермов есть три условия, способствующие решению этих задач:
1) нужно оказаться во внешней среде с таким сочетанием разных термальных факторов (теплового излучения солнца и/или окружающих предметов, температуры воздуха и почвы), при котором имелся бы по крайней мере один превалирующий, доставляющий к телу животного мощный тепловой поток;
2) внешняя среда должна иметь существенную мозаичность, контрастность термальных условий от участков с высокой до участков с низкой тепловой нагрузкой, и все эти участки для животного должны быть одинаково доступны (необходимость высокой подвижности, активности животных);
3) в нервной системе должен быть прежде всего развит механизм поведенческой терморегуляции, позволяющий изменять относительный тепловой поток от разных тепловых факторов, менять тепловой баланс тела при сохранении заданного уровня его температуры.
Первый пункт явно требует выбора внешней среды с подходящими параметрами. Водная среда, в которой обитали амфибии, этим требованиям явно не удовлетворяет. Мощный тепловой поток (инсоляция и температура почвы) и контрастная термальная мозаичность среды доступны только на суше.
Второй пункт также может быть реализован только на суше, и к тому же он требует развития в определенных направлениях многих морфофизиологических систем организма: опорно-двигательной, дыхательной, покровной, сердечно-сосудистой, нервной, энергообеспечения и др.
Эндотермы решили эти проблемы в большей степени за счет внутренних механизмов (эндогенный термогенез и регуляция температуры за счет изменений интенсивности термогенеза и теплоотдачи), осуществив соответствующие эволюционные перестройки морфофизиологических систем организма.
Однако исследования в основном последних десятилетий показывают, что понятие эндотермии само по себе невероятно сложное, разноплановое и еще далеко не познанное. А то, что о нем к настоящему времени известно, поставило много новых вопросов по сути проблемы.
Дело в том, что у разных групп позвоночных животных известно множество стратегий проявления эндотермных свойств. Чаще всего, когда речь заходит об эндотермии у позвоночных животных, о термогенезе, то вспоминают и обсуждают классические модельные группы – млекопитающих и птиц. Но эндотермия в той или иной форме и степени известна у всех групп позвоночных. Поэтому, начнем с рыб.
ЭНДОТЕРМИЯ У РЫБ
Хрящевые и костные рыбы независимо друг от друга развили специфические формы мышечной эндотермии, позволяющие им поднять температуру своего тела относительно окружающей воды. Этих специфических стратегий в основном две.
1) Тепло становится побочным продуктом действий медленно сокращающихся аэробных красных мышц во время постоянного плавания (эндотермия красных мышц). Мало того, области вокруг красных мышц анатомически организуются в своеобразный термостат, прежде всего, за счет развития сети противоточных кровеносных сосудов (чудесная сеть), призванной сохранять тепло внутри тела (Graham et al., 1983; Graham, Dickson, 2000, 2001; Katz, 2002; Dickson, Graham, 2004).
2) Глазодвигательные мышцы превращаются в специализированный нагревательный орган, в котором мышечные волокна теряют сократительную активность и выполняют холостые циклы кальция между цитоплазмой и саркоплазматическим ретикулумом, происходящие с выделением тепла (Carey, 1982; Block, 1986, 1994; Morrissette et al., 2003).
Таким образом, нагревательные органы производят недрожательный термогенез, который можно назвать черепной эндотермией. В дополнение к этому механизм теплопродукции в черепе может быть еще связан с сокращениями красных глазодвигательных мышц (Sepulveda et al., 2008) или с передачей тепла от осевых красных мышц через специальные отверстия в задней части черепа (Dickson, Graham, 2004). Только один вид тунца, Allothunnus fallai (южный тунец), имеет настоящий обогреватель мозга, для чего используются все четыре прямых мышцы (Sepulveda et al., 2008). Наконец, у опаха Lampris sp., Lampridiformes, недавно была описана уникальная стратегия теплопродукции, включающая как черепную эндотермию (Runcie et al., 2009), так и специфическую эндотермию всего тела (рис. 1), в основе которой, скорее всего, лежит недрожательный термогенез (Wegner et al., 2015; Franck et al., 2019). Кроме черепного термогенеза и термогенеза красных мышц вокруг осевого скелета, иногда для повышения температуры используются активно работающие грудные плавники. Так, черепная и грудно-плавниковая чудесные сети были также обнаружены у нескольких видов скатов, но стратегия их теплопродукции пока неизвестна (Alexander, 1996).
Рис. 1.
Температура тела опаха Lampris guttatus. Распределение внутренних температур тела (измерения сделаны примерно на глубине 4–5 см под кожей у рыбы длиной 98.0 см и весом 40.0 кг при температуре окружающей воды 10.5° (по: Wegner et al., 2015).

В целом повышенную температуру в туловище и в черепе демонстрируют много разных групп рыб – тунцы, акулы, макрели, марлины, рыбы-мечи, сарганы, опахи и др. (Carey et al., 1971; Linthicum, Carey, 1972; Carey, 1982; Block, Carey, 1985; Block, 1986, 1991, 1994; Wolf et al., 1988; Block, 1991, 1994; Block et al., 1993; Block, Finnerty, 1994; Graham, Dickson, 2000, 2001; Dickson, Graham, 2004; Bernal, Sepulveda, 2005; Miya et al., 2013; Watanabe et al., 2015; Franck et al., 2019; Pimiento et al., 2019; Legendre, Davesne, 2020).
Расширение диапазона температур окружающей воды и областей географического распространения предполагается многими авторами как основное адаптивное преимущество эндотермии, а особенно эндотермии красных мышц в этих таксонах (Dickson, Graham, 2004; Watanabe et al., 2015). Это может быть основной движущей силой конвергентного происхождения эндотермии, по крайней мере в шести разных ветвях пластинчатожаберных и костистых рыб, а также у гигантских вымерших морских рептилий, таких как ихтиозавры, плезиозавры и мозазавры (Bernard et al., 2010; Legendre, Davesne, 2020).
ЭНДОТЕРМИЯ У РЕПТИЛИЙ
Среди рептилий также известна способность повышать температуру своего тела по отношению к температурам внешней среды за счет эндогенных механизмов. Описано несколько вариантов стратегий их эндотермии.
Наиболее известный случай – дрожательный (сократительный) термогенез – среди чешуйчатых рептилий, который связан, в частности, с родительским поведением у разных видов змей. Так, самки питонов плотно обвивают кладку кольцами своего тела. Температуры их тела и кладки при этом повышаются и стабилизируются на уровне примерно 30–32°. Происходит это двумя основными путями.
Один из них – терморегуляционное поведение. Если температура окружающей среды и тела самки питона опускалась ниже 31°, змея подставляла часть своего тела в нагретую зону под лампу, грела ее, а затем втягивала эту нагретую часть внутрь колец туловища, поближе к кладке. В результате температура всего тела и кладки питона повышалась (Орлов, 1986; Valensiennes, 1841; Lamarre-Picquot, 1842; Sclater, 1862; Pope, 1961; Hutchison et al., 1966; Crawshaw et al., 1981; Harlow, Grigg, 1984; Slip, Shine, 1988). Такое поведение наблюдалось, например, у королевского питона Python regius, тиморского водяного питона Liasis mackloti и зеленого питона Chondropython viridis (Орлов, 1986).
Но есть и второй путь. При температуре субстрата и воздуха ниже 25.5–31° у самок питонов наблюдались пульсирующие сокращения мышц тела с частотой от 10 до 42 в минуту. При этом температура тела змей повышалась до 32–33° и поддерживалась на этом уровне (Орлов, 1986). Это типичный пример дрожательного или сократительного термогенеза. При этом показано, что частота мышечных контрактур прямо пропорциональна эндогенному повышению температуры тела (van Mierop, Barnard, 1976a,b). В результате дрожательный термогенез поднимает температуру тела относительно температуры воздуха на 7–18° (Орлов, 1986; Sup, Shine, 1988; Snow et al., 2010). Такое явление было отмечено у бирманского питона Python bivittatus (Valensiennes, 1841; Lamarre-Picquot, 1842; Hutchison et al., 1966), у коврового питона Morelia spilota (Sup, Shine, 1988; Stahlschmidt, DeNardo, 2009), а также у королевского питона, тиморского водяного питона и зеленого питона (Орлов, 1986).
Были специально поставлены эксперименты, при которых в террариумах с насиживающими самками питонов отсутствовали источники направленного тепла, а температура субстрата и воздуха была 27–30°. Несмотря на это, температура тела насиживающих самок тиморского водяного питона составляла 31–33°, а королевского питона – 31–32.5° (Орлов, 1986).
При этом проявление способности к эндогенному повышению температуры тела отмечали у беременных самок питонов примерно за 2 недели до яйцекладки. Весь период инкубации яиц длился 68–70 дней. Почти все это время температура тела змей была повышенная, но за 5–10 дней до конца инкубации температура их тела постепенно понижалась и сравнивалась с температурами субстрата и воздуха (Орлов, 1986).
Способность повышать температуру тела вне связи с родительским поведением описана и для других рептилий, особенно средних и крупных размеров – игуан, варанов, а при строительстве гнезда – у черепах и крокодилов (Benedict, 1932; Hutchison et al., 1966; Brattstrom, Collins, 1972; Cloudsley-Thompson, 1974; Johnson, 1974; Dutton, Fitzpatrick, 1975; Smith, 1975; Sapsford, Hughes, 1978; Bartholomew, 1982). Если у мелких рептилий с большой относительной поверхностью тела это эндогенное тепло очень быстро рассеивается, то у более крупных животных оно может иметь определенное значение (Benedict, 1932). Это было показано на крупных черепахах, варанах и др. (Galvao et al., 1965; Fair et al., 1972; Seebacher et al., 1999; Burness et al., 2001), на кожистых морских черепахах Dermochelys coriacea (Fair et al., 1972), на зеленых черепахах Chelonia mydas (Standora et al., 1982).
У кожистой морской черепахи Dermochelys coriacea, самой большой из современных видов черепах – до 700 кг (Paladino et al., 1990), была описана гомеотермия благодаря ее способности поддерживать температуру тела на относительно постоянном уровне – как минимум на 18° выше, чем температура окружающей холодной воды (Greer et al., 1973). Эта терморегуляция обеспечивается очень толстым изолирующим слоем субэпидермально васкуляризированной жировой ткани, аналогичной жировой ткани китообразных и ластоногих (Davenport et al., 2009). Жировой слой также присутствует вокруг глаз возле сетчатки и внутри полости черепа, защищая нейрокраниум и солевые железы и ограничивая потери тепла вовне (Davenport et al., 2009). Кроме того, противоточные теплообменники, аналогичные таковым у тунца и акулы-ламнида, можно найти в его переднем и заднем плавниках (Greer et al., 1973), и было показано, что возможность обеспечить активную терморегуляцию через контролируемое рассеивание тепла, напрямую зависит от температуры окружающей воды (Bostrom et al., 2010). Эти теплообменники также функционируют как локальный способ возвращать тепло, выделяемое при мышечном термогенезе внутри конечности и предотвращать гипертермию в остальной части тела (Davenport et al., 2015). Эти две адаптации позволяют черепахе поддерживать температуру тела около 25° даже во время активного плавания в холодной воде во время глубоких погружений или в приполярных водах при температуре воды меньше 5° (Bostrom et al., 2010; Köhler et al., 2012).
Наличие эндогенной теплопродукции у кожистой морской черепахи по физиологическим характеристикам теплового обмена не отличается от таковых у других рептилий. По этой причине большой размер туловища и высокая инсуляция были предложены в качестве основных причин гомеотермии кожистых черепах, которые делают возможным сохранение тепла в организме, не требуя высокой скорости метаболизма (Paladino et al., 1990). Эта стратегия, получившая название гигантотермии, впоследствии была предложена как терморегуляторный процесс у крупных динозавров не птичьей линии (Paladino et al., 1990; Chinsamy-Turan, 2005; Sander et al., 2011; Seymour, 2013). Действительно, большой размер тела был описан как потенциальная причина гомеотермии динозавров с конца 1970-х гг. (Benton, 1979), и гипотеза гигантотермии с тех пор обсуждалась во многих палеонтологических исследованиях и обзорах с противоречивыми интерпретациями о возможном влиянии филогении и онтогенеза на этот физиологический процесс (Sup, Shine, 1988; Snow et al., 2010; Burton et al., 2011; Brashears, DeNardo, 2013). Узкоспециализированные адаптации кожистой черепахи, однако, тесно связаны с постоянным плаванием, связанным с океаническим, пелагическим образом жизни. Другие возможные причины для противоточной системы обмена в конечностях четвероногих могут быть также связаны с водным образом жизни, как это показано у утконоса Ornithorhynchus anatinus (Grant, Dawson, 1978), и с чрезвычайно холодными температурами окружающей среды, как наблюдается у пингвинов Spheniscidae (McCafferty et al., 2013) или у песца Vulpes lagopus (Prestrud, 1991). Обобщение этой стратегии для других клад позвоночных только на основании их большого размера вводит в заблуждение, особенно без учета разницы в размерах между кожистой черепахой и большими не птичьими динозаврами (например, зауроподы).
Это свойство может быть функционально связано с приобретением эндотермии, так как использование дрожательного термогенеза во время пробуждения у мелких зимнеспящих млекопитающих очень похоже на гомеотермию насиживающих питонов (Grigg et al., 2004). Способность к эндогенной теплопродукции привела некоторых авторов к предположению, что дрожательный термогенез может быть не единственным механизмом, вовлеченным в производство тепла у этих видов питонов, и что у них также возможен и недрожательный термогенез (Brashears, DeNardo, 2013). И действительно, у насиживающих самок питонов заметно повышался уровень метаболизма (Benedict, 1932; Stemmler-Morath, 1956; Hutchison et al., 1966; Vinegar et al., 1970; Johnson et al., 1975; van Mierop, Barnard, 1976a,b; Wagner, 1976; Ross, 1978, 1981).
Но в разных отрядах рептилий была задокументирована также способность временно поддерживать более высокую температуру тела также и путем недрожательного (несократительного) термогенеза.
Так, у гремучих змей во время пищеварения наблюдалось небольшое повышение температуры тела (приблизительно на 1° после обильной еды), длящееся до 6 дней и напрямую коррелирующее с размером съеденной пищи (Tattersall et al., 2004; Tattersall, 2016), или у некоторых варанид (приблизительно на 0.5°) (Bennett et al., 2000). В обоих примерах, несмотря на сильное увеличение скорости метаболизма в три–четыре раза у варанид (Bennett et al., 2000) и в 20 раз у некоторых змей (Secor, Diamond, 2000), повышенное потребление кислорода связано с физиологическими функциями, а не с теплопродукцией. Таким образом, рост температуры тела всегда остается очень маленьким, что также вероятно связано с повышенной теплопроводностью (Tattersall et al., 2004).
Отмечено некоторое повышение температуры тела заборной игуаны Sceloporus без всякой мышечной работы – только когда одному самцу предъявляли другого. Температура тела при этом повышалась у него на 0.25–3.0° (в среднем на 1.3°) только от эмоциональной агрессивной реакции без всяких внешних проявлений и движений (Engbretson, Livezey, 1972).
Описано чисто метаболическое повышение температуры тела ящериц тегу Tupinambis merianae весом около 2 кг в репродуктивный период. В течение ночи они находились в искусственной норе. Но прежде чем выйти из нее при первом освещении утром (6:00 утра), тегу уже имели температуру тела существенно выше, чем в окружающей среде иногда на 6–10° (Tattersall, 2016; Tattersall et al., 2016) (рис. 2).
Рис. 2.
Инфракрасное тепловое изображение ящериц тегу Tupinambis merianae, имеющих существенно более высокую температуру тела, чем в норе, в которой они в течение долгого времени находились (по: Tattersall et al., 2016).

Также отмечено повышение температуры тела ящериц при патологических реакциях, при введении ряда бактериальных препаратов или при болезнях (Vaughn et al., 1974; Bernheim, Kluger, 1976; Firth et al., 1980; Cooper, Jackson, 1981; Balsai, 1986; Muchlinski et al., 1989; Warwick, 1991).
У некоторых групп древних рептилий, принадлежащих к разным отрядам и даже классам, на спине имелись большие по площади выросты разной структуры, на которые имеет смысл обратить особое внимание. Так, у спинозавров (динозавры, зауропсиды) остистые отростки спинных позвонков были сильно удлинены (иногда до 1 м и даже более) и обтянуты кожей в виде паруса (рис. 3, 4).
Рис. 3.
Скелет спинозавра (https://indianapublicmedia.org/wpimages/amomentofscience/2015/02/spinosaurus.jpg).

Рис. 4.
Реконструкция внешнего вида спинозавра (https://avatars.mds.yandex.net/getzen_doc/1710047/pub_5d068bef729-e3a0d58fcfd9c_5d06908b7fbd010e5953f330/scale_1200).

У диметродонов (рис. 5, 6) и эдафозавров (рис. 7, 8) (пеликозавры, синапсиды) длиной от 1 до 6.5 м и весом до 2 т тоже имелись подобные паруса. Также паруса на спине имели и некрупные до 1.5–2 м триасовые архозавры ктенозаурисциды (рис. 9).
Рис. 5.
Скелет диметродона (https://upload.wikimedia.org/wikipedia/commons/b/bf/Dimetrodon_limbatus_ AMNH_4636.JPG).

Рис. 6.
Реконструкция внешнего вида диметродонов (https://animalreader.ru/wp-content/uploads/2014/09/ papocarnegieDimetrodon05.jpg).

Рис. 7.
Скелет эдафозавра (https://upload.wikimedia.org/wikipedia/commons/a/ad/Edaphosaurus-Field_ Museum.jpg).

Рис. 9.
Реконструкция внешнего вида ктенозаурисцид (https://vadim-proskurin.livejournal.com/366371.html).

У стегозавров (также динозавры, зауропсиды) в среднем около 9 м в длину и около 4 м в высоту на спине имелись два ряда крупных костных пластин (рис. 10, 11). Кость в этих пластинах была рыхлая, пронизанная многочисленными канальцами, вероятно, кровеносными сосудами. Защитные функции, как это изначально предполагали некоторые ученые, такая рыхлая наполненная кровью кость вряд ли могла исполнять. У нее явно были другие функции.
Рис. 10.
Скелет стегозавра (http://www.travelthruhistory.tv/ThruHistory/wp-content/uploads/2013/11/UtahFieldHouseDinosaurByPhilKonstantin.jpg).

Рис. 11.
Реконструкция внешнего вида стегозавра (https://avatars.mds.yandex.net/get-zen_doc/225901/pub_5d13ad5-f6d9c0000b0418503_5d13b86d6c33d200aea9d319/scale_1200).

И паруса, и костные пластины наиболее эффективно могли быть использованы для терморегуляции. Но в каком качестве? Чтобы разобраться в этом, узнáем, какую температуру тела имели и поддерживали у себя крупные динозавры.
Об уровне температуры тела у динозавров можно судить по данным специальных исследований и расчетам, приведенным разными авторами в последнее время (Eagle et al., 2011; Grady et al., 2014; Canavan et al., 2016). Все эти авторы, исследуя данную проблему с разных сторон, сходятся на том, что у динозавров температура тела должна была сохраняться примерно на уровне от 27–28° до 32–38°. За счет чего у них могла удерживаться такая высокая температура тела?
Использование паруса на спине в качестве дополнительной площади нагрева с помощью инсоляции (как об этом иногда писали и пишут в литературе) на деле малоэффективно. По расчетам ряда ученых (Gould, 1998), у динозавров весом около 10 т для повышения температуры тела всего на 1° при нагревании преимущественно за счет инсоляции с помощью парусных образований потребовалось бы 86 часов непрерывного пребывания на солнцепеке. А некоторые спинозавры, например, достигали 17 м в длину и вес у них был около 13.5 т. Поэтому нагреться с помощью паруса до температуры, на 10–15° превышающей температуру воздуха, такому крупному животному в реальной климатической обстановке было бы практически невозможно. У современных рептилий описаны развитые вазомоторные механизмы перераспределения тепла в теле, помогающие в его нагревании (Черлин, 2014), но они задействуют только небольшие участки тела и объемы крови, поэтому могут помочь ускорению нагревания в основном у животных некрупных – примерно до размеров серого варана. Для рассматриваемых нами средних и крупных вымерших динозавров это вряд ли актуально. При этом предположительное уменьшение продолжительности нагревания туловища, благодаря парусным образованиям и вазомоторным реакциям, со 100 часов (а по приведенным выше расчетам, скорее всего – существенно больше) даже до 20 (что в реалии уже невероятно) при 24-часовой продолжительности суток – совершенно непринципиально и практически бессмысленно.
Хотим обратить внимание на то, что температура тела самых крупных из современных ящериц – комодских варанов Varanus komodensis, сходных, вероятно, по размерам с эдафозаврами и диметродонами, и других более мелких варанид вполне успешно удерживается при активности на уровне 32–36° или немного выше (Целлариус и др., 1991; Harlow et al., 2010), то есть на 5–10° выше температуры окружающей среды. При этом климатические условия позволяют им быть успешными и конкурентоспособными без всяких дополнительных морфологических способов ускорения нагревания (без специальных теплообменных радиаторов в виде парусов и т.п.).
Так для чего же были нужны древним рептилиям радиаторы в виде парусов или групп отдельных пластин?
Совершенно очевидно, что при обычной жизнедеятельности активно охотящихся эктотермных животных (некоторых динозавров) в их организме прежде всего при движении выделялось достаточно большое количество тепла, а небольшая относительная поверхность тела, большая термоинерционная масса и толстые слабо теплопроводные покровы препятствовали выводу тепла из организма. В этой ситуации температура тела, в первую очередь, крупных хищных подвижных динозавров, скорее всего, повышалась до 32–38°, но при необходимости продолжительной интенсивной физической активности (охота, погони, драки и т.п.) могла возрастать и до опасного уровня (около 40° и более). Логично предположить, что в таких условиях наличие теплоотдающих радиаторов было бы чрезвычайно полезно и даже необходимо. Однако радиаторы были далеко не у всех таких динозавров. Их не было у подавляющего большинства крупных и активных хищников, для которых дополнительное теплоотведение по этой логике должно было стать наиболее актуальным. Развились они лишь у некоторых групп крупных хищных динозавров и, вероятно, неслучайно именно у них. Были паруса и у эдафозавров, диметродонов и ктенозаурисцид, сходных по размерам с различными современными варанидами, которые, как и рецентные вараны, вполне могли бы обходиться без дополнительных средств внешнего нагревания в виде парусных теплообменников.
Важно отметить, что в процессе эволюции варианты теплообменников, предназначенных именно для отдачи избытков тепла, неоднократно использовались. Прежде всего мы знаем это по эндотермным животным. Отчасти иллюстрацией этого является известное правило Аллена, использование высунутого языка у псовых и т.п. Кроме того, у туканов их огромный клюв приобрел такую внутреннюю структуру, которая придает ему важнейшую функцию – избавляться от переизбытка тепла (Tattersall et al., 2009; van de Ven et al., 2016) (рис. 12). На рисунке видно, что чем выше температура окружающего воздуха, тем горячее у туканов клюв. При температурах 30–32° он имеет наибольшую температуру (рис. 12а; б2, б3), что способствует интенсивной теплоотдаче. При более высокой температуре воздуха (43°) тукан приоткрывает клюв и у него начинается пантинг33, в результате чего температура клюва и передней части головы птицы понижается (рис. 12 б4).
Рис. 12.
Клюв тукана Tockus leucomelas как терморегулятор. (a) – тепловое изображение поверхности клюва тукана (Ts) при различных температурах воздуха (Та). На фото представлены термографические изображения взрослых (а, adultus) и ювенильных (j, juvenis) туканов при соответствующих температурах воздуха (по: Tattersall et al., 2009). (б) – тепловое изображение самки тукана при разных температурах воздуха. Температура поверхности отображается в виде шкалы слева от каждого изображения. 1 – Ta= 15°: Ts соответствует фону; 2 – Та = 30.7°: Tsменяется, особенно на нижней челюсти; 3 – Ta = 32.2°: Tsнамного выше, чем у остальной части тела и окружающей среды, что указывает на тепло, излучаемое клювом; 4 – Ta = 43°: Ta > Ts, клюв холоднее, чем окружающая среда, и птица использует транспирационную потерю воды, чтобы сохранять прохладу, на что указывает пантинг при открытом клюве (по: van de Ven et al., 2016).

Гребень на голове казуара используется в таком же качестве. Шея у казуара при любой внешней температуре достаточно горячая, но температура гребня явно различная. При низкой температуре (5°) гребень птицы прохладный. Но чем выше температура окружающего воздуха, тем температура гребня и, следовательно, его теплоотдача – выше (Eastick et al., 2019) (рис. 13).
Рис. 13.
Тепловые изображения головы казуара при различных температурах среды (по: Eastick et al., 2019).

И в том, и в другом случае очевидно, что выдающиеся части тела используются дополнительным, специальным, особым образом. А гребень казуара вообще, по сути, можно считать некоторым аналогом парусных образований на спинах древних рептилий, их моделью.
Все это дает весомый повод предположить, что у ряда групп динозавров и других древних рептилий разных систематических групп и размеров независимо и параллельно могла возникнуть и, видимо, реально возникала повышенная, эндогенная теплопродукция, дополнительная к теплопродукции при мышечной работе. Такой дополнительный несократительный термогенез давал существенные конкурентные и селективные преимущества в усилении интенсивности и в улучшении качества активности. Тогда при их общих морфофизиологических особенностях (существенной массе, плохой теплопроводности покровов, неразвитой системе теплоотдачи и т.п.) необходимость дополнительного теплоотведения становилась безальтернативной. Таким образом, только появление специфического, несократительного, эндогенного термогенеза объясняет и оправдывает абсолютную жизненную необходимость наличия именно у таких групп животных специальных радиаторов для предотвращения смертельного перегрева. Если же предположить, что эти структуры не связаны с необходимостью интенсивной теплоотдачи, то у данных групп они теряют свою функциональность или даже становятся вредными для животных. Следовательно, само наличие таких радиаторов разной конструкции, появлявшихся у различных групп древних рептилий, косвенно свидетельствует о том, что у представителей этих групп животных, вполне вероятно, уже была повышенная, эндогенная, дополнительная теплопродукция, то есть первоначальная эндотермия.
Таким образом, известные нам материалы позволяют заключить, что:
1) у рыб и рептилий в процессе эволюции неоднократно и в разных ветвях эволюционного развития возникали различные варианты эндотермии;
2) у современных рыб и рептилий имеется широкий спектр вариантов эндотермии от своеобразного применения дрожательного, сократительного термогенеза, характерного и для рыб, до элементов несократительного термогенеза, свойственного птицам и, прежде всего, млекопитающим; проявляется также эффект гигантотермии.
ЭНДОТЕРМИЯ МЛЕКОПИТАЮЩИХ И ПТИЦ
Дрожательный термогенез – очень распространенный процесс у всех млекопитающих и птиц, происходящий в ходе длительных периодов низкой температуры воздуха или во время фазы пробуждения от оцепенения для производства тепла дополнительного к тому, которое получено с помощью недрожательного термогенеза (Hohtola, 2004). Он включает производство тепла через асинхронное возбуждение мышечных волокон, так что часто мышцы-антагонисты оказываются активны одновременно. Это происходит без внешних проявлений мышечной работы и позволяет всю АТФ, накопленную в мышцах для сокращения, использовать для выделения тепла. Дрожательный термогенез развивался независимо у птиц и млекопитающих (табл. 1) и считается механизмом корректировки температуры тела, который, вероятно, был эволюционным преимуществом при приобретении эндотермии для обеих групп (Hohtola, 2004).
Таблица 1.
Краткое изложение физиологических стратегий, описанных в литературе как эндотермические, для каждого таксона позвоночных, обсуждаемого в тексте, с акцентом на филогению, клеточные/молекулярные механизмы (если они известны) и палеофизиологические проявления в ископаемых стволовых группах (по: Legendre, Davesne, 2020)
| Таксономические группы | Эндотермическая линия | Тип эндотермии | Анатомические особенности | Термогенный механизм | Возможные палеофизиологические проявления |
|---|---|---|---|---|---|
| Elasmobranchii, Lamniformes | Lamniidae (Block, Carey, 1985) | Эндотермия красных мышц, черепная эндотермия (Block, Carey, 1985) |
Встроенные осевые красные мышцы вдоль позвоночника с чудесной сетью, сосудистое соединение с черепной коробкой (Wolf et al., 1988) | Побочный продукт сокращений красных мышц (Block, Carey, 1985; Wolf et al., 1988) | Неизвестно. Возможно,
размеры тела
или палеобиогео- графия (Ferrón, 2017) |
| Elasmobranchii, Lamniformes | Alopias vulpinus (Bernal, Sepulveda, 2005) | Эндотермия красных мышц (Bernal, Sepulveda, 2005) | Встроенные осевые красные мышцы вдоль позвоночника с чудесной сетью (Bernal et al., 2001; Bernal, Sepulveda, 2005) | Побочный продукт сокращений красных мышц (Bernal et al., 2001; Bernal, Sepulveda, 2005) | Неизвестно |
| Elasmobranchii, Myliobatiformes |
Mobulidae (Alexander, 1996) | Черепная эндотермия (Alexander, 1996) | Черепная чудесная сеть (Alexander, 1996) | Неизвестно | Неизвестно |
| Teleostei, Lampridiformes |
Lampris sp. (Wegner et al., 2015) | Эндотермия всего тела
(Wegner et al., 2015),
черепная эндотермия (Runcie et al., 2009) |
Специализированные грудные красные мышцы, инсулярная жировая ткань, чудесная сеть
в жаберных дугах (Wegner et al., 2015) |
Побочный продукт сокращений красных мышц (Wegner et al., 2015), предполагается несократительный термогенез в саркоплазматическом ретикулуме (сарколипин) (Franck et al., 2019) | Остеолитические кости (Davesne et al., 2018) |
| Teleostei, Istiophoriformes |
Istiopharidae, Xophiidae (Carey, 1982) |
Черепная эндотермия (Carey, 1982) |
Нагревательный орган (модифицированные глазодвигательные мышцы), черепная чудесная
сеть (Block, 1986; Block et al., 1993; Morrissette et al., 2003) |
Несократительный термогенез в саркоплазматическом ретикулуме (рианодиновый рецептор) (Morrissette et al., 2003) |
Значительные изменения
в костях рострума (Atkins et al., 2014) |
| Teleostei, Scombriformes, Scombridae |
Gastero chisma melampus (Block, 1994) | Черепная эндотермия (Block, 1994) |
Нагревательный орган (модифицированные глазодвигательные мышцы), черепная чудесная
сеть (Block, 1994) |
Несократительный термогенез в саркоплазматическом ретикулуме (Morrissette et al., 2003) | Неизвестно |
| Teleostei, Scombriformes, Scombridae |
Thunnini (Graham, Dickson, 2000) | Эндотермия красных мышц, черепная эндотермия (Linthicum, Carey, 1972; Graham, Dickson, 2000, 2001) | Встроенные осевые красные мышцы вдоль позвоночника,
осевая и черепная чудесные сети (Graham, Dickson, 2000, 2001; Dickson, Graham, 2004),
нагревательный орган только
у Allothunnus fallai (Sepulveda et al., 2008) |
Побочный продукт сокращений красных мышц (Dickson, Graham, 2004), несократительный
термогенез в саркоплазматическом ретикулуме Allothunnus fallai (Sepulveda et al., 2008) |
Остеолитические кости (Davesne et al., 2019) |
| Amniota, Squamata, Pythonidae | Python bivittatus, Morelia spilota (Brashears, DeNardo, 2013), Pythonregius, Liasis mackloti, Chondropython viridis (Орлов, 1986) |
Мышечный термогенез (Орлов, 1986; Brashears, DeNardo, 2013) |
Специализированные мышцы (Sup, Shine, 1988) | Побочный продукт мышечных сокращений, возможен несократительный термогенез (Brashears, DeNardo, 2013) |
Неизвестно |
| Amniota, Squamata, Teiidae | Salvator merianae (Tattersall et al., 2016) | Сезонная эндотермия, связанная с размножением (Tattersall et al., 2016) | Неизвестно | Неизвестно, предположительно, несократительный термогенез (Tattersall et al., 2016) |
Неизвестно |
| Amniota, Chelonia | Dermochelys coriacea (Paladino et al., 1990) | Гигантотермия(Paladino et al., 1990) | Изолирующая жировая ткань (Paladino et al., 1990) | Возможно, побочный продукт мышечной и метаболической активности | Неизвестно (следы жира у исчезнувших морских амниот) |
| Amniota, Archosauria | Aves (Walter, Seebacher, 2009) | Эндотермия всего тела, сократительный термогенез (Pörtner, 2004; Walter, Seebacher, 2009) | Инсулирующий перьевой покров, дыхательные носовые раковины, однонаправленный поток
воздуха в легких, мышечная гиперплазия, четырехкамерное сердце, маленький размер генома
(обсуждается) (Mezentseva et al., 2008;
Clarke, Pörtner, 2010; Newman, 2011; Kapusta et al., 2017) |
Дрожательный и недрожательный термогенез в скелетных мышцах (адениннуклеотид- транслоказа, сакролипин) (Toyomizu et al., 2002; Hohtola, 2004; Newman, 2011) |
Инсулирующий перьевой покров, дыхательные носовые раковины, специфическое гистологическое устройство костей, пустотелость костей (дыхательные воздушные мешки) (De Ricqlès et al., 1991; Seymour et al., 2004; Norell, Xu, 2005; Bourke et al., 2014; Kapusta et al., 2017; Brocklehurst et al., 2018) |
| Amniota, Mammalia | Monotremata (Brice, 2009) |
Факультативная эндотермия, дрожательный термогенез (Grigg et al., 2004; Brice, 2009) |
Инсуляция из меха и жира, четырехкамерное сердце, чудесная сеть в конечностях (утконос) (Grant, Dawson, 1978; Brice, 2009) | Дрожательный термогенез (Hohtola, 2004) |
Мех, дыхательные носовые раковины (Hillenius, 1992), специфическое гистологическое
строение кости (Chinsamy, Hurum, 2006) |
| Amniota, Mammalia | Metatheria (Hayward, Lisson, 1992) |
Эндотермия всего тела, дрожательный термогенез (Hayward, Lisson, 1992; Jastroch et al., 2008) | Инсулирующий меховой покров, дыхательные носовые раковины, четырехкамерное сердце (Clarke, Pörtner, 2010; Oelkrug et al., 2015) | Дрожательный термогенез, недрожательный термогенез (механизм неизвестен) (Kabat et al., 2003; Polymeropoulos et al., 2012) | Мех, дыхательные носовые раковины (Hillenius, 1992), специфическое гистологическое
строение кости (Kolb et al., 2015) |
| Amniota, Mammalia | Eutheria (Clarke, Pörtner, 2010) |
Эндотермия всего тела,
дрожательный термогенез (Clarke, Pörtner, 2010) |
Бурая жировая ткань, инсулирующие мех и жир, дыхательные носовые раковины, четырехкамерное сердце (Clarke, Pörtner, 2010; Oelkrug et al., 2015) | Дрожательный термогенез, недрожательный термогенез в бурой жировой ткани (разобщающий белок 1) (Cannon, Nedergaard, 2004; Hohtola, 2004) |
Мех, дыхательные носовые раковины (Hillenius, 1992), специфическое гистологическое
строение кости (Kolb et al., 2015) |
Эндотермия у млекопитающих
Теплопродукция у млекопитающих с начала XX в. изучалась довольно основательно (Калабухов, 1929, 1946а,б; Стрельников, 1933, 1940; Слоним, Щербакова, 1935а,б,в; Израэль, 1936а,б; Слоним, 1952, 1964, 1971, 1979, 1984, 1986; Физиология терморегуляции, 1984; Martin, 1903; Cannon, Nedergaard, 2004; Jastrosh et al., 2008; Brice, 2009; Hughes et al., 2009; Rowland et al., 2015; Gaudry et al., 2017; Periasamy et al., 2017). Теперь известно, что у плацентарных млекопитающих метаболическое тепло вырабатывается в бурой жировой ткани и что эта структура найдена только у плацентарных (Cannon, Nedergaard, 2004; Oelkrug et al., 2015) (табл. 1). Процесс этот происходит благодаря активности специфического разобщающего белка UCP1 (Legendre, Davesne, 2020). Этот процесс обычно называют недрожательным термогенезом млекопитающих (Hughes et al., 2009; Jastroch, Seebacher, 2020), который проявляется за пределами термонейтральной зоны без сокращения скелетных мышц (Cannon, Nedergaard, 2004). Недрожательный термогенез позволяет большинству плацентарных поддерживать температуру своего тела на постоянном уровне (гомеотермия), обычно в пределах диапазона 35–40° (Clarke, Rothery, 2008), и интенсивность его увеличивается у акклиматизированных к холоду животных – адаптивный термогенез (Cannon, Nedergaard, 2004). Этот адаптивный недрожательный термогенез обычно описывается в качестве типичной эндотермии млекопитающих, но среди плацентарных и неплацентарных существуют другие стратегии термогенеза.
Однопроходные (утконос, четыре вида ехидн Tachyglossus), которые не обладают бурой жировой тканью, показывают более низкие значения базального обмена и температуры тела, чем другие млекопитающие (Grant, Dawson, 1978). У утконоса самая высокая скорость метаболизма среди всех однопроходных, что соответствует примерно 70–80% соответствующих значений у плацентарных, в то время как ехидны показывают лишь 25–40% от соответствующих значений базального обмена. Но все однопроходные показывают при этом сходные значения температуры тела – около 30–34° в зависимости от температуры окружающей среды (Miklouho-Maclay, 1884; Schmidt-Nielsen et al., 1966; Nicol, 2017). Поскольку ехидны обладают зависящим от температуры внешней среды широким спектром температуры тела, очень низкими значениями базального метаболизма и способностью входить в суточный торпор или спячку при низкой температуре окружающей среды с падением температуры тела на 10° по сравнению с нормальным диапазоном, этих животных часто считают протоэндотермами, то есть отражающими предковое состояние терморегуляции, анализ которого может помочь в понимании эволюции эндотермии у плацентарных млекопитающих (Schmidt-Nielsen et al., 1966; Grigg et al., 2004; Nicol, 2017).
Эти низкие значения базального метаболизма и температуры тела, однако, могут быть связаны с разными причинами – как с их филогенетическим положением как однопроходных, так и с их роющим образом жизни (McNab, 1979) и их диетой, состоящей почти исключительно из маленьких членистоногих (Nicol, 2017). Ехидны, в частности, считаются очень хорошим примером низкой метаболической активности, обнаруженной у всех млекопитающих-мирмекофагов по сравнению с их близкими родственниками с другой диетой (McNab, 1984). Тем не менее, ехидны, вероятно, имеют некоторые общие характеристики ранних адаптаций, связанных с эндотермией, которые могли присутствовать у синапсид (не млекопитающих): умеренно высокие и очень лабильные уровни базального метаболизма с факультативной гомеотермической эндотермией (например, в репродуктивные периоды) или с сильной инсуляцией для предотвращения потери тепла. Утконос, наоборот, не впадает в спячку, не входит в оцепенение (Grant, Dawson, 1978) и способен поддерживать температуру своего тела на постоянном уровне, даже когда температура воздуха или воды опускается ниже 10° (Brice, 2009). Это может быть объяснено наличием локальных противоточных обменных систем (чудесной сети) в его конечностях, аналогичных таковым у тунца, ламноидных акул и кожистых черепах и обеспечивающих при низкой температуре тела высокую внутреннюю инсуляцию в дополнение к покровной, обеспеченной мехом и подкожным жиром (Grant, Dawson, 1978; Nicol, 2017). Поэтому, хотя возможно, что все однопроходные имеют сходные механизмы теплопродукции, утконос и ехидны имеют очень разные стратегии терморегуляции, эволюция которых еще требует своего изучения.
Хотя скорости метаболизма у сумчатых также ниже, чем у плацентарных, но многие из них способны поддерживать высокую температуру тела, несмотря на отсутствие у них бурой жировой ткани (Jastroch et al., 2008; Polymeropoulos et al., 2012). У нескольких видов сумчатых имеется достаточно высокий уровень адаптивного недрожательного термогенеза, но механизм этого процесса явно отличается от плацентарных (Jastroch et al., 2008). Большое количество митохондрий и большая площадь митохондриальных мембран издавна считались важными факторами, способствующими адаптивному недрожательному термогенезу у плацентарных (Else, Hulbert, 1985). Тем не менее, экспериментально было показано, что у сумчатых более высокий митохондриальный поток протонов, чем у плацентарных того же размера, что положительно коррелирует с массоспецифичным уровнем базального метаболизма как у плацентарных, так и у сумчатых (Polymeropoulos et al., 2012). Имеется некоторое количество различных исследований и версий, но точный механизм, лежащий в основе эндотермии неплацентарных млекопитающих, в настоящее время неизвестен. История эволюционного развития и функции разобщающего белка UCP1 до сих пор не понятны, несмотря на некоторое количество специальных исследований. Известно, что последовательность, кодирующую UCP1, можно найти во многих других кладах позвоночных, включая кистеперых рыб и амфибий, что указывает на то, что ген, вероятно, появился очень рано в эволюции позвоночных, по крайней мере, у последнего общего предка костных рыб (Klingenspor et al., 2008; Hughes et al., 2009). Широко распространено мнение, что UCP1 приобрел термогенные способности только в последнем общем предке плацентарных, через его проявление в бурой жировой ткани. Несколько недавних исследований по эволюции гена белка UCP1 у плацентарных, однако, показали, что во многих крупных кладах млекопитающих появились инактивирующие мутации, в результате чего UCP1 не может проявить свое действие в их митохондриях для достижения недрожательного термогенеза (Legendre, Davesne, 2020). Так что решение вопроса о происхождении механизмов недрожательного термогенеза еще впереди.
Помимо обычных гомеотермических способностей, большое количество млекопитающих и птиц развили способности к снижению уровня метаболизма в ответ на конкретные экологические условия, то есть это проявления гетеротермии (Clarke, Pörtner, 2010). Так, подвергаясь воздействию холодной погоды ночью, некоторые виды млекопитающих и птиц пассивно входят в состояние ежедневного оцепенения, то есть снижения температуры тела для сохранения энергии и уменьшения потери тепла, как правило, связанных с понижением скорости метаболизма (Cannon, Nedergaard, 2004). Некоторые виды также могут впадать в спячку, то есть длительные, активно контролируемые периоды оцепенения в течение нескольких дней или недель с последующей фазой пробуждения.
Примеров подобных ситуаций очень много. Во сне температура тела некоторых млекопитающих заметно снижается. Так, в период зимней спячки у сусликов Spermophilus она опускается порой до 3–5° (Калабухов, 1946б).
При изучении устойчивости к холоду аборигенов центральной части Австралии оказалось, что они совершенно спокойно при температуре воздуха 5–10° спали обнаженными на голой земле без малейших признаков дрожи и повышения газообмена. Температура внутренней части тела у них при этом оставалась нормальной (выше 36°), а вот температура кожи снижалась на туловище до 15°, а на конечностях – до 10° (Goldby et al., 1938; Hammel et al., 1959). У обычных людей в этой ситуации возникли бы ощущения почти непереносимой боли, а австралийцы спокойно спали и не чувствовали ни боли, ни холода.
Почти не поддерживают температуру тела на одном высоком уровне некоторые однопроходные млекопитающие, например ехидна, у которой температура тела может колебаться от 22 до 37° (Miklouho-Maclay, 1884; Martin, 1903; Schmidt-Nielsen et al., 1966). Температуры тела даже у взрослых обыкновенных полевок Microtus arvalis в течение суточной активности могут колебаться от 23 до 42.4° (Стрельников, 1940). Почти не поддерживает температуру тела голый землекоп Heterocephalus glaber (Yahav Buffenstein, 1992).
Таким образом, как пассивный, так и активный контроль свойств, связанных с тепловым метаболизмом, является предковым по отношению к кладам млекопитающих и птиц, и было высказано предположение, что они сильно повлияли на рост эндотермии у немаммальных синапсид и динозавров не птичьей линии (Geiser et al., 2017; Lovegrove, 2017). Действительно, такая высокая пластичность в термогенном метаболизме обеспечивает способность удерживать энергию через снижение базального метаболизма и температуры тела (например, во время развития, или когда температура окружающей среды достаточно высока, чтобы гарантировать, что температура тела может поддерживаться на относительно стабильном уровне за счет баскинга), но также для достижения высоких метаболических показателей, чтобы регулировать температуру инкубации, или чтобы кормиться ночью, когда температура среды низкая, чтобы избежать конкуренции и/или хищничества от эктотермических позвоночных – гипотеза ночного бутылочного горлышка (Crompton et al., 1978; Gerkema et al., 2013). Выход из гомеотермной эндотермии у млекопитающих и птиц соответствует, таким образом, приобретению полноценной эндотермии и проявлению разнообразия и эволюции многих физиологических процессов, воспринимаемых в совокупности как эндотермия млекопитающих.
Эндотермия у птиц
Птицы в целом имеют более высокую скорость метаболизма, чем любые другие клады позвоночных, значения базального метаболизма типичной птицы превышают таковые у типичного эктотермного животного примерно в 15 раз, и примерно в 12 раз – типичного млекопитающего (Clarke, Pörtner, 2010). По этой причине их способность достигать недрожательного термогенеза широко описана в литературе (Ruben, 1995; Walter, Seebacher, 2009; Clarke, Pörtner, 2010). Механизм выделения метаболического тепла, описанный у птиц, однако, физиологически отличен от млекопитающих: так как бурая жировая ткань отсутствует у птиц, и ген, кодирующий UCP1, был потерян целой кладой рептилий, так что птицы не использовали UCP1 млекопитающих для обеспечения недрожательного термогенеза (Mezentseva et al., 2008; Newman, 2011). Еще один митохондриальный разобщающий белок, птичий UCP (avUCP), был описан у птиц и проявляется преимущественно в их скелетных мышцах (Emre et al., 2007). avUCP играет несколько ролей в митохондриях птиц – он производит свободные радикалы или регулирует использование липидов (Emre et al., 2007), и первоначально предполагалось, что он влияет на производство тепла у птиц, аналогично UCP1 у млекопитающих (Toyomizu et al., 2002). Тем не менее, было экспериментально показано, что он не имеет никакого значения ни в митохондриальной разобщающей активности, ни в производстве тепла в мышцах и печени у птиц (Walter, Seebacher, 2009). Вместо этого птичий гомолог адениннуклеотидтранслоказы (ANT) – другого белка, ответственного за транспорт адениннуклеотидов АДФ/АТФ через внутреннюю митохондриальную мембрану, – был найден у всех эукариот (Santamaria et al., 2004) и идентифицирован как основной белок, ответственный за митохондриальное разобщение в птичьих скелетных мышцах. Предполагается, что он непосредственно участвует в выработке тепла при термогенезе в скелетных мышцах (Toyomizu et al., 2002; Walter, Seebacher, 2009).
Однако, даже если митохондриальная адениннуклеотидтранслоказа играет важную роль в птичьем недрожательном термогенезе, производство тепла у птиц может, скорее всего, осуществляться благодаря другому специализированному процессу, который первоначально произошел от мышечного термогенеза, уже присутствующего у всех позвоночных, – благодаря производству тепла через разобщение ионов кальция в саркоплазматической сети мышечных клеток, активированных сарколипином (Bal, Periasamy, 2020). У птиц этот процесс, скорее всего, стал основным способом достижения недрожательного термогенеза через мышечную гиперплазию, особенно в грудной мышце (Newman, 2011; Lovegrove, 2017; Periasamy et al., 2017). В общем, масса скелетных мышц значительно более развита у птиц, чем у амниот такого же размера, и скелетные мышцы птиц, участвующие в полете, имеют высокое содержание митохондрий и миоглобина, что способствует высокой аэробной дыхательной способности (Rowland et al., 2015). Гиперплазия мышц птиц, вероятно, обусловленная приобретением двуногости у теропод и последующей диверсификацией образа жизни птиц, таким образом, считается основным фактором появления как взлетающего полета, так и эндотермии птиц (Gould, 1997; Clarke, Pörtner, 2010; Newman et al., 2013; Rowland et al., 2015; Lovegrove, 2017). Эволюция насиживания и родительской заботы также была описана как потенциальный фактор мышечной гиперплазии и появления эндотермии у нескольких видов птиц (Angilletta et al., 2010). Интересно, что потеря способности к полету у птиц также, по-видимому, коррелирует с низкими значениями базального метаболизма и температурами тела. Самые низкие известные независимые от массы значения базального метаболизма для птиц можно найти у новозеландских киви Apteryx (Calder, King, 1974; Calder, Dawson, 1978). И другие нелетающие бескилевые (например, эму Dromaius novaehollandiae и страусы Struthionidae) также показывают низкие значения базального метаболизма по сравнению с другими птицами (Maloney, Dawson, 1993). И самые низкие показатели температуры тела у птиц были зарегистрированы у нелетающих бескилевых и пингвинов (Clarke, Rothery, 2008).
Поскольку птичья эндотермия связывается многими авторами с мышечной гиперплазией, с приобретением бипедального передвижения у теропод, в течение последних пяти десятилетий было выдвинуто множество эволюционных гипотез в отношении эндотермии у динозавров не птичьей линии, тем более что другие характеристики, которые ранее связывали с птичьей физиологией, были идентифицированы как присутствующие во всей кладе Dinosauria (Norell, Xu, 2005; O’Connor, Claessens, 2005; Claessens et al., 2009; Xu et al., 2010; Farmer, 2015). Многие исследователи изначально считали, что скорость метаболизма у динозавров должна быть низкой, если предположить, что их большие размеры и предполагаемая высокая инсуляция были достаточны для обеспечения стабильной температуры тела без метаболической теплопродукции (Benton, 1979; Paladino et al., 1990; Seebacher, 2003). Позднее высокие значения базального метаболизма были предсказаны несколькими исследованиями для не птичьих динозавров, особенно крупных теропод (Pontzer et al., 2009; Grady et al., 2014; Werner, Griebeler, 2014; Legendre et al., 2016). Однако это не обязательно означает, что не птичьи динозавры достигают такого высокого уровня базального метаболизма при использовании физиологической стратегии такой же, как у современных птиц, так как аналогичные значения базального метаболизма могут быть достигнуты многими различными способами. По этой причине обычно предполагаемая эндотермия не птичьих динозавров в настоящее время не может быть связана с какой-либо конкретной физиологической стратегией.
Совсем недавно вышла статья, в которой высказывалось предположение о том, что появление птиц (теплокровных летающих динозавров) было связано с эволюционным уменьшением их размеров (Rezende et al., 2020). В этой статье представлен анализ большого количества данных о современных и вымерших эктотермах и эндотермах. По мнению автора, уменьшение размеров динозавров (опуская детали) способствовало усилению их метаболизма и могло привести к переходу к эндотермии (или облегчить его). Однако имеет смысл обратить внимание на одно интересное обстоятельство, которое не было акцентировано в статье как важное: как показывает предыдущий обзор, дело далеко не только в чисто аллометрических закономерностях, но и в многочисленных качественных показателях организации биохимических процессов, обмена, анатомии, то есть в разнообразии механизмов обеспечения эндотермии. Поэтому у эктотермных рептилий меньших размеров, которые имеют более интенсивный метаболизм, чем большие рептилии, но в функциональной структуре своего метаболизма не имеют составляющей, отчетливо обеспечивающей термогенез, механическое, аллометрическое усиление метаболизма не вызовет заметного увеличения термогенеза. У эндотермов же, у которых в функциональной структуре метаболизма имеется существенный элемент термогенеза, мелкие животные (в данном случае – птицы) обладают более интенсивным метаболизмом, чем крупные, а значит, могут обладать и более интенсивным термогенезом на единицу массы. Следовательно, если уменьшение размеров у предков птиц действительно связывается с повышением метаболизма и температуры тела, то их предки, скорее всего, уже обладали повышенной теплопродукцией и были эндотермными.
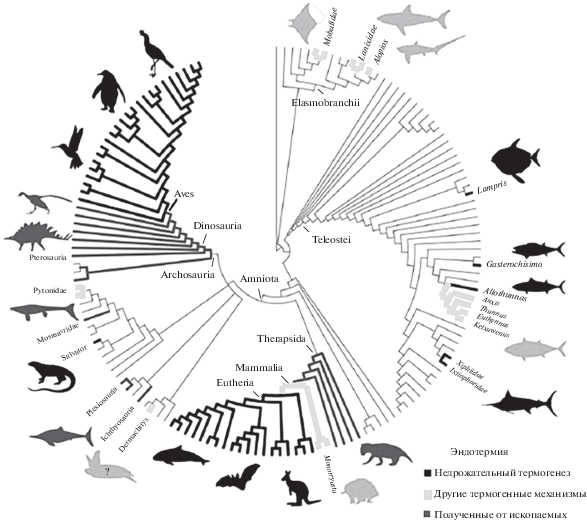
В целом взаимоотношения между разными вариантами эндотермических стратегий (при современном понимании проблемы) в различных группах позвоночных животных представлены на рисунке 14. А систематизация данных о распределении эндотермических стратегий приведена в таблице 1.
Рис. 14.
Филогения позвоночных животных, показывающая независимое появление стратегий теплопродукции, описанных в литературе как эндотермия, с таксонами, в которых эндотермия появилась хотя бы один раз и которые на рисунке выделены жирными линиями. Различают недрожательный термогенез, то есть стратегию, наиболее часто называемую эндотермией, и другие стратегии; некоторые таксоны (млекопитающие и птицы) способны достигать недрожательного термогенеза, но могут также иногда полагаться на другие механизмы выработки тепла. Ископаемые таксоны, которые были определены как потенциальные эндотермы, также помечены. Кожистая морская черепаха Dermochelys coriacia помечена знаком вопроса, так как недрожательный термогенез не был убедительно продемонстрирован у этого вида (по: Legendre, Davesne, 2020).
ЗАКЛЮЧЕНИЕ
Исходя из всего изложенного выше, можно сделать ряд важных заключений.
1. Практически во всех больших кладах позвоночных животных, начиная с разных хрящевых и костных рыб, неоднократно появлялись группы с повышенной температурой тела. Причем механизмы эндогенного повышения температуры тела во многих случаях различные, то есть единых механизмов у эндотермии нет. Общее в них – сама суть – стремление повысить температуру тела. Мало того, это стремление проявляется не только с применением эндогенного тепла (эндотермия), но и в ряде направлений развития – с применением внешнего, экзогенного тепла (эктотермия). Этот факт является в определенном смысле подтверждением того, что стратегическое направление, проявляющееся во всех группах позвоночных, – это стремление к повышению температуры тела, к сохранению повышенной температуры тела в течение более или менее продолжительного времени в сутках и в году. Причем любыми доступными средствами! У эктотермов для этого используется богатый арсенал поведенческих регуляторных реакций, а у эндотермов – разные варианты биохимических и физиологических преадаптаций, на базе которых развиваются разнообразные экзотермические проявления (термогенез) и варианты их контроля и регуляции, сохранения произведенного тепла или отдачи избытков тепла в зависимости от ситуации.
2. Эндотермия, теплокровность, как единое биологические проявление существует только как стратегическое функциональное направление, проявление того самого эволюционного принципа стабилизации высокой температуры тела у позвоночных, но не как единое филогенетическое эволюционное направление развития, прежде всего, потому что в разных кладах оно реализуется различными способами.
3. Постепенная стабилизация в эволюции позвоночных животных высокой температуры тела в течение хотя бы части суток в основном за счет внешних источников тепла (в наиболее ярком и развитом выражении – как у современных рептилий) или постоянно в основном за счет эндогенной теплопродукции (в наиболее ярком и развитом выражении – как у современных плацентарных млекопитающих и птиц) является для позвоночных не побочным продуктом эволюционного развития, не постепенно развившейся в результате адаптивного отбора потребностью, а одной из изначальных первопричин и мощной направляющей, канализирующей силой, стратегией их эволюции. При этом принцип стабилизации высокой температуры тела в эволюции позвоночных животных наиболее ярко проявляется при сравнении не видов и родов, а в ряду основных морфофизиологических типов: рыбы → амфибии → рептилии → эндотермы (птицы и млекопитающие), когда при переходе от одного морфофизиологического типа организации к другому в эволюции происходят серьезные ароморфные перестройки (Черлин, 2017). Причем эти ароморфные морфофизиологические перестройки происходят не хаотически, а достаточно канализировано, направленно: в эволюции у позвоночных животных проявляются, развиваются и закрепляются именно те комплексы морфофизиологических признаков, которые призваны оптимизировать деятельность различных важных для функционирования организма биохимических соединений, а также призваны реализовывать потребные для этой оптимизации закономерности, что нами было уже неоднократно показано (Черлин, 2012, 2017; Cherlin, 2015).
После этих выводов, попробуем по возможности кратко и максимально четко ответить на два логичных, своевременных, заключительных и очень важных вопроса:
– Зачем позвоночным животным так нужна повышенная температура тела?
Повышенная температура тела нужна животным, прежде всего, потому что температуры около 40° намного ближе к оптимальному диапазону работы важнейших биохимических соединений в организме (в частности ферментов), чем те условия внешней среды, в которой животные живут. Без этих соединений жизнедеятельность вообще невозможна, а оптимальный температурный диапазон для ферментов – это тот, в котором реакции с ферментами происходят с наибольшей скоростью и с наименьшими энергетическими затратами. Кроме того, в диапазоне температур 37–40° в организме уравновешиваются анаболические и катаболические процессы, ускоряется и оптимизируется деятельность нервной системы, позволяя ей усложнять работу, направленную в первую очередь на оперативную адаптацию к внешней среде, усиливается энергетическая обеспеченность активности и повышается уровень базального метаболизма, кардинально улучшая всем этим качество активности, создавая таким животным безусловные экологические преимущества (Черлин, 2017). Есть и другие преимущества высокой температуры тела, но перечисленных – уже достаточно. Именно поэтому стремление повысить температуру тела является важным для жизнедеятельности животных, причем на всех уровнях – от биохимических соединений до организма в целом.
– Почему стабильно высокая температура тела так нужна именно позвоночным животным?
Уже много лет назад было показано, что у многочисленных групп животных: и беспозвоночных, и позвоночных – при активности регистрируется примерно один и тот же уровень температуры тела – 36–40° (Стрельников, 1948). Совершенно очевидно, что высокие температуры тела важны для многих животных. Но, тем не менее, мы говорим о том, что высокая температура тела эволюционно важна в первую очередь именно позвоночным животным, потому что именно для них мы можем констатировать, что стремление повысить и стабилизировать температуру тела на высоком уровне становится важнейшей канализирующей силой их эволюции (Черлин, 2012, 2017; Cherlin, 2015). Так почему же именно у позвоночных животных эта направленность стала такой важной, лежащей в основе их эволюционных преобразований?
У позвоночных животных, в отличие от беспозвоночных, существует эволюционная направленность на развитие, раскрытие и использование потенциальных возможностей индивидуального животного в полезном, экономящем энергию активности и конкурентоспособном ключе. Поэтому, наряду с другими физиологическими системами организма, возможно, опережающее значение имело эволюционное развитие нервной системы, особенно – переднего мозга, что способствовало существенному усложнению индивидуального поведения. Но, скорее всего, такое грандиозное усложнение нервной системы и поведения возможно только в случае, когда скорость прохождения сигналов (нервных импульсов) и скорость совершения отдельных операций становятся достаточно высокими, чтобы обеспечить оперативное функционирование чрезвычайно сложной функциональной системы, а это, в свою очередь, возможно в природе лишь при высокой температуре. Именно поэтому А.В. Рюмин считал, что прогрессивное развитие животных возможно только при достаточно высокой температуре тела (Рюмин, 1939), с чем мы совершенно согласны.
Следовательно, один из важнейших факторов, определяющих значение высокой температуры тела именно для позвоночных животных, при постепенном, эволюционном усложнении уровня их организации – это необходимость мощного развития нервной системы и индивидуального поведения.
Кроме того, у позвоночных животных имелся ряд биохимических преадаптаций, которые раскрывают новые возможности для активности, для освоения новых сред и т.п., а также позволяют активно и направленно использовать высокие температуры тела для направленного же прогрессивного морфофизиологического эволюционного развития (Черлин, 2017).
У беспозвоночных животных в процессе эволюции можно наблюдать появление групп животных, которые тем или иным способом могли достигать определенных успехов в решении отдельных задач. Примером может служить высокий уровень своеобразного развития нервной системы и поведения у головоногих моллюсков (Finn et al., 2009; Albertin et al., 2015), но они не были способны на сложное, комплексное, многовекторное эволюционное развитие, в отличие от позвоночных, обладавших к тому же удачным универсальным планом строения, допускающим такое перспективное развитие. Также в качестве примера можно привести общественных насекомых, в частности муравьев. Некоторые исследователи считают, что у них более или менее полноценные функции организма исполняет муравейник как единое целое. А отдельные муравьи – лишь элементы, его составляющие. Тогда получается, что сложность и многообразие связей и структуры целой сложной функциональной системы организма раскладываются на отдельных муравьев, и внутри крохотных, дискретных задач, решаемых каждой отдельной особью, скорости прохождения сигналов и совершения отдельных операций в этих масштабах вполне достаточны даже при низких температурах (Hemmings, Andrew, 2016).
Думаем, что наш ответ на оба вопроса не исчерпывает всех возможных вариантов, но уже этого достаточно, чтоб понять главное: у позвоночных животных были веские функциональные и прочие причины, направляющие их эволюционное развитие на повышение и стабилизацию температуры тела в диапазоне 37–40° любыми доступными и допустимыми способами.
Список литературы
Ананичев А.В. Пищеварительные ферменты рыб и сезонная изменчивость их активности // Биохимия. 1959. Т. 24. № 6. С. 1033–1040.
Анисимова И.М., Лавровский В.В. Ихтиология. М.: Высшая школа, 1983. 255 с.
Биохимия / Ред. Е.С. Северин. М.: ГЭОТАР-Медиа, 2004. 784 с.
Голованов В.К. Температурные критерии жизнедеятельности пресноводных рыб. М.: Полиграф-Плюс, 2013. 300 с.
Гуржий А.Н. Ваш террариум. М.: Аквариум-Принт, 2006. 144 с.
Израэль А.И. Значение факторов высокогорья в физиологии человека и животных // Тр. САГУ. Сер. зоол. Ташкент: САГУ, 1936а. Вып. 24. 27 с.
Израэль А.И. Физиология лошади на горных перевалах Тянь-Шаня // Тр. САГУ. Сер. зоол. Ташкент: САГУ, 1936б. Вып. 28. 22 с.
Калабухов Н.И. Летняя спячка сусликов (Citellus fulvus Licht. и С. pygmaeus Раll.) // Тр. лаб. эксперим. биол. Моск. зоопарка. 1929. Т. 5. С. 163–176.
Калабухов Н.И. Сохранение энергетического баланса организма как основа процесса адаптации // Журн. общ. биол. 1946a. Т. 7. № 6. С. 419–434.
Калабухов Н.И. Спячка животных. М.: Советская наука, 1946б. 184 с.
Колтун Е.М., Русин В.И. Некоторые аспекты терморегуляции у птиц за влияния повышенной и пониженной температуры окружающей среды // Науковий вісник ЛНУВМБТ ім. С.З. Ґжицького. 2016. Ч. 1. Т. 18. № 1 (65). С. 61–68.
Коштоянц X.С. Основы сравнительной физиологии. Т. 1. М., Л.: АН СССР, 1950. 523 с.
Коштоянц X.С., Коржуев П.А. Материалы к сравнительной физиологии пищеварительных ферментов. I. Трипсин холоднокровных и теплокровных животных, температурный оптимум и теплоустойчивость их // Зоол. журн. 1934. Т. 13. № 1. С. 71–82.
Кузьмина В.В. Общие закономерности мембранного пищеварения у рыб и его адаптивная перестройка: Автореф. дис. … д-ра биол. наук. М.: Инст. эволюц. морфол. и экол. живот. АН СССР, 1986. 39 с.
Орлов Н.Л. Факультативная эндогенная терморегуляция питонов (Boidae, Pythoninae) и корреляция между эндотермными реакциями и поведенческой терморегуляцией // Зоол. журн. 1986. Т. 65. № 4. С. 551–559.
Рюмин А.В. Температурная чувствительность позвоночных животных и биологический путь происхождения теплокровных форм // Сб. студ. научных работ МГУ. 1939. Вып. 6. С. 55–84.
Рюмин А.В. Значение температуры в онтогенезе и филогенезе животных // Успехи соврем. биол. 1940. Т. 12. № 3. С. 504–515.
Слоним А. Д. Животная теплота и ее регуляция в организме млекопитающих. Л.: Наука, 1952. 327 с.
Слоним А.Д. Химическая терморегуляция и структура эффекторной части терморегуляционного рефлекса // Физиол. журн. СССР им. И.М.Сеченова. 1964. Т. 50. № 8. С. 117–125.
Слоним А.Д. Экологическая физиология животных. М.: Высшая школа, 1971. 448 с.
Слоним А.Д. Учение о физиологических адаптациях // Экологическая физиология животных / Ред. А.Д. Слоним. Л.: Наука, 1979. С. 79–182.
Слоним А.Д. Температура среды обитания и эволюция температурного гомеостаза // Физиология терморегуляции / Ред. К.П. Иванов. Л.: Наука, 1984. С. 378–440.
Слоним А.Д. Эволюция терморегуляции. Л.: Наука, 1986. 76 с.
Слоним А.Д., Щербакова О.П. Материалы к сравнительной физиологии терморегуляции. Химическая терморегуляция у взрослых гамадрилов // Бюл. ВИЭМ. 1935а. № 11–12. С. 16–17.
Слоним А.Д., Щербакова О.П. Материалы к сравнительной физиологии терморегуляции. Химическая терморегуляция у обезьян макак // Бюл. ВИЭМ. 1935б. № 11–12. С. 17–18.
Слоним А.Д., Щербакова О.П. Материалы к сравнительной физиологии терморегуляции. К механизму терморегуляции у хищников // Бюл. ВИЭМ. 1935в. № 11–12. С. 18–19.
Сравнительная физиология животных. Т. 2 / Ред. Л. Проссер. М.: Мир, 1977. 576 с.
Стрельников И.Д. Физиологические основы экологии грызунов // Сб. ВИЗР. 1933. № 7. С. 72–76.
Стрельников И.Д. Значение теплового обмена в экологии роющих грызунов (к вопросу о факторах массового размножения и массовой гибели мышевидных грызунов) // Изв. АН СССР. Сер. биол. 1940. № 2. С. 276–298.
Стрельников И.Д. Значение солнечной радиации и взаимодействия физико-географических факторов в экологии животных различных ландшафтов (к вопросу о значении физической географии в экологии животных) // Пробл. физ. географ. 1948. № 13. С. 145–155.
Физиология терморегуляции / Ред. К.П. Иванов. Л.: Наука, 1984. 470 с.
Целлариус А.Ю., Черлин В.А., Меньшиков Ю.Г. Предварительное сообщение о работах по изучению биологии Varanus griseus (Reptilia, Varanidae) в Средней Азии // Герпетологические исследования. Л.: ЛИСС, 1991. С. 61–103.
Черлин В.А. Стабилизация высокой температуры тела в эволюции позвоночных животных // Успехи соврем. биол. 1990. Т. 109. № 3. С. 440–452.
Черлин В.А. Организация процесса жизни как системы. СПб.: Русско-Балтийский информационный центр “БЛИЦ”, 2012. 124 с.
Черлин В.А. Рептилии: температура и экология. Saarbrücken: LAP, 2014. 442 с.
Черлин В.А. Современный взгляд на термобиологию с позиции изучения рептилий // Биосфера. 2016. Т. 8. № 1. С. 47–67.
Черлин В.А. Значение изменений интенсивности сопряженного и несопряженного дыхания митохондрий в эволюции позвоночных животных // Успехи соврем. биол. 2017. Т. 137. № 5. С. 479–497.
Черлин В.А., Леонтьева О.А., Червяцова О.Я. Александр Владимирович Рюмин – забытый биолог // Принципы экологии. 2016. Т. 5. № 4 (20). С. 57–89.
Чиркин А.А., Данченко Е.О. Биохимия. М.: Медицинская литература, 2010. 624 с.
Шмидт-Ниельсен К. Физиология животных. Приспособление и среда. Кн. 1. М.: Мир, 1982. 416 с.
Эстерле О. Почему жизнь концентрируется при 37°С? 2000. http://scisne.net/a-451.
Ярцев В.В., Куранова В.Н. О возможности гибридизации приморского, Salamandrella tridactyla, и сибирского, S. keyserlingii, углозубов (Amphibia: Caudata, Hynobiidae) // Вестн. Томск. гос. унив. Биология. 2013. № 3 (23). С. 83–90.
Albertin C.B., Simakov O., Mitros T. et al. The octopus genome and the evolution of cephalopod neural and morphological novelties // Nature. 2015. V. 524. P. 220–224.
Alexander R.L. Evidence of brain-warming in the mobulid rays, Mobula tarapacana and Manta birostris (Chondrichthyes: Elasmobranchii: Batoidea: Myliobatiformes) // Zool. J. Linn. Soc. 1996. V. 118. P. 151–164.
Angilletta M.J., Cooper B.S., Schuler M.S., Boyles J.G. The evolution of thermal physiology in endotherms // Front. Biosci. 2010. V. 2. P. 861–881.
Atkins A., Dean M.N., Habegger M.L. et al. Remodeling in bone without osteocytes: billfish challenge bone structure–function paradigms // PNAS USA. 2014. V. 111. P. 16047–16052.
Bal N.C., Periasamy M. Uncoupling of sarcoendoplasmic reticulum calcium ATPase pump activity by sarcolipin as the basis for muscle non-shivering thermogenesis // Phil. Trans. R. Soc. Lond. B Biol. Sci. 2020. V. 375. P. 20190135.
Balsai M. Making it hot for the microbes: why reptiles may “desire” to be warmer when ill // Bull. Chicago Yerpetol. Soc. 1986. V. 22. № 3–4. P. 79–83.
Bargelloni L., Marcato S., Patarnello T. Antarctic fish hemoglobins: evidence for adaptive evolution at subzero temperature // PNAS USA. 1998. V. 95. P. 8670–8675.
Bartholomew G.A. Physiological control of body temperature // Biology of the Reptilia. V. 12. Physiology C. Physiological ecology / Eds C. Gans, F.H. Pough. N.Y.: Academic Press, 1982. P. 167–211.
Benedict F.G. The physiology of large reptiles with special reference to the heat production of snakes, tortoises, lizards and alligators. V. 425. Washington: Carnegie Institution, 1932. P. 539.
Bennett A.F., Hicks J.W., Cullum A.J. An experimental test of the thermoregulatory hypothesis for the evolution of endothermy // Evolution. 2000. V. 54. № 5. P. 1768–1773.
Benton M.J. Ectothermy and the success of dinosaurs // Evolution. 1979. V. 33. P. 983–997.
Bernal D., Sepulveda C.A. Evidence for temperature elevation in the aerobic swimming musculature of the common thresher shark, Alopias vulpinus // Copeia. 2005. № 1. P. 146–151.
Bernal D., Dickson K.A., Shadwick R.E., Graham J.B. Review: analysis of the evolutionary convergence for high performance swimming in lamnid sharks and tunas // Comp. Biochem. Physiol. A Mol. Integr. Physiol. 2001. V. 129. P. 695–726.
Bernard A., Lécuyer C., Vincent P. et al. Regulation of body temperature by some Mesozoic marine reptiles // Science. 2010. V. 328. № 5984. P. 1379–1382.
Bernheim H.A., Kluger M.J. Fever and antipyresis in lizard Dipsosaurus dorsalis // Am. J. Physiol. 1976. V. 231. № 1. P. 198–203.
Block B.A. Structure of the brain and eye heater tissue in marlins, sailfish, and spearfishes // J. Morphol. 1986. V. 190. P. 169–189.
Block B.A. Endothermy in fish: thermogenesis, ecology and evolution // Biochemistry and molecular biology of fishes / Eds P.M. Hochachka, T. Mommsen. Amsterdam: Elsevier, 1991. P. 269–311.
Block B.A. Thermogenesis in muscle // Annu. Rev. Physiol. 1994. V. 56. P. 535–577.
Block B.A., Carey F.G. Warm brain and eye temperatures in sharks // J. Comp. Physiol. B. 1985. V. 156. P. 229–236.
Block B.A., Finnerty J.R. Endothermy in fishes: a phylogenetic analysis of constraints, predispositions, and selection pressures // Environ. Biol. Fishes. 1994. V. 40. 283–302.
Block B.A., Finnerty J.R., Stewart A.F., Kidd J. Evolution of endothermy in fish: mapping physiological traits on a molecular phylogeny // Science. 1993. V. 260. P. 210–214.
Bourke J.M., Ruger P.W., Ridgely R.C. et al. Breathing life into dinosaurs: tackling challenges of soft-tissue restoration and nasal airflow in extinct species // Anat. Rec. 2014. V. 297. P. 2148–2186.
Bostrom B.L., Jones T.T., Hastings M., Jones D.R. Behaviour and physiology: the thermal strategy of leatherback turtles // PLoS One. 2010. V. 5. P. e13925.
Brashears J.A., DeNardo D.F. Revisiting python thermogenesis: brooding Burmese pythons (Python bivittatus) cue on body, not clutch, temperature // J. Herpetol. 2013. V. 47. P. 440–444.
Brattstrom B.H., Collins R. Thermoregulation // Int. TurtleTortoise Soc. J. 1972. V. 16. № 5. P. 15–19.
Brice P.H. Thermoregulation in monotremes: riddles in a mosaic // Aust. J. Zool. 2009. V. 57. P. 255–263.
Brocklehurst R.J., Schachner E.R., Sellers W.I. Vertebral morphometrics and lung structure in non-avian dinosaurs // R. Soc. Open. Sci. 2018. V. 5. P. 180983.
Burness G., Diamond J., Flannery T. Dinosaurs, dragons, and dwarfs: the evolution of maximal body size // PNAS USA. 2001. V. 98. № 25. P. 14518–14523.
Burton T., Killen S.S., Armstrong J.D., Metcalfe N.B. What causes intraspecific variation in resting metabolic rate and what are its ecological consequences? // Proc. Biol. Sci. 2011. V. 278. P. 3465–3473.
Calder W.A., King J.R. Thermal and caloric relations of birds // Avian biology / Eds D.S. Farner, J.R. King. N.Y.: Academic Press, 1974. P. 259–413.
Calder W.A., Dawson T.J. Resting metabolic rates of ratite birds: the kiwis and the emu // Comp. Biochem. Physiol. 1978. V. 60A. P. 479–481.
Canavan R.R., Field D.J., Zelenitsky D.K. et al. Eggshell clumped isotope temperatures: implications for dinosaur thermoregulation // 5th Int. Clumped Isotope Workshop, Abstr. (St. Petersburgh, Florida, January 6–9, 2016). 2016. P. 6.
Cannon B., Nedergaard J. Brown adipose tissue: function and physiological significance // Physiol. Rev. 2004. V. 84. P. 277–359.
Carey F.G. A brain heater in the swordfish // Science. 1982. V. 216. P. 1327–1329.
Carey F.G., Teal J.M., Kanwisher J.W. et al. Warm-bodied fish // Am. Zoologist. 1971. V. 11. P. 137–143.
Cherlin V.A. The biochemical basis of staging in evolution of vertebrates // Some important aspects of thermal bio-logy of reptiles. Saarbrücken: LAP, 2015. P. 140–192.
Chinsamy A., Hurum J.H. Bone microstructure and growth patterns of early mammals // Acta Palaeontol. Pol. 2006. V. 51. P. 325–338.
Chinsamy-Turan A. The microstructure of dinosaur bone: deciphering biology with fine-scale techniques. Baltimore, MD: Johns Hopkins Univ. Press, 2005. 195 p.
Claessens L.P.A.M., O’Connor P.M., Unwin D.M. Respiratory evolution facilitated the origin of pterosaur flight and aerial gigantism // PLoS One. 2009. V. 4. P. e4497.
Clarke A., Rothery P. Scaling of body temperature in mammals and birds // Funct. Ecol. 2008. V. 22. P. 58–67.
Clarke A., Pörtner H.-O. Temperature, metabolic power and the evolution of endothermy // Biol. Rev. 2010. V. 85. P. 703–727.
Cloudsley-Thompson J.L. Physiological thermoregulation in the spurred tortoise (Testudo graeca) // J. Natur. Hist. 1974. V. 8. № 5. P. 577–587.
Cooper J.E., Jackson O.F. Miscellaneous diseases // Diseases of the Reptilia / Eds J.E. Cooper, O.F. Jackson. London: Academic Press, 1981. P. 488–504.
Crawshaw L.I., Moffitt B.P., Lemons D.E., Downey J.A. The evolutionary development of vertebrate thermoregulation // Am. Scientist. 1981. V. 69. № 5. P. 543–550.
Crompton A.W., Taylor C.R., Jagger J.A. Evolution of homeothermy in mammals // Nature. 1978. V. 272. P. 333–336.
Davenport J., Fraher J., Fitzgerald E. et al. Fat head: an analysis of head and neck insulation in the leatherback turtle (Dermochelys coriacea) // J. Exp. Biol. 2009. V. 212. P. 2753–2759.
Davenport J., Jones T.T., Work T.M., Balazs G.H. Topsy-turvy: turning the counter-current heat exchange of leatherback turtles upside down // Biol. Lett. 2015. V. 11. P. e20150592.
Davesne D., Meunier F.J., Friedman M. et al. Histology of the endothermic opah (Lampris sp.) suggests a new structure–function relationship in teleost fish bone // Biol. Lett. 2018. V. 14. P. 20180270.
Davesne D., Meunier F.J., Schmitt A.D. et al. The phylogenetic origin and evolution of acellular bone in teleost fishes: insights into osteocyte function in bone metabolism // Biol. Rev. 2019. V. 94. P. 1338–1363.
Dawson W.R. On the physiological significance of the preferred body temperatures of reptiles // Perspectives of biophysical ecology. Ecological studies / Eds D.M. Gates, R.B. Schmerl. N.Y.: Springer-Verlag, 1975. V. 12. P. 443–473.
De Ricqlès A., Meunier F.J., Castanet J., Francillon-Vieillot H. Comparative microstructure of bone // Bone matrix and bone specific products. V. 3. Bone / Ed. B.K. Hall. Boca Raton, FL: CRC Press, 1991. P. 1–78.
Dickson K.A., Graham J.B. Evolution and consequences of endothermy in fishes // Physiol. Biochem. Zool. 2004. V. 77. P. 998–1018.
Dutton R.H., Fitzpatrick L.C. Metabolic compensation to metabolic temperatures in the rusty lizard, Sceloporus olivaceus // Compar. Biochem. Physiol. 1975. V. A51. № 2. P. 309–318.
Eagle R.A., Tütken T., Martin T.S. et al. Dinosaur body temperatures determined from isotopic (13C–18O) ordering in fossil biominerals // Science. 2011. V. 333. № 6041. P. 443–445.
Eastick D.L., Tattersall G.J., Watson S.J. et al. Cassowary casques act as thermal windows // Sci. Rep. 2019. V. 9. P. e1966.
Else P.L., Hulbert A.J. An allometric comparison of the mitochondria of mammalian and reptilian tissues: the implications for the evolution of endothermy // J. Comp. Physiol. B. 1985. V. 156. P. 3–11.
Emre Y., Hurtaud C., Ricquier D. et al. Avian UCP: the killjoy in the evolution of the mitochondrial uncoupling proteins // J. Mol. Evol. 2007. V. 65. P. 392–402.
Engbretson G.A., Livezey R.L. The effects of aggressive display on body temperature in the fence lizard Sceleporus occidentalis occidentalis Baird and Girard // Physiol. Zool. 1972. V. 45. P. 247–254.
Fair W., Ackman R.G., Mrosovsky N. Body temperature of Dermochelys coriacea: warm turtle from cold water // Science. 1972. V. 177. P. 791–793.
Farmer C.G. The evolution of unidirectional pulmonary airflow // Physiology. 2015. V. 30. P. 260–272.
Ferrón H.G. Regional endothermy as a trigger for gigantism in some extinct macropredatory sharks // PLoS One. 2017. V. 12. P. e0185185.
Finn J.K., Tregenza T., Norman M.D. Defensive tool use in a coconut-carrying octopus // Curr. Biol. 2009. V. 19. P. R1069–R1070.
Firth B.T., Ralph C.L., Boardman T.J. Independent effects of the pineal and a bacterial pyrogen in behavioural thermoregulation in lizards // Nature. 1980. V. 285. № 5764. P. 399–400.
Franck J.P.C., Slight-Simcoe E., Wegner N.C. Endothermy in the smalleye opah (Lampris incognitus): a potential role for the uncoupling protein sarcolipin // Comp. Biochem. Physiol. Mol. Integr. Physiol. 2019. V. 233. P. 48–52.
Galvao P.E., Tarasantchi J., Guertzenstein P. Heat production of tropical snakes // Amer. J. Physiol. 1965. V. 209. № 3. P. 501–506.
Gaudry M.J., Jastroch M., Treberg J.R. et al. Inactivation of thermogenic UCP1 as a historical contingency in multiple placental mammal clades // Sci. Adv. 2017. V. 3. P. e1602878.
Geiser F., Stawski C., Wacker C.B., Nowack J. Phoenix from the ashes: fire, torpor, and the evolution of mammalian endothermy // Front. Physiol. 2017. V. 8. P. 842.
Gerkema M.P., Davies W.I.L., Foster R.G. et al. The nocturnal bottleneck and the evolution of activity patterns in mammals // Proc. Biol. Sci. 2013. V. 280. P. 20130508.
Goldby F., Hicks C.S., O’Connor W.J., Sinclair D.A. A comparison of the skin temperature and skin circulation of naked whites and Australian aborigines exposed to similar environmental changes // Austral. J. Exp. Biol. Med. Sci. 1938. V. 16. P. 29–37.
Gould S.J. The exaptive excellence of spandrels as a term and prototype // PNAS USA. 1997. V. 94. № 10. P. 750–755.
Gould S.J. Sex, drugs, disasters, and the extinction of dinosaurs // 75 Readings Plus / S. Buscemi, C. Smith. N.Y.: McGraw-Hill, 1998. P. 448–454.
Grady J.M., Enquist B.J., Dettweiler-Robinson E. et al. Dinosaur physiology. Evidence for mesothermy in dinosaurs // Science. 2014. V. 344. P. 1268–1272.
Graham J.B., Dickson K.A. The evolution of thunniform locomotion and heat conservation in scombrid fishes: new insights based on the morphology of Allothunnus fallai // Zool. J. Linn. Soc. 2000. V. 129. P. 419–466.
Graham J.B., Dickson K.A. Anatomical and physiological specialization for endothermy // Fish physiology. Tuna: physiology, ecology, and evolution. V. 19 / Eds B.A. Block, E.D. Stevens. San Diego, CA: Academic Press, 2001. P. 121–165.
Graham J.B., Koehrn F.J., Dickson K.A. Distribution and relative proportions of red muscle in scombrid fishes: consequences of body size and relationships to locomotion and endothermy // Can. J. Zool. 1983. V. 61. P. 2087–2096.
Grant T.R., Dawson T.J. Temperature regulation in the platypus, Ornithorhynchus anatinus: production and loss of metabolic heat in air and water // Physiol. Zool. 1978. V. 51. P. 315–332.
Greer A.E., Lazell J.D., Wright R.M. Anatomical evidence for a counter-current heat exchanger in the leatherback turtle (Dermochelys coriacea) // Nature. 1973. V. 244. P. 181.
Grigg G.C., Beard L.A., Augee M.L. The evolution of endothermy and its diversity in mammals and birds / Physiol. Biochem. Zool. 2004. V. 77. P. 982–997.
Hammel H.T., Eisner R.W., LeMessurier D.H. et al. Thermal and metabolic responses of the Australian Aborigine exposed to moderate cold in summer // J. Appl. Physiol. 1959. V. 14. P. 605–615.
Harlow P., Grigg G. Shivering thermogenesis the production of heat, especially within the animal body thermogenesis in brooding diamond python, Python spilotes spilotes // Copeia. 1984. V. 4. P. 959–965.
Harlow H.J., Purwandana D., Jessop T.S., Phillips J.A. Body temperature and thermoregulation of Komodo dragons in the field // J. Therm. Biol. 2010. V. 35. P. 338–347.
Hayward J.S., Lisson P.A. Evolution of brown fat: its absence in marsupials and monotremes // Can. J. Zool. 1992. V. 70. P. 171–179.
Hemmings Z., Andrew N. Effects of microclimate and species identity on body temperature and thermal tolerance of ants (Hymenoptera: Formicidae): body temperature and thermal tolerance of ants // Austral Entomol. 2016. V. 56. P. 104–114.
Hillenius W.J. The evolution of nasal turbinates and mammalian endothermy // Paleobiology. 1992. V. 18. P. 17–29.
Hohtola E. Shivering thermogenesis in birds and mammals // Life in the cold: evolution, mechanisms, adaptation, and application. Proc. 12th Int. Hibernat. Symp. (Vancouver, 25 July–1 August, 2004) / Eds B.M. Barnes, H.V. Carey. Fairbanks, AK: Institute of Arctic Biology, University of Alaska, 2004. P. 241–252.
Hughes D.A., Jastroch M., Stoneking M., Klingenspor M. Molecular evolution of UCP1 and the evolutionary history of mammalian non-shivering thermogenesis // BMC Evol. Biol. 2009. V. 9. Art. 4.
Hutchison V.H., Dowling H.D., Vinegar A. Thermoregulation in a brooding female Indian python, Python molurus // Science. 1966. V. 151. P. 694–696.
Jastroch M., Seebacher F. Importance of adipocyte browning in the evolution of endothermy // Phil. Trans. R. Soc. Lond. B Biol. Sci. 2020. V. 375. P. 20190134.
Jastroch M., Withers K.W., Taudien S. et al. Marsupial uncoupling protein 1 sheds light on the evolution of mammalian nonshivering thermogenesis // Physiol. Genomics. 2008. V. 32. P. 161–169.
Johnson C.R. Thermoregulation in crocodilians. I. Head-body temperature control in the papuan – New Guinean Crocodiles, Crocodilus novoaguineae and Crocodilus porosus // Comp. Biochem. Physiol. A Comp. Physiol. 1974. V. 49. № 1A. P. 3–28.
Johnson C.R., Webb G.J.W., Johnson C. Thermoregulation in pythons III. Thermal ecology and behavior of the blackheaded rock python, Aspidites melanocephalus // Herpetologica. 1975. V. 81. № 3. P. 326–332.
Kabat A.P., Rose R.W., Harris J., West A.K. Molecular identification of uncoupling proteins (UCP2 and UCP3) and absence of UCP1 in the marsupial Tasmanian bettong, Bettongia gaimardi // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 2003. V. 134. P. 71–77.
Kapusta A., Suh A., Feschotte C. Dynamics of genome size evolution in birds and mammals // PNAS USA. 2017. V. 114. P. E1460–E1469.
Katz S.L. Design of heterothermic muscle in fish // J. Exp. Biol. 2002. V. 205. P. 2251–2266.
Klingenspor M., Fromme T., Hughes D.A. et al. An ancient look at UCP1 // Biochim. Biophys. Acta. 2008. V. 777. P. 637–641.
Kolb C., Scheyer T.M., Veitschegger K. et al. Mammalian bone palaeohistology: a survey and new data with emphasis on island forms // Peer J. 2015. V. 3. P. e1358.
Köhler M., Marín-Moratalla N., Jordana X., Aanes R. Seasonal bone growth and physiology in endotherms shed light on dinosaur physiology // Nature. 2012. V. 487. P. 358–361.
Lamarre-Picquot P. Troisieme memoirs sur l’incubation et quatre phenomenes observes ches les ophidiens // Comp. Rend., Acad. Sci., Paris. 1842. V. 14. P. 164.
Legendre L.J., Davesne D. The evolution of mechanisms involved in vertebrate endothermy // Phil. Trans. R. Soc. B. 2020. V. 375 (1793). P. e20190136.
Legendre L.J., Guénard G., Botha-Brink J., Cubo J. Palaeohistological evidence for ancestral high metabolic rate in archosaurs // Syst. Biol. 2016. V. 65. P. 989–996.
Licht P. The effect of temperature on hart rates of lizards during rest and activity // Physiol. Zool. 1964. V. 38. P. 129–137.
Licht P., Basu S.L. Influence of temperature on lizard testes // Nature. 1967. V. 213. P. 672–674.
Linthicum D.S., Carey F.G. Regulation of brain and eye temperatures by the bluefin tuna // Comp. Biochem. Physiol. A Comp. Physiol. 1972. V. 43. P. 425–433.
Lovegrove B.G. A phenology of the evolution of endothermy in birds and mammals // Biol. Rev. 2017. V. 92. P. 1213–1240.
Maloney S.K., Dawson T.J. Sexual dimorphism in basal metabolism and body temperature of a large bird, the emu // Condor. 1993. V. 95. P. 1034–1037.
Martin C.J. Thermal adjustment and respiratory exchange in monotremes and marsupials. A study in the development of homœothermism. L.: R. Soc. Lond., 1903. P. 1–37.
McCafferty D.J., Gilbert C., Thierry A.-M. et al. Emperor penguin body surfaces cool below air temperature // Biol. Lett. 2013. V. 9. P. e20121192.
McNab B.K. The influence of body size on the energetics and distribution of fossorial and burrowing mammals // Ecology. 1979. V. 60. P. 1010–1021.
McNab B.K. Physiological convergence amongst ant-eating and termite-eating mammals // J. Zool. 1984. V. 203. P. 485–510.
Mezentseva N.V., Kumaratilake J.S., Newman S.A. The brown adipocyte differentiation pathway in birds: an evolutionary road not taken // BMC Biol. 2008. V. 6. Art. 17.
Miklouho-Maclay N.D. Temperature of the body of Echidna hystrix Cuv. // Proc. Linn. Soc. New South Wales. 1884. V. 8. P. 425–426.
Miya M., Friedman M., Satoh T.P. et al. Evolutionary origin of the Scombridae (tunas and mackerels): members of a Paleogene adaptive radiation with 14 other pelagic fish families // PLoS One. 2013. V. 8. P. e73535.
Morrissette J.M., Franck J.P.G., Block B.A. Characterization of ryanodine receptor and Ca2+-ATPase isoforms in the thermogenic heater organ of blue marlin (Makaira nigricans) // J. Exp. Biol. 2003. V. 206. P. 805–812.
Muchlinski A.E., Stoutenburgh R.I., Hogan J.M. Fever response in laboratory-maintained and free-ranging chuckwallas (Sauromalus obesus) // Amer. J. Physiol. 1989. V. 257. № 1. P. R150–R155.
Navas C.A., Carvajalino-Fernández J.M., Saboyá-Acosta L.P. et al. The body temperature of active amphibians along a tropical elevation gradient: patterns of mean and variance and inference from environmental data // Funct. Ecol. 2013. V. 27. № 5. P. 1145–1154.
Newman S.A. Thermogenesis, muscle hyperplasia, and the origin of birds // BioEssays. 2011. V. 33. P. 653–656.
Newman S.A., Mezentseva N.V., Badyaev A.V. Gene loss, thermogenesis, and the origin of birds // Ann. N.Y. Acad. Sci. 2013. V. 1289. P. 36–47.
Nicol S.C. Energy homeostasis in monotremes // Front. Neurosci. 2017. V. 11. P. 195.
Norell M.A., Xu X. Feathered dinosaurs // Ann. Rev. Earth Planet. Sci. 2005. V. 33. P. 277–299.
O’Connor P.M., Claessens L.P.A.M. Basic avian pulmonary design and flow-through ventilation in non-avian theropod dinosaurs // Nature. 2005. V. 436. P. 253–256.
Oelkrug R., Polymeropoulos E.T., Jastroch M. Brown adipose tissue: physiological function and evolutionary significance // J. Comp. Physiol. B. 2015. V. 185. P. 587–606.
Okada S., Utsunomiya T., Okada T. et al. Characteristics of Japanese giant salamander (Andrias japonicus) populations in two small tributary streams in Hiroshima prefecture, Western Honshu, Japan // Herpetol. Conserv. Biol. 2008. V. 3. № 2. P. 192–202.
Paladino F.V., O’Connor M.P., Spotila J.R. Metabolism of leatherback turtles, gigantothermy and thermoregulation of dinosaurs // Nature. 1990. V. 344. P. 858–860.
Periasamy M., Herrera J.L., Reis F.C.G. Skeletal muscle thermogenesis and its role in whole body energy meta-bolism // Diab. Metab. J. 2017. V. 41. P. 327–336.
Pimiento C., Cantalapiedra J.L., Shimada K. et al. Evolutionary pathways toward gigantism in sharks and rays // Evolution. 2019. V. 73. P. 588–599.
Polymeropoulos E.T., Heldmaier G., Frappell P.B. et al. Phylogenetic differences of mammalian basal metabolic rate are not explained by mitochondrial basal proton leak // Proc. R. Soc. B Biol. Sci. 2012. V. 279. P. 185–193.
Pontzer H., Allen V., Hutchinson J.R. Biomechanics of running indicates endothermy in bipedal dinosaurs // PLoS One. 2009. V. 4. P. e7783
Pope C.H. The giant snakes // N.Y.: Alfred A. Knopf, 1961. P. 289.
Pörtner H.O. Climate variability and the energetic pathways of evolution: the origin of endothermy in mammals and birds // Physiol. Biochem. Zool. 2004. V. 77. P. 959–981.
Prestrud P. Adaptation by the Arctic fox (Alopex lagopus) to the polar winter // Arctic. 1991. V. 44. P. 132–138.
Rausch C.M., Starkweather P.L., van Breukelen F. One year in the life of Bufo punctatus: annual patterns of body temperature in a free-ranging desert anuran // Naturwissenschaften. 2008. B. 95. Iss. 6. S. 531–535.
Rezende E.L., Bacigalupe L.D., Nespolo R.F., Bozinovic F. Shrinking dinosaurs and the evolution of endothermy in birds // Sci. Adv. 2020. V. 6. P. 4486.
Ross R. The python breeding manual. Stanford: Inst. Herpetol. Res., 1978. P. 1–51.
Ross R. Breeding pythons in captivity // Proc. Melbourne Herpetol. Symposium (May 19–21, 1980). Melbourne: The Royal Melbourne Zoological Gardens, 1981. P. 139–142.
Rowland L.A., Bal N.C., Periasamy M. The role of skeletal-muscle-based thermogenic mechanisms in vertebrate endothermy // Biol. Rev. 2015. V. 90. P. 1279–1297.
Ruben J.A. The evolution of endothermy in mammals and birds: from physiology to fossils // Ann. Rev. Physiol. 1995. V. 57. P. 69–95.
Runcie R.M., Dewar H., Hawn D.R. et al. Evidence for cranial endothermy in the opah (Lampris guttatus) // J. Exp. Biol. 2009. V. 212. P. 461–470.
Sander P.M., Christian A., Clauss M. et al. Biology of the sauropod dinosaurs: the evolution of gigantism // Biol. Rev. 2011. V. 86. P. 117–155.
Santamaria M., Lanave C., Saccone C. The evolution of the adenine nucleotide translocase family // Gene. 2004. V. 333. P. 51–59.
Sapsford C.W., Hughes G.R. Body temperature of the loggerhead sea turtle Caretta caretta and the leatherback sea turtle Dermochelys coriacea during nesting // Zool. Afr. 1978. V. 18. № 1. P. 63–69.
Schmidt-Nielsen K., Dawson T.J., Crawford E.C. Temperature regulation in the echidna (Tachyglossus aculeatus) // J. Cell. Physiol. 1966. V. 67. P. 63–71.
Sclater P.L. Notes on the incubation of Python sebae, as observed in the Society’s Gardens // Proc. Zool. Soc. London. 1862. P. 365–368.
Secor S.M., Diamond J.M. Evolution of regulatory responses to feeding in snakes // Physiol. Biochem. Zool. 2000. V. 73. P. 123–141.
Seebacher F. Dinosaur body temperatures: the occurrence of endothermy and ectothermy // Paleobiology. 2003. V. 29. P. 105–122.
Seebacher F., Grigg G.C., Beard L.A. Crocodiles as dinosaurs: behavioural thermoregulation in very large ectotherms leads to high and stable body temperatures // J. Exp. Biol. 1999. V. 202. № 1. P. 77–86.
Sepulveda C.A., Dickson K.A., Bernal D., Graham J.B. Elevated red myotomal muscle temperatures in the most basal tuna species, Allothunnus fallai // J. Fish Biol. 2008. V. 73. P. 241–249.
Seymour R.S. Maximal aerobic and anaerobic power generation in large crocodiles versus mammals: implications for dinosaur gigantothermy // PLoS One. 2013. V. 8. P. e69361.
Seymour R.S., Bennett-Stamper C.L., Johnston S.D. et al. Evidence for endothermic ancestors of crocodiles at the stem of archosaur evolution // Physiol. Biochem. Zool. 2004. V. 77. P. 1051–1067.
Slip D.J., Shine R. Reptilian endothermy: a field study of thermoregulation by brooding dimond pythons // J. Zool. 1988. V. 216. № 2. P. 367–378.
Smith E.N. Thermoregulation of the American alligator, Alligator mississippiensis // Physiol. Zool. 1975. V. 48. № 2. P. 177–194.
Snow R.W., Wolf A.J., Greeves B.W. et al. Thermoregulation by a brooding Burmese python (Python molurus bivittatus) in Florida // Southeast. Nat. 2010. V. 9. P. 403–405.
Stahlschmidt Z.R., DeNardo D.F. Effect of nest temperature on egg-brooding dynamics in Children’s pythons // Physiol. Behav. 2009. V. 98. P. 302–306.
Standora E.A., Spotila J.R., Foley R.E. Regional endothermy in the sea turtle, Chelonia mydas // J. Therm. Biol. 1982. V. 7. № 3. P. 159–165.
Stemmler-Morath C. Beitrag zur Gefangenschafts- und Fortpflanzungsbiologie von Python molurus L. // Zool. Garden. 1956. B. 21. № 5–6. S. 347–364.
Sup D.J., Shine R. Reptilian endothermy: a field study of thermoregulation by brooding diamond pythons // J. Zool. 1988. V. 216. P. 367–378.
Tattersall G.J. Reptile thermogenesis and the origins of endothermy // Zoology. 2016. V. 119. P. 403–405.
Tattersall G.J., Milsom W.K., Abe A.S. et al. The thermogenesis of digestion in rattlesnakes // J. Exp. Biol. 2004. V. 207. P. 579–585.
Tattersall G.J., Andrade D.V., Abe A.S. Heat exchange from the toucan bill reveals a controllable vascular thermal radiator // Science. 2009. V. 325. Iss. 5939. P. 468–470.
Tattersall G., Leite C., Sanders C. et al. Seasonal reproductive endothermy in tegu lizards // Sci. Adv. 2016. V. 2. P. e1500951.
Toyomizu M., Ueda M., Sato S. et al. Cold-induced mitochondrial uncoupling and expression of chicken UCP and ANT mRNA in chicken skeletal muscle // FEBS Lett. 2002. V. 529. P. 313–318.
Xu X., Zheng X., You H. Exceptional dinosaur fossils show ontogenetic development of early feathers // Nature. 2010. V. 464. P. 1338–1341.
Yahav S., Buffenstein R. Caecal function provides the energy of fermentation without liberating heat in the poikilothermic mammal, Heterocephalus glaber // J. Comp. Physiol. B. 1992. V. 162. P. 216–218.
Valensiennes A. Observations faites pendant l’incubation d’une femelle du python a deux raies (Pythin bivittatus, Kuhl.) pendant les mois de mai et de juin 1841 // Comp. Rend., Acad. Sci., Paris. 1841. V. 13. P. 126–133.
van Mierop L.H.S., Barnard S.M. Observations on the reproduction of Python molurus bivittatus (Reptilia, Serpentes, Boidae) // J. Herpetol. 1976a. V. 10. № 4. P. 333–340.
van Mierop L.H.S., Barnard S.M. Thermoregulation in a brooding female Python molurus bivittatus (Reptilia, Serpentes, Boidae) // Copeia. 1976b. № 2. P. 398–401.
van de Ven T.M.F.N., Martin R.O., Vink T.J.F. et al. Regulation of heat exchange across the Hornbill Beak: functional similarities with Toucans? // PLoS One. 2016. V. 11. № 5. P. 1–14.
Vaughn L.K., Bernheim H.A., Kluger M.J. Fever in the lizard Dipsosaurus dorsalis // Nature. 1974. V. 252. P. 473–474.
Vinegar A., Hutchison V.H., Dowlong H.G. Metabolism, energetics and thermoregulation during brooding of snakes of genus Python (Reptilia, Boidae) // Zoologica. 1970. V. 55. № 2. P. 19–48.
Wagner E. Breeding the Burese python Python molurus bivittatus at Seattle Zoo // Int. Zool. Jearb. 1976. V. 16. P. 83–85.
Warwick C. Commentary: observation on disease-associated preferred body temperatures in reptiles // App. Anim. Behav. Sci. 1991. № 28. P. 375–380.
Walter I., Seebacher F. Endothermy in birds: underlying molecular mechanisms // J. Exp. Biol. 2009. V. 212. P. 2328–2336.
Watanabe Y.Y., Goldman K.J., Caselle J.E. et al. Comparative analyses of animal-tracking data reveal ecological significance of endothermy in fishes // PNAS USA. 2015. V. 112. P. 6104–6109.
Wegner N.C., Snodgrass O.E., Dewar H., Hyde J.R. Whole-body endothermy in a mesopelagic fish, the opah, Lampris guttatus // Science. 2015. V. 348. Iss. 6236. P. 786–789.
Werner J., Griebeler E.M. Allometries of maximum growth rate versus body mass at maximum growth indicate that non-avian dinosaurs had growth rates typical of fast growing ectothermic sauropsids // PLoS One. 2014. V. 9. P. e88834.
Wolf N.G., Swift P.R., Carey F.G. Swimming muscle helps warm the brain of lamnid sharks // J. Comp. Physiol. B. 1988. V. 157. P. 709–715.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



