Успехи современной биологии, 2021, T. 141, № 4, стр. 315-335
Функциональная роль окисления метионинов в белках: аргументы “за” и “против”
М. А. Розенфельд 1, *, Л. В. Юрина 1, А. Д. Васильева 1
1 Институт биохимической физики им. Н.М. Эмануэля РАН
Москва, Россия
* E-mail: rosenfeld41@mail.ru
Поступила в редакцию 21.12.2020
После доработки 13.01.2021
Принята к публикации 16.01.2021
Аннотация
Превращение метионина в метионинсульфоксид (MetO) является одной из наиболее часто встречающихся окислительных модификаций в белках из-за особой восприимчивости метионина к окислительным условиям. Окисление метионина может влиять на структуру и функцию белка, а уровень MetO увеличивается при развитии окислительного стресса. Большинство клеток содержат метионинсульфоксид редуктазы (MSR), которые катализируют тиоредоксин-зависимое восстановление метионинсульфоксида в исходный метионин. Показано, что мутации, приводящие к снижению активности MSR, связаны со снижением устойчивости некоторых клеток к окислительному стрессу, тогда как мутации, приводящие к перепроизводству активности MSR, приводят к увеличению устойчивости к окислительному стрессу. В работе анализируются редокс-реакции метионинов в функциональной регуляции некоторых внутриклеточных белков, актина и кальмодулина, и обсуждается наличие антиоксидантных метионинов во внутриклеточных белках, таких как глутаминсинтетаза, 15-липоксигеназа, рекомбинантные белки, интерферон α-2b, тканевой активатор плазминогена, фактор стволовых клеток человека. Отсутствие MSR в плазме крови делает окисление метионинов в белках необратимым, поэтому способность метионинов служить перехватчиками молекул окислителя без повреждения функции плазменных белков является достаточно дискуссионным. Антиоксидантные метионины были обнаружены в ряде белков, таких как макроглобулин, антитромбин III, фактор свертывания крови XIII. Однако для большинства белков плазмы крови антиоксидантные метионины не выявлены. Проводится корреляция между окислением метионинов и развитием патологических состояний в организме.
ВВЕДЕНИЕ
Живые организмы постоянно подвергаются воздействию высокореакционных и токсических продуктов, являющихся производными кислорода, получивших обобщенное название активных форм кислорода (АФК). В организме человека более 95% свободных радикалов относятся к свободным радикалам кислорода. Эти продукты могут продуцироваться экзогенно, как вредные вещества в атмосфере, и эндогенно, как побочные продукты ферментативных реакций клеточного метаболизма. К данным соединениям относят: озон (O3) перекись водорода (H2O2), гидроксильный радикал (HO·), супероксидный анион-радикал (${\text{O}}_{2}^{{\centerdot - }}$), синглетный кислород (1O2). В присутствии гемсодержащих пероксидаз происходит образование гипогалоидных кислот (HOCl, HOBr, HOJ), которые являются мощными токсинами, обладающими чрезвычайно высокой химической реакционной способностью по отношению к органическим молекулам (Меньщикова и др., 2006; Панасенко, 2013; Карбышев, Абдуллаев, 2018; Cobley, 2020). Основным источником HOCl в организме является лейкоцитарная миелопероксидаза (Панасенко, 2013). В то время как небольшое количество АФК играет важную роль в процессах передачи сигналов в клетках (Ray et al., 2012), высокое содержание АФК определяет окислительный стресс, ответственный за серьезные метаболические нарушения и повреждение структур биологических макромолекул (Tse et al., 2016).
В настоящее время общепризнано, что белки выступают в качестве основной мишени для АФК (Davies, 2016). Вышеперечисленные производные кислорода способны повреждать белки, что в конечном итоге влияет на их структуру и проявляется в более или менее выраженной потере биохимических функций. Окислители могут вызывать химические модификации боковых цепей аминокислотных остатков, превращение белка в производные, чувствительные к протеолитической деградации, образование белок-белковых поперечных связей и фрагментацию белка, как следствие разрыва полипептидной цепи белка (Stadtman, Levine, 2003; Hawkins et al., 2003). Существуют убедительные доказательства того, что белки, подвергающиеся окислительным посттрансляционным повреждениям с измененной пространственной структурой и функцией, накапливаются при старении, окислительном стрессе и в результате различных заболеваний (Grune et al., 2013).
Установлено, что эволюционно организмы выработали защитные механизмы против высокого уровня АФК (Lu et al., 2001). Защита от АФК-опосредованного окислительного повреждения белков, локализованных во внутриклеточном пространстве, катализируется большим разнообразием антиоксидантных систем. Наиболее эффективными ферментативными антиоксидантами являются супероксиддисмутаза, каталаза, глутатионпероксидаза, пероксиредоксины (Carocho, Ferreira, 2013; Nimalaratne, Wu, 2015). Неферментативные антиоксиданты включают глутатион (GSH), тиоредоксин, аскорбат, α-токоферол, мочевую кислоту и др. (Rizzo et al., 2010; Poljšak, Fink, 2014). Антиоксиданты могут действовать синергически по отношению к различным типам активных форм кислорода, предотвращая их образование либо превращая большинство реактивных метаболитов в менее активные, или способствуя инактивации этих токсических производных (Grune et al., 2013).
Будучи высокоуязвимым объектом для атаки АФК, белки и, следовательно, аминокислотные остатки, составляющие первичную структуру этих белков, подвергаются окислительному повреждению. Репарация повреждений в белках ограничивается восстановлением окисленных производных серосодержащих аминокислотных остатков, цистеина и метионина. Как полагают (Grune et al., 2013), причиной тому является множество возможных продуктов окисления 20 аминокислот, очевидно, превышающих по своему количеству диапазон эффективной репарации. Окислительное повреждение оставшегося большинства аминокислотных остатков (АКО) как во внеклеточных, так и во внутриклеточных белках, носит необратимый характер, то есть ни неферментативным, ни ферментативным способами эти остатки не могут быть восстановлены в исходную нативную форму. Не имеется ни одного свидетельства восстановления аминокислот, отличных от серосодержащих, в окисленных белках. Такие поврежденные белки являются мишенью для деградации различными внутриклеточными протеазами, включая катепсины, кальпаины и особенно 20S-протеасому (Grune et al., 1996; Rivett, 1986).
Остатки цистеина (Cys) участвуют в каталитическом цикле многих ферментов и образуют дисульфидные связи, которые вносят вклад в структуру белка. Сера стабильно существует в нескольких степенях окисления, что делает ее универсальным компонентом в биологических системах. Остатки цистеина способны окисляться с образованием сульфеновой, сульфиновой и сульфоновой кислот, последняя из которых не может быть восстановлена в исходную форму. Самой высокоактивной и наиболее восстановленной формой серы в биомолекулах является тиол (-SH), присутствующий в аминокислоте Cys. Cys находится в активном центре многих белков и в различных белковых доменах, которые участвуют в регуляции ферментов, переносе белков, контроле экспрессии генов и передаче сигналов рецепторами (Grune, et al., 2013).
Остатки Cys белков особенно подвержены окислению АФК (Vogt, 1995). В отличие от других окислений, опосредованных АФК, окисление серосодержащих аминокислот, как упоминалось ранее, является обратимым. Окисление Cys-сульфгидрильных групп белков приводит к образованию либо внутримолекулярных (белок1S-Sбелок1), либо межмолекулярных (белок1S-Sбелок2) производных белков, поперечно связанных, а реакции с GSH дают смешанный дисульфид (белокS-SG). Эти дисульфидные производные могут быть восстановлены реакциями дисульфидного обмена, катализируемыми тиол-трансферазами, которые катализируют реакции между GSH и Trx [Th(SH)2] для регенерации сульфгидрильных групп белка. Как GS-SG, так и Th(S-S) могут быть восстановлены в нативную форму редуктазами (Nishinaka et al., 2001).
Функциональные последствия потери -SH включают неправильную укладку белка, каталитическую инактивацию, снижение антиоксидантной способности и потерю определенных специфических функций, таких как связывание тяжелых металлов и др.
ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ МЕТИОНИНА В БЕЛКАХ
Долгое время полагали, что метионин в белках, помимо его участия в инициации трансляции, играет простую структурную роль, находясь в гидрофобном ядре, подобно другим гидрофобным аминокислотам, таким как лейцин, изолейцин и валин. Однако накопленные данные однозначно свидетельствуют, что метионин наделен разнообразными функциями. Метионин является важным клеточным антиоксидантом, стабилизирует структуру белков, участвует в распознавании поверхностей белка и др. В недавно опубликованной прекрасной обзорной работе эти функции метионина в белках детально проанализированы (Aledo, 2019).
Каталитическое восстановление окисленного метионина во внутриклеточных белках
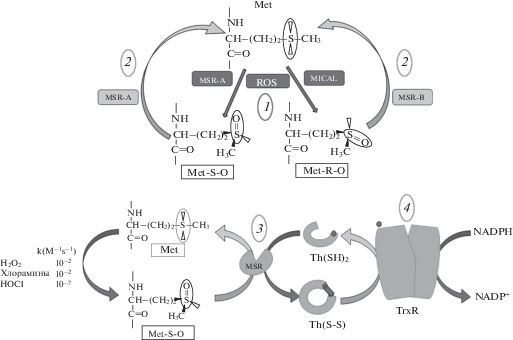
Из-за особой восприимчивости серосодержащей аминокислоты, метионина (Met), ко всем формам АФК, генерируемым в клетке, Met легко окисляется в условиях окислительного стресса (Weissbach et al., 2005), превращаясь в смесь S- и R-стереоизомеров (MetO). Образование метионинсульфоксида является одной из наиболее часто встречающихся окислительных модификаций белков. Однако, в отличие от окисления других аминокислотных остатков (кроме Cys), окисление Met до MetO обратимо. MetO может быть восстановлен в нативную форму Met под действием редуктаз (MSR-A и MSR-B), которые катализируют восстановление S- и R-изомеров M-etO, соответственно, обратно до Met (Weissbach et al., 2005; Lim et al., 2019), (рис. 1).
Рис. 1.
Окисление и восстановление метионина. 1 – метиониновые остатки белков легко окисляются различными видами АФК до S- и R-стереоизомеров метионинсульфоксида (MetO); 2 – MetO может быть снова восстановлен до метионина с помощью метионинсульфоксид редуктаз (MSR-А и MSR-В), которые катализируют восстановление R- и S‑изомеров; 3 – оба фермента используют тиоредоксин Trx (Th(SH)2) в качестве восстановителя; 4 – в присутствии NADPH окисленная форма Trx (Th(S-S)) может быть восстановлена с помощью фермента Trx редуктазы (TrxR). В конечном итоге, сопряженные реакции обеспечивают NADPH-зависимый механизм удаления АФК (NADPH + H+ АФК → → NADP+ + H2O + продукты) (адаптировано по: Weissbach et al., 2005; Grune et al., 2013; Manta, Gladyshev, 2017; Aledo, 2019; Lim et al., 2019).
Влияние пространственного расположения и пептидного окружения на реакционную активность метионина
Обратимое окисление метионинов позволяет рассматривать их как внутримолекулярные антиоксиданты, которые защищают другие (не подлежащие восстановлению) аминокислоты от окисления (Lim et al., 2019). Другими словами, остатки метионина способны полностью или частично перехватывать окислители, прежде чем они смогут атаковать другие аминокислотные остатки, играющие ключевую роль в поддержании структуры или функции белка. Наиболее легко окисляемые остатки метионина, экспонированные на поверхностности белка (то есть максимально пространственно доступные для молекул окислителя), как правило, окисляются с незначительными последствиями для функциональности белка, в то время как оставшиеся остатки метионина, локализованные внутри белковой глобулы, которые являются жизненно важными для функционирования белка, гораздо менее подвержены окислению (Elmallah et al., 2013; Wang et al., 2016). Однако, так как в отличие от других гидрофобных остатков, таких как валин, лейцин или изолейцин, боковая цепь метионина является неразветвленной, обеспечивая ей достаточную гибкость, метионины, находящиеся внутри белка, но сохраняющие локальную структурную гибкость, также потенциально могут подвергаться окислению (Xu et al., 2012). Большое значение для функционирования белка имеет наличие антиоксидантных остатков метионина в предполагаемых антиоксидантных областях, являющихся ловушками различных видов окислителей (Rosenfeld et al., 2018).
Хотя доступность остатков метионина к растворителю является важным фактором, определяющим их склонность к окислению, она не может однозначно объяснять их реакционную способность только пространственной локализацией. Чтобы проанализировать другие возможные структурные факторы, были исследованы различные наборы метионинов, чувствительных к окислению или устойчивых к окислению, содержащихся в человеческих белках. Сравнение белков, содержащих окисленные метионины, со всеми белками в протеоме человека привело к заключению, что первые демонстрируют значительно более высокое среднее значение содержания метионина, чем последние. Внутри данного белка, изучение аминокислотной последовательности, окружающей неокисленный метионин, выявило предпочтительное расположение соседних остатков тирозина и триптофана, но не остатков фенилаланина. Результаты этих анализов позволили сделать вывод о том, что “S-ароматический мотив” снижает реакционную способность серосодержащего остатка метионина по отношению к окислителям (Aledo et al., 2015). С другой стороны, недавнее исследование предоставило биоинформатические данные, свидетельствующие о том, что окисление метионина усиливается в непосредственной близости от участков фосфорилирования (Veredas et al., 2017).
Окисление остатков метионина обычно увеличивает гидрофобность поверхности белков (Chao et al., 1997). С другой стороны, окисление метионина до сульфоксида должно было бы приводить к снижению гидрофобности поверхности белка (Gellman, 1991), потому что метионинсульфоксид, сам по себе, является более гидрофильным, чем исходный метионин. Однако внутри белка добавление кислорода к метионину, очевидно, нарушает естественную картину складывания полипептидной цепи, вызывая обнажение более гидрофобных, по сравнению с метионином, остатков (Moskovitz et al., 2000). Так как окисление поверхностно-локализованных метионинов вызывает увеличение гидрофобности белка, окисление одного такого метионина может изменять стабильность второго метионина, расположенного в другом месте белка, и вследствие этого способствовать его вовлечению в окислительный процесс (Walker et al., 2019). Другими словами, можно говорить о наличии некоторого рода “кооперативности” в окислении остатков метионина, которая в свою очередь зависит от структурной стабильности белка в целом.
Антиоксидантные метионины и клеточная регуляция
Хотя АФК образуются в различных клеточных структурах, подавляющее большинство продукции АФК можно отнести к митохондриям (Гривенникова, Виноградов, 2013). Неудивительно, что эта органелла обладает множеством систем нейтрализации АФК. В этой связи, переназначение кодона AUA из изолейцина в метионин, наблюдаемое в генетическом коде митохондрий млекопитающих, было интерпретировано как адаптивный процесс, приводящий к накоплению антиоксидантных метионинов в реакциях дыхательной цепи (Bender et al., 2008). Действительно, в то время как среднее содержание метионина в белках, кодируемых ядерным геномом (nDNA), составляет около 2%, этот процент возрастает до 6%, когда анализируемые белки являются белками, кодируемыми митохондриальным геномом (mtDNA) (Aledo, 2019).
Таким образом, согласно гипотезе об антиоксидантной роли метионинов (Bender et al., 2008), эти АКО могли быть движущей силой эволюции. Те линии млекопитающих, которые демонстрируют более высокие скорости генерации АФК, могли бы подвергаться более высокому селективному давлению для увеличения содержания метионина в их митохондриальных белках (Aledo, 2019). Другими словами, если остатки метионина в митохондриальных белках служат ловушками АФК, тогда белки животных, подвергшихся высокому окислительному стрессу, должны “накапливать” метионин более эффективно, чем их ортологические белки видов, подвергшихся более низкому окислительному стрессу. Чтобы подтвердить эту гипотезу, был проведен метаанализ митохондриальных геномов видов млекопитающих, используя продолжительность жизни как обратный показатель скорости продукции АФК (Aledo et al., 2011). Проведенный анализ показал, что кодируемые митохондриями полипептиды короткоживущих видов, подвергшиеся более высокому окислительному стрессу, избирательно накапливали метионины по сравнению с их долгоживущими аналогами, не находящимися в среде с высокой генерацией АФК (Aledo et al., 2011), что предполагает роль естественного отбора в содержании метионина в белках (Aledo et al., 2012).
Регуляция антиоксидантного статуса белков метионинсульфоксид редуктазами
Активность метионинсульфоксид редуктаз (MSR) прямо связана с их способностью восстанавливать окисленные метионины и, тем самым, обеспечивать клеткам высокую толерантность к окислительным воздействиям. Было установлено, что мутации, приводящие к снижению активности MSR, вызывают снижение устойчивости некоторых клеток к окислительному стрессу, тогда как мутации, приводящие к перепроизводству активности MSR, способствуют увеличению устойчивости к окислительному стрессу (Grune et al., 2013). Важность MSR в старении была подчеркнута результатами исследований, показывающих, что избыточная экспрессия гена MSR-A в дрожжах (Moskovitz et al., 1998), нейрональных клетках PC-12 и человеческих Т-клетках (Yermolaieva et al., 2004), дрозофиле (Ruan et al., 2002) вызывает повышенную устойчивость к окислительному стрессу. Более того, гиперэкспрессия MSR у дрозофилы приводит к почти удвоению максимальной продолжительности жизни (Ruan et al., 2002). Этот эффект MSR на продолжительность жизни подтверждается исследованиями, результаты которых свидетельствовали о том, что мутантные штаммы дрожжей (Moskovitz et al., 1997), бактерий (Douglas et al., 2004) и мышей (Moskovitz et al., 2001), у которых отсутствует ген MSR-A, были более чувствительны к окислительному стрессу.
Стереоспецифичное фермент-катализируемое окисление метионина
Взаимопревращение Met и MetO in vivo представляет собой процесс, включающий две разные реакции окисления и восстановления. Эти окислительно-восстановительные реакции могут быть катализированы ферментами. Образование метионинсульфоксида может быть катализировано, по меньшей мере, двумя различными ферментами. Метионинсульфоксид редуктаза A (MSR-A, бифункциональный фермент), катализируя реакцию окисления, образует S-эпимер метионинсульфоксида. В этой связи интересно отметить, что метионинсульфоксид редуктаза B, в отличие от MSR-A, не проявляет способности катализировать окисление остатков метионина в белках (Lim et al., 2011). Соответствующая схема реакций окисления и восстановления метионина, катализируемых различными ферментами представлена на рис. 1.
Фермент MICAL (Molecule interacting with CasL), принадлежащий к семейству цитоплазматических, актин-связывающих белков, которые привлекли к себе внимание как редокс-зависимые регуляторы актина, также проявляет стереоспецифичность и катализирует образование R-эпимера метионинсульфоксида (Manta, Gladyshev, 2017). В следующем разделе ферментативное окисление метионинов во внутриклеточных белках будет проанализировано более детально.
Таким образом, окисление метионина во внутриклеточных белках имеет многофакторную природу и, без сомнения, наличие антиоксидантных метионинов может в значительной степени обусловливать резистентность белков к окислительному стрессу.
Необратимое окисление метионинов в плазменных белках
Что касается внеклеточных белков и, в частности, белков плазмы крови, окисление которых будет анализироваться в отдельном разделе, они подвергаются атаке различными окислителями, генерируемыми, главным образом, лейкоцитами и тромбоцитами (Ланкин и др., 2001; Гривенникова, Виноградов, 2013). Полагают, что уровень окислителей в плазме крови, по крайней мере, не ниже такового в клетках (Bruschi et al., 2013). Плазма крови содержит ряд низкомолекулярных антиоксидантов (аскорбат, урат, глутатион и др.), а также антиоксидантные белки – церулоплазмин, трансферрин, альбумин. Однако следует отметить, что вне клеток уровни глутатиона и антиоксидантных ферментов слишком низки, чтобы обеспечить адекватную защиту самих белков от вредного действия метаболитов кислорода (Bruschi et al., 2013). В литературе имеются ограниченные данные, касающиеся репарации белков по механизму тиол-дисульфидного обмена, происходящего в жидкой фазе. Одним из ярких примеров восстановления окисленного белка в плазме является регуляция активности тканевого фактора с помощью секретируемого тиоредоксина-1 (Wang et al., 2013). Однако до настоящего времени не появилось ни одного сообщения об обратимом окислении метионина (Griffiths et al., 2014). Это подразумевает, что функционально значимые или антиоксидантные метионины в плазменных белках могут подвергаться окислительным модификациям без возможности восстановления в исходную форму.
Следовательно, накопление окисленных белков в кровотоке может происходить как из-за избыточного производства АФК, так и из-за неадекватного восстановления поврежденных молекул. Это подразумевает, что белки плазмы не могут быть защищены антиоксидантами от вовлечения в окислительную модификацию в той же степени, как они были бы защищены внутри клеток. Другими словами, способность белков плазмы перехватывать молекулы окислителей без повреждения их структуры и функции вследствие необратимого окисления остатков метионина, по-видимому, очень ограничена.
АНТИОКСИДАНТНАЯ И РЕГУЛЯТОРНАЯ РОЛЬ МЕТИОНИНА ВО ВНУТРИКЛЕТОЧНЫХ БЕЛКАХ
Проводимые в течение многих лет исследования MSR-A- и MSR-B-зависимого восстановления окисленных белков демонстрировали важную роль редуктаз в поддержании устойчивости белков, клеток, тканей и организмов к окислительному стрессу как in vitro, так и in vivo (Grune et al., 2013). Ряд внутриклеточных белков содержит уязвимые к окислению метиониновые остатки с потенциальной регуляторной ролью, которые способны к каталитическому восстановлению. Все больше данных подтверждают дополнительную исключительную функцию редуктаз, связанную с регуляцией функции белка, посредством обратимого окисления метионина, контролируя тем самым различные биологические процессы. В этой части обзора мы рассмотрим два белка – актин и кальмодулин, кардинально различающихся по своей структуре и функции и достаточно полно охарактеризованных в отношении редокс-активных метионинов.
Обратимое окисление метионина в регуляции сборки F-актина
Актин, образующий шесть изоформ актина: β- и γ-немышечные, α-скелетные, α-сердечные и α- и γ-гладкие мышечные изоактины, является одним из наиболее функционально разнообразных белков в эукариотических клетках. Актин вовлекается во многие важные клеточные процессы, включая сокращение мышц, подвижность клеток, деление клеток, цитокинез и др. (Simiczyjew et al., 2017). Актин связывает АДФ/АТФ и Mg2+/Ca2+, и это связывание регулирует полимеризационные свойства актина, включая способность отдельных мономеров белка (G-актин) полимеризоваться и образовывать филаменты. Сборка филаментов актина (F-актин) и его разборка с образованием исходного G-актина являются витальными для нормального функционирования клеток.
Актиновый цитоскелет представляет собой уязвимую мишень для клеточного окислительного стресса (Le-Donne et al., 2001). Актин подвержен окислению различными окислителями, в частности, пероксидом водорода и гипохлоритом (HOCl/OCl–). Как было установлено, шесть цистеинов в β/γ-актине (Cys10, Cys217, Cys257, Cys285, Cys272 и Cys374) и пять цистеинов в α-актине (те же, что и в β/γ-актине за исключением Cys272) могут быть вовлечены в окисление, причем Cys374 является наиболее редокс-чувствительным остатком (Wilson et al., 2016). В целом полагают, что окисление цистеинов замедляет полимеризацию/деполимеризацию G-актина (Wang et al., 2001) и делает F-актин более хрупким (Stournaras et al., 1990). Эти данные указывают на то, что окисление играет ключевую роль в разборке актиномиозинового комплекса во время клеточной адгезии.
Модельные исследования in vitro выявили воздействие перекиси водорода на мономерный актин, приводящее к превращению 6 из 16 метионинов в метионинсульфоксиды. Хотя начальным эффектом действия H2O2 на актин было окисление Cys374, было показано, что Met44, Met47, Met176, Met190, Met269 и Met355 были также вовлечены в окисление, причем Met44 и Met47 проявляли наибольшую уязвимость к окислению (Milzani et al., 2000). Окисленные метионины находились во всех четырех субдоменах актина: MetO355 – в первом субдомене; MetO44, MetO47 – во втором субдомене; MetO176 – в третьем субдомене; MetO190, MetO269 – в четвертом субдомене. Структура субдомена 1 является критической областью для связывания различных белков с актином, тогда как субдомен 2 играет важную роль в процессах полимеризации и стабилизации актиновых филаментов. Поэтому не удивительно, что окисление вызывало нарушения функциональных свойств актина (Hung et al., 2011). К этому следует добавить, что шесть остатков метионина, Met82, Met119, Met123, Met132, Met299 и Met313 локализованы полностью в гидрофобном ядре молекулы актина, в то время как относительная доступность к растворителю других частично экспонированных остатков метионина располагалась в ряду: Met47 > Met355 > > Met44 > Met227 > Met283 > Met269 > Met325 > > Met176 > Met305 > Met190. Результаты показывают, что H2O2-индуцированная окислительная модификация отдельных метионинов не связана напрямую с их пространственным расположением, что является следствием изменений в третичной структуре актина, вызванных окислением метионинов (Milzani et al., 2000) или эффектом “кооперативности” при окислении остатков метионина в белке (Walker et al., 2019).
Окисление остатков метионина в актине Met44 и Met47 может также осуществляться ферментативном способом (Wilson et al., 2016). Это окисление, как упоминалось ранее, опосредуется семейством белков, называемых MICAL, которые включают монооксигеназный домен, способствующий превращению метионина в метионинсульфоксид (Hung et al., 2011). В присутствии кофермента NADPH MICAL добавляет кислород к остаткам Met44 и Met47 на F-актине. MICAL окисляет эти два остатка стереоспецифично в R-конформации и генерирует актин Met44-R-сульфоксид и Met47-R-сульфоксид (Hung et al., 2013).
Несмотря на то, что остаток Met44 локализован внутри структуры F-актина, благодаря конформационным перестройкам при взаимодействии молекул фермента и актина, активный сайт MICAL получает доступ к плохо доступному метионину (Wilson et al., 2016). Ключевой остаток Met44 находится в D-петле части субдомена II актина, что имеет решающее значение для межмолекулярных контактов субъединиц актина (Wilson et al., 2016). В этой связи, окисление Met44, но не Met47, по-видимому, является доминирующим фактором для процесса деполимеризации F-актина (Grintsevich et al., 2016), потому что мутанты актина Met44Leu устойчивы к разборке, вызванной MICAL, а мутанты Met47Leu – нет (Grintsevich et al., 2017).
На рис. 2 показано расположение Met44 и Met47 в димере актина, индуцированное окисление которых вызывает ослабление межмолекулярных контактов, что способствует диссоциации димера на два мономера. Образующиеся мономеры актина медленнее собираются и подвержены более легкой фрагментации после повторной сборки.
Рис. 2.
Структурная модель молекулы актина. Остатки Met44 и Met47, окисляемые MICAL, находятся на границе раздела между соседними мономерами актина (PDB ID: 2ZWH) (Oda et al., 2009), каждый из которых состоит из I, II, III и IV субдоменов. MICAL специфически окисляет остатки актина Met44 и Met47 (Hung et al., 2011), причем основным средством, с помощью которого MICAL вызывает разборку F-актина, является окисление остатка Met44. Окисление Met44 и Met47 способствует существенному ослаблению межмолекулярных взаимодействий и последующей диссоциации димера (адаптировано по: Milzani 2000 et al.; Hung et al., 2013; Wilson et al., 2016).

Взаимодействия кофилина (белка, способного связываться с G- и F- актином) и модифицированного актина усиливают склонность F-актина к деполимеризации, способствуя образованию мономерного актина при окислении под действием MICAL (Wilson et al., 2016). Кроме того, MICAL-катализированное окисление актина способствует высвобождению кофилина, обеспечивая тем самым надежный механизм разборки различных форм актина в ответ на передачу сигналов клетками (Xu et al., 2017). MICAL-опосредованное влияние на динамику актина обратимо с помощью ферментов метионинсульфоксид редуктаз, и под действием метионинсульфоксид-редуктазы B1 (MSR-B1) Met44- и Met44-R-сульфоксиды восстанавливаются в исходный метионин (Hung et al., 2013).
Таким образом, MICAL-индуцированное окисление Met44 в актине, вызывающее деполимеризацию F-актина, и обратное превращение MetO44 в исходную форму метионина, катализируемое метионинсульфоксид редуктазой MSR-В, которое восстанавливает способность G-актина к полимеризации, демонстрируют уникальный способ ферментативной редокс-регуляции сборки и разборки надмолекулярной структуры актинового волокна.
Окислительная модификация кальмодулина
Кальмодулин (CaM) является небольшим белком (148 аминокислотных остатков) и рассматривается как наиболее важный сенсор Ca2+ (Chin, Means, 2000). Регуляция цитоплазматической концентрации Ca2+ является повсеместным механизмом, посредством которого клетки преобразуют внешние сигналы в биологические ответы. Каскад сигналов, инициируемый повышением Ca2+, часто опосредуется Ca2+-связывающими белками, такими как кальмодулин. CaM связывает и активирует более 300 известных белков-мишеней (Tebar et al., 2020), включая кальмодулин-зависимые протеинкиназы и фосфатазы, цитоскелетные белки, ионные каналы и насосы (Chyan et al., 2017). CaM содержит два глобулярных домена, соединенных длинной и гибкой α-спиралью, называемой “центральным линкером”. Каждый домен содержит два Ca2+-связывающие сайта, имеющие структурный мотив: спираль-петля-спираль (EF-hand) (Liu et al., 2020; Tebar et al., 2020). Хотя эти два домена обладают высокой степенью гомологии в последовательности, они демонстрируют тонкие различия в структурах и аффинности к Ca2+ (Gifford et al., 2007). Взаимодействие Ca2+ с CaM запускает в белке конформационные изменения, приводящие к открытию гидрофобных карманов и готовность к ассоциации с различными белками-мишенями (Gifford et al., 2007). Другими словами, Ca2+/CaM связывается с белками-мишенями с существенно более высокой аффинностью по сравнению с CaM в отсутствии Ca2+ (aпo-CaM).
CaM имеет необычно высокое содержание метионина (9 метиониновых остатков), включая 46% гидрофобных остатков в карманах связывания, которые имеют решающее значение для взаимодействия CaM с белками-мишенями (Vetter, Leclerc, 2003; Yamniuk, Vogel, 2004). Остатки метионина в кальмодулине, которые являются критическими для межбелкового взаимодействия, являются потенциальными мишенями для окисления (Lim et al., 2013). Окисление метионина в кальмодулине, имитируемое замещением метионина глютамином (M109Q и M124Q), уменьшает влияние ионов кальция на структуру CaM, в первую очередь, за счет уменьшения константы равновесия от закрытой к открытой конформации в присутствии Ca2+. Предполагается, что окисление метионина изменяет взаимодействие CaM с белками-мишенями, нарушая этот Ca2+-зависимый структурный сдвиг (McCarthy et al., 2015).
Поскольку CaM не содержит остатков Cys, окисление остатков метионина играет важную роль в нарушении метаболизма кальция. Например, превращение в кальмодулине Met144 и Met145 в MetO нарушает CaM-зависимую активацию как саркоплазматической, так и эндоплазматической Ca2+-АТФазы (Chen et al., 2005).
Как упоминалось выше, MSR-A способна осуществлять ферментативное окисление, атакуя свободные метионины или остатки метионина в пептидах и белках до MetO (Lim et al., 2013). CaM является субстратом для MSR-A с интригующей специфичностью. В отличие от H2O2- или H-OCl/OCI–-индуцированного окисления CaM, способного модифицировать каждый из 9 имеющихся остатков метионина, MSR-A стереоспецифически окисляет единственный метионин – Met77 (рис. 3а) до MetO (Lim et al., 2013). Остаток Met77 находится в карбоксильной части центрального линкера. Согласно кристаллической структуре белка, центральный линкер представляет собой жесткую спираль. Однако исследования ЯМР показывают, что он достаточно неупорядочен и гибок в растворе (Barbato et al., 1992). Связывание кальция кальмодулином стабилизирует структуру его центрального линкера в последовательности между Met77 и Ser82 (Qin, Squier, 2001), предположительно, способствуя сайт-специфическому окислению Met77 метионинсульфоксид редуктазой А (Lim et al., 2013). Кристаллическая структура CaM свидетельствует, что Phe12 и атом серы в Met77 расположены на расстоянии 5.6 Å друг от друга, образуя, таким образом, уникальный метионин-ароматический мотив, который играет важную роль в стабилизации белковых структур и межбелковых взаимодействий (Walgenbach et al., 2018). Как полагают авторы (Qin, Squier, 2001), окисление Met77 может нарушить связывание мишеней с комплементарными NH2-участками CaM.
Рис. 3.
Ферментативное окисление аминокислотных остатков метионина в Са2+/CaM и апо-кальмодулине. Селективное ферментативное окисление метионина Met77 в Са2+/CaM (PDB ID: 1CLL), катализируемое MSR-A (а); окисление всех девяти имеющихся остатков метионина в апо-кальмодулине (PDB ID: 1CFD) MSR-A (б). Структурные изменения в молекуле CaM при окислительной модификации метионина не показаны (адаптировано по: McCarthy et al., 2015).

При действии метионинсульфоксид редуктазы А в направлении восстановления окисленный CaM полностью восстанавливается до своей нативной формы. На основании этого был сделан важный вывод, что обратимая ковалентная модификация Met77 может регулировать взаимодействие CaM с одной или несколькими его мишенями (Lim et al., 2013).
Описанное выше сайт-специфическое окисление Met77 относится к Ca2+/CaM, то есть в форме, связанной с кальцием. Удаление кальция с получением апо-кальмодулина вызывает большие изменения в его третичной структуре, которые включают изменения экспозиции остатков метионина как в амино-, так и в карбоксильном кальций-связывающих доменах (Vetter, Leclerc, 2003). Вследствие этого специфичность, присущая кальций-связанному кальмодулину, терялась в апо-форме белка, и большинство молекул содержало множественные остатки MetO. Все 9 остатков метионина были окисляемыми (рис. 3б), хотя Met110 и Met145 окислялись наиболее быстро. Однако окисление оставалось стереоспецифичным при генерировании MetO, о чем свидетельствовала способность MSR-A полностью восстанавливать все MetO в окисленном апо-кальмодулине (Lim et al., 2013). Относительно недавно, тестируя созданных мутантных мышей, у которых CaM дикого типа был заменен CaM, содержащим имитатор метионинсульфоксида 77 (M77Q), было показано, что обратимое окисление метионина 77 в кальмодулине под действием MSR-A может в значительной степени регулировать клеточные функции (Marimoutou et al., 2018).
Антиоксидантные метионины во внутриклеточных белках
Целый ряд внутриклеточных белков содержит антиоксидантные метионины, окисление которых не влияет или влияет очень слабо на биологическую активность белка.
Ярким примером этого послужило исследование пероксид-индуцированного окисления глутаминсинтетазы, демонстрирующее, что 8 из 16 остатков метионина могут быть окислены без потери каталитической активности. Картирование окисляемых остатков метионина показало, что все они были поверхностно-экспонированными и, наоборот, остатки, которые оставались неокисленными, были локализованы внутри белковой глобулы (Lim et al., 2019). Более детальное изучение топографического распределения окисляемых остатков метионина обнаружило удивительную картину: эти остатки выстилали участок, ведущий от поверхности фермента к его активному центру. Другими словами, эти остатки метионина собирались строго определенным образом, охраняя активный сайт и действуя как макромолекулярные ловушки АФК (Lim et al., 2019).
При исследовании чувствительности рекомбинантных белков, интерферона и тканевого активатора плазминогена, вовлекаемых в индуцированное окисление трет-бутилгидропероксидом, удалось показать, что два из пяти остатков метионина в интерфероне и три из пяти остатков метионина в молекуле тканевого активатора плазминогена могут быть окислены без потери биологической активности белков (Keck, 1996). Это, по мнению авторов, свидетельствовало о поверхностной локализации этих метионинов (Keck, 1996). Сходный результат был получен при окислении фактора роста кератиноцитов (Spahr et al., 1996).
Изучение H2O2-индуцированного окисления рекомбинантного фактора стволовых клеток человека, содержащего пять остатков метионина, показало, что Met1, Met27 и Met15 были высокоуязвимыми к окислительной модификации с незначительным влиянием на биологическую активность, а это признак того, что эти метионины являются поверхностно-экспонированными (Hsu et al., 1996). Оставшиеся два остатка, Met36 и Met48, были гораздо менее подвержены окислению, и окислительная модификация любого остатка сопровождалась значительной потерей биологической активности. Очевидно, что Met36 и Met48 погружены внутрь белковой глобулы и такие метионины, как правило, наделены функциональной активностью.
15-липоксигеназы млекопитающих подвергаются необратимой ауто-инактивации во время каталитического цикла. Фермент содержит множественные метионины, и окисление только одного метионина вблизи активного сайта каталитического домена очень хорошо коррелирует с инактивацией белка. Хотя это может быть регуляторным механизмом, было показано (Gan et al., 1995), что замена сайт-специфического окисляемого метионина Met590 на лейцин приводит к форме фермента, который, по-прежнему, способен к аутоинактивации. Исходя из этих результатов, было предположено, что Met590 является антиоксидантом, защищающим активный сайт белка (Moskovitz et al., 2000)
Признавая химическую легкость окисления метионинов, метионины, находящиеся на поверхности, представляют собой грозный механизм антиоксидантной защиты, способный защищать критические остатки внутри белка, а также другие клеточные компоненты. Поскольку метионинсульфоксид редуктазы могут восстанавливать MetO до метионина, эта антиоксидантная защита приобретает особую каталитическую эффективность. Один из таких примеров функционирования системы принадлежит авторам (Garner et al., 1998), которые установили, что липопротеины высокой плотности восстанавливают токсичные продукты окисления холестерина до спиртов с сопутствующим окислением двух метиониновых остатков до сульфоксидов. В свою очередь, другие авторы показали (Sigalov, Stern, 1998), что система может функционировать каталитически, поскольку окисленный аполипопротеин может быть восстановлен метионинсульфоксид редуктазой.
В заключение хотелось бы отметить следующее. В данном разделе мы ограничились лишь некоторыми примерами участия антиоксидантных метионинов в сохранении функциональности внутриклеточных белков, (дополнительные примеры можно найти в работах (Moskovitz et al., 2000; Grune et al., 2013; Gu et al., 2015). Что касается ферментативного восстановления метионинсульфоксидов, необходимо учитывать, что вклад метионинов в белках как антиоксидантов, нейтрализующих АФК, может быть в определенной мере ограниченным. Оба типа MSR действуют более эффективно в восстановлении развернутых, а не свернутых окисленных белков, и этот эффект обусловлен лучшим доступом ферментов к метионин сульфоксидам, присутствующим в гидрофобных ядрах субстратных белков (Tarrago et al., 2012). Однако окисление точечного экспонированного метионина может не сопровождаться разворачиванием структуры белка. Тем не менее, концепция, декларирующая, что поверхностно-расположенные в белках метионины представляют собой эндогенные антиоксиданты, а взаимопревращение Met/MetO, которое имеет решающее значение для клеточной физиологии, обеспечивает селективный способ точной регуляции функции белка, является в настоящее время наиболее продуктивной и обоснованной в понимании функционирования белков и клеток при генерации АФК (Drazic, Winter, 2014)
ОКИСЛИТЕЛЬНАЯ МОДИФИКАЦИЯ МЕТИОНИНОВ ВО ВНЕКЛЕТОЧНЫХ БЕЛКАХ
Как указывалось выше, из-за отсутствия в плазме крови метионинсульфоксид редуктаз не обнаружено ни одного случая восстановления окисленных форм метионинов (Griffiths et al., 2014). Однако, так как метионины являются наиболее высокореакционными в окислительных реакциях с АФК, по сравнению со всеми остальными аминокислотами (за исключением цистеина), это позволяет экспонированным метионинам перехватывать АФК и тем самым служить эндогенными антиоксидантами во внеклеточных белках. Количество таких антиоксидантных метионинов во многом определяет антиоксидантную “емкость” белка, его окислительную резистентность, то есть его способность противостоять токсическому действию молекул окислителей.
Окислительная модификация α2-макроглобулина человека
Интригующие данные, полученные авторами при исследовании окислительной модификации человеческого α2-макроглобулина (hα2M) (Reddy et al., 1994), убедительно продемонстрировали существование некоторых остатков метионина в белке, окисление которых не влияло на его активность. Последующее наблюдение превращения (в определенных положениях) метионинов в метионинсульфоксиды в других белках, которое не оказывало заметного воздействия на функциональные свойства этих белков, привело к становлению более общей гипотезы, согласно которой метионины, локализованные на поверхности белка, могут быть ловушками АФК и, следовательно, действовать как эндогенные антиоксиданты (Lim et al., 2019).
Молекула hα2M обладает четвертичной, гомотетрамерной структурой, которая образована четырьмя идентичными субъединицами, собранными в два дисульфид-связанных димера, удерживаемых вместе нековалентными силами (Marrero et al., 2012). Каждая субъединица hα2M содержит 25 остатков метионина, которые присутствуют во всех структурных областях белка. hα2M наделен множеством функций, в частности, необратимо ингибирует огромное разнообразие протеиназ независимо от механизма их действия или специфичности, включая серин-, цистеин-, аспарагин- и металлопротеиназы (Rehman et al., 2013).
Исследования окисления α2-макроглобулина при действии на него различных видов АФК показало, что перекись водорода или супероксидный анион-радикал не влияли на его структуру и функцию (Lim et al., 2019). Гипохлорит и гидроксильные радикалы – оба были способны модифицировать аминокислотные остатки в α2-макроглобулине, однако только гипохлорит мог вызывать потерю белком способности ингибировать протеиназы (Khan et al., 2009). Многие функции α2-макроглобулина регулируются гипохлоритом. Индуцированные гипохлоритом химические и структурные модификации hα2M человека усиливают его активность как шаперона (Dahl et al., 2015), влияют на способность белка связывать цитокины и факторы роста (Wu et al., 1998) и др. Доказательства гипохлорит-индуцированной регуляции функций hα2M и возможные последствия этого в протекании различных физиологических и патологических процессов были суммированы в недавно опубликованной обзорной работе (Cater et al., 2019).
Детальное изучение реакции окисления белка установило, что каждая субъединица hα2M потребляет восемь молей N-хлорамина без потери ингибиторной, антипротеиназной активности (Reddy et al., 1994). Потребление восьми эквивалентов хлорамина вызывало окисление восьми остатков метионина с превращением их в сульфоксиды метионина. Продолжение воздействия способствовало окислению шести дополнительных остатков метионина и одного ключевого, в функциональном отношении остатка триптофана Trp436, что обусловливало инактивацию белка (Reddy et al., 1994; Lim et al., 2019). Окисление метионинов в значительной степени было ответственно за гипохлорит-индуцированную диссоциацию тетрамера hα2M на димеры. Хотя точную локализацию окисленных остатков метионинов еще предстоит установить, предполагается, что некоторые из них локализованы в области так называемого bait-domain (Wyatt et al., 2015). Этот домен содержит большое количество пептидных связей, доступных для гидролитического расщепления различными протеиназами (Wyatt et al., 2014) и, кроме того, он изобилует множественными метионинами: Met607, Met666, Met673, Met688, Met697 и Met713. Поскольку в нативном тетрамере два метионина, Met697 и Met713 локализованы внутри гибкого сегмента bait-domain и находятся на границе раздела нековалентно-связанных hα2M-димеров (Marrero et al., 2012; Wyatt et al., 2015), было высказано предположение, что эти метионины могут быть наиболее легкодоступными для молекул гипохлорита, и их окисление может способствовать диссоциации тетрамера (Rosenfeld et al., 2018).
В целом α2-макроглобулин остается все еще крайне плохо изученным белком в отношении идентификации его аминокислотных остатков, которые подвергаются окислительным модификациям под действием АФК. Точные положения модифицированных остатков метионинов, подвергающиеся атаке гипохлоритом, остаются неизвестными. Картирование метионинов, вовлекаемых в окислительную модификацию, используя масс-спектрометрический метод, крайне необходимо в будущем, чтобы заполнить важный пробел в понимании механизма окисления этого многофункционального белка и в возможной антиоксидантной роли конкретных метионинов, защищающих ключевой остаток Trp436.
Накопленные данные по окислению α2-макроглобулина оказались знаковыми. Они свидетельствовали о том, что метионины во внеклеточном белке могут также служить линией обороны без их ферментативного восстановления. Кроме того, количество антиоксидантных метионинов в белке во многом определяет его толерантность к окислителям, что приобретает особую значимость при функционировании белка in vivo в условиях развития окислительного стресса. И, наконец, окисление плазменных белков не является однозначно деструктивным, а может выполнять регуляторную роль.
Окисление остатков метионина в антитромбине III
АФК может способствовать прокоагулянтному состоянию крови за счет окислительных модификаций белков, участвующих в коагуляции (Gutmann et al., 2020; Wang, Zennadi et al., 2020).
Антитромбин III (АТIII) принадлежит к широкому семейству ингибиторов сериновых протеаз (серпины). АТIII является наиболее важным физиологическим ингибитором в процессах коагуляции, ингибируя активность прокоагулянтных протеаз, которые участвуют как во внутреннем пути, так и во внешнем пути свертывания крови (Olson et al., 2004). Эффективность процесса инактивации антитромбином целевых протеаз зависит от связывания им кофактора – гепарина (Rau et al., 2007).
Антикоагулянтная активность ATIII, главным образом, опосредуется способностью экспонированной, то есть находящейся в открытой конформации, центральной реактивной петли серпина (RCL, reactive centre loop), включающей остатки Ala383–Val400, захватывать молекулу тромбина. В результате атаки реактивной петли АТ каталитическим центром тромбина Ser195 пептидная связь Arg393-Ser394 разрывается, и происходит образование необратимого неактивного комплекса (Olson, Björk, 1994). Каталитическая архитектура тромбина разрушается, то есть происходит потеря его упорядоченной структуры, вследствие чего протеаза теряет врожденное свойство взаимодействовать с ее субстратами (Rau et al., 2007). Конформационная подвижность RCL обеспечивается связыванием гепарина с гепарин-связывающим доменом АТ.
Как было установлено, гепарин-связывающая способность антитромбина снижается после его окисления перекисью водорода (van Patten et al., 1999) или перекисью липидов (De Cristofaro, Landolfi, 2000). АФК может нарушать взаимодействие между тромбином и комплексом АТIII–гепарин (Gray, Barrowcliffe, 1985) и, кроме того, дополнительно снижать гепарин-связывающую способность антитромбина.
AT оказался уязвимым к окислению хлорамином, причем инактивация ингибитора прямо коррелировала с дозой окислителя (Stief et al., 1988). В той же работе была исследована хлорамин-индуцированная инактивация двух других ингибиторов сериновых протеаз – альфа-1-протеиназы (A1-P1) и ингибитора активатора плазминогена 1 (PAI-1), для которых удалось показать, что механизм инактивации заключается в превращении метионина в метионинсульфоксид в реактивном центре этих белков. Сопоставление эффектов окисления на функциональные свойства АТ, не имеющего остатков метионина в структуре RCL, и A1-P1, PAI-1, дало авторам основание предположить, что окисление, по-видимому, является общим механизмом изменения баланса между сериновыми протеазами и их ингибиторами в пользу протеаз (Stief et al., 1988).
АТ содержит 12 метионинов, четыре из которых расположены наиболее близко к поверхности белка. В трехмерной структуре два из этих остатков метионина, Met314 и Met315, расположены рядом с RCL AT. Еще два экспонированных метионина, Met17 и Met20, находятся в непосредственной близости с участком связывания AT с гепарином (Carrell et al., 1994). Детальное исследование возможной роли метионинов в окислительной модификации АТ, обработанного перекисью водорода, было выполнено с привлечением метода масс-спектрометрии (van Patten et al., 1999). Было обнаружено, что Met314 и Met315 являются наиболее чувствительными к окислению, но их окисление не влияло ни на антитромбиновую активность, ни на связывание гепарина. Метионины в положениях 17 и 20 были более резистентными к окислению. Их модификация происходила только при значительно более высоких концентрациях пероксида и сопровождалась снижением аффинности к гепарину. Однако при насыщающих концентрациях гепарина активность только незначительно снижалась для этих сильно окисленных образцов AT. Структурные исследования выявили интересную особенность, что высокоокисленный AT является менее склонным подвергаться значительным конформационным изменениям, вызванным гепарином, наиболее вероятно, из-за окисления Met17. На основании полученных результатов авторы сделали вывод (van Patten et al., 1999), что поскольку этого не происходит в менее окисленных и, по-видимому, более физиологически значимых формах АТ, окисление не является средством контроля активности АТ.
Таким образом, мы можем констатировать, что молекула АТ обладает, по крайней мере, двумя антиоксидантными метионинами, Met314 и Met315 (van Patten et al., 1999), препятствующими окислительному повреждению структуры петли, жизненно важной для экспрессии функции белка.
Антиоксидантные метионины в структуре коагуляционного фактора крови XIII
Коагуляционный фактор крови XIII (FXIII) является крайне мало изученным белком в отношении подверженности его окисленной модификации. Только относительно недавно были начаты исследования в этом направлении. В данном разделе суммированы результаты по антиоксидантной роли метиониновых остатков в этом белке.
FXIII играет ведущую роль в поддержании процессов коагуляции и фибринолиза. Он осуществляет как ковалентное сшивание фибриновых полимеров, являющихся матрицей кровяного сгустка, так и сшивание фибрина с белками фибринолитической системы.
FXIII представляет собой гетеротетрамерный профермент FXIII-A2B2, который состоит из двух каталитических субъединиц A (FXIII-A) и двух идентичных регуляторных субъединиц B (FXIII-В). Все четыре субъединицы скреплены нековалентными связями. Каталитическая полипептидная цепь образует пять различных структурных доменов: N-концевой участок длиной 37 аминокислот на субъединице FXIII-A, называемый пептидом активации (FXIII-AP), β-сэндвич, каталитический домен, содержащий активный сайт (остатки Cys314, His373 и Asp396) и домены β-баррель 1 и β-баррель 2 (Bagoly, Muszbek, 2019). β-Сэндвич-домены и домены β-баррель 1 и β-баррель 2 почти полностью состоят из структур типа β-sheet с небольшим включением α-спиралей в сэндвич-доменах и β-баррель 1. Каталитический домен содержит структуры как β-складчатых листов, так и α-спирали. Пространственная структура димера каталитических субъединиц FXIII, полученная на основании рентгенструктурного анализа, представлена на рис. 4. Как видно из рис. 4, мономеры субъединицы FXIII-A образуют димер, напоминающий шестиугольник с симметрией C2, в котором два центральных каталитических домена окружены структурами шести β-складчатых листов.
Рис. 4.
Изображение кристаллической димерной структуры каталитических субъединиц FXIII (PDB ID: 1F13) с окислительными модификациями метиониновых остатков, обнаруженных в окисленных образцах профермента. Левый (темный) и правый (светлый) мономеры представляют собой структуру каталитической субъединицы FXIII, обработанную озоном и гипохлоритом, соответственно. Черным цветом обозначены остатки метионина, окислительные модификации которых были обнаружены в образцах как обработанных озоном, так и обработанных гипохлоритом; заштрихованы – аминокислотные остатки метионина, которые были модифицированы только при окислении озоном; серые – только для образцов, обработанных гипохлоритом.

Регуляторная субъединица свернута в 10 так называемых суши-доменов, каждый из которых содержит ~60 аминокислот и ковалентно стабилизирован парой внутренних дисульфидных связей (Souri et al., 2008). По данным электронной микроскопии субъединица B выглядит как тонкая, гибкая и изогнутая нить (Carrell et al., 1989). Однако до настоящего времени FXIII-B в кристаллической форме не получена, и достоверная информация о ее трехмерной структуре отсутствует.
Этот белок интересен не только тем, что в отличие от всех других ферментов системы свертывания крови, которые относятся к сериновым протеиназам, FXIII является членом семейства ферментов трансглутаминаз, но также и тем, что превращение профермента FXIII-A2B2 в активную форму фермента является многостадийным процессом. Очень кратко об активации: первая стадия заключается в тромбин-катализируемом протеолитическом расщеплении связи Arg37-Gly38 на NH2-конце субъединицы FXIII-A, приводящей к высвобождению активационного пептида. Это расщепление вызывает превращение гетеротетрамера FXIII-A2B2 в гетеротетрамер ${\text{FXIII - A}}_{{\text{2}}}^{{\text{'}}}{{{\text{B}}}_{{\text{2}}}}$. Вторая стадия активации обусловлена связыванием ионов кальция с FXIII-A', сопровождаемым конформационными перестройками и диссоциацией гетеротетрамера ${\text{FXIII - A}}_{{\text{2}}}^{{\text{'}}}{{{\text{B}}}_{{\text{2}}}}$ на димеры, субъединицы ${\text{FXIII - A}}_{{\text{2}}}^{{\text{'}}}$ и FXIII-B2. На последней стадии активации под влиянием ионов кальция ${\text{FXIII - A}}_{{\text{2}}}^{{\text{'}}}$ претерпевает также крупномасштабные конформационные перестройки, превращаясь в активную форму фермента, FXIII-A* (Bagoly, Muszbek, 2019; Protopopova et al., 2019).
Проведенные масс-спектрометрические исследования озон-индуцированного окисления профермента показали, что из 18 остатков метионина, присутствующих в первичной структуре белка, 14 остатков были идентифицированы в нативном образце FXIII, и 9 из них оказались поврежденными окислением в образце FXIII, обработанном озоном. Эти остатки были локализованы в домене β-сэндвич (Met159), каталитическом домене (Met265, Met350, Met474, Met475 и Met499) и домене β-баррель 2 (Met646, Met676, Met709). Поскольку эти остатки проявляли повышенную восприимчивость к окислению, казалось, что они являются экспонированными, выполняя роль перехватчиков молекул озона. Другие пять остатков Met – Met247, Met380, Met406, Met520 и Met595 были значительно менее подвержены окислению и, как полагали авторы (Vasilyeva et al., 2018), вероятно локализованы внутри белковой глобулы и становятся экспонированными только во время конформационных перегруппировок молекулы вследствие активации.
Однако результаты более раннего исследования трансглутаминазной активности FXIII-A*, образованного из окисленного озоном профермента, свидетельствовали о том, что FXIII-A* несколько терял в своей ферментативной активности (Rosenfeld et al., 2013). Это затрудняло точную идентификацию антиоксидантных метионинов в белке.
Опосредованное гипохлоритом окисление FXIII на разных этапах его ферментативной активации показало, что белок в форме профермента, как и в случае озона, проявлял максимальную резистентность к индуцированному окислению, в то время как фермент обнаруживал наибольшую уязвимость к гипохлориту (Vasilyeva et al., 2020). Результаты ВЭЖХ-МС/МС (высокоэффективная жидкостная хроматография в сочетании с тандемной масс-спектрометрией) выявили в проферменте, окисленном 150 мкМ гипохлоритом, целый ряд модифицированных метионинов: Met242, Met350, Met406, Met474, Met475, Met499 и Met512, Met520, Met595, Met646, Met676, Met709, принадлежащих каталитической субъединице. Так как профермент, обработанный 150 мкМ гипохлоритом, полностью сохранял свою ферментативную активность, присущую неповрежденному белку, был сделан вывод, что все вышеперечисленные метионины функционируют в качестве эндогенных антиоксидантов. Многие из этих остатков являются общими для озон-, и гипохлорит-индуцированного окисления профермента (рис. 4). В то же время, в окисленном ферменте были обнаружены два дополнительных модифицированных метионина в положениях 265 и 292, что является индикатором того, что в проферменте эти метионины находились в гидрофобном ядре субъединицы A и при активации белка они мигрировали на поверхность, становясь мишенью для молекул окислителя.
Что касается регуляторной субъединицы, в ней удалось идентифицировать несколько окисленных метионинов: Met29 – в первом суши-домене, Met94 – во втором, Met383 и Met448 – в седьмом, Met441 в – восьмом. Авторы полагают, что эти метионины вносят дополнительный вклад в антиоксидантную защиту белка (Vasilyeva et al., 2020).
Совсем недавно были получены данные о том, что в образцах плазмы, собранных у здоровых добровольцев, индуцированное окисление 500 мкМ HOCl/−OCl не изменяло ферментативную активность FXIII (Misztal et al., 2019). Поскольку в плазме FXIII циркулирует вместе с другими белками, превалирующими по концентрации, каждый из которых способен в той или иной степени перехватывать АФК, тем самым ограничивая окисление FXIII, можно предположить, что окислительная модификация FXIII будет затрагивать, в основном, поверхностно экспонированные аминокислотные остатки метионина (Vasilyeva et al., 2020). Физиологическая целесообразность такой антиоксидантной адаптации остается пока не вполне понятной. Полагают, что такая адаптация может быть эффективной при воспалительных процессах. В очаге воспаления локальный уровень HOCl/−OCl может достигать миллимолярных концентраций (Stief et al., 2000). В плазме крови FXIII, как известно, нековалентно связан с фибриногеном (Souri et al., 2015), который, в свою очередь, путем связывания с интегрином (Mac-1), экспрессируемым на активированных лейкоцитах, обеспечивает ключевую связь между тромбозом и воспалением (Lishko et al., 2004). При высоких локальных концентрациях HOCl/–OCl можно ожидать, что трансглутаминазная активность FXIII-A*, будет снижена, что приведет к уменьшению количества α-полимеров в фибриновой сети (Vasilyeva et al., 2020). Поскольку α-полимеры вносят существенный вклад в устойчивость фибрина к гидролизу плазмина (Rijken et al., 2017), их уменьшающееся количество можно рассматривать как компенсаторный механизм, когда устойчивый к плазмину фибрин с аномальной структурой образуется из поврежденного окислением фибриногена.
Фибриноген: окислительные модификации метионинов и функциональные последствия
В последние годы были опубликованы прекрасные обзорные статьи, в которых дано очень подробное описание структуры и биохимии фибриногена (Kattula et al., 2017; Weisel, Litvinov, 2017). В этой связи мы практически не будем останавливаться на этих аспектах молекулы фибриногена, и каждый читатель может подчерпнуть необходимую информацию из цитируемых выше работ.
Вероятно, фибриноген является одним из наиболее изучаемых белков в отношении его окисления и функциональных последствий. Такой повышенный интерес к этому белку может быть обусловлен его огромной значимостью в гемостазе и во многих других физиологических и патофизиологических процессах (Kattula et al., 2017; Weisel, Litvinov, 2017), а также его наиболее высокой окислительной уязвимостью среди других белков плазмы крови (Shacter et al., 1994).
В 2012 году была опубликована работа (Weigandt et al., 2012), в которой сообщалось, что обработка фибриногена хлорноватистой кислотой в физиологически близких концентрациях преимущественно окисляет специфические остатки метионина αMet476, βMet367 и γMet78, которые локализованы в αC-домене, COOH-концах Bβ-цепи и α-суперспиральном участке γ-цепи, соответственно. Значимость этой работы заключается в том, что впервые было сопоставлено нарушение функциональных свойств окисленного фибриногена, имеющего результатом ингибирование процесса латеральной агрегации фибриновых фибрилл, с конкретным окислительным сайтом, Met476, локализованным на αC-доменах молекулы фибриногена. Так как латеральная агрегация протофибрилл фибрина опосредуется взаимодействующими между собой αC-доменами (Weisel, Litvinov, 2017), было высказано предположение (Weigandt et al., 2012; Martinez et al., 2013; Pederson, Interlandi, 2019), что окислительная модификация Met476 способна нарушить эти взаимодействия.
Последующие исследования индуцированного окисления фибриногена различными окисляющими агентами также обнаружили ряд остатков метионинов, превращенных в метионинсульфоксид (Юрина и др., 2019, 2020; Yurina et al., 2019; Sovová et al., 2020), принадлежащих всем трем полипептидным цепям белка. Во всех случаях, то есть независимо от вида и дозы окислителя, в списке модифицированных метионинов присутствовали три метионина – АαMet476, BβMet367 и γMet78. Топография окисленных остатков метионинов в молекуле фибриногена при его индуцированном окислении озоном, гипохлоритом и перекисью водорода представлена на рис. 5.
Рис. 5.
Топография окисленных остатков метионина (обозначены черным цветом) в молекуле фибриногена (PDB ID: 3GHG) при его индуцированном окислении озоном, гипохлоритом и перекисью водорода. Молекула фибриногена состоит из двух идентичных субъединиц, каждая из которых формируется тремя разными полипептидными цепями – Aα, Bβ и γ, состоящими из 610, 461 и 411 аминокислотных остатков. Молекула фибриногена включает ряд структурных элементов: центральную область Е, образованную NH2-концевыми участками всех шести полипептидных цепей, две периферические области D, COOH-концевые участки β- и γ-цепей которых формируют глобулярные β- и γ-узлы. В свою очередь, области Е и D связаны между собой суперспиральными сегментами, составленными из медиальных участков Aα-, Bβ- и γ-цепей. COOH-концевые участки Aα-цепи формируют αС-область, состоящую из αС-домена и гибкого αС-коннектора (не показаны на рисунке).

С помощью масс-спектрометрии были выявлены окислительные модификации метионинов в структуре фибриногена в плазме крови доноров и у пациентов с коагулопатией, возникающей вследствие травмы (White et al., 2016). Метионинсульфоксиды находились в семи различных положениях, но у субъектов, страдающих коагулопатией, они были слегка повышены только в положениях BβMet314 и AαMet476, по сравнению с контрольной группой (White et al., 2016).
При анализе роли модифицированных окислением метионинов в самосборке фибрина возникает ощущение сложности и некоторой запутанности в возможности достаточно строго обоснованного приписывания им антиоксидантных или функциональных свойств. Например, в выполненных исследованиях (Weigandt et al., 2012; White et al., 2016) декларируется функциональная значимость остатка AαMet476, подтверждаемая результатами компьютерного моделирования структуры и динамики взаимодействий αС-доменов, которые демонстрируют снижение вероятности образования димеров αС-доменов за счет окисления AαMet476 (Pederson, Interlandi, 2019).
Попытаемся в этом разобраться более подробно. Каждый αC-домен состоит из двух независимо свернутых структур – N- и C-концевых субдоменов, образованных остатками Aα392–503 и Aα504–610, соответственно (Weisel, Litvinov, 2017). Полимеризация αC-αC включает два механизма. Один из них состоит в самоассоциации αC-доменов, которая происходит посредством взаимодействующих структур, β-шпилек, принадлежащих N-концевым субдоменам (Tsurupa et al., 2012). Окисление AαMet476, как предполагается, опосредует ингибирование боковой агрегации протофибрилл фибрина путем нарушения ключевой структуры β-шпильки (Burney et al., 2014).
Второй механизм заключается во взаимодействии C-концевого субдомена с αC-коннектором (Tsurupa et al., 2012). Из представленного в работах списка модификаций метионинов (Юрина и др., 2019, 2020; Yurina et al., 2019; Sovová et al., 2020), следует, что в αС-области (αС-домен, соединенный с αС-коннектором) имеется целый ряд окисленных метионинов, среди которых могут быть функционально значимые для сборки фибрина, кроме AαMet476. В частности, можно предположить, что модификация метионинов в αС-коннекторе, Met235, Met238 и Met240, нарушает его структурную гибкость, не позволяющую ему в полной мере обеспечить взаимодействия с C-концевым субдоменом αC-домена. Кроме того, в самом C-концевом субдомене идентифицированы окислительные модификации метионинов АαMet517 и АαMet584, которые также могли бы обусловливать ингибирование процесса латеральной агрегации. Если к этому добавить, что αC-области не являются единственно необходимыми для латеральной агрегации (Weisel, Litvinov, 2017), то есть имеются также и другие структуры, ответственные за этот процесс, ситуация с трактовкой роли АαMet517 становится совсем неодназначной.
И наконец то, что AαMet476 оказывается легко окисляемым не только благодаря индуцированному окислению, но уже содержится в окисленной форме в исходных, то есть необработанных образцах (Юрина и др., 2019, 2020; Yurina et al., 2019), подразумевает, что этот метионин может располагаться на белковой поверхности или близко к ней. Такой метионин, как многократно указывалось в настоящей работе, скорее является антиоксидантным, нежели выполняет важную функциональную роль. Это в полной мере можно отнести и к остаткам BβMet367 и γMet78.
Таким образом, только дальнейшие исследования посттрансляционных модификаций в фибриногене и последующих нарушений в его функциональных свойствах смогут внести полную ясность в эту крайне запутанную проблему (De Vries et al., 2020; Kattula et al., 2020).
ЗАКЛЮЧЕНИЕ
В данной обзорной работе рассмотрены некоторые примеры окисления метионинов во внутриклеточных и плазменных белках и их возможная роль в поддержании или нарушении функционирования этих белков. Во внутриклеточных белках ферментативное окисление метионинов, способность метионинсульфоксид редуктаз полностью восстанавливать метионинсульфоксиды в исходную форму, а также наличие антиоксидантных метионинов являются важными механизмами регуляции клеточных функций. Некоторые плазменные белки могут обладать большим количеством антиоксидантных метионинов, в то время как другие – теряют свою активность при окислении единственного остатка. Физиологический смысл этого феномена пока остается неясным. Большинство наших сегодняшних представлений о конкретных белковых мишенях и функциональных последствиях окисления метионина в белках получены из исследований in vitro и очень ограниченно in vivo. Поэтому многое еще предстоит изучить, чтобы понять эволюционную роль окисления метионинов в белках в поддержании гомеостаза и те причины, которые способствуют развитию патологий. В любом случае, если еще какое-то время назад предполагали, что окисление белков носит случайный характер, сейчас, очевидно, что это не так, и окисление подчиняется определенной программе, смысл которой нам еще до конца не ясен. Важную роль в идентификации модифицированных метионинов сыграло развитие метода масс-спектрометрии высокого разрешения, способного дифференцировать метионины по их окислительной уязвимости в структуре белков, свидетельствующее об их пространственном расположении. Однако новые методы и модели необходимы для более глубокого и всестороннего понимания механизмов, регулирующих специфические реакции окисления метионинов в белках в живом организме.
Список литературы
Гривенникова В.Г., Виноградов А.Д. Генерация активных форм кислорода митохондриями // Успехи биол. хим. 2013. Т. 53. С. 245–296.
Карбышев М.С., Абдуллаев Ш.П. Биохимия оксидативного стресса. Учебно-методическое пособие / Ред. А.В. Шестопалов. М.: Издательство ХХ, 2018. 60 с.
Ланкин В.3., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при патологических состояниях (пособие для врачей). М.: РКНПК МЗ РФ, 2001. 78 с.
Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. М.: Фирма “Слово”, 2006. 556 с.
Панасенко О.М., Горудко И.В., Соколов А.В. Хлорноватистая кислота как предшественник свободных радикалов в живых системах // Успехи биол. хим. 2013. Т. 53. С. 195–244.
Юрина Л.В., Васильева А.Д., Бугрова А.Е. и др. Индуцированная гипохлоритом окислительная модификация фибриногена // ДАН. 2019. Т. 484. С. 367–371.
Юрина Л.В., Васильева А.Д., Кононенко В.Л. и др. Структурно-функциональные повреждения фибриногена в результате пероксид-индуцированного окисления // ДАН. 2020. Т. 492. С. 287–292.
Aledo J.C. Methionine in proteins: the Cinderella of the proteinogenic amino acids // Protein Science. 2019. V. 28. P. 1785–1796.
Aledo J.C., Cantón F.R., Veredas F.J. Sulphur atoms from methionines interacting with aromatic residues are less prone to oxidation // Sci. Rep. 2015. V. 5. P. 16955.
Aledo J.C., Li Y., de Magalhães J.P. et al. Mitochondrially encoded methionine is inversely related to longevity in mammals // Aging Cell. 2011. V. 10. P. 198–207.
Aledo J.C., Valverde H., De Magalhães J.P. Mutational bias plays an important role in shaping longevity-related amino acid content in mammalian mtDNA-encoded proteins // J. Mol. Evol. 2012. V. 74. P. 332–341.
Bagoly Z., Muszbek L. Factor XIII: what does it look like? // J. Thromb. Haemost. 2019. V. 17. P. 714–716.
Barbato G., Ikura M., Kay L.E. et al. Backbone dynamics of calmodulin studied by 15N relaxation using inverse detected two-dimensional NMR spectroscopy: the central helix is flexible // Biochemistry. 1992. V. 31. V. 5269–5278.
Bender A., Hajieva P., Moosmann B. Adaptive antioxidant methionine accumulation in respiratory chain complexes explains the use of a deviant genetic code in mitochondria // PNAS USA. 2008. V. 105. P. 16496–16501.
Bruschi M., Candiano G., Santucci L., Ghiggeri G.M. Oxidized albumin. The long way of a protein of uncertain function // Biochim. Biophys. Acta. 2013. V. 1830. P. 5473–5479.
Burney P.R., White N., Pfaendtner J. Structural effects of methionine oxidation on isolated subdomains of human fibrin D and αC regions // PLoS One. 2014. V. 9. P. 1–10.
Carocho M., Ferreira I.C. A review on antioxidants, prooxidants and related controversy: natural and synthetic compounds, screening and analysis methodologies and future perspectives // Food Chem. Toxicol. 2013. V. 51. P. 15–25.
Carrell N.A., Erickson H.P., McDonagh J. Electron microscopy and hydrodynamic properties of factor XIII subunits // J. Biol. Chem. 1989. V. 264. P. 551–556.
Carrell R.W., Stein P.E., Fermi G., Wardell M.R. Biological implications of a 3 Å structure of dimeric antithrombin // Structure. 1994. V. 2. P. 257–270.
Cater J.H, Wilson M.R., Wyatt A.R. Alpha-2-macroglobulin, a hypochlorite-regulated chaperone and immune system modulator // Oxid. Med. Cell. Longev. 2019. P. 5410657.
Chao C.C., Ma Y.S., Stadtman E.R. Modification of protein surface hydrophobicity and methionine oxidation by oxidative systems // PNAS USA. 1997. V. 94. P. 2969–2974.
Chen B., Mayer M.U., Squier T.C. Structural uncoupling between opposing domains of oxidized calmodulin underlies the enhanced binding affinity and inhibition of the plasma membrane Ca-ATPase // Biochemistry. 2005. V. 44. P. 4737–4747.
Chin D., Means A.R. Calmodulin: a prototypical calcium sensor // Trends Cell. Biol. 2000. V. 10. P. 322–328.
Chyan C.-L., Irene D., Lin S.-M. The recognition of calmodulin to the target sequence of calcineurin – a novel binding mode // Molecules. 2017. V. 22. P. 1584.
Cobley J.N. Mechanisms of mitochondrial ROS production in assisted reproduction: the known, the unknown, and the intriguing // Antioxidants (Basel). 2020. V. 9. P. 933.
Dahl J.U., Gray M.J., Jakob U. Protein quality control under oxidative stress conditions // J. Mol. Biol. 2015. V. 427. P. 1549–1563.
Davies M J. Protein oxidation and peroxidation // Biochem. J. 2016. V. 473. P. 805–825.
De Cristofaro R., Landolfi R. Oxidation of human alpha-thrombin by the myeloperoxidase-H2O2-chloride system: structural and functional effects // Thromb. Haemost. 2000. V. 83. P. 253–261.
De Vries J.J., Snoek C.J.M., Rijken D.C., de Maat M.P.M. Effects of post-translational modifications of fibrinogen on clot formation, clot structure, and fibrinolysis // Arterioscler. Thromb. Vasc. Biol. 2020. V. 40. P. 554–569.
Douglas T., Daniel D.S., Parida,B.K. et al. Methionine sulfoxide reductase A (MsrA) deficiency affects the survival of Mycobacterium smegmatis within macrophages // J. Bacteriol. 2004. V. 186. P. 3590–3598.
Drazic A., Winter J. The physiological role of reversible methionine oxidation // Biochim. Biophys. Acta. 2014. V. 1844. P. 1367–1382.
Elmallah M.I., Borgmeyer U., Betzel C., Redecke L. Impact of methionine oxidation as an initial event on the pathway of human prion protein conversion // Prion. 2013. V. 7. P. 404–411.
Gan Q.F., Witkop G.L., Sloane D.L. et al. Identification of a specific methionine in mammalian 15-lipoxygenase which is oxygenated by the enzyme product 13-HPODE: dissociation of sulfoxide formation from self-inactivation // Biochemistry. 1995. V. 34. P. 7069–7079.
Garner B., Waldeck A.R., Witting P.K. et al. Oxidation of high density lipoproteins. II. Evidence for direct reduction of lipid hydroperoxides by methionine residues of apolipoproteins AI and AII // J. Biol. Chem. 1998. V. P. 6088–6095.
Gellman S.H. On the role of methionine residues in the sequence independent recognition of nonpolar protein surfaces // Biochemistry. 1991. V. 30. P. 6633–6636.
Gifford J.L., Walsh M.P., Vogel H.J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs // Biochem. J. 2007. V. 405. P. 199–221.
Gray E., Barrowcliffe T.W. Inhibition of antithrombin III by lipid peroxides // Thromb. Res. 1985. V. 37. P. 241–250.
Griffiths H.R., Dias I.H., Willetts R.S., Devitt A. Redox regulation of protein damage // Redox. Biol. 2014. V. 2. P. 430–435.
Grintsevich E.E., Ge P., Sawaya M.R. et al. Catastrophic disassembly of actin filaments via Mical-mediated oxidation // Nat. Commun. 2017. V. 8. P. 2183.
Grintsevich E.E., Yesilyurt H.G., Rich S.K. et al. F-actin dismantling through a redox-driven synergy between Mical and cofilin // Nat. Cell. Biol. 2016. V. 18. V. 876–885.
Grune T., Catalgol B., Jung T. Protein oxidation and aging // Wiley Online Library. 2013. P. 524.
Grune T., Reinheckel T., Davies K.J. Degradation of oxidized proteins in K562 human hematopoietic cells by proteasome // J. Biol. Chem. 1996. V. 271. P. 15504–15509.
Gu S.X., Stevens J.W., Lentz S.R. Regulation of thrombosis and vascular function by protein methionine oxidation // Blood. 2015. V. 125. 3851–3859.
Gutmann C., Siow R., Gwozdz A.M. et al. Reactive oxygen species in venous thrombosis // Int. J. Mol. Sci. 2020. V. 21. P. 1918.
Hawkins C.L., Pattison D.I., Davies M.J. Hypochlorite-induced oxidation of amino acids, peptides and proteins // Amino Acids. 2003. V. 25. P. 259–274.
Hsu Y.R., Narhi L.O., Spahr C. In vitro methionine oxidation of Escherichia coli-derived human stem cell factor: effects on the molecular structure, biological activity, and dimerization // Protein Sci. 1996. V. 5. P. 1165–1173.
Hung R-J., Park C.W., Terman J.R. Direct redox regulation of F-actin assembly and disassembly by Mical // Science. 2011. V. 334. P. 1710–1714.
Hung R.-J., Spaeth C.S., Yesilyurt H.G., Terman J.R. SelR reverses Mical-mediated oxidation of actin to regulate F-actin dynamics // Nat. Cell. Biol. 2013. V. 15. P. 1445–1454.
Kattula S., Byrnes J.R., Wolberg A.S. Fibrinogen and fibrin in hemostasis and thrombosis // Arterioscler. Thromb. Vasc. Biol. 2017. V. 37. P. e13–e21.
Keck R.G. The use of t-butyl hydroperoxide as a probe for methionine oxidation in proteins // Anal. Biochem. 1996. V. 236. P. 56–62.
Khan S.A., Khan F.H. Hydroxyl radical mediates oxidative modification of caprine alpha-2-macroglobulin // Protein Pept. Lett. 2009. V. 16. P. 32–35.
Le-Donne I., Rossi R., Milzani A. et al. The actin cytoskeleton response to oxidants: from small heat shock protein phosphorylation to changes in the redox state of actin itself // Free Radic. Biol. Med. 2001. V. 31. P. 1624–1632.
Lim J.C., Kim G., Levine R.L. Stereospecific oxidation of calmodulin by methionine sulfoxide reductase A // Free Radic. Biol. Med. 2013. V. 61. P. 257–264.
Lim J., Kim G., Levine R. Methionine in proteins: it’s not just for protein initiation anymore // Neurochem. Res. 2019. V. 44. P. 1–11.
Lim J.C., You Z., Kim G., Levine R.L. Methionine sulfoxide reductase A is a stereospecific methionine oxidase // PNAS USA. 2011. V. 108. P. 10472–10477.
Lishko V.K., Podolnikova N.P., Yakubenko V.P. et al. Multiple binding sites in fibrinogen for integrin alphaMbeta2 (Mac-1) // J. Biol. Chem. 2004. V. 279. P. 44897–44906.
Liu F., Chu X., Lu H.P., Wang J. Molecular mechanism of multispecific recognition of calmodulin through conformational changes // PNAS. USA. 2017. V. 114. P. E3927–E3934.
Lu A.L., Li X., Gu Y. et al. Repair of oxidative DNA damage: mechanisms and functions // Cell. Biochem. Biophys. 2001. V. 35. P. 141–170.
Manta B., Gladyshev V.N. Regulated methionine oxidation by monooxygenases // Free Radic. Biol. Med. 2017. V. 109. P. 141–155.
Marimoutou M., Springer D.A., Liu C. et al. Oxidation of methionine 77 in calmodulin alters mouse growth and behavior // Antioxidants (Basel). 2018. V. 7 (10). P. 140.
Marrero A., Duquerroy S., Trapani S. et al. The crystal structure of human alpha2-macroglobulin reveals a unique molecular cage // Angewandte Chemie. (Internat. ed. in English). 2012. V. 51. P. 3340–3344.
Martinez M., Weisel J.W., Ischiropoulos H. Functional impact of oxidative posttranslational modifications on fibrinogen and fibrin clots // Free Radic. Biol. Med. 2013. V. 65. P. 411–418.
McCarthy M.R., Thompson A.R., Nitu F. et al. Impact of methionine oxidation on calmodulin structural dynamics // Biochem. Biophys. Res. Commun. 2015. V. 456. P. 567–572.
Milzani A., Rossi R., Di Simplicio P. et al. The oxidation produced by hydrogen peroxide on Ca-ATP-G-actin // Protein Sci. 2000. V. 9. P. 1774–1782.
Misztal T., Golaszewska A., Tomasiak-Lozowska M.M. et al. The myeloperoxidase product, hypochlorous acid, reduces thrombus formation under flow and attenuates clot retraction and fibrinolysis in human blood // Free Radic. Biol. Med. 2019. V. 141. P. 426–437.
Moskovitz J., Bar-Noy S., Williams W.M. et al. Methionine sulfoxide reductase (MsrA) is a regulator of antioxidant defense and lifespan in mammals // PNAS USA. 2001. V. 98. P. 12920–12925.
Moskovitz J., Berlett B.S., Poston J.M., Stadtman E.R. The yeast peptide-methionine sulfoxide reductase functions as an antioxidant in vivo // PNAS USA. 1997. V. 94. P. 9585–9589.
Moskovitz J., Flescher E., Berlett B.S. et al. Overexpression of peptide-methionine sulfoxide reductase in Saccharomyces cerevisiae and human T cells provides them with high resistance to oxidative stress // PNAS USA. 1998. V. 95. P. 14071–14075.
Moskovitz J., Levine R.L., Stadtman E.R. Oxidation of methionine in proteins roles in antioxidant defense and cellular regulation // IUBMB Life. 2000. V. 50. P. 301–317.
Nimalaratne C., Wu J. Hen egg as an antioxidant food commodity: a review // Nutrients. V. 2015. V. 7. P. 8274–8293.
Nishinaka Y., Masutani H., Nakamura H., Yodoi J. Regulatory roles of thioredoxin in oxidative stress-induced cellular responses // Redox Rep. 2001. V. 6. P. 289–295.
Oda T., Iwasa M., Aihara T. et al. The nature of the globular- to fibrous-actin transition // Nature. 2009. V. 457. P. 441–445.
Olson S.T., Björk I. Regulation of thrombin activity by antithrombin and heparin // Sem. Thromb. Hemost. 1994. V. 20. P. 373–409.
Olson S.T., Swanson R., Raub-Segall E. et al. Accelerating ability of synthetic oligosaccharides on antithrombin inhibition of proteinases of the clotting and fibrinolytic systems. Comparison with heparin and low-molecular-weight heparin // Thromb. Haemost. 2004. V. 92. P. 929–939.
Pederson E.N., Interlandi G. Oxidation-induced destabilization of the fibrinogen αC-domain dimer investigated by molecular dynamics simulations // Proteins. 2019. V. 87. P. 826–836.
Poljšak B., Fink R. The protective role of antioxidants in the defence against ROS/RNS-mediated environmental pollution // Oxid. Med. Cell. Longev. 2014. V. 2014. P. 1–22.
Protopopova A.D., Ramirez A., Klinov D.V. et al. Factor XIII topology: organization of B subunits and changes with activation studied with single-molecule atomic force microscopy // J. Thromb. Haemost. 2019. V. 17. P. 737–748.
Qin Z., Squier T.C. Calcium-dependent stabilization of the central sequence between Met(76) and Ser(81) in vertebrate calmodulin // Biophys. J. 2001. V. 81. P. 2908–2918.
Rau J.C., Beaulieu L.M., Huntington J.A., Church F.C. Serpins in thrombosis, hemostasis and fibrinolysis // J. Thromb. Haemost. 2007. V. 5. (Suppl. 1). P. 102–115.
Ray P.D., Huang B.-W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling // Cell. Signal. 2012. V. 24. P. 981–990.
Reddy V.Y., Desorchers P.E., Pizzo S.V. et al. Oxidative dissociation of human alpha 2-macroglobulin tetramers into dysfunctional dimers // J. Biol. Chem. 1994. V. 269. P. 4683–4691.
Rehman A.A., Ahsan H., Khan F.H. α-2-Macroglobulin: a physiological guardian // J. Cell. Physiol. 2013. V. 8. P. 1665–1675.
Rijken D.C., Uitte de Willige S. Inhibition of fibrinolysis by coagulation Factor XIII // Biomed. Res. Int. 2017. P. 1209676.
Rizzo A.M., Berselli P., Zava S. et al. Endogenous antioxidants and radical scavengers // Adv. Exp. Med. Biol. 2010. V. 698. P. 52–67.
Rivett A.J. Regulation of intracellular protein turnover: covalent modification as a mechanism of marking proteins for degradation // Curr. Top. Cell. Reg. 1986. V. 28. P. 291–337.
Rosenfeld M.A., Bychkova A.V., Shchegolikhin A.N. et al. Ozone-induced oxidative modification of plasma fibrin-stabilizing factor // Biochim. Biophys. Acta. 2013. V. 1834. P. 2470–2479.
Rosenfeld M.A., Vasilyeva A.D., Yurina L.V. et al. Oxidation of proteins: is it a programmed process? // Free Radic. Res. 2018. V. 52. P. 14–38.
Ruan H., Tang X.D., Chen M.L. et al. High-quality life extension by the enzyme peptide methionine sulfoxide reductase // PNAS USA. 2002. V. 99. P. 2748–2753.
Shacter E., Williams J.A., Lim M. Differential susceptibility of plasma proteins to oxidative modification: examination by Western blot immunoassay // Free Radic. Biol. Med. 1994. V. 17. P. 429–436.
Sigalov A.B., Stern L.J. Enzymatic repair of oxidative damage to human apolipoprotein A-I // FEBS Lett. 1998. V. 433. P. 196–200.
Simiczyjew A., Mazur A.J., Dratkiewicz E., Nowak D. Involvement of β- and γ-actin isoforms in actin cytoskeleton organization and migration abilities of bleb-forming human colon cancer cells // PLoS One. 2017. V. 12. P. e0173709.
Souri M., Kaetsu H., Ichinose A. Sushi domains in the subunit-B of factor XIII responsible for oligomer assembly // Biomolecules. 2008. V. 47. P. 8656–8664.
Souri M., Osaki T., Ichinose A. The non-catalytic B subunit of coagulation actor XIII accelerates fibrin cross-linking // J. Biol. Chem. 2015. V. 290. P. 12027–12039.
Sovová Ž., Štikarová J., Kaufmanová J. et al. Impact of posttranslational modifications on atomistic structure of fibrinogen // PLoS One. 2020. V. 15. P. e0227543.
Spahr C.S., Nahri L., Speakman J. et al. The effects of in vitro methionine oxidation on the bioactivity and structure of human keratinocyte growth factor // Protein Sci. 1996. V. 5. P. 299–308.
Stadtman E.R., Levine R.L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins // Amino Acids. 2003. V. 25. P. 207–218.
Stief T.W., Aab A., Heimburger N. Oxidative inactivation of purified human alpha-2-antiplasmin, antithrombin III, and C1-inhibitor // Thromb. Res. 1988. V. 49. P. 581–589.
Stief T. W., Kurz J., Doss M.O., Fareed J. Singlet oxygen inactivates fibrinogen, factor V, factor VIII, factor X, and platelet aggregation of human blood // Thromb. Res. 2000. V. 97. P. 473–480.
Stournaras C., Drewes G., Blackholm H. et al. Glutathionyl (cysteine-374) actin forms filaments of low mechanical stability // Biochim. Biophys. Acta. 1990. V. 1037. P. 86–91.
Tarrago L., Kaya A., Weerapana E. et al. Methionine sulfoxide reductases preferentially reduce unfolded oxidized proteins and protect cells from oxidative protein unfolding // J. Biol. Chem. 2012. V. 287. P. 24448–24459.
Tebar F., Chavero A., Agell N. et al. Pleiotropic roles of calmodulin in the regulation of KRas and Rac1 GTPases: functional diversity in health and disease // Int. J. Mol. Sci. 2020. V. 21. P. 3680.
Tse G., Yan B.P., Chan Y.W. et al. Reactive oxygen species, endoplasmic reticulum stress and mitochondrial dysfunction: the link with cardiac arrhythmogenesis // Front. Physiol. 2016. V. 7. P. 313.
Tsurupa G., Pechik I., Litvinov R.I. et al. On the mechanism of alphaC polymer formation in fibrin // Biochemistry. 2012. V. 51. P. 2526–2538.
van Patten S.M., Hanson E., Bernasconi R. et al. Oxidation of methionine residues in antithrombin. Effects on biological activity and heparin binding // J. Biol. Chem. 1999. V. 274. P. 10268–10276.
Vasilyeva A., Indeykina M., Bychkova A. et al. Oxidation-induced modifications of the catalytic subunits of plasma fibrin-stabilizing factor at the different stages of its activation identified by mass spectrometry // Biochim. Biophys. Acta. 2018. V. 1866. P. 875–884.
Vasilyeva A., Yurina L., Shchegolikhin A. et al. The structure of blood coagulation factor XIII is adapted to oxidation // Biomolecules. 2020. V. 10. P. 914.
Veredas F.J., Aledo J.C., Cantón F.R. Methionine residues around phosphorylation sites are preferentially oxidized in vivo under stress conditions // Sci. Rep. 2017. V. 7. P. 40403.
Vetter S.W., Leclerc E. Novel aspects of calmodulin target recognition and activation // Eur. J. Biochem. 2003. V. 270. P. 404–414.
Vogt W. Oxidation of methionyl residues in proteins: tools, targets, and reversal // Free Radic. Biol. Med. 1995. V. 18. P. 93–105.
Walgenbach D.G., Gregory A.J., Klein J.C. Unique methionine-aromatic interactions govern the calmodulin redox sensor // Biochem. Biophys. Res. Commun. 2018. V. 20. P. 236–241.
Walker E.J., Bettinger J.Q., Welle K.A. et al. Global analysis of methionine oxidation provides a census of folding stabilities for the human proteome // PNAS USA. 2019. V. 116. P. 6081–6090.
Wang J., Boja E.S., Tan W. et al. Reversible glutathionylation regulates actin polymerization in A431 cells // J. Biol. Chem. 2001. V. 276. P. 47763–47766.
Wang P., Wu Y., Li X. et al. Thioredoxin and thioredoxin reductase control tissue factor activity by thiol redox-dependent mechanism // J. Biol. Chem. 2013. V. 288. P. 3346–3358.
Wang Q., Zennadi R. Oxidative stress and thrombosis during aging: the roles of oxidative stress in RBCS in venous thrombosis // Int. J. Mol. Sci. 2020. V. 21. P. 4259.
Wang Z., Feng B., Xiao G., Zhou Z. Roles of methionine oxidation in E200K prion protein misfolding: implications for the mechanism of pathogenesis in E200K linked familial Creutzfeldt-Jakob disease // Biochim. Biophys. Acta. 2016. V. 1864. P. 346–358.
Weigandt K.M., White N., Chung D. et al. Fibrin clot structure and mechanics associated with specific oxidation of methionine residues in fibrinogen // Biophys. J. 2012. V. 103. P. 2399–2407.
Weisel J.W., Litvinov R.I. Fibrin formation, structure and properties // Subcell. Biochem. 2017. V. 82. P. 405−456.
Weissbach H., Resnick I., Brot N. Methionine sulfoxide reductases: history and cellular role in protecting against oxidative damage // Biochim. Biophys. Acta. 2005. V. 1703. P. 203–212.
White N.J., Wang Y., Fu X. et al. Post-translational oxidative modification of fibrinogen is associated with coagulopathy after traumatic injury // Free Radic. Biol. Med. 2016. V. 96. P. 181–189.
Wilson C., Terman J.R., González-Billault C., Ahmed G. Actin filaments-A target for redox regulation // Cytoskeleton. 2016. V. 73. P. 577–595.
Wu S.M., Patel D.D., Pizzo S.V. Oxidized alpha2-macroglobulin (alpha2M) differentially regulates receptor binding by cytokines/growth factors: implications for tissue injury and repair mechanisms in inflammation // J. Immunol. 1998. V. 161. P. 4356–4365.
Wyatt A.R., Kumita J.R., Farrawell N.E. et al. Alpha-2-macroglobulin is acutely sensitive to freezing and lyophilization: implications for structural and functional studies // PLoS One. 2015. V. 10. P. e0130036.
Wyatt A.R., Kumita J.R., Mifsud R.W. et al. Hypochlorite-induced structural modifications enhance the chaperone activity of human α2-macroglobulin // PNAS USA. 2014. V. 111. P. 2081–2090.
Xu K., Uversky V.N., Xue B. Local flexibility facilitates oxidization of buried methionine residues // Protein Pept. Lett. 2012. V. 19. P. 688–697.
Xu Q., Huff L.P., Fujii M., Griendling K.K. Redox regulation of the actin cytoskeleton and its role in the vascular system // Free Radic. Biol. Med. 2017. V. 109. P. 84–107.
Yamniuk A.P., Vogel H.J. Calmodulin’s flexibility allows for promiscuity in its interactions with target proteins and peptides // Mol. Biotechnol. 2004. V. 27. P. 33–57.
Yermolaieva O., Xu R., Schinstock C. et al. Methionine sulfoxide reductase A protects neuronal cells against brief hypoxia/reoxygenation // PNAS USA. 2004. V. 101. P. 1159–1164.
Yurina L., Vasilyeva A., Indeykina M. et al. Ozone-induced damage of fibrinogen molecules: identification of oxidation sites by high-resolution mass spectrometry // Free Radic. Res. 2019. V. 53. P. 430–455.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


