Успехи современной биологии, 2022, T. 142, № 2, стр. 138-152
Энтерогематический барьер при критических состояниях организма
Т. В. Шефер 1, *, О. А. Вакуненкова 2, **, Ю. Ю. Ивницкий 2, А. И. Головко 2
1 Государственный научно-исследовательский испытательный институт военной медицины
Санкт-Петербург, Россия
2 Научно-клинический центр токсикологии им. акад. С.Н. Голикова
Санкт-Петербург, Россия
* E-mail: schafer@yandex.ru
** E-mail: institute@toxicology.ru
Поступила в редакцию 07.12.2021
После доработки 31.12.2021
Принята к публикации 31.12.2021
- EDN: NAWPYE
- DOI: 10.31857/S0042132422020065
Аннотация
Энтерогематический барьер (ЭГБ) – система диффузионных препятствий, разделяющих кишечный химус и кровь. Цель обзора – идентификация роли дисфункции ЭГБ в формировании критических состояний организма и обоснование путей профилактики этих состояний. Дана характеристика токсичных веществ, продуцируемых нормальной кишечной микрофлорой. Показана вовлеченность эндотоксина и аммиака в патогенез сепсиса, острых нарушений кровообращения, вторичных острых поражений легких и острой церебральной недостаточности. Предложены подходы к защите ЭГБ при критических состояниях организма.
ВВЕДЕНИЕ
Юридический анализ причин смерти пациента предполагает выбор из четырех возможностей: несвоевременное, неправильное, недостаточное оказание медицинской помощи либо отсутствие ее связи с исходом заболевания (Гришин, 2018). Один из источников ошибки при таком выборе – непредсказуемость осложнений острых заболеваний, ярко проявившаяся в ходе эпидемии COVID-19 (Ponti et al., 2020). Непредсказуемость проявляется внезапным развитием критических состояний организма: сепсиса, острых нарушений кровообращения, вторичных острых поражений легких, острой церебральной недостаточности. Они возникают не у всех пациентов и изменчивы в проявлениях. Причины этой изменчивости требуют детализации.
Ранее мы показали (Ивницкий и др., 2020), что при острых отравлениях вероятность летальных осложнений возрастает в соответствии с исходным уровнем дисфункции сосудистого эндотелия. Некоторые из вызывающих ее гуморальных факторов являются продуктами жизнедеятельности нормальной микрофлоры кишечника (Liu et al., 2017). У здорового человека способность этих продуктов преодолевать энтерогематический барьер (ЭГБ) – систему структур, разделяющих кишечный химус и кровь, – незначительна. Утечка в кровь продуктов жизнедеятельности кишечной микрофлоры вовлечена в патогенез ряда хронических заболеваний (Tang et al., 2017). Последствия же массированного однократного поступления в кровь таких веществ на фоне действия экзогенного токсиканта мало изучены.
Можно предположить, что при острых заболеваниях прямое или опосредованное повреждение ЭГБ вызывает его вторичную дисфункцию и создает предпосылки к поступлению в кровь метаболитов и клеточных компонентов бактерий в дозах, влияющих на исход заболеваний. A priori состав смеси этих веществ зависит от состава кишечной микрофлоры, который индивидуально изменчив (Role of gut bacteria…, 2005), а по некоторым оценкам даже уникален (Choi et al., 2020). Его изменчивостью может быть обусловлена непредсказуемость осложнений острых заболеваний. Предметом настоящего обзора явились данные, позволяющие проверить эти гипотезы и проследить связь некоторых критических состояний организма с происходящими при них изменениями состояния ЭГБ.
Цель обзора: идентификация роли дисфункции ЭГБ в формировании критических состояний организма и обоснование подходов к их профилактике.
СУЩЕСТВЕННЫЕ СВЕДЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ ЭГБ
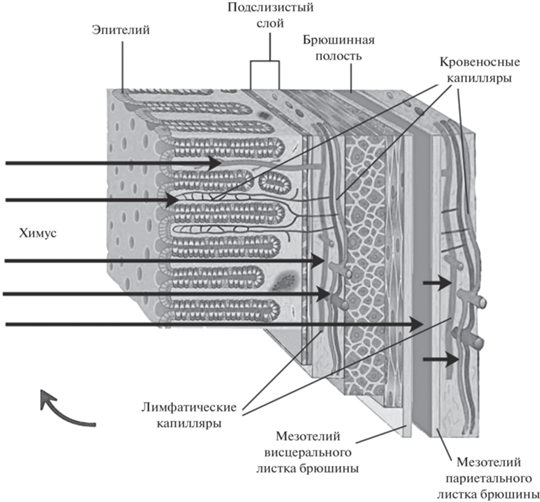
Еще 10 лет назад термин ЭГБ употребляли в значении “эпителий слизистой оболочки кишечника” (Rao, Wang, 2011, p. 4). Сегодня в ЭГБ включают также ассоциированных с эпителием симбионтных бактерий, муцин и эндотелий кровеносных и лимфатических капилляров подслизистого слоя (Liu et al., 2021). Вещества, ускользнувшие от абсорбции капиллярной сетью кишечной стенки, на своем пути в кровь преодолевают дополнительные элементы ЭГБ: гладкую мускулатуру кишки, два слоя брюшинного мезотелия (висцеральный, париетальный), слой смачивающей их брюшинной жидкости средней толщиной 0.5 мм и эндотелий гемо- и лимфокапилляров париетальной брюшины.
Слой муцина толщиной 150 мкм, состоящий из гидратированных гликопротеинов, отделяет эпителиальные клетки от агрессивной среды – химуса. Образование муцина нарушено при ишемии слизистой оболочки, что наиболее опасно для толстой кишки с ее высокой плотностью микробной колонизации. В норме симбионтные аэробные бактерии вытесняют патогенную микрофлору с апикальной поверхности энтеро- и колоноцитов, обеспечивают последние необходимыми субстратами (Role of gut bacteria…, 2005). Основная функция монослоя эпителиоцитов толщиною 20 мкм – избирательная абсорбция веществ из химуса.
Ввиду наличия ворсинок в тонкой кишке и крипт – в толстой площадь абсорбирующей поверхности слизистой оболочки желудочно-кишечного тракта (ЖКТ) близка к 200 м2 (Lopetuso et al., 2015). В норме абсорбция веществ в ЖКТ происходит преимущественно трансцеллюлярным путем. Доля парацеллюлярного транспорта, предположительно, пропорциональна доле площади поверхности слизистой оболочки, которую составляют межклеточные контакты: 0.1% (Toxicology…, 2007). Межклеточные контакты двух типов – плотные и адгезионные – состоят из актина и обеспечивают прочность эпителия, связывая плазматическую мембрану смежных клеток с их цитоскелетом (Lopetuso et al., 2015). Межклеточные контакты – биомишень для ряда ксенобиотиков (Lechuga et al., 2020), на фоне повреждающего действия которых значение парацеллюлярного транспорта возрастает.
ЭГБ здорового человека малопроницаем для бактерий, обитающих в кишечнике. ДНК кишечной микрофлоры (Escherichia coli, Bacteroides) обнаруживают в плазме крови лишь при повреждении ЭГБ (Shi et al., 2014). Вещества, подлежащие удалению из организма, проникают из желудочно-кишечного химуса в кровь путем пассивной диффузии. Их абсорбцию приближенно описывают уравнением первого закона диффузии Фика для мембран: J = D × (Ci – C0), где J – плотность потока вещества, моль × м−2 × с−1; D – коэффициент проницаемости мембраны, м × с−1; Ci и C0 – концентрация вещества с эпителиальной и эндотелиальной сторон мембраны, моль × м−3. Биодоступность токсичных продуктов жизнедеятельности кишечной микрофлоры повышается при увеличении множителей (Ci − C0) или D. Первый из них лимитирован содержанием этих веществ в химусе, а второй – состоянием эпителия и сосудистого эндотелия ЖКТ. Предположительно, абсорбция возрастает при повышении гидростатического давления химуса в результате усиленного газообразования или гладкомышечного спазма (Lin, Pimentel, 2005).
Часть образовавшихся в химусе веществ, преодолевших эпителий, поступает в гемо- и лимфокапиллярную сети подслизистого слоя и далее – в сосуды бассейнов v. portae и ducti thoracici. В норме этот путь – основной. Другая часть, пройдя сквозь висцеральный и париетальный листки брюшины, поступает в лимфатические сосуды бассейна ducti thoracici или в гемокапиллярную сеть бассейна v. cavae inferioris. Такому процессу – трансперитонеальной диффузии – в толстой кишке способствует отсутствие сплошного продольного мышечного слоя, который сконцентрирован в узких taenie coli и потому не представляет собой диффузионного препятствия (Magnotti et al., 1998). Показана трансперитонеальная диффузия аммиака (Schäfer et al., 2011) и бактериальных липополисахаридов (Manani et al., 2020). Участвующие в трансперитонеальной диффузии вещества на своем пути в общий кровоток избегают пресистемного метаболизма в печени. При портальной гипертензии значение трансперитонеальной диффузии может возрастать, поскольку диффузия веществ из просвета кишечника в бассейн v. portae замедляется (Møller et al., 2020). Трансперитонеальную диффузию используют для детоксикации с помощью перитонеального диализа (Комаров и др., 1981).
Таким образом, функции ЭГБ – поддержание градиента концентрации веществ между желудочно-кишечным химусом и кровью, а также селективная абсорбция этих веществ. Движение веществ по такому градиенту схематически показано на рис. 1.
НОРМАЛЬНАЯ МИКРОФЛОРА ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Микроорганизмы более 400 видов колонизируют ЖКТ здорового человека. Их общая численность превышает число эукариотических клеток, а масса оценивается в 0.3% массы тела хозяина (Sender, Fuchs, 2016). Плотность колонизации бактериями дистальных отделов ЖКТ выше, чем проксимальных (табл. 1).
Таблица 1.
Нормальное содержание бактерий в химусе ЖКТ человека (по: Role of gut bacteria…, 2005; Sender, Fuchs, 2016)
| Отдел ЖКТ | Показатели | ||
|---|---|---|---|
| концентрация, мл−1 | объем, мл | число бактерий | |
| Желудок | ≤ 103* | 250–900 | ≤107* |
| Двенадцатиперстная и тощая кишки | 103–104 | 400 | ~107 |
| Подвздошная кишка | 108 | 400 | ~1011 |
| Толстая кишка | 1011 | 400 | ~1014 |
Отобранные натощак пробы содержимого желудка в норме имеют pH ≤ 3.0 и практически стерильны. В присутствии пищи или при гипохлоргидрии бактерии в просвете желудка более многочисленны и представлены преимущественно облигатными анаэробами, стрептококками, лактобациллами, нейссериями и стафилококками. При pH > 5.0 (в старческом возрасте, при пернициозной анемии, атрофическом гастрите) микробный состав желудочного содержимого неотличим от такового в тонкой кишке. На слизистой оболочке желудка многих клинически здоровых людей (до ⅔ 51–60-летней субпопуляции) в слое муцина выявляется аммиакпродуцирующая грамотрицательная бактерия Helicobacter pylori. У длительно инфицированных ею людей на фоне пангастрита значение pH желудочного содержимого повышено, а бактерицидная функция желудка снижена. Как следствие, при хеликобактериозе состав микрофлоры отделов ЖКТ, лежащих дистальнее, имеет неблагоприятные отличия от такового у здоровых лиц (Hunt et al., 2015).
В двенадцатиперстной и тощей кишках вегетация бактерий уравновешена их активным удалением в результате пищеварительной секреции и моторики, а также бактерицидным действием желчи. Преобладают грамположительные кокки (Streptococci, Peptococci) и палочки (Lactobacilli, Bifidobacteria).
Бактериальная флора терминального отдела подвздошной кишки вследствие рефлюкса из слепой кишки сходна с микрофлорой последней (Role of gut bacteria…, 2005).
В химусе толстой кишки бактерии составляют в среднем 27% его сухой массы (Sender, Fuchs, 2016). Анаэробных бактерий (с преобладанием Escherichia coli, Bacteroides fragilis, Lactobacilli и Bifidobacteria) в толстой кишке в 1000 раз больше, чем аэробных (Role of gut bacteria…, 2005). Анаэробы представлены грамположительными (Bifidobacteria, Eubacteria, Propionibacteria) и грамотрицательными (Bacteroides, Fusobacteria, Entherobacteria) бактериями. Слизистую оболочку толстой кишки колонизируют не только симбионтные, но и условно-патогенные бактерии (преимущественно из семейства Enterobacteriaceae), обладающие уреазной активностью (Walker, 2012).
Состав нормальной кишечной микрофлоры зависит от рациона, возраста, приема антибактериальных лекарственных средств и ряда неконтролируемых условий (Role of gut bacteria…, 2005; Choi et al., 2020). Образованию токсичных веществ в кишечнике способствует преобладание представителей типов Proteobacteria и Fusobacteria над Bacteroidetes, препятствуют же Lactobacilli и Bifidobacteria. Число микроорганизмов в ЖКТ ограничено его пропульсивной активностью. В норме транзитное время для желудка составляет 10–48 мин, для тонкой кишки – 2.5–4 ч (O’Grady et al., 2020) и для толстой кишки – 25–40 ч (Sender, Fuchs, 2016). Длительность пассажа химуса по толстой кишке определяет наибольший вклад ее микробиоты в образование токсичных веществ, особенно при запорах (Мечников, 1987; Role of gut bacteria…, 2005).
ТОКСИЧНЫЕ ПРОДУКТЫ ЖИЗНЕДЕЯТЕЛЬНОСТИ НОРМАЛЬНОЙ КИШЕЧНОЙ МИКРОФЛОРЫ
Нормальная кишечная микрофлора образует как необходимые, так и токсичные для хозяина вещества (Rodríguez-Hernández et al., 2020). Справедливость сформулированной более века назад (Мечников, 1987) гипотезы о способности соединений, образуемых из нутриентов нормальной кишечной микрофлорой, при определенных условиях вызывать системные патологические процессы ныне полностью доказана. В течение последних 10 лет число ежегодных публикаций, доступных по ключевым словам: gut-liver axis, gut-brain axis, gut microbiota, gut microbiota and metabolome, gut microflora и human gut microbiome, – росло экспоненциально. На сайте PubMed.gov оно выросло с 2010 г. по 2019 г. в 12, 14, 17, 30, 37 и 61 раз соответственно, при том что в предыдущие десятилетия практически не изменялось. Появился даже неблагозвучный термин “фекальный волатилом”, обозначающий смесь летучих продуктов жизнедеятельности кишечной микрофлоры, содержанию которых в выдыхаемом воздухе придается диагностическое значение при системных заболеваниях (Rodríguez-Hernández et al., 2020). Ниже рассмотрены обладающие системной токсичностью вещества бактериального происхождения: продукты деградации азотсодержащих нутриентов (белков, аминокислот, аминоспиртов, фосфолипидов) и липополисахариды.
Аммиак. На долю ЖКТ приходится не менее ⅔ аммиака, продуцируемого в организме. В энтероцитах основным механизмом его образования является глутаминазная реакция, а в толстой кишке – метаболическая активность бактерий: дезаминирование аминокислот и азотистых оснований, гидролиз мочевины, диффундирующей к люминальной поверхности слизистой оболочки из крови (Ивницкий и др., 2012). Уреолитическая активность микроорганизмов, ассоциированных с толстокишечной слизистой оболочкой, – источник половины аммиака, продуцируемого кишечной микрофлорой (Walker, 2012). Содержание аммиака в химусе толстой кишки крысы втрое выше, чем тонкой: 45 и 15 ммоль/кг соответственно (Agostini et al., 1972).
Из кишечного химуса в общий кровоток аммиак поступает как через воротную вену, так и путем трансперитонеальной диффузии (Schäfer et al., 2011). За сутки у здорового человека из кишечника в кровь (преимущественно портальную) поступает около 4 г аммиака (Summerskill, Wolpert, 1970). Его уровень в крови печеночной вены положительно зависит от уровня в портальной крови (Dobson et al., 1990), а последний – от содержания аммиака в химусе (Gips et al., 1973). Благодаря обезвреживанию в печени концентрация аммиака в плазме крови печеночной вены в 2–3 раза ниже, чем в плазме крови воротной вены (Dobson et al., 1990), и на порядок ниже, чем в крови мезентериальных вен, дренирующих ободочную кишку (Role of gut bacteria…, 2005).
В плазме артериальной крови нормальная концентрация аммиака ([NH3] + [${\text{NH}}_{4}^{ + }$]) составляет 30 мкМ (Ali, Nagalli, 2021). Ее повышение сопровождается нейротоксичностью, впервые описанной в лаборатории И.П. Павлова (Ганн и др., 1892). При значениях ([NH3] + [${\text{NH}}_{4}^{ + }$]) в плазме крови 50–100 мкМ гипераммониемия бессимптомна; при 100–200 мкМ – отмечаются рвота, атаксия, раздражительность и гиперактивность, а при 200 мкМ – кома (Pagana, Pagana, 2014). При среднем значении объема химуса толстой кишки 0.4 л (Мечников, 1987) и содержании аммиака в нем 5.7–39.0 мМ (Agostini et al., 1972) суммарный кишечный пул аммиака составляет 2.3–15.6 ммоль. Одномоментное равномерное распределение этого количества в крови (5 л), лимфе (2 л) и химусе толстой кишки повысило бы содержание аммиака в крови до 311–2108 мкМ, то есть до значений, намного превышающих порог комы.
В клетки аммиак проникает в неионизированной форме – NH3. При pH = 7.36, характерном для плазмы крови в норме (с учетом константы основности аммиака pKa = 9.15 при t = 37°C), доля NH3-формы составляет 1.6%. В цитоплазме pH ниже, что обусловливает диффузию аммиака в клетки даже при его нормальном содержании в крови (Ивницкий и др., 2012). При метаболическом ацидозе или газовом алкалозе разность значений pH плазмы крови и цитоплазмы возрастает, что интенсифицирует поступление аммиака в клетки по градиенту концентрации NH3 (Dobson et al., 1990; Scott et al., 2013). В этих случаях его токсические эффекты возможны и при отсутствии гипераммониемии.
Помимо нейротоксичности аммиак проявляет эндотелиотоксичность, показанную как in vitro, так и in vivo. В культивируемых эндотелиоцитах мозговых капилляров он вызывал окислительный стресс, накопление NO и продуктов пероксидации арахидоновой кислоты (Skowrońska, Albrecht, 2013), повышал проницаемость плазматической мембраны для флуоресцеин-изотиоцианатного производного декстрана и экспрессию транспортера аргинина – субстрата синтеза NO (Skowrońska et al., 2012). Культивационная среда эндотелиоцитов, обработанных аммиаком, при добавлении к культуре астроцитов вызывала набухание последних, что указывает на возможную вовлеченность сосудистого эндотелия в формирование отека мозга при гипераммониемии (Jayakumar, Norenberg, 2018). Повышение концентрации аммиака в культивационной среде разрушало внеклеточный матрикс и увеличивало парацеллюлярную проницаемость монослоя эндотелиоцитов (Skowrońska et al., 2012).
Аммиак активирует в эндотелиоцитах Толл-подобные рецепторы 4-го типа, отвечающие за воспалительную реакцию на эндотоксин, что ведет к сверхпродукции свободных радикалов кислорода и азота, набуханию эндотелиоцитов и повышению их проницаемости для веществ, вовлеченных в патогенез печеночной энцефалопатии (Jayakumar, Norenberg, 2018). Гипераммониемия вызывала эндотелий-зависимое NO-опосредованное расширение артериол головного мозга, что могло способствовать повышению внутричерепного давления и отеку мозга при острой печеночной недостаточности (Scott et al., 2013). Внутривенное введение кроликам ацетата аммония увеличивало проницаемость гематоэнцефалического барьера (ГЭБ) для полиэтиленгликоля ПЭГ 400 (McClung et al., 1990). По данным позитронно-эмиссионной томографии, проницаемость ГЭБ повышена и у пациентов с хронической печеночной энцефалопатией (Ochoa-Sanchez, Rose, 2018). Таким образом, интенсификация поступления аммиака в клетки эндотелия сосудов головного мозга вызывает в них окислительный стресс, воспалительное повреждение, повышает проницаемость и нарушает локальную регуляцию кровотока.
Триметиламин-N-оксид (ТМАО) – рудиментарный для человека дериват аммиака, полезная функция которого (в качестве осмолита) сохранилась у морских животных. Образуется в печени путем окисления триметиламина – продукта разложения бактериями Clostridium, Escherichia, Enterobacter, Acinetobacter и Proteus L‑карнитина, холина, лецитина или бетаина в просвете толстой кишки (Zhang, Davis, 2016). Концентрация триметиламина в плазме крови в 38 раз ниже, чем ТМАО. Данные о концентрации TMAO в плазме крови здоровых людей варьируют: от 0.17 до 34.62 мкМ на фоне шестимесячного ежедневного приема 1.5 г L-карнитина (Olek et al., 2019). Она повышается также с увеличением доли Gammaproteobacteria в кишечной микробиоте (Бонитенко и др., 2010). Содержание ТМАО в крови мышей возрастает при их переводе на обогащенный холином рацион. В крови гнотобиотических (свободных от бактерий) мышей C57BL/6J ТМАО отсутствует даже при их содержании на богатом холином рационе. Перевод таких мышей на нестерильные условия содержания ведет к появлению в их крови ТМАО (Zhu et al., 2016).
Системная токсичность ТМАО проявляется системным воспалением (MacPherson et al., 2020). При оценке способности повышенного уровня ТМАО в крови вызывать окислительный стресс эндотелия получены противоречивые данные: как наличие (Brunt et al., 2020), так и отсутствие (Olek et al., 2019) признаков такового. In vitro показана способность ТМАО вызывать вазоспазм (Restini et al., 2020). Повышенный уровень TMAO в плазме крови ассоциирован с сердечно-сосудистыми заболеваниями (Марченко, Ларюшина, 2017), стеатозом печени (Tan et al., 2019), фиброзом почек (Zhang, Davis, 2016; Cosola et al., 2018), тромбообразованием (Zhu et al., 2016), повышенным риском тромбоэмболии при фибрилляции предсердий (Gong et al., 2019). В отдельных публикациях прослежена связь нарушений кровообращения с уровнем триметиламина, а не ТМАО (Jaworska et al., 2019).
Роль кишечной микрофлоры в формировании опосредованной ТМАО эндотелиальной дисфункции описывается третьим постулатом Р. Коха для возбудителей заболеваний – возбудитель болезни вызывает ее, будучи введенным в здоровое животное. Трансплантация химуса из слепой кишки не склонных к тромбозу мышей линии NZW/LacJ гнотобиотическим мышам, содержавшимся на богатом холином рационе кормления, не изменяла уровень ТМАО в крови и свертываемость крови реципиентов. Пересадка же гнотобиотическим мышам химуса от мышей “про-тромботической” линии C57BL/6J вызывала значительное повышение как содержания ТМАО, так и свертываемости крови (Zhu et al., 2016). Оральный прием антибиотиков блокировал подъем уровня ТМАО в крови после нагрузки лецитином (Tang et al., 2013) или карнитином (Koeth et al., 2013).
Таким образом, высокое содержание ТМАО и (или) триметиламина в крови сопряжено с повышенным риском системного воспаления, вазоспазма, тромбообразования, поражений печени и почек.
Индоксилсульфат, индоксилацетат. Индол – метаболит триптофана, за который в толстой кишке конкурируют Clostridium sporogenes, метаболизирующие его до 3‑индолпропионовой кислоты, Lactobacillus, метаболизирующие триптофан до индол-3‑альдегида, и ряд бактерий, экспрессирующих триптофаназу, но не метаболизирующих индол. В последнем случае свободный индол поступает в печень, где ацилируется с образованием индоксилсульфата и индоксилацетата. В отличие от 3-индолпропионата и индол-3-альдегида, проявляющих свойства нейропротектора и иммуномодулятора соответственно (Zhang, Davis, 2016), индоксилсульфат и иноксилацетат эндотелиотоксичны. Их накопление в крови ассоциировано с хронической почечной недостаточностью и риском сердечно-сосудистых заболеваний (Zhang, Davis, 2016; Cosola et al., 2018). Содержание индоксилсульфата в плазме крови составляет от 10−7 до 2.4 × 10−6 М в норме и от 2.5 × 10−4 до 5.0 × 10−4 М при хронической почечной недостаточности (Matsumoto et al., 2019).
p-Крезилсульфат образуется в клетках эпителия толстой кишки и в гепатоцитах сульфатированием p-крезола – продукта дезаминирования и декарбоксилирования ароматических аминокислот тирозина и фенилаланина с участием бактерий семейств Bacteroidaceae, Bifidobacteriaceae, Clostridiaceae, Enterobacteriaceae, Enterococcaceae, Eubacteriaceae, Fusobacteriaceae, Lachnospiraceae, Lactobacillaceae, Porphyromonadaceae, Staphylococcaceae, Ruminococcaceae и Veillonellaceae. Ежедневно в толстой кишке образуется 50–100 мг p-крезола (Role of gut bacteria…, 2005). p-Крезилсульфат эндотелиотоксичен при его содержании в плазме крови, наблюдаемом при хронической почечной недостаточности, 116–568 мкМ при 15–35 мкМ – в норме (Gryp et al., 2017). Содержание p-крезилсульфата в крови пациентов с отеком легких повышено. Введение мышам p-крезилсульфата увеличивало проницаемость легочных капилляров, активировало лейкоциты, повышало продукцию свободнорадикальных форм кислорода и вызывало гибель клеток и интерстициальный отек легких (Chang et al., 2018).
Индоксилсульфат, индоксилацетат и p-крезилсульфат имеют низкий почечный клиренс, поэтому при почечной недостаточности накапливаются в крови (Matsumoto et al., 2019). В норме плазматический пул этих веществ на 95–97% представлен их комплексами с альбумином. При почечной недостаточности увеличивается их содержание в свободной форме, что сопровождается повышением эндотелиотоксичности. Она проявляется воспалением, вазоспазмом, ишемией, тромбообразованием, формированием инсулинорезистентности тканей и мультиорганной недостаточности, повышенным риском сердечно-сосудистых осложнений имеющихся заболеваний (Cosola et al., 2018).
Моноамины образуются в кишечном химусе из аминокислот под действием индуцибельных декарбоксилаз, некоторые из которых пиридоксальфосфат-зависимы. Наибольшую декарбоксилазную активность проявляют Enterobacteria (Role of gut bacteria…, 2005). В кишечном химусе новорожденных содержание моноаминов незначительно, но возрастает по мере бактериальной колонизации ЖКТ (Suárez et al., 2019). Из L-тирозина микрофлора образует p-тирамин и p-октопамин, из L-триптофана – триптамин и серотонин, из гистидина – гистамин. Количество моноаминов, поступающих в портальную систему, в норме не превышает возможности печени по их обезвреживанию – преимущественно путем конъюгации (Role of gut bacteria…, 2005). При дисфункции ЭГБ, интенсификации синтеза и (или) нарушении конъюгации моноаминов в печени их содержание в крови повышено (Zhang, Davis, 2016).
Тирамин, триптамин, октопамин и серотонин при поступлении в кровь оказывают сосудосуживающее действие. Инфузия октопамина вызывала у свиней гипоксемию на фоне гипервентиляции и увеличения легочного венозно-артериального шунтирования (Nespoli et al., 1983). Накопление серотонина в крови вызывает серотониновый синдром, симптомами которого являются тахикардия, артериальная гипертензия, гипертермия, повышение свертываемости крови, а в тяжелых случаях – рабдомиолиз и полиорганная недостаточность (Волков, 2014). Гистамин вызывает бронхоспазм, вовлечен в патогенез воспаления, повышает вязкость крови и нарушает микроциркуляцию (Zhang, Davis, 2016).
Таким образом, системная биологическая активность моноаминов, продуцируемых кишечной микрофлорой, характеризуется их влиянием на кровообращение, процессы газообмена в легких, свертывания крови и (или) воспаления. Это определяет возможность вовлечения моноаминов в патогенез осложнений острых отравлений: сердечно-сосудистых нарушений, сепсиса, коагулопатии, вторичных острых поражений легких.
Бактериальный эндотоксин. Содержание смеси липополисахаридов грамотрицательных бактерий (именуемой эндотоксином) в толстокишечном химусе взрослого человека составляет 2.5 г/л (Bested et al., 2013). В плазме крови оно на 9 порядков меньше: 10 нг/л, что является порогом воспалительной активации макрофагов и эндотелиоцитов. Это значение умеренно повышено при периодонтите, сахарном диабете, циррозе печени и болезни Альцгеймера, а при сепсисе оно достигает 500 нг/л (Brown, 2019). Повышенное содержание эндотоксина в плазме крови можно определить как эндотоксинемию, то есть частный случай эндотоксемии. Уровни эндотоксина и ТМАО в плазме крови положительно коррелируют между собой (MacPherson et al., 2020). В плазме крови эндотоксин содержится как в биологически активной свободной форме, так и в форме комплексов с белками крови, не всегда выявляемых при лабораторном исследовании (Комаров и др., 1981).
Эндотоксин обладает выраженной эндотелиотоксичностью, которая проявляется окислительным стрессом, разрушением гликокаликса, адгезией лейкоцитов, вазоспазмом и тромбообразованием (Iba et al., 2018), повышением проницаемости ГЭБ (Minami et al., 2007). Содержание эндотоксина в крови, характерное для сепсиса, ведет к цитокиновому шторму и септическому шоку (Pfalzgraff, Weindl, 2019). Его хроническое воздействие в более низкой концентрации сопровождается хроническим системным воспалением (Morris et al., 2015). Липополисахариды Escherichia coli имеют намного бóльшие провоспалительные свойства, чем липополисахариды Bacteroides dorei или Bacteroides vulgatus (Yoshida et al., 2020).
Эндотоксин вызывает тромбоксан-зависимую легочную вазоконстрикцию, а при более высоких концентрациях, характерных для септического шока, – системную вазодилатацию и легочную гипертензию (Corrêa et al., 2020). Эндотоксинемия повышает проницаемость ГЭБ как для самого эндотоксина, так и для других веществ, повышает проницаемость легочных капилляров, вызывает некардиогенный отек легких (Wang et al., 2019), нарушает функции печени (Solé et al., 2021) и почек (Nežić et al., 2020).
МЕХАНИЗМЫ ДИСФУНКЦИИ ЭГБ ПРИ ОСТРЫХ ЗАБОЛЕВАНИЯХ
Прямое повреждение ЭГБ. Ксенобиотики, инфекционные агенты, ионизирующее излучение непосредственно повреждают ЭГБ, нарушая его барьерную функцию. Энтеротоксичность присуща не только химически агрессивным веществам, поступающим в организм перорально, но и многим системно действующим токсикантам.
Эпителий тонкой кишки и, в меньшей мере, желудка и толстой кишки – типичная система клеточного обновления с высокой пролиферативной активностью. Это делает его высокочувствительным к цитостатическим лекарственным средствам, вызывающим интерфазную гибель энтероцитов и, как следствие, денудацию эпителия. Различия энтеротоксического действия таких веществ определяются лишь уровнем дифференцированности преимущественно поражаемых клеток. Так, адриамицин вызывает апоптоз энтероцитов главным образом в 4–5 позиции от стволовой клетки, располагающейся в нижней точке межворсиночной крипты. При действии изопропил-метан-сульфоната, азотистого иприта или актиномицина D энтероциты интерфазно гибнут в позиции 6–7, фторурацила, милерана, циклофосфамида или циклогексимида – в позиции 7–9, винкристина или гидроксимочевины – в позиции 10–11 (Ijiri, Potten, 1983). У крыс при острой интоксикации циклофосфаном проницаемость ЭГБ для метиленового синего, маннитола и лактулозы (Шефер и др., 2011) повышена. Энтеротоксичность цитостатиков, применяемых при трансплантации стволовых кроветворных клеток, – один из факторов, лимитирующих выживаемость пациентов (McMillen et al., 2021).
Прямая энтеротоксичность присуща этанолу (Bishehsari et al., 2017), ряду микотоксинов, мышьяку и солям тяжелых металлов (Куценко, 2004). Специфическая токсичность нестероидных противовоспалительных лекарственных средств сделала их средствами экспериментального моделирования острого гастроэнтерита (Karádi et al., 2001), а декстрана сульфата и 2,4,6-тринитробензолсульфоната – средствами экспериментального моделирования острого колита (Ishisono et al., 2019). Некоторые микотоксины вызывают воспалительное повреждение ЭГБ, потенцируя действие на него эндотоксина (Ge et al., 2020). Микотоксины Т-2 и дезоксиниваленол повышают проницаемость ЭГБ для полиэтиленгликоля ПЭГ 4000 (Семенов и др., 2019).
Увеличение проницаемости ЭГБ – результат не только прямого повреждения эпителия и сосудистого эндотелия кишечника ксенобиотиком или продуктами его метаболизма. Такими же могут быть эффекты острой гипоксии, гладкомышечного спазма органов ЖКТ и желудочно-кишечного стаза, часто наблюдаемых при острых отравлениях.
Острая гипоксия кишечника при критических состояниях организма обусловлена нарушениями внешнего дыхания и кровообращения. При острых тяжелых отравлениях к таким состояниям относится экзотоксический шок, а при отсутствии респираторной поддержки – угнетение дыхательного центра, нервно-мышечный блок, бронхообструктивный синдром (Бонитенко и др., 2010). В результате централизации кровообращения при них ЖКТ испытывает более глубокую гипоксию, чем наиболее важные для поддержания жизнедеятельности организма органы: головной мозг, легкие и сердце.
Аэробный тип энергетического обмена энтероцитов предрасполагает их к нарушению окислительного ресинтеза АТФ. Это доказывается повреждениями кишечника при высотной гипоксии, проявляющимися воспалением, изъязвлением, кровотечением, которые являются угрожающими жизни состояниями, осложняющими горную болезнь (Khanna et al., 2019). Газовая гипоксия провоцировала повышение уровня цитокинов в крови и проницаемости ЭГБ у крыс при беге на тредмиле (Hill et al., 2020). Проницаемость ЭГБ повышена при гемолитической анемии (Abuga et al., 2020) и острой кровопотере (Khazoom et al., 2020).
Некоторые цитотоксиканты ингибируют ферменты энергетического обмена либо разобщают окислительное фосфорилирование (Куценко, 2004), что усугубляет энергодефицитное состояние биотканей при острых отравлениях такими веществами. Разобщение окислительного фосфорилирования в клетках эпителия толстой кишки нарушает их барьерную функцию по отношению к Escherichia coli (Saxena et al., 2018). Мыши с более активным окислительным фосфорилированием в слизистой оболочке толстой кишки более устойчивы к ее повреждению декстран сульфатом или тринитробензол сульфонатом (Bär et al., 2013).
Подслизистое гемокапиллярное сплетение в тонкой кишке лучше развито, чем в толстой (Magnotti et al., 1998), что объясняет более высокую чувствительность последней к ишемическому повреждению (Звенигородская и др., 2010). При гипоксии в кишечнике снижено образование муцина, что ведет к воспалительным изменениям слизистой оболочки (Звенигородская и др., 2010).
Гладкомышечный спазм органов ЖКТ – один из характерных симптомов отравления ингибиторами холинэстеразы и серотонинергическими лекарственными средствами (Куценко, 2004), но он может быть и реакцией на острую гипоксию, вызванную централизацией кровообращения, или результатом спазмогенного действия на гладкую мускулатуру кишечника серотонина, образуемого Enterobacteria. Серотонинергическая стимуляция толстой кишки сопровождается, помимо спазма ее собственной гладкой мускулатуры, также артериальным спазмом микроциркуляторного русла. Высказана гипотеза о триаде мышечный спазм–ишемия–боль как о факторе повышенной проницаемости ЭГБ при синдроме раздраженного кишечника (Uno, 2019). При острых отравлениях реакция ЭГБ на такие изменения может быть аналогичной.
Желудочно-кишечный стаз – потенциально летальное осложнение у пациентов отделений реанимации и интенсивной терапии. Это одно из проявлений токсичности опиоидов, холинергических антагонистов и серотониновых агонистов (Toxicology…, 2007). Он характерен для тяжелых отравлений, сопровождающихся комой (Ivnitsky et al., 2006), а также для острых отравлений веществами алкилирующего действия (Шефер, 2015).
При стазе возникают две предпосылки к интенсификации диффузии веществ, продуцируемых кишечной микрофлорой, сквозь ЭГБ: его повреждение и повышенное газообразование в ЖКТ. Одним из факторов повреждения ЭГБ при стазе является изменение состава кишечной микрофлоры. При снижении пропульсивной активности ЖКТ вегетация бактерий не компенсируется их удалением, в результате чего возрастает люминальная концентрация токсичных веществ, в частности, аммиака. Повреждение колоноцитов обусловлено увеличением не только суммарной концентрации аммиака ([NH3] + [${\text{NH}}_{4}^{ + }$]), но и pH химуса, а значит, и доли аммиака, представленного в высокопенетрантной форме NH3 (Agostini et al., 1972); его цитотоксическое действие на колоноциты сокращает их жизненный цикл и продукцию муцина (Zhou et al., 2020).
Таким образом, при острых тяжелых заболеваниях развивается вторичная дисфункция ЭГБ – повышение его проницаемости для метаболитов и клеточных компонентов кишечной микрофлоры. Патогенетическими механизмами вторичной дисфункции ЭГБ при острых заболеваниях являются его прямое повреждение, желудочно-кишечный стаз, гипоксия и гладкомышечный спазм тканей ЖКТ. Вторичная дисфункция ЭГБ, повышенные продукция токсичных веществ кишечной микрофлорой и газообразование – предпосылки к интенсификации поступления токсичных веществ из кишечного химуса в общий кровоток с формированием эндотоксемии.
ЭНДОТОКСЕМИЯ И ЭНДОТОКСИКОЗ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ ОРГАНИЗМА
Эндотоксемия – накопление в крови биологически активных веществ, образовавшихся в организме. Эндотоксикоз – совокупность клинических проявлений эндотоксемии. Исходя из представления об организме как об экосистеме, составной частью которой является кишечная микробиота (Role of gut bacteria…, 2005; Tang et al., 2017), к эндогенным веществам относят и соединения, продуцируемые нормальной кишечной микрофлорой. Такие вещества способствуют развитию критических состояний организма, осложняющих острые заболевания. Эти состояния можно рассматривать как эндотоксикоз – совокупность клинических проявлений эндотоксемии.
Острые нарушения кровообращения. Выраженные эндотоксинемия и гипераммониемия характерны для шока. Повышенное содержание эндотоксина в крови наблюдали при септическом (Luna et al., 2021), травматическом и геморрагическом (Hu et al., 2019) шоке. В эксперименте септический шок воспроизводится введением животным эндотоксина (Fujivara et al., 2020).
Концентрация аммиака в плазме крови пациентов, доставленных в реанимационное отделение в связи с остановкой сердца, в 4.8 раза выше, чем у пациентов со спонтанным кровообращением (Lin et al., 2013). Содержание аммиака в плазме крови и мозговой ткани собак и кроликов многократно повышено при инсулиновом и при тепловом шоке. Основные симптомы как инсулинового, так и теплового шока воспроизводятся введением животным солей аммония (Козлов, 1971).
При геморрагическом шоке источником эндотоксемии является кишечник. Эндотоксемия протекает в три стадии: 1) повышение содержания веществ низкой и средней молекулярной массы в тканях кишечника и крови воротной вены; 2) начало нарастания их содержания в системном кровотоке; 3) достижение одинаково высокой токсичности крови воротной вены и сонной артерии (Храмых, Долгих, 2007).
Сепсис – системная воспалительная реакция на эндотоксинемию и бактериемию, наиболее часто осложняющая острые отравления у лиц, страдающих алкогольной зависимостью (Chaung et al., 2019). При массовом остром отравлении метанолом сепсис развивался у 6.4% пострадавших (Kumar et al., 2019). У 33% пациентов с сепсисом инфекционные агенты в крови не обнаружены (Novosad et al., 2016). Вместе с тем, для сепсиса характерна эндотоксинемия. Ведущим механизмом ее развития является дисфункция ЭГБ, обусловленная активацией одного из ферментов репарации ДНК – поли-(АДФ-рибоза)-полимеразы-1 – в энтероцитах. Это истощает в них пул НАД+, что ведет к нарушению окислительного фосфорилирования, гибели энтероцитов и повышению проницаемости кишечного эпителия (Fink, 2002).
В эксперименте сепсис хорошо воспроизводится введением животным эндотоксина (Chen et al., 2020). Эндотоксин при характерных для сепсиса значениях содержания в крови повреждает почки, сердце и печень, является основным этиологическим фактором мультиорганной недостаточности (Luna et al., 2021). Под влиянием эндотоксина при сепсисе активируется каскад свертывания крови, возникает микрососудистый тромбоз. Периваскулярный отек и коагулопатия при сепсисе затрудняют перфузию тканей, что ведет к их гипоксии, мультиорганной недостаточности, отеку легких и шоку (Pool et al., 2018).
В патогенез мультиорганной недостаточности при сепсисе вовлечен и аммиак. Концентрация аммиака в плазме крови пациентов с диагнозом “сепсис” при поступлении в реанимационное отделение повышена и положительно коррелирует с вероятностью развития у них мультиорганной недостаточности в последующие 28 сут. (Zhao et al., 2020). У пациентов с положительным тестом на бактериемию уровень аммиака в плазме крови вдвое выше, чем при отрицательном тесте (Numan et al., 2018).
Вторичные острые поражения легких – некардиогенный отек легких, синдромы шокового и влажного легкого (Бонитенко и др., 2010). О вовлеченности эндотоксина в патогенез повышенной проницаемости альвеолярно-капиллярного барьера свидетельствуют эндотоксинемия у пациентов с этим состоянием (Maniatis et al., 2008) и возможность моделировать его воздействием эндотоксина как in vitro, так и in vivo (Wang et al., 2018). Эндотоксин вызывает и гемодинамические нарушения в легких, ведущие к развитию отека: введение в полость правого предсердия свиней эндотоксина Escherichia coli повышало давление крови в легочной артерии (Corrêa et al., 2020). Гипераммониемия предшествует развитию легочной гипертензии и является лучшим лабораторным показателем для ее прогнозирования у пациентов с портокавальным шунтом (Bloom et al., 2020).
Острая церебральная недостаточность (ОЦН) – совокупность синдромов и состояний, возникающих в результате острой дисфункции ЦНС, обусловленной диффузным поражением головного мозга. Возникает при тяжелых отравлениях веществами с различными механизмами действия. Клинически проявляется синдромами нарушения и помрачения сознания, двигательными расстройствами, ускоренным катаболизмом, острыми нарушениями дыхания и кровообращения центрального генеза. Характеризуется отсутствием специфичности как клинических, так и морфологических признаков. Является критическим состоянием организма, поскольку характеризуется грубым нарушением витальных функций. Патогенез ОЦН малоизучен. Предполагают участие в ней острой гипоксии и, позднее, медиаторного хаоса (Шилов и др., 2010).
Биологическая активность представителей бактериального метаболома позволяет предположить их вовлеченность в патогенез ОЦН в качестве факторов, усугубляющих действие экзогенного токсиканта и гипоксии. Гипераммониемия характерна для острой печеночной недостаточности, осложненной отеком мозга и повышенным внутричерепным давлением (Sheikh et al., 2018). Внутричерепное давление, неврологические расстройства и летальность положительно связаны с уровнем аммиака в сыворотке крови пациентов с непеченочной гипераммониемией (Bested et al., 2013). Содержание аммиака в плазме крови и мозговой ткани было многократно повышено при моделировании на собаках и крысах диабетической комы (Козлов, 1971). У крыс на фоне острой интоксикации циклофосфаном (600 мг/кг) усугубление гипераммониемии внутрижелудочным введением ацетата аммония интенсифицировало накопление в крови и головном мозгу аммиака и глутамина, истощало тканевой пул пирувата (Ивницкий и др., 2019), ускоряло развитие неврологических расстройств, отчетливо сходных по симптоматике с острым отравлением солями аммония, сокращало продолжительность жизни животных (Ivnitsky et al., 2011). Неврологические проявления острого отравления солями аммония соответствуют определению ОЦН (Козлов, 1971).
Эндотоксин сенсибилизировал животных к острой церебральной гипоксии. Введение поросятам эндотоксина Escherichia coli потенцировало убыль нейронов, метаболические расстройства и повышало вероятность гибели мозга при последующей окклюзии сонной артерии (Pang et al., 2020). Введение хорькам эндотоксина отягощало повреждение их головного мозга при окклюзии сонных артерий (Wood et al., 2019). Эндотоксин потенцировал отек мозга при высотной гипоксии (Zhou et al., 2017).
Таким образом, имеющиеся в литературе данные указывают на вовлеченность эндотоксина и аммиака, продуцируемых нормальной кишечной микрофлорой, в патогенез ряда патологических состояний, которые могут осложнять острые отравления, – сепсиса, острых нарушений кровообращения, вторичных острых поражений легких и острой церебральной недостаточности.
ПЕРСПЕКТИВЫ ЗАЩИТЫ ЭГБ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ ОРГАНИЗМА
Средства плановой защиты ЭГБ. Нормальная микрофлора кишечника – основной фактор защиты от его колонизации патогенными микроорганизмами. Она активирует в тонкой кишке гликозилтрансферазы, ответственные за формирование гликоконъюгатов щеточной каймы. Адгезированные к слизистой оболочке бактерии формируют механический барьер, отделяющий ее от химуса. Симбионтные анаэробные грамположительные бактерии: Lactobacilli, Bifidobacteria, Propionobacteria – подавляют развитие условно патогенной кишечной микрофлоры: Escherichia coli, Clostridium botulinum и Clostridium dificile (Role of gut bacteria…, 2005). К механизмам защитного действия пробиотиков на ЭГБ относят (Bested et al., 2013) нормализацию состава кишечной микрофлоры, подавление образования ею аммиака, аминов, уремических токсинов, ингибирование продукции воспалительных цитокинов, синтез нейротрофических факторов, улучшение абсорбции углеводов и эссенциальных нутриентов, повышение болевого порога. Для плановой защиты ЭГБ применимы пробиотики, пребиотики и другие низкотоксичные препараты, рассчитанные на длительный прием. Так, экспериментально показана возможность использования сока подорожника для коррекции гипераммониемического и нейротоксического действия циклофосфамида (Шефер и др., 2015).
Средства экстренной защиты ЭГБ. Благоприятное влияние пребиотиков на ЭГБ рассмотрено в ряде подробных обзоров (Role of gut bacteria…, 2005; Bested et al., 2013; Liu et al., 2017; Tang et al., 2017). В качестве средств экстренной профилактики его повреждений перспективны те из них, которые способны формировать экранирующую пленку на слизистой оболочке. При назначении пектина внутрь на слизистых оболочках формируется защитная пленка пектинатов кальция (Ishisono et al., 2019). Она препятствует поступлению из химуса в кровь веществ, образуемых микрофлорой. Подобным свойством обладает и желатина таннат (Çağan et al., 2017). Защитный эффект, обусловленный экранирующим действием, ожидается в период транзита энтеросорбента в тонкой кишке, то есть с 10–48 до 160–288 мин после его приема внутрь.
При критических состояниях организма сведений об их этиологическом факторе, как правило, недостаточно, поэтому лечение направлено на коррекцию общих механизмов патогенеза. К ним относится острая гипоксия ЖКТ, поэтому ранняя оксигенотерапия может быть полезной для профилактики эндотоксикоза. Это согласуется с данными о потенцировании токсического действия аммиака острой гипоксией (Козлов, 1971) и о противовоспалительном действии гипербарической оксигенации при сепсисе (Rinaldi et al., 2011).
Ценное дополнение к оксигенотерапии гипоксических состояний организма – антигипоксанты (Иванов и др., 2020). К ним можно отнести и газовые смеси, в небольших концентрациях содержащие инертные газы, оксид азота (II), водород, сероводород. У ксенона, оксида азота (II) и водорода выявлены нейропротекторные и кардиотонические свойства, у аргона и сероводорода – только нейропротекторные (Alshami et al., 2020). Важный элемент лечения – устранение воспаления. Гидрокортизон в дозе 2.8 мг/кг предотвращал дисфункцию ЭГБ и эндотоксемию у крыс при моделировании сепсиса лигированием и проколом слепой кишки (Assimakoppoulos et al., 2021).
ЗАКЛЮЧЕНИЕ
Нормальная микрофлора кишечника продуцирует вещества, профиль системной токсичности которых при введении в больших дозах соответствует ряду критических состояний организма: острым нарушениям кровообращения, сепсису, вторичным острым поражениям легких, острой церебральной недостаточности. Количество этих веществ, содержащихся в кишечном химусе здорового человека, при полной или существенной утрате градиентов их концентрации между химусом и кровью обеспечивает возникновение перечисленных патологических состояний. ЭГБ – система диффузионных препятствий, разделяющих кишечный химус и кровь, поддерживающая градиенты концентрации токсичных веществ, достигающие 109. При тяжелых острых заболеваниях возникают предпосылки к повреждению ЭГБ и его вторичной дисфункции, ведущей к развитию эндотоксемии и эндотоксикоза.
Как дисфункция ЭГБ, так и эндотоксемия при ряде критических состояний организма документированы данными экспериментальных и клинических исследований. Показана вовлеченность бактериального эндотоксина и аммиака кишечного происхождения в патогенез сепсиса, острых нарушений кровообращения, вторичных острых поражений легких и острой церебральной недостаточности, осложняющих такие отравления.
Меры плановой защиты ЭГБ от повреждения включают коррекцию состава кишечной микрофлоры, нацеленную на подавление образования ею цитотоксических веществ и подавление продукции воспалительных цитокинов. Экстренная профилактика вторичной дисфункции ЭГБ предусматривает устранение гипоксии и воспаления органов ЖКТ, защиту слизистой оболочки применением препаратов, экранирующих ее от химуса.
Список литературы
Бонитенко Е.Ю., Бонитенко Ю.Ю., Бушуев Е.С. и др. Острые отравления лекарственными средствами и наркотическими веществами. СПб.: ЭЛБИ-СПб, 2010. 440 с.
Волков В.П. Ятрогенные психонейросоматические синдромы. Тверь: Триада, 2014. 320 с.
Ганн М., Массен В.М., Ненцкий М., Павлов И.П. Экковский свищ венъ нижней полой и воротной и его последствия для организма // Арх. биол. наук. 1892. Т. 1. № 4. С. 400–444.
Гришин С.М. Преступления, совершенные медицинскими работниками вследствие ненадлежащего исполнения своих профессиональных обязанностей (по материалам судебной практики Европейской части России 2015–2017 гг.) // Медицина. 2018. № 1. С. 1–14.
Звенигородская Л.А., Самсонова Н.Г., Топорков А.С. Хроническая ишемическая болезнь органов пищеварения: алгоритм диагностики и лечения // Рус. мед. журн. 2010. № 9. С. 544–548.
Иванов М.Б., Шустов Е.Б., Литвинцев Б.С. и др. Эндотелиальная дисфункция как звено патогенеза COVID-19 // Medline.ru. Рос. биомед. журн. 2020. Т. 21. С. 884–903.
Ивницкий Ю.Ю., Шефер Т.В., Рейнюк Т.В. Эндогенный аммиак в токсическом процессе. Развитие концепции эндотоксикоза. Palmarium Academic Publishing, 2012. 176 с.
Ивницкий Ю.Ю., Шефер Т.В., Тяптин А.А., Рейнюк В.Л. Изменения химического состава крови и головного мозга крыс при моделировании миелоабляционного режима применения циклофосфана // Токсикол. вестн. 2019. Т. 156. № 3. С. 13–18.
Ивницкий Ю.Ю., Рейнюк В.Л., Иванов М.Б. и др. Сосудистый эндотелий при острых отравлениях // Medline.ru. Рос. биомед. журн. 2020. Т. 21. С. 976–1004.
Козлов Н.Б. Аммиак, его обмен и роль в патологии. М.: Медицина, 1971. 127 с.
Комаров Б.Д., Лужников Е.А., Шиманко И.И. Хирургические методы лечения острых отравлений. М.: Медицина, 1981. 271 с.
Куценко С.А. Основы токсикологии. СПб.: Фолиант, 2004. 715 с.
Марченко А.Б., Ларюшина Е.М. Роль триметиламин N-оксида в патогенезе, диагностике и прогнозе кардиоваскулярных заболеваний // Мед. экол. 2017. № 1. С. 41–46.
Мечников И.И. Этюды оптимизма. М.: Наука, 1987. 328 с.
Семенов Э.И., Мишина Н.Н., Папуниди К.Х. Неучтенная анафилактическая реакция на действие микотоксинов // Medline.ru. Рос. биомед. журн. 2019. Т. 20. С. 36–43.
Храмых Т.П., Долгих В.Т. К вопросу эндотоксемии при геморрагической гипотензии // Политравма. 2007. № 3. С. 51–59.
Шефер Т.В. Патогенетические основы медикаментозной коррекции ранних проявлений острого резорбтивного действия ипритов. Развитие концепции эндотоксикоза: Дис. … док. мед. наук. СПб.: ВМедА, 2015. 306 с.
Шефер Т.В., Рейнюк В.Л., Краснов К.А., Ивницкий Ю.Ю. Повышение циклофосфаном проницаемости тонкой кишки крыс для содержащихся в ее просвете гидрофильных веществ средней молярной массы // Medline.ru. Рос. биомед. журн. 2011. Т. 12. С. 1437–1449.
Шефер Т.В., Ивницкий Ю.Ю., Рейнюк В.Л. Влияние сока подорожника на проявления и исход острой интоксикации циклофосфаном у крыс // Биопрепараты. 2015. Т. 55. № 3. С. 61–63.
Шилов В.В., Александров М.В., Васильев С.А. и др. Острая церебральная недостаточность при тяжелых отравлениях // Medline.ru. Рос. биомед. журн. 2010. Т. 11. Ст. 25. С. 315–321.
Abuga K., Muriuki J., Williams T., Atkinson S. How severe anaemia might influence the risk of invasive bacterial infections in African children // Int. J. Mol. Sci. 2020. V. 21. № 18. Art. 6976.
Agostini L., Down P., Murison J., Wrong O. Faecal ammonia and pH during lactulose administration in man: comparison with other cathartics // Gut. 1972. V. 13. № 11. P. 859–866.
Ali R., Nagalli S. Hyperammonemia // StatPearls. Treasure Island: StatPearls Publishing, 2021.
Alshami A., Einav S., Skrifvars M., Varon J. Administration of inhaled noble and other gases after cardiopulmonary resuscitation: a systematic review // Am. J. Emerg. Med. 2020. V. 38. № 10. P. 2179–2184.
Assimakoppoulos S., Papadopoulou L., Bantouna D. et al. Faecal microbiota transplantation and hydrocortisone ameliorate intestinal barrier dysfunction and improve survival in a rat model of cecal ligation and puncture-induced sepsis // Shock. 2021. V. 55. P. 666–675.
Bär F., Bochmann W., Widok A. et al. Mitochondrial gene polymorphisms that protect mice from colitis // Gastroentherology. 2013. V. 145. № 5. P. 1055–1063.
Bested A.C., Logan A.C., Selhub E.M. Intestinal microbiota, probiotics and mental health: from Metchnikoff to modern advances: Part II – contemporary contextual research // Gut Pathog. 2013. № 5. Art. 3.
Bishehsari F., Magno E., Swanson G. et al. Alcohol and gut-derived inflammation // Alcohol Res. 2017. V. 38. № 2. P. 163–171.
Bloom P., Rodriguez-Lopez J., Witkin A. et al. Ammonia predicts hepatic involvement and pulmonary hypertension in patients with hereditary hemorrhagic telangiectasia // Clin. Transl. Gastroenterol. 2020. V. 11. № 1. P. e00118.
Brown G.C. The endotoxin hypothesis of neurodegeneration // J. Neuroinflamm. 2019. V. 16. Art. 180.
Brunt V., Gioscia-Ryan R., Casso A. et al. Trimethylamine-N-oxide promotes age-related vascular oxidative stress and endothelial dysfunction in mice and healthy humans // Hypertension. 2020. V. 76. № 1. P. 101–112.
Çağan E., Ceilan S., Mengi S., Çağan H. Evaluation of gelatin tannate aganist symptoms of acute diarrhea pediatric patients // Med. Sci. Monit. 2017. V. 23. P. 2029–2034.
Chang J., Liang S., Thanasekaran P. et al. Translational medicine in pulmonary-renal crosstalk: therapeutic targeting of p-cresyl sulfate triggered nonspecific ROS and chemoattractans in dyspneic patients with uremic lung injury // J. Clin. Med. 2018. V. 7. № 9. Art. 266.
Chaung W., Brenner M., Yen H. et al. Recombinant human milk fat globule-EGF factor VIII (rhMFG-E8) as a therapy for sepsis after acute exposure to alcohol // Mol. Med. 2019. V. 25. Art. 52.
Chen S., Xiu G., Zhou J. et al. Role of high mobility group box1 in intestinal mucosal barrier injury in rat with sepsis induced by endotoxin // Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2020. V. 32. № 7. P. 803–807.
Choi T., Choi Y., Koo J. Mental disorders linked to crosstalk between the gut microbiome and the brain // Exp. Neurobiol. 2020. V. 29. P. 403–416.
Corrêa T., Pereira A., Takala J., Jakob S. Regional venous-arterial CO2 to arterial-venous O2 content difference ratio in experimental circulatory shock and hypoxia // Intens. Care Med. Exp. 2020. V. 8. № 1. Art. 64.
Cosola C., Rocchetti M.T., Cupisti A., Gesualdo L. Microbiota metabolites: pivotal players of cardiovascular damage in chronic kidney disease // Pharmacol. Res. 2018. V. 130. P. 132–142.
Dobson G.P., Veech R.L., Passoneau J.V., Huang M.T. In vivo portal-hepatic venous gradients of glycogenic precursors and incorporation of [3-3H]glucose into liver glycogen in the awake rat // J. Biol. Chem. 1990. V. 265. P. 16350–16357.
Fink M. Bench-to-bedside review: cytopathic hypoxia // Crit. Care. 2002. V. 6. № 6. P. 491–499.
Fujivara Y., Ohnishi K., Horlad H. et al. CD163 deficiency facilitates lipopolysaccharide-induced inflammatory responses and endotoxin shock in mice // Clin. Transl. Immunol. 2020. V. 9. № 9. P. e1162.
Ge L., Lin Z., Le G. et al. Nontoxic-dose deoxynivalenol aggravates lipopolysaccharides-induced inflammation and tight junction disorder in IPEC-J2 cells through activation of NF-κB and LC3B // Food Chem. Toxicol. 2020. V. 145. Art. 111712.
Gips C.H., Qué G.S., Wibbens-Alberts M. The arterial ammonia curve after oral and intraduodenal loading with ammonium acetate. Absorption in the stomach // Neth. J. Med. 1973. V. 16. P. 14–17.
Gong D., Zhang L., Zhang Y. et al. Gut microbial metabolite trimethylamine N-oxide is related to thrombus formation in atrial fibrillation patients // Am. J. Med. Sci. 2019. V. 358. № 6. P. 422–428.
Gryp T., Vanholder R., Vaneechoutte M., Glorieux G. p-Cresyl sulfate // Toxins. 2017. V. 9. № 2. Art. 52.
Hill G., Gillum T., Lee B. et al. Prolonged treadmill running in normobaric hypoxia causes gastrointestinal barrier permeability and elevates circulating levels of pro- and anti-inflammatory cytokines // Appl. Physiol. Nutr. Metab. 2020. V. 45. № 4. P. 376–386.
Hu C., Sun J., Du J. et al. The Hippo-YAP pathway regulates the proliferation of alveolar epithelial progenitors after acute lung injury // Cell Biol. Int. 2019. V. 43. № 10. P. 1174–1183.
Hunt R.H., Camilleri M., Crowe S.E. et al. The stomach in health and disease // Gut. 2015. V. 64. № 10. P. 1650–1668.
Iba T., Levy J.H., Hirota T. et al. Protection of the endothelial glycocalyx by antithrombin in endotoxin-induced rat model of sepsis // Thromb. Res. 2018. V. 171. P. 1–6.
Ijiri K., Potten C. Response of intestinal cells of different topographical and hierarchical status to ten cytotoxic drugs and five sources of radiation // Brit. J. Cancer. 1983. V. 47. № 2. P. 175–185.
Ishisono K., Mano T., Yabe T., Kitaguchi K. Dietary fiber pectin ameliorates experimental colitis in a neutral sugar side chain-dependent manner // Front. Immunol. 2019. V. 10. Art. 2979.
Ivnitsky J.J., Rejniuk V.R., Schäfer T.V., Malakhovsky V.N. Fulminant hyperammonaemia induced by thiopental coma in rats // Toxicology. 2006. V. 224. № 3. P. 184–190.
Ivnitsky J.J., Schäfer T.V., Rejniuk V.L. Promotion of the toxic action of cyclophosphamide by digestive tract luminal ammonia in rats // ISRN Toxicology. 2011. V. 2011. Art. 450875.
Jaworska K., Bielinska K., Gawrys-Kopczynska M., Ufnal M. TMA (trimethylamine), but not its oxide TMAO (trimethylamine-oxide), exerts hemodynamic effects-implications for interpretation of cardiovascular actions of gut microbiome // Cardiovasc. Res. 2019. V. 115. P. 1948–1949.
Jayakumar A., Norenberg M. Hyperammonemia in hepatic encephalopathy // J. Clin. Exp. Hepatol. 2018. V. 8. № 3. P. 272–280.
Karádi O., Nagi Z., Bódis B., Mózsik G. Atropine-induced gastrointestinal cytoprotection dependences to the intact of vagal nerve against indomethacin-induced gastrointestinal mucosal and microvascular damage in rats // J. Physiol. Paris. 2001. V. 95. № 1–6. P. 29–33.
Khanna K., Mishra K., Chanda S. et al. Effects of acute exposure to hypobaric hypoxia on mucosal barrier injury and the gastrointestinal immune axis in rats // High Alt. Med. Biol. 2019. V. 20. № 1. P. 35–44.
Khazoom F., L’Ecuyer S., Gilbert K. et al. Impact of uric acid on liver injury and intestinal permeability following resuscitated hemorrhagic shock in rats // J. Trauma Acute Care Surg. 2020. V. 89. № 6. P. 1076–1084.
Koeth R.A., Wang Z., Levison B.S. et al. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis // Nat. Med. 2013. V. 19. № 5. P. 576–585.
Kumar M., Kaeley N., Nagasubramanyam V. et al. Single center experience of managing methanol poisoning in the hilly state of Uttarakhand: a cross sectional study // Int. J. Crit. Illn. Inj. Sci. 2019. V. 9. № 4. P. 172–176.
Lechuga S., Naydenov N., Feygin A. et al. Loss of β-cytoplasmic actin in the intestinal epithelium increases gut barrier permeability in vivo and exaggerates the severity of experimental colitis // Front. Cell Dev. Biol. 2020. V. 8. Art. 588836.
Lin H., Pimentel M. Bacterial concepts in irritable bowel syndrome // Rev. Gastroenterol. Dis. 2005. V. 5. P. S3–S9.
Lin C., Chi C., Wu S. et al. Prognostic values of blood ammonia and partial pressure of ammonia on hospital arrival in out-of-hospital cardiac arrests // Am. J. Emerg. Med. 2013. V. 31. № 1. P. 8–15.
Liu R., Hong J., Xu X. et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention // Nat. Med. 2017. V. 23. № 7. P. 859–868.
Liu S., Song P., Sun F. et al. The concept revolution of gut barrier: from epithelium to endothelium // Int. Rev. Immunol. 2021. V. 40. № 6. P. 401–408.
Lopetuso L., Scaldaferri F., Bruno G. et al. The therapeutic management of gut barrier leaking: the emerging role for mucosal barrier protectors // Eur. Rev. Med. Pharmacol. Sci. 2015. V. 19. № 6. P. 1068–1076.
Luna M., Kamariski M., Principi L. et al. Severely ill pediatric patients with Shiga toxin-associated hemolytic uremic syndrome (STEC-HUS) who suffered from multiple organ involvement in the early stage // Pediatr. Nephrol. 2021. V. 36. № 6. P. 1499–1509.
MacPherson M., Hov J., Ueland T. et al. Gut microbiota-dependent trimethylamine N-oxide associates with inflammation in common variable immunodeficiency // Front. Immunol. 2020. V. 11. Art. 574500.
Magnotti L.J., Upperman J.S., Xu D.Z. et al. Gut-derived mesenteric lymph but not portal blood increases endothelial cell permeability and promotes lung injury after hemorrhagic shock // Ann. Surg. 1998. V. 228. № 4. P. 518–527.
Manani S., Virzì G., Guiliani A. et al. Lipopolysaccharide evaluation in peritoneal dialysis patients with peritonitis // Blood Purif. 2020. V. 49. № 4. P. 434–439.
Maniatis N.A., Kotanidou A., Catravas J.D., Orfanos S.E. Endothelial pathomechanisms in acute lung injury // Vascul. Pharmacol. 2008. V. 49. P. 119–133.
Matsumoto T., Takayanagi K., Kojima M. et al. Acute exposure to indoxyl sulfate impairs endothelium-dependent vasorelaxation in rat aorta // Int. J. Mol. Sci. 2019. V. 20. Art. 338.
McClung H., Sloan H., Powers P. et al. Early changes in the permeability of the blood-brain barrier produced by toxins associated with liver failure // Pediatr. Res. 1990. V. 28. № 3. P. 227–231.
McMillen K., Coghlin-DicksonT., Adintori P. Optimization of nutrition support practices early after hematopoietic cell transplantations // Bone Marrow Transplant. 2021. V. 56. P. 314–326.
Minami T., Oda K., Gima N., Yamazaki H. Effects of lipopolysaccharide and chelator on mercury content in the cerebrum of thimerosal-administered mice // Environ. Toxicol. Pharmacol. 2007. V. 24. № 3. P. 316–320.
Møller S., Kimer N., Barløse M., Bendtsen F. Pathophysiological-based treatment of complications of cirrhosis // Scand. J. Gastroentherol. 2020. V. 55. № 4. P. 383–394.
Morris M.C., Gilliam E.A., Li L. Innate immune programing by endotoxin and its pathological consequences // Front. Immunol. 2015. V. 5. Art. 680.
Nespoli A., Chiara O., Clement M. et al. The cardiorespiratory impairment in cirrhosis and sepsis. An experimental interpretation using octopamine infusion // Circ. Shock. 1983. V. 10. № 1. P. 15–30.
Nežić L., Škrbić R., Amidžić L. et al. Protective effects of simvastatin on endotoxin-induced acute kidney injury through activation of tubular epithelial cells' survival and hindering cytochrome C-mediated apoptosis // Int. J. Mol. Sci. 2020. V. 21. Art. 7236.
Novosad S., Sapiano M., Grigg C. et al. Vital signs: epidemiology of sepsis: prevalence of health care factors and opportunities for prevention // MMWR. 2016. V. 65. № 33. P. 864–869.
Numan Y., Jawaid Y., Hirzallah H. et al. Ammonia vs. lactic acid in predicting positivity of microbial culture in sepsis: the ALPS pilot study // J. Clin. Med. 2018. V. 7. № 8. Art. 182.
Ochoa-Sanchez R., Rose C. Pathogenesis of hepatic encephalopathy in chronic liver disease // J. Clin. Exp. Hepatol. 2018. V. 8. № 3. P. 262–271.
O’Grady J., Murphy C.L., Burry L. et al. Defining gastrointestinal transit time using video capsule endoscopy: a study of healthy subjects // Endosc. Int. Open. 2020. V. 8. № 3. P. E396–E400.
Olek R., Samulak J., Sawicka A. et al. Increased trimethylamine N-oxide is not associated with oxidative stress markers in healthy aged women // Oxid. Med. Cell. Longev. 2019. V. 2019. Art. 6247169.
Pagana K.D., Pagana T.J. Mosby’s manual of diagnostic and laboratory tests. St. Louis: Mosby Elsevier, 2014. 1245 p.
Pang R., Martinello K., Meehan C. et al. Proton magnetic resonance spectroscopy lactate/N-acetylaspartate within 48 h predicts cell death following varied neuroprotective interventions in a piglet model of hypoxia-ischemia with and without inflammation-sensitization // Front. Neurol. 2020. V. 11. Art. 883.
Pfalzgraff A., Weindl G. Intracellular lipopolysaccharide sensing as a potential therapeutic target for sepsis // Tr. Pharmacol. Sci. 2019. V. 40. P. 187–197.
Ponti G., Maccaferri M., Ruini C. et al. Biomarkers associated with COVID-19 disease progression // Crit. Rev. Clin. Lab. Sci. 2020. V. 57. № 6. P. 389–399.
Pool R., Gomez H., Kellum J.A. Mechanisms of organ dysfunction in sepsis // Crit. Care Clin. 2018. V. 34. P. 63–80.
Rao J.N., Wang J.Y. Regulation of gastrointestinal mucosal growth. San Rafael: Morgan and Claypool Life Sciences, 2011. 114 p.
Restini C., Fink G., Watts S. Vascular reactivity stimulated by TMA and TMAO: are perivascular adipose tissue and endothelium involved? // Pharmacol. Res. 2020. V. 163. Art. 105273.
Rinaldi B., Cuzzocrea S., Donniacuo M. et al. Hyperbaric oxygen therapy reduces toll-like receptor signaling pathway in multiple organ failure // Intens. Care Med. 2011. V. 37. № 7. P. 1110–1119.
Rodríguez-Hernandez P., Cardador M.J., Arce L., Rodríguez-Estévez V. Analytical tools for disease diagnosis in animals via fecal volatilome // Crit. Rev. Anal. Chem. 2020. V. 12. P. 1–16.
Role of gut bacteria in human toxicology and pharmacology / Ed. M.J. Hill. London: Taylor & Francis, 2005. 280 p.
Saxena A., Lopes F., McKay D. Reduced intestinal epithelial mitochondrial function enhances in vitro interleukin-8 production in response to commensal Escherichia coli // Inflamm. Res. 2018. V. 67. № 10. P. 829–837.
Schäfer T.V., Ivnitsky J.J., Rejniuk V.L. Cyclophosphamide-induced leakage of gastrointestinal ammonia into the common bloodstream in rats // Drug Chem. Toxicol. 2011. V. 34. № 1. P. 25–31.
Scott T., Kronsten T., Hughes R., Shawcross D. Pathophysiology of cerebral oedema in acute liver failure // World J. Gastroenterol. 2013. V. 19. № 48. P. 9240–9255.
Sender R., Fuchs S. Revised estimates for the number of human and bacteria cells in the body // PLoS Biol. 2016. V. 14. № 8. Art. e1002533.
Sheikh M., Unni N., Agarwal B. Neurological monitoring in acute liver failure // J. Clin. Exp. Hepatol. 2018. V. 8. № 4. P. 441–447.
Shi K., Wang F., Jiang H. et al. Gut bacterial translocation may aggravate microinflammation in hemodialysis patients // Dig. Dis. Sci. 2014. V. 59. P. 2109–2117.
Skowrońska M., Albrecht J. Oxidative and nitrosative stress in ammonia neurotoxicity // Neurochem. Int. 2013. V. 62. № 5. P. 731–737.
Skowrońska M., Zielińska M., Wójcik-Stanaszek W. et al. Ammonia increases paracellular permeability of rat brain endothelial cells by a mechanism encompassing oxidative/nitrosative stress and activation of matrix metalloproteinases // J. Neurochem. 2012. V. 121. № 1. P. 125–134.
Solé C., Guilly S., Da Silva K. et al. Alterations in gut microbiome in cirrhosis as assessed by quantitative metagenomics: relationship with acute-on-chronic liver failure and prognosis // Gastroenterology. 2021. V. 160. P. 206–218.
Suárez L., Moreno-Luque M., Martínez-Ardines I. et al. Amine variations in faecal content in the first weeks of life of newborns in relation to breast-feeding or infant formulas // Br. J. Nutr. 2019. V. 122. № 10. P. 1130–1141.
Summerskill W.H.J., Wolpert E. Ammonia metabolism in the gut // Am. J. Clin. Nutr. 1970. V. 23. № 5. P. 633–639.
Tan X., Liu Y., Long J. et al. Trimethylamine N-oxide aggravates liver steatosis through modulation of bile acid metabolism and inhibition of farnesoid X receptor signaling in nonalcoholic fatty liver disease // Mol. Nutr. Food Res. 2019. V. 63. № 17. Art. e1900257.
Tang W.H., Wang Z., Levison B.S. et al. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk // N. Engl. J. Med. 2013. V. 368. № 17. P. 1575–1584.
Tang W., Kitai T., Hazen L. Gut microbiota in cardiovascular health and disease // Circ. Res. 2017. V. 120. № 7. P. 1183–1196.
Toxicology of the gastrointestinal tract / Ed. S. Gad. Boca Raton, L., N.Y.: Taylor & Francis Group, 2007. 384 p.
Uno Y. Hypothesis: mechanism of irritable bowel syndrome in inflammatory bowel disease // Med. Hypoth. 2019. V. 132. Art. 109324.
Walker V. Severe hyperammonaemia in adults not explained by liver disease // Ann. Clin. Biochem. 2012. V. 49. P. 214–228.
Wang W., Weng J., Yu L. et al. Role of TLR4-p38 MAPK-Hsp27 signal pathway in LPS-induced pulmonary epithelial hyperpermeability // BMC Pulm. Med. 2018. V. 18. № 1. Art. 178.
Wang L., Cao Y., Gorshcov B. et al. Ablation of endothelial Pfkfb3 protects mice from acute lung injury in LPS-induced endotoxemia // Pharmacol. Res. 2019. V. 146. Art. 104292.
Wood T., Moralejo D., Corry K. et al. A ferret model of inflammation-sensitized late preterm hypoxic-ischemic brain injury // J. Vis. Exp. 2019. V. 153. Art. e60131.
Yoshida N., Yamashita T., Kishino S. et al. A possible beneficial effect of Bacteroides on faecal lipopolysaccharide activity and cardiovascular diseases // Sci. Rep. 2020. V. 10. № 1. Art. 13009.
Zhang L.S., Davis S.S. Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions // Genome Med. 2016. V. 8. № 1. Art. 46.
Zhao J., He Y., Xu P. et al. Serum ammonia levels on admission for predicting sepsis patient mortality at D28 in the emergency department: a 2-center retrospective study // Medicine (Baltimore). 2020. V. 99. Art. e19477.
Zhou Y., Huang X., Zhao T. et al. Hypoxia augments LPS-induced inflammation and triggers high altitude cerebral edema in mice // Brain Behav. Immun. 2017. V. 64. P. 266–275.
Zhou W., Cheng Y., Zhu P. et al. Implication of gut microbiota in cardiovascular diseases // Oxid. Med. Cell. Longev. 2020. V. 2020. Art. 5394096.
Zhu W., Gregory J.C., Org E. et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk // Cell. 2016. V. 165. P. 111–124.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии