Успехи современной биологии, 2022, T. 142, № 4, стр. 315-332
Исследование микробиома человека и животных как источника генетических и фармакологических ресурсов для развития инновационных биотехнологий в медицине, животноводстве и агропромышленном комплексе
В. Н. Даниленко 1, *, Р. А. Юнес 1, Р. А. Ильясов 1, 2, А. С. Ковтун 1, А. С. Яненко 3, Ю. Е. Козловский 3, А. В. Сидоренко 4, Э. И. Коломиец 4
1 Институт общей генетики им. Н.И. Вавилова РАН
Москва, Россия
2 Башкирский государственный аграрный университет
Москва, Россия
3 Национальный исследовательский центр “Курчатовский институт”
Уфа, Россия
4 Институт микробиологии НАН Беларуси
Минск, Беларусь
* E-mail: valerid@vigg.ru
Поступила в редакцию 29.03.2022
После доработки 29.03.2022
Принята к публикации 30.03.2022
- EDN: VTVRVG
- DOI: 10.31857/S0042132422040044
Аннотация
Сегодня всем известны этапы разработки антибактериальных препаратов, успехи в этой области и проблемы применения в медицине. Первоначально усилиями ученых всего мира были созданы антибиотики на основе природных продуцентов почвенного происхождения. Широкомасштабное и порой нерациональное применение антибактериальных препаратов способствовало появлению и широкому распространению патогенов, устойчивых к большинству антибиотиков. Такая же ситуация складывалась и в области разработки противовирусных и иммуномодулирующих препаратов. Стало очевидным, что человек проигрывает гонку болезням и патогенам. Появилась необходимость в создании новых подходов и парадигм в разработке технологий и в выборе источников лекарственных средств. Успехи последнего десятилетия в области изучения микробиоты человека открыли перед нами много возможностей. Современные представления о структуре и функциях кишечной микробиоты и концептуальное объединение знаний о комменсальных микроорганизмах, включая пробиотические, полученные молекулярно-генетическими, транскриптомными, протеомными и метаболомными методами, позволили сформировать понятие “фармабиотики”. Создание фармабиотиков на основе микроорганизмов, населяющих различные полости тела человека, включая кишечник, является новым и интенсивно развивающимся направлением фармакологической науки. Поставленные цели в этой области могут быть достигнуты при условии комплексного решения ряда фундаментальных задач, обеспечивающих создание эффективных и безопасных фармпрепаратов и ингредиентов для них. Роль микробиома вообще и фармабиотиков в частности в качестве селективных модуляторов и иммунной системы, в первую очередь клеточного иммунитета, и антиоксидантной системы становится все более очевидной. В течение последнего десятилетия в РФ и Республике Беларусь интенсивно проводятся исследования микробиома кишечника человека и животных и разработка препаратов пробиотиков и фармабиотиков с нейромодулирующей, иммуномодулирующей, антиоксидантной и противовоспалительной активностями.
ВВЕДЕНИЕ
Прорыв последних лет в области комплексного изучения микробиома человека привел к открытию новых возможностей и перспектив создания лекарственных препаратов нового поколения – фармабиотиков. Метамикробиом – это совокупность генов, полученная в результате полногеномного секвенирования микробиоты и последующего метагеномного анализа. К фармабиотикам относят живые штаммы комменсальных бактерий кишечника, их компоненты (клеточные стенки, полисахариды) и метаболиты (белки, пептиды, ферменты, специфические фрагменты ДНК, малые РНК), а также другие биологически активные вещества, которые проявляют фармакологическую активность c установленным механизмом действия и безопасны в использовании (Sleator, Hill, 2008, 2009; Shanahan, Collins, 2010; Patterson et al., 2014; Danilenko et al., 2021).
Микробиота человека в последние годы рассматривается как один из альтернативных источников получения фармакологически активных ингредиентов для фармпрепаратов нового поколения с иммуномодулирующей, нейромодулирующей, антиоксидантной и противовоспалительной активностями (рис. 1).
Рис. 1.
Симбиотическая связь микробиоты с организмом хозяина (по: Evans et al., 2013; Lyte, 2014, адаптировано).
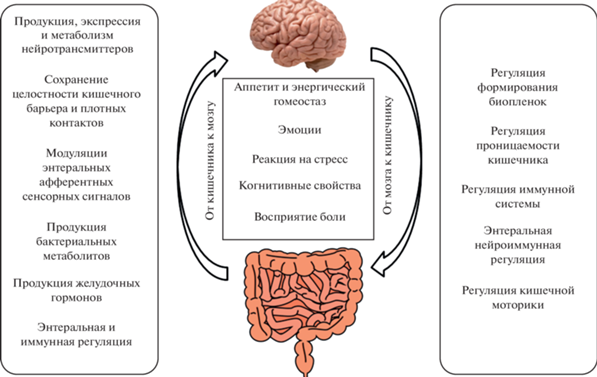
Около 10 лет назад произошла смена парадигмы в представлении о микроорганизмах, населяющих кишечник человека. Микробиом кишечника (МК) сегодня называют нейроэндокринным виртуальным органом (рис. 1), интегрирующим взаимодействие и гомеостаз практически всех систем и органов человека через ось кишечник–мозг (Evans et al., 2013; Lyte, 2014; Cryan et al., 2019; Agirman, Hsiao, 2021; Margolis et al., 2021). Знания об иммуномодулирующем, нейромодулирующем и антиоксидантном потенциалах микробиома и носителях этих свойств – конкретных комменсальных бактериях – позволят более рационально использовать уже существующие противоинфекционные и другие препараты. Проведение полного и глубокого метагеномного анализа МК позволило выявить в его составе бактерии, содержащие заданные гены и их комбинации, определяющие потенциальную иммунобиологическую и антиоксидантную активность. Вся система функционирует как единая сеть. Нарушение в одном звене приводит к сбою всей системы и, как следствие, к дисбактериозу.
С использованием определенных процедур искомые бактерии, не содержащие генов патогенности и лекарственной устойчивости, несущие необходимые комбинации целевых генов, могут быть выделены из биологических образцов (фекалий) для дальнейшего исследования. В настоящее время в мире существуют биобанки образцов микробиоты и комменсальных бактерий (Liu et al., 2021). Вместе с тем следует учитывать регионально-культурные особенности состава микробиома и высокую штаммоспецифичность способности бактерий продуцировать те или иные фармакологически активные вещества. Поскольку в России отсутствуют такие биобанки, представляется целесообразным сформировать когорты здоровых молодых людей, представляющих основные регионы страны, для отбора образцов микробиоты.
Создание новых лекарственных препаратов для лечения заболеваний различной этиологии: онкологических, кардиологических, аутоиммунных, нейропсихиатрических, нейродегенеративных и, в первую очередь, инфекционных – испытывает в последние годы определенные трудности. Пандемия COVID-19 и последствия перенесения заболевания обострили ситуацию и объединили мировые научные и бизнес-сообщества для разработки современной концепции поиска и создания новых противовоспалительных средств. На первом месте стоят препараты с иммуномодулирующей и нейромодулирующей активностями. Создание лекарственных препаратов, имеющих минимальные побочные эффекты и не являющихся чужеродными для человеческого организма, способных скоординировано налаживать работу иммунной и антиоксидантной систем, становится все более востребованным (Akour, 2020; Averina et al., 2020, 2021; Danilenko et al., 2021; Jabczyk et al., 2021; Singh, Rao, 2021).
Использование микробиома человека в терапевтических целях (поиски новых лекарственных препаратов и создание диагностикумов) – это стремительно развивающееся в мире направление. Более 250 компаний и 800 исследовательских проектов заявили себя в базе данных Microbiome Drug Database. Ведется поиск уникальных штаммов бактерий (фармабиотиков) и их продуктов (метабиотиков – постбиотиков) с целью лечения и профилактики различных патологий. Большое внимание уделяется разработке препаратов с иммуномодулирующей и противовоспалительной активностями. Создан ряд компаний, официально заявивших о себе и продвигающих свои продукты на мировом рынке.
МИКРОБИОМ КИШЕЧНИКА ЧЕЛОВЕКА: ИММУНОМОДУЛИРУЮЩИЙ, НЕЙРОМОДУЛИРУЮЩИЙ, АНТИОКСИДАНТНЫЙ И ПРОТИВОВОСПАЛИТЕЛЬНЫЙ ПОТЕНЦИАЛЫ
Иммуномодулирующий потенциал микробиоты человека
Взаимодействия МК и иммунной системы хозяина являются полимодальными, сложными и двунаправленными. С момента рождения, МК человека играет решающую роль в индукции и функционировании иммунной системы (Belkaid, Harrison, 2017). Иммунная система, с одной стороны, поддерживает партнерские отношения с комменсальными и симбиотическими микроорганизмами, с другой – индуцирует защитные воспалительные реакции в ответ на вторжение патогена; то есть иммунная система учится сосуществовать с комменсальной микробиотой и адекватно реагировать на патогенные микроорганизмы (Hooper et al., 2012). Нарушение гомеостаза кишечника приводит к таким заболеваниям, как рак, болезнь Крона, неспецифический язвенный колит, сахарный диабет, ожирение, аллергия, астма и др. (Cianci et al., 2018). Развитие этих заболеваний также коррелирует с нарушением функционирования иммунной системы.
Кишечник является важным иммунологическим органом. Около 70% всех иммунокомпетентных клеток находятся в кишечной слизи; около 25% слизистой оболочки состоит из иммунологически активных тканей и клеток. Кишечно-ассоциированная лимфоидная ткань GALT (gut-associated lymphoid tissue) включает клеточные (макрофаги, плазматические и тучные клетки, лимфоциты и др.) и структурные (лимфоидные фолликулы, лимфатические узлы, пейеровы бляшки и др.) элементы. Последние, находящиеся под контролем клеток иммунологической памяти, участвуют во взаимодействии между антигенпрезентирующими клетками, способными к абсорбции или процессингу антигена, и Т-клетками, тем самым осуществляя иммунный ответ. Важной функцией GALT является идентификация антигена и снятие или развитие иммунологической толерантности к антигенам.
Толл-подобные рецепторы TLRs (Toll-like receptors) представляют собой трансмембранные молекулы, связывающие вне- и внутриклеточные структуры, и являются элементами иммунной защиты кишечного эпителия. Они выполняют важнейшую функцию в иммунном ответе: обнаруживают определенные структуры антигенов кишечных бактерий и связывают их. TLRs обеспечивают толерантность к резидентной микробиоте, доставку АРС-антигена, усиление плотных контактов и индукцию антимикробных пептидов (Lu et al., 2018). Кроме того, TLRs могут быть рецепторами цитокинов, в частности ИЛ-1 и ИЛ-13. В настоящее время, известно 13 типов TLRs. У млекопитающих наиболее важным является TLR4. Этот рецептор бактериальных эндотоксинов играет ключевую роль в индукции врожденного иммунитета и воспаления. TLR4 активируется бактериальными липополисахаридами LPS (lipopolysaccharides) за счет скоординированного и последовательного действия трех белков: липополисахарид-связывающего белка, кластера дифференцировочного антигена CD14 и рецепторов миелоидного дифференцировочного белка MD-2. Последние связывают LPS и представляют его TLR4 в мономерной форме, образуя активный комплекс (TLR4/MD-2/LPS) (Gómez-Llorente et al., 2010; Schappe et al., 2018). Кроме того, в кишечнике взрослых обнаружены иммуноглобулины всех классов, при этом преобладают секреторные иммуноглобулины А (sIgА). Доказанное влияние МК на иммунную адаптацию и формирование толерантности человека к внешним факторам позволило использовать микроорганизмы-симбионты человека для профилактики и лечения целого ряда заболеваний (Peri et al., 2012; Dong et al., 2020).
Сегодня опубликовано много работ по изучению иммуномодулирующего действия пробиотических штаммов лактобацилл и бифидобактерий (Belkina et al., 2021; Shimizu et al., 2021; Varsha et al., 2021). В качестве представителей комменсальной микробиоты эти бактерии способны селективно стимулировать врожденный иммунитет и оказывать влияние на формирование адаптивного иммунного ответа, влияя на профили секреции и провоспалительных, и противовоспалительных цитокинов. Исследование иммуномодулирующей активности пробиотических штаммов бактерий проводится на культурах энтероцитов (Caco-2, HT-29), иммуноцитов (EC-6, THP-1) и на лабораторных животных (здоровых, с дефектами иммунной системы, гнотобионтах). При исследовании влияния живых и разрушенных (нагреванием или ультрафиолетовым излучением) культур бактерий и их метаболитов на иммунитет анализируются особенности кластерной дифференцировки иммунокомпетентных клеток и уровень продукции цитокинов при помощи иммунологических и генетических методов (Munoz-Quezada et al., 2013). С использованием современных методических подходов показано, что разные штаммы бифидобактерий, лактобацилл и их компоненты оказывают различный по степени выраженности иммуномодулирующий эффект (Patten, Laws, 2015; Lim, Shin, 2020; Rocha Ramirrez et al., 2021). Согласно данным экспериментальных исследований in vitro и доклинических исследований, специфические штаммы пробиотиков способны обеспечивать защиту от вирусных инфекций путем стимуляции противовирусных, цитокиновых и хемокиновых реакций в эпителиальных или иммунных клетках респираторного и желудочно-кишечного тракта (ЖКТ). Бифидобактерии и лактобациллы способны проявлять противовирусное действие частично за счет усиления врожденного иммунитета путем модуляции иммунной системы кишечника. Также они могут усиливать выработку цитокинов в легких или сыворотке крови (Bozkurt, Quigley, 2020).
Антиоксидантный потенциал микробиоты человека
Как комменсальные, так и патогенные бактерии в составе МК способны влиять на клеточный уровень активных форм кислорода (АФК) через модуляцию митохондриальной активности (Zorov et al., 2014). Комменсальные бактерии продуцируют формилированные пептиды, которые связываются с рецепторами, сопряженными с G-белками GPCRs (G-protein-coupled receptors) на макрофагах и нейтрофилах, что приводит к запуску воспалительного процесса в эпителиальных клетках. Воспалительный процесс сопровождается выработкой супероксида NOX-1, тем самым увеличивая уровень клеточных АФК (Migeotte et al., 2006). Кишечные бактерии Lactobacillus и Bifidobacterium способны превращать нитраты и нитриты в оксид азота NO, что делает эпителий кишечника богатым источником NO. Аналогичным образом стрептококки и бациллы продуцируют NO из L-аргинина с помощью NO-синтазы (Tiso, Schechter, 2015). NO в наномолярной концентрации считается нейропротектором и является нейротрансмиттером для нор-адренергических, нехолинергических нейронов кишечника. В то же время в более высокой концентрации NO оказывает пагубный эффект, вызванный продукцией активных форм кислорода и азота, в частности супероксида и H2O2. Последние образуют высокореактивные гидроксильные радикалы, которые ассоциируются с нейровоспалением, дегенерацией аксонов и нарушением развития нервной системы (Wang B. et al., 2017). Полезные метаболиты-антиоксиданты – короткоцепочечные жирные кислоты, вырабатываемые кишечными бактериями, – помогают снизить уровень АФК, влияя на активность митохондрий (Mishra et al., 2015; Marsova et al., 2018, 2020; Nowak et al., 2019) Антиоксиданты – молекулы, которые взаимодействуют со свободными радикалами, генерируемыми в клетках, и прекращают цепную реакцию, вызванную АФК и приводящую к нарушению функционирования клетки. Вещества, обладающие антиоксидантными свойствами, играют ключевую роль в поддержании общего здоровья человека (Firuzi et al., 2011; Averina et al., 2021). Когда у человека естественные механизмы нейтрализации, возникающие в процессе нормального метаболизма АФК, не справляются со своей задачей, развивается патологическое состояние – оксидативный (окислительный) стресс. Способность отдельных штаммов пробиотических бактерий снижать окислительный стресс доказана различными исследованиями in vitro и in vivo (Amaretti et al., 2013). Механизмы действия таких штаммов достаточно многообразны и включают в себя: хелатирование токсичных ионов (Fe2+ и Cu2+); синтез ферментов-антиоксидантов (каталаза, супероксиддисмутаза), пептидов и тиолов (тиоредоксин, глютатион), веществ с антиокислительными свойствами (витамины B1 и B12, короткоцепочечные жирные кислоты); воздействие на клеточные рецепторы; регуляцию внутренних систем сигнальной трансдукции эукариотических клеток; активацию транскрипции ферментов, нейтрализующих свободные радикалы (Nrf2-Keap1-ARE, NF-κB, MAPK, PKC); модуляцию видового состава МК и др. (Amaretti et al., 2013; Wang N. et al., 2017). Образуемые бактериальные низкомолекулярные антиоксиданты, в том числе тиолы, играют в клетке важную роль – участвуют в поддержании клеточного редокс-статуса, в работе системы детоксикации, в синтезе эйкозаноидов, в регуляции многих механизмов клеточного сигналинга, клеточного цикла, экспрессии генов и апоптоза (Mishra et al., 2015). Многие пробиотические бактерии являются продуцентами антиоксидантных веществ: аминокислот (метионин, цистин, цистеин), витаминов (PP, С, K). Пробиотики могут проявлять антиоксидантное действие посредством метаболизма окислительных соединений или профилактики их образования в кишечнике (Azcárate-Peril et al., 2011). Способность некоторых пробиотических бактерий продуцировать антиокислительные ферменты и метаболиты обеспечивает их особую перспективность для борьбы со свободными радикалами (Danilenko et al., 2021).
Нейромодулирующий потенциал микробиоты человека
В последние годы растет интерес к изучению влияния МК на психическое состояние человека (Chen et al., 2021; Nikolova et al., 2021).
Проведенные исследования на животных показали существование двунаправленной связи между ЦНС и микробиотой ЖКТ, которая модулирует функционирование ЦНС через иммунологические, эндокринные и нейрональные механизмы (Cryan et al., 2019). На различных моделях животных показано влияние МК на поведение, способность к обучению, память, уровни тревожности и депрессии, реакцию на эмоциональные стимулы, устойчивость к стрессам (Margolis et al., 2021). Изучалось действие и отдельных штаммов пробиотических бактерий. Определено влияние пробиотиков, содержащих специфические виды и штаммы бактерий, на снижение депрессивных и тревожных симптомов (Nadeem et al., 2019).
Введение штамма Lactiplantibacillus plantarum PS128 мышам понижает у них тревожность и депрессивно-подобное поведение, а также степень воспаления и уровень кортикостерона в крови и повышает уровни дофамина и серотонина в префронтальной коре и стриатуме (Liu et al., 2015, 2016). Штамм Lactobacillus helveticus NS8 снижает у крыс признаки депрессии, тревожность и улучшает когнитивные характеристики, при этом увеличиваются уровни серотонина, норэпинефрина и нейротрофического фактора мозга в гиппокампе (Liang et al., 2015). Введение штамма Bifidobacterium longum 1714 мышам линии BALB/c (Savignac et al., 2014) понижает у них тревожность и депрессивно-подобное поведение. А введение штамма Lacticaseibacillus rhamnosus JB-1 самцам линии BALB/c (Bravo et al., 2011) приводит к снижению тревожности и депрессивно-подобного поведения, а также к изменению экспрессии рецепторов гамма-аминомасляной кислоты (ГАМК-рецепторов) в миндалевидной железе, голубом пятне, гиппокампе и других участках мозга. Штамм B. longum NCC3001 понижает у мышей тревожность и увеличивает уровень нейротрофического фактора мозга BDNF (brain derived neurotrophic factor) в гиппокампе (Bercik et al., 2010). Введение мышам штамма B. longum subsp. infantis 35624 понижает у них депрессивно-подобное поведение (Desbonnet et al., 2010). Отмечено (Yunes et al., 2020) снижение депрессивно-подобного поведения мышей линии BALB/c после введения композиции из двух штаммов L. plantarum 90sk и Bifidobacterium adolescentis 150.
Клинические исследования выявили, что употребление пробиотиков, содержащих специфические виды и штаммы бактерий, приводит к снижению депрессивных и тревожных симптомов и у человека (Messaoudi et al., 2011). Исследования также продемонстрировали различия в составе МК у пациентов с диагнозом генерализованного депрессивного расстройства, по сравнению со здоровой популяцией (Valles-Colomer et al., 2019).
ПРОБИОТИКИ, ПОСТБИОТИКИ И ФАРМАБИОТИКИ – ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ
Существующие определения пробиотиков, постбиотиков и фармабиотиков
Согласно определению, сформулированному рабочей группой ВОЗ в 2001 г., термин “пробиотики” означает живые микроорганизмы, которые при применении в адекватных количествах оказывают положительное влияние на здоровье организма-хозяина. Важно понимать, что пробиотики относятся к биологически активным добавкам, что исключает их использование в терапевтических целях (Hotel, Cordoba, 2001).
В отличие от пробиотиков, предназначенных для потребления здоровыми людьми с целью профилактики болезней и улучшения общего состояния организма, под фармабиотиками подразумевают живые бактерии, структурные компоненты их клеток и/или метаболиты с установленным механизмом фармакологического действия, рассчитанные на лечение конкретных нозологий (Sleator, Hill, 2008, 2009; Shanahan, Collins, 2010; Patterson et al., 2014).
Недавно принятый термин “постбиотики” обозначает убитые микробные клетки и/или их компоненты (за исключением вакцин), которые позитивно влияют на здоровье человека. Другие равнозначные по смыслу понятия: парабиотики, тиндализированные бактерии, метабиотики и др. Постбиотики легче поддаются контролю с точки зрения их качества, пробиотических свойств, стандартизации и производства (Salminen et al., 2021).
Вклад исследований микробиома в уточнение и самого понятия, и областей применении пробиотиков
Бурное развитие в последнее десятилетие междисциплинарного направления “микробиом человека” открыло глобальные перспективы для поиска новых биомишеней и разработки лекарственных средств различной направленности. Сегодня хорошо известно, что практически все заболевания коррелируют с нарушением (дисбиозом) композиции и функционирования МК. Многие заболевания сопровождаются дисбиозом, нарушением функционирования иммунной системы и воспалительными процессами от локальных до системных, охватывающими все органы и системы человека (Vijay, Valdes, 2021).
Известна роль микробиома и его основных бактериальных компонентов (пробиотических бактерий) в становлении и поддержании иммунитета. Изучается антиоксидантный потенциал пробиотических бактерий, в первую очередь лактобацилл и бифидобактерий. Классические пробиотические бактерии известны со времени их открытия И.И. Мечниковым и широко используются в пищевой и медицинской промышленности (Mackowiak, 2013; Novik, Savich, 2020; Stavropoulou, Bezirtzoglou, 2020). В последние годы формулируется новая концепция разработки и применения полезных комменсальных бактерий, выделенных из микробиома, и их ингредиентов (компонентов) для профилактики и лечения заболеваний различной этиологии. В мировой науке идет интенсивное обсуждение преимуществ и недостатков применения живых пробиотических бактерий, фармабиотиков и постбиотиков (Danilenko et al., 2021; Salminen et al., 2021). При использовании в фармакологии и при разработке лечебных продуктов питания указывается на необходимость проведения комплекса медико-биологических исследований не только по безопасности, но и по эффективности, нозологической направленности и механизмам действия препаратов. Как правило, источником фармабиотиков (постбиотиков) является МК человека и комменсальные бактерии, выделенные из него. Разрабатываются новейшие технологии поиска и изучения перспективных свойств фармабиотиков. Формируется новая парадигма создания фармпрепаратов на основе фармабиотиков, в том числе противоинфекционных. С учетом высоких иммуномодулирующего и антиоксидативного потенциалов фармабиотиков планируется их использование для повышения активности антибиотиков, вакцин и других существующих лекарственных препаратов. Фармабиотики селективного действия рассматриваются в качестве препаратов нового поколения для коррекции микробиома с целью восстановления иммунного баланса организма и снятия воспалительных процессов, вызванных оксидативным стрессом (Sleator, Hill, 2008, 2009; Shanahan, Collins, 2010; Patterson et al., 2014). Для ускоренного создания таргетных фармабиотиков исследования ведутся комплексно по нескольким направлениям: проведение фундаментальных исследований по изучению механизмов действия уже отобранных фармабиотиков; разработка концепции, новых генетических и биоинформатических технологий для поиска фармабиотиков в метагеномах здоровых людей, в том числе стрессоустойчивых; последующий отбор и характеристика уникальных штаммов с помощью омиксных технологий – это глобальный путь, по которому движется современная наука о здоровье. Микробиом – это основа здоровья человека.
Вместе с тем требуется постоянно расширять и концептуально обосновывать научную базу использования МК человека в качестве источника фармабиотиков, фармакологически активных компонентов и кодирующих их генов, метабиотиков для последующего создания лекарственных препаратов. Понимая всю важность и необходимость разработок в этом направлении, следует учитывать регионально-культурные особенности формирования микробиоты различных групп населения при создании фармабиотиков.
Метамикробиом кишечного тракта – источник фармабиотиков и фармакологически активных ингредиентов с иммуномодулирующей, антиоксидантной и нейромодулирующей активностями
МК в совокупности рассматривается сегодня как особый орган, состоящий из микроорганизмов, населяющих ЖКТ, которые не уступают по своей численности количеству эукариотических клеток организма хозяина (Dekaboruah et al., 2020). МК вносит жизненно важный вклад в энергетический гомеостаз, обмен веществ, состояние кишечного эпителия, иммунологическую активность организма, включая его ответ на инфекционные заболевания.
Благодаря накопленным в настоящее время данным по микробиоте, можно судить о роли дисбаланса МК в развитии различных заболеваний (психических, онкологических, аутоиммунных и инфекционных) (Blumberg, Powrie, 2012; Levy et al., 2017). Микробиомика представляет собой развивающуюся область исследований, цель которой – выявление компонентов микробиоты, анализ микробиома, характеристика взаимодействия между микробиотой и хозяином и определение влияния на состояние здоровья человека. МК воздействует не только на клетки кишечного эпителия и энтеральную нервную систему, но и на развитие и функционирование различных органов и систем, включая ЦНС и иммунную систему. МК начинает формироваться после рождения и сопровождает человека на протяжении всей его жизни, поддерживая нормальное функционирование иммунной системы через различные механизмы (Belkaid, Harrison, 2017; Averina et al., 2021). Так как иммунная система преимущественно расположена в кишечной лимфоидной ткани, микроаспирация кишечных бактерий или перемещение сенсибилизированных иммунных клеток через лимфу или кровоток существенно влияет на иммунный ответ в других органах: в частности метаболиты, вырабатываемые микроорганизмами ЖКТ, влияют на легкие (Wang B. et al., 2017). Сегодня развитие многих заболеваний связывают с нарушениями в функционировании иммунной системы.
Одной из ключевых характеристик микробиоты, делающей ее важным фактором в регуляции многих процессов в человеческом организме (иммуномодуляция, нейромодуляция, антиоксидантная активность) (Averina, Danilenko, 2017; Averina et al., 2020, 2021), является способность составляющих ее бактерий синтезировать огромное количество различных активных соединений (рис. 2).
Рис. 2.
Влияние микробиоты кишечника на организм хозяина при помощи синтеза различных биологически активных соединений (по: Averina, Danilenko, 2017; Averina et al., 2020, 2021; Belkina et al., 2021; Poluektova et al., 2021).
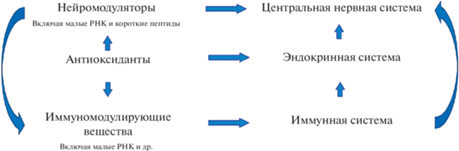
Недавние исследования показали, что в дополнение к классическим пробиотическим видам большинство комменсальных микроорганизмов, часто доминирующих в здоровых популяциях и истощенных у больных людей, также могут положительно взаимодействовать с иммунной системой хозяина и способствовать укреплению здоровья (O’Toole et al., 2017). К ним можно отнести Akkermansia muciniphila, Bacteroides fragilis, Faecalibacterium prausnitzii (Delgado et al., 2020). Идентификация биологически активных фракций из таких микроорганизмов предоставляет новые возможности для использования их в фармакологии.
Внеклеточные или поверхностно-ассоциированные белковые молекулы комменсальных кишечных микроорганизмов выполняют (Ruiz et al., 2016; Hidalgo-Cantabrana et al., 2017) важнейшие функции во взаимодействии с организмом хозяина и представляют собой микроб-ассоциированные молекулярные паттерны MAMPs (microbe-associated molecular patterns), приводящие к активации специфических сигнальных путей PRRs (pattern recognition receptors). Среди компонентов бактериальных клеток, которые могут вызвать иммунную реакцию в организме хозяина, сегодня известны: пили (Turroni et al., 2013; Ottman et al., 2017), флагеллины (Eggestøl et al., 2020), белки Р75 и Р40 (Yan et al., 2007), иммуноглобулин-связывающие суперантигенные белки IbpA и IbpB (Arumugam et al., 2011), белки с пептидом STp с высоким содержанием серина и треонина (Bernardo et al., 2012; Al-Hassi et al., 2014), белки с пептидами FR-16 и LR-17 (Blanco-Míguez et al., 2017; Hidalgo-Cantabrana et al., 2017), экзополисахариды – цвиттерионные (Round et al., 2011), с β-глюканами (Kamiya et al., 2018), гетерополимерные и моносахаридные (Hidalgo-Cantabrana et al., 2014), секретируемые компоненты клеточной стенки (Górska et al., 2016), тейхоевые и липотейхоевые кислоты (Xie et al., 2012), короткоцепочечные жирные кислоты (Ríos-Covián et al., 2016), индол-3-альдегид, индол-3-пропионат, индол-3-уксусная кислота (Zelante et al., 2013; Venkatesh, Karunakaran, 2014), 3-индолакриловая кислота (Wlodarska et al., 2017), D-триптофан, кинуреновая кислота, ниацин, никотиновая кислота (Thorburn et al., 2014), глутамин, гистидин и производные глицина (Hirata, Kunisawa, 2017). Они являются медиаторами иммуномодуляции, оказываемой различными комменсальными видами, включая как классические пробиотические лактобациллы или бифидобактерии, так и другие виды бактерий (Delgado et al., 2020). Использование микробных биологически активных соединений вместо живых микроорганизмов может быть особенно важным при работе с уязвимыми иммунодефицитными популяциями и способно препятствовать распространению генов лекарственной устойчивости и патогенности (Salminen et al., 2021). В ЗАКЛЮЧЕНИИ данного обзора подробно изложены перспективы использования недавно открытого у B. longum GT15 белка FN3, селективно связывающегося с TNF-α.
Изучение МК человека является глобальным междисциплинарным направлением исследований в мировой науке. В последние годы стало очевидно, что микробиом здорового человека может служить источником получения фармабиотиков и фармакологически активных ингредиентов для профилактики и лечения заболеваний различной этиологии, в первую очередь характеризующихся нарушением функционирования иммунной системы и сопровождающихся локальными и генерализованными воспалительными процессами. Установлены белковые и пептидные внеклеточные компоненты лактобацилл и бифидобактерий, потенциально ответственные за иммуномодулирующий и антиоксидантный потенциалы. Вместе с пищей и водой в кишечник поступают различные патогены, включая вирусы животных и растений. Микробиом может нейтрализовать вирусы (CRISPR/Cas-системы), а может способствовать изменению их генетического кода (системы репарации/рекомбинации).
МИКРОБИОМ КИШЕЧНИКА: СУЩЕСТВУЮЩИЕ ТЕХНОЛОГИИ И АЛГОРИТМЫ ПОИСКА ГЕНОВ И ИХ ПРОДУКТОВ С ЗАДАННЫМИ СВОЙСТВАМИ
Метагеномные исследования, сигнатура и каталоги генов
Функциональный потенциал МК может быть описан через разнообразие и относительную представленность бактериальных генов. С развитием методов высокопроизводительного секвенирования стал возможен анализ совокупного генетического материала бактерий микробиоты – метагенома. Как результат, на настоящий момент наблюдается стремительный рост числа метагеномных исследований (Martin et al., 2018; Kovtun et al., 2018; Laudadio et al., 2019; Averina et al., 2020). Секвенирование полного метагенома позволяет искать определенные бактериальные гены для более глубокого понимания функционального потенциала микробиоты. Однако подобный анализ невозможен без хорошо составленных референсных каталогов генов и проведения функциональной аннотации метагенома. Для этого используют множество аннотированных последовательностей генов, например, базу данных RefSeq (O’Leary et al., 2016) и базы данных метаболических путей – KEGG (Kanehisa et al., 2016) или MetaCyc (Caspi, Moffitt, 2018). Также нужно учитывать гены, детерминирующие определенную функцию микробиоты. Для этого используются специализированные референсные каталоги, собранные вручную. Основой этого подхода является подробный анализ опубликованных данных с целью получения наиболее достоверного набора референсных бактериальных генов. Такие каталоги могут быть использованы для описания определенных функциональных свойств микробиоты, например ее нейромодулирующего, иммуномодулирующего, анти-оксидантного потенциалов и т.д. Первый каталог разработан (Kovtun et al., 2018) и использован для определения коровой метагеномной сигнатуры МК в норме. Метагеномная сигнатура – один из способов описания метагенома – это матрица, содержащая информацию не только о генах, но и о том, в каких бактериях они присутствуют. Второй каталог разработан (Valles-Colomer et al., 2019) и использован (Averina et al., 2020) для описания функциональных изменений в МК детей с расстройствами аутистического спектра. Его также эффективно использовали в работах по описанию изменений МК при депрессии (Valles-Colomer et al., 2019) и шизофрении (Zhu et al., 2020).
Большое бактериальное разнообразие МК наделяет ее обширной сетью метаболических путей и, как следствие, способностью продуцировать различные биологически активные соединения, что обеспечивает значимые функциональные характеристики микробиоты: нейромодулирующий, иммуномодулирующий и антиоксидантный потенциалы.
Подходы к функциональной аннотации микробиоты
В данный момент существует ряд различных подходов для функциональной аннотации метагенома, зависящих от типа данных метагеномного секвенирования. Первый подход основан на данных 16S рРНК и представляет собой косвенный анализ метаболических путей в метагеноме, исходящий из заранее определенного таксономического состава (Langille et al., 2013). Подобный метод не является точным, поскольку его эффективность сильно зависит, во-первых, от разрешающей способности таксономического анализа, которая для технологии секвенирования второго поколения сильно ограничена короткой длиной получаемых прочтений, во-вторых, от полноты референсной базы аннотированных бактериальных геномов. Поэтому для функционального анализа метагенома гораздо лучше использовать другой тип данных (и связанные с ним подходы) – полный метагеном, представляющий собой совокупность всего генетического материала, содержащегося в микробиоте.
Одним из главных шагов при функциональной аннотации микробиоты по полному метагеному является выравнивание данных на референсную базу генов. Выравнивать можно как просто прочтения, так и полученные из них более длинные последовательности – контиги. Для второго необходимо проводить сборку метагенома с использованием специализированных программ, например metaSPAdes (Nurk et al., 2017). Недостатком первого метода является сложность оценки покрытия гена в референсной базе данных, поскольку необходимо учитывать не только глубину, но и ширину и равномерность покрытия. Более длинные контиги гораздо удобнее выравнивать с известными последовательностями генов, однако сборка требует большой глубины секвенирования, а также она искажает информацию об относительной представленности гена – для ее восстановления потребуется дополнительный этап картирования чтений на контиги.
Подходы к аннотации метагеномных данных
Наиболее простой подход к аннотации метагеномных данных – использование как можно более обширной базы, например RefSeq (O’Leary et al., 2016). Данный метод обладает максимальной разрешающей способностью, однако может породить большое количество ложноположительных аннотаций, поскольку метаболические пути у бактерий разных таксономических групп могут сильно отличаться, как и функции отдельных ферментов. Например, показано (Maini Rekdal et al., 2019), что синтез дофамина у некоторых кишечных бактерий происходит благодаря тирозиндекарбоксилазе, а не с использованием дофадекарбоксилазы, как, например, у млекопитающих.
Второй подход подразумевает использование баз данных метаболических путей, например KEGG (Kanehisa et al., 2016) или MetaCyc (Caspi, Moffitt, 2018). Это курируемые базы данных, информация в которых постоянно обновляется, что обеспечивает ее актуальность. Данный подход оптимален в том случае, если стоит задача полной аннотации метагенома, то есть восстановления всех содержащихся в нем метаболических путей. Однако, если необходимо дать определенную функциональную характеристику исследуемой микробиоты, потребуется использование более узких таргетированных баз.
Основа третьего подхода – заранее составленный референсный каталог последовательностей генов, участвующих в определенных метаболических путях. Для этого необходимо проводить анализ литературных источников с целью создания как можно более полного и точного каталога. К таким источникам могут относиться как опубликованные статьи, так и различные курируемые базы данных: SwissProt (Poux et al., 2017), KEGG, MetaCyc и т.д. Использование таргетных каталогов позволяет описать определенный интересующий исследователя функциональный потенциал микробиоты. Так, на настоящий момент существует несколько референсных каталогов, позволяющих описать нейромодулирующий потенциал микробиоты (Kovtun et al., 2018; Valles-Colomer et al., 2019).
ДОСТИЖЕНИЯ УЧЕНЫХ РАЗНЫХ СТРАН В ОБЛАСТИ СОЗДАНИЯ ПРОБИОТИКОВ И ПЕРСПЕКТИВНОЙ РАЗРАБОТКИ ФАРМАБИОТИКОВ
Технологии и алгоритмы, разработанные в ИОГен РАН, для анализа микробиома и создания фармабиотиков
В течение последнего десятилетия в лаборатории генетики микроорганизмов ИОГен РАН разработаны биоинформатические алгоритмы анализа метамикробиома кишечника и сформирована концепция поиска в микробиоте редких штаммов бактерий с помощью комбинаций заданных генов. Созданы каталог ортологов бактериальных генов, продукты которых обладают иммуномодулирующей и антиоксидантной активностями, и алгоритм использования для биоинформатической идентификации в метагеномах кишечника штаммов коменсальных бактерий, содержащих комбинации заданных генов. Выявлена коровая метагеномная сигнатура МК здорового человека, отражающая нейромодулирующий, иммуномодулирующий и антиоксидантный потенциалы. Разработаны подходы для выделения и культивирования штаммов комменсальных анаэробных бактерий МК с потенциальными свойствами фармабиотиков. Создан биобанк образцов микробиоты и коллекция штаммов потенциальных фармабиотиков для последующего использования в научных и практических целях. Получены штаммы фармабиотиков и данные об их белках, пептидах и ферментах с иммуномодулирующими и антиоксидантными свойствами, отобранные с использованием подходов сравнительного геномного, транскриптомного и протеомного анализов. Проанализированы иммуномодулирующие и антиоксидантные свойства отобранных штаммов и их компонентов. Последние были проверены на адекватных системах клеточных культур и на лабораторных животных. Разработаны инновационные технологии создания фармакологически активных компонентов на основе микробиома здоровых людей. Отобраны кандидаты для иммуномодулирующих и антиоксидантных препаратов с противовоспалительной и иммуномодулирующей активностями, предназначенные для реабилитации пациентов, переболевших COVID-19. Проведены клинические исследования отобранных препаратов и организовано опытно-промышленное производство фармабиотиков. Проводятся доклинические исследования препаратов “Супербакт” и “Лактовирин” на основе фармабиотика Limosilactobacillus (Lactobacillus) fermentum U-21 для нейтрализации оксидативного стресса и его последствий при различных заболеваниях, включая COVID-19. Разрабатывается препарат, нейтрализующий TNF-α на основе FN3-белка бифидобактерий, содержащих фибронектиновые домены, для снятия воспалительных процессов различной направленности, в том числе воспалительных процессов, характерных для течения COVID-19.
Использование омиксных технологий в создании фармабиотиков на примере Limosilactobacillus fermentum U-21
В последние годы в мире происходят революционные изменения в области разработки и использования фармакологических препаратов на основе бактерий – представителей микробиоты человека и животных и их биологически активных компонентов. Такие препараты все чаще называются фармабиотиками в противовес пробиотикам, используемым в основном как биологические активные добавки и употребляемым здоровыми людьми. Для создания фармабиотиков, кроме традиционных микробиологических и биотехнологических подходов, используются омиксные технологии – комплекс геномных, транскриптомных и протеомных. В представленной работе данные технологии были использованы для характеристики отобранного ранее по ряду уникальных антиоксидантных свойств штамма L. fermentum U-21 (Marsova et al., 2018, 2020; Danilenko et al., 2020; Stavrovskaya et al., 2021). На моделях паракват-индуцируемого оксидативного стресса in vitro и in vivo (Escherichia coli, Caenorhabditis elegans, грызуны) живая культура L. fermentum U-21 проявила способность нейтрализовать действие супероксид аниона и предотвращала разрушение органов у исследуемых животных, включая черную субстанцию головного мозга. Геномный и сравнительный анализы L. fermentum U-21 позволили выявить 24 гена, продукты которых могут проявлять антиоксидантные свойства в том числе в отношении организма исследуемых животных. Наиболее значительными, на наш взгляд, могут быть гены тиоредоксинового комплекса и метаболизма, а также транспорта тяжелых металлов. В качестве индуктора оксидативного стресса использована перекись водорода – наиболее распространенный агент для исследования изменений транскрипционной активности у бактерий, в том числе у лактобактерий. Увеличение транскрипционной активности демонстрировали 380 генов, а для 370 генов отмечалось снижение транскрипционной активности более чем в два раза. Повышение транскрипционной активности в 14–24 раза показали гены предполагаемого оперона карбоксилазы мочевины. На наш взгляд, важными для последующих исследований являются изменения транскрипционной активности генов транспорта, в том числе ионов металлов Fe2+ и Cu2+, а также синтеза и катаболизма некоторых аминокислот. Протеомный анализ экзопротеома штамма L. fermentum U-21 и других штаммов этого вида позволил идентифицировать белок шаперонного комплекса ClpB, который может играть ключевую роль в рефолдинге неправильно собранных в результате оксидативного стресса белков в различных тканях и органах. Использование омиксных технологий для характеристики терапевтических свойств и механизма действия штамма L. fermentum U-21 – один из первых примеров в этом направлении. Полученные данные стали первым этапом для последующей выработки стратегии по созданию штаммов фармабиотиков. Включение в комплекс омиксных технологий метаболомного анализа штамма L. fermentum U-21 является насущным и необходимым (Полуэктова и др., 2022).
FN3 – цитокинсвязывающий белок бифидобактерий: перспективы для создания иммуномодулирующих препаратов
Бифидобактерии – анаэробные бактерии, существовавшие на планете Земля до появления на ней кислорода и после его появления, заселившие анаэробные полости практически всех представителей животного мира от насекомых до человека (Fischer et al., 2016; Ślesak et al., 2016). Предполагается, что бифидобактерии, представленные на сегодня 99 видами рода Bifidobacterium, участвовали в формировании иммунной системы своих хозяев. Хорошо известно, что виды Bifidobacterium longum и B. bifidum первыми после рождения заселяют кишечник человека и формируют иммунную систему ребенка. Интенсивно исследуется роль бифидобактерий и их компонентов (метаболитов) в коммуникации кишечник–мозг и кишечник–иммунная система. Относительно хорошо изучены метаболиты и компоненты клеток бифидобактерий, модулирующие с помощью тех или иных механизмов активность иммунной системы. Вместе с тем практически ничего не известно о сигнальных системах (белках, рецепторах и др.), способных воспринимать сигналы иммунной системы, в том числе осуществлять взаимодействия с цитокинами.
Ученые лаборатории генетики микроорганизмов ИОГен РАН открыли и исследовали видоспецифический оперон PFNA бифидобактерий (Nezametdinova et al., 2018, 2021; Dyakov et al., 2020), ответственный за такие взаимодействия. PFNA-оперон, присутствующий практически у всех видов бифидобактерий, содержит пять основных генов: pkb2, fn3, aaa-atp, duf58, tgm. Белки, кодируемые по крайне мере тремя из этих генов: PKB2 (серин-треониновая протеинкиназа), FN3 (белок, содержащий фиброниктиновые домены) и TGM (трансглютаминаза), обладают лиганд-связывающей способностью (Nezametdinova et al., 2021) (рис. 3).
Рис. 3.
Гипотетическое схематическое изображение роли оперона PFNA во взаимодействии бифидобактерий с иммунной системой хозяина. Активация сигнальной системы PKB2. Серин-треониновая протеинкиназа (PKB2), следующая его активация неизвестным лигандом, аутофосфорилатами и фосфорилированием других субстратов. Штамм B. longum GT15 увеличивает экспрессию цитокинов TNF-α, IL-8 и IL-10 в клетках человека (по: Nezametdinova et al., 2021).
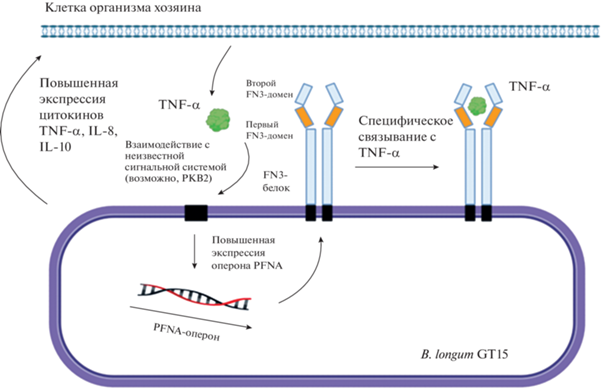
Кластер PFNA присутствует у всех видов бифидобактерий – обитателей кишечника человека. Важно отметить, что данный оперон является видоспецифическим и проявляет значительную дивергенцию белковых последовательностей, кодируемых генами кластера, между различными видами рода Bifidobacterium. Показано, что дивергенция является результатом позитивной селекции, по-видимому, со стороны иммунной системы организма хозяина. В то же время данный кластер консервативен для всех штаммов одного вида бифидобактерий. Роль оперона PFNA в формировании механизмов видоспецифического иммунного взаимодействия с организмом хозяина представляет большой интерес. В составе видоспецифического оперона PFNA был обнаружен ген fn3, кодирующий уникальный FN3-белок. Экспрессия данного гена, как и других генов оперона PFNA, увеличивается при росте штамма B. longum subsp. longum GT15 в присутствии TNF-α (Veselovsky et al., 2020). Белок FN3 встречается только у бифидобактерий, имеет сигнальный пептид, трансмембранный домен, два FN3-домена (Nezametdinova et al., 2014, 2018, 2021; Dyachkova et al., 2019). Предположительно, он может участвовать в адгезии бифидобактерий на клетках эпителия кишечника человека (Osswald et al., 2015). Однако наличие в составе данного белка двух FN3-доменов с мотивами цитокиновых рецепторов позволило предположить, что данный белок может быть рецептором для связывания цитокинов, продуцируемых организмом-хозяином. Показана способность фрагмента белка FN3 (ΔFN3.1) B. longum subsp. longum GT15 специфически связываться с цитокином человека TNF-α (Dyakov et al., 2020). Следует отметить, что виды бифидобактерий, обитающие в кишечнике человека и относящиеся к разным группам, имеют достаточно сильные отличия в последовательностях изучаемых мотивов (Nezametdinova et al., 2021). Можно предположить, что выявленные особенности структуры мотивов цитокиновых рецепторов связаны как с видоспецифической адаптацией бифидобактерий к своему хозяину, так и с межвидовой конкуренцией разных видов бифидобактерий в кишечнике организма-хозяина. Данный белок имеет огромный потенциал для создания противовоспалительных препаратов (Dyakov et al., 2020).
Подходы к разработке психобиотиков на примере штаммов лактобацилл и бифидобактерий, продуцирующих ГАМК
Психобиотиками называют штаммы живых микроорганизмов, способные оказывать положительное влияние на работу ЦНС и периферической нервной системы, что проявляется в улучшении состояния больных с психическими расстройствами (тревожность, депрессия и т.д.), когнитивных свойств и других аспектов работы нервной системы. Психобиотики оказывают свой эффект в организме через различные пути, одним из которых является синтез биологически активных соединений, в частности ГАМК. В связи с этим перспективным подходом к поиску штаммов бактерий для разработки психобиотиков является отбор штаммов, способных продуцировать ГАМК.
ГАМК – аминокислота, не входящая в состав белков, важнейший тормозной нейромедиатор ЦНС человека и млекопитающих. ГАМК синтезируется нейронами ЦНС, известными как ГАМКергические. ГАМК также синтезируется и утилизируется МК. Понижение уровня ГАМК в плазме крови и в ЦНС ассоциируется с депрессией (Kendell et al., 2005), расстройствами аутистического спектра (Gaetz et al., 2014) и другими заболеваниями. Учитывая значимую роль, которую играет ГАМК в различных психических расстройствах, ее синтез МК представляет большой интерес. Возможно, ГАМК, продуцируемая бактериями МК, влияет на работу головного мозга через блуждающий нерв. Подтверждением тому является определение роли блуждающего нерва в качестве посредника между МК и головным мозгом (Bravo et al., 2011).
Ранее нашей группой (Yunes et al., 2016), равно как в других лабораториях мира (Barrett et al., 2012), установлено, что ГАМК синтезируется in vitro из ее предшественника – глютаминовой кислоты – отдельными представителями видов лактобацилл и бифидобактерий. На основе отобранных штаммов, продуцирующих ГАМК, в частности L. plantarum 90sk и B. adolescentis 150, создан препарат-психобиотик, который впоследствии испытан на различных моделях животных и проявил психобиотические свойства.
Изучение пробиотического потенциала бактерий в Институте микробиологии НАН Беларуси
Сотрудниками Института микробиологии НАН Беларуси исследованы области генома бактерий B. longum BIM B-813D, ответственные за адгезию, колонизацию в ЖКТ человека, метаболизм сложных углеводов. В результате установлено наличие последовательности, кодирующей препилинпептидазу (H8S96_04985), предназначенную для синтеза и созревания пилей адгезии, и трех транспептидазных сортаз (класса Е и С), необходимых для полимеризации субъединиц пилина. Геном B. longum BIM B-813D содержит также последовательность, кодирующую серпин (H8S96_02745) – гомолог ингибитора сериновых протеаз, который эффективно блокирует работу панкреатической эластазы и эластазы нейтрофилов, что позволяет бифидобактериям обитать в определенных нишах кишечника. В геноме B. longum BIM B-813D выявлены гены, кодирующие факторы адгезии, которые позволяют бифидобактериям конкурировать с патогенами за сайты связывания на слизистой кишечника. В процессе эволюции микроорганизмами создано множество путей метаболизма углеводов, которые позволяют экономно использовать генетический потенциал клетки, вовлекая в работу необходимые гены в определенных условиях. Последовательность генома предоставляет информацию о предполагаемых углевод-модифицирующих ферментах, которые позволяют бифидобактериям адаптироваться к обитанию в ЖКТ макроорганизма. Разнообразие гликозидаз B. longum BIM B-813D, специализированных на метаболизме различных олигосахаридов, отражает эволюционную адаптацию данного вида к утилизации растительных поли- и олигосахаридов, что позволяет им доминировать в биотопе кишечника (Ушакова и др., 2012).
В результате молекулярно-генетического анализа бактерий Bacillus amyloliquefaciens BIM В-497 – основы пробиотической кормовой добавки “Споробакт” – аннотированы генетические локусы, кодирующие метаболиты бациллин, бацилломицин, диффицидин, фенгицин, макролактин, сурфактин, отвечающие за проявление антагонистической активности штамма. Определены ключевые факторы, стимулирующие продукцию указанных метаболитов, в частности установлено влияние термошока на интенсификацию синтеза активных липопептидов (сурфактина А) (Бережная и др., 2019).
С использованием T-RFLP-анализа показано, что добавка в корм жидких бактериальных культур B. amyloliquefaciens BIM В-497 и B. subtilis BIM В-713 оказывает влияние на метаболическую активность кишечной микробиоты крупного рогатого скота и приводит к направленной перестройке экосистемы рубца в сторону увеличения (на 35%) рубцовых бактерий и простейших.
ЗАКЛЮЧЕНИЕ
За последние 10 лет междисциплинарное исследование микробиоты (микробиом) человека и животных стало одним из мейнстримов в области современной биологии, химии, медицины и биоинформатики. Функциональная значимость мириадов бактерий, населяющих организм, для гармонии его микро- и макроэкологии стала очевидной и востребованной в практическом плане. Как исходно, так и сегодня, наибольший интерес вызывает микробиота (микробиом) кишечника человека. Впечатляет как количество населяющих кишечник родов бактерий (более 50), так и объем генетического материала, в сто раз превышающий размер собственного генома человека. Неудивительно, что нарушение композиции микробиома и, как следствие, генов и их комбинаций четко коррелирует с теми или иными заболеваниями: аутоиммунными, кардиологическими, онкологическими, нейродегенеративными, психическими и др. Уже на первом этапе изучения микробиом был признан особым нейроэндокринным органом, осуществляющим двунаправленное взаимодействие с головным мозгом. Установлено, что микробиом кишечника способен синтезировать все те же низкомолекулярные и пептидные вещества с нейромодулирующей активностью, что и нейроны энтеральной и центральной нервной системы. Показано, что дисбиоз (изменения микробиоты) является триггером воспалительных процессов, приводящих к нарушению гомеостаза и возникновению различных заболеваний. Как и для любого другого органа, возникла задача выявления и установления параметров, характеризующих его в норме. Первыми в мире такие характеристики начали определять ученые ИОГен РАН в 2014 г. В первую очередь это сигнатуры, характеризующие нейромодулирующий, иммуномодулирующий и антиоксидантный потенциалы микробиоты. Эти параметры послужили основой для целенаправленного создания на основе комменсальных бактерий микробиоты, в первую очередь так называемых пробиотических бактерий – лактобацилл и бифидобактерий, препаратов фармабиотиков. Это живые биологически активные бактерии или их компоненты и метаболиты с установленным механизмом действия и известными фармакологически активными ингредиентами, способные оказывать лечебный эффект как самостоятельно, так и в комплексе с известными препаратами.
В последние годы конкретизированы биологически активные ингредиенты микробиома человека и животных и компоненты персонализированных продуктов: пребиотики, парабиотики, постбиотики и автопробиотики; выявлены глобальные регуляторные гены, значимые регуляторные системы клеток организма человека, воспринимающие иммуномодулирующую, нейромодулирующую и антиоксидантную активности конкретных биологически активных ингредиентов; получены экспериментальные данные, показывающие значимую роль пробиотиков, постбиотиков и фармабиотиков на их основе в коррекции состава микробиома; разрабатываются препараты фармабиотиков с заданными характеристиками: психобиотики, иммунобиотики, антиоксибиотики. Глобальные успехи в области изучения микробиома человека и животных и переход от классических пробиотиков – БАДов – к фармабиотикам – полноценным безопасным лекарственным препаратам с известным механизмом действия – открывают новые горизонты в персонализированной медицине.
Последствия пандемии COVID-19, известные как постковидный синдром, включают в себя ряд заболеваний различной этиологии (кардиологические, неврологические и иммунологические) и сопровождаются дисбиозом микробиома и системными воспалительными процессами. Постковидный синдром актуализировал и стимулировал исследования, в том числе и в России, в области как поиска бактерий с антиоксидантными, противовоспалительными, иммуномодулирующими и антибактериальными свойствами, так и дальнейшего их использования для создания фармабиотиков и постбиотиков (Averina et al., 2021; Danilenko et al., 2021; Poluektova et al., 2021). Для работы в этом направлении в России по инициативе ИОГен РАН создан междисциплинарный консорциум “Нутригеномика микробиома”. Нутригеномика – это наука, изучающая влияние питания и в том числе биологически активных пищевых добавок на экспрессию генов человека и на его здоровье (Marcum, 2020). Интенсивное изучение микробиома человека и животных сегодня позволяет сформировать понятие “нутригеномика микробиома” и продолжить исследования в рамках проекта “Фармакобионутриенты”.
Список литературы
Бережная А.В., Евдокимова О.В., Валентович Л.Н. и др. Молекулярно-генетический и функциональный анализ генома бактерий Bacillus velezensis БИМ В-439Д // Прикл. биохим. микробиол. 2019. Т. 55. № 4. С. 366–377. https://doi.org/10.1134/S0555109919040032
Полуэктова Е.У., Мавлетова Д.А., Одорская М.В. и др. Сравнительный геномный, транскриптомный и протеомный анализ штамма Limosilactobacillus fermentum U-21, перспективного для создания фармабиотика // Генетика. 2022. V. 9 (в печати).
Ушакова Н.А., Некрасов Р.В., Правдин В.Г. и др. Новое поколение пробиотических препаратов кормового назначения // Фунд. исслед. 2012. Т. 1. С. 184–192.
Agirman G., Hsiao E.Y. SnapShot: the microbiota–gut–brain axis // Cell. 2021. V. 184. № 9. P. 2524–2524.e1. https://doi.org/10.1016/j.cell.2021.03.022
Akour A. Probiotics and COVID-19: is there any link? // Lett. Appl. Microbiol. 2020. V. 71. № 3. P. 229–234. https://doi.org/10.1111/lam.13334
Al-Hassi H.O., Mann E.R., Sanchez B. et al. Altered human gut dendritic cell properties in ulcerative colitis are reversed by Lactobacillus plantarum extracellular encrypted peptide STp // Mol. Nutr. Food Res. 2014. V. 58. № 5. P. 1132–1143. https://doi.org/10.1002/mnfr.201300596
Amaretti A., Di Nunzio M., Pompei A. et al. Antioxidant properties of potentially probiotic bacteria: in vitro and in vivo activities // Appl. Microbiol. Biotechnol. 2013. V. 97. № 2. P. 809–817. https://doi.org/10.1007/s00253-012-4241-7
Arumugam M., Raes J., Pelletier E. et al. Enterotypes of the human gut microbiome // Nature. 2011. V. 473. № 7346. P. 174–180. https://doi.org/10.1038/nature09944
Averina O.V., Danilenko V.N. Human intestinal microbiota: role in development and functioning of the nervous system // Mikrobiologiia. 2017. V. 86. № 1. P. 5–24. https://doi.org/10.7868/S0026365617010050
Averina O.V., Kovtun A.S., Polyakova S.I. et al. The bacterial neurometabolic signature of the gut microbiota of young children with autism spectrum disorders // J. Med. Microbiol. 2020. V. 69. № 4. P. 558–571. https://doi.org/10.1099/jmm.0.001178
Averina O.V., Poluektova E.U., Marsova M.V., Danilenko V.N. Biomarkers and utility of the antioxidant potential of probiotic Lactobacilli and Bifidobacteria as representatives of the human gut microbiota // Biomedicines. 2021. V. 9. № 10. P. 1340. https://doi.org/10.3390/biomedicines9101340
Azcárate-Peril M.A., Sikes M., Bruno-Bárcena J.M. The intestinal microbiota, gastrointestinal environment and colorectal cancer: a putative role for probiotics in prevention of colorectal cancer? // Am. J. Physiol. Gastrointest. Liver Physiol. 2011. V. 301. № 3. P. G401–424. https://doi.org/10.1152/ajpgi.00110.2011
Barrett E., Ross R.P., O’Toole P.W. et al. γ-Aminobutyric acid production by culturable bacteria from the human intestine // J. Appl. Microbiol. 2012. V. 113. № 2. P. 411–417. https://doi.org/10.1111/j.1365-2672.2012.05344.x
Belkaid Y., Harrison O.J. Homeostatic immunity and the microbiota // Immunity. 2017. V. 46. № 4. P. 562–576. https://doi.org/10.1016/j.immuni.2017.04.008
Belkina T.V., Averina O.V., Savenkova E.V., Danilenko V.N. Human intestinal microbiome and the immune system: the role of probiotics in shaping an immune system unsusceptible to COVID-19 infection // Biol. Bull. Rev. 2021. V. 11. № 4. P. 329–343. https://doi.org/10.1134/S2079086421040034
Bercik P., Verdu E.F., Foster J.A. et al. Chronic gastrointestinal inflammation induces anxiety-like behavior and alters central nervous system biochemistry in mice // Gastroenterology. 2010. V. 139. № 6. P. 2102–2112.e1.
https://doi.org/10.1053/j.gastro.2010.06.063
Bernardo D., Sánchez B., Al-Hassi H.O. et al. Microbiota/host crosstalk biomarkers: regulatory response of human intestinal dendritic cells exposed to Lactobacillus extracellular encrypted peptide // PLoS One. 2012. V. 7. № 5. P. e36262. https://doi.org/10.1371/journal.pone.0036262
Blanco-Míguez A., Gutiérrez-Jácome A., Fdez-Riverola F. et al. MAHMI database: a comprehensive MetaHit-based resource for the study of the mechanism of action of the human microbiota // Database (Oxford). 2017. V. 2017. P. baw157.
https://doi.org/10.1093/database/baw157
Blumberg R., Powrie F. Microbiota, disease, and back to health: a metastable journey // Sci. Transl. Med. 2012. V. 4. № 137. P. 137rv7. https://doi.org/10.1126/scitranslmed.3004184
Bozkurt H.S., Quigley E.M. The probiotic Bifidobacterium in the management of coronavirus: a theoretical basis // Int. J. Immunopathol. Pharmacol. 2020. V. 34. P. 2058738420961304. https://doi.org/10.1177/2058738420961304
Bravo J.A., Forsythe P., Chew M.V. et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve // PNAS USA. 2011. V. 108. № 38. P. 16050–16055.https://doi.org/10.1073/pnas.1102999108
Caspi A., Moffitt T.E. All for one and one for all: mental disorders in one dimension // Am. J. Psych. 2018. V. 175. № 9. P. 831–844. https://doi.org/10.1176/appi.ajp.2018.17121383
Chen L.L., Abbaspour A., Mkoma G.F. et al. Gut microbiota in psychiatric disorders: a systematic review // Psychosom. Med. 2021. V. 83. № 7. P. 679–692. https://doi.org/10.1097/PSY.0000000000000959
Cianci R., Pagliari D., Piccirillo C.A. et al. The microbiota and immune system crosstalk in health and disease // Mediators inflamm. 2018. V. 2018. P. 2912539. https://doi.org/10.1155/2018/2912539
Cryan J.F., O’Riordan K.J., Cowan C.S. et al. The microbiota–gut–brain axis // Physiol. Rev. 2019. V. 99 (4). P. 1877–2013. https://doi.org/10.1152/physrev.00018.2018
Danilenko V.N., Stavrovskaya A.V., Voronkov D.N. et al. The use of a pharmabiotic based on the Lactobacillus fermentum U-21 strain to modulate the neurodegenerative process in an experimental model of Parkinson disease // Ann. Clin. Exp. Neurol. 2020. V. 14. № 1. P. 62–69.
Danilenko V.N., Devyatkin A.V., Marsova M.V. et al. Common inflammatory mechanisms in COVID-19 and Parkinson’s diseases: the role of microbiome, pharmabiotics and postbiotics in their prevention // J. Inflam. Res. 2021. V. 14. P. 6349–6381. https://doi.org/10.2147/JIR.S333887
Dekaboruah E., Suryavanshi M.V., Chettri D., Verma A.K. Human microbiome: an academic update on human body site specific surveillance and its possible role // Arch. Microbiol. 2020. V. 202. № 8. P. 2147–2167. https://doi.org/10.1007/s00203-020-01931-x
Delgado B., Bach A., Guasch I. et al. Whole rumen metagenome sequencing allows classifying and predicting feed efficiency and intake levels in cattle // Sci. Rep. 2020. V. 10. № 1. P. 2875. https://doi.org/10.1038/S41598-020-60003-8
Desbonnet L., Garrett L., Clarke G. et al. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression // Neuroscience. 2010. V. 170. № 4. P. 1179–1188. https://doi.org/10.1016/j.neuroscience.2010.08.005
Dong L., Xie J., Wang Y., Zuo D. Gut microbiota and immune responses // Adv. Exp. Med. Biol. 2020. V. 1238. P. 165–193. https://doi.org/10. 1007/978-981-15-2385-4_10
Dyachkova M.S., Chekalin E.V., Danilenko V.N. Positive selection in Bifidobacterium genes drives species-specific host–bacteria communication // Front. Microbiol. 2019. V. 10. P. 2374. https://doi.org/10.3389/fmicb.2019.02374
Dyakov I.N., Mavletova D.A., Chernyshova I.N. et al. FN3 protein fragment containing two type III fibronectin domains from B. longum GT15 binds to human tumor necrosis factor alpha in vitro // Anaerobe. 2020. V. 65. P. 102247. https://doi.org/10.1016/j.anaerobe.2020.102247
Eggestøl H.Ø., Lunde H.S., Haugland G.T. The proinflammatory cytokines TNF-alpha and IL-6 in lumpfish (Cyclopterus lumpus L.) – identification, molecular characterization, phylogeny and gene expression analyses // Dev. Comp. Immunol. 2020. V. 105. P. 103608. https://doi.org/10.1016/j.dci.2020.103608
Evans J.M., Morris L.S., Marchesi J.R. The gut microbiome: the role of a virtual organ in the endocrinology of the host // J. Endocrinol. 2013. V. 218. № 3. P. R37–47. https://doi.org/10.1530/JOE-13-0131
Firuzi O., Miri R., Tavakkoli M., Saso L. Antioxidant therapy: current status and future prospects // Curr. Med. Chem. 2011. V. 18. № 25. P. 3871–3888. https://doi.org/10.2174/092986711803414368
Fischer W.W., Hemp J., Valentine J.S. How did life survive Earth’s great oxygenation? // Curr. Opin. Chem. Biol. 2016. V. 31. P. 166–178. https://doi.org/10.1016/j.cbpa.2016.03.013
Gaetz W., Bloy L., Wang D.J. et al. GABA estimation in the brains of children on the autism spectrum: measurement precision and regional cortical variation // Neuroimage. 2014. V. 86. P. 1–9. https://doi.org/10.1016/j.neuroimage.2013.05.068
Gómez-Llorente C., Muñoz S., Gil A. Role of Toll-like receptors in the development of immunotolerance mediated by probiotics // Proc. Nutr. Soc. 2010. V. 69. № 3. P. 381–389. https://doi.org/10.1017/S0029665110001527
Górska S., Dylus E., Rudawska A. et al. Immunoreactive proteins of Bifidobacterium longum ssp. longum CCM 7952 and Bifidobacterium longum ssp. longum CCDM 372 identified by gnotobiotic mono-colonized mice sera, immune rabbit sera and non-immune human sera // Front. Microbiol. 2016. V. 7. P. 1537. https://doi.org/10.3389/Fmicb.2016.01537
Hidalgo-Cantabrana C., Sánchez B., Milani C. et al. Genomic overview and biological functions of exopolysaccharide biosynthesis in Bifidobacterium spp. // Appl. Environ. Microbiol. 2014. V. 80. № 1. P. 9–18. https://doi.org/10.1128/Aem.02977-13
Hidalgo-Cantabrana C., Delgado S., Ruiz L. et al. Bifidobacteria and their health-promoting effects // Microbiol. Spectr. 2017. V. 5. № 3. P. 1.https://doi.org/10.1128/microbiolspec.BAD-0010-2016
Hirata S.-I., Kunisawa J. Gut microbiome, metabolome, and allergic diseases // Allergol. Int. 2017. V. 66. № 4. P. 523–528. https://doi.org/10.1016/j.alit.2017.06.008
Hooper D.U., Adair E.C., Cardinale B.J. et al. A global synthesis reveals biodiversity loss as a major driver of ecosystem change // Nature. 2012. V. 486. № 7401. P. 105–108. https://doi.org/10.1038/nature11118
Hotel A.C.P., Cordoba A. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria // Prevention. 2001. V. 5. № 1. P. 1–10.
Jabczyk M., Nowak J., Hudzik B., Zubelewicz-Szkodzińska B. Diet, probiotics and their impact on the gut microbiota during the COVID-19 pandemic // Nutrients. 2021. V. 13. № 9. P. 3172. https://doi.org/10.3390/Nu13093172
Kamiya T., Watanabe M., Hara H. et al. Induction of human-lung-cancer-A549-cell apoptosis by 4-hydroperoxy-2-decenoic acid ethyl ester through intracellular ROS accumulation and the induction of proapoptotic CHOP expression // J. Agric. Food Chem. 2018. V. 66. № 41. P. 10741–10747. https://doi.org/10.1021/acs.jafc.8b04424
Kanehisa M., Sato Y., Kawashima M. et al. KEGG as a reference resource for gene and protein annotation // Nucl. Acids Res. 2016. V. 44. № D1. P. D457–D462. https://doi.org/10.1093/nar/gkv1070
Kendell S.F., Krystal J.H., Sanacora G. GABA and glutamate systems as therapeutic targets in depression and mood disorders // Expert Opin. Ther. Targets. 2005. V. 9. № 1. P. 153–168. https://doi.org/10.1517/14728222.9.1.153
Kovtun A.S., Averina O.V., Zakharevich N.V. et al. In silico identification of metagenomic signature describing neurometabolic potential of normal human gut microbiota // Rus. J. Genet. 2018. V. 54. № 9. P. 1101–1110. https://doi.org/10.1134/S1022795418090089
Langille M.G., Zaneveld J., Caporaso J.G. et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences // Nat. Biotechnol. 2013. V. 31. № 9. P. 814–821. https://doi.org/10.1038/nbt.2676
Laudadio I., Fulci V., Stronati L., Carissimi C. Next-generation metagenomics: methodological challenges and opportunities // OMICS. 2019. V. 23. № 7. P. 327–333. https://doi.org/10.1089/omi.2019.0073
Levy M., Kolodziejczyk A.A., Thaiss C.A., Elinav E. Dysbiosis and the immune system // Nat. Rev. Immunol. 2017. V. 17. № 4. P. 219–232. https://doi.org/10.1038/nri.2017.7
Liang S., Wang T., Hu X. et al. Administration of Lactobacillus helveticus NS8 improves behavioral, cognitive, and biochemical aberrations caused by chronic restraint stress // Neuroscience. 2015. V. 310. P. 561–577. https://doi.org/10.1016/j.neuroscience.2015.09.033
Lim H.J., Shin H.S. Antimicrobial and immunomodulatory effects of Bifidobacterium strains: a review // J. Microbiol. Biotechnol. 2020. V. 30. № 12. P. 1793–1800. https://doi.org/10.4014/jmb.2007.07046
Liu W.H., Yang C.H., Lin C.T. et al. Genome architecture of Lactobacillus plantarum PS128, a probiotic strain with potential immunomodulatory activity // Gut Pathog. 2015. V. 7. P. 22. https://doi.org/10.1186/s13099-015-0068-y
Liu Y.W., Liu W.H., Wu C.C. et al. Psychotropic effects of Lactobacillus plantarum PS128 in early life-stressed and naïve adult mice // Brain Res. 2016. V. 1631. P. 1–12. https://doi.org/10.1016/j.brainres.2015.11.018
Liu C., Du M.X., Abuduaini R. et al. Enlightening the taxonomy darkness of human gut microbiomes with a cultured biobank // Microbiome. 2021. V. 9. № 1. P. 119. https://doi.org/10.1186/s40168-021-01064-3
Lu Z., Liu Y., Xu J. et al. Immunohistochemical quantification of expression of a tight junction protein, claudin-7, in human lung cancer samples using digital image analysis method // Comp. Meth. Progr. Biomed. 2018. V. 155. P. 179–187. https://doi.org/10.1016/j.cmpb.2017.12.014
Lyte M. Microbial endocrinology and the microbiota–gut–brain axis // Adv. Exp. Med. Biol. 2014. V. 817. P. 3–24. https://doi.org/10.1007/978-1-4939-0897-4_1
Mackowiak P.A. Recycling Metchnikoff: probiotics, the intestinal microbiome and the quest for long life // Front. Publ. Health. 2013. V. 1. P. 52. https://doi.org/10.3389/fpubh.2013.00052
Maini Rekdal V., Bess E.N., Bisanz J.E. et al. Discovery and inhibition of an interspecies gut bacterial pathway for levodopa metabolism // Science. 2019. V. 364. № 6445. P. eaau6323. https://doi.org/10.1126/science.aau6323
Marcum J.A. Nutrigenetics/nutrigenomics, personalized nutrition, and precision healthcare // Curr. Nutr. Rep. 2020. V. 9. № 4. P. 338–345. https://doi.org/10.1007/s13668-020-00327-z
Margolis K.G., Cryan J.F., Mayer E.A. The microbiota–gut–brain axis: from motility to mood // Gastroenterology. 2021. V. 160. № 5. P. 1486–1501. https://doi.org/10.1053/j.gastro.2020.10.066
Marsova M., Abilev S., Poluektova E., Danilenko V. A bioluminescent test system reveals valuable antioxidant properties of Lactobacillus strains from human microbiota // World J. Microbiol. Biotechnol. 2018. V. 34. № 2. P. 27. https://doi.org/10.1007/s11274-018-2410-2
Marsova M., Poluektova E., Odorskaya M. et al. Protective effects of Lactobacillus fermentum U-21 against paraquat-induced oxidative stress in Caenorhabditis elegans and mouse models // World J. Microbiol. Biotechnol. 2020. V. 36. № 7. P. 104. https://doi.org/10.1007/s11274-020-02879-2
Martin T.C., Visconti A., Spector T.D., Falchi M. Conducting metagenomic studies in microbiology and clinical research // Appl. Microbiol. Biotechnol. 2018. V. 102. № 20. P. 8629–8646. https://doi.org/10.1007/s00253-018-9209-9
Messaoudi M., Lalonde R., Violle N. et al. Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects // Br. J. Nutr. 2011. V. 105. № 5. P. 755–764. https://doi.org/10.1017/S0007114510004319
Migeotte I., Communi D., Parmentier M. Formyl peptide receptors: a promiscuous subfamily of G protein-coupled receptors controlling immune responses // Cyt. Growth Factor Rev. 2006. V. 17. № 6. P. 501–519. https://doi.org/10.1016/j.cytogfr.2006.09.009
Mishra V., Shah C., Mokashe N. et al. Probiotics as potential antioxidants: a systematic review // J. Agric. Food Chem. 2015. V. 63. № 14. P. 3615–3626. https://doi.org/10.1021/jf506326t
Muñoz-Quezada S., Chenoll E., Vieites J.M. et al. Isolation, identification and characterisation of three novel probiotic strains (Lactobacillus paracasei CNCM I-4034, Bifidobacterium breve CNCM I-4035 and Lactobacillus rhamnosus CNCM I-4036) from the faeces of exclusively breast-fed infants // Br. J. Nutr. 2013. V. 109. Suppl. 2. P. S51–62. https://doi.org/10.1017/S0007114512005211
Nadeem I., Rahman M.Z., Ad-Dab’bagh Y., Akhtar M. Effect of probiotic interventions on depressive symptoms: a narrative review evaluating systematic reviews // Psych. Clin. Neurosci. 2019. V. 73. № 4. P. 154–162. https://doi.org/10.1111/pcn.12804
Nezametdinova V.Z., Zakharevich N.V., Alekseeva M.G. et al. Identification and characterization of the serine/threonine protein kinases in Bifidobacterium // Arch. Microbiol. 2014. V. 196. № 2. P. 125–136. https://doi.org/10.1007/s00203-013-0949-8
Nezametdinova V.Z., Mavletova D.A., Alekseeva M.G. et al. Species-specific serine-threonine protein kinase Pkb2 of Bifidobacterium longum subsp. longum: genetic environment and substrate specificity // Anaerobe. 2018. V. 51. P. 26–35. https://doi.org/10.1016/j.anaerobe.2018.03.003
Nezametdinova V.Z., Yunes R.A., Dukhinova M.S. et al. The role of the PFNA operon of Bifidobacteria in the recognition of host’s immune signals: prospects for the use of the FN3 protein in the treatment of COVID-19 // Int. J. Mol. Sci. 2021. V. 22. № 17. P. 9219. https://doi.org/10.3390/ijms22179219
Nikolova V.L., Hall M.R., Hall L.J. et al. Perturbations in gut microbiota composition in psychiatric disorders: a review and meta-analysis // JAMA Psychiatry. 2021. V. 78. № 12. P. 1343–1354. https://doi.org/10.1001/jamapsychiatry.2021.2573
Novik G., Savich V. Beneficial microbiota. Probiotics and pharmaceutical products in functional nutrition and medicine // Microb. Infect. 2020. V. 22. № 1. P. 8–18. https://doi.org/10.1016/j.micinf.2019.06.004
Nowak A., Paliwoda A., Błasiak J. Anti-proliferative, pro-apoptotic and anti-oxidative activity of Lactobacillus and Bifidobacterium strains: a review of mechanisms and therapeutic perspectives // Crit. Rev. Food Sci. Nutr. 2019. V. 59. № 21. P. 3456–3467. https://doi.org/10.1080/10408398.2018.1494539
Nurk S., Meleshko D., Korobeynikov A., Pevzner P.A. metaSPAdes: a new versatile metagenomic assembler // Genome Res. 2017. V. 27. № 5. P. 824–834. https://doi.org/10.1101/gr.213959.116
O’Leary N.A., Wright M.W., Brister J.R. et al. Reference sequence (RefSeq) database at NCBI: current status, taxonomic expansion, and functional annotation // Nucl. Acids Res. 2016. V. 44. № D1. P. D733-D745. https://doi.org/10.1093/nar/gkv1189.
Osswald A., Westermann C., Sun Z., Riedel C.U. A phytase-based reporter system for identification of functional secretion signals in Bifidobacteria // PLoS One. 2015. V. 10. № 6. P. e0128802. https://doi.org/10.1371/journal.pone.0128802
O’Toole P.W., Marchesi J.R., Hill C. Next-generation probiotics: the spectrum from probiotics to live biotherapeutics // Nat. Microbiol. 2017. V. 2. P. 17057. https://doi.org/10.1038/nmicrobiol.2017.57
Ottman N., Geerlings S.Y., Aalvink S. et al. Action and function of Akkermansia muciniphila in microbiome ecology, health and disease // Best Pract. Res. Clin. Gastroenterol. 2017. V. 31. № 6. P. 637–642. https://doi.org/10.1016/j.bpg.2017.10.001
Patten D.A., Laws A.P. Lactobacillus-produced exopolysaccharides and their potential health benefits: a review // Benef. Microb. 2015. V. 6. № 4. P. 457–471. https://doi.org/10.3920/BM2014.0117
Patterson E., Cryan J.F., Fitzgerald G.F. et al. Gut microbiota, the pharmabiotics they produce and host health // Proc. Nutr. Soc. 2014. V. 73. № 4. P. 477–489. https://doi.org/10.1017/S0029665114001426
Peri F., Calabrese V., Piazza M. et al. Synthetic molecules and functionalized nanoparticles targeting the LPS–TLR4 signaling: a new generation of immunotherapeutics // Pure Appl. Chem. 2012. V. 84. № 1. P. 97–106. https://doi.org/10.1351/PAC-CON-11-10-35
Poluektova E., Yunes R., Danilenko V. The putative antidepressant mechanisms of probiotic bacteria: relevant genes and proteins // Nutrients. 2021. V. 13. № 5. P. 1591.
Poux S., Arighi C.N., Magrane M. et al. On expert curation and scalability: UniProtKB/Swiss-Prot as a case study // Bioinformatics. 2017. V. 33. № 21. P. 3454–3460.https://doi.org/10.1093/bioinformatics/btx439
Ríos-Covián D., Ruas-Madiedo P., Margolles A. et al. Intestinal short chain fatty acids and their link with diet and human health // Front. Microbiol. 2016. V. 7. P. 185. https://doi.org/10.3389/Fmicb.2016.00185
Rocha-Ramírez L.M., Hernández-Chiñas U., Moreno-Guerrero S.S. et al. Probiotic properties and immunomodulatory activity of Lactobacillus strains isolated from dairy products // Microorganisms. 2021. V. 9. № 4. P. 825. https://doi.org/10.3390/microorganisms9040825
Round J.L., Lee S.M., Li J. et al. The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota // Science. 2011. V. 332. № 6032. P. 974–977. https://doi.org/10.1126/science.1206095
Ruiz L., Hidalgo C., Blanco-Míguez A. et al. Tackling probiotic and gut microbiota functionality through proteomics // J. Proteomics. 2016. V. 147. P. 28–39. https://doi.org/10.1016/j.jprot.2016.03.023
Salminen S., Collado M.C., Endo A. et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics // Nat. Rev. Gastroenterol. Hepatol. 2021. V. 18. № 9. P. 649–667. https://doi.org/10.1038/s41575-021-00440-6
Savignac H.M., Kiely B., Dinan T.G., Cryan J.F. Bifidobacteria exert strain-specific effects on stress-related behavior and physiology in BALB/c mice // Neurogastroenterol. Motil. 2014. V. 26. № 11. P. 1615–1627. https://doi.org/10.1111/nmo.12427
Schappe M.S., Szteyn K., Stremska M.E. et al. Chanzyme TRPM7 mediates the Ca2+ influx essential for lipopolysaccharide-induced Toll-like receptor 4 endocytosis and macrophage activation // Immunity. 2018. V. 48. № 1. P. 59–74.e5. https://doi.org/10.1016/j.immuni.2017.11.026
Shanahan F., Collins S.M. Pharmabiotic manipulation of the microbiota in gastrointestinal disorders, from rationale to reality // Gastroenterol. Clin. North Am. 2010. V. 39. № 3. P. 721–726. https://doi.org/10.1016/j.gtc.2010.08.006
Shimizu K., Ojima M., Ogura H. Gut microbiota and probiotics/synbiotics for modulation of immunity in critically ill patients // Nutrients. 2021. V. 13. № 7. P. 2439. https://doi.org/10.3390/Nu13072439
Singh K., Rao A. Probiotics: a potential immunomodulator in COVID-19 infection management // Nutr. Res. 2021. V. 87. P. 1–12. https://doi.org/10.1016/j.nutres.2020.12.014
Sleator R.D., Hill C. Engineered pharmabiotics with improved therapeutic potential // Hum. Vaccin. 2008. V. 4. № 4. P. 271–274. https://doi.org/10.4161/hv.4.4.6315
Sleator R.D., Hill C. Rational design of improved pharmabiotics // J. Biomed. Biotechnol. 2009. V. 2009. P. 275287. https://doi.org/10.1155/2009/275287
Ślesak I., Ślesak H., Zimak-Piekarczyk P., Rozpądek P. Enzymatic antioxidant systems in early anaerobes: theoretical considerations // Astrobiology. 2016. V. 16. № 5. P. 348–358. https://doi.org/10.1089/ast.2015.1328
Stavropoulou E., Bezirtzoglou E. Probiotics in medicine: a long debate // Front. Immunol. 2020. V. 11. P. 2192. https://doi.org/10.3389/fimmu.2020.02192
Stavrovskaya A.V., Voronkov D.N., Gushchina A.S. et al. Pharmabiotic based on Lactobacillus fermentum strain U-21 modulates the toxic effect of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine as Parkinsonism inducer in mice // Hum. Physio. 2021. V. 47. № 8. P. 891–900. https://doi.org/10.1134/S0362119721080120
Thorburn A.N., Macia L., Mackay C.R. Diet, metabolites, and “western-lifestyle” inflammatory diseases // Immunity. 2014. V. 40. № 6. P. 833–842. https://doi.org/10.1016/j.immuni.2014.05.014
Tiso M., Schechter A.N. Nitrate reduction to nitrite, nitric oxide and ammonia by gut bacteria under physiological conditions // PloS One. 2015. V. 10. № 3. P. e0119712. https://doi.org/10.1371/journal.pone.0119712
Turroni F., Serafini F., Foroni E. et al. Role of sortase-dependent pili of Bifidobacterium bifidum PRL2010 in modulating bacterium-host interactions // PNAS USA. 2013. V. 110. № 27. P. 11151–11156. https://doi.org/10.1073/pnas.1303897110
Valles-Colomer M., Falony G., Darzi Y. et al. The neuroactive potential of the human gut microbiota in quality of life and depression // Nat. Microbiol. 2019. V. 4. № 4. P. 623–632. https://doi.org/10.1038/s41564-018-0337-x
Varsha K.K., Maheshwari A.P., Nampoothiri K.M. Accomplishment of probiotics in human health pertaining to immunoregulation and disease control // Clin. Nutr. ESPEN. 2021. V. 44. P. 26–7. https://doi.org/10.1016/j.clnesp.2021.06.020
Venkatesh R., Karunakaran K. Oxidation of aromatic anils by sodium perborate in aqueous acetic acid medium // As. J. Chem. 2014. V. 26. № 3. P. 739–744. https://doi.org/10.14233/ajchem.2014.15506
Veselovsky V.A., Dyachkova M.S., Menyaylo E.A. et al. Gene networks underlying the resistance of Bifidobacterium longum to inflammatory factors // Front. Immunol. 2020. V. 11. P. 595877. https://doi.org/10.3389/fimmu.2020.595877
Vijay A., Valdes A.M. Role of the gut microbiome in chronic diseases: a narrative review // Eur. J. Clin. Nutr. 2021. V. 76. P. 489–501. https://doi.org/10.1038/s41430-021-00991-6
Wang B., Yao M., Lv L. et al. The human microbiota in health and disease // Engineering. 2017. V. 3. № 1. P. 71–82. https://doi.org/10.1016/J.ENG.2017.01.008
Wang N., Song G., Yang Y. et al. Inactivated Lactobacillus promotes protection against myocardial ischemia–reperfusion injury through NF-κB pathway // Biosci. Rep. 2017. V. 37. № 6. P. BSR20171025. https://doi.org/10.1042/bsr20171025
Wlodarska M., Luo C., Kolde R. et al. Indoleacrylic acid produced by commensal peptostreptococcus species suppresses inflammation // Cell Host Microbe. 2017. V. 22. № 1. P. 25–7.e6. https://doi.org/10.1016/j.chom.2017.06.007
Xie L., Zhang L., Zhong Y. et al. Profiling the metatranscriptome of the protistan community in Coptotermes formosanus with emphasis on the lignocellulolytic system // Genomics. 2012. V. 99. № 4. P. 246–255. https://doi.org/10.1016/j.ygeno.2012.01.009
Yan J., Yoon H., Kumar S. et al. Enhanced cellular immune responses elicited by an engineered HIV-1 subtype B consensus-based envelope DNA vaccine // Mol. Ther. 2007. V. 15. № 2. P. 411–421. https://doi.org/10.1038/sj.mt.6300036
Yunes R.A., Poluektova E.U., Dyachkova M.S. et al. GABA production and structure of gadB/gadC genes in Lactobacillus and Bifidobacterium strains from human microbiota // Anaerobe. 2016. V. 42. P. 197–204. https://doi.org/10.1016/j.anaerobe.2016.10.011
Yunes R.A., Poluektova E.U., Vasileva E.V. et al. A multi-strain potential probiotic formulation of GABA-producing Lactobacillus plantarum 90sk and Bifidobacterium adolescentis 150 with antidepressant effects // Prob. Antimicrob. Prot. 2020. V. 12. № 3. P. 973–979. https://doi.org/10.1007/s12602-019-09601-1
Zelante T., Iannitti R.G., Cunha C. et al. Tryptophan cata-bolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22 // Immunity. 2013. V. 39. № 2. P. 372–385. https://doi.org/10.1016/j.immuni.2013.08.003
Zhu F., Ju Y., Wang W. et al. Metagenome-wide association of gut microbiome features for schizophrenia // Nat. Comm. 2020. V. 11. № 1. P. 1612. https://doi.org/10.1038/s41467-020-15457-9
Zorov D.B., Plotnikov E.Y., Silachev D.N. et al. Microbiota and mitobiota. Putting an equal sign between mitochondria and bacteria // Biochemistry (Mosc.). 2014. V. 79. № 10. P. 1017–1031. https://doi.org/10.1134/S0006297914100046
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


