Успехи физиологических наук, 2019, T. 50, № 1, стр. 17-44
Соматотопия структур мозга, реализация целенаправленного эмоционально мотивированного поведения и энграмма памяти
А. С. Базян *
Федеральное государственное бюджетное учреждение науки Институт Высшей Нервной Деятельности
и Нейрофизиологии РАН
117485 Москва, Россия
* E-mail: bazyan@mail.ru
Поступила в редакцию 06.10.2018
Аннотация
Этот обзор посвящен изучению нескольких высших функций мозга и их объединению в единую взаимосвязанную и интегрированную систему, через реализацию целенаправленного эмоционально мотивированного поведения. Целенаправленное поведение контролируется соматотопией мозга. Соматотопия корковой пирамидной системы известна давно. Описывается соматотопия экстрапирамидной системы мозга, соматотопия базальных ганглиев и восходящих таламокортикальных сетей. Описывается возможность формирования энграммы памяти нейронами дорзального стриатума, интеграцией глутаматергических и ГАМКергических синапсов, в пределах соматотопии мозга. Энграмма в пределах соматотопии, это строго специфическая нейронная сеть реализующая целенаправленное поведение. Описываются два механизма контроля энграммы памяти: контроль со стороны эмоционально мотивационных состояний и контроль со стороны эмоционально насыщенной когнитивной карты мозга.
ВВЕДЕНИЕ
Этот обзор посвящен изучению нескольких высших функций мозга, которые мы анализировали ранее, и их объединению в единую взаимосвязанную и интегрированную систему, через реализацию целенаправленного эмоционально мотивированного поведения [2–15, 32–36]. Все процессы мозга можно рассматривать с позиции реализации поведения. В основе реализации поведения лежит соматотопия мозга. Соматотопия представляет собой строго специфическую двустороннюю анатомическую связь между мышцами и различными участками моторной и соматосенсорной коры мозга. Соматотопия, это представительство всего тела и его внутренних органов в коре мозга [18, 25, 107]. Моторная кора управляет мышечным сокращением и расслаблением. Соматосенсорная кора получает информацию от разных частей тела и внутренних органов. В зависимости от поступающей информации человек реализует целенаправленное поведение. Например, если искра попадает на руку, то человек отдергивает ее. Если болит, скажем, печень, то человек идет к врачу, начинает пить лекарство и держать диету. Соматотопия сенсорной коры – это восходящий сигнал, который затем передается на двигательную кору. И уже нисходящий сигнал из двигательной коры реализует целенаправленное поведение. Таким образом, соматотопическая организация в коре головного мозга, особенно в первичном двигателе и первичной соматосенсорной коре головного мозга, является хорошо известным и фундаментальным понятием для описания функций этих областей.
Основными звеньями системы регуляции моторного поведения являются сенсомоторная кора, мозжечок, красное ядро и базальные ганглии. Каждая из этих структур имеет свою специфику в анализе периферической афферентации и формировании моторной команды, которая реализуется через кортикоспинальную и другие нисходящие системы мозга.
Сенсомоторная соматотопия – это пирамидная система мозга. Каждая область моторной коры связана с определенной частью тела и участвует в ее управлении. Показано, что активность нейронов моторной коры коррелирует с разными параметрами движения, включая скорость, силу [65], направление, движения в суставах [79, 80], положение конечности [24]. Микростимуляция моторной коры может вызывать сложные движения [82]. Предполагается, что моторная система использует метод “оптимального контроля” множества параметров при выполнении каждого конкретного движения [141]. Показано участие моторной коры в контроле позы и в обучении новой позе. При этом существенную роль играет пластичность и изменение функций разных отделов моторной коры и других структур в процессе обучения и при компенсации мозговых повреждений [6].
Мозжечок играет существенную роль в моторном программировании. Латеральный мозжечок получает информацию о плане движения от ассоциативных областей коры и формирует программу движения, которая через зубчатые ядра и ядра таламуса передается на премоторную и моторную кору, где формируется нисходящая моторная программа. Копия этой программы, через нижнюю оливу поступает в промежуточную и медиальную области мозжечка, где обе копии сравниваются с афферентной информацией. Корректирующий сигнал передается в спинной мозг через соответствующие ядра мозжечка в красное ядро и в вестибулярные ядра. Через последние мозжечок участвует в контроле позы и равновесия. Показана также роль мозжечка в подготовке позы к движению [61, 62], в организации ритмических движений [1, 6], в формировании эмоциональных и мотивационных состояний [38, 58], в формировании наркотически зависимых состояний [111, 113], в обучении и памяти [50, 58, 140]. Показано, что при обучении в мозжечке происходит активный синаптогенез [88].
Описанные выше функции и связи мозжечка, позволяют уточнить схему иерархических сетей мозга, которую мы приводили ранее [8–10] и представить ее в приведенной на рис. 1 виде.
Рис. 1.
Иерархические сети мозга. Сплошные жирные черные линии, глютаматергичные связи (возбуждающие); полые черные линии, ГАМК-ергические связи (тормозящие); пунктирные линии, ДА-ергические передача. Черная субстанция ретикулярная часть (ЧСрч.), черная субстанция компактная часть (ЧСкч.) и вентральная тегментальная область (ВТО) объединены на основании глобального ДА сигнала. Гипот. – гипоталамус, Гипп. Гиппокмп – гиппокамп, Минд. – миндалина, Хаб. – хабенула, ПЯ – прилежащее ядро (nucleus accumbens), ПфК – префронтальная кора, СМК – сенсомоторная кора, ГПвне – Globus Pallidus внешний. СТЯ – субталамическое ядро. ГПв – Globus Pallidus внутренний. РЯТ – ретикулярное ядро таламуса. МЖЗ – мозжечок. SC – superior colliculus (двухолмие). ЭПОСМ – экстрапирамидная область среднего мозга. Энкеф – энкефалин. Суб. Р – субстанция Р. Дин – динорфин.
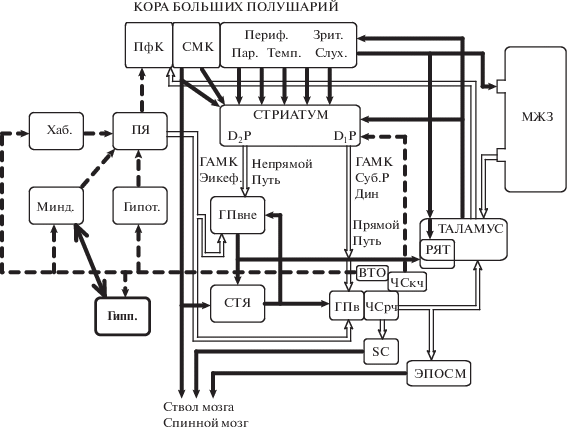
СОМАТОТОПИЯ БАЗАЛЬНЫХ ГАНГЛИЙ
Базальные ганглии являются частью экстрапирамидной системы мозга, участвующей в моторном контроле. Центральной структурой базальных ганглий является стриатум, который состоит из трех ядер. Прилежащее ядро, или nucleus accumbens, относят к вентральному стриатуму. Головка, хвостатое ядро и скорлупа относятся к структурам дорзального стриатума и составляют неостриатум [109].
95% всех нейронов дорзального стриатума – это ГАМКергические средние звездчатые нейроны. Остальные 5% – это интернейроны: большие не звездчатые нейроны составляют 1–2% клеточной популяции стриатума. Они используют ацетилхолин как медиатор – никотиновый холинорецептор. Третий тип нейронов – это средние не звездчатые нейроны. Это также интернейроны, они используют соматостатин как передатчик. Четвертый тип нейронов – это маленькие не звездчатые нейроны, которые используют ГАМК как медиатор [6]. Всего интернейронов 5%, что очень мало для функционирования локальной сети. Недостаточное количество интернейронов в дорзальном стриатуме, компенсируется специальным строением аксонов и дендритов средних звездчатых нейронов стриатума. Это позволяет им участвовать в функционировании локальной сети. Аксон средних звездчатых нейронов дорзального стриатума, идущий к нейронам паллидума (бледный шар) и к ретикулярной части черной субстанции, обладает коллатералями у самого основания аксона; они иннервируют дендритное дерево собственного и соседних средних звездчатых нейронов [109]. Следовательно, средние звездчатые нейроны сами участвуют в локальной обработке информации дорзальным стриатумом, используя ГАМК как медиатор.
Иерархические сети дорзального стриатума имеют специфическое строение. Синапсы средних звездчатых нейронов стриатума возбуждаются практически от всех областей коры головного мозга (рис. 1). Корковый вход использует глутамат как собственный медиатор и заканчивается в значительной степени на дендритных шипиках средних звездчатых нейронов. Проекции от коры головного мозга к стриатуму имеют топографическую организацию. Например, соматосенсорная и моторная кора проецируются к заднему неостриатуму (putamen), а префронтальная кора проецируется к головке хвостатого ядра Нужно отметить, что префронтальная кора, проецируется преимущественно к субталамическому ядру (СТЯ) [115].
Внутри соматосенсорных и моторных проекций к стриатуму сохраняется соматотопия. Предполагается, что топографические отношения между корой головного мозга и стриатумом обеспечивают базу для функционально различных параллельных сетей в базальных ганглиях [109]. Эти циркулирующие сети включают моторные, глазодвигательные и лимбические cвязи. Внутри каждой сети, предполагается наличие подсети, причем таким образом, чтобы у первичной моторной коры и премоторной коры были неидентичные связи со структурами базальных ганглий. Аналогично, дорзолатеральные и орбитолатеральные сети обладают особыми паттернами.
К этим пяти параллельно функционирующим сетям можно добавить еще две параллельно функционирующие сети: от соматосенсорной коры до ретикулярного ядра таламуса и от слуховой коры [20, 21]. Причем сети, идущие в базальные ганглии от слуховой коры, не моторные сети, так как в функционировании слуховой системы моторная реакция практически не используется. Можно полагать, что основные процессы подключающие слуховую систему к базальным ганглиям, это интегрирующие реакции.
Активность из коры приходит к определенным частям хвостатого ядра. Оттуда к определенным частям внутреннего сегмента globus pallidus (бледный шар) и ретикулярной части черной субстанции. Можно полагать, что наличие параллельных разделенных сетей позволяет также понять механизм стереотипного поведения, который может функционировать наподобие параллельных сетей. Например, стереотипия круговых движений, челночных движений, жевания, лизания, грызения, и тому подобное. К такому роду стереотипии можно отнести и реакцию самостимуляции, которая возникает, в определенных условиях, при активации вентральной тегментальной области, мезолимбической дофаминергической (ДА) системы (гипоталамус, миндалина, хабенула, прилежащее ядро) и префронтальной коры (рис. 1).
В черной субстанции (см. рис. 1) информация расщепляется на три части: одна часть запускает таламокортикальные сети и возвращает информацию в кору и в дорзальный стриатум; вторая часть, формирует выход из базальных ганглиев вместе с красным ядром и дополняет информацию, идущую из моторной коры; третья часть, через глобальный ДА сигнал, запускает мезолимбическую, мезокортикальную и ниграстриатную ДА систему, которая через взаимодействие с ядрами шва (серотонин – СТ) и голубого пятна (норадреналин – НА) интегрируется с НА и СТ системами и контролирует эмоционально мотивационные состояния. Восходящая от черной субстанции ДА-ергическая активность контролируется префронтальной корой [9, 11].
Хотя топография и соматотопия подразумевают определенную степень параллельной организации, есть также конвергенция и дивергенция в кортико-стриатных проекциях. Большие дендритные области средних звездчатых нейронов позволяют им получать вход от смежных проекций, которые приходят из различных областей коры. Входы нескольких корковых областей перекрываются, и вход от одиночной корковой области проецируется дивергентно к многочисленным зонам стриатума. Например, сенсорно-двигательные корковые проекции к стриатуму от областей руки в соматосенсорной коре и моторной коре [6, 67, 109] Таким образом, каждая корковая область проецируется к нескольким зонам стриатума, а несколько функционально связанных корковых областей проецируются к одной зоне стриатума. Эта сходящаяся и расходящаяся организация служит анатомической основой для интеграции и преобразования информации от нескольких областей коры головного мозга, в том числе и при условнорефлекторном обучении. Эти дивергентные и конвергентные связи могут интегрировать разные представительства в коре мозга через процессы пластичности, в том числе и представительства условного и безусловного раздражителей.
Но кроме корковой соматотопии описана и соматотопия в структурах базальных ганглиев [115]. Базальные ганглии представляют собой группу подкорковых ядер (рис. 1), и состоят из стриатума, бледного шара (ГП) субталамического ядра (СТЯ) и черной субстанции (ЧС). Стриатум можно разделить на хвостатое ядро, скорлупу и вентральный стриатум. Бледный шар можно разделить на внешние (ГПвне) и внутренние (ГПв) сегменты, а так же на вентральный и дорзальный бледный шар. ЧС состоит из ретикулярной (ЧСрч) и компактной части (ЧСкч). Среди этих ядер, стриатум и СТЯ являются входами в базальные ганглии. Стриатум принимает входные сигналы от всей коры головного мозга, а СТЯ принимает входные сигналы в основном из префронтальной или лобной коры. С другой стороны, ГПв и ЧСрч служат в качестве выходных ядер базальных ганглиев. GPe соединяет систему входов с выходным ядром. SNc состоит из ДА нейронов, которые имеют широкие проекции ко всем структурам базальных ганглий, особенно в стриатуме и модулируют их активность. Кроме того ДА проекциями из SNc обладают и мезо-кортико-лимбические структуры: миндалина, хабенула, гипоталамус, гиппокамп и префронтальная кора.
Соматотопия экстрапирамидной системы определяется тем, что все перечисленные структуры базальных ганглий имеют представительство всех частей тела животных [115]. Например, представительство передней лапы, задней лапы, языка и так далее. Соматотопия имеет прямые и обратные связи. В пирамидальной системе прямыми связями можно считать синаптические связи от моторной коры к мышцам, а обратными связями можно считать связи от мышц к соматосенсорной коре. Соматотопия экстрапирамидной системы также имеет прямые и обратные связи. Прямые специфические связи к мышцам, через основные выходы базальных ганглиев, имеют стриатум, субталамические ядра и черная субстанция, внешние и внутренние сегменты бледного шара, таламус. Таламус относится к выходу из базальных ганглиев и связь черная субстанция–таламус, активирует таламокортикальные сети. Это означает, что соматотопия экстрапирамидной системы имеет, как и соматотопия пирамидной системы прямые и обратные связи. Прямые связи формируются через кортико-базальные сети, а обратные связи формируются через таламокортикальные сети, которые возвращают сигнал в кору и в стриатум (рис. 1).
Рассмотрим, что означает соматотопия таламуса. Как видно из схемы, все структуры сенсомоторной коры и базальных ганглий, дают выход через спинной мозг на мышцы и управляют целенаправленным поведением – повернуть налево, повернуть направо, прыгнуть вверх, прыгнуть вниз, поймать и жевать, убегать, выпить и т.д. и т.п. Но, как видно из схемы, у таламуса нет выхода на мышцы, это структура обратной связи в кору и в дорзальный стриатум. Но тем не менее у нее есть соматотопия. Кора больших полушарий и тело стриатума, это интегрирующие структуры. Но обратная связь, которая циркулирует непрерывно в таламокортикальных сетях, указывает на то, что поэтапная интеграция контролируется восходящей соматотопией таламуса.
Показано, что в каждой структуре иерархических сетей реализуется процесс соматотпии, то есть каждая структура специфически связана с периферийными мышцами. Спрашивается зачем это нужно? Можно полагать, что это связано со специфической функцией каждой структуры. Прилежащее ядро или вентральный стриатум, это центр эмоциональных и мотивационных состояний [8, 9]. Мотивационные состояния управляют поведением через вентральные части внешних и внутренних ядер globus pallidus (бледного шара). А целенаправленное эмоционально мотивированное поведение реализуется под контролем эмоционально насыщенной когнитивной карты мозга, которая формируется интеграцией гиппокампа с корой больших полушарий [9, 10].
ПРОЦЕССЫ СИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
Предполагается, что в основе реализации обучения и нового поведения лежит модификация эффективности синаптической передачи, которая консолидируется и сохраняется на длительное время. Из рис. 1 видно, что каждая структура имеет как возбуждающую, так и тормозную иннервацию. И вообще известно, что каждый нейрон имеет очень большое количество тормозящих и возбуждающих синапсов. Процессы возбуждения и торможения суммируются алгебраически. После процессов пластичности, нейрон срабатывает как алгебраический сумматор, консолидирует эту активность и передает информацию нового качества на следующий нейрон. Мы описываем эти процессы последовательно, но на самом деле они происходят одновременно.
С позиции молекулярно–клеточных механизмов функционирования нейронов неважно, какого качества воздействия модифицируют эффективность синаптической передачи: обучение целого животного, сочетанная активация двух входов нейрона, высокочастотная стимуляция или фармакологическое воздействие. Именно эта идея лежит в основе модели длительной потенциации (ДП) [7, 54], которая очень широко используется для исследования молекулярно-клеточных механизмов памяти. Обычно ДП исследуется на возбуждающих глутаматергических синапсах головного мозга. Но имеется и другой процесс пластичности, длительная депрессия (ДД).
В основе процессов обучения и памяти лежит специфическая модификация экспрессии генов. Если в начальной стадии обучения, при кратковременной памяти мы введем животному блокатор синтеза белка, то естественно нарушим специфическую модификацию экспрессии генов и нарушим процесс консолидации. Это зависимый от времени процесс, если после начала обучения проходит определенное время, то процесс консолидируется и его очень трудно сбить, даже блокаторами синтеза белка.
Возбуждающие глутаматергические синапсы коры, стриатума и гиппокампа имеют однотипный постсинаптический состав рецепторов: AMPA, каинатные и NMDA-ионотропные рецепторы. Постсинаптические AMPA-рецепторы и каинатные рецепторы это Na+/K+-каналы. Их активация вызывает генерацию возбуждающего постсинаптического потенциала (ВПСП). NMDA-рецептор является Na+/K+/Ca2+ каналом. Накопление высокой концентрации Са2+ через NMDA-рецептор индуцирует ДП, накопление умеренной концентрации Са2+ через тот же NMDA-рецептор индуцирует ДД [7, 19, 37, 99, 143]. Считается, что в основе эффективности синаптической передачи лежит процесс кластеризации, увеличение количества постсинаптических AMPA-рецепторов при ДП [46, 56, 105, 134, 137] и уменьшение количества AMPA-рецепторов при ДД [54]. Но, на самом деле, можно полагать, что процесс более сложный и многоуровневый, который приводит к увеличению эффективности синаптической передачи.
Обычно на постсинаптической глутаматергической мембране локализованы два типа рецепторов AMPA и NMDA. NMDA-рецептор обладает потенциал-зависимым магниевым блоком. Активация NMDA-рецептора агонистами открывает хемочувствительный канал, но Na+ и Ca2+ не проходят внутрь клетки, так как канал закрыт Mg2+ и клетка не реагирует на пресинаптическую активацию. Деполяризация мембраны до 30 мВ снимает магниевый блок с NMDA-рецепторов. Потенциал зависимый Mg2+ формирует позднюю компоненту NMDA-рецептора, которая играет ключевую роль в процессах пластичности.
При моносинаптической активации глутаматергического синапса, постепенно нарастающая деполяризация, вызванная АМРА-компонентой ВПСП, снимает Mg2+ блок NMDA-рецептора, глутамат открывает хемочувствительный канал, Na+ и Са2+ начинают поступать внутрь клетки, вследствие чего запускается поздняя NMDA-компонента. Считается, что поздняя компонента NMDA-рецептора составляет 25% от максимальной амплитуды ВПСП АМРА-рецептора. Это определяет умеренный вход Са2+ внутрь клетки и, как было экспериментально показано, вызывает ДД. Это механизм ДД при несочетанной активации двух глутаматных входов, который связан с уменьшением количества AMPA-рецепторов на постсинаптической мембране [7, 54].
Длительная потенциация возникает при сочетанной активации двух глутаматергических синаптических входов одного нейрона, или при сочетанной активации одного синаптического входа нейрона с поляризацией мембраны нейрона, или при высокочастотной стимуляции одного синаптического входа нейрона. Экспериментально, ДП реализуется следующим образом: стимулируется один синаптический вход, или пропускается ток через мембрану клетки; второй синаптический вход стимулируют на фоне активации первого входа, или на фоне поляризующего тока. Стимуляция первого синаптического входа снимает Mg2+ блок NMDA-рецептора второго синапса. При активации второго входа Са2+ и Na+ проходят через NMDA- и AMPA-рецепторы соответственно. Первоначально Са2+, через процессы фосфорилирования и дефосфорилирования, модифицирует Na+ проводимость AMPA-рецептора, затем запускает трансдукционный сигнал и усиливает экспрессию генов AMPA-рецептора. Через несколько сочетаний, повышается эффективность синаптической передачи второго входа, которая удерживается несколько часов после прекращения сочетаний – ДП. Другой моделью ДП или обучения считается высокочастотная длительная посттетаническая потенциация (LTP). NМDА-рецептор функционирует таким образом, что при моносинаптической реакции активация синапса совпадает или сочетается со следующей активацией того же синапса, из-за высокой частоты стимуляции. Фактически, механизм тот же самый, что и при сочетании двух входов или при сочетании одного входа и поляризации нейрона. Так как индуцируемая вошедшим Са2+ модуляторная реакция медленная и длительно удерживаемая, а частота активации синапса высокая, то следующий стимул накладывается, т.е. сочетается с предыдущей модуляторной реакцией, которая, в конечном счете, приводит к значительному повышению концентрации внутриклеточного Са2+. Реакция опять же двухэтапная: первый этап реакции – это процессы фосфорилирования АМРА- и NMDA-рецепторов, которые относятся к кратковременной памяти; а процессы модификации экспрессии генов консолидируют реакцию первого этапа и переводят ее в долговременную память [7].
Синаптической пластичностью обладает и ГАМКА-рецептор, генерирующий тормозной постсинаптический потенциал (ТПСП) [5, 33, 35, 36]. Аллостерическая пластичность ГАМКА-рецептора наблюдается после выработки повышенной судорожной готовности – пентилентетразолового (ПТЗ) киндлинга у крыс, при ежедневном введении ПТЗ в субконвульсивной дозе 20 мг/кг в течение 24 дней. На 24-ый день субконвульсивная доза 20 мг/кг уже вызывает судороги, взаимодействуя с пикротоксиновым (ПКТ) сайтом ГАМКА рецептора и аллостерически уменьшает активность ГАМК и бензодиазепинового (БДЗ) сайтов. Плотности БДЗ сайта уменьшается на 20% без изменения аффинности связывания. Эта реакция удерживается 48 ч, но через 7 сут возвращается к исходному уровню. Через 6 мес. у киндлинговых животных плотность БДЗ сайта уменьшается до 50%. Однократная инъекция ПТЗ в дозе 30 мг/кг полностью восстанавливает судорожную активность, увеличивает плотность БДЗ сайта до 80% от контроля (20% уменьшение от контроля) без изменения аффинности. У животных этого возраста судороги, вызванные той же дозой ПТЗ, сопровождаются уменьшением плотности и аффинности БДЗ сайта. То есть, в течение 6 мес. рецепторная реакция сохраняется и воспроизводится независимо от текущей рецепторной реакции [5, 7, 33, 35, 36].
Процесс воспроизведения судорожной активности очень похож на воспроизведения памяти через длительное время. Но судороги, в том числе и ПТЗ судороги, вызывают амнезию, о каком сходстве с памятью может идти речь в этом случае? Мы исследовали этот вопрос на рефлексе пассивного избегания [2, 34]. Сразу после обучения вводили ПТЗ в дозе 50 мг/кг. На следующий день рефлекс не воспроизводился. Если на второй день, за 2 ч до тестирования рефлекса, крысам ввести ПТЗ в дозе 30 мг/кг, то рефлекс прекрасно воспроизводился. Это означает, что ПТЗ судороги вызывают диссоциированное обучение. Но известно, что ПТЗ это анксиоген, который вызывает реакцию страха, а рефлекс пассивного избегания основывается на выработке реакции страха к темному отсеку условнорефлекторной камеры. Тогда мы исследовали другой анксиоген, неспецифический антагонист ДА-рецепторов – галоперидол [32]. Введенный за 2 ч до тестирования галоперидол, в субкаталептической дозе, воспроизвел рефлекс пассивного избегания и не повлиял на латентный период захода в темный отсек условнорефлекторной камеры у контрольных крыс. Подробный анализ полученных результатов позволил описать схему внутриклеточной специфической модификации экспрессии генов. То есть процесс консолидации памяти, переход кратковременной памяти в долговременную стадию на примере взаимодействия трех рецепторов, ГАМКА-рецептора, глутаматных рецепторов, ДА-рецептора и трансдукционного сигнала (рис. 2).
Рис. 2.
Схематическая модель внутриклеточной специфической модификации экспрессии генов с помощью трансдукционного сигнала. ГЛУ-Р – глутаматергические рецепторы; ГАМК(А)-Р – ГАМКА рецепторы; ДА-Р – дофаминергические рецепторы; Ф – ферменты синтезирующие вторичные посредники; СФ – субстрат фосфорилирования; G – G-белок; ПК – протеин киназа; CaMK – кальций/калмодулин–зависимая протеин киназа. Трансдукционный сигнал опосредованный глутаматергическими рецепторами представлены сплошной линией. Трансдукционный сигнал опосредованный ГАМКА рецептором представлен крупными пунктирными линиями. Трансдукционный сигнал опосредованный ДА рецепторами представлены мелкими пунктирными линиями.
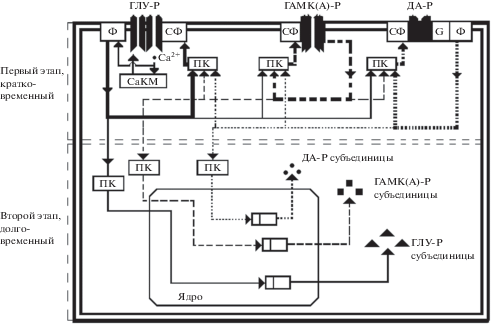
В нескольких работах показано, что при процессах интеграции, например, разные виды химического и электрического киндлинга, длительная потенциация и другие, активность ГАМКА- и глутаматных рецепторов модифицируются, объединяются и вероятно консолидируются, так как сами экспериментальные модели вызывают процессы длительного хранения информации [5, 35]. Можно полагать, что это и есть алгебраическая суммация процессов возбуждения, торможения и их длительное хранение.
Но показано, что этот процесс происходит и в норме. Проходящий через NMDA-рецептор Са2+, через систему мембранных белков, процессы фосфорилирования и дефосфорилирования, контролирует активность ГАМКА-рецептора, индуцируя целенаправленные пластические изменения и объединяя пластичность ГАМК- и глутаматных рецепторов [83, 101]. Этот новый модифицированный комплекс ГАМКА и глутаматных рецепторов консолидируется и сохраняется через кругооборот субъединиц ГАМКА- и глутаматных рецепторов [101]. По-видимому, этот же механизм является основой кластеризации ГАМКА-рецепторов, при процессах пластичности [70, 72, 87, 101].
Но оказалось, что синаптическая пластичнось более широкий процесс и относится не только к постсинаптическим рецепторам. В процесс пластичности вовлекается также ГАМК-транспортер [131, 132], который локализован на пресинаптической терминали и контролирует инактивацию ГАМК. От скорости инактивации зависит время действия выделенного ГАМК- на ГАМКА-рецептор.
СИНАПТИЧЕСКАЯ ПЛАСТИЧНОСТЬ И ЭНГРАММЫ ПАМЯТИ
В психологии принято следующее определение энграммы [17]. “Энграмма – это физическая привычка или след памяти, запечатленный в протоплазме (цитоплазма и ядро клетки) организма, оставленный воздействием определённого раздражителя”. Если несколько отредактировать это определение, то получится: Энграмма – это след памяти, запечатленный в клетках организма, оставленный воздействием определенного раздражителя. Под это определение подходит и синаптическая пластичность.
В 1949 г. Хебб написал книгу “Организация поведения. Нейрофизиологическая теория” [74]. В этой книге он описал свою идею проторения синапса при обучении. Описывается модель нейрона с двумя входами, один вход молчащий (0), другой работающий (1). Под влиянием обучения два входа сочетаются, и в итоге вход с нулевым значением начинает отвечать на активность, синапс со значением (0), превращается в синапс со значением (1). То есть молчащий синапс проторяется.
Глутаматные рецепторы
Принцип Хебба поставлен в основу разработки компьютеров. Предполагается, что 0 это молчащий синапс, а 1 это проторенный синапс. Позднее молчащие синапсы были открыты экспериментально [63, 77, 98, 103]. Молчащие синапсы – это синапсы, которые содержат только NMDA-рецепторы с малым количеством или совсем без AMPA-рецептора, например, при нормальном потенциале покоя мембраны эти синапсы не выявляют постсинаптических ответов на синаптическое выделение глутамата. “Немолчащими” эти синапсы становятся путем включения AMPA-рецепторов в постсинаптическую мембрану. Эта гипотеза была быстро расширена за счет включения AMPA-рецепторов в синапсы и привела к большим исследовательским успехам для молекулярных механизмов, контролирующих кругооборот AMPA-рецепторов [46, 56, 104, 133, 136].
Четыре субъединицы формируют катионный канал NMDA-рецептора. NMDA-рецептор является Na+/K+/Ca2+-каналом. Рецептор имеет одну особенность. Он обладает потенциал-зависимым Mg2+ блоком. Считается, что именно это свойство NMDA-рецепторов делает его ключевой фигурой в молекулярно-клеточных механизмах синаптической пластичности (см. выше). Было показано, что NMDA-рецептор контролирует синаптическую пластичность, формируя специфические кластеры AMPA- и NMDA-рецепторных комплексов [5, 46, 54, 56, 104, 133, 136].
Процесс кластеризации, это когда количество AMPA-рецепторов увеличивается и получается ДП – длительная потенциация. Процесс декластеризации, это когда количество AMPA-рецепторов уменьшается и получается ДД – длительная депрессия. ДП это механизм усиления синаптической связи, а ДД это механизм ослабления синаптической связи или удаления ненужных связей.
Структура AMPA-рецепторов
АМРА-рецепторы опосредуют быструю синаптическую передачу в ЦНС и состоят из субъединиц GluA1-4, продуктов отдельных генов. Подобно всем субъединицам ионотропных глутаматных рецепторов, субъединицы GluA имеют внеклеточный N-конец и внутриклеточный С-конец (иллюстрируемый субъединицей GluA2). Лиганд связывающий домен составлен из N-концевой области S1 и S2. Все субъединицы рецептора AMPA существуют как два варианта сплайсинга, флип и флоп. Альтернативная кассета для сращивания находится на C-конце контура между доменами TMIII и TMIV (рис. 3). Хотя изменение субъединиц рецептора невелико (изменяется только несколько аминокислот), эффект может быть довольно драматичным, что приводит к изменению кинетики десенситизации [26].
Рис. 3.
Структура субъединицы GluA2. Субъединица имеет четыре трансмембранных домена: ТМ1, ТМ2, ТМ3 и ТМ4. ТМ2 домен формирует пору канала. Схема субъединицы используется для иллюстрации структурных свойств субъединиц AMPA-рецептора. N-конец является внеклеточным, а С-конец является внутриклеточным. Изменение склейки происходит в области “Flip/Flop”, давая два варианта для каждой последовательности генов. С-конец содержит области связывания для белков AP2, NSF и PDZ, таких как PICK1 и GRIP. Сайт R/Q РНК редактирования заменой одной аминокислоты превращает непроницаемый для Са2+ канал в проницаемый.
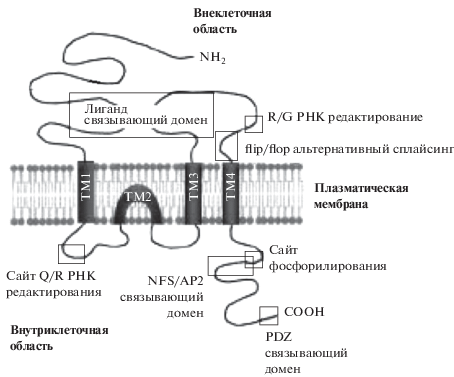
Нативные каналы рецептора AMPA непроницаемы для кальция, функция контролируется субъединицей GluA2. Проницаемость для кальция GluA2 субъединицы определяется посттранскрипционным редактированием мРНК GluA2, который изменяет одну аминокислоту в области TMII от глутамина (Q) до аргинина (R). Это так называемый сайт редактирования Q/R – GluA2 (Q) является проницаемым для кальция, в то время как GluA2 (R) – нет. Почти весь белок GluA2, экспрессируемый в ЦНС, находится в форме GluA2 (R), что приводит к возникновению непроницаемых для кальция рецепторов AMPA. Это, наряду со взаимодействием с другими внутриклеточными белками, превращает GluA2-субъединицу, возможно, в одну из самых важных субъединиц AMPA-рецептора [26].
Функции AMPA-рецепторов
АМРА-рецепторы ответственны за большую часть быстрой возбуждающей синаптической передачи по всей ЦНС, и их модуляция является конечным механизмом, лежащим в основе большей части пластичности возбуждающей передачи в мозге. Увеличение постсинаптического ответа на стимул достигается либо за счет увеличения количества рецепторов AMPA на постсинаптической поверхности, либо путем увеличения проводимости каналов экспрессируемых рецепторов. Это было показано для механизмов ДД [41]. Далее стало ясно, что эти два, по-видимому, разных механизма увеличения ответа рецептора АМРА могут быть объединены в один механизм экспрессией Ca2+ проницаемых AMPA-рецепторов, которые обладают высокой проводимостью в ответ на тетаническую стимуляцию. Таким образом, как считают эти авторы [126, 138], общая проводимость синапса может быть увеличена путем обмена рецепторов, а не модификации существующих рецепторов.
С-конец субъединицы GluA2 содержит сайты связывания для большого количества взаимодействующих белков, таких как NSF, AP2, а также терминальный домен PDZ, который связывает PICK1 и GRIP, тогда как субъединица GluA1 взаимодействует с SAP97. Эффекты этих белок-белковых взаимодействий имеют решающее значение для локализации и кругооборота этих рецепторов, чтобы они могли выполнять свою роль в процессах пластичности [26].
Структура NMDA-рецепторов
Субъединица NMDA-рецепторов имеет сходные структурные характеристики, как и другие члены семейства ионотропных глутаматных рецепторов, с внеклеточным N-концом, внутриклеточным С-концом и рецидивирующим трансмембранным доменом (рис. 3 и табл. 1). Существуют два семейства субъединиц, которые входят в состав NMDA-рецепторов, субъединицы GluN1 и GluN2. Субъединица GluN1 является существенным компонентом всех рецепторных комплексов NMDA, тогда как существуют четыре субъединицы GluN2 (GluN2A-D), которые являются продуктами отдельных генов. Субъединицы GluN1 объединяются с различными субъединицами GluN2 для генерации большого количества различных NMDA-рецепторов с различными фармакологическими и биологическими свойствами. Таким образом, NMDA-рецепторы в разных частях мозга или на разных стадиях развития могут действовать одинаково [117].
Таблица 1.
Субъединицы глутаматных рецепторов
| NMDA-Рецептор | AMPA-Рецептор | Каинатный Рецептор |
|---|---|---|
| NR1 = GluN1 | GluRA = GluR1 = GluA1 | GluR5 = GLUK5 = GluK1 |
| NR2A = GluN2A | GluRB = GluR2 = GluA2 | GluR6 = GLUK6 = GluK2 |
| NR2B = GluN2B | GluRC = GluR3 = GluA3 | GluR7 = GLUK7 = GluK3 |
| NR2C = GluN2C | luRD = GluR4 = GluA4 | KA1 = GLUK1 = GluK4 |
| NR2D = GluN2D | KA2 = GLUK2 = GluK5 | |
| NR3A = GluN3A | ||
| NR3B = GluN3B |
Примечание. На протяжении многих лет существовало множество различных схем номенклатуры ионотропных глутаматных рецепторов. В приведенной таблице представлена окончательная номенклатура ионотропных глутаматных рецепторов, согласованная в Париже в 2008 г. с Международным союзом базовой и клинической фармакологии (IUHPAR) [76].
В дополнение к вариации, вызванной использованием различных субъединиц GluN2 в рецепторном комплексе, GluN1 субъединица существует в нескольких вариантах сплайсинга, синтезированных путем дифференциального сращивания мРНК, полученных из одного гена. В N- и C-конце имеются два участка для изменения сплайсинга. Изменение сплайсинга может иметь важное значение для регуляции внутриклеточных взаимодействий, таких как PDZ-PSD-95-связывающие белки [117].
Глицин, коагонист Глутамата
L-глутамат не является единственным агонистом NMDA-рецептора. Глицин, еще одна аминокислота, является коагонистом рецептора, и оба передатчика должны связываться для того, чтобы рецептор функционировал. Сайты связывания глутамата и глицина находятся на разных субъединицах – глицин связывается с субъединицей GluN1, тогда как глутамат связывается с субъединицей GluN2. Это одна из причин, по которой для генерации полностью функционирующего рецептора требуются оба типа субъединиц. Субъединица GluN2B также имеет сайт связывания для полиаминов, регуляторных молекул, которые модулируют функционирование NMDA-рецептора [117].
Функция NMDA-рецептора
NMDA-рецептор функционирует как модулятор синаптического ответа и детектор совпадения. При потенциалах покоя мембраны NMDA-рецепторы неактивны. Это связано с зависимым от потенциала блоком канала ионами магния, препятствующими протеканию ионов через канал. Устойчивая активация рецепторов AMPA, например, посредством последовательности импульсов, поступающих на пресинаптическую терминаль, деполяризует постсинаптический рецептор, снимает магниевый блок канала, тем самым позволяя активировать NMDA-рецептор. В отличие от рецепторов AMPA, содержащих GluA2-субъединицу, NMDA-рецепторы проницаемы для ионов кальция, а также проницаемы для других ионов. Таким образом, активация NMDA-рецептора приводит к притоку в постсинаптические клетки кальция, который играет важную роль в актуализации ряда сигнальных каскадов, в зависимости от конкретной полученной импульсной последовательности [117].
Каинатные рецепторы и синаптическая пластичность. Долгосрочное потенцирование в синапсе Мшистых Волокон поля CA3-гиппокампа
ДП в синапсах мшистых волокон поля CA3 гиппокампа (МВ-CA3) не зависит от NMDA-рецепторов. Пресинаптические каинатные рецепторы играют очень важную роль в этой форме ДП. Эти МВ являются аксонами зернистых клеток зубчатой фасции гиппокампа, которые проецируются в поле СА3-гиппокампа. Синапсы МВ-CA3 необычны тем, что содержат несколько участков высвобождения глутамата, каждый из которых имеет соответствующую пресинаптическая плотность. При базальном выделении вероятность того, что любой из этих сайтов выделит нейромедиатр низка. Кроме того, в отличие от синапсов в области CA1, в пресинаптических участках имеется несколько NMDA-рецепторов. LTP в этом синапсе является независимым от NMDA-рецептора [85].
Показано, что LY382884, антагонист рецепторов, содержащих GluK1 субъединицу, селективно блокирует индукцию независимого от NMDA-рецептора ДП в нейронах поля CA3-гиппокампа [45], что указывает на наличие GluK1-содержащих рецепторов. Это подтверждается использованием селективного антагониста GluK1, UBP296 [109]. Было также продемонстрировано, что этот эффект МВ ДП обусловлен селективным ингибированием пресинаптических каинатных рецепторов, расположенных в области CA3, гиппокампа [94]. Серия высокочастотной стимуляции приводит к модификации пресинаптической мембраны, увеличивая вероятность высвобождения глутамата с любого участка [85].
Механизм индукции ДП
Механизмы индукции МВ-ДП сейчас интенсивно исследуются. Индукция МВ-ДП приводит к облегчению синаптической передачи, опосредованному пресинаптическими каинатными рецепторами. Такое облегчение является результатом обратной связи, в котором синаптическая активация пресинаптических каинатных рецепторов приводит к увеличению высвобождения глутамата, что вызывает увеличение синаптической передачи и увеличение активации пресинаптических каинатных рецепторов [95]. Окклюзия этого частотного облегчения путем индукции МВ-ДП предполагает, что эти два процесса связаны, и вполне возможно, что частотное облегчение является триггером для индукции МВ-ДП [85].
Дальнейшие доказательства наличия связи между этими двумя формами пластичности, вытекают из того, что концентрация ионов Ca2+ является критической, позволяющей LY382884 блокировать оба процесса. При низкой концентрации Ca2+ (2 мМ) индукция МВ-ДП и облегчение синаптической передачи восприимчивы к блокаде антагонистами GluK1, но при более высоких концентрациях Ca2+ (4 мМ) они не выявляются [96]. Кроме того, оба процесса блокируются рианодином (ингибитором выделения Ca2+ из внутриклеточных хранилищ), но только при низкой концентрации Ca2+; аналогичным образом оба процесса блокируются филантотоксином (ингибитором неописанных непроницаемых для Ca2+-рецепторов глутамата), но снова только при низких концентрациях Ca2+.
Приведенные здесь данные показывают, что при низких концентрациях Ca2+ МВ-ДП и облегчение синаптической передачи МВ зависят от Ca2+-проницаемого GluK1, содержащего каинатного рецептора, и выделения Ca2+ из внутриклеточных хранилищ. Однако при высоких концентраций Ca2+ блок этих процессов может быть преодолен, что указывает на наличие альтернативного пути для поступления Ca2+ в пресинаптическое окончание. Было показано, что это происходит через Ca2+-каналы L-типа. Как МВ-ДП, так и облегчение синаптической передачи МВ блокируются совместным применением LY382884 и нифедипина, ингибитора Ca2+ каналов L-типа, даже при высоких концентрациях Ca2+ [96]. Таким образом, можно предложить механизм индукции МВ-ДП, который включает в себя приток ионов Ca2+ через GluK1 субъединицу каинатного рецептора, который индуцирует выделение Ca2+ из внутриклеточных депо, что, в свою очередь, приводит к увеличению высвобождения глутамата из пресинаптических окончаний в ответ на исходную стимуляцию [85].
Давно известно, что помимо прямой роли каинатных рецепторов, метаботропные рецепторы глутамата также играют определенную роль в МВ-ДП. Было показано, что МВ-ДП может быть заблокирован (S)-MCPG, антагонистом рецепторов mGlu группы I/II [31].
Таким образом изменение эффективности глутаматергической синаптической пластичности зависит от четырех процессов: кластеризации и декластеризации рецепторов; субъединичного состава окружающего ионный канал, редактирования рецепторов и сплайс вариантов субъединиц.
ГАМКА-рецептор
Как уже было сказано выше, ионы Са2+, которые проходят через канал NMDA-рецептора, вызывают кластеризацию и декластеризацию AMPA-рецептора и контролируют активность ГАМКА-рецептора и интегрируют глутаматные и ГАМКА-рецепторы в единую систему. Это означает, что пластичность ГАМКА-рецептора тоже связана с кластеризацией и декластеризацией этого рецептора. И действительно, кластеризация ГАМКА-рецепторов показана в нескольких работах [70, 72, 87, 101]. Внутриклеточный кругооборот (trafficking) ГАМКА-рецептора обеспечивает обновление рецептора в нормальных условиях [52, 75, 89, 145]. В то же время, кругооборот рецепторов также лежит в основе многих форм синаптической пластичности, как в ингибирующих, так и в возбуждающих синапсах, с помощью динамической регуляции количества рецепторов на поверхностных мембранах [75, 101, 123, 125]. В ГАМКергических синапсах постсинаптически индуцируемая потенциация зависит от увеличения экзоцитоза ГАМКА-рецептора, что, в свою очередь, способствует накоплению рецепторов на постсинаптической мембране, как это наблюдается в культивированных нейронах, на срезах и in vivo [93, 106, 116, 119, 124, 125].
И наоборот, ингибиторная длительная депрессия коррелирует со снижением доступности ГАМКА-рецепторов в синапсах, хотя совершенно не понятно, с чем это связано, или с интернализацией рецептора, или с рассеиванием из синапса [29, 93, 114]. Действительно, специфическая блокада эндоцитоза ГАМКА-рецептора в клетку, предотвращает депрессию торможения в срезах первичной зрительной коры [93], в то время как не влияет на экспрессию ингибиторной ДД в нейрональных культурах гиппокампа [29, 114].
Другим ключевым элементом внутриклеточного кругооборота рецепторов, которые способствуют регуляции количества поверхностных рецепторов и которые могут играть определенную роль в экспрессии постсинаптической пластичности является внутриклеточная сортировка рецептора [101, 145]. На самом деле, определяя судьбу внутриклеточных рецепторов по отношению к деградации рецепторов в лизосоме или рециркуляции рецепторов на субсинаптическую мембрану, внутриклеточная сортировка может контролировать количество рецепторов и вовлекаться в кругооборот рецепторов. Таким образом, преимущественное распределение рецепторов к рециркуляции или лизосомальной деградации могли бы увеличить или уменьшить количество поверхностного рецептора во время синаптической потенциации или депрессии, соответственно [27, 89, 102]. Следует отметить, что рециркуляция пластически модифицированных рецепторов на поверхность может быть быстрее, чем вновь синтезированные рецепторы, от нескольких минут до нескольких часов [43, 57, 128].
Ключевая роль кругооборота (trafficking) рецепторов в экспрессии синаптической пластичности первоначально была продемонстрирована in vitro, а затем была подтверждена in vivo в экспериментах, посвященных возбуждающей и ингибирующей синаптической пластичности в стволе мозга при формировании сенсорного опыта [55, 100], при возникновении и угашении страха в миндалине и прилежащем ядре (nucleus accumbens) [53], в медиальной префронтальной коре при индукции кокаином [39, 81], в зрительной коре [69, 116], и в гиппокампе [97, 142].
Структура ГАМКА-рецепторов и зависимость ее активности от субъединичной композиции
Рецептор гамма-аминомасляной кислоты типа А (ГАМКА) является супрамолекулярным рецепторным комплексом [5, 103, 108, 144]. ГАМКА-рецептор обладает 20 субъединицами: α субъединица – 6 изоформ, β субъединица – 4 изоформы, γ субъединица – 3 изоформы, δ субъединица – 1 изоформа, ε субъединица – 1 изоформа, π субъединица – 1 изоформа, ρ субъединица – 3 изоформы и θ субъединица – 1 изоформа [40, 44, 146]. У птиц обнаружена γ4 изоформа, но она не обнаружена у млекопитающих. Субъединицы ε и θ обнаружены в мозге человека, в мозге обезьяны и крысы обнаружены субъединицы, структурно сходные с ними [44, 146].
На рис. 4a, представлены пять специфических участков или сайтов связывания ГАМКА-рецептора. Первый участок – ГАМК-сайт, с которым связывается сам ГАМК и его специфические агонисты, например, мусцимол и конкурентный антагонист бикукулин. Взаимодействие ГАМК с собственным сайтом ГАМКА-рецептора открывает хлорный канал, что приводит к генерации ТПСП. Для открытия хлорного канала необходимо взаимодействие двух молекул ГАМК с двумя специфическими участками связывания, которые локализованы между α1 и β2 субъединицами нативного рецептора (рис. 4б). Второй участок связывания ГАМКА-рецептора – бензодиазепиновый (БДЗ) сайт, локализован между γ2 и α1 субъединицами. С этим сайтом связываются БДЗ агонисты, например, диазепам, клоназепам; БДЗ антагонисты – флумазенил; и обратные агонисты БДЗ сайта – ДМКМ, βССМ. Третий участок связывания ГАМКА-рецептора – пикротоксиновый (ПТК) сайт, с которым соединяются конвульсанты, в частности, пентилентетразол. Четвертый участок связывания ГАМКА-рецептора – барбитуратный сайт, с которым связываются пентобарбитал и фенобарбитал. С этим же сайтом, предположительно, связывается и этанол. Пятый сайт связывания ГАМКА-рецептора – нейростероидный.
Рис. 4.
Схема нативного ГАМКА-рецептора. а) Рецептор с хлорным каналом и пятью участками аллостерической регуляции проводимости хлорного канала. б) Хлорный канал открывается, когда две молекулы ГАМК связываются с рецептором. Участок связывания между α1 и β2 субъединицами. Участок связывания бензодиазепина (БДЗ) локализован между γ2 и α1 субъединицами.
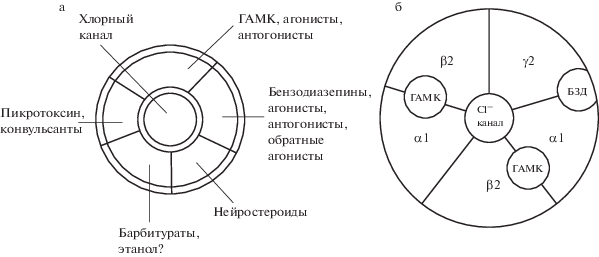
Эффективность аллостерической регуляции зависит от субъединичной композиции (состава) рецептора. Например, наличие γ2 субъединицы в составе рецептора интенсифицирует аллостерическое усиление ГАМК эффектов диазепамом, клоназепамом и золпидемом. Для диазепама и клоназепама таким же усиливающим эффектом обладает наличие любой α субъединицы в композиции рецептора кроме α4 и α6 субъединиц. Наличие этих субъединиц в композиции ГАМКА-рецептора блокирует эффект фуросемида, влияющий на ГАМК-сайт. Аллостерический эффект лореклезола на связывание ГАМК с ГАМК-сайтом значительно усиливается при наличие β2 и β3 субъединиц в составе ГАМКА-рецептора. Отсутствие γ2 субъединицы ослабляет аллостерическое усиление ГАМК эффектов этими веществами. Цинк вызывает аллостерическую супрессию ГАМК эффектов при отсутствии γ2 субъединицы в рецепторе. Аллостерический усиливающий эффект нейростероидов на связывание ГАМК с ГАМК-сайтом обратно пропорционально уровню δ субъединицы в композиции ГАМКА-рецептора, и так далее [103].
Субъединичная композиция рецептора определяет степень аллостерической регуляции ГАМКА-рецептора (рис. 5). Эта схема характеризует связывание лиганда к БДЗ участку ГАМКА-рецепторов мозга в зависимости от субъединичной композиции [42]. Как видно из рисунка, если в субъединичную композицию ГАМКА-рецептора включены γ1- и γ3-субъединицы, то рецептор слабо чувствителен к диазепаму (БДЗ агонист); если в субъединичную композицию рецептора включены α4 и α6 субъединицы, то рецептор не чувствителен к диазепаму. Низко чувствительные и не чувствительные к диазепаму комплексы локализованы на внесинаптической мембране и ответственны за тонические тормозные реакции. Подавляющее большинство ГАМКА рецепторов мозга (80%) чувствительны к диазепаму. Из них часть обладает низкой аффинностью к золпидему, другая часть обладает высокой аффинностью к золпидему. Эти рецепторы, локализованные на субсинаптической мембране, и генерируют ТПСП. Зависимости и эффективности аллостерической регуляции ГАМКА-рецептора от субъединичной композиции посвящено много работ [7].
Рис. 5.
Схема зависимости активности ГАМКА-рецептора от субъединичной композиции. Объяснение в тексте.

Субъединицы ГАМКА-рецептора, так же как глутаматергические рецепторы, имеют сплайс варианты. Следуя гомологии аминокислотной последовательности (сиквенса), девятнадцать известных у млекопитающих субъединиц ГАМКА-рецептора объединяют в семь семейств (6α, 4β, Зγ, 1δ, 1ε, 1π, Зρ) [40, 47]. Гомология сиквенса между семействами субъединиц достигает 30–40%. Около 20–30% гомологичности сиквенса существует между всеми субъединицами ГАМКА-рецептора и другими генными продуктами суперсемейства [60, 122, 135]. Большинство семейств субъединиц имеет многочисленные субтипы (α1–6, β1–4, γ1–3, δ, ε, π, ρ1–3). Сиквенсы внутри субъединичных семейств имеют гомологию около 70–80%.
Дополнительное разнообразие возникает вследствие альтернативного сплайсинга эксонов на уровне предшественников мРНК, описанного для γ2 [146], β2 [72] и β4 субъединиц. В каждом случае пептидные продукты сплайсинга отличаются длиной внутриклеточной петли между 3 и 4 трансмембранными доменами. Явление сплайсинга известно и для других субъединиц, но оно либо не влияет на белковую последовательность, либо такие сплайс-варианты субъединиц не образуют функциональных рецепторов. ДНК каждой субъединицы ГАМКА-рецептора кодирует полипептид около 50 кДа, с предполагаемыми сайтами N-гликозилирования и четырьмя α-спиралевидными гидрофобными регионами, пронизывающими мембрану [122, 135]. Между третьим и четвертым трансмембранными доменами предположительно находится гидрофильный цитоплазматический участок с высокой вариабельностью сиквенса, который участвует во внутриклеточных регуляторных механизмах, таких как фосфорилирование.
Таким образом изменение эффективности ГАМКA-рецептора, так же как изменение глутаматергической синаптической пластичности зависит от четырех процессов: кластеризации и декластеризации рецепторов; субъединичного состава окружающего ионный канал, редактирования рецепторов и/или сплайс вариантов субъединиц.
Основываясь на этом мы может написать систему уравнений, которые описывают эффективность синаптической пластичности:
Здесь SP – эффективность синаптической пластичности, отражающая уменьшение или увеличение эффективности синаптической передачи; N – нативный рецептор; e – глутаматные рецепторы (excitation, возбуждение); i – ГАМКА-рецептор (inhibition, торможение); +M – кластеризация рецепторов; –М – декластеризация рецепторов; m – модификация субъединичной композиции рецепторов; Δm – сплайс варианты и/или редактирование рецепторов. Знак ± означает, что как модификация субъединичной композиции рецепторов, так и сплайс варианты или редактирование рецепторов может привести и к повышению эффективности синаптической передачи, или к уменьшению эффективности синаптической передачи [12–14].
Соматотопия экстрапирамидной системы определяется тем, что все перечисленные структуры базальных ганглий имеют представительство всех частей тела животных [115]. Например, представительство передней лапы, представительство задней лапы, представительство языка и так далее. Соматотопия имеет прямые и обратные связи. В пирамидальной системе прямыми связями можно считать синаптические связи от моторной коры к мышцам, а обратными связями можно считать связи от мышц к соматосенсорной коре. Соматотопия экстрапирамидной системы так же имеет прямые и обратные связи. Прямые специфические связи к мышцам, через основные выходы базальных ганглиев, имеют стриатум, внешние и внутренние сегменты бледного шара субталамические ядра и черная субстанция. Таламус относится к выходу из базальных ганглиев и связан с черной субстанцией, но таламус не имеет выхода для реализации поведения (рис. 1), таламус активирует таламокортикальные сети. Это означает, что соматотопия экстрапирамидной системы имеет, как и соматотопия пирамидной системы, прямые и обратные связи. Прямые связи формируются через кортико-базальные сети, а обратные связи формируются через таламокортикальные сети, которые возвращают сигнал в кору и в стриатум (рис. 1).
Девяносто пять процентов всех нейронов дорзального стриатума – это ГАМК-ергические средние звездчатые нейроны (рис. 6). Остальные пять процентов – это интернейроны: большие незвездчатые нейроны составляют 1–2% от клеточной популяции стриатума. Они используют ацетилхолин как медиатор. Третий тип нейронов – это средние незвездчатые нейроны. Это также интернейроны, они используют соматостатин как передатчик. Четвертый тип нейронов – это маленькие незвездчатые нейроны, которые используют ГАМК как медиатор [10, 11, 109]. Всего интернейронов 5%, что очень мало для функционирования локальной сети. Нехватка интернейронов в дорзальном стриатуме компенсируется специальным строением аксонов и дендритов средних звездчатых нейронов стриатума (рис. 6), что позволяет им участвовать в функционировании локальной сети. Одиночный аксон средних звездчатых нейронов дорзального стриатума, идущий к нейронам бледного шара и ретикулярной части черной субстанции, обладает коллатералями у самого основания аксона; они иннервируют дендритное дерево собственного и соседних средних звездчатых нейронов [109]. Следовательно, средние звездчатые нейроны сами участвуют в локальной обработке информации дорзальным стриатумом, используя ГАМК как медиатор.
Рис. 6.
Средняя звездчатая клетка дорзального стриатума. а) Дендритное дерево нейрона, с локализованными на нем шипиками. б) Терминаль того же нейрона с коллатералями. Объяснение в тексте.

Теперь рассмотрим, каким образом процесс синаптической пластичности формирует специфическую сеть, в зависимости от обучения или при реализации декларативной памяти (увидел – запомнил, услышал – запомнил), и/или при реализации целенаправленного поведения и т.д. и т.п. Во всех этих ситуациях в основе выработки нового паттерна, или топографии сети, или выработки специфической схемы сети лежит синаптическая пластичность. Все эти процессы формирования нового паттерна, формирования специфической сети представляет собой энграмму памяти, которая консолидируется специфической модификацией экспресии генов. Выше было сказано, что в дорзальном стриатуме однотипная популяция средних звездчатых нейронов, которые получают возбуждающие глутаматергические сигналы от различных областей коры больших полушарий [109], вырабатывают специфический паттерн синаптической пластичности. Так как средние звездчатые нейроны тормозящие, они ГАМКергические, то эти нейроны формируют локальную нервную сеть, которая, обрабатывая сигнал, вырабатывает специфический паттерн импульсной активности для этой группы нейронов и продвигает ее дальше в бледный шар. На дендритном дереве средних звездчатых нейронов локализованы тридцать, сорок тысяч синапсов (рис. 6), некоторые авторы считают, что синапсов пятьдесят тысяч. Но мы для удобства будем считать, что этих синапсов тридцать тысяч.
Часть синапсов, будем считать пятнадцать тысяч, возбуждаются от нейронов из различных частей коры больших полушарий: нейроны зрительной коры, нейроны слуховой коры, нейроны периформной коры, нейроны сенсомоторной коры, нейроны париетальной коры и т.д. Остальные пятнадцать тысяч синапсов получают ГАМКергический тормозной сигнал от собственных коллатералей, от коллатералей соседних средних звездчатых клеток и вырабатывают паттерн алгебраической суммации. Активирующие сигналы от различных частей коры, в зависимости от условий, приходят в разное время. Одни сигналы от нейронов из различных областей коры совпадают друг с другом, а другие сигналы не совпадают, то есть являются одиночными. Экспериментально показано [54], что совпадающие сигналы вызывают длительную потенциацию, а одиночные сигналы вызывают длительную депрессию. Будем считать что пять тысяч нейронов вызывают специфический паттерн длительной потенциации. Пять тысяч нейронов вызывают длительную депрессию, ослабляя паттерн нейронов от определенных частей коры, или вообще исключая активность этих нейронов из схемы сети. А реакция остальных пяти тысяч нейронов остается неизменной. Такая мозаичная реакция популяции средних звездчатых нейронов специфически модифицирует и тормозящие синапсы, то есть тормозное влияние на соседние нейроны. Формируется специфический паттерн выходного сигнала популяции звездчатых нейронов дорзального стриатума для данных условий – энграмма, которая затем консолидируется и хранится в памяти. То есть формируется энграмма сети в пределах определенной соматотопии. Такой специфический паттерн активации в пределах определенной соматотопии, то есть энграмма передается в следующую структуру, то есть во внешние и внутренние ядра бледного шара, далее на субстанцию нигра, формируя специфические паттерны выходной активности, направленной к мышцам, то есть на реализацию целенаправленного поведения. Такая же специфическая схема сети идет в таламус, контролируя возвратный сигнал.
Таким образом, основой целенаправленного поведения является соматотопия пирамидной и экстрапирамидной системы мозга, то есть соматотопия соматосенсорной коры мозга и базальных ганглий. Основой выработки и формирования нового поведения является синаптическая пластичность, которая представляет из себя алгебраическую суммацию процессов возбуждения и торможения, Процессы синаптической пластичности включают в себя процессы кластеризации и декластеризации ГАМК и глутаматергических рецепторов, модификацию субъединичной композиции рецепторов и модификацию рецепторов через редактирование или сплайс варианты. Функционирование процессов синаптической пластичности в пределах соматотопии структур иерархической сети мозга формирует в этих структурах и, соответственно, в этих сетях специфический паттерн активности нейронов – энграмму локальной сети. Выработка специфического паттерна активности иерархических сетей мозга формирует специфическую схему внутри иерархических сетей, в пределах соматотопии. Сформированная специфическая схема иерархических сетей – энграмма, пронизывает все вовлеченные в поведение структуры мозга, с прямыми и обратными связями и консолидируется.
Реализация целенаправленного эмоционально мотивированного поведения, в том числе и энграмма, управляется и контролируется несинаптическими модуляторными системами мозга, которые формируют эмоциональные, мотивационные состояния, и эмоционально насыщенную когнитивную карту мозга. [8–11].
МОДУЛЯТОРНЫЕ НЕСИНАПТИЧЕСКИЕ СИСТЕМЫ МОЗГА И ФОРМИРОВАНИЕ ЭМОЦИОНАЛЬНЫХ И МОТИВАЦИОННЫХ СОСТОЯНИЙ
В официальном издании международного фармакологического общества (IUPHAR) [25] описаны 64 модуляторных систем, рецепторы которых связаны с G-белками, и 7 хемо-чувствительных каналов. Из них ацетилхолиновый–никотиновый канал и комплекс глутаматных ионотропных катионных рецепторов генерируют ВПСП. ГАМКА- и глициновый ионотропные рецепторы, анионный канал, генерируют ТПСП. Катионный 5-HT3 СТ-рецептор, NA+/K+/Ca2+ канал, относится к модуляторной СТ системе мозга [48], другие 13 рецепторов этой СТ системы связаны с G белками [25]. Семь рецепторов АТФ – это NA+/K+/Ca2+-каналы [25], притом, что АТФ не медиатор а ко-медиатор, он секретируется с нейромодуляторами НА, ДА и СТ [49]. Затем, после выделения, АТФ быстро расщепляется до аденозина с помощью АТФаз. А рецепторы аденазина, чисто метаботропные рецепторы, ассоциированные с G-белками [25].
Есть принципиальная разница между синаптическими медиаторными системами: ГАМК, глутамат, глицин и никотиновая–ацетилхолиновая система и модуляторными системами. Медиаторные системы передают информацию локально от точки к точке и формируют нейронную сеть. Терминали всех этих систем миелинизированы и информация (потенциал действия) передается со скоростью 50 м/с, перепрыгивая через перехваты Ранвье. Характеристики синаптической передачи: синаптическая задержка около 0.5 мс. Максимальная амплитуда постсинаптического потенциала (ПСП), достигается через 2–3 мс. Длительность ПСП, 10–15 мс [4, 117].
Тела нейронов модуляторных систем компактно локализованы в определенных структурах мозга. Нейроны ДА системы локализованы в черной субстанции, нейроны НА системы – в голубом пятне, нейроны СТ системы – в ядрах шва. Эти ядра: черная субстанция, голубое пятно и ядра шва локализованы в среднем мозге, а их длинные не миелинизированные терминали, с варикозными расширениями, доходят до коры мозга и интенсивно иннервируют ее. При нервном импульсе нейромодуляторы выделяются из варикозных расширений сразу на большую популяцию клеток. Нервный импульс движется по не миелинизированным волокнам со скоростью 0.5 м/с. Задержка метаботропной реакции от 200 до 800 мс. Если метаботропная реакция через трансдукционный сигнал индуцирует модификацию экспрессии генов, то это уже процесс консолидации памяти. Таким образом, модуляторные системы функционируют на три порядка медленее медиаторных систем [4, 117].
Можно полагать, что у животных и человека возникает следующая последовательность процессов, которая приводит к формированию эмоциональных и мотивационных состояний и к целенаправленному поведению. Потребность приводит к возникновению мотивации и к индукции мотивированного поведения [22]. Реализация мотивированного поведения и удовлетворение потребности приводит к возникновению эмоционально положительного состояния. Неудовлетворенная потребность усиливает мотивацию и вызывает эмоционально отрицательные состояния [8].
Ранее [8] были проанализированы три вида потребности: потребность есть, потребность пить и сексуальная потребность. Центры этих трех видов потребностей локализованы в гипоталамусе (рис. 1). Крайние латеральные части вентромедиального ядра гипоталамуса ответственны за жажду и голод и отвечают за контроль потребления пищи. Показано, что вентромедиальное ядро гипоталамуса (ВМЯГ) участвует в регуляции аппетита. Гипоталамус реагирует на стимулы крови, в том числе на: лептин (гормон сытости), грелин (гормон голода), ангиотензин, инсулин, гормоны гипофиза, цитокины, плазменные концентрации глюкозы, осмолярность (жажда) и т.д. Портальная вена, которая проходит в непосредственной близости от гипоталамуса не имеет гематоэнцефалического барьера, поэтому гипоталамус получает много химических сигналов, которые не проходят в другие части мозга из-за гематоэнцефалического барьера. Кроме лептина и грелина ощущение голода и сытости контролируется концентрацией инсулина и сахара в крови [8].
Потребность пить контролируется регуляцией баланса жидкости. Она возникает от недостатка жидкости и/или увеличения концентрации определенных осмолитов, таких как соль. Если объем воды в теле падает ниже определенного порога или концентрация осмолитов становится высокой, мозг получает сигналы жажды. Антидиуретический гормон – вазопрессин контролирует водный баланс и потребность пить [8].
Половая потребность зависит от таких гормонов, как тестостерон, эстроген, прогестерон, окситоцин и вазопрессин. У большинства видов млекопитающих половые гормоны контролируют способность участвовать в сексуальном поведении. Тем не менее, половые гормоны непосредственно не регулируют способность совокупляться. Скорее, половые гормоны приматов индуцируют мотивацию сексуального поведения [8].
Количество нейронов, формирующих потребность, ограничено. Сами ядра гипоталамуса, в которых локализованы эти нейроны, маленькие. Поэтому можно полагать, что нейроны пищевого, питьевого и половых центров функционируют как нейроны “бабушки”. Под нейроном “бабушки” подразумевают одиночный нейрон, активация которого вызывает, в конечном счете, активацию большого количества нейронов, точнее большой нейронной сети [126]. В гипоталамусе индукция мотивации и целенаправленного поведения маленьким количеством нейронов связана с тем, что, ядра гипоталамуса, формирующие потребности, взаимодействуют с мезо–кортико–лимбической ДА системой, которая, в свою очередь, вовлекает многие структуры от среднего мозга (вентральная тегментальная область) до областей коры головного мозга [8–11, 28, 59, 68, 90, 122, 136, 149] и индуцирует мотивированное поведение. На рис. 1 показано, что информация от дорзального стриатума приходит к дорзальным областям ядер паллидума (бледный шар) – сверху. А от прилежащего ядра (nucleus accumbens), к вентральной области ядер паллидума – снизу. Такие различия, приведенные на рис. 1, не случайны. Есть большое количество экспериментальных данных, которые показывают, что мотивационные реакции реализуются именно через вентральные области ядер паллидума, вот некоторые из них [51, 84, 86, 130, 147].
Симонов [22] определил, что “влияние эмоций на поведение подчинено принципу максимизации положительных эмоций и минимизации отрицательных”. На основании этого мы можем дать определение эмоциональных состояний. Эмоционально положительное состояние, это состояние, которое направлено на собственное продление и усиление. Эмоционально отрицательное состояние, это состояние, которое направлено на собственное ослабление или прекращение [9–11]. Именно в силу определения эмоционально положительных состояний, бесконтрольное продление и усиление этих состояний приводит к возникновению зависимости: наркотической, алкогольной, гедонической и так далее. Длительное злоупотребление наркотиками, алкоголем, сладостями приводит к модификации активности многих рецепторов и через трасдукционный сигнал, к эпигенетической модификации экспрессии генов и консолидации модифицированной активности рецепторов [9–11], что превращает эту реакцию в зависимость и заболевание.
Эмоциональные состояния формируются моноаминергическими системами мозга. К моноаминергическим системам относятся норадреналин- (НА), дофамин- (ДА) и серотонин- (СТ) эргические системы среднего мозга. Как уже указывалось выше, тела нейронов этих систем локализованы рядом друг с другом в среднем мозге, а их не миелинизированные терминали параллельно друг другу иннервируют практически одни и те же структуры мозга [9–11].
Предполагается, что основной системой, формирующей эмоционально положительные состояния, является ДА система и, в первую очередь, мезо-кортико-лимбическая ДА система. Это предположение подтверждается работами по cамостимуляции, по самовведению наркотиков, по предпочтению места введения наркотиков, этанола и никотина, по предпочтению места кормления и потребления сахарозы. Эти работы показали, что эмоционально положительные состояния формируются усилением мезо-кортико-лимбической ДА системы. В то же время уменьшение активности мезо-кортико-лимбической ДА системы вызывает депрессивные состояния, т.е. эмоционально отрицательные состояния [9–11].
НА система мозга, это стресс-реактивная система, первая реагирует на стресс. Показано, что НА система вовлечена в стрессовые и эмоционально отрицательные реакции. Проекции НА нейронов через паравентрикулярные ядра гипоталамуса (ПЯГ) вовлекаются в генерацию острых стрессовых реакций и необходимы для запуска гипоталамо-гипофизарно-надпочечниковой оси (выделение АКТГ) в течение хронического стресса. НА играет важную роль в активации ПЯГ. НА терминали непосредственно взаимодействуют с нейронами, выделяющими кортикотропин-релизинг-гормон [9–11].
СТ система мозга функционирует реципрокно ДА системе. Из этого можно заключить, что эмоционально-отрицательные состояния следует устранять, снижая уровень СТ системы. Однако известно, что купирование депрессии трициклическими антидепрессантами происходит на фоне активации СТ системы, вследствие ингибирования антидепрессантами транспортера СТ, т.е. торможения обратного захвата СТ. Трициклические антидепрессанты ингибируют также и захват НА. Но при этом показано, что антидепрессивный эффект сильнее выражен у специфических блокаторов захвата СТ по сравнению с трициклическими антидепрессантами. Анализ экспериментальных результатов позволяет сделать заключение о том, что СТ система – это система наказания. Но после выработки экспериментальной безвыходности или депрессивных состояний активация СТ системы ингибированием транспортера СТ селективными блокаторами, вызывает эмоционально положительные реакции [9–11].
Таким образом, эмоционально положительные и отрицательные реакции формируются взаимодействием и интеграцией НА, ДА и СТ системы. НА система – стресс индуцируемая система, которая ингибирует ДА систему и индуцирует депрессивные состояния. Активация ДА системы вызывает эмоционально положительную реакцию, ингибирование – отрицательную реакцию. СТ система – это буферная система, которая при нормальном функционировании ДА системы является системой наказания, но при возникновении депрессивных состояний меняет свою реакцию на противоположную и вызывает эмоционально положительную реакцию. Причем в ряде работ показано, что эта реакция опосредована через усиление ДА системы [9–11]].
Показано, что рецепторы лептина, грелина, вазопрессина, окситоцина и половых гормонов экспрессируются в ДА нейронах мезолимбической системы и индуцируют мотивированное поведение. Мезолимбическая ДА система это система формирования эмоциональных и мотивационных состояний [8–11]. Произвольное поведение, так же как и условнорефлекторное поведение реализуется через кортико-базальные сети (рис. 1). Психонервное поведение, направляемое образами внешнего мира, в отличие от рефлекторного или условнорефлекторного поведения называется произвольным [16]. При анализе условнорефлекторного поведения мы оперируем понятиями стимул или сигнал, которые двигаются через кортико-базальные сети и подключают таламо-кортикальные сети, индуцируя эмоционально мотивационные состояния через черную субстанцию и одновременно индуцируя дополнительные компоненты поведения (рис. 1). При произвольном поведении мы оперируем понятиями образов. То есть по кортико-базальным и таламо-кортикальным сетям двигаются сигналы уже интегрированных образов: слуховых, зрительных обонятельных, которые формируются в новой коре и запускают кортико-базальные сети (рис. 1). Теперь уже сформированные интеграцией образы индуцируют эмоциональные и мотивационные состояния через черную субстанцию. Можно полагать, что при условнорефлекторной деятельности также работают сформированные в новой коре образы. Но мы, почему-то, привыкли оперировать понятиями сигналы и стимулы. Я думаю, это происходит потому, что мы до конца еще не понимаем, как формируется образ. При целенаправленном мотивированном поведении мы тоже оперируем образами, которые формируются в новой коре.
Восходящая от черной субстанции ДА-ергическая активность, формирующая мотивационные эмоционально положительные или отрицательные состояния, контролируется префронтальной корой (рис. 1). Интегрирующей структурой эмоционально мотивационных состояний является прилежащее ядро (рис. 1, ПЯ). Эта структура получает эмоционально положительную и эмоционально отрицательную реакцию от гипоталамуса, хабенулы, миндалины и гиппокампа, интегрирует их и вырабатывает в скорлупе (shell) прилежащего ядра определенный рострокаудальный градиент соотношений отрицательных (передняя часть скорлупы) и положительных (хвостовая часть скорлупы) реакций (рис. 7) и выводит эту информацию в вентральную часть ядер внешнего и внутреннего паллидума (бледный шар) (рис. 1), и индуцирует целенаправленное мотивированное поведение [129]. Следовательно, и произвольное, и целенаправленное поведение реализуются через различные части одних и тех же структур базальных ганглий (дорзальная и вентральная части внутреннего и внешнего паллидума, рис. 1) [8–11].
Рис. 7.
Прилежащее ядро (Nucleus Accumbens, Shell). Выделенная темная часть на рис. а – поглощение пищи (эмоционально положительное состояние). Выделенная темная часть на рис. б – оборонительные реакции (эмоционально отрицательная). На а) крайняя левая точка 100% – положительное состояние, на б) крайняя правая точка 100% – отрицательное состояние. Между ними градиент: 100 – 0; 90 – 10; 80 – 20; … 20 – 80; 10 – 90; 0– 100%.

Градиент соотношений положительных и отрицательных реакций [129] точнее сопоставление мотивации страха и мотивации принятия пищи вдоль ростокаудального градиента представляет собой постепенное градуальное изменение этих отрицательных и положительных соотношений (рис. 7). Кроме того, вкусовые ощущения человека могут быть разложен на четыре основных: сладкое, соленое, кислое и горькое [23]. В последнее время исследователи выделяют также приятный вкус глутамата натрия, называемый по-японски umami, который существенно отличается от четырех классических вкусов [73, 92, 131]. Из перечисленных пяти вкусовых ощущений, два можно отнести к положительным ощущениям: сладкий и umami. А три остальные: соленое, кислое и горькое можно отнести к аверсивным ощущениям. Кроме того, все эти ощущения имеют степень интенсивности, от чего будет зависеть интенсивность отрицательных и положительных ощущений.
Но если вспомнить, что стриатум обладает соматотопией и функционирует нисходящими параллельными сетями, то мы можем объединить эти процессы, так как они оба объединяются на внешних и внутренних ядрах поллидума через их дорзальные и вентральные части. В зависимости от эмоционально-мотивационного состояния и его интенсивности, можно получить очень широкий спектр параллельно функционирующих нисходящих сетей, реализующих разного рода целенаправленное поведение в очень широком диапазоне эмоционально-мотивационных состояний.
Приведенная выше работа [129] показывает, что эмоционально отрицательные и положительные состояния формируются разными частями одной и той же структуры. Например, центральное ядро миндалины участвует в формировании реакции страха, в том числе и реакции “замирания”. То же самое ядро миндалины имеет отношение и к положительным пищевым реакциям. Очень интересные результаты получены при усиление экспрессии гена фосфолипазы Cγ1 (PLCγ1) в вентральной тегментальной области (ВТО). Области, где локализованы тела мезо-кортико-лимбических ДА нейронов. Было показано, что микроинъекция вирусов герпеса, несущих гены PLCγ1 в переднюю часть ВТО, вызывает эмоционально положительную реакцию, а микроинъекция тех же вирусов в хвостовую часть ВТО вызывает эмоционально отрицательную реакцию. Обе эти системы активируются одним и тем же модулятором, в данном эксперименте морфином, реакция которого опосредована также взаимодействием с ДА нейронами ВТО. Тогда почему усиление ДА системы в этой области, вызывает только эмоционально положительные состояния при реализации поведения? Можно полагать, что это связано с определением, которое мы привели выше. Эмоционально положительное состояние направлены на собственное усиление, поэтому поведение проявляется все ярче и ярче. Эмоционально отрицательное состояние направлено на собственное прекращение, поэтому поведение при эмоционально отрицательных состояниях ослабевает. Необходимы специальные исследования, чтобы их выявить. Таким образом, показано [129], что в формировании эмоционально положительных и эмоционально отрицательных состояниях большую роль играют ГАМК и глутаматные системы. Так как ГАМК и глутаматная системы медиаторные синаптические системы и передают информацию от точки к точке, то входящая отрицательная или положительная реакция зависит от специфики входящих связей. Например, после удара электрическим током, реакция отрицательная и ГАМК и глутаматергичемские системы специфически связаны с той сетью структуры мозга, которая ответственна за эмоционально отрицательные реакции. После облизывания сахара реакция положительная и ГАМК и глутаматергичемские системы специфически связаны с той сетью структуры мозга, которая ответственна за эмоционально положительные реакции. Нейромодуляторные системы модифицируют ГАМК и глутаматергические синапсы, как описано на рис. 2. И модифицируют сеть целенаправленного поведения таким образом, что поведение усиливает эмоционально положительное состояние – животное начинает поедать сахар. В другом случае сеть целенаправленного поведения модифицируются таким образом, что поведение ослабляет эмоционально отрицательное состояние – животное избегает удара тока.
РЕАЛИЗАЦИЯ ЦЕЛЕНАПРАВЛЕННОГО ПОВЕДЕНИЯ И ЭМОЦИОНАЛЬНО НАСЫЩЕННАЯ КОГНИТИВНАЯ КАРТА МОЗГА
Мотивированное целенаправленное поведение: поиск пищи, поиск воды, поиск сексуального партнера без ориентации в окружающей среде и без когнитивной карты мозга невозможно. Надо знать и помнить, как пахнет еда, как выглядит и пахнет опасность, откуда доносится запах феромонов, куда следует идти и каких кустов опасаться и так далее. Идею когнитивной карты мозга выдвинул Толман в 1948 г. Эту идею подтвердил О’Киф, открытием “клеток места” [120] и, связав ее с когнитивной картой мозга [121]. За открытие в мозгу млекопитающих “клеток места”, и клеток, отвечающих за ориентацию в пространстве “навигаторные клетки” в 2014 г. Джон О'Киф, Эдвард Мозер и Мэй-Бритт Мозер получили Нобелевскую премию по физиологии и медицине. Гиппокампальные клетки места – это специальные клетки в каждом из слоев структуры, которые разряжаются комплексной пачечной активностью, когда животное движется через определенное место в окружающей среде. Область, в которой клетки разряжаются с наибольшей частотой, это “частотное поле” или “поле места”. Внутри этого поля нейроны места могут показать максимальную частоту разрядов 20 Гц или более, вне этого поля эти нейроны разряжаются частотой 0.1 Гц. В связи с достаточным количеством клеток места, их поля в состоянии картировать или покрывать любую данную окружающую среду. Предполагается, что эти нейроны используются не только для ориентации в пространстве, а также формируют когнитивную карту, так как в дальнейшем эти нейроны вовлекаются в процессы памяти и на них могут накладываться существенные элементы и эпизоды опыта. Можно полагать, что “поле места” формируется под влиянием эмоционально- мотивационного состояния, когда животное получает пищу в одном из рукавов восьми-рукавного лабиринта, или когда крыса находит платформу в лабиринте Мориса и выходит из воды.
Большую роль в формировании когнитивной карты играют навигационные нейроны, или “нейроны сетки”, локализованные в энторинальной коре и открытые супругами Мозер и их учениками в 2005 г. [71]. Энторинальная кора – основной вход для нейронов гиппокампа. Нейроны сетки разряжаются в ответ на свободное движение животного, и перекрывают пространства, которые примерно равны по размеру и расположены в периодическом треугольнике, покрывающем все доступное поле, в котором движется животное. То есть, навигационные нейроны своими разрядами “обстреливают”, контролируют, точнее, регистрируют не сами “нейроны места”, а “частотное поле” или “поле места”. Периодический паттерн разрядов возникает независимо от конфигурации ориентиров, как в темноте, так и в присутствии видимых ориентиров, независимо от скорости и направления движения [71]. Тут необходимо отметить, что крысы ночные животные, у них слабое зрение, они лучше ориентируются по запаху.
Также в энторинальной коре обнаружены нейроны направления, которые зависят от поворота головы [см. 10, 11], и играют принципиальную роль при формировании когнитивной карты. Эти нейроны активируются, когда голова животного отворачивается от исходного направления на 45°. При этом повороте, вероятно, образ восприятия окружающего пространства, и обонятельный, и зрительный, и слуховой будет значительно меняться. Но энторинальная кора не единственное место локализации этих нейронов. Они обнаружены также в других областях головного мозга, в том числе: пост-субикулюм, ретроспленальная кора, таламус (передние и боковые дорзальные ядра таламуса), боковое маммилярное ядро, дорзальное тегментальное ядро, стриатум [см. 10, 11]. Фактически нейроны поворота головы осуществляют “мониторинг” окружающей среды и вместе с нейронами места и навигационными нейронами формируют целостный образ окружающей среды.
Исследования выявили существование нейронов времени в гиппокампе, которые реагируют активацией в ответ на протекающие друг за другом последовательные моменты в течение опыта [см. 10, 11]. Автор считает, что такое временное кодирование не может быть соотнесено с внешними событиями или пространственными измерениями опыта. Как полагает автор, эти нейроны времени представляют собой течение времени в конкретных воспоминаниях, и поэтому получили название “клетки времени”. Импульсные свойства клеток времени совпадают с импульсными свойствами гиппокампальных “клеток места”; “клетки времени”, таким образом, обеспечивают дополнительное измерение, интегрированное с пространственным отображением. Прочное представление времени и пространства в гиппокампе предполагает фундаментальный механизм для формирования пространственно-временного континииума (непрерывности) в рамках согласованных воспоминаний. Несмотря на взгляды автора, можно полагать, что клетки времени, совпадающие по особенностям функционирования с клетками места, выстраивают внешние события во временной последовательности, так как активность клеток места меняется и при изменении внешних событий. Это очень важно, так как память консолидирует временную последовательность событий, и память воспроизводится во временной последовательности. Кстати, работа этого автора, изданная в 2013 г., так и называется “Память на время” [см. 10, 11].
Современная физика определяет соотношение пространства и времени как пространственно-временной континуум, то есть непрерывность, неразрывность пространства и времени. Мы также воспринимаем непрерывность нашего трехмерного пространства (высота, ширина и глубина) и его неразрывность со временем, которая ограничена длительностью нашей жизни. Это неразрывность воспринимается лично каждым из нас и реализуется с помощью нашей памяти. Мы запоминаем и воспроизводим события в определенной последовательности и связываем эти события с определенном местом действия
Летом 2015 г. c разницей в пять дней, были напечатаны работы, проведенные в двух различных лабораториях, в них описаны нейроны скорости в медиальной энторинальной коре. Особенности этих нейронов состоят в том, что при повышении скорости бега, у крыс повышается частота разрядов этих нейронов [91, 138]. Все эти клетки гиппокампа и энторинальной коры формируют сеть с нейронами различных областей коры больших полушарий и становятся основой когнитивной карты мозга. Но есть и второй путь взаимодействия гиппокампа с корой, который приведен на рис. 8.
Рис. 8.
Кортико – гиппокампальная сеть. а) Прямые и опосредованные связи нейронов гиппокампа с корой больших полушарий мозга. Неокортекс – кора больших полушарий; Париет – париетальная кора; Сенс-мот. – сенсомоторная кора; Преф. – префронтальная кора; Слух – слуховая кора; Темпор – темпоральная кора; Зрит. кора – зрительная кора; Параги. извилина – парагиппокампальгая извилина, Парих. кора – парихинальная кора; Энторин. кора – энторинальная кора; Гран. клет. ЗФ – гранулярные клетки зубчатой фасции; СА3 – поле СА3 гиппокампа; СА1 – поле СА1 гиппокампа; Суб. – субикулюм. б) Второй путь взаимодействия гиппокампа с корой. Через таламус, таламокортикалные сети и обратно вниз, через ассоциативные зоны коры.

Объединение функций или совместное рассмотрение (рис. 1 и 8) организует, так называемый, “контекст окружающей среды”, или эмоционально насыщенную когнитивную карту мозга. Когнитивная карта становится эмоционально насыщенной, так как гиппокамп тесно контактирует с миндалиной, одной из эмоциогенных структур мозга [64, 66, 148]. Рис. 1 показывает, что любой стимул или сигнал, даже одиночный, проходящий через экстрапирамидную систему, эмоционально оценивается: хорошо это или плохо, усилить этот сигнал или ослабить. А через экстрапирамидную систему проходит вся нисходящая от коры информация.
Таким образом, с помощью эмоционально насыщенной когнитивной карты мозга животное следит за тем, что происходит в окружающем мире и в соответствии с этим модифицирует свое поведение и консолидирует его. Из этого следует, что когнитивная карта мозга управляет энграммой памяти.
ЗАКЛЮЧЕНИЕ
В этом обзоре описаны высшие функции мозга, которые объединяются в единую взаимосвязанную и интегрированную систему, через реализацию целенаправленного эмоционально мотивированного поведения и консолидации памяти. Целенаправленное поведение контролируется соматотопией мозга. Соматотопия корковой пирамидной системы известна давно, это соматотопия сенсомоторной коры. Описывается соматотопия экстрапирамидной системы мозга, соматотопия базальных ганглий и восходящих таламокортикальных сетей. Описывается возможность формирования энграммы памяти нейронами дорзального стриатума, интеграцией процессов пластичности глутаматергических и ГАМКергических синапсов, в пределах соматотопии мозга. Энграмма в пределах соматотопии, это строго специфическая нейронная сеть реализующая целенаправленное поведение. Описываются два механизма контроля энграммы памяти: контроль со стороны эмоционально мотивационных состояний и контроль со стороны эмоционально насыщенной когнитивной карты мозга. Эмоционально мотивационные состояния формируются нейромодуляторными системами мозга, точнее моноаминергическими системами среднего мозга. Взаимодействуя с ГАМК и глутаматными сиинапсами, модуляторные системы модифицируют их и консолидируют через свои метаботропные рецепторы, индуцирующие модификацию экспрессии генов. С помощью эмоционально насыщенной когнитивной карты мозга животное следит за тем, что происходит в окружающем мире и в соответствии с этим модифицирует свое поведение и консолидирует его. Из этого следует, что когнитивная карта мозга управляет энграммой памяти.
Работа выполнена при поддержке программ РАН и РФФИ, проект № 17-29-01005-офи_м.
Список литературы
Аршавский Ю.И., Гельфанд И.М., Орловский Г.Н. Мозжечок и управление ритмическими движениями. М. Наука 1984. 165 с.
Базян А.С., Гецова В.М., Орлова Н.В. Фармакологическое напоминание эмоционального состояния облегчает воспроизведение амнезированного следа памяти // Рос. Физиол. Журн. им. И.М. Сеченова. 2000. Т. 86. № 5. С. 578–587.
Базян А.С., Григорьян Г.А. Молекулярно-химические основы эмоциональных состояний и подкрепления // Успехи физиол. наук. 2006. Т. 37. № 1. С. 68–83.
Базян А.С., Сегал О.Л. Синаптические и паракринные несинаптические системы мозга млекопитающих // Нейрохимия. 2009. Т. 26. № 2. С. 93–103.
Базян А.С., Хашаев З.Х. Аллостерическая пластичность ГАМКА рецептора и внутринейрональная интеграция на уровне трансдукционного сигнала // Усп. физиол. наук. 2010. Т. 41. № 1. С. 3–25.
Базян А.С., Григорьян Г.А., Иоффе М.Е. Регуляция моторного поведения // Успехи физиол. наук. 2011. Т. 42. № 3. С. 65–80.
Базян А.С. Молекулярно-нейрохимические и нейрофизиологические механизмы пластичности: реализация поведения, обучение, консолидация, хранение и воспроизведение памяти // Усп. физиол. наук. 2013. Т. 44. № 4. С. 3–23.
Базян А.С., Рогаль А.В. Нейрохимические механизмы возникновения потребности, мотивации и целенаправленного поведения // Успехи физиол. наук. 2015. Т. 46. № 1. С. 3–21.
Базян А.С. Мотивационные и эмоциональные состояния: структурные, cистемные, нейрохимические, молекулярные и клеточные механизмы // Успехи физиол. наук. 2016а. Т. 47. № 1. С. 15–33. [PMID: 27149821]
Базян А.С. Молекулярные, клеточные и системные механизмы мотивационных и эмоциональных состояний, реализация целенаправленного поведения и эмоционально насыщенная когнитивная карта мозга // XVIII Международная научно-техническая конференция “Нейроинформатика-16": Лекции по нейроинформатике. М: НИЯУ МИФИ 2016б. С. 147–170. 224 с.
Базян А.С. Интеграция высшие функции мозга как основа когнитивности // Успехи физиол. наук. 2016в. Т. 47. № 3. С. 19–23.
Базян А.С. Сравнение бинарной модели памяти компьютера с моделью памяти в живых системах, млекопитающих // Труды конгресса по интеллектуальным системам и информационным технологиям “IS&IT’17”. Научное издание в 3 томах. Таганрог: Изд-во Ступеина С.А. 2017. Т. 2. С. 280–289.
Базян А.С. Модель Хебба и современные представления о молекулярных и клеточных механизмах памяти // XIX Международная научно-техническая конференция “Нейроинформатика-17": Сборник научных трудов. Ч. 2. М: НИЯУ МИФИ 2017. С. 149–158. 208 с.
Базян А.С. Процессы синаптической пластичности на дендритном дереве нейрона // Труды конгресса по интеллектуальным системам и информационным технологиям “IS&IT’18”. Научное издание в 3 томах. Таганрог: Изд-во Ступеина С.А. 2018. Т. 2. С. 320–327.
Базян А.С. Роль подкрепления при обучении и памяти: кодирование эмоциональных и мотивационных состояний, функции медиаторных и модуляторных систем мозга // Усп. физиол. наук. 2018. Т. 49. № 3. С. 24–40.
Бериташвили И.С. От спинномозговой координации движения до психонервной интеграции поведения // Вестник АН СССР. 1966. № 7. С. 59–67.
Блог психолога. 23. 09. 2018. http://myanceva.ru/psy/155-engramma-ili-kak-rabotaet-nasha-pamiat.html.
Блюм Ф., Лейзерсон А., Хофстедтер Л. Мозг, разум и поведение // Москва “Мир” 1988.
Мурзина Г.Б., Силькис И.Г. Модель посттетанической эффективности дендритного шипика нейрона // Биофизика. 1997. Т. 43. № 3. С. 702–710.
Силькис И.Г. О роли базальных ганглиев в формировании рецептивных полей нейронов первичной слуховой коры и механизмы их пластичности // Усп. физиол. наук. 2015а. Т. 46. № 3. С. 60–75.
Силькис И.Г. О роли базальных ганглиев в обработке сложных звуковых стимулов и слуховом внимании // Усп. физиол. наук. 2015б. Т. 46. № 3. С. 76–92.
Симонов П.В. Лекции о работе головного мозга. М. Наука: 2001. 95 с.
Смит К.Ю.М. Биология сенсорных систем. М.: БИНОМ. Лаборатория знаний, 2005.
Aflado T.S., Graciano M.S.A. Relationship between unconstrained arm movements and single-neuron firing in the macaque motor cortex // J. Neurosci. 2007. V. 27. P. 2760–2780.
Alexander S.P.H., Mathie A., Peters J.A. Guide to Receptors and Channels (GRAC), 5th edition // Brit J. Pharmacol. 2011. V. 164. Sappl. 1. P. S1–S324.
AMPA Receptors 24.09.2018 // http://www.bristol.ac.uk/synaptic/receptors/ampar/.
Arancibia-Cárcamo I.L., Kittler J.T. Regulation of GABA(A) receptor membrane trafficking and synaptic localization // Pharmacol. Ther. 2009. V. 123 № 1. P. 17–31.
Aubele T., Kritzer M.F. Androgen influence on prefrontal dopamine systems in adult male rats: localization of cognate intracellular receptors in medial prefrontal projections to the ventral tegmental area and effects of gonadectomy and hormone replacement on glutamate-stimulated extracellular dopamine level // Cereb Cortex. 2012. V. 22. № 8. P. 1799–1812.
Bannai H., Lévi S., Schweizer C. et al. Activity-dependent tuning of inhibitory neurotransmission based on GABAAR diffusion dynamics // Neuron. 2009. V. 62. № 5. P. 670–682.
Barberis A., Petrini E.M., Mozrzymas J.W. Impact of synaptic neurotransmitter concentration time course on the kinetics and pharmacological modulation of inhibitory synaptic currents // Front. Cell. Neurosci. 2011. 5: 6. doi 10.3389/fncel.2011.00006
Bashir Z.I., Bortolotto Z.A., Davies C.H. et al. Induction of LTP in the hippocampus needs synaptic activation of glutamate metabotropic receptors // Nature. 1993. V. 363. № 6427. P. 347–350.
Bazyan A.S., Getsova V.M., Orlova N.V. Haloperidol catalepsy consolidation in the rat as a model of neuromodulatory integration // Neurosci. 2000. V. 99. № 2. P. 279–288.
Bazyan A.S., Zhulin V.V., Karpova M.N. et al. Long-term reduction of benzodiazepine receptor density in the rat cerebellum by acute seizures and kindling and its recovery six months later by a pentylenetetrazole challenge // Brain Res. 2001a. V. 888. № 2. P. 212–220.
Bazyan A.S., Getsova V.M., Orlova N.V. Pharmacological reminder of emotional state the retrieval of traces from amnesic memory // Neurosci. Behav. Physiol. 2001б. V. 31. № 5. P. 509–515.
Bazyan A.S. Two types of epilepsy models and processes of cognition: Pentylenetetrazole kindling and absence epilepsy of WAG/Rij rats strain // In: “Underlying Mechanisms of Epilepsy”, Ed., Kaneez F.S. Rijeka, Croatia. In Tech, 2011. P. 283–302.
Bazyan A.S. Research Topic. Allosteric plasticity of GABAA-receptors // Frontiers in Cellular Neuroscience. 2013. http://www.frontiersin.org/cellular_neuroscience/researchtopics/Allosteric_plasticity_of_GABAA_1/2048.
Bear M.F., Malenka R.C. Synaptic plasticity: LTP and LTD // Current Opin Neurobiol. 1994. V. 4. № 3. P. 389–399.
Belkhiria C., Driss T., Habas C. et al. Exploration and identification of cortico-cerebellar-brainstem closed loop during a motivational-motor task: an fMRI study // Cerebellum. 2017. V. 16. № 2. P. 326–339.
Bellone C., Luscher C. Cocaine triggered AMPA receptor redistribution is reversed in vivo by mGluR-dependent long-term depression // Nat. Neurosci. 2006. V. 9. № 5. P. 636–641.
Barnard E.A., Skolnick P., Olsen R.W. et al. International Union of Pharmacology. XV. Subtypes of γ-Aminobutyric AcidA Receptors: Classification on the Basis of Subunit Structure and Receptor Function // Pharmacol. Rev. 1998. V. 50. № 2. P. 291–313.
Benke T.A., Lüthi A., Isaac J.T., Collingridge G.L. Modulation of AMPA receptor unitary conductance by synaptic activity // Nature. 1998. V. 393. № 6687. P. 793–797.
Benke D., Möhler H. Benzodiazepine binding to GABA(A) receptors // Curr Protoc Pharmacol. 2006 Dec; Chapter 1: Unit 1.16. doi 10.1002/0471141755.ph0116s35
Bogdanov Y., Michels G., Armstrong-Gold C. et al. Synaptic GABAA receptors are directly recruited from their extrasynaptic counterparts // EMBO J. 2006. V. 25. № 18. P. 4381–4389
Bonnert T.P., McKernan R.M., Farrar S. et al. Theta, a novel gamma-aminobutyric acid type A receptor subunit // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 17. P. 9891–9896.
Bortolotto Z.A., Clarke V.R., Delany C.M et al. Kainate receptors are involved in synaptic plasticity // Nature. 1999. V. 402. № 6759. P. 297–301.
Bredt D.S., Nicoll R.A. AMPA Receptor Trafficking at Excitatory Synapses. // Neuron. 2003. V. 40. № 2. P. 361–379.
Burt D.R., Kamatchi G.L. GABAA receptor subtypes: from pharmacology to molecular biology // FASEB J. 1991. V. 5. № 14. P. 2916–2923.
Bunin M.A., Wightman R.M. Paracrine neurotransmission in the CNS: involvement of 5-HT // Trends Neurosci. 1999 V. 22. № 9. P. 377–382.
Burnstock G., Krügel U., Abbracchioc M.P., Illes P. Purinergic signaling: From normal behavior to pathological brain function // Prog. Neurobiol. 2011. V. 95. № 2. P. 229–274.
Caetano-Anollés K., Rhodes J.S. et al.Cerebellum transcriptome of mice bred for high voluntary activity offers insights into locomotor control and reward-dependent behaviors // PLoS One. 2016; 11(11): Nov 28. doi 10.1371/journal.pone.0167095
Castro D.C., Cole S.L., Berridge K.C. Lateral hypothalamus, nucleus accumbens, and ventral pallidum roles in eating and hunger: interactions between homeostatic and reward circuitry // Front Syst Neurosci. 2015 Jun 15; 9:90. eCollection 2015. doi 10.3389/fnsys.2015.00090
Charych E.I., Yu W., Miralles C.P. et al. The brefeldin A-inhibited GDP/GTP exchange factor 2, a protein involved in vesicular trafficking, interacts with the beta subunits of the GABA receptors // J. Neurochem. 2004. V. 90. № 1. P. 173–189.
Chhatwal J.P., Myers K.M., Ressler K.J., Davis M. Regulation of gephyrin and GABAA receptor binding within the amygdala after fear acquisition and extinction // J. Neurosci. 2005. V. 25. № 2. P. 502–506.
Citri A., Malenka R.C. Synaptic plasticity: Multiple forms, functions, and mechanisms // Neuropsychopharmacol. 2008. V. 33. № 1. P. 18–41.
Clem R.L., Barth A. Pathway-specific trafficking of native AMPARs by in vivo experience // Neuron. 2006. V. 49. № 5. P. 663–670
Collingridge G.L., Isaac J.T., Wang Y.T. Receptor trafficking and synaptic plasticity // Nat. Rev. Neurosci. 2004. V. 5. № 12. P. 952–962.
Connolly C.N., Kittler J.T., Thomas P. et al. Cell surface stability of gamma-aminobutyric acid type A receptors. Dependence on protein kinase C activity and subunit composition // J. Biol. Chem. 1999. V. 274. № 51. P. 36565–36572
D'Angelo E., Casali S. Seeking a unified framework for cerebellar function and dysfunction: from circuit operations to cognition // Front. Neural Circuits. 10 January 2013 |http://dx.org/10.3389/fncir.2012.00116.
Delaere F., Akaoka H., De Vadder F., Duchampt A., Mithieux G. Portal glucose influences the sensory, cortical and reward systems in rats // Eur. J. Neurosci. 2013. V. 38. № 10. P. 3476–3486.
DeLorey T.M., Olsen R.W. Gamma-aminobutyric acidA receptor structure and function // J. Biol. Chem. 1992. V. 267. № 24. P. 16747–16750.
Diedrichsen J., Verstynen T., Lehman S.L., Ivry R.B. Cerebellar involvement in anticipating the consequences of self-produced actions during bimanual movements // J. Neurophysiol. 2005. V. 93. P. 801–812.
Diener H.C., Dichgans J., Guschlbauer B. et al. Associated postural adjustments with body movement in normal subjects and patients with parkinsonism and cerebellar disease // Rev. Neurol. (Paris). 1990. V. 146. P. 555–563.
Durand G.M., Kovalchuk Y., Konnerth A. Long-term potentiation and functional synapse induction in developing hippocampus // Nature. 1996. V. 381. № 6577. P. 71–75.
Esber G.R., Holland P.C. The basolateral amygdala is necessary for negative prediction errors to enhance cue salience, but not to produce conditioned inhibition // Eur J Neurosci. 2014. V. 40. № 9. P. 3328–3337.
Evarts E.V. Relation of pyramidal tract activity to force exerted during voluntary movement // J. Neurophysiol. 1968. V. 31. № 1. P. 14–27.
Fernando A.B.P., Murray J.E., Milton A.L. The amygdala: securing pleasure and avoiding pain // Front Behav Neurosci. 2013. 7: 190. doi 10.3389/fnbeh.2013.00190
Flaherty A.W., Graybiel A.M. Corticostriatal transformations in the primate somatosensory system. Projections from physiologically mapped body-part representations // J. Neurophysiol. 1991. V. 66. P. 1249–1263.
Frank G.K., Oberndorfer T.A., Simmons A.N. et al. Sucrose activates human taste pathways differently from artificial sweetener // Neuroimage. 2008. V. 39. № 4. P. 1559–1569.
Frenkel M.Y., Sawtell N.B., Diogo A.C. et al. Instructive effect of visual experience in mouse visual cortex // Neuron. 2006. V. 51. № 3. P. 339–349
Jacob T.C., Moss S.J., Jurd R. GABAA receptor trafficking and its role in the dynamic modulation of neuronal inhibition // Nat Rev Neurosci. 2008. V. 9. № 5. P. 331–343.
Hafting T., Fyhn M., Molden S., Moser M.B., Moser E.I. Microstructure of a spatial map in the entorhinal cortex // Nature. 2005. V. 436. № 7052. P. 801–806.
Harvey K., Duguid I.C., Alldred M.J. et al. The GDP-GTP exchange factor collybistin: an essential determinant of neuronal gephyrin clustering. // J. Neurosci. 2004. V. 24. № 25. P. 5816–5826.
Hajeb P., Jinap S. Umami taste components and their sources in Asian foods // Crit Rev Food Sci Nutr. 2015. V. 55. № 6. P. 778–91. doi 10.1080/10408398.2012.678422
Hebb D.O. The organization of behavior. a neuropsychological theory. New York: Wiley and Sons. 1949.
Huganir R.L., Nicoll R.A. AMPARs and synaptic plasticity: the last 25 years // Neuron. 2013. V. 80. № 3. P. 704–717.
Ionotropic glutamate receptor nomenclature // http://www.bristol.ac.uk/synaptic/receptors/nomenclature/.
Isaac J.T., Nicoll R.A., Malenka R.C. Evidence for silent synapses: implications for the expression of LTP // Neuron. 1995. V. 15. № 2. P. 427–434.
GABAA receptor // https://en.wikipedia.org/wiki/GABAA_receptor#cite_note-12#cite_note-12.
Georgopoulos A.P., Kalaska J.F., Caminiti R., Massey J.T. On the relations between the direction of two-dimensional arm movements and cell discharge in primate motor cortex // J. Neurosci. 1982. № 2. P. 1527–1537.
Georgopoulos A.P., Ashe J., Smyrnis N., Taira M. The motor cortex and the coding of force // Science. 1992. V. 256. P. 1692–1695.
Ghasemzadeh M.B., Vasudevan P., Giles C. et al. Glutamatergic plasticity in medial prefrontal cortex and ventral tegmental area following extended-access cocaine self-administration // Brain Res. 2011. V. 1413. № 1. P. 60–71
Graciano M.S.A., Taylor C.S.R., Moore T. Complex movements evoked by microstimulation of precentral cortex // Neuron. 2002. V. 34. P. 841–851.
Greengard P., Allen P.B., Nairn A.C. Beyond the dopamine receptor: the darpp-32/protein phosphatase-1 cascade // Neuron, 1999. V. 23. № 3. P. 435–447.
Khoo A.T., Gibson G.D., Prasad A.A., McNally G.P. Role of the striatopallidal pathway in renewal and reacquisition of alcohol seeking // Behav Neurosci. 2015. V. 129. № 1. P. 2–7.
Kainate Receptors and synaptic plastisity 29.09.2018 // http://www.bristol.ac.uk/synaptic/receptors/kar/plasticity/.
Kemppainen H., Raivio N., Kiianmaa K. Role for ventral pallidal GABAergic mechanisms in the regulation of ethanol self-administration // Psychopharmacol. (Berl). 2012. V. 223. № 2. P. 211–121.
Kins S., Betz H., Kirsch J. Collybistin, a newly identified brain-specific GEF, induces submembrane clustering of gephyrin // Nat Neurosci. 2000. V. 3. № 1. P. 22–29.
Kleim J.A., Freeman J.H., Jr., Bruneau R. et al. Synapse formation is associated with memory storage in the cerebellum // Proc. Natl. Acad. Sci. USA. 2002. V. 99. № 20. P. 13228–13231.
Kittler J.T., Thomas P., Tretter V. et al. Huntingtin-associated protein 1 regulates inhibitory synaptic transmission by modulating gamma-aminobutyric acid type A receptor membrane trafficking // Proc. Natl. Acad. Sci. USA 2004. V. 101. № 34. P. 12736–12741.
Kritzer M.F., Creutz L.M. Region and sex differences in constituent dopamine neurons and immunoreactivity for intracellular estrogen and androgen receptors in mesocortical projections in rats // J. Neurosci. 2008. V 28. № 38. P. 9525–9535.
Kropff E., Carmichael J.E., Moser M.B., Moser E.I. Speed cells in the medial entorhinal cortex // Nature. 2015. V. 523. № 7561. P. 419–424.
Kurihara K. Umami the fifth basic taste: history of studies on receptor mechanisms and role as a food flavor // Biomed. Res. Int. 2015. doi 10.1155/2015/189402
Kurotani T., Yamada K., Yoshimura Y., Crair M.C., Komatsu Y. State-dependent bidirectional modification of somatic inhibition in neocortical pyramidal cells // Neuron. 2008. V. 57. № 6. P. 905–916.
Lauri S.E., Bortolotto Z.A., Bleakman D. et al. A critical role of a facilitatory presynaptic kainate receptor in mossy fiber LTP // Neuron. 2001. V. 32. № 4. P. 697–709.
Lauri S.E., Delany C.J., Clarke V.R. Synaptic activation of a presynaptic kainate receptor facilitates AMPA receptor-mediated synaptic transmission at hippocampal mossy fibre synapses // Neuropharmacol. 2001. V. 41. № 8. P. 907–915.
Lauri S.E., Bortolotto Z.A., Nistico R. A role for Ca2+ stores in kainate receptor-dependent synaptic facilitation and LTP at mossy fiber synapses in the hippocampus // Neuron. 2003. V. 39. № 2. P. 327–341.
Lee H.K., Takamiya K., Han J.S. et al. Phosphorylation of the AMPA receptor GluR1 subunit is required for synaptic plasticity and retention of spatial memory // Cell. 2003. V. 112. № 5. P. 631–643.
Liao D., Hessler N.A., Malinow R. Activation of postsynaptically silent synapses during pairing-induced LTP in CA1 region of hippocampal slice // Nature. 1995. V. 375. № 2. P. 427–434.
Linden D.J. Long-term synaptic depression in the mammalian brain // Neuron. 1994 V. 12. № 3. P. 457–472.
Lu H.C., She W.C., Plas D.T. et al. Adenylyl cyclase I regulates AMPA receptor trafficking during mouse cortical ‘barrel’ map development // Nat. Neurosci. 2003. V. 6. № 9. P. 939–947.
Luscher B., Fuchs T., Kilpatrick C.L. GABAAR trafficking – mediated plasticity of inhibitory synapses // Neuron. 2011. V. 70. № 3. P. 385–409.
Mabb A.M., Ehlers M.D. Ubiquitination in postsynaptic function and plasticity // Annu. Rev. Cell Dev. Biol. 2010. V. 26. P. 179–210
Macdonald R.L., Olsen R.W. GABAA-receptor channels // Annu. Rev. Neurosci. 1994. V. 17. P. 569–602.
Malenka R.C., Nicoll R.A. NMDA-receptor-dependent synaptic plasticity: multiple forms and mechanisms // Trends in Neurosci. 1993. V. 16 № 12. P. 521–527.
Malinow R., Malenka R.C. AMPA receptor trafficking and synaptic plasticity // Annu. Rev. Neurosci. 2002. V. 25. P. 103–126.
Marsden K.C., Beattie J.B., Friedenthal J., Carroll R.C. NMDA receptor activation potentiates inhibitory transmission through GABA receptor–associated protein-dependent exocytosis of GABA(A) receptors // J. Neurosci. 2007. V. 27. № 52. P. 14326–14337
Medical Physiology. 2018. http://www.brainkart.com/subject/Medical-Physiology_250/.
Mehta A.K., Ticku M.K. An update on GABAA-receptors // Brain Res. Rev. 1999. V. 29. № 2–3. P. 196–217.
Mink J.W. The basal ganglia // Fundamental neuroscience. 2nd ed. Scuire L.R., Bloom F.T., McConnell S.C., Roberts J.L., Spitzer N.C., Zigmond M.J. eds. Elsevier Science.: Academic Press. 2003. P. 815–839.
More J.C., Nistico R., Dolman N.P. et al. Characterisation of UBP296: a novel, potent and selective kainate receptor antagonist // Neuropharmacol. 2004. V. 47. № 1. P. 46–64.
Moreno-Rius J., Miquel M. The cerebellum in drug craving // Drug Alcohol Depend. 2017. V. 173. P. 151–158.
Morrow A.L., Porcu P., Boyd K.N., Grant K.A. Hypothalamic-pituitary-adrenal axis modulation of GABAergic neuroactive steroids influences ethanol sensitivity and drinking behavior // Dialogues Clin. Neurosci. 2006. V. 8. № 4. P. 463–477.
Moulton E.A., Elman I., Becerra L.R., Goldstein R.Z., Borsook D. The Cerebellum and addiction: insights gained from neuroimaging research // Addict Biol. 2014. V. 19. № 3. P. 317–331.
Muir J., Arancibia-Carcamo I.L., Macaskill A.F. et al. NMDA-receptors regulate GABAA receptor lateral mobility and clustering at inhibitory synapses through serine 327 on the gamma2 subunit // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 38. P. 16679–16684.
Nambu A. Somatotopic organization of the primate basal ganglia // Front. Neuroanat. 2011; 5: 26. doi 10.3389/fnana.2011.00026
Nahmani M., Turrigiano G.G. Deprivation-induced strengthening of presynaptic and postsynaptic inhibitory transmission in layer 4 of visual cortex during the critical period // J. Neurosci. 2014. V. 34. № 7. P. 2571–2582.
Nicoll R.A., Malenka R.C., Kauer J.A. Functional comparison of neurotransmitter receptor subtypes in mammalian central nervous system // Physiol. Rev. 1990. V. 70. № 2. P. 513–565.
NMDA Receptor. 29.09.2018. // http://www.bristol.ac.uk/synaptic/receptors/nmdar/.
Nusser Z., Hájos N., Somogyi P., Mody I. Increased number of synaptic GABA(A) receptors underlies potentiation at hippocampal inhibitory synapses // Nature. 1998. V. 395. № 6698. P. 172–177.
O'Keefe J., Dostrovsky J. The hippocampus as a spatial map: preliminary evidence from unit activity in the freely moving rat // Brain Res. 1971. V. 31. № 1. 171–175.
O'Keefe J., Nadel L. The Hippocampus as a Cognitive Map, Oxford: Oxford U.P. 1978.
Olsen R.W., Tobin A.J. Molecular Biology of GABAA receptors // FASEB J., 1990. V. 4. № 5. P. 1469–1480.
Orlando M., Ravasenga T., Petrini E.M. et al. Correlating fluorescence and high-resolution scanning electron microscopy (HRSEM) for the study of GABAA receptor clustering induced by inhibitory synaptic plasticity // Sci. Rep. 2017; 7: 13768. doi 10.1038/s41598-017-14210-5
Petrini E.M., Ravasenga T., Hausrat T.J. et al. Synaptic recruitment of gephyrin regulates surface GABAA receptor dynamics for the expression of inhibitory LTP // Nat. Commun. 2014. 5. 3921. doi 10.1038/ncomms4921
Petrini E.M., Barberis A. Diffusion dynamics of synaptic molecules during inhibitory postsynaptic plasticity // Front. Cell Neurosci. 2014. 8. 300. doi 10.3389/fncel.2014.00300
Quiroga R.Q., Reddy L., Kreiman G., Koch C., Fried I. Invariant visual representation by single neurons in the human brain // Nature. 2005. V. 435. № 7045. P. 1102–1107.
Plant K., Pelkey K.A., Bortolotto Z.A. et al. Transient incorporation of native GluR2-lacking AMPA receptors during hippocampal long-term potentiation // Nat. Neurosci. 2006. V. 9. № 5. P. 602–604.
Renner M., Choquet D., Triller A. Control of the postsynaptic membrane viscosity // J. Neurosci. 2009. V. 29. № 9. P. 2926–2937
Reynolds S.M., Berridge K.C. Glutamate motivational ensembles in nucleus accumbens: rostrocaudal shell gradients of fear and feeding // Eur. J. Neurosci. 2003. V. 17. № 10. P. 2187–2200.
Simon M.J., Higuera-Matas A., Roura-Martinez D. et al. Changes in D1 but not D2 dopamine or mu-opioid receptor expression in limbic and motor structures after lateral hypothalamus electrical self-stimulation: A quantitative autoradiographic study // Neurobiol. Learn. Mem. 2016. V. 127. P. 17–26.
Singh P.B., Hummel T., Gerber J.C., Landis B.N., Iannilli E. Cerebral processing of umami: A pilot study on the effects of familiarity // Brain Res. 2015. V. 1614. P. 67–74. doi 10.1016/j.brainres.2015.04.019
Scimemi A. Plasticity of GABA transporters: an unconventional route to shape inhibitory synaptic transmission // Front. Cell Neurosci. 2014a; 8: 128. Published online. doi 10.3389/fncel.2014.00128
Scimemi A. Structure, function, and plasticity of GABA transporters // Front Cell Neurosci. 2014b; 8: 161. Published online. doi 10.3389/fncel.2014.00161
Sheng M., Kim M.J. Postsynaptic signaling and plasticity mechanisms // Science. 2002. V. 298. № 5594. P. 776–780.
Schofield P.R., Darlison M.G., Fujita N. et al. Sequence and functional expression of the GABA-A receptor shows a ligand-gated receptor superfamily // Nature. 1987. V. 328. № 6127. P. 221–227.
Schur E.A., Kleinhans N.M., Goldberg J. et al. Activation in brain energy regulation and reward centers by food cues varies with choice of visual stimulus // Int. J. Obes (Lond) 2009. V. 33 № 6. P. 653–661.
Song I., Huganir R.L. Regulation of AMPA receptors during synaptic plasticity // Trends Neurosci. 2002. V. 25. № 11. P. 578–588.
Sun C., Kitamura T., Yamamoto J., Martin J. et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells // Proc. Natl. Acad Sci USA. 2015. V. 112. № 30. P. 9466–9471.
Terashima A., Cotton L., Dev K.K. et al. Regulation of synaptic strength and AMPA receptor subunit composition by PICK1 // J. Neurosci. 2004. V. 24. № 23. P. 5381–5390.
Therrien A.S., Wolpert D.M. Effective reinforcement learning following cerebellar damage requires a balance between exploration and motor noise // Brain. 2016. V. 139. № 1. P. 101–114.
Todorov E., Jordan M.I. Optimal feedback control as a theory of motor coordination // Nat. Neurosci. 2002. V. 5. № 11. P. 1226–1235.
Tretter V., Revilla-Sanchez R., Houston C. et al. Deficits in spatial memory correlate with modified gamma-aminobutyric acid type A receptor tyrosine phosphorylation in the hippocampus // Proc. Natl. Acad. Sci. USA 2009. V. 106. № 47. P. 20039–20044.
Tsumoto T. Long-term potentiation and long-term depression in the neocortex // Prog. Neurobiol. 1992. V. 39. № 2. P. 209–328.
Vale C., Pomes A., Rodriguez-Farre E., Sunol C. Allosteric interactions between gamma-aminobutyric acid, benzodiazepine and picrotoxinin binding sites in primary cultures of cerebellar granule cells. Differential effects induced’ by gamma- and delta- hexachlorocyclohexane // Eur. J. Pharmacol. 1997. V. 319. № 2–3. P. 343–353.
Vithlani M., Terunuma M., Moss S.J. The dynamic modulation of GABA(A) receptor trafficking and its role in regulating the plasticity of inhibitory synapses // Physiol. Rev. 2011. V. 91. № 3. P. 1009–1022.
Whiting P.J., McAllister G., Vassilatis D. Neural restricted RNA splicing regulates the expression of a novel GABAA-receptor subunit conferring atypical functional properties // J. Neurosci. 1997. V. 17. P. 5027–5037.
Wydra K., Golembiowska K., Zaniewska M., Kamińska K., Ferraro L., Fuxe K., Filip M. Accumbal and pallidal dopamine, glutamate and GABA overflow during cocaine self-administration and its extinction in rats // Addict Biol. 2013. V. 18. № 2. P. 307–24.
Wu M., Kujawa A., Lu L.H., Fitzgerald D.A. et al. Age-related changes in amygdala-frontal connectivity during emotional face processing from childhood into young adulthood // Hum Brain Mapp. 2016. [Epub ahead of print] doi 10.1002/hbm.23129
Zheng H., Townsend R.L., Shin A.C. et al. High-fat intake induced by mu-opioid activation of the nucleus accumbens is inhibited by Y1R-blockade and MC3/4R-stimulation // Brain Res. 2010. V. 1350. P. 131–138.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


