Успехи физиологических наук, 2019, T. 50, № 2, стр. 15-30
От нейрональной модели целенаправленного поведения к моделированию систем искусственного интеллекта
С. В. Альбертин *
ФГБУН Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: salber1@rambler.ru
Поступила в редакцию 13.05.2018
Аннотация
В статье рассматриваются возможности разработки и использования нейрональных моделей целенаправленного поведения животных при создании систем искусственного интеллекта и нейроимплантатов при лечении нейродегенеративных заболеваний мозга. Анализируются проблемы микрочипирования структур мозга, играющих определяющую роль в формировании памяти и самосознания человека. Обсуждаются психологические, социальные и этические последствия разработки новейших когнитивных технологий.
ВВЕДЕНИЕ
Успехи биологии и медицины в создании и последующем вживлении искусственно смоделированных и изготовленных из биологически совместимых материалов различных тканей организма (костной, покровной, соединительной), биологически активных веществ (плазма крови, гормоны и т.п.), органов (искусственные почка, сердце, хрусталик и роговица глаза и т.д.) – широко используются при лечении различных заболеваний и компенсации утраченных функций организма. Моделирование широко применяется в хирургии при протезировании опорно-двигательной аппарата, в челюстно-лицевой и пластической хирургии, связанной с исправлением различных дефектов и достижения требуемых косметических эффектов, восстановлении дефектов опорно-двигательного аппарата, утраченного слуха и зрения, или компенсации их функций с помощью разработанных инновационных технологий [9, 15, 16, 97].
В последние годы наблюдается резкий рост исследований, направленный на моделирование и производство не только отдельных синтетических органов и тканей, но и на конструирование искусственно созданных автономных устройств: биоподобных электромеханических роботов, способных к обучению, ориентации в пространстве, целеполаганию и целенаправленному поведению [25, 32, 59, 77, 81], а также биогибридных систем, совмещающих интеллектуальные возможности человека и искусственно созданных устройств - нейроимплантов [27, 34, 37, 44, 50, 96].
МОДЕЛИРОВАНИЕ И СОЗДАНИЕ БИОПОДОБНЫХ АВТОНОМНЫХ УСТРОЙСТВ
При создании биоподобных автономных устройств исследователи, обычно, используют нейрональные модели целенаправленного поведения, выполненные на животных. Эти модели позволяют исследовать нейрофизиологические механизмы, стратегию и тактику поведения испытуемых (при изменении условий реагирования), сетевую архитектуру и алгоритм осуществления отдельных поведенческих актов, а на их основе конструируют биоподобных и антропоморфных роботов, способных копировать адаптивное поведение различных видов животных [25, 32, 38, 59–61, 81].
Одной из популярных моделей является нейрональная модель избегательного поведения крыс в водном бассейне, которая основана на поиске животными, помещаемыми бассейн, местонахождения погруженной в воду безопасной платформы, определяемой с помощью экстралабиринтных навигационных знаков – лабиринт Морриса [70]. Используя результаты анализа нейрональной активности гиппокампа и энторинальной коры, регистрируемой при осуществлении поискового поведения крыс в водном лабиринте Морриса, а также архитектуры и алгоритма осуществления отдельных поведенческих актов Кричмар с сотрудниками [60, 61] создали сетевую нейроморфную модель целенаправленного поискового поведения. На основе этой модели авторы сконструировали электромеханического биоподобного робота “Darwin X”, оснащенного сенсорными датчиками, который был предназначен находить в условиях так называемой сухой версии лабиринта скрытую (hidden) платформу с помощью внешних зрительных ориентиров, копируя целенаправленное поведение подопытных животных в водных лабиринтах. Нейроморфная модель целенаправленного поведения в водном лабиринте Морриса, использованная Кричмаром с сотрудниками [60, 61], показала принципиальную возможность создания биоробота, способного к правильному решению поисковой задачи при использовании, так называемой, сухой версии лабиринта. Однако исходная поведенческая модель поискового поведения в водном лабиринте, используемая на животных при определении сетевой архитектуры и алгоритма поведенческих актов, необходимых для создания нейроморфной модели целенаправленного поведения, имеет следующие недостатки, которые ограничивают ее применение при конструировании и дальнейшем совершенствовании биоподобных автономных устройств.
1. Условия обучения и тестирования животного (water Morris maze) и созданного на его основе биоробота (dry-version space task) имеют значительные различия, которые затрудняют корректное сравнение регистрируемых параметров поведения и взаимную экстраполяцию полученных результатов исследований.
2. При тестировании крыс с использованием водного лабиринта Морриса у животных наблюдаются выраженные индивидуальные, видовые (крысы, мыши) и генотипические различия регистрируемых нейрофизиологических и поведенческих показателей [86]. При этом многие исследователи отмечали у подопытных животных развитие выраженных стрессорных реакций [20, 46, 52], что может изменять нормальное восприятие предъявляемых навигационных сигналов и, как следствие, влиять на выбор и осуществление адекватного поведения.
3. Применение аверсивных водных лабиринтов может вызывать у животных патологические изменения регистрируемой нейрональной активности гиппокампа и связанных с ним структур мозга. Это может существенно искажать нормальную картину реагирования нейрональной сети, алгоритм и маршруты выполняемых поисковых реакций животных, что затрудняет создание биологически полноценной нейроморфной модели поискового поведения подопытного животного, необходимой для конструирования биоподобных роботов.
4. Использование водных лабиринтов позволяет моделировать лишь однозначное, строго детерминированное целенаправленное поведение, которое направлено на избегание аверсивного воздействия. Но оно исключает возможность усложнять условия проведения эксперимента, требующего от животных адаптивно применять разные тактики мотивированного поведения при решении поисковой задачи, которые возможны в условиях подкрепляемого пищевого поведения с выбором одного из различных видов предлагаемых вознаграждений.
С целью устранения вышеуказанных ограничений, в Национальном Центре Научных Исследований Франции (CNRS) и Институте физиологии им. И.П. Павлова РАН, была предложена альтернативная нейрональная модель адаптивного поискового поведения животных. Она была разработана при исследовании поискового поведения крыс в радиальном лабиринте с дифференцированным пищевым подкреплением [22–24, 94]11. Важным обстоятельством является также то, что радиальные лабиринты успешно используется для исследования целенаправленного поведения в пространстве, как животных, так и человека [29, 76].
В соответствии с разработанной моделью адаптивного поискового поведения, подопытные животные крысы (линии Long Evans) были обучены заходить в один из отсеков 4-х рукавного радиального лабиринта. Каждый из отсеков был оснащен кормушкой для подачи в жидком виде подкрепления (вода, молоко) и электрической лампочкой, включение которой осуществлялось при выходе крысы на центральную площадку лабиринта и являлось пусковым условным сигналом для захода животного в подкрепляемый рукав (pavlovian stimulus/response). Выбор животным правильного (освещенного) рукава приводил к подаче дифференцированного подкрепления, при этом в 3-х рукавах крысы получали по 1-ой капле, а в одном рукаве – 5 капель подкрепления, которые подавались в дискретном режиме в центральный локус кормушки (последовательно по 1-ой капле, интервал между каплями 1–5 с). Подача каждой капли подкрепления сопровождалась щелчками соленоида, воспринимаемыми подопытным животным. В отдельной серии экспериментов максимальное подкрепление подавалось одновременно, по 1-ой капле в пяти раздельных локусах кормушки, хорошо видимых животным при подходе к кормушке. Порядок включения внутри лабиринтных зрительных сигналов (лампочек) осуществлялся в случайном порядке.
Ошибочные ответы (заходы в неосвещенные отсеки) и попытки повторного подхода подопытных животных к одной и той же поилке без выхода на центральную площадку лабиринта не подкреплялись. Способность подопытных крыс к запоминанию местоположения в пространстве отсека с наибольшим 5 капель подкреплением, тестировалась с помощью серии пробных тестов (probe trials) – одновременным включением зрительных условных сигналов (лампочек) во всех 4-х рукавах лабиринта, когда животным предоставляли возможность получить подкрепление в любом рукаве лабиринта. Одновременное включение всех лампочек служило для животных сигналом для изменения стратегии поведения (set shifting strategy). заключающейся в переходе от реагирования на включение одного из внутрилабиринтных раздражителей – pavlovian stimulus/response, так называемое model free behavior [36], к поиску предпочитаемого подкрепления в лабиринте с помощью конфигурации (модели) навигационных знаков – хорошо видимых геометрических фигур, которые нанесены на внутреннюю поверхность ширмы, установленной вокруг лабиринта – model based behavior [36]. Поисковое поведение у подопытных животных тестировалось при наличии полного комплекта навигационных знаков, при фрагментарном восприятии навигационных ориентиров для тестирования способности к инвариантному восприятию сенсорных сигналов – Invariant behavior, а также при увеличении временной отсрочки при подаче наибольшего подкрепления – Response inhibition. Условнорефлекторные переделки (reversal learning), связанные с изменением местоположения максимального подкрепления в рукавах лабиринта, проводились ежедневно, утром, после ночного отдыха животного.
Проведенные исследования показали, что интактные животные в 80–90% тестируемых пробах при одновременном включении локальных зрительных сигналов выбирали рукав лабиринта с наибольшим подкреплением [22, 23]. При этом показано, что выбор наибольшего подкрепления у подопытных животных сопровождался синхронизацией нейрональной активности прилежащего ядра (n. accumbens) и гиппокампа в тета-диапазоне [24, 94]. В отдельной серии экспериментов проводили обучение животных с дифференцированным (1, 3, 5, 7 капель) подкреплением, подаваемым во всех 4-х рукавах радиального лабиринта – Test 1A (рис. 1). Обеспечение свободного доступа в тестовой пробе (test probe) к кормушкам во всех рукавах лабиринта показали, что животные последовательно выбирали рукава лабиринта с 7, 5, 3, и 1 каплями, сохраняя приоритет выбора наибольшего подкрепления, что свидетельствовало о возможности формирования у животного карт памяти о локализации всех предъявляемых подкреплений. При этом у этих животных, также как и при выполнении предыдущей задачи c дифференцированным подкреплением (Test 1), сохранялось наличие синхронной активности гиппокампа и прилежащего ядра при выборе каждого подкрепляемого рукава [98].
Рис. 1.
Выбор подопытными животными предпочитаемого подкрепления в лабиринте с дифференцированным подкреплением при одновременном включении локальных зрительных сигналов во всех рукавах радиального лабиринта – Tests 1, 1a [22, 23, 98]. Цифры на рисунке – количество капель подкрепления в рукавах лабиринта. Кружки со стрелками – направление обзорного движения животного при определении локализации предпочитаемого подкрепления в лабиринте с помощью экстралабиринтных навигационных сигналов. Справа сверху – кроскоррелограмма синхронной активности в тета-диапазоне нейронной активности прилежащего ядра и гиппокампа, регистрируемой при выборе предпочитаемого (наибольшего) подкрепления. Справа внизу – уровень правильных ответов при выборе наибольшего подкрепления до и после повреждения прилежащего ядра.

Электролитическое повреждение прилежащего ядра [23] приводило к нарушению способности животных к нахождению местоположения наибольшего подкрепления в лабиринте по навигационным ориентирам, а также в последующие дни тестирования при изменении местоположения максимального подкрепления в рукавах лабиринта (рис. 1). Сходные результаты нарушения поведения наблюдались у интактных подопытных животных, тестируемых после инъекции ДА – агониста амфетамина [6].
При увеличении отсрочки между дискретно подаваемыми порциями наибольшего (5 капель) подкрепления до 3–5 с (рис. 2) интактные животные, используя возможности краткосрочной памяти – Short Term Memory, были способны к ожиданию следующей отсроченной порции подкрепления, однако эта способность нарушалась при стимуляции ДА-реактивной системы вентрального стриатума [3, 4].
Рис. 2.
Tестирование подопытных животных до и после инъекции ДА-агониста амфетамина (при увеличении отсрочки между дискретно подаваемыми порциями набольшего (5 капель) подкрепления) – Test 2 [3, 4]. Тестирование животных до и после инъекции ДА-антагониста галоперидола (при наличии лишь одного из двух смежных экстралабиринтных зрительных навигационных ориентиров) – Test 3 [7]. Цифры на рисунке – количество капель подкрепления в рукавах лабиринта. Кружки со стрелками – направление движения животного при определении локализации предпочитаемого подкрепления в лабиринте с помощью экстралабиринтных навигационных сигналов. Справа вверху – число (%) ответов с выбором наибольшего подкрепления при увеличении времени между дискретно предъявляемыми порциями подкрепления. Справа внизу – количество (%) выборов различных рукавов лабиринта (target – целевой рукав с наибольшим подкреплением; left – левый; right – правый; back – противоположный целевому рукава лабиринта).

При исследовании влияния фрагментарной экспозиции экстралабиринтных навигационных знаков (рис. 2) три знаковых ориентира убирали, оставляя один из двух парных сигналов, которые ранее однозначно определяли локализацию предпочитаемого подкрепления [7]. Интактные животные сохраняли способность к инвариантному восприятию прежней конфигурации ориентиров, необходимой при определении наибольшего подкрепления с помощью активного использования эпизодической памяти – Episodic мemory, которая, однако, нарушалась при дисбалансе ДА-ергической системы вентрального стриатума [7]. Наличие выявленной у животных эпизодической памяти давала им возможность адаптивно реагировать при изменении условий реагирования в лабиринте, так как позволяла инвариантно воспринимать неполные фрагменты окружающей обстановки и принимать решения в соответствии со своим прошлым опытом. Следует отметить, что эпизодическая память является основой для формирования автобиографической памяти человека, дающей возможность безошибочно идентифицировать не только объекты, но и различных субъектов, включая выражение лица и мимики человека, являющихся необходимым условием для социальной коммуникации, а также позволяет восстанавливать в памяти контекстуальные детали различных сцен. Особый интерес вызывают результаты наших исследований, связанные с экстренным переобучением подопытных животных поиску наибольшего подкрепления при изменении его локализации в радиальном лабиринте, определяемого с помощью новой конфигурации (модели) навигационных ориентиров (reversal learning) [5]. Попытки в этих исследованиях провести повторные, выполненные без перерыва в день опыта, сеансы переобучения животных нахождению нового места предпочитаемого подкрепления в радиальном лабиринте, приводили у интактных подопытных животных к нарушению способности использовать навигационную ориентацию (model-based behavior), как более адаптивную тактику для максимизации подкрепления, при сохранении менее продуктивного условнорефлекторного реагирования на подачу внутрилабиринтных сигналов [5]. Фармакологические (введение испытуемым препарата, индуцирующего сон) и процедурные (предоставление в перерыве между сеансами с переобучением кратковременного отдыха со сном) воздействия свидетельствовали о функциональной (обратимой) природе нарушений, выявленных у подопытных животных [5]. Минимизация этих нарушений у животных после естественного, или вызванного введением нейропептида сна, потверждает ранее высказанное предположение о необходимости нейрональных перестроек мозга во время сна для консолидации следов памяти (их переводу в долгосрочную форму памяти) и восприятия нервными клетками новой информации об изменениях в окружающей среде [40, 67, 78, 83].
Изменение условий проведения эксперимента в лабиринте с дифференцированным вознаграждением, оснащенным внутрилабиринтными и экстралабиринтными сигнальными раздражителями, позволяли подопытным животным принимать решения о выборе адаптивной стратегии поведения и соответствующие реакции на основе использования различных видов памяти: Associative stimulus/response memory; Short term space memory; Short term memory on delayed reward; Episodic memory; Long term memory (рис. 3). При этом у животных был выявлен алгоритм и сложная архитектура поведения крыс с различными уровнями принятия решения о выборе адаптивной стратегии при ориентации в лабиринте, в организации которых ведущую роль играл вентральный стриатум (n. accumbens), получающий прямые моносинаптические проекции от ДА-ергических нейронов вентральной тегментальной области среднего мозга (VTA), гиппокампа (Subiculum), энторинальной коры (EC), амигдалы (AMY), префронтальной коры (PFC) и посылающий эффекторные проекции к вентральному паллидуму, который, в свою очередь, посылает прямые проекции к нейронам VTA и медио-дорсальному ядру таламуса (MD), связанному с префронтальной корой [66].
Рис. 3.
Вверху: Взаимодействие различных видов памяти при ориентации крыс в пространстве. Внизу: Модифицированная схема нейрональной организации структур головного мозга [66], участвующей в формировании адаптивного поведения при изменении условий реагирования в радиальном лабиринте. VTA – ДА-ергические проекции вентральная тегментальная область среднего мозга; PFC – префронтальная кора; AMY – амигдала; CA1, CA3 – поля гиппокампа; PPTg – ножково-мостовое ядро тегментума; MD – медиодорсальное ядро таламуса. Активирующие и тормозные влияния соответственно обозначены знаками “плюс” и “минус”.

Используя вышеописанную нейрональную модель (адаптивного поискового поведения крыс в лабиринте с дифференцированным подкреплением) наши коллеги, работавшие в Национальном Центре Научных Исследований Франции [39, 56, 68 ], а также исследователи Шефилдского Университета Великобритании [58], сконструировали электромеханические аппаратно-программные роботы. Роботы были предназначены воспроизводить алгоритм вышеописанного поведения: правильно реагировать на изолированные включения внутрилабиринтных раздражителей (pavlovian stimulus/response test) и переключать внимание на внешние навигационные знаки при изменении стратегии поведения (set shifting strategy), наблюдаемого у реальных крыс в 4-х рукавном лабиринте [22–24].
Биороботы представляли собой стилизованные в виде крыс электромеханические устройства, установленные на подвижной платформе, оснащенные двигателем с тахометром для регистрации скорости движения робота, контроллерами ходовых двигателей и исполнительных механизмов, бинокулярными зрительными и бинауральными слуховыми сенсорами, тактильными тензодатчиками в виде вибрисс и сервоприводами, позволяющими изменять положение головы и туловища биоподобного робота. При этом изменения положения и повороты робота регистрировались с помощью роторного сенсора, копирующего функции вестибулярного аппарата животного (рис. 4). Вознаграждением при правильном выборе рукава лабиринта служила энергетическая подзарядка аккумулятора робота, которая позволяла роботу отмечать, когда и какое количество подкрепления получено.
Рис. 4.
Схематическое изображение устройства (вверху), общий вид лабиринта (внизу) и аппаратно программного робота Psikharpax [56, 68], предназначенного для осуществления двигательной реакции выбора сигнализируемого отсека в 4-рукавном радиальном лабиринте, используя вышеописанную модель поведения крыс в радиальном лабиринте [22, 23].
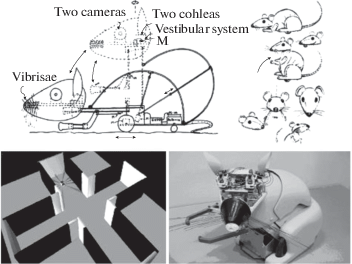
Сконструированные нашими коллегами биоподобные роботы, в целом, могли правильно осуществлять выбор рукава лабиринта, ориентируясь на внутрилабиринтные сенсорные сигналы (associative S/R learning), переключать внимание на внешние навигационные знаки для получения максимального вознаграждения (set shifting strategy), а также находить наибольшее подкрепление (reversal learning) при изменении его местоположения в рукавах лабиринта. Вместе с тем исследователи [56] отмечали, что скорость выполнения задачи у биороботов, по сравнению с подопытными крысами, была намного ниже, чем у реальных животных, несмотря на то, что вибриссы-тензодатчики помогали им успешно обходить встречающиеся на пути препятствия (стенки и углы лабиринта). Это объясняется тем, что в отличие от биороботов, при первоначальном обучении реальных животных (pavlovian stimulus/response), фактически задействованы два вида памяти: 1) подкрепляемое ассоциативное S/R (stimulus/response) обусловливание и 2) параллельно протекающее латентное обучение, которое основанно на формировании пространственной памяти (short-term space memory) о локализации наибольшего подкрепления, которое обеспечивало подопытным крысам быстрое и практически безошибочное решение задачи при тестировании последующего поведенческого акта. У сконструированных биороботов вышеуказанное параллельное обучение вызывало очевидные затруднения.
Важно подчеркнуть, что биоподобные роботы [39, 56, 58], выполненные на основе описанной нейрональной модели, с дифференцированным пищевым подкреплением, могли максимизировать вознаграждение (подзарядка аккумулятора), которое можно было получать регулярно в течение длительного периода времени при правильном реагировании в лабиринте. При этом робот, на основе показаний встроенного счетчика, имел собственную оценку количества “заработанной” энергии аккумулятора, которая позволяла роботу продлить свою активность. Таким образом, робот, являясь автономным устройством, имел потребность определять уровень заряда аккумулятора и при недостатке энергии изменять тактику поведения для получения дополнительного вознаграждения в виде подзарядки аккумулятора. Результаты ранее проведенных нейрональных исследований на крысах предполагают, что функцию “критика”, оценивающего необходимость и возможность получения подкрепления животным, в описанной нами модели подкрепляемого обучения выполняет прилежащее ядро (n. accumbens), а функцию исполнителя продуктивной тактики поведения, так называемого “актера”, – дорсальный стриатум [56, 94].
Следует отметить, что вышеописанные биороботы [39, 56, 68] были сконструированы для воспроизведения относительно простой формы Павловского ассоциативного обучения (подача внутрилабиринтного сигнала – побежка в сигнализируемый рукав радиального лабиринта), усложненной последующей сменой стратегии поведения, связанной с использованием пространственной памяти при выборе подкрепления с помощью экстралабиринтных навигационных ориентиров [23]. Однако они не были приспособлены адаптивно менять свое поведение при изменении других условий реагирования в радиальном лабиринте, требующих использования эпизодической памяти при фрагментарной экспозиции экстралабиринтных навигационных знаков, краткосрочной памяти на задержанное вознаграждения при дискретной подаче отдельных порций наибольшего подкрепления.
Возникает вопрос, возможно ли сконструировать автономных биороботов, способных оперативно реагировать на все вышеописанные изменения условий реагирования, решаемые подопытными животными в лабиринте с дифференцированным подкреплением? Есть основания полагать, что дальнейшая аппаратно-программная модернизация биороботов (путем их оснащения современными модульными электронными запоминающими устройствами, выполненная с учетом выявленной сложной многоуровневой архитектуры и алгоритма поведения тестируемых крыс в лабиринте с дифференцированным подкреплением), позволит будущим биороботам сравняться в скорости реагирования с реальными животными. А в отдельных случаях (reversal learning) превосходить скорость переобучения подопытных крыс, т. к. биороботы, в отличие от реальных животных, не требуют сна для нейронального перепрограммирования. Следует отметить, что многоуровневая архитектура поведения с использованием различных уровней принятия решения о выборе адаптивной стратегии поведения в настоящее время начинает активно использоваться в роботостроении [59, 99].
Вышеописанная нейрональная поведенческая модель ориентации в 4-х стороннем лабиринте с асимметричным подкреплением может быть практически использована, не только для изучения организации целенаправленного поведения в пространстве, диагностики нарушений внимания при тестировании животных и человека [1, 2, 21] и конструирования роботизированных устройств, (предназначенных для автономной ориентации и целеполагания [39, 41, 53, 56]), но также (в качестве основы) для создания других автоматизированных устройств. Одним из направлений может служить моделирование и создание системы автоматического управления автомобилем в различных дорожных ситуациях: 1) при регулируемом светофором дорожном движении на 4-стороннем перекрестке – на изолированное включение сенсорных сигналов светофора; 2) на нерегулируемом перекрестке – включены все сигналы светофора; 3) при поломке светофора, или утрате необходимых дорожных знаков, когда водителю необходимо ориентироваться на сенсорные сигналы и препрограммированный алгоритм правил проезда на нерегулируемом перекрестке.
Разработанная модель адаптивного поискового поведения в радиальном лабиринте с дифференцированным вознаграждением успешно применяется при тестировании, как животных, так и человека, с сохранением всех условий и процедуры проведения эксперимента [1, 2]. Сходные тактики решения задач животными и человеком при изменении условий реагирования в радиальном лабиринте [21, 29, 76,] указывают на перспективные возможности использования описанной модели подкрепляемого обучения при конструировании не только биоподобных, но и антропоморфных роботов.
Вместе с тем необходимо указать на серьезные ограничения, связанные с проблемой учета в роботостроении эмоциональных и мотивационных аспектов поведения, которые играют важную роль в организации адаптивных целенаправленных реакций у животных и человека.
Известно, что хранение информации и ее извлечение из памяти модулируются эмоциональной, контекстуальной, а у человека и лингвистической информацией. Эмоции порождают соответствующие мотивации, которые определяют последующее целенаправленное поведение. Единственно возможные у вышеописанных роботов эмоции “страха” (низкий заряд аккумулятора) и эмоции “удовольствия” (пополнение его заряда) является лишь симуляцией эмоций и не могут мотивировать робота на выполнение более сложных целенаправленных действий, адекватных при различных ситуациях и обстоятельствах. Отметим, что у наиболее успешной конструкции антропоморфого робота – андроида “София”, разработанного гонконгской компании Hanson Robotics, проблему эмоций, необходимую для социальной коммуникации андроида, исследователи пытаются разрешить с помощью моделирования 62-х препрограммированных мимических реакций, используя искусно выполненную пластичную маску андроида. Однако смоделированные мимические реакции этого андроида, несмотря на их кажущуюся правдоподобность, далеко не всегда являлись адекватными эмоциональными реакциями, проявляемыми в конкретных ситуациях общения андроида с человеком. Особенно остро проблемы моделирования самосознания, мотивированного эмоционального поведения и социальной коммуникации стоят перед исследователями, создающими так называемых социальных роботов, предназначенных для ухода за детьми, пожилыми людьми и больными [31, 74, 92, 95]. Попытка инженеров Йельского университета создать андроида NICO [47], который, наряду со способностью к адекватной имитации эмоциональных реакций, был бы способен обладать “самосознанием”, то есть способностью узнавать себя по отражению в зеркале, у ряда исследователей вызвала критические замечания. Ведущий специалист Сиднейского Технологического университета (в области робототехники) Мария-Анна Вильямс (Williams), по поводу указанного исследования, заметила, что известные ей биороботы “не только не узнают себя в зеркале, но не могут даже опознать отдельные части своего сконструированного тела, т.е. робот может посмотреть вниз и увидеть свои ноги, но не может распознать, что это его собственные ноги”. Это не позволяет им эффективно и безопасно работать совместно с человеком" [51]. Учитывая значительные различия в скорости обработки информации, принятия решений и выполнении действий у человека и компьютерного робота проблема безопасного взаимодействия робота с человеком приобретает первостепенное значение.
Есть основания полагать, что заявления о возможности моделирования у робота полноценного самосознания, по меньшей мере, являются сомнительными. Моделирование самосознания невозможно без создания моделей собственного “Я” и Окружающего мира, что позволяет субъекту выделить себя из окружающей среды, моделировать различные ситуации в диаде “Я” и “Окружающая среда” и осуществлять практическую деятельность, связанную с реализацией этих моделей. У человека, наряду с чувственно-телесным осознанием образа (модели) собственного “Я”, в процессе онтогенеза наблюдается также понятийное формирование своего “Я”, то есть модели “Я-понятие”, которое имеет более высокий порядок, так как определяет профессиональный, социальный, образовательный статус индивида, его морально-нравственные ценности, что дает возможность не только идентифицировать себя и определять свое положение в обществе, но и активно моделировать и выстраивать социальные связи в окружающем его мире.
Большинство исследователей, работающих над созданием антропоморфных роботов, полагают, что дальнейший прогресс в создании и совершенствовании систем искусственного интеллекта, скорее всего, будет связан не с конструированием электромеханических роботов (способных к программированному выполнению ограниченного числа специализированных функций), а с разработкой биогибридных интеллектуальных систем. Это – моделирование и создание синтетических нейроимплантов, которые вживляются в головной мозг для восстановления утраченных функций отдельных структур мозга и/или усиления интеллектуальных возможностей человека.
РАЗРАБОТКА БИОГИБРИДНЫХ ИНТЕЛЛЕКТУАЛЬНЫХ СИСТЕМ
В последние годы ученые наблюдают значительный рост предложений, направленных не столько на профилактику, лечение и реабилитацию нарушенного здоровья человека, сколько на расширение и усиление его индивидуальных физических и психических возможностей с помощью новейших технических средств, биомедицинских и компьютерных технологий [8, 17, 19].
В 2006 г. учеными из Университета Брауна в Род-Айленде впервые был сконструирован и имплантирован в моторную кору головного мозга парализованного человека микрочип. В результате чего, больной смог частично компенсировать утраченные возможности: пользоваться курсором компьютера, набирать текст и переключать телепрограммы с помощью мысленного усилия (http://news.bbc.co.uk/hi/russian/sci/tech/newsid-4397000/4397209.stm).
В последние годы стали появляться сенсационные сообщения [27, 34, 44, 50, 55, 80] о разработках в опытах на животных новейших когнитивных технологий. Они предназначены не для восстановления утраченных функций мозга, а для т. н. “усиления и улучшения” сенсорных и мыслительных способностей человека путем вживления непосредственно в мозг человека модельных образцов микрочипов, работающих автономно, или дистанционно связанных с комьютером, образуя, таким образом, своеобразный гибрид мозга человека и вычислительной машины.
В частности, ученые Kалифорнийского университета под руководством профессора Бергера (Berger), а также ряд их последователей, используя результаты опытов, выполненных на препаратах прижизненных срезов мозга, заявили, что разработали и приступили к испытанию in vivo в экспериментах на животных электронную модель одного из наиболее изученных, морфологически упорядоченных и структурированных образований мозга – гиппокампа, которая, по словам исследователей, сможет увеличить скорость и объем памяти человека [27, 34, 37, 44, 55]. Действительно, гиппокамп – одна из основных структур мозга, участвующих в пространственной ориентации и формировании различных видов памяти, является привлекательным для этого объектом, так как его нервные связи, входные и выходные нервные пути, подробно картированы и хорошо распознаваемы на различных препаратах мозга [14, 28, 65, 85]. Гиппокамп легко извлекается из мозга вместе с его входными нервными путями. Трехмерная структура гиппокампа позволяет получать тонкие срезы с интактными путями к клеткам того же среза мозга. Стимуляция таких путей вызывает долговременную потенциацию (ДВП) нейронов гиппокампа [28, 65], при этом характеристики ДВП примерно одинаковы и в срезах и в интактном мозгу. Важно отметить, что реакция ДВП в обоих случаях специфична для определенных путей, т.е. она развивается только в тех клетках, к которым подводится раздражитель, а не распространяется от клетки к клетке, другими словами это результат функционирования сети специфических связей, а не представляет собой волну диффузной активности. Показано, что развитие ДВП как в срезах гиппокампа, так и in vivo в интактном мозгу, проходит две фазы: 1) с коротким периодом инициации и 2) более длительной фазой устойчивой реакции. Они рассматриваются как аналоги перехода от кратковременной памяти к долговременной, при этом авторы выделяют несколько форм ДВП, лежащей в основе формирования ассоциативного обучения [14, 85]. Более того, на нейронах гиппокампа выявлено наличие так называемой ассоциативной формы ДВП, суть которой заключается в том, что слабая стимуляция, недостаточная для поддержания ДВП, может стать активирующим фактором, если сочетается с сильной стимуляцией через второй путь. Оба вида стимуляции должны совпадать или ассоциироваться по времени, как условный и безусловный раздражители при ассоциативном обучении. По заключению С. Роуза [14] при этом можно даже получить такую форму ассоциативного обучения, в которой смешаны поведенческие и нейрофизиологические стимулы.
Последние исследования показывают, что основой нейронального взаимодействия при ассоциативном обучении может быть не только ДВП, но и изменения синаптической пластичности, ранее описанные Хеббом [48]. Возможность ассоциативного обучения на основе синаптических перестроек по Хеббу показана на нейронах гиппокампа, а также амигдалярных NMDA-рецепторах [69, 90] и кортико-стриатных синапсах при модулирующем влиянии нейромедиатора дофамина [82]. По мнению Легенштейна [63] схема синаптической пластичности по Хеббу и созданная на ее основе математическая модель хорошо объясняют реорганизацию нейрональной сети, наблюдаемой в опытах на приматах, управляющих посредством джойстика курсором на экране компьютера с помощью команд, поступающих с моторной коры мозга [72, 88, 91].
Следует отметить, что у пациентов с двусторонним поражением гиппокампа оперативная память на текущие события остается незатронутой, однако полностью исчезает способность включать новую информацию в долговременную память [89]. Согласно экспериментальным данным, полученным Виноградовой [10], гиппокамп играет роль входного фильтра информации, подлежащий, или не подлежащей регистрации в долговременной памяти.
Вышеуказанные особенности строения и нейрональной активности гиппокампа, выявленные дефекты памяти (у лиц с травматическими повреждениями этой структуры), определили выбор исследователями гиппокампа, в качестве объекта для создания его электронной модели – микрочипа, способного, по их мнению, компенсировать нарушения памяти у больных с органическими повреждениями этой структуры, а также способного “усилить и улучшить память” человека для более быстрой обработки больших объемов информации. При этом могут быть использованы возможности, так называемой, эйдетической памяти. Следует отметить, что эйдетическая (греч. “эйдос” – образ) память хорошо выражена у больных аутизмом, а также у детей, которые при воспроизведении ранее увиденного буквально считывают информацию, имея в голове ее зрительный образ [45]. С возрастом у человека формируется способность к активной фильтрации, сознательному подавлению эмоционально негативной или незначимой в данный момент информации, сопровождаемая формированием избирательного внимания. Это является важным условием для адаптивного приспособления к окружающей среде, в отличие от активно работающей в детские годы памяти, основанной на способности к образной фиксации событий и непрерывных изменений окружающего мира.
Учитывая, что гиппокамп представляет собой совокупность нейронных сетей, функционирующих параллельно, исследователи Калифорнийского университета поставили задачу обойти поврежденную область мозга, выстроив искусственно созданный мостик с помощью электронного чипа. Изучая входящие и исходящие потенциалы, регистрируемые в серийно расположенных срезах гиппокампа крыс, ученые сначала создали математическую структурно-функциональную модель нейропротеза данного образования мозга. После этого она была транслирована на кремниевый чип, который размещали на черепе животного, с возможностью последующего вживления в мозг (рис. 5).
Микрочип связан с гиппокампом двумя пучками электродов, которые расположены по разным сторонам поврежденной области данной мозговой структуры. Один пучок электродов регистрирует электрическую активность других отделов мозга, другой – электрические сигналы, выработанные микросхемой нейропротеза, которые направляются обратно в мозг, обходя, таким образом, поврежденный участок мозга и восстанавливая утраченные функции гиппокампа. Позднее, исследователи [27, 34] на двух группах подопытных крыс показали возможность передачи записанной на нейрочип информационного паттерна нейрональной активности гиппокампа от животных, обученных выполнять задачу отсроченного выбора предложенного образца (DNMS memory task), необученным крысам – реципиентам, которые в результате переноса записанной информации начинали с успехом выполнять предложенный поведенческий тест. В настоящее время исследователи планируют тестировать описанные нейропротезы гиппокампа в опытах на обезьянах, с целью проверки их эффективности для последующего применения на людях с органическими повреждениями данной структуры мозга. Следует отметить, что кроме “чипирования” гиппокампа группа исследователей, используя сходные методологические подходы, проводят эксперименты на животных по созданию искусственной модели мозжечка [43, 50]. Отдельные исследователи допускают возможность осуществить крупномасштабное моделирование мозговых структур, включая полную эмуляцию головного мозга, что, по их мнению, будет означать полное сохранение и/или усиление церебральных функций обработки информации [30].
Будут ли субъекты, с вживленными нейрочипами, обладать возможностью ускоренного обучения и феноменальной памяти, которая, возможно, будет основана на гипертрофированной образной памяти (сопровождаемой нарушениями способности к забыванию, формированию избирательного внимания и пониманию отвлеченной знаковой информации), или разработчики задействуют другой механизм организации памяти, пока неизвестно. В любом случае, исследователям, наряду с вопросом биосовместимости вживляемого в мозг нейрочипа, будет необходимо решать проблему упорядочивания, а также забывания (forgetting) ранее воспринятой информации, которая как у животных, так и у человека, как известно, решается путем сложного процесса перепрограммирования памяти во время сна [5, 40, 54, 64].
ЭТИЧЕСКИЕ АСПЕКТЫ МОДЕЛИРОВАНИЯ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА
Сообщения о разработке нейроимплантов для восстановления функций поврежденных структур мозга и/или усиления интеллектуальных возможностей человека разделили ученых и общественность различных стран на два противоположных лагеря: приверженцев микрочипирования мозга [27, 84] и их противников. Последние указывают на непредсказуемые физиологические и психологические последствия вживления имплантатов для их носителей, а также возникающие при этом этические проблемы [19, 57, 73].
Приверженцы микрочипирования (в основном, сами разработчики, представители бизнеса и их лоббисты) считают возможным и необходимым с помощью нейроимплантатов усилить способности человека к быстрой обработке все возрастающего потока информации, совершить своеобразный “upgrade” человеческого мозга (http://transhumanism-russia.ru/).
Большинство ученых, учитывая сложность решения задачи по моделированию функций гиппокампа, который, как известно, вместе с другими образованиями мозга ответственен не только за память, но и за формирование мотивации, эмоций, различных форм внимания, ориентацию в пространстве, скептически относятся к созданию нейрочипа, способного воспроизвести все функции гиппокампа человека и даже “улучшить” его работу.
Конечно, задача разработчиков может быть значительно облегчена, если исследователи планируют создать не полноценную модель гиппокампа, сохраняющую способность человека контролировать восприятие информации, ее фильтрацию и самостоятельно принимать на основе ее анализа решения, а ее упрощенный вариант, псевдомодель, функции которой будут заключаться, преимущественно, в запоминании информации, получаемой от нейрочипа, который работает автономно или дистанционно связан с компьютером, и выполнении управляющих команд. Алгоритм решения подобных задач впервые был апробирован около пятидесяти лет назад в опытах Олдса [75] на крысах с электродами, вживленными в так называемых “зонах удовольствия”, которые были расположенны в септальных ядрах и гипоталамусе; и экспериментах Дельгадо [35] по управлению агрессивными реакциями и различными видами двигательного поведения у обезьян и других животных с помощью дистанционной стимуляции неостриатума и других структур мозга.
Несмотря на критические замечания оппонентов, приверженцы микрочипирования уверены в быстром прогрессе использования нейрочипирования, так как разработки в этой области хорошо финансируются в разных странах. Согласно, документу, утвержденному Минпромэнерго, в России также принята программа, согласно которой к 2025 г. “широкое распространение получат встроенные беспроводные наноэлектронные устройства, обеспечивающие постоянный контакт человека с окружающей его интеллектуальной средой, и… средства прямого беспроводного контакта мозга человека с окружающими его предметами, транспортными средствами и другими людьми”. Согласно принятой программе “тиражи такой продукции превысят миллиарды штук в год из-за ее повсеместного распространения” [13]. Еще раньше Министерство обороны США оформило контракт на разработку микрочипа, которые можно будет имплантировать в мозг солдата и постоянно отслеживать состояние его здоровья при осуществлении боевых действий (http://news.mail.ru/society/1395100/).
В отличие от России, где недавний показ по ТВ каналу “Россия” фильма “Я – Киборг. Человек будущего” (www.youtube.com/watch) с демонстрацией ожидаемых “чудесных” возможностей микрочипирования сопровождался лишь вялой дискуссией в Интернете, публикация решения правительства США финансировать разработку и использование нейрочипов вызвало ожесточенные споры в США по поводу снижения безопасности и возможностью контроля за частной жизнью людей, путем распространения новых технологий. Секретариат EGE (Европейской Группы по Этике в Науке и Новых Технологиях) Европейской Комиссии, которая состоялась 14 декабря 2004 г., в ходе обсуждений этой проблемы, выразил сильную обеспокоенность тем, что при вживлении нейрочипов “вместе с возможным улучшением вместимости памяти существует риск коррекции ее содержимого на предмет содержания вещей, которые не желательно сохранять” [18]. Это вызывает сильные этические опасения и, по мнению одного из участников, в пределе может быть сведено к диктату того, “что дозволено” (http://europa.eu.int/comm/european group ethics).
Этические проблемы микрочипирования человека были в центре внимания прошедшей в 2007 г. в Сан-Франциско конференции ученых и программистов “Саммит сингулярности: искусственный интеллект и будущее человечества” [26]. Представители общественных и религиозных организаций США и Европы заявили о неприятии микрочипирования, напомнив властным органам, что они “обладают данной свыше свободой Воли и не желают превращаться в управляемых биороботов”. В нескольких штатах были приняты законы, запрещающие насильственную имплантацию микрочипов.
Ряд ученых считает, что основной опасностью при микрочипировании мозга, следствием которого будет появление своеобразного гибрида человека с вычислительной машиной, наряду с возможностью контроля и манипуляции сознанием населения, будет изменение психологического состояния человека после имплантации, самосознание которого (его личностное “Я”) может быть утрачено, или радикально отличаться от самосознания обычного, не подвергшегося микрочипированию, человека [42]. Особенно это относится к попыткам изменения, с помощью технических средств, свойств памяти человека, так как память позволяет нам осознавать не только собственную индивидуальность, но и личности других людей.
Практикующим врачам и психиаторам хорошо известно, что любая имплантация органов и тканей может негативно сказываться не только на физическом, но и на психическом состоянии оперированных людей в виде психологического неприятия вживленных органов и биопротезов, или отказа от планируемой имплантации [11, 49, 87]. Психологические последствия модельного микрочипирования мозга могут приводить к развитию тяжелых нервно-психических расстройств не только из-за осознания человеком своего состояния, ведущего к стигматизации и травмирующей самооценке, но и боязни выстраивания отношений с обычными людьми, которые могут быть осведомлены (или догадываться) о необычном статусе контактирующего с ним субъекта. Возникает вопрос: согласится ли общественность с практикой массового нейрочипирования и, как будут строиться отношения между субъектами, согласившимися на микрочипирование, и людьми, отказавшимися от данной процедуры по этическим, моральным и религиозным соображениям? По мнению чл.-корр. РАН Юдина [19], личность, конструированная, или реконструируемая с помощью технических и психологических технологий, будет сталкиваться с серьезными трудностями из-за несоответствия превалирующим социальным и культурным нормам и ценностям.
Вместе с тем есть основание полагать, что, учитывая высокую стоимость нейроимплантов, операции по их вживлению и созданию необходимой технической и информационной инфраструктуры для их обслуживания, возможностями высококачественного нейропротезирования смогут воспользоваться немногие. В основном это будут обеспеченные люди, которые в результате образуют, так называемую элитную категорию населения, обладающую экстраординарными интеллектуальными возможностями, что позволит им занять ведущее положение в обществе. По мнению ряда ученых [30, 57, 73] это вызовет еще большее расслоение современного общества, что может привести к созданию непреодолимой социальной напряженности.
ЗАКЛЮЧЕНИЕ
Ограниченный объем статьи не позволяет подробно рассмотреть все направления, связанные с разработкой и использованием нейрональных моделей целенаправленного поведения животных при создании роботизированных систем искусственного интеллекта, а также нейроимплантов для лечения нейродегенеративных заболеваний мозга и/или усиления интеллектуальных возможностей человека. За рамками статьи оставлены описания исследований, связанные с дистанционным контролем движения животных с помощью вживленных в мозг электродов [62, 93], разработкой биоподобного робота, оснащенного высокотехнологической системой тактильных датчиков [77], моделированием синтетического нейроимпланта мозжечка [43, 50]. С работами этих исследователей можно ознакомиться по указанным ссылкам.
Большой интерес также представляют исследования, связанные с анализом социальных последствий развития и внедрения в практику современных наукоемких технологий. Оживленную дискуссию в обществе вызывают исследования о возможных взаимоотношениях, которые могут сложится между электромеханическими роботами, антропоморфными роботами – андроидами, людьми с вживленными нейроимплантами и обычными гражданами, отказавшимися по различным соображениям от усиления своих интеллектуальных возможностей с помощью нейрохирургической операции [12, 17, 30, 33, 71, 79].
Как и в каком направлении будут развиваться дальнейшие исследования, связанные с созданием систем искусственного интеллекта, нейропротезированием и его использованием при заместительной терапии пораженных структур мозга и улучшении интеллектуальных возможностей человека, покажет ближайшее будущее.
Список литературы
Альбертин С.В. Способ диагностики синдрома дефицита внимания в эксперименте на животных // Патент РФ № 2269295. Бюл. изобр. 2006. № 4 (3 ч.). С. 331.
Альбертин С.В. Диагностика синдрома дефицита внимания с гиперактивностью с использованием условнорефлектрного подхода // Журн. неврол. и психиатрии им. С.С. Корсакова. 2010. Т. 110. № 12. С. 67–73.
Альбертин С.В. Модельные исследования центральной нервной системы. Санкт-Петербург, Изд. “Дорн”, 2011. 274 с.
Альбертин С.В. Участие гиппокампа и стриатума в формировании поискового поведения у ювенильных крыс: нейрофармакологический анализ // Междунар. научн. журн. “Инновационная наука”. 2015. № 8. С. 18–20.
Альбертин С.В. Влияние режима условнорефлекторного переобучения крыс на поисковое поведение в радиальном лабиринте // Рос. физиол. журн. им. И.М. Сеченова. 2016а. Т. 102(11). С. 1302–1311.
Альбертин С.В. Влияние стимуляции дофаминергической системы мозга на пищевое предпочтение у крыс // Рос. физиол. журн. им. И.М. Сеченова. 2016б. Т. 102(10). С. 1137–1145.
Альбертин С.В. Влияние фрагментации зрительных навигационных сигналов на ориентацию крыс в радиальном лабиринте // Рос. физиол. журн. им. И.М. Сеченова. 2017. Т. 103(8). С. 854–865.
Аргонов В.Ю. Искусственное программирование потребностей человека: путь к деградации или новый стимул развития? // Вопросы философии. 2008. № 12. С. 22–38.
Баллюзек Ф.В., Куркаев А.С., Сенте Л. Нанотехнология для медицины. СПб, 2008. 103 с.
Виноградова О.С. Гиппокамп и память. М. Наука, 1975.
Кемпбелл А., Джиллет Г., Джонс Г. Медицинская этика. М. “Геотар-Медиа”, 2010. 395 с.
Курцвейл Р. Эволюция разума. Изд. Эксмо, 2015. 452 с.
“Об утверждении Стратегии развития электронной промышленности России на период до 2005 года” // Приказ Минпромэнерго № 311 от 07.08.2007 г.
Роуз С. Устройство памяти. От молекул к сознанию. М: Мир, 1995. 377 с.
Сазыкин Ю.О. Биотехнология: учебное пособие для студентов вузов. М: Academia, 2008. 253 с.
Хенч Л., Джонс Д. Мир биологии и медицины. Биоматериалы, искусственные органы и инжиниринг тканей. М: Техносфера, 2007. 303 с.
Хоружий С.С. Проблема постчеловека, или трансформативная антропология глазами синергийной антропологии // Философские науки. 2008. № 2. С. 10–31.
Этические аспекты ICT имплантатов в человеческое тело // Слушания дебатов круглого стола секретариат EGE – Европейской Группы по Этике в Науке и Новых Технологиях. (http:// europa.eu.int/comm/european_group_ethics/clocs/roundtabict.pdf). Amsterdam. 21 December 2004.
Юдин Б.Г. Сотворение Трансчеловека // Вестн. Рос. Акад. Наук. 2007. № 6. С. 520–527.
Aguilar-Valles A., Sanchez E., de Gortari P. et al. Analysis of stress response in rats trained in the water maze: differential expression of corticotropine-releasing hormone, glucocorticoid receptors and brain-derived neurotrophic factor in limbic regions // Neuroendocrinology. 2005. V. 82. P. 306–319.
Albertin S.V. Diagnosis of Attention Deficit Hyperactivity Disorder Using a Conditioned Reflex Approach // Neurosci and Behav. Physiol. 2011. V. 41(9). P. 906–910.
Albertin S.V., Mulder A.B., Tabuchi E. et al. Accumbens medial shell lesions impair performance in rats performing in a differentially rewarded plus maze // Soc. Neurosci. Abstr. California. 1998. V. 24:1909.
Albertin S.V., Mulder A.B., Tabuchi E. et al. Lesions of the medial shell of the nucleus accumbens impair rats in finding larger rewards but spare reward-seeking behavior // Behav. Brain Res. 2000. V. 117. P. 173–183.
Albertin S.V., Wiener S.I. Neuronal Activity in the Nucleus Accumbens and Hippocampus in Rats during Formation of Seeking Behavior in a Radial Maze // Bull. Exp. Biol. Med. 2015. V. 158. P. 405–409.
Arbib M., Metta G., van der Smagt P. Handbook of Robotics, chapter Neurorobotics: From vision to action 2008. Springer-Verlag, Berlin, 2008. P. 1453–1480.
Artificial Intellect & Future // The Singularity Summit: San Francisco. CA. 8–9 Sept. 2007.
Berger T., Hampson R.E., Song D., Goonawardena A., Marmarelis V.Z., Deadwyler S.A. A cortical neural proprosthesis for restoring and enhancing memory // J. Neural Eng. 2011. 8:046017.
Bliss T.V., Lomo T. Long lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path // J. Physiology. 1973. V. 232. P. 331–356.
Bohbot V.D., Jech R., Ruzicka E., Nadel L. et al. Rat Spatial Memory Tasks Adapted for Humans: Characterization in Subjects with Intact Brain and Subjects with Medial Temporal Lobe Lesions // Physiol. Res. 2002. V. 51(1): S49–S64.
Bostrom N. Superintelligence: Paths, Dangers, Strategies. Oxford Univ. Press, 2014. 352 p.
Cabibihan J.-J., Williams M.-A., Simmons R. When Robots Engage Humans // Int. J. Soc. Robotics. 2014. V. 6. P. 311–313. https://doi.org/10.1007/s12369-014-0249-8
Caluwaerts K., Staffa M., Guyen S.N., Grand C., Dolle L., Favre-Felix A., Girard D., Khamassi M. A biologically inspired meta-control navigation system for the Psikharpax rat robot // Bioinspiration and Biomimmetics. 2012. № 2. P. 025009.
Chalmers D. The singularity: A philosophical analysis // J. Consciousness Studies. 2010. V. 9(10). P. 7–65.
Deadwyler S.A., Berger T.W., Sweat A.J. et al. Donor/recipient enhancement of memory in rat hippocampus // Frontiers in Systems Neuroscience, 2013. https://doi.org/10.3389/fnsys.2013.00120
Delgado J.M.R., Bracchita H. Free and instrumental behavior in monkeys during radiostimulation of the caudate nucleus // Int. J. Psychobiol. 1972. V. 2. P. 233–248.
Daw N.D., Niv Y., Dayan P. Uncertainty-based competition between prefrontal and dorsolateral striatal systems for behavioral control // Nat. Neurosci. 2005. V. 8. P. 1704–1711.
Dworkin E. Artificial Hippocampus // ELE382 Biomed. Eng. Seminar II. 15 Nov. 2004.
Edelman G.M. Learning in and from Brain-Based Devices // Science. 2007. V. 318. P. 1103–1105.
Filliat D., Girard B., Guillot A., Khamassi M., Lacheze L., Meyer J.-A. State of the artificial rat Psikharpax // In Schaal A. e. a. (Eds) From Animals to Animats: Proc. Of the 8th Int. Conf. on Stimulation of Adaptive Behavior. The MIT Press, Cambridge, MA. 2004. P. 2–12.
Fischer S. et al. Sleep’s role in the processing unwanted memory // J. Sleep Res. 2011. 20(2). P. 267–270.
Fox C., Humphries M.D., Mitchinson B., Riss T., Somogyvari Z., Prescott T. Technical integration of hippocampus, basal ganglia and physical models for spatial navigation // Frontiers in Neuroinformatics. https://doi.org/10.3389/neuro.11.006.2009
Gillett G. Cyborgs and moral identity // J. Med. Ethics. 2006. V. 32. P. 79–83.
Giovannucci A., Bamford S., Herreros I. et al. Replacing a cerebellar microcircuit with an Autonomous neuroprosthetic device // In. Animal Meeting of the Soc. Neurosci. 2010. California.
Graham-Row D. World’s first brain prosthesis revealed // New Scientists. 12 March. 2003.
Haber N.R. Eidetic images // Scientific American. 1969. V. 220. P. 36–40.
Harrison F.E., Hosseini A.H., McDonald M.P. Endogenous stress responses in water maze and Barnes maze spatial memory tasks // Behav. Brain Res. 2009. V. 198(1). P. 247–251.
Hart J.W., Scassellati B. Mirror Perspective-Taking with a Humanoid Robot // Proceedings of the Twenty- Sixth AAAI Conference on Artificial Intelligence. 2012.
Hebb D.O. The organization of Behavior. Willey, 1949. P. 62–63.
Hench L.L. Science and Ethics. London. Imperial Colledge Press, 2000.
Herreros I., Giovanucci A., Taub A.H. et al. A cerebellar neuroprosthestic system: computational architecture and in vivo test // Frontiers in Bioengineering and Biotechnology. 2014. № 2. Article 14. https://doi.org/10.3389/fbioe.2014.00014
Hodson H. Robot learns to recognize itself in the mirror // Neuroscientists. 2012. Magazine issue 2878.
Holscher C. Stress impairs performance in spatial water maze learning tasks // Behav. Brain Res. 1999. V. 100. P. 225–235.
Humphries M.D., Prescott T. The ventral basal ganglia, a selection mechanism at the crossroads of space, strategy and reward // Progress in Neurobiology. 2009. V. 90. P. 385–417.
Inostroza M., Born J. Sleep for preserving and transformation episodic memory // Annual Rev. of Neurosci. 2013. 36. P. 79–102.
Kalangher L. Getting nanowires on the brain // Nanotechweb. 31 August. 2006.
Khamassi M., Lacheze L., Girard B. et al. Actor-Critic Models of Reinforcement Learning in the Basal Ganglia: From Natural to Artificial Rats //Adaptive Behav. 2005. V. 13. P. 131–148.
Kjolberg K., Delgado-Ramos G.C., Wickson F., Strand S. Models of governance for converging technologies // Technology Analysis and Strategic Management. 2008. V. 20(1).
Koene A., Prescott T.J. Hippocampus, Amygdala and Basal Ganglia based navigation control // Lectures Notes in Computer Science. 2009. V. 5768LNCS. Part 1. P. 264–276.
Kortenkamp D., Simmons R. Robotic systems architectures and programming // In B. Sicilliano and Khatib (Eds), Handbook of Robotics. Springer-Verlag. 2008. P. 187–206.
Krichmar J.L., Nitz D.A., Gally J.A., Edelman G.M. Characterizing functional hippocampal pathway in a brain-based device it solves a spatial memory task // PNAS. 2005a. V. 102(6). P. 2111–2116.
Krichmar J.L., Seth A.K., Nitz D.A., Fleischer J.C., Edelman G.M. Spatial navigation and causal analysis in a brain-based device modeling cortical-hippocampal interaction // Neuroinformatics. V.3. P. 197–221. 2005b.
Lee M.G., Jun G., Choi H.S. et al. Operant conditioning of rat navigation using electrical stimulation for directional cues and rewards // Behav. Processes. 2010. V. 84(3). P. 715–720.
Legenstein R., Chase S.M., Schwartz A.B. et al. A reward modulated Hebbian learning rule can explain experimentally observed network reorganization in a brain control task // The J. Neurosci. 2010. V. 30(25). P. 8400–8470.
Lewis P.R., Durrant S.J. Overlapping memory replay during sleep builds cognitive schemata // Trends in Cogn. Sci. 2011. 15(8). 343–351.
Levy W.B., Steward O. Temporal contiguity requirements for long-term associative potentiation depression in the hippocampus // Neuroscience. 1983. V. 8. P. 791–797.
Lisman J.E., Grace A.A. The hippocampal – VTA Loop: Controlling the Entry of Information into Long- term Memory // Neuron. 2005. V. 46. P. 703–713.
Liu Z.W. Faraguna U., Cirelli C. et al. Direct evidence for wake-related increases and sleep-related decreases in synaptic strength in rodent cortex // The J. Neurosci. 2010. V. 23. P. 8671–8675.
Meyer J.-A., Guillot A., Girard B., Khamassi M., Pirim P., Berthoz A. The Psikharpax project: towards building an artificial rat // Robotics and Autonomous Systems. 2005. V. 50. P. 211–223.
Moosmang S., Haider N., Klugbauer N. Role of hippocampal Cav1.2Ca channel ion NMDA receptor-independent synaptic plasticity and spatial memory // J. Neurosci. 2005. V. 25. P. 9883–9892.
Morris R. Development of a water-maze procedure for studying spatial learning in the rats // Neurosci. Meth. 1984. V. 11. P. 47–60.
Muehlhauser L., Salamon A. Intelligence explosion: evidence and import // In Singularity Hypothesis: A Scientific and Philosophical Assessment, Eden (eds). Springer. Berlin. 2012.
Musallam S., Cornel B.D., Creger B. et al. Cognitive control signals for neural prosthetics // Science. 2004. V. 305. P. 258–262.
Nordmann A. Converging technologies: Shaping the future of European societies // European Commission. 2004.
Ojha S., Williams M-A. Ethically-Guided Emotional Responses for Social Robots: Should I Be Angry? // In: Agah A., Cabibihan JJ., Howard A., Salichs M., He H. (eds.) Int. Conf. on Social Robotics ICSR. 2016. P. 233–242. https://doi.org/ https://doi.org/10.1007/978-3-319-47437-3_23.10.1007/978-3-319-47437-3_23.
Olds J. Hypothalamic substrates of reward // Physiol. Rev. 1962. V. 42(4). P. 554–604.
Overman W.H., Pate B.J., Moore K., Peuster A. Ontogeny of Place learning in Children as Measured in the Radial Arm Maze, Morris Search Task and Open Field Task // Behav. Neurosci.1996. V. 110(6). P. 1205–1228.
Pearson M.J., Mitchinson B., Sullivan J.C. et al. Biomimetic vibrissal sensing for robots // Phil. Trans. R. Soc. 2011. V. 366. P. 3085–3096.
Pennartz C.M., Lee E., Verheul J. et al. The ventral striatum in off-line processing: ensemble reactivation during sleep and modulation by hippocampal ripples // J. Neurosci. 2004. V. 24. P. 6446–6456.
Peters T. The soul of trans-humanism // Dialog. A J. Theology. 2005. V. 44(4). P. 384.
Phillips H. Brain prothesis passes live tissue test // New Scientists. 25 Oct. 2004.
Prescott T.J., Lepora N., Verschure P.F.M. A future of living machines? International trends and prospects in biomimetic and biohybrid systems // Proc of SPIE – The International Soc. for Optical Engineerring. 2014. https://doi.org/10.1117/12.2046.30510.1117/12.2046.305
Reynolds J.N.J., Wickens J.R. Substantia nigra dopamine regulates synaptic plasticity and membrane potential fluctuations in the rat neostriatum, in vivo // Neuroscience. 2000. V. 99. P. 199–203.
Ribeiro S. Sleep and plasticity // Pfluger-Archive Eur. J. Physiol. 2012. 463(1). 111–120.
Roco M.C., Bainbridge W.S. Converging technologies for Improving Human Performance: Nanotechnology, Biotechnology, Information Technology and Cognitive Science. Springer. Berlin, 2003.
Rose S. The making of memory: from molecules to mind. London. N.Y. Bantham Press, 1993.
Rosenfeld C.S., Ferguson S.A. Barnes Maze Testing Strategies with Small and Large Rodent Models // Vis. Exp. 2014. V. 84. c51194. https://doi.org/10.3791/51194
Sanner M. A comparison of public attitudes toward autopsy, organ donation and anatomic dissection. A Swedish Survey // J. Fm. Med. Assoc. 1994. V. 271. P. 284–288.
Schwartz A.B. Useful signals from motor cortex // J. Physiology. 2007. V. 579. P. 581–601.
Scoville W.B., Milner B. Loss of recent memory after bilateral hippocampal lesions // J. Neurol. Neurosurgery & Psychiatry. 1957. V. 20. P. 11–21.
Sigurdsson T., Doyer V., Cain C.K., LeDoux J.E. Long-term potentiation in the amygdala: a celullar mechanism of fear learning and memory // Neuropharmacology. 2007. V. 52. P. 215–227
Taylor D.M., Tillery S.I., Schwartz A.B. Direct cortical control of 3D neuroprosthetic devices // Science. 2002. V. 296. P. 1829–1832.
Vitale J., Williams M-A., Johnston B. Socially Impaired Robots: Human Social Disorders and Robot’s Socio – Emotional Intelligence // arXiv: 1602.04529v1 [cs. RO] 15 Feb 2016. 10.1007 1978-3-319-11973-1-36
Wang X., Su X., Huai R. et al. Telemetry navigation system for animal-robots // Robot. 2006. V. 28(2). P. 183–186.
Wiener S.I., Shibata R., Tabuchi E., Trullier O., Albertin S.V., Mullder A.B. Spatial and behavioral correlates in nucleus accumbens neurons receiving hippocampal or prefrontal cortical inputs // Int. Congr. Ser. Elsevier. 2003. V. 1250. P. 275–292.
Williams M.A. Robot social intelligence. In: Ge S.S., Khatib O., Cabibihan J.J., Simmons R., Williams MA. (eds) Social Robotics. ICSR 2012. p. 45–55. Lecture Notes in Computer Science, V. 7621. Springer, Berlin. https://doi.org/ https://doi.org/10.1007/978-3-642- 34103-8_510.1007/978-3-642- 34103-8_5.
Wolbring G. Artificial Hippocampus, the Bony Hive Mind and Other Neurological Endeavors // Innov. Watch. 15 Nov. 2006
Wood H. Neural repair and rehabilitation: Achieving complex control of a neuroprosthetic arm // Nature Reviews Neurology. 2013. V. 9(2). P. 62–62.
Wiener S.I., Tabuchi E., Mulder A.B. Position and behavioral modulation of synchronization of hippocampal and accumbens neurons discharges in freely moving rats // Hippocampus. 2000. V. 10. P. 718–728.
Yarmohamadi M., Javadi H.H.C., Erfani H. Improvement of robot path planning using particle swarm optimization in dynamic environments with mobile obstacle and targets // Advanced Studies in Advanced Studies in Biology. 2011. V. 3(1). P. 43–53.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук



