Успехи физиологических наук, 2021, T. 52, № 4, стр. 3-17
Взаимодействие синтаз оксида азота с циклооксигеназами при регуляции физиологических и патофизиологических процессов и его роль в механизмах адаптивной гастропротекции
В. А. Золотарев a, *, Р. П. Хропычева a, **
a Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН, лаборатория физиологии пищеварения
Санкт-Петербург, Россия
* E-mail: zolotarevva@infran.ru
** E-mail: khropychevarp@infran.ru
Поступила в редакцию 19.05.2021
После доработки 02.06.2021
Принята к публикации 20.07.2021
Аннотация
На клеточном и тканевом уровне регуляции физиологических и патофизиологических процессов нитрергическая и простагландиновая системы находятся в тесном контакте, воздействуя друг на друга. Целью предлагаемого обзора является систематизация сведений о взаимодействии конститутивных и индуцибельных изоформ синтазы оксида азота (NOS) и циклооксигеназы (ЦОГ), в которой основное внимание уделяется роли этого феномена в механизмах гастропротекции. Взаимодействие между NOS и ЦОГ происходит на разных этапах регуляции работы ферментов, включая влияние на доступность субстрата, изменение каталитической активности самих ферментов, их транскрипции и трансляции. Кроме того, во взаимодействие вступают внутриклеточные ферментативные сигнальные пути, связанные с оксидом азота (NO) и простагландинами. Результат взаимного влияния ферментов зависит от того, какие их изоформы взаимодействуют, скорости синтеза и степени окисления молекулы NO. Также в обзоре анализируются особенности взаимодействия нейрональной и эндотелиальной NOS с ЦОГ, и участие в этом процессе капсаицин-чувствительных афферентов при осуществлении реакций гастропротекции. Сделан вывод, что дальнейшее изучение специфичных механизмов взаимодействия NOS и ЦОГ может выявить новые молекулярные мишени для фармакологических воздействий.
ВВЕДЕНИЕ
Простагландины (ПГ) и оксид азота (NO) являются основными ауто- и паракринными регуляторами реакций адаптивной гастропротекции, а именно: усиления кровотока в подслизистом слое, увеличения секреции слизи и бикарбонатов на поверхность СОЖ, уменьшения агрегации тромбоцитов, ускорения клеточной пролиферации эпителия, а также сокращения эндогенной секреции кислоты в ответ на раздражение СОЖ потенциально ульцерогенными агентами [62].
Простагландины синтезируются во всех тканях организма циклооксигеназами (ЦОГ) из арахидоновой кислоты. В желудке ЦОГ представлены двумя изоформами, конститутивными (ЦОГ-1) и индуцибельными (ЦОГ-2) ферментами. Конститутивная изоформа производит ПГ в наномолярной концентрации, достаточной, тем не менее, для поддержания гомеостаза СОЖ. Экспрессия ЦОГ-2 в базальных условиях незначительна, но возрастает на порядок под действием провоспалительных цитокинов и факторов роста. Вместе с увеличением экспрессии ЦОГ-2 значительно возрастает продукция ПГ, вследствие чего происходит инфильтрация лейкоцитов, формируется отек, возникает воспаление и боль.
Синтазы оксида азота (NOS) – другая группа ферментов, выполняющая сходные функции по поддержанию гомеостаза ЖКТ, а также при воспалительных процессах. NOS катализирует превращение L-аргинина в L-цитрулин и NO. Конститутивные изоформы фермента: эндотелиальная (eNOS) и нейрональная (nNOS), – продуцируют NO в наномолярной концентрации, достаточной для запуска реакций в близлежащих тканях. Индуцибельная форма (iNOS), транскрипция которой усиливается под действием воспалительных стимулов, например, эндогенных цитокинов или бактериального липополисахарида, независимо от внутриклеточной концентрации Ca2+ продуцирует NO в микромолярной концентрации, что ведет к отсроченному образованию токсичных активных форм азота [4].
Нитрергическая и простагландиновая системы повсеместно вступают в тесный контакт, управляя обычно одними и теми же физиологическими и патофизиологическими процессами. Результат взаимодействия NO/ЦОГ зависит от условий, в которых оно происходит. При этом NO и ПГ задействуют различные внутриклеточные сигнальные пути. Оксид азота активирует растворимую гуанилатциклазу (ГЦ-I), что приводит к увеличению концентрации цГМФ, а ПГ стимулируют главным образом синтез цАМФ [27]. В результате создаются условия для многообразных взаимодействий нитрергической и простагландиновой систем между собой. Впервые возможность влиять на активность ЦОГ с помощью NO была показана группой P. Needleman на изолированных семенных пузырьках овец, в которых экзогенный газообразный NO ускорял работу ЦОГ-1, что приводило к многократному увеличению продукции ПГE2 [94]. Эти исследования легли в основу концепции, рассматривающей ЦОГ как важный внутриклеточный “рецептор”, служащий для усиления, либо модулирования сигналов NO.
Последующее 30-летнее изучение функциональной связи между NOS и ЦОГ выявило взаимодействие между нитрергической и простагландиновой системами на разных уровнях регуляции. Прежде всего, NO и его окисленные формы могут напрямую влиять и на синтез ПГ и экспрессию ЦОГ-1,-2, как усиливая их, так и ослабляя. С другой стороны, перекисные соединения, генерируемые ЦОГ, также способны изменять биосинтез NO [96]. Большим разнообразием характеризуются взаимодействия внутриклеточных ферментативных каскадов, связанных с NOS и ЦОГ, в которое вовлечены капсаицин-чувствительные первичные афференты (КЧПА) [51]. Эти данные, наряду с их фундаментальной важностью, имеют значение для развития потенциала нестероидных противовоспалительных препаратов (НПВП). Известный прогресс в терапевтическом использовании способности NO функционально замещать ПГ нашел отражение в разработке группы селективных ингибиторов ЦОГ-2, конъюгированных с донором NO [10]. Оксид азота компенсировал связанное с отсутствием ПГ увеличение риска инфаркта миокарда, инсульта, сердечной недостаточности и гипертонии, задержки заживления желудочных язв, торможения клеточной пролиферации и ангиогенеза [20, 71]. В то же время при отсутствии сведений о сохраняющихся или нарушенных связях NOS/NO/ЦОГ роль доноров NO остается не вполне ясной.
В предлагаемом обзоре авторы попытались систематизировать данные о взаимодействии конститутивных и индуцибельных изоформ NOS с ЦОГ в норме и при патологии, уделяя основное внимание значению этого феномена для гастропротекции.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ВЛИЯНИЯ NO И ЕГО ОКИСЛЕННЫХ ФОРМ НА АКТИВНОСТЬ ЦИКЛООКСИГЕНАЗ
Результат действия NO на изоформы ЦОГ в значительной мере зависит от скорости синтеза NO и степени окисления молекулы. Изменение этих параметров может приводить к противоположным эффектам. Ранние работы показали, что прямое влияние NO на гем простетической группы ЦОГ в анаэробных условиях маловероятно [128]. На начальных этапах исследования опровергалось также участие ГЦ-I в реакции между NO и ЦОГ in vivo и in vitro, поскольку специфические ингибиторы ГЦ-I, например, метиленовая синь, не влияли на потенцирующий эффект NO [23, 53, 70, 72, 94, 95, 134]. Позже возможность ГЦ-I-опосредованного взаимодействия между NO и ЦОГ получила подтверждение, а также была показана эффективность неметаболизируемого аналога цГМФ, dbcГМФ, для стимуляции синтеза ПГ в клетках карциномы легких и в слизистой оболочке двенадцатиперстной кишки (ДПК) [36, 105, 137].
Среди молекулярных механизмов, посредством которых NO действует на каталитическую активность ЦОГ, первым было описано антиоксидантное влияние NO. Известно, что выделяющиеся при стимуляции ЦОГ супероксид анионы вызывают автоинактивацию фермента [31]. Присутствие же NO, связывающего ${\text{О}}_{2}^{ - }$ с образованием пероксинитрита (ONOO–), в определенной мере поддерживает каталитическую активность ЦОГ-1 и ЦОГ-2 [40, 64]. Пероксинитрит также может взаимодействовать с простетической группой гемоглобина и с остатками тирозина циклооксигеназного сайта. Предполагается, что, взаимодействуя с Fe в составе гема, ONOO– ускоряет процесс катализа [56, 67]. Модификация под действием ONOO– тирозинового остатка, особенно Tyr-385, напротив, инактивирует фермент [14, 39, 98]. Действуя на Tyr, ONOO– модифицирует ЦОГ при хроническом воспалении и других патологических состояниях, включая атеросклероз, болезнь Паркинсона и болезнь Альцгеймера [58]. В клеточных культурах описана способность L-аргинина, доноров NO, а также пероксинитрита, посредством стимуляции фосфолипазы A2 (PLA2), ускорять выделение арахидоновой кислоты из мембранных фосфолипидов, и, следовательно, облегчать синтез эйкозаноидов [8, 19].
Стимуляция ЦОГ с помощью NO может происходить и за пределами простетической группы гемоглобина через образование S-нитрозотиолов [43]. Этот путь характерен для регуляции активности ЦОГ-2, S-нитрозилирование которой длится столько, сколько сохраняется активность iNOS [57]. Cпецифическое S-нитрозилирование остатков цистеина в ЦОГ-2 происходит при непосредственном контакте между молекулами iNOS и ЦОГ-2 [57]. Принципиальная важность контакта между самими молекулами ферментов подтверждается тем, что доноры NO не модифицируют цистеин в ЦОГ-1,-2 [129]. Процесс S-нитрозилирования ЦОГ-2 не ограничивается макрофагами. В головном мозге, где ЦОГ-2 экспрессируется конститутивно, S-нитрозилирование фермента происходит с помощью nNOS [127]. Интересно, что iNOS-зависимое S-нитрозилирование не ограничивается только ЦОГ. Таким путем iNOS активирует цитоплазматическую фосфолипазу A2α (PLA2α). В этом случае PLA2α не взаимодействует с iNOS напрямую, но образует комплекс с iNOS/ЦОГ-2, т.е. и в этом случае активация ЦОГ-2 является основным этапом для S-нитрозилирования и индукции PLA2α [140].
ДЕЙСТВИЕ NO НА ТРАНСКРИПЦИЮ И ТРАНСЛЯЦИЮ ЦОГ
Оксид азота модулирует продукцию ПГ, оказывая влияние на транскрипцию и трансляцию ЦОГ-2 [134]. В культуре хондроцитов человека аппликация донора NO в летальной дозе сопровождалось увеличением экспрессии ЦОГ-2 и синтеза ПГЕ2, наряду с фрагментацией ДНК и индукцией каспазы-3 [80]. Эти изменения отсутствуют на фоне блокады митоген-активируемой протеинкиназы, киназы p38, либо селективного угнетения ЦОГ-2. При этом сам по себе ПГЕ2 не ускорял клеточную смерть, но потенцировал эффект NO. Аналогичное взаимодействие между NO и ЦОГ-2 через p38-зависимую стимуляцию ядерного фактора κB (NF-κB) выявлено в восходящем канальце петли Генле [24]. В целом можно считать, что NO активирует внеклеточные сигнал-зависимые протеин киназы и киназу p38, стимулирующие ЦОГ-2 и синтез ПГЕ2, который в свою очередь потенцирует эффект NO и ускоряет клеточную смерть [80].
Оксид азота необходим для поддержания длительной экспрессии гена ЦОГ-2 и биосинтеза ПГЕ2, что, однако, не приводит к изменению уровня мРНК ЦОГ-2 [54, 84, 126]. Известно, что NO взаимодействует с рядом внутриклеточных сигнальных каскадов, которые потенциально связаны с экспрессией ЦОГ, а именно цАМФ/PKA/CREB и JNK/Jun/ATF2 [65, 82]. Определяющее значение в модуляции биосинтеза NOS/ЦОГ имеет внутриклеточная концентрация NO и ПГ. В микроглии человеческого плода при очень низких концентрациях NO, который генерируют конститутивные изоформы NOS, экспрессия ЦОГ усиливается и ускоряется синтез ПГ [54], в то время как высокие концентрации NO подавляют активность ЦОГ-2 [108]. Наиболее вероятным посредником, обеспечивающим экспрессию iNOS в ответ на многие внеклеточные стимулы, является ядерный фактор – κB. В астроглии NO, синтезированный cNOS в базальных условиях, удерживает iNOS в неактивном состоянии, ослабляя действия NF-κB [13, 21, 45, 69]. Угнетение NF-κB с помощью NO происходит несколькими путями, включая прямое действие NO на связывание NF-κB с промотером, а также S-нитрозилирование остатка Цис-62 в субъединице p50 или стабилизацию эндогенного ингибитора NF-κB, IκB-α [28, 68, 83]. Таким образом, в клетках, в которых синтез iNOS происходит под действием внеклеточных стимуляторов NF-κB, NO может вызвать начальное торможение активности iNOS. Затем, по мере увеличения концентрации, NO, взаимодействуя с оксидом серы, трансформируется в пероксинитрит, что приводит к угнетению NF-κB и активации iNOS. Поскольку NF-κB является также мощным стимулятором ЦОГ-2, этот механизм может быть задействован в торможении синтеза ПГ [29].
ВЛИЯНИЕ ЦИКЛООКСИГЕНАЗ НА НИТРЕРГИЧЕСКУЮ РЕГУЛЯЦИЮ ФУНКЦИЙ
Почти одновременно с открытием действия NO на ЦОГ появились данные, что продукты ЦОГ также могут влиять на нитрергическую систему. При этом уменьшение или увеличение продукции NO под действием ПГ зависит от типа клеток, в которых идет синтез. В перитонеальных макрофагах мыши на фоне высокого уровня ПГI2 активность iNOS ослабевает. Похожие результаты получены на клетках Купфера крысы, в которых при стимуляции эндотоксином снижение уровня ПГ сопровождалось сокращением синтеза NO. В качестве основного посредника как тормозного, так и возбуждающего действия ПГ на NOS рассматривается аденилатциклаза и увеличение цитоплазматического уровня цАМФ. Например, в мышечном слое кровеносных сосудов крысы активаторы PKA, такие как форсколин или дибутирил цАМФ, стимулируют синтез мРНК iNOS [73]. В культуре клеток плотного пятна (Macula densa) дистального извитого канальца аппликация ПГЕ2 сопровождалась заметным снижением экспрессии мРНК nNOS, что приводило к ослаблению секреции ренина [23]. Угнетение ЦОГ с помощью индометацина или аспирина, ведущее в тромбоцитах к снижению продукции тромбоксана А2, сопровождалось снижением активности NOS. Торможение NOS с помощью индометацина прекращалось в присутствии Ca2+, что не было связано с изменениями экспрессии NOS [22].
От каталитической активности ЦОГ-2 также зависит доступность субстратов и ферментов синтеза NO: L-аргинина, NADPH, кислорода, тетрагидробиоптерина (H4B), гема, ФМН и ФАД. Такое действие ЦОГ-2 осуществляется за счет пероксидазной активности этого фермента и генерации форм активного кислорода [66, 132]. Пероксид водорода стимулирует продукцию H4B в сосудистых эндотелиальных клетках [99]. Кроме того, известно, что цАМФ увеличивает активность iNOS, ускоряя трансмембранный перенос L-аргинина и замедляя его превращение в L-цитруллин [32].
NOS И ЦОГ В СЛИЗИСТОЙ ОБОЛОЧКЕ ЖЕЛУДКА
Иммунное мечение и гибридизация in situ показали, что изоформы cNOS обильно экспрессируются в стенке желудка. Эндотелиальная изоформа присутствует в кровеносных сосудах мышечного и подслизистого слоя [88, 138]. Нейрональная синтаза NO выявляется значительно шире: в нейронах миэнтерального сплетения [15, 38], в клетках эпителия и желудочных желез, включая слизистые, главные, щеточные и некоторые эндокринные клетки. В этих же клетках присутствует растворимая ГЦ-I [16–18, 33, 52, 61, 89]. Действие NO может распространяться на соседние клетки. Известны расчеты, показывающие, что в течение нескольких секунд до окисления молекула NO способна диффундировать на расстояние свыше 200 мкм [139]. Индуцируемая форма NOS экспрессируется в макрофагах при глубоких поражениях СОЖ [115].
Локализация ЦОГ-1 в СОЖ отличается от топографии cNOS. Синтез ПГ идет в отдельных мезенхимных клетках базальной пластинки, фибробластах и макрофагах. Менее интенсивное иммунное окрашивание ЦОГ-1 обнаруживается в железистых, обкладочных и слизистых клетках пилорических желез, но, что обращает на себя внимание, фермент не встречается в поверхностных эпителиальных клетках желудка [125]. В здоровой слизистой оболочке ЦОГ-2 отсутствует, но в изобилии появляется в очагах воспаления, где обеспечивает резкое увеличение синтеза провоспалительных ПГ [102]. При гастрите и язвенной болезни желудка сильное иммунное окрашивание ЦОГ-2 выявлено в мезенхимных клетках собственной пластинки и вокруг капилляров, в макрофагах и фибробластах в зоне грануляции, а также в регенерирующем эпителии и в участках кишечной метаплазии [125].
Большинство ПГ, образующихся в желудке человека и грызунов, – это ПГE2 и ПГI2 [85, 86]. В СОЖ также присутствует тромбоксан, но он синтезируется в основном тромбоцитами [135]. Разнообразные физиологические эффекты ПГ определяются типом и положением рецепторов, на которые направлено его действие. У грызунов мРНК рецептора EP1 находят в мышечных клетках желудка [30], а также в главных и обкладочных клетках желудочных желез [79]. Матричная РНК рецептора EP3 встречается в обкладочных клетках, миэнтеральных нейронах и клетках глии [30, 75, 79]. Четвертый подтип рецепторов (EP4) найден в обкладочных и слизистых эпителиальных клетках, в эндотелиальных клетках, в стенках артерий и вен [30, 79, 91, 142]. В эпителиальных клетках, секретирующих ионы бикарбоната $\left( {{\text{HCO}}_{3}^{ - }} \right),$ показана экспрессия рецепторов EP3/4 [30]. В то же время применение селективных блокаторов ПГ рецепторов и соответствующих ген-нокаутных линий мышей показало, что усиление секреции ${\text{HCO}}_{3}^{ - }$ происходит посредством рецептора EP1 [120]. Рецепторы простациклина (IP) преобладают в мембранах тромбоцитов и в сосудистых гладкомышечных клетках. Особый интерес для исследования гастропротективных механизмов вызывает присутствие рецепторов IP, наряду с EP2, в плазматической мембране капсаицин-чувствительных нервных окончаний в подслизистом слое [104, 118].
Таким образом, в здоровой СОЖ и в подслизистом слое не наблюдается полного перекрывания сайтов, экспрессирующих сNOS и ЦОГ-1. По-видимому, NO не способен стимулировать или тормозить активность ЦОГ-1, действуя непосредственно на гем последней, ввиду низкой аффинности к нему. Часто противоречащие друг другу данные говорят о том, что взаимодействие NO с ЦОГ осуществляется через связанные с ними ферментативные сигнальные каскады, главным образом через взаимодействие цАМФ и цГМФ [128].
ВЗАИМОДЕЙСТВИЕ NOS И ЦОГ В РЕАКЦИЯХ АДАПТИВНОЙ ГАСТРОПРОТЕКЦИИ
Запуск гастропротективных процессов в здоровой СОЖ, включающих усиление кровотока в подслизистом слое, секрецию слизи и бикарбонатов на поверхность эпителия, ослабление агрегации тромбоцитов и лейкоцитов, является, в основном, результатом локального взаимодействия нитрергической и простагландиновой систем. В культуре слизистых эпителиальных клеток из желудка кролика экзогенный NO усиливал синтез ПГЕ2 и повышал уровень стабильного метаболита ПГI2, 6 кето-ПГF1α. Умеренный рост концентрации ПГ под действием экзогенного NO предполагает участие ЦОГ-1. Неселективный блокатор NOS, L-NNA, а также аналог цГМФ, 8-бромо-цГМФ, не влияли на уровень ПГЕ2 и 6 кето-ПГF1α, скорее всего, в связи с отсутствием в изолированных клетках базальной продукции NO. Очевидно также, что в культуре эпителиальных клеток ГЦ-I/цГМФ зависимые пути активации ЦОГ не работали [130].
С функциональной точки зрения взаимодействие NO/ЦОГ-1 в желудке лучше всего изучено в процессах заживления эпителия, а также в регуляции секреции бикарбонатов и тонуса кровеносных сосудов. Секреция ${\text{HCO}}_{3}^{ - }$ поверхностными эпителиоцитами в ответ на закисление полостного содержимого или ирритацию слизистой оболочки является одним из основных механизмов построения преэпителиального защитного барьера в желудке и ДПК. Насыщая мало перемешиваемый слой слизи на поверхности эпителия, относительно небольшое количество бикарбонатов нейтрализует протоны, диффундирующие из полости желудка [6, 34]. При этом локальная регуляция секреции ${\text{HCO}}_{3}^{ - }$ практически полностью зависит от синтеза ПГ, NO и нервных факторов [74].
Ранние исследования показали, что пороговые концентрации слабых ирритантов, запускающие протективные сосудистые и секреторные реакции в СОЖ, не всегда стимулируют эндогенный синтез ПГ, зато способствуют секреции других медиаторов [47, 103]. К тому же повышение концентрации ПГ в ответ на аппликацию ирританта отстает во времени от сосудистых реакций [25, 77, 107]. Следовательно, весьма вероятно, что на фоне слабых раздражающих воздействий на здоровую СОЖ, продукция NO конститутивными NOS приводит к потенциации ЦОГ-1, при этом участие индуцибильных изоформ ферментов в реакциях адаптивной гастропротекции представляется ничтожным [60, 115].
Было установлено, что в желудке стимулирующее действие ЦОГ-1/ПГЕ2 на секрецию ${\text{HCO}}_{3}^{ - }$ полностью опосредовано рецептором ЕP1, через который активируются Gqα белки, PLC-β/PIP2/IP3 и высвобождение внутриклеточного Ca2+ [119]. Другие разновидности ПГ рецепторов, ЕP3/4, выявленные иммуногистохимически, не связаны с продукцией ${\text{HCO}}_{3}^{ - }$ в желудке [30]. Реакция рецепторов EP3/4, опосредованная белком Gsα и аденилатциклазой, скорее всего, неэффективна в поверхностных эпителиоцитах, где активность аденилатциклазы низка, и прямая стимуляция фермента форсколином не изменяет продукцию ${\text{HCO}}_{3}^{ - }$ [114, 119]. В ДПК реакции ЦОГ-1/ПГЕ2 также запускают защитную секрецию ${\text{HCO}}_{3}^{ - },$ но здесь она опосредуется рецепторами ЕP3/4 через белок Gsα и цАМФ [78, 106, 124].
Роль NO в формировании бикарбонатного барьера на поверхности СОЖ не так очевидна. Системное введение блокатора конститутивных NOS (L-NAME) приводило к парадоксальному, на первый взгляд, дозозависимому усилению базальной секреции ${\text{HCO}}_{3}^{ - }$ в иннервированом желудке in situ, которое коррелировало с подъемом артериального давления. Индометацин, а также М- и N-холиноблокаторы отменяли эффект L-NAME [63, 110, 112, 113]. Доноры NO, напротив, снижали базальный уровень ${\text{HCO}}_{3}^{ - },$ что было связано с активацией ГЦ-I и в то же время зависело от синтеза ПГ [5, 59, 110]. Похожее усиление базальной секреции ${\text{HCO}}_{3}^{ - }$ на фоне системного введения L-NАМЕ регистрировали в ДПК [121]. В денервированном малом желудочке по Гейденгайну и в изолированном желудке мыши аппликация доноров NO, напротив, сопровождалась ГЦ-I зависимым увеличением продукции ${\text{HCO}}_{3}^{ - }$ [11, 59].
Участие нитрергической системы в усилении секреции ${\text{HCO}}_{3}^{ - }$ при ирритации СОЖ не получило подтверждения в ранних исследованиях [111]. Позднее, эффект неселективной блокады cNOS был показан, но только при сильном раздражении СОЖ. Так L-NAME не влиял на секрецию ${\text{HCO}}_{3}^{ - },$ вызванную действием 100 мМ HCl, но ослаблял реакцию на более концентрированный раствор кислоты (200 мМ) или на кислоту, добавленную к гипертоническому раствору [5].
Авторы этого обзора установили, что в желудке in situ изоформы cNOS оказывают разнонаправленное действие на секрецию ${\text{HCO}}_{3}^{ - },$ как базальную, так и вызванную ирритацией слизистой оболочки. У наркотизированных крыс блокада nNOS приводила к ослаблению секреции ${\text{HCO}}_{3}^{ - }.$ Результат же селективного угнетения eNOS зависел от уровня секреции кислоты в желудке. При сохраненной базальной секреции H+ блокада eNOS заметно усиливала секрецию ${\text{HCO}}_{3}^{ - },$ но при угнетении секреции кислоты с помощью омепразола блокада eNOS становилась неэффективной [1]. Было выяснено, что зарегистрированный феномен связан с сокращением на фоне блокады eNOS кровотока в желудке, что провоцирует накопление в области базальной пластинки ионов бикарбоната, доступных для транспорта на поверхность СОЖ [2]. В то же время, характерное в условиях ирритации усиление кровотока в подслизистом слое зависело, главным образом, от активности nNOS [4, 90].
Немногочисленные работы, описывающие секрецию ${\text{HCO}}_{3}^{ - }$ в ответ на ирритацию в желудке и в ДПК, подтвердили, что стимулирующий эффект NO связан с взаимодействием NO/ЦОГ-1 [3, 36, 37, 105]. При этом нитрергическое увеличение продукции ${\text{HCO}}_{3}^{ - }$ зависело от реакции NO/ГЦ-1/цГМФ и последующего синтеза ПГЕ2, который, в свою очередь, через рецептор EP1 активирует Gqα белки, PLC-β/PIP2/IP3 и высвобождение внутриклеточного Ca2+ [78, 119, 124]. Анализ взаимодействия изоформ cNOS c ЦОГ при потенциации желудочной секреции ${\text{HCO}}_{3}^{ - }$ показал, что эффект nNOS полностью реализуется через ГЦ-I/цГМФ зависимое усиление синтеза ПГ. Взаимодействие eNOS/ПГ при регуляции секреции ${\text{HCO}}_{3}^{ - }$ оказалось более сложным. Угнетение ЦОГ индометацином сопровождалась усилением реакции на блокаду eNOS [3]. Данные о взаимодействии NO и ЦОГ в эндотелии сосудов подтверждают возможность такого эффекта. В культуре эндотелиальных клеток ослабление синтеза ПГ при блокаде ЦОГ компенсируется усилением продукции NO, за счет чего поддерживается вазодилатация [133]. Посредником, увеличивающим синтез NO в этом случае, может быть Ca2+, концентрация которого в цитоплазме эндотелиальных клеток возрастает вследствие потенциации действия гистамина при блокаде ЦОГ. Кроме того, гистамин усиливает продукцию цГМФ [12].
Локальная вазодилатация рассматривается как ведущий механизм гастропротекции, в реализации которого значительную роль играет взаимодействие NO с ЦОГ, которое в норме происходит на уровне ферментативных сигнальных каскадов [128]. Исследования на культуре эндотелиальных клеток показали, что NO существенно усиливает биосинтез ПГ. В этих же клетках блокатор конститутивных NOS, L-NMMA, кроме ослабления синтеза NO понижал, а донор NO увеличивал концентрацию 6-кето-ПГF1α. С другой стороны, ПГ не способны компенсировать ослабление вазодилатации, вызванное блокадой NOS, равно как и аппликация ПГЕ2 не влияла на уровень метаболитов NO в ткани [133]. Известно, что цГМФ стимулирует цАМФ через угнетение в сосудистой стенке цАМФ-фосфодиэстеразы. Кроме того, агенты, повышающие уровень цАМФ и цГМФ, вызывают ослабление активности PLС и уменьшение концентрации внутриклеточного Ca2+ [136]. В изолированных микрососудах выделение нитратов в ответ на аппликацию форсколина, 8-бромо-цАМФ и изопротеренола опосредовалось PKA и фосфатидилинозитол 3-киназой. При этом взаимодействие цАМФ/NO не сказывалось на экспрессии белка NOS [143].
Еще одним звеном координации нитрергической и простагландиновой систем при ирритации СОЖ являются капсаицин-чувствительные первичные афферентные окончания (КЧПА), которые регулируют секреторные реакции, кровоток в подслизистом слое и моторику желудка. Действие КЧПА, поддерживающее целостность СОЖ, осуществляется локально посредством кальцитонин-ген родственного пептида (КГРП), который секретируется из терминалей первичных афферентов. Экскреции КГРП можно добиться в эксперименте с помощью алкалоида капсаицина (КАПС), известного как относительно селективный стимулятор рецепторов переменного потенциала ванилоидных 1-го типа (TRPV1) в плазматической мембране афферентных окончаний. Необходимо отметить, что КГРП принципиально важен для запуска реакций на ирритацию СОЖ [46, 49]. У КГРП ген-нокаутных животных реакции адаптивной гастропротекции полностью отсутствуют [81, 100]. Кроме того, во многих TRPV1-содержащих волокнах в области базальной пластинки и в мышечном слое, но, в основном, около артериол подслизистого слоя, присутствует nNOS, и при ирритации СОЖ в нервных окончаниях идет синтез NO [50, 51].
Действие КГРП осуществляется через мембранный КГРП-рецептор и опосредуется Gsα пептидом и аденилатциклазой. Повышение концентрации цАМФ приводит к активации PKA и, в некоторых случаях, к открытию АТФ-чувствительных калиевых каналов, что способствует, например, вазодилатации. Важным свойством КГРП является запуск эндотелий-зависимой вазорелаксации, которую обеспечивает взаимодействие цАМФ/eNOS [93].
Многие локальные эффекты КЧПА в желудке, такие как стимуляция секреции ${\text{HCO}}_{3}^{ - }$ и гиперемия, связаны с эндогенным синтезом ПГ. Так аппликация КАПС на желудочный эпителий приводила к увеличению концентрации продукта гидролиза ПГI2, 6-кето ПГF1α [123]. В сосудистой стенке синтез ПГI2, стимулированный КГРП, является результатом взаимодействия eNOS/ЦОГ-1 [44]. Продукция ПГI2 увеличивалась также при ацидификации СОЖ, причем в этом случае она зависела от нормального функционирования первичных афферентов [123].
Стимуляция первичных афферентов в желудке с помощью КАПС не влияла на продукцию ПГE2, хотя в ДПК аналогичное воздействие вызывало заметное увеличение концентрации ПГЕ2 [55, 118]. В то же время, синтез ПГЕ2 в желудке усиливался на фоне ацидификации слизистой оболочки, но молекулярный механизм этой реакции до сих пор неизвестен. В результате, под действием ПГЕ2 посредством рецепторов EP1 и независимо от КЧПА развивалась гиперемия и увеличивалась продукция ${\text{HCO}}_{3}^{ - }$ [7, 76].
Эффекты экзогенного КГРП не были связаны с продукцией ПГ и не изменялись под действием неселективного блокатора ЦОГ индометацина, но секреция КГРП в ответ на аппликацию КАПС в присутствии индометацина значительно ослабевала. Это наблюдение обосновывает наличие обратной связи между клетками, синтезирующими ПГ и КЧПА, с помощью которой ПГЕ2 и ПГI2 потенцируют реакции первичных афферентов в желудке. Дополнительно сообщалось, что ПГI2 вызывал более сильную сенситизацию КЧПА, чем ПГЕ2 [50, 123]. Сенситизация КЧПА под действием ПГЕ2 происходит с участием рецепторов EP2, а действие ПГI2 осуществляется через IP рецепторы. Вероятно, основным механизмом как ПГЕ2/ЕР2-, так и ПГI2/IP-зависимой сенситизации КЧПА является стимуляция аденилатциклазы [122]. Усиление кровотока в сосудистом русле желудка, вызванное обратной диффузией кислоты через поврежденный слизистый слой, связано с относительно независимыми эффектами простагландина ПГЕ2 и КЧПА/ПГI2. Ранняя фаза сосудистой реакции определялась действием ПГЕ2 через рецептор EP1, поздняя фаза зависела от ПГI2/IP. Реакции обеих фаз прекращались после десенситизации КЧПА [117, 118]. Таким образом, ПГE2, ПГI2 и NO включены в два относительно самостоятельных контура регуляции гастропротективных реакций в желудке, взаимодействующих через КЧПА (рис. 1).
Рис. 1.
Взаимодействие оксида азота, простагландинов и капсаицин-чувствительных афферентных нервных окончаний при регуляции тонуса кровеносных сосудов и секреции бикарбонатов в желудке. 1) – капсаицин-чувствительное нервное окончание; 2) артериола подслизистого слоя; 3) мезенхимная клетка; 4) клетки поверхностного эпителия. ГЦ-I – растворимая гуанилатциклаза, КАПС – капсаицин, КГРП – кальцитонин-ген родственный пептид, КГРП-Р1– рецептор кальцитонин-ген родственного пептида 1, ПГE2 – простагландин E2, ПГI2 – простациклин I2, цАМФ – циклический аденозин монофосфат, цГМФ – циклический гуанозинмонофосфат, ЦОГ-1 – циклооксигеназа-1, ASIC – кислоточувствительный ионный канал, EP1,2 – рецепторы простагландина 1 и 2, H+ – протон, IP – рецептор простациклина, nNOS, eNOS – нейрональная и эндотелиальная синтазы оксида азота, NO – оксид азота, TRPV1 – рецептор переменного потенциала ванилоидный 1-го типа.
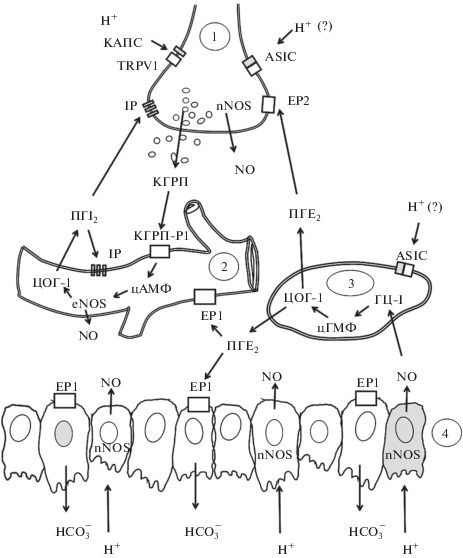
Аппликация слабых ирритантов повышает устойчивость СОЖ к последующему поражению сильными ульцерогенными факторами. Данный феномен, положенный в основу теории адаптивной гастропротекции, полностью зависит от увеличения синтеза простагландинов, ЦОГ-1/ПГЕ2 [92, 116]. Реакции адаптивной гастропротекции, вызванные аппликацией на СОЖ таурохолевой кислоты длятся более 5 часов. В это время включается несколько защитных механизмов: на раннем этапе гастропротекция связана с реакцией ЦОГ-1/ПГ, в то время как поздняя фаза обеспечивается iNOS/NO и ЦОГ-1,-2/ПГ. При этом экспрессия мРНК ЦОГ-2 и iNOS в желудке выявляется спустя 3 ч после слабой ирритации СОЖ [141].
Взаимодействие нитрергической и простагландиновой систем влияет на уcтойчивость СОЖ к ульцерогенным факторам. От этого взаимодействия также зависит профилактическое действие слабых ирритантов против сильных некротизирующих агентов. В частности, у крыс внутрижелудочная аппликация 20% раствора этанола приводит к значительному уменьшению повреждений эпителия при последующем применении 100% этанола. Инъекция L-NNA, либо индометацина, произведенная до воздействия слабым ирритантом, блокировала данный эффект. На фоне поражения СОЖ 100% этанолом блокада сNOS и iNOS значительно усиливала синтез ПГЕ2, т.е. снижение активности одного фермента компенсировалось усилением другого, в результате чего кровоток в подслизистом слое поддерживался на достаточном уровне [60]. Описан и обратный эффект, при котором в подкожных венах повышение активности NOS происходило при ослаблении ЦОГ [9].
ВЗАИМОДЕЙСТВИЕ NO И ЦОГ ПРИ ВОСПАЛЕНИИ
Синтез NO и ПГ в очагах воспаления увеличивается многократно. При этом характер взаимодействия ферментов меняется по сравнению со здоровой СОЖ, что обусловлено типом вовлеченных клеток, длительностью взаимодействия и концентрацией факторов. Известно, что нестероидные противовоспалительные препараты (НПВП) на основе селективных блокаторов ЦОГ-2, сохраняя анальгетические, противовоспалительные и жаропонижающие свойства, оказывают меньшее ульцерогенное действие, чем другие группы НПВП [101]. Тем не менее, ЦОГ-2 производит определенный положительный эффект на заживление слизистой оболочки, что подтверждается увеличением концентрации ЦОГ-2 на краях и на дне язвы [41]. Клинические наблюдения и эксперименты на животных показали, что применение селективных ингибиторов ЦОГ-2 задерживает заживление язв, тормозит клеточную пролиферацию и ангиогенез [20, 71]. Аналогичные результаты были получены в опытах на ЦОГ-2-ген нокаутных мышах [97]. Другой индуцируемый фермент, iNOS, также влияет на развитие воспаления и заживление. Поэтому доноры NO в составе NO-ассоциированных НПВП ослабляют негативное действие ингибиторов ЦОГ-2 на заживление СОЖ. Интересно, что задержка заживления происходит на фоне ингибиторов cNOS, а селективная блокада iNOS такого действия не имеет [42].
Вышесказанное обосновывает интерес к взаимному влиянию конститутивных и индуцибельных NOS и ЦОГ при воспалении. В условиях эндотоксемии, вызванной введением в желудок крысы бактериального липополисахарида, возросшая активность ЦОГ-2, а равно и аппликация ПГЕ2 усиливали реакцию iNOS, но не влияли на экспрессию iNOS и ЦОГ, в то время как iNOS не действовала на ЦОГ-2 [131]. Взаимодействие ЦОГ-1 и iNOS приводит к усилению воспаления, вызванного Helicobacter pylori. Как показано на биоптатах СОЖ человека, на фоне инфекции увеличение концентрации ЦОГ-2 дополнительно стимулировало синтез NO. При этом обратного действия iNOS на синтез ПГЕ2 и экспрессию ЦОГ-2 не наблюдалось [35]. Рассматриваются различные пути влияния ЦОГ-2 на активность iNOS. Например, ЦОГ-2 продуцирует не только простаноиды, но и активные формы кислорода, которые влияют на синтез NO, в том числе через усиление синтеза H4B [99]. Кроме того, ПГЕ2 может активировать iNOS через увеличение внутриклеточной концентрации цАМФ в клетках желудочного слизистого эпителия [48]. Эффект цАМФ также достигается за счет ускорения транспорта L-аргинина в клетку и его превращения в L-цитрулин [32]. Влияние цАМФ на iNOS может быть связано также с действием ГТФ циклогидролазы I, ускоряющей синтез H4B [87].
В очагах язвенного поражения у крыс выявлено активирующее действие NOS на NF-κB в фибробастах, макрофагах и нейтрофилах. Основное влияние на уровень NF-κB оказывает eNOS, а эффект iNOS не описан [42]. Поскольку NF-κB стимулирует экспрессию генов iNOS, интерлейкина-1β, цитокин-активированного хемоатрактанта нейтрофилов и ЦОГ-2, он оказывает благоприятное действие на заживление желудочных язв, способствуя инфильтрации нейтрофилов, регенерации эпителия и ангиогенезу [109].
ЗАКЛЮЧЕНИЕ
Многочисленные данные свидетельствуют, что нитрергическая и простагландиновая системы, находясь в непосредственной близости друг от друга, оказывают реципрокное влияние в норме и при патологии. Взаимодействие между конститутивными и индуцибельными изоформами NOS и ЦОГ выявлено на разных этапах регуляции работы ферментов, включая действие на доступность субстрата, изменение каталитической активности самих ферментов, их транскрипции и трансляции. Кроме того, во взаимодействие вступают внутриклеточные ферментативные сигнальные пути, связанные с NO и ПГ. Результат взаимного влияния ферментов зависит от того, какие изоформы взаимодействуют, скорости синтеза и степени окисления молекулы NO.
Повышение концентрации L-аргинина, доноров NO, а также пероксинитрита может ускорить выделение арахидоновой кислоты из мембранных фосфолипидов посредством PLA2. Окисленные формы NO прямо влияют на активность ЦОГ-1,-2. Пероксинитрит действует на гем простетической группы за счет своих антиоксидантных свойств и через модификацию остатка Тир385. В присутствии NO, либо при прямом контакте c самим ферментом iNOS, может происходить нитрозилирование остатков Цис за пределами гема. В очаге воспаления NO поддерживает длительную экспрессию гена ЦОГ-2 и биосинтез ПГЕ2, что в основном связано с активацией NF-κB.
В условиях физиологической нормы конститутивные NOS продуцируют наномолярные дозы NO, который стимулируют ЦОГ-1, локально поддерживая гомеостаз, что, например, имеет решающее значение в реакциях адаптивной гастропротекции. В этом случае влияние NO на ЦОГ-1 реализуется через взаимодействие внутриклеточных ферментов активируемых цГМФ и цАМФ. Кроме того, в эндотелии сосудов ослабление биосинтеза ПГ может компенсироваться усилением синтеза NO, чем объясняется различие в физиологических эффектах взаимодействия блокаторов nNOS или eNOS с эффектом неселективного блокатора ЦОГ индометацина.
В здоровой СОЖ в координацию эффектов сNOS и ЦОГ-1 вовлечены капсаицин-чувствительные первичные афферентные окончания, локально экскретирующие КГРП и NO. Простагландины ПГI2 и ПГЕ2 потенцируют активность капсаицин-чувствительных афферентов. Однако при ирритации слизистой оболочки желудка ПГЕ2 синтезируется независимо от КЧПА, и независимо от них стимулирует кровоток в подслизистом слое и секрецию ${\text{HCO}}_{3}^{ - }.$
Продукты ЦОГ, в свою очередь, оказывают влияние на нитрергическую систему. В качестве основного посредника как тормозного, так и возбуждающего действия ПГ на NOS рассматривается аденилатциклаза и увеличение цитоплазматического уровня цАМФ. При воспалении ЦОГ-2 влияет на доступность субстратов и ферментов синтеза NO: L-аргинина, NADPH, кислорода, H4B, гема, ФМН и ФАД.
В целом, взаимодействие нитрергической и простагландиновой систем является жизненно важным процессом, поддерживающим гомеостаз различных тканей организма. Дальнейшее изучение специфичных механизмов такого взаимодействия может выявить новые молекулярные мишени для фармакологических воздействий.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2014–2020 годы (ГП-14, раздел 64).
Список литературы
Золотарев В.А., Андреева Ю.В., Вершинина Е.А. и др. Роль конститутивных синтаз оксида азота в регуляции желудочной секреции бикарбонатов на фоне слабой ирритации слизистой оболочки // Росс. Физиол. Журн. им. Сеченова. 2015. Т. 101. № 4. С. 415–432.
Золотарев В.А., Андреева Ю.В., Силин Л.В. и др. Нитрергическая регуляция транспорта бикарбонатов из подслизистого слоя желудка наркотизированных крыс // Рос. Физиол. Журн. им. Сеченова. 2017а. Т. 103. № 4. С. 432–445.
Золотарев В.А., Андреева Ю.В., Вершинина Е.А. и др. Взаимодействие конститутивных синтаз оксида азота с циклооксигеназами при управлении секрецией бикарбонатов в слизистой оболочке желудка // Бюлл. Эксп. Биол. Мед. 2017б. Т. 163. № 1. С. 9–13.
Золотарев В.А., Андреева Ю.В., Вершинина Е.А. и др. Участие TRPV1 в регуляции продукции бикарбонатов и кровотока в желудке при увеличении полостной кислотности // Рос. Физиол. Журн. им. Сеченова. 2018. Т. 104. № 10. С. 1202–1214.
Aihara E., Sasaki Y., Ise F. et al. Distinct mechanisms of acid-induced ${\text{HCO}}_{3}^{ - }$ secretion in normal and slightly permeable stomachs // Am. J. Physiol. Gastrointest. Liver Physiol. 2006. V. 291. № 3. P. G464–471.
Allen A., Flemström G. Gastroduodenal mucus bicarbonate barrier: protection against acid and pepsin // Am. J. Physiol. Cell Physiol. 2005. V. 288. № 1. P. C1–19.
Araki H., Ukawa H., Sugawa Y. et al. Roles of prostaglandin E receptor subtypes in cytoprotective action of prostaglandin E2 in rat stomach // Aliment. Pharmacol. Ther. 2000. V. 14(Suppl. 1). P. 116–124.
Barbin L., Boarini I., Borasio P.G. et al. Nitric oxide-mediated arachidonic acid release from perifused Venus verrucosa oocytes // General Comp. Endocrinol. 2003. V. 130. P. 215–221.
Barker J.E., Bakhle Y.S., Anderson J. et al. Reciprocal inhibition of nitric oxide and prostacyclin synthesis in human saphenous vein // Br. J. Pharmacol. 1996. V. 118. P. 643–648.
Bennett J.S., Daugherty A., Herrington D. et al. The use of nonsteroidal anti-inflammatory drugs (NSAIDs): a science advisory from the American Heart Association // Circulation. 2005. V. 111. № 13. P. 1713–1716.
Bilski J., Konturek P.C., Konturek S.J. et al. Role of endogenous nitric oxide in the control of gastric acid secretion, blood flow and gastrin release in conscious dogs // Regul. Pept. 1994. V. 53. № 3. P. 175–184.
Bolz S.S., Pohl U. Indomethacin enhances endothelial NO release – evidence for a role of PGI2 in the autocrine control of calcium-dependent autacoid production // Cardiovasc. Res. 1997. V.36. P. 437–444.
Bonaiuto C., McDonald P.P., Rossi F. et al. Activation of nuclear factor-B by α-amyloid peptides and interferon-gamma in murine microglia // J. Neuroimmunol. 1997. V. 77. P. 51–56.
Boulos C., Jiang H., Balaz M. Diffusion of peroxynitrite into the human platelet inhibits cyclooxygenase via nitration of tyrosine residues // J. Pharmacol. Exp. Ther. 2000. V. 293. P. 222–229.
Bredt D.S., Hwang P.M., Snyder S.H. Localization of nitric oxide synthase indicating a neural role for nitric oxide // Nature. 1990. V. 347. P. 768–770.
Brown J.F., Tepperman B.L., Hanson P. et al. Differential distribution of nitric oxide synthase between cell fractions isolated from the rat gastric mucosa // Biochem. Biophys. Res. Commun. 1992. V. 184 P. 680–685.
Burrell M.A., Montuenga L.M., García M. et al. Detection of nitric oxide synthase (NOS) in somatostatin-producing cells of human and murine stomach and pancreas // J. Histochem. Cytochem. 1996. V. 44. P. 339–346.
Byrne C.R., Price K.J., Williams J.M. et al. Nitric oxide synthase and arginase in cells isolated from the rat gastric mucosa // Biochim. Biophys. Acta. 1997. V. 1356. P. 131–139.
Chalimoniuk M., Stolecka A., Cakała M. et al. Amyloid beta enhances cytosolic phospholipase A2 level and arachidonic acid release via nitric oxide in APP-transfected PC12 cells // Acta Biochim. Pol. 2007. V. 54. № 3. P. 611–623.
Chan F.K., Wong V.W., Suen B.Y. et al. Effect of celecoxib on the healing of complicated gastric ulcers: a prospective, double blinded, randomized trial // Gastroenterology. 2005. V. 128. Suppl 2. P. A2
Chao C.C., Lokensgard J.R., Sheng W.S. et al. IL-1-induced iNOS expression in human astrocytes via NF-κB // Neuroreport. 1997. V. 8. P. 3163–3166.
Chen L., Salafranca M.N., Mehta J.L. Cyclooxygenase inhibition decreases nitric oxide synthase activity in human platelets // Am. J. Physiol. Heart Circ. Physiol. 1997. V. 273. P. H1854–H1859.
Cheng H.F., Wang C.J., Moeckel G.W. et al. Cyclooxygenase-2 inhibitor blocks expression of mediators of renal injury in a model of diabetes and hypertension // Kidney Intl. 2002. V. 62. P. 929–939.
Cheng H.F., Zhang M.Z., Harris R.C. Nitric oxide stimulates cyclooxygenase-2 in cultured cTAL cells through a p38-dependent pathway // Am. J. Physiol. Renal. Physiol. 2006. V. 290. P. F1391–F1397.
Cho C.H., Chen B.W., Ho C.S. et al. Assessment of hemodynamic changes in rat stomachs by laser Doppler velocimetry and reflectance spectrophotometry. Effects of ethanol and prostaglandin E2 under ischemic and congestive conditions // Digestion. 1994. V. 55. № 6. P. 389–394.
Corbett J.A., Kwon G., Turk J. et al. IL-1 induces the coexpression of both nitric oxide synthase and cyclooxygenase by islets of Langerhans: activation of cyclooxygenase by nitric oxide // Biochemistry. 1993. V. 32. P. 13767–13770.
Cuzzocrea S., Salvemini D. Molecular mechanisms involved in the reciprocal regulation of cyclooxygenase and nitric oxide synthase enzymes // Kidney International. 2007. V. 71. P. 290–297.
DelaTorre A., Schroeder R.A., Bartlett S.T. et al. Differential effects of nitric oxide-mediated S-nitrosylation on p50 and c-jun DNA binding // Surgery. 1998. V. 124. P. 137–141.
Diaz-Cazorla M., Perez-Sala. D, Lamas S. Dual effect of nitric oxide donors on cyclooxygenase-2 expression in human mesangial cells // J. Am. Soc. Nephrol. 1999. V. 10. P. 943–952.
Ding M., Kinoshita Y., Kishi K. et al. Distribution of prostaglandin E receptors in the rat gastrointestinal tract // Prostaglandins. 1997. V. 53. P. 199–216.
Egan R.W., Paxton J., Kuehl F.A.Jr. Mechanism for irreversible selfdeactivation of prostaglandin synthetase // J. Biol. Chem. 1976. V. 251. P. 7329–7335.
Ferro A., Queen L.R., Priest R.M. et al. Activation of nitric oxide synthase by β2-adrenoceptors in human umbilical vein endothelium in vitro // Br. J. Pharmacol. 1999. V. 126. P. 1872–1880.
Fiorucci S., Distrutti E., Santucci L. et al. Leukotrienes stimulate pepsinogen secretion from guinea pig gastric chief cells by a nitric oxidedependent pathway // Gastroenterology. 1995. V. 108. P. 1709–1719.
Flemstrom G., Garner A. Gastroduodenal ${\text{HCO}}_{3}^{ - }$ transport: characteristics and proposed role in acidity regulation and mucosal protection // Am. J. Phys. 1982. V. 242. № 3. G.183–191.
Franco F., Talamini G. Cross-talk between inducible nitric oxide synthase and cyclooxygenase in Helicobacter pylori-induced gastritis // Med. Princ. Pract. 2009. V. 18. № 6. P. 477–481.
Furukawa O., Kitamura M., Sugamoto S. et al. Stimulatory effect of nitric oxide on bicarbonate secretion in bullfrog duodenums in vitro // Digestion. 1999. V. 60. № 4. P. 324–331.
Furukawa O., Kawauchi S., Mimaki H. et al. Stimulation by nitric oxide of ${\text{HCO}}_{3}^{ - }$ secretion in bullfrog duodenum in vitro-roles of cyclooxygenase-1 and prostaglandins // Med. Sci. Monit. 2000. V. 6. № 3. P. 454–459.
García-Vitoria M., García-Corchon C., Rodríguez J.A. et al. Expression of neuronal nitric oxide synthase in several cell types of the rat gastric epithelium // J. Histochem. Cytochem. 2000. V. 48. P. 1111–1120.
Goodwin D.C., Gunthe, M.R., Hsi L.C. et al. Nitric oxide trapping of tyrosyl radicals generated during prostaglandin endoperoxide synthase turnover. Detection of the radical derivative of tyrosine 385 // J. Biol. Chem. 1998. V. 273. P. 8903–8909.
Gryglewski R.J., Palmer R.M., Moncada S. Superoxide anion is involved in the breakdown of endothelium-derived vascular relaxing factor // Nature. 1986. V. 320. P. 454–456.
Guo J.S., Cho C.H., Wang, W.P. et al. Expression and activities of three inducible enzymes in the healing of gastric ulcers in rats // World J. Gastroenterol. 2003. V. 9. P. 1767–1771.
Guo J.S., Cho C.H., Wang J.Y. et al. Differential effects of selective and non-selective inhibition of nitric oxide synthase on the expression and activity of cyclooxygenase-2 during gastric ulcer healing // Eur. J. Pharmacol. 2006. V. 536. P. 301–308.
Hajjar D.P., Lander H.M., Pearce S.F. et al. Nitric oxide enhances prostaglandin-H synthase-1 activity by a hemeindependent mechanism: evidence implicating nitrosothiols // J. Am. Chem. Soc. 1995. V. 117. P. 3340–3346.
Harada N., Okajima K., Uchiba M. et al. Ischemia/reperfusion-induced increase in the hepatic level of prostacyclin is mainly mediated by activation of capsaicin-sensitive sensory neurons in rats // J. Lab. Clin. Med. 2002. V. 139. P. 218–226.
Hartlage-Rubsamen M., Lemke R., Schliebs R. Interleukin-1β, inducible nitric oxide synthase, and nuclear factor-κB are induced in morphologically distinct microglia after rat hippocampal lipopolysaccharide/interferon-gamma injection // J. Neurosci. Res. 1999. V. 57. P. 388–398.
Hayashi H., Ohno T., Nishiyama K. et al. Transient prevention of ethanol-induced gastric lesion by capsaicin due to release of endogenous calcitonin gene-related peptide in rats // Jpn. J. Pharmacol. 2001. V. 86. P. 351–354.
Hawkey C.J., Kemp R.T., Walt R.P. et al. Evidence that adaptive cytoprotection in rats is not mediated by prostaglandins // Gastroenterology. 1988. V. 94. P. 948–954.
Hiraishi H., Terano A., Ota S. et al. Prostaglandin production in cultured gastric mucosal cells: role of cAMP on its modulation // Prostaglandins. 1986. V. 32. P. 259–273.
Holzer P. Neural emergency system in the stomach // Gastroenterology. 1998. V. 114. P. 823–839.
Horie S., Yamamoto H., Michael G.J. et al. Protective role of vanilloid receptor type 1 in HCl-induced gastric mucosal lesions in rats // Scand. J. Gastroenterol. 2004. V. 39. P. 303–312.
Horie S., Raimura M., Matsumoto K et al. Cooperative effects of neuronal nitric oxide synthase and endothelial nitric oxide synthase on gastric hyperemic response to intragastric capsaicin / In:"Capsaicin – sensitive neural afferentation and the gastrointestinal tract: from bench to bedside”, book edited by Gyula Mozsik, Omar M. E. Abdel-Salam and Koji Takeuchi, ISBN 978-953-51-1631-8, Published: July 16, 2014. P. 103–123.
Ichikawa T., Ishihara K., Kusakabe T. et al. Distinct effects of tetragastrin, histamine, and CCh on rat gastric mucin synthesis and contribution of NO // Am. J. Physiol. 1998. V. 274. P. G138–146.
Inoue T., Fukuo K., Morimoto S. et al. Nitric oxide mediates interleukin-1-induced prostaglandin E2 production by vascular smooth muscle cells // Biochem. Biophys. Res. Commun. 1993. V. 194. P. 420–424.
Janabi N., Chabrier S., Tardieu M. Endogenous nitric oxide activates prostaglandin F2 alpha production in human microglial cells but not in astrocytes: a study of interactions between eicosanoids, nitric oxide, and superoxide anion (O2–) regulatory pathways // J. Immunol. 1996. V. 157. P. 2129–2135.
Kagawa S., Aoi M., Kubo Y., Kotani T. et al. Stimulation by capsaicin of duodenal ${\text{HCO}}_{3}^{ - }$ secretion via afferent neurons and vanilloid receptors in rats. Comparison with acid-induced ${\text{HCO}}_{3}^{ - }$ response // Dig. Dis. Sci. 2003. V. 48. P. 1850–1856.
Karthein R., Dietz R., Nastainczyk W. et al. Higher oxidation states of prostaglandin H synthase. EPR study of a transient tyrosyl radical in the enzyme during the peroxidase reaction // Eur. J. Bioch. 1988. V. 171. P. 313–320.
Kim S.F., Huri D.A., Snyder S.H. Inducible nitric oxide synthase binds, S-nitrosylates, and activates cyclooxygenase-2 // Science. 2005. V. 310. P. 1966–1970
Kim S.F. The nitric oxide-mediated regulation of prostaglandin signaling in medicine // Vitam. Horm. 2014. V. 96. P. 211–245.
Kita K., Takahashi K., Ohashi Y. et al. Phosphodiesterase isozymes involved in regulation of formula secretion in isolated mouse stomach in vitro // J. Pharmacol. Exp. Ther. 2008. V. 326. № 3. P. 889–896.
Ko J.K., Cho C.H. Co-regulation of mucosal nitric oxide and prostaglandin in gastric adaptive cytoprotection // Inflamm. Res. Sep. 1999. V. 48. № 9. P. 471–478.
Kugler P., Hofer D., Mayer B. et al. Nitric oxide synthase and NADP-linked glucose-6-phosphate dehydrogenase are co-localized in brush cells of rat stomach and pancreas // J. Histochem. Cytochem 1994. V. 42. P. 1317–1321.
Laine L., Takeuchi K., Tarnavski A. Gastric mucosal defense and cytoprotection: bench to bedside // Gastroenterol. 2008. V. 135. № 1. P. 41–60.
Lamarque D., Dutreuil C., Dhumeaux D. et al. Increased gastric bicarbonate secretion in portal hypertensive anesthetized rats: role of prostaglandins and nitric oxide // Dig. Dis. Sci. 1997. V. 42. № 4. P. 743–750.
Landino L. M., Crews B.C., Timmons M.D. et al. Peroxynitrite, the coupling product of nitric oxide and superoxide, activates prostaglandin biosynthesis // Proc. Natl. Acad. Sci. USA. 1996. V. 93. № 26. P. 15069–15074.
Liu Y., Borchert G.L., Phang J.M. Polyoma enhancer activator 3, an ets transcription factor, mediates the induction of cyclooxygenase-2 by nitric oxide in colorectal cancer cells // J. Biol. Chem. 2004. V. 279. P. 18694–18700.
Madrigal J.L., Garcia-Bueno B., Moro M.A. et al. Relationship between cyclooxygenase-2 and nitric oxide synthase-2 in rat cortex after stress // Eur. J. Neurosci. 2003. V. 18. P. 1701–1705.
Marnett L.J., Rowlinson S.W., Goodwin D.C. et al. Arachidonic acid oxygenation by COX-1 and COX-2. Mechanisms of catalysis and inhibition // J. Biol. Chem. 1999. V. 274. P. 22903–22906.
Matthews J.R., Botting C.H., Panico M. et al. nhibition of NF-κBB DNA binding by nitric oxide // Nucleic Acids Res. 1996. V. 24. P. 2236–2242.
Miceli F., Tringali G., Tropea A.et al. The effects of nitric oxide on prostanoid production and release by human umbilical vein endothelial cells // Life Sci. 2003. V. 73. P. 2533–3542.
Misko T.P., Trotter J.L., Cross A.H. Mediation of inflammation by encephalitogenic cells: interferon gamma induction of nitric oxide synthase and cyclooxygenase 2 // J. Neuroimmunol. 1995. V. 61. P. 195–204.
Mizuno H., Sakamoto C., Matsuda K. et al. Induction of cyclooxygenase 2 in gastric mucosal lesions and its inhibition by the specific antagonist delays healing in mice // Gastroenterology. 1997. V. 112. P. 387–397.
Mollace V., Colasanti M., Rodino P. NMDA-dependent prostaglandin E2 release by human cultured astroglial cells is driven by nitric oxide // Biochem. Biophys. Res. Commun. 1995. V. 215. P. 793–799.
Mollace V., Muscoli C., Masini E. et al. Modulation of prostaglandin biosynthesis by nitric oxide and nitric oxide donors // Pharmacol. Rev. 2005. V. 57. P. 217–252.
Montrose M.H., Akiba Y., Takeuchi K. et al. Gastroduodenal mucosal defense / In: Physiology of the Gastrointestinal Tract, Fourth Edition, edited by Leonard R. Johnson. Academic Press, 2006.
Morimoto K., Sugimoto Y., Katsuyama M. et al. Cellular localization of mRNAs for prostaglandin E receptor subtypes in mouse gastrointestinal tract // Am. J. Physiol. 1997. V. 272. № 3. Pt 1. P. G681–687.
Murakami T., Tanigami M., Amagase K. et al. Adaptive gastric cytoprotection is mediated by prostaglandin E receptor EP1 but not EP4 subtype // Gastroenterology. 2012. V. 142 (Suppl. 1). P. S-496.
Mutoh H., Ota S., Hiraishi H. et al. Adaptive cytoprotection in cultured rat gastric mucus-producing cells. Role of mucus and prostaglandin synthesis // Dig. Dis. Sci. 1995. V. 40. № 4. P. 872–878.
Nicola C., Timoshenko A.V, Dixon S.J. et al. EP1 receptor-mediated migration of the first trimester human extravillous trophoblast: the role of intracellular calcium and calpain // J. Clin. Endocrinol. Metab. 2005. V. 90. P. 4736–4746.
Northey A., Denis D., Cirino M. et al. Cellular distribution of prostanoid EP receptors mRNA in the rat gastrointestinal tract // Prostaglandins Other Lipid Mediat. 2000. V. 62. P. 145–156.
Notoya K., Jovanovic D.V., Reboul P. et al. The induction of cell death in human osteoarthritis chondrocytes by nitric oxide is related to the production of prostaglandin E2 via the induction of cyclooxygenase-2 // J. Immunol. 2000. V. 165. P. 3402–3410.
Ohno T., Hattori Y., Komine R. et al. Roles of calcitonin generelated peptide in maintenance of gastric mucosal integrity and in enhancement of ulcer healing and angiogenesis // Gastroenterology. 2008. V. 134. P. 215–225.
Park S.W., Sung M.W., Heo D.S. et al. Nitric oxide upregulates the cyclooxygenase-2 expression through the cAMP response element in its promoter in several cancer cell lines // Oncogene. 2005. V. 24. P. 6689–6698.
Peng H.B., Libby P., Liao J.K. Induction and stabilization of IκB-α by nitric oxide mediates inhibition of NF-κB // J. Bioll. Chem. 1995. V. 270. P. 14214–14219.
Perkins D.J., Kniss D.A. Blockade of nitric oxide formation down-regulates cyclooxygenase-2 and decreases PGE2 biosynthesis in macrophages // J. Leukoc. Biol. 1999. V. 65. P. 792–799.
Peskar B.M. On the synthesis of prostaglandins by human gastric mucosa and its modification by drugs // Biochim. Biophys. Acta. 1977. V. 487. P. 307–314.
Peskar B.M., Gunter B., Peskar B.A. Prostaglandins and prostaglandin metabolites in human gastric juice // Prostaglandins. 1980. V. 20. P. 419–427.
Pluss C., Werner E.R., Blau N. et al. Interleukin 1β and cAMP trigger the expression of GTP cyclohydrolase I in rat mesangial cells // Biochem. J. 1996. V. 318. P. 665–671.
Price K.J., Hanson P.J., Whittle B.J. Localization of constitutive isoforms of nitric oxide synthase in the gastric glandular mucosa of the rat // Cell Tissue Res. 1996. V. 285. P.157–163.
Price K., Hanson P. Constitutive nitric oxide synthases in rat gastric mucosa: subcellular distribution, relative activity and different carboxylterminal antigenicity of the neuronal form compared with cerebellum // Digestion. 1998. V. 59. P. 308–313.
Raimura M., Tashima K., Matsumoto K. et al. Neuronal nitric oxide synthase-derived nitric oxide is involved in gastric mucosal hyperemic response to capsaicin in rats // Pharmacology. 2013. V. 92. № 1–2. P. 60–70.
Rao R., Redha R., Macias-Perez I. et al. Prostaglandin E2-EP4 receptor promotes endothelial cell migration via ERK activation and angiogenesis in vivo // J. Biol. Chem. 2007. V. 282. P. 16959–16968.
Robert A., Nezamis J.E., Lancaster C. Mild irritants prevent gastric necrosis through “adaptive cytoprotection” mediated by prostaglandins // Am. J. Physiol. 1983. V. 245. P. G113–G121.
Russell F.A., King R., Smillie S.J. Calcitonin gene-related peptide: physiology and pathophysiology // Physiol. Rev. 2014. Oct. V. 94. № 4. P. 1099–1142.
Salvemini D., Misko T.P., Masferrer J.L. et al. Nitric oxide activates cyclooxygenase enzymes // Proc. Natl. Acad. Sci. USA. 1993. V. 90. P. 7240–7244.
Salvemini D., Masferrer J.L. Interactions of nitric oxide with cyclooxygenase: in vitro, ex vivo, and in vivo studies // Methods Enzymol. 1996. V. 269. P. 12–25.
Salvemini D., Kim S.F., Mollace V. Reciprocal regulation of the nitric oxide and cyclooxygenase pathway in pathophysiology: Relevance and clinical implications // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013. V. 304. № 7. P. R473–487. https://doi.org/10.1152/ajpregu.00355.2012
Schmassmann A., Zoidl G., Peskar B.M. et al. Role of the different isoforms of cyclooxygenase and nitric oxide synthase during gastric ulcer healing in cyclooxygenase-1 and -2 knockout mice // Am. J. Physiol. Gastrointest. Liver Physiol. 2006. V. 290. P. G747–G756.
Shi W., Hoganson C.W., Espe M. et al. Electron paramagnetic resonance and electron nuclear double resonance spectroscopic identification and characterization of the tyrosyl radicals in prostaglandin H synthase 1 // Biochemistry. 2000. V. 39. P. 4112–4121.
Shimizu S., Shiota K., Yamamoto S. et al. Hydrogen peroxide stimulates tetrahydrobiopterin synthesis through the induction of GTP-cyclohydrolase I and increases nitric oxide synthase activity in vascular endothelial cells // Free Radic. Biol. Med. 2003. V. 34. P. 1343–1352.
Shimozawa N., Okajima K., Harada N. et al. Contribution of sensory neurons to sex difference in the development of stress induced gastric mucosal injury in mice // Gastroenterology. 2006. V. 131. P. 1826–1834.
Silverstein F., Faich G., Goldstein J.L. et al. Gastrointestinal toxicity with celecoxib vs. nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib long-term arthritis safety study // JAMA. 2000. V. 284. P. 1247–1255.
Simmons D.L., Botting R.M., Hla T. Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition // Pharmacol. Rev. 2004. V. 56. P. 387–437.
Smith W.L., Marnett L.J. Prostaglandin endoperoxide synthase: structure and catalysis // Biochim. Biophys. Acta. 1991. V. 1083. P. 1–17.
Stitham J., Arehart E.J., Gleim S.R. Human prostacyclin receptor structure and function from naturally-occurring and synthetic mutations // Prostaglandins Other Lipid Mediat. 2007. V. 82. P. 95–108.
Sugamoto S., Kawauch. S, Furukawa O. et al. Role of endogenous nitric oxide and prostaglandin in duodenal bicarbonate response induced by mucosal acidification in rats // Dig. Dis. Sci. 2001. V. 46. № 6. P. 1208–1216.
Sugimoto Y., Negishi M., Hayashi Y. et al. Two isoforms of the EP3 receptor with different carboxyl-terminal domains. Identical ligand binding properties and different coupling properties with Gi proteins // J. Biol. Chem. 1993. V. 268. P. 2712–2718.
Svanes K., Gislason H., Guttu K. et al. Role of blood flow in adaptive protection of the cat gastric mucosa // Gastroenterology. 1991. V. 100. P. 1249–1258.
Swierkosz T.A., Mitchell J.A., Warner T.D. et al. Co-induction of nitric oxide synthase and cyclo-oxygenase: interactions between nitric oxide and prostanoids // Br. J. Pharmacol. 1995. V. 114. P. 1335–1342.
Takahashi S., Fujita T., Yamamoto A. Role of nuclear factor-κB in gastric ulcer healing in rats // Am. J. Physiol. 2001. V. 280. P. G1296–G1304.
Takeuchi K., Ohuchi T., Miyake H. et al. Stimulation by nitric oxide synthase inhibitors of gastric and duodenal ${\text{HCO}}_{3}^{ - }$ secretion in rats // J. Pharmacol. Exp. Ther. 1993. V. 266. № 3. P. 1512–1519.
Takeuchi K., Ohuchi T., Okabe S. Endogenous nitric oxide in gastric alkaline response in the rat stomach after damage // Gastroenterology. 1994a. V. 106. № 2. P. 367–374.
Takeuchi K., Ohuchi T., Tachibana M. et al. The mechanism underlying stimulation of gastric ${\text{HCO}}_{3}^{ - }$ secretion by the nitric oxide synthase inhibitor NG-nitro-L-arginine methyl ester in rats // J. Gastroenterol. Hepatol. 1994b. V. 9. Suppl 1. P. S50–54.
Takeuchi K., Takehara K., Kato S. et al. Changes in gastric ${\text{HCO}}_{3}^{ - }$ secretory response to NG-nitro-L-arginine methyl ester in rats following repeated administration // J. Gastroenterol. Hepatol. 1996. V. 11. № 12. P. 1164–1170.
Takeuchi K., Yagi K., Kato S. et al. Role of prostaglandin E receptor subtypes in gastric and duodenal bicarbonate secretion in rats // Gastroenterology. 1997. V. 113. P. 1553–1559.
Takeuchi K., Suzuki K., Araki H., Mizoguchi H., Sugamoto S., Umdeda M. Roles of endogenous prostaglandins and nitric oxide in gastroduodenal ulcerogenic responses induced in rats by hypothermic stress // J. Physiol. Paris. 1999. V. 93. № 5. P. 423–431.
Takeuchi K., Araki H., Umeda M. et al. Adaptive gastric cytoprotection is mediated by prostaglandin EP1 receptors: A study using rats and knockout mice // J. Pharmacol. Exp. Ther. 2001. V. 297. P. 1160–1165.
Takeuchi K., Komoike Y., Takeeda M. et al. Gastric mucosal ulcerogenic responses following barrier disruption in knockout mice lacking prostaglandin EP1 receptors // Aliment. Pharmacol. Ther. 2002. V. 16. P. 74–82.
Takeuchi K., Kato S., Takeeda M. et al. Facilitation by endogenous prostaglandins of capsaicin-induced gastric protection in rodents through EP2 and IP receptors // J. Pharmacol. Exp. Ther. 2003. V. 304. P. 1055–1062.
Takeuchi K., Aihara E., Hayashi M. et al. Role of prostaglandin E receptor subtypes in gastroduodenal ${\text{HCO}}_{3}^{ - }$ secretion // Med. Chem. 2005. Jul. V. 1. № 4. P. 395–403.
Takeuchi K., Kato S., Amagase K. Prostaglandin EP receptors involved in modulating gastrointestinal mucosal integrity // J. Pharmacol. Sci. 2010. V. 114. № 3. P. 248–261.
Takeuchi K., Kita K., Hayashi S. et al. Regulatory mechanism of duodenal bicarbonate secretion. Roles of endogenous prostaglandins and nitric oxide // Pharm. Ther. 2011. V. 130. P. 59–70.
Takeuchi K. Gastric cytoprotection by prostaglandin E2 and prostacyclin: Relationship to EP1 and IP receptors // J. Physiol. Pharmacol. 2014. V. 65. № 1. P. 3–14.
Takeuchi K., Aihara E. Mechanism of capsaicin-stimulated gastric ${\text{HCO}}_{3}^{ - }$ secretion – comparison with mucosal acidification / In: Capsaicin – sensitive neural afferentation and the gastrointestinal tract: from bench to bedside. Eds by G. Mozsik, O.M.E. Abdel-Salam, K. Takeuchi.Published: July 16, 2014. under CC BY 3.0 license.
Tang C.H., Yang R.S., Fu W.M. Prostaglandin E2 stimulates fibronectin expression through EP1 receptor, phospholipase C, protein kinase Calpha, and c-Src pathway in primary cultured rat osteoblasts // J. Biol. Chem. 2005. V. 280. P. 22907–22916.
Tatsuguchi A., Sakamoto C., Wada K. et al. Localisation of cyclooxygenase 1 and cyclooxygenase 2 in Helicobacter pylori related gastritis and gastric ulcer tissues in humans // Gut. 2000. V. 46. P. 782–789.
Tetsuka T., Daphna-Iken D., Miller B.W. et al. Nitric oxide amplifies interleukin 1-induced cyclooxygenase-2 expression in rat mesangial cells // J. Clin. Invest. 1996. V. 97. P. 2051–2056.
Tian J., Kim S.F., Hester L. et al. S-nitrosylation/activation of COX-2 mediates NMDA neurotoxicity // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 10537–10540.
Tsai A.L, Wei C., Kulmacz R.J. Interaction between nitric oxide and prostaglandin H synthase // Arch. Biochem. Biophys. 1994. V. 313. P. 367–372.
Tsikas D., Niemann J. Nitric oxide, peroxynitrite, S-nitrosothiols and thiols are unlikely to exert their effects on recombinant cyclooxygenase-1 and cyclooxygenase-2 activity in vitro by modifying cysteine moieties // Nitric Oxide Biol. Chem. 2012. V. 26. P. 192–194.
Uno H., Arakawa T., Fukuda T. et al. Nitric oxide stimulates prostaglandin synthesis in cultured rabbit gastric cells // Prostaglandins. 1997. V. 53. P. 153–162.
Uno K., Iuchi Y., Fujii J. et al. In vivo study on cross talk between inducible nitric-oxide synthase and cyclooxygenase in rat gastric mucosa: effect of cyclooxygenase activity on nitric oxide production // J. Pharm. Exp. Ther. 2004. V. 309. № 3. P. 995–1002.
Vane J.R., Bakhle Y.S., Botting R.M. Cyclooxygenases 1 and 2 // Annu. Rev. Pharmacol. Toxicol. 1998. V. 38. P. 97–120.
Vassalle C., Domenici C., Lubrano V. et al. Interaction between nitric oxide and cyclooxygenase pathways in endothelial cells // J. Vasc. Res. 2003. Sep-Oct. V. 40. № 5. P. 491–499.
Von Knethen A., Brune B. Cyclooxygenase-2: an essential regulator of NO-mediated apoptosis // FASEB J. 1997. V. 11. P. 887–895.
Wallace J.L., Whittle B.J.R. Role of prostanoids in the protective actions of BW755C on the gastric mucosa // Eur. J. Pharmacol. 1985. V. 115. P. 45–52.
Walter U., Nolte C., Geiger P. et al. Inhibition of platelet function by cyclic nucleotides and cyclic nucleotide-dependent protein kinases / In: Hermann AG. ed. Antithrombotics. Dordrecht. Germany: Kluwer Academic Publishers. 1991. P. 121–138.
Watkins D.N., Garlepp M.J., Thompson P.J. Regulation of the inducible cyclo-oxygenase pathway in human cultured airway epithelial (A549) cells by nitric oxide // Brit. J. Pharmacol. 1997. V. 121. P. 1482–1488.
Whittle B.J.R., Lopez-Belmonte J., Moncada S. Regulation of gastric mucosal integrity by endogenous nitric oxide: interactions with prostanoids and sensory neuropeptides in the rat // Br. J. Pharmacol. 1990. V. 99. P. 607–611.
Wood J., Garthwaite J. Models for diffusional spread of nitric oxide: implications for neural nitric oxide signalling and its pharmacological properties // Neuropharmacology. 1994. V. 33. P. 1235–1244
Xu., Han C., Lim K., Wu T. Activation of cytosolic phospholipase A2α through nitric oxide-induced S-nitrosylation. Involvement of inducible nitric-oxide synthase and cyclooxygenase-2 // J. Biol. Chem. 2008. V. 283. P. 3077–3087.
Yamamoto H., Tanaka. A, Kunikata T. et al. Inducible types of cyclooxygenase and nitric oxide synthase in adaptive cytoprotection in rat stomachs // J. Physiol. (Paris) 1999. V. 93. P. 405–412.
Yokoyama U., Iwatsubo K., Umemura M. et al. The prostanoid EP4 receptor and its signaling pathway // Pharmacol. Rev. 2013. V. 65. № 3. P. 1010–1052.
Zhang X., Hintze T.H. cAMP signal transduction cascade, a novel pathway for the regulation of endothelial nitric oxide production in coronary blood vessels // Arterioscler. Thromb. Vasc. Biol. 2001. V. 21. P. 797–803.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


