Успехи физиологических наук, 2022, T. 53, № 3, стр. 54-74
Интероцепторы кишки в нейроиммунных взаимодействиях
О. Н. Платонова a, *, Е. Ю. Быстрова a, К. А. Дворникова a, А. Д. Ноздрачев a, b
a Лаборатория интероцепции, ФГБУН Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: olgaplatonova1991@mail.ru
Поступила в редакцию 16.02.2022
После доработки 28.02.2022
Принята к публикации 03.03.2022
- EDN: IWPVDC
- DOI: 10.31857/S0301179822030080
Аннотация
Интероцепторы, осуществляющие афферентацию, наиболее широко, четко, выразительно представлены в энтеральной части метасимпатической нервной системы (МНС) и обнаруживаются, как правило, несколькими слоями. В обзоре будут преимущественно рассмотрены современные данные, касающиеся нормальных и патофизиологических процессов, опосредованных именно нейроиммунными взаимодействиями. Управление процессом осуществляется сигнальными молекулами, экспрессирующимися в нервном и иммунном компонентах. Механизмы модуляции ответов осуществляются благодаря активации интероцепторов, а также иммунных клеток, определяющих пути соответствующего ответа. Обзор демонстрирует последние достижения в понимании того, как иммунные клетки и внутренние первичные афферентные нейроны (IPAN) используют медиаторы, такие как ацетилхолин (ACh), катехоламин (CCh), серотонин (5-HT), вещество P (SP), связанный с геном кальцитонина пептид (CGRP), вазоактивный кишечный пептид (VIP) и др.
ВВЕДЕНИЕ
Термин “интероцепция” был использован Чарльзом Шеррингтоном еще в начале двадцатого столетия (1906 г.) и определялся как комплекс рецепторов слизистой оболочки пищеварительного тракта, адаптированных к восприятию химических стимулов. К настоящему времени значение термина существенно расширилось и включает совокупность рецепторов всех внутренних органов, кровеносных сосудов, скелетных мышц и систем организма в восходящем ряду позвоночных [13].
Предложенная создателем учения об интероцепции академиком В.Н. Черниговским и широко используемая ныне классификация основана на модальности предъявляемых раздражителей. Во многом это связано с дизайном физиологических экспериментов, использовавшихся в минувшем столетии. В общем виде такие исследования предполагали предъявление некоторых стимулов (механических, термических, химических, осмотических и др.) с последующей регистрацией электрической активности и интерпретацией результатов исследований. Между тем, развитие методов молекулярной биологии и микроскопии позволило получить еще и целый ряд новых сведений о топографии, пластичности, структуре и особенностях работы периферических сенсорных образований в комплексе их взаимодействий [5, 15].
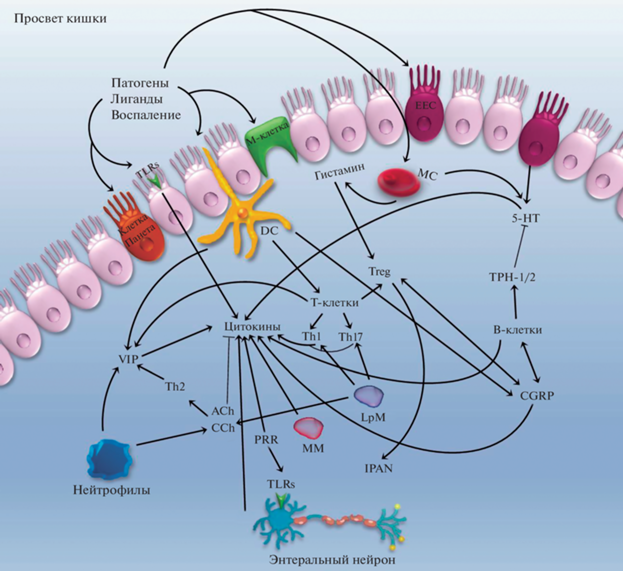
Анатомическая структура кишки, как известно, представлена несколькими слоями (рис. 1). Ее слизистая оболочка содержит эпителиальные клетки (intestinal epithelial cell, IEC), имеющие морфологические и функциональные различия. Выделяют 6 видов эпителиоцитов: каемчатые (столбчатые), бокаловидные, энтероэндокринные (enteroendocrine cells, EEC), клетки с ацидофильными гранулами (клетки Панета), бескаемчатые (малодифференцированные) и микроскладчатые (М-клетки).
Рис. 1.
Упрощенная схема (не показаны внешние ветви парасимпатического и симпатического отдела АНС) строения участка кишки, продольное сечение. Подслизистое и межмышечное сплетение обеспечивают иннервацию на всей глубине кишки. Иммунные клетки представлены как в мышечных слоях (ММ – мышечные макрофаги), так и в слизистой оболочке и подслизистой основе (LpM – макрофаги собственной пластинки, MC – Тучные клетки, DC – дендритные клетки), особенно в Пейеровых бляшках. Тела внутренних первичных афферентных нейронов (IPAN) находятся в обоих сплетениях, а их отростки имеют широкую сеть, связывающие все отображенные на схеме компоненты.

В восходящем ряду позвоночных межмышечное (Ауэрбахово), или еще называемое сейчас миэнтеральным нервным сплетением (longitudinal muscle-myenteric plexus, LMMP), располагающееся между кольцевым и продольным слоями гладких мышц, а также подслизистое (Мейсснерово) сплетение (submucosal plexus, SMP) [4, 14], содержат большое количество афферентных волокон. В них обнаруживаются медиаторы, выделяемые специализированными клетками, выстилающими просвет кишечного тракта. Помимо того, через слизистую оболочку поступает еще информация о химическом составе продуктов питания, патогенная и собственная микробиота, лекарственные препараты и пр. В зависимости от агента, соответственно, высвобождается широкий спектр пептидов и медиаторов, вырабатываемых не только эпителиальными энтероэндокринными и иммунными клетками, но и собственными кишечными (энтеральными) метасимпатическими нейронами [21, 41, 76].
Иммунные клетки, включая макрофаги, нейтрофилы, тучные клетки и лимфоциты, также модулируют активность сенсорных нейронов, хотя механизм такого перекрестного общения между иммунной и нервной системами пока не совсем понятен. Однако все чаще признается, что между клетками нервной и иммунной систем существует сильное взаимодействие [38, 76].
ИННЕРВАЦИЯ ЭНТЕРАЛЬНОГО КАНАЛА
Иннервация кишки осуществляется симпатической, парасимпатической и метасимпатической частями-отделами автономной нервной системы (АНС). Во многих публикациях и обсуждениях их чаще обозначают “системами”: симпатическая нервная система (СНС), парасимпатическая нервная система (ПНС), соответственно и метасимпатическая нервная система (МНС). Помимо того, в практике для удобства понимания или манипуляции часто выделяют собственно кишечный отдел – “энтеральную нервную систему” (ЭНС), которая функционирует подобно произвольному “мозгу в кишке”, обеспечивающей “гомеостазические паттерны” ее кишечного поведения – перистальтику, секрецию, всасывание, выделение, кровоток и т.д. [40, 57]. Важно отметить, что все отделы АНС выполняют одновременно афферентную и эфферентную функции. При этом мотонейроны АНС довольно однородны и могут быть на основе постганглионарных нейротрансмиттеров (neurotransmitters, NTs) подразделены на симпатические и парасимпатические. В сенсорике же существует своя значительная сенсорная неоднородность [13, 52, 58].
Кишечная нервная система в основном представлена внутренними первичными сенсорными афферентными и эфферентными (так называемыми моторными) компонентами, сосредоточенными преимущественно в интрамуральных ганглионарных сплетениях МНС. Иннервируется эта система также еще и терминалями от внешних первичных афферентов, симпатических и парасимпатических нервов [15, 58].
Большинство афферентных волокон являются немиелинизированными волокнами блуждающего нерва (vagus nerve, VN). В тонкой кишке и ее брыжейке находится еще значительное число афферентов симпатического чревного сплетения, в большей степени представленных высокоскоростными толстыми миелинизированными волокнами. Толстая же кишка и органы таза снабжаются преимущественно волокнами каудального (нижнего) подчревного сплетения, где число толстых и тонких миелинизированных волокон примерно одинаково [5, 7, 14].
В кишке стимуляция симпатических волокон вызывает преимущественно тормозные, парасимпатических – возбуждающие эффекты. В верхнем отделе канала (пищевод и желудок) основные внешние сенсорные волокна отходят от блуждающего нерва, тогда как в нижнем (толстой кишке) их влияние практически полностью исчезает, замещаясь спинномозговыми афферентами. Клеточные тела последних лежат в ганглиях дорсальных корешков (dorsal root ganglion, DRG) [15].
Нейрон-опосредованные ответы кишки запускаются активацией сенсорных афферентов на стимулы (в том числе воспаление) и сигналы передаются к клеткам-мишеням посредством рефлексов, включая местные рефлексы стенки кишки (“собственные рефлексы” по В.Н. Черниговскому) [5]. Что же касается экстраспинальных рефлексов, возникающих в стенке кишки и синаптически переключающихся в превертебральных симпатических ганглиях без вовлечения центральной нервной системы, то В.Н. Черниговский назвал их “сопряженными местными рефлексами” [4, 5].
Следует заметить, что в афферентных нейронах блуждающего нерва существуют рецепторы интерлейкина-1 (Interleukin-1, IL-1) и простагландинов (prostaglandin, PG), фактор некроза опухоли-альфа (tumor necrosis factor, TNF-α), провоспалительные пептиды семейства тахикининов, а также продукты тучных клеток. ЭНС обрабатывает и ряд ощущений, таких как химический состав содержимого и растяжение [59, 70–72]. Однако, влияя на врожденный и адаптивный иммунитет, она активно способствует также использованию защитных механизмов. Таким образом, ЭНС может участвовать в патогенезе воспалительных заболеваний кишки (Inflammatory bowel disease, IBD), вызванных различными инфекционными агентами [41, 46].
Для запуска нервного ответа в качестве промежуточных звеньев ЭНС использует эпителиальные, энтероэндокринные, иммунные и гладкомышечные клетки, а также кишечную глию и интерстициальные клетки Кахаля, где нейрональный контроль опосредуется холинергическими, вазоактивными кишечными пептидами и сигнальными путями оксида азота. Между тем, в последние десятилетия появляются данные об экспрессии рецепторов врожденного иммунитета собственными кишечными нейронами у мыши, крысы и человека, что свидетельствует о наличии более сложной коммуникации между этими структурами [13, 16, 21, 28, 57].
Сенсорные нейроны, называемые еще внутренними первичными афферентными нейронами (intrinsic primary afferent neuron, IPAN) – относительно большие мультиаксональные нейроциты, которые располагаются исключительно в интрамуральных ганглиях межмышечного и подслизистого сплетений, обладают хемосенсорными и механосенсорными свойствами и имеют морфологию клеток Догеля II-го типа (рис. 1). Для регуляции множества пищеварительных и желудочно-кишечных функций они образуют полные рефлекторные цепи с кишечными интернейронами и мотонейронами [33, 45, 76].
В отличие от внешних афферентов, IPAN не передают висцеральные ощущения от кишки мозгу. Кишка получает внешнюю иннервацию за счет сенсорных афферентов из ганглиев DRG, которые опосредуют преимущественно висцеральную боль, давление и нейрогенное воспаление. Внешняя иннервация также осуществляется сенсорными афферентами яремных ганглиев, обеспечивая чувство насыщения, тошноту, гомеостазис кишки и воспалительные рефлекторные цепи. Следовательно, сенсорная информация из кишки по-разному обрабатывается разными типами нейронов, что приводит к различным желудочно-кишечным ощущениям и функциональным результатам [39, 41, 45].
Чувствительные окончания блуждающего нерва активируются провоспалительными цитокинами TNF-α, IL-1β, гистамином и простагландинами. В ответ возбуждающие нейроны ядра одиночного пути активируют вагусные эффекторные окончания, которые выделяют ацетилхолин. Последний связывается с альфа-никотиновыми рецепторами на макрофагах и блокирует производство провоспалительных цитокинов. Некоторые авторы считают чрезмерную продукцию провоспалительных цитокинов, таких как TNF-α и IL-1β, причиной нейротоксичности, вследствие которой происходит дегенерация аксонов и гибель нейроцитов [2, 8, 15].
В дополнение к внутренним сенсорным нейронам, которые также могут функционировать как интернейроны, существуют одноаксональные восходящие и нисходящие интернейроны кишки. Их различные нейрохимические классы могут находиться в разных участках органа. ACh обычно является первичным передатчиком интернейронов, но каждый подтип использует различные ко-трансмиттеры или нейромодуляторы, такие как серотонин, аденозинтрифосфат, тахикинин [13, 32, 33].
В миэнтеральном сплетении возбуждающие и тормозные мотонейроны иннервируют гладкие мышцы, вызывая их сокращение или расслабление. Первые, как правило, проецируются орально; их основной передатчик ACh. В то же время вторые проецируются каудально (анально) и используют различные трансмиттеры, включая оксид азота (NO), вазоактивный кишечный пептид (vasoactive intestinal polypeptide, VIP) и полипептид, активирующий аденилатциклазу гипофиза (pituitary adenylate cyclase-activating polypeptide, PACAP). В подслизистом же сплетении секретомоторные и сосудорасширяющие нейроны иннервируют преимущественно слизистую оболочку и подслизистую сосудистую сеть. Главными нейротрансмиттерами здесь служат ACh и VIP [8, 34, 58, 65].
При воздействии инфекционных агентов активация кишечных нейронов возможна непосредственно напрямую через афферентные окончания. Показано, например, что воздействие липополисахарида (lipopolysaccharide, LPS) на препараты сплетения и первичные кишечные культуры приводит к нейронной модуляции воспалительного ответа, что, в свою очередь, подтверждается усилением продукции TNF-α. Мишенями определенных токсинов могут являться первичные сенсорные клетки слизистой оболочки, стимулирующие секрецию. В частности, токсин A Clostridium difficile увеличивает активность нейронов подслизистой оболочки AH- и S-типа. Воздействие Lactobacillus rhamosus и Bacteroides fragilis на эпителий вызывает реакцию первичных афферентов в течение нескольких секунд и способствует повышению возбудимости в течение нескольких минут. Короткая латентность ортодромных потенциалов действия (ПД) позволила предположить, что IPAN ответы являются прямыми сенсорными ПД, опосредованными нервными процессами, распространяющимися в эпителии слизистой оболочки [40, 44].
Сенсорные нейроны также получают синаптические входы от локальных цепей кишечных афферентов, поскольку у них регистрировались вторичные возбуждающие постсинаптические потенциалы. Помимо того, было обнаружено, что капсульный полисахарид А из B. fragilis является медиатором активации сенсорных нейрональных ответов. Эти данные свидетельствуют о том, что опосредованное L. reuteri усиление возбудимости сенсорных нейронов может снизить перистальтику толстой кишки, и это снижение мышечного напряжения, вероятно, способствует пробиотическому облегчению висцеральной боли [44].
Появляющиеся данные поддерживают идею о том, что нормальная внутренняя и внешняя нейротрансмиссия в кишке частично регулируется метаболитами бактериального происхождения. Нарушения функции нервного надзора могут быть связаны с изменением метаболической активности кишечных микроорганизмов. В этих случаях клинические симптомы могут быть облегчены путем изменения микробных сообществ с помощью пребиотиков, пробиотиков и антибиотиков [57]. Распознавание указанных бактериальных агентов и, вероятно, прочих лигандов врожденного иммунитета, требует наличия на телах нейронов и волокнах специализированных рецепторов.
МЕДИАТОРЫ НЕЙРОИММУННОЙ ПЕРЕДАЧИ
Сигнальные молекулы и их метаболиты, передающие сигналы через еще более широкий спектр рецепторов различных типов нервных волокон, в том числе и в кишке, характеризуются большим разнообразием. К ним относят нейротрансмиттеры (ACh, норэпинефрин (norepinephrine, NE), нейропептид Y (neuropeptide Y, NPY), субстанция P (substance P, SP), VIP и пр.), адренокортикотропный гормон (АКТГ), рилизинг-гормон кортикотропина (corticotropin-releasing hormone, CRH), глюкокортикоиды (glucocorticosteroid, GC), свободные радикалы, цитокины и др., которые способны активировать иммунные клетки через специфические рецепторы [2, 8, 9, 11, 22, 42, 53].
Количество экспрессируемых рецепторов неодинаково, зависит от вида и локализации конкретных объектов, а также от микросреды. Хотя иммунные и эпителиальные клетки считаются каноническими организаторами сложного равновесия, ЭНС играет существенную роль в управлении ответом на антимикробный белок (antimicrobial peptide, AMP). Так, например, нейроны кишки продуцируют плейотропный цитокин IL-18, причем делеция IL-18 только из энтеральных нейронов, но не из иммунных или эпителиальных клеток, приводит к восприимчивости мышей к Salmonella typhimurium.
РНК-секвенирование показало, что продуцируемый нейронами IL-18 особенно необходим для гомеостатической продукции AMP бокаловидными клетками. Нейрон-специфичная передача сигналов IL-18 контролирует кишечный иммунитет и влияет на барьерные функции слизистой оболочки. При этом IL-18+ нейроны являются нитрергическими (IL-18+ nNOS+), в то время как холинергические IL-18+ не обнаружены [42, 69].
Продукция цитокинов, определяемых как сигнальные молекулы в иммунной системе собственными нейронами ЭНС, подтверждает сложность двунаправленного взаимодействия нервной и иммунной системам. Наиболее важную роль в регуляции воспаления и иммунного гомеостазиса кишки играют нейротрансмиттеры [1, 8, 19].
Нейротрансмиттеры или нейропептиды (neuropeptides, NP) – семейство элементов, которые выполняют локальную нейроэндокринную и сигнальную функцию. Активация сенсорных нейронов вызывает кальций-зависимое высвобождение из нервных окончаний плотных ядерных везикул, содержащих нейропептиды. В некоторых случаях более крупные пептиды-предшественники процессируются в несколько нейропептидов, которые оказывают влияние через один или несколько рецепторов, экспрессируемых нейронами, иммунными клетками и стромальными клетками кишки. Количественные изменения в метаболоме NT дают возможность лучше понять нейроиммунно-опосредованное воспаление. Так, например, метаболизм нейротрансмиттеров нарушается колитом, вследствие чего в сыворотке крови повышаются уровни нейротрансмиттеров, а в содержимом кишки накапливается избыток аминокислотных медиаторов. В ответ на воспаление происходит сдвиг аминокислот и холинов, наиболее выраженный в отношении метаболизма триптофана и фенилаланина [40, 44, 69].
Ацетилхолин (ACh) – это первичный парасимпатический нейромедиатор. Он имеет множество рецепторов, которые бывают двух типов: мускариновые (mAChR), состоящие из 5 подтипов (M1–M5), и никотиновые (nAChR) из гомомерных или гетеромерных комбинаций 5 субъединиц. Никотиновые рецепторы напрямую связаны с ионными каналами, тогда как мускариновые представляют собой рецепторы, связанные с G-белком, которые влияют на передачу сигналов в клетке [30, 77].
Общепризнано, что ЭНС является регулятором иммунной функции, которая потенциально используется для достижения иммуносупрессии при IBD. Ее активация приводит к высвобождению ACh из эфферентных холинергических волокон вагуса и способна опосредовать про- и противовоспалительную активность. Возбуждение рецепторов, как показали эксперименты, вызывает десенсибилизацию за счет модуляции внутриклеточного кальция. Стимуляция уменьшает местное и системное воспаление на моделях эндотоксемии, артрита и колита [11, 25, 77].
Нервная и иммунная системы неразрывно связаны на всех этапах развития организма. Нейроиммунные взаимодействия прежде всего происходят посредством двунаправленного обмена информацией, опосредованного молекулами, в ранних исследованиях ассоциированными только с нервной, или эндокринной, или иммунной системами. Указанные молекулы представляют собой нейропептиды, нейротрансмиттеры, опиоидные пептиды, глюкокортикоиды, свободные радикалы и цитокины. Многие нейротрансмиттеры и их рецепторы, первоначально описанные в ЦНС, экспрессируются иммунными клетками и обладают рядом иммуномодулирующих свойств. Напротив, цитокины, первоначально представленные как первичные сигнальные молекулы между иммунокомпетентными клетками во время иммунных ответов, теперь считаются полноценными участниками поддержания функций в ЦНС и в нервном развитии. Они также неразрывно вовлечены в нейродегенеративные процессы через СНС, ПНС, МНС [7, 15].
Подобно возможностям иммунных клеток, сенсорные нейроны также способны идентифицировать патогенные агенты. Кинетика ответа нейроцитов на порядки быстрее, чем у иммунных клеток (обычно миллисекунды по сравнению с часами). Следовательно, ранняя реакция нервной системы координирует защитные механизмы хозяина для устранения угроз и опосредования процессов восстановления органов и тканей [12].
Это позволило сформулировать принципиально новые представления о механизмах участия интероцепторов в модуляции реакций на внедрение веществ антигенной природы. В частности, было предложено новое самостоятельное понятие “Полимодальная интероцептивная сенсорная система” (ПИСС), представляющая собой многофакторную систему сенсорных взаимодействий висцеральных органов с ЦНС. Согласно представлениям, стимулированные интероцепторы (в частности, ноцицепторы) в ПИСС приводят к активации вне- и внутриклеточной мембранной рецепции иннервируемых тканей при участии волокон симпатической, парасимпатической и метасимпатической частей АНС, обусловливая развитие висцеральной гиперчувствительности [4].
Исследование экспрессии мРНК гетеромерного nAChR и субъединицы рецептора в ЭНС новорожденных крыс в тонкой и толстой кишке выявило экспрессию мРНК α3, α5, α7, β2 и β4 в их нервных сплетениях. В подслизистом сплетении экспрессия α3, α5 и β4 была обнаружена и в некоторых ганглиях. Субъединицы α4, α6 и β3 не были найдены в ЭНС, но транскрипты α2 были выявлены лишь в некоторых областях тонкой кишки. Между тем, сигнал не был связан с ганглиозными клетками. Эти сведения подтверждают наличие гетеромерных nAChR в ЭНС, подобных тем, которые обнаруживаются в периферической нервной системе. При этом большинство из них состоит из α3 (α5) β4 и нескольких α3β2 nAChR. Кроме того, могут присутствовать гомомерные α7 nAChR [34].
У мышей с эндотоксемией, дефицитных по α7-никотиновому рецептору АХ (α7-nAchR), были повышены системные уровни TNF-α, IL-1β и IL-6, и эти мыши не могли подавлять уровни TNF-α при стимуляции блуждающего нерва. В частности, экспрессия α7-nAChR на макрофагах была необходима для наблюдаемого ACh-опосредованного подавления TNF-α. Стимуляция α7-субъединицы никотиновых ацетилхолиновых рецепторов на макрофагах в значительной степени ингибирует продукцию TNF-α, IL-1β, HMGB1 (high-mobility group protein) и других цитокинов, путем передачи клеточного сигнала, ингибирующего ядерную активность NF-κB (nuclear factor kappa B) и активирующего фактор транскрипции STAT3 (signal transducer and activator of transcription 3) посредством фосфорилирования нерецепторной тирозинкиназы Janus kinase 2 (JAK2) [32, 37, 77].
Рецептор α7nAChR обнаружен в головном мозге и в иммунных клетках, таких как дендритные Т-клетки. Для иммунных клеток существуют различные механизмы, включая классический поток ионов, модуляцию цАМФ или ингибирование митоген-активируемого протеина MAP-киназы p38, что приводит к ингибированию высвобождения провоспалительных цитокинов типа фактора некроза опухоли TNF-α [6, 25].
Нервные сигналы, воздействуя на дендритные клетки (Dendritic cells, DC) и лимфоциты через сенсорные волокна блуждающего нерва, могут ослабить воспалительную реакцию. Лимфоциты периферической крови человека также экспрессируют различные холинергические продукты, включая ACh, холинацетилтрансферазу (ChAT), ацетилхолинэстеразу (acetylcholinesterase, AChE), везикулярный переносчик ацетилхолина (vesicular acetylcholine transporter, VAChT), а также мускариновые холинергические рецепторы M2–M5. Т-клетки секретируют ACh в ответ на активацию своих β-адренергических рецепторов (beta-adrenergic receptors, ADR-β) [25, 32, 77].
На моделях колита показано, что селективные агонисты α7-nAChR снижают инфильтрацию иммунных клеток и тяжесть заболевания, однако при этом они также способны ухудшать его течение. T- и B-лимфоциты продуцируют ацетилхолин и, как следствие, активно участвуют в холинергической передаче и противовоспалительном сигнальном пути. Эти клетки также характеризуются способностью к продукции ChAT, которая является ферментом, ограничивающим скорость синтеза ACh Х1 [25].
DC и перитонеальные макрофаги экспрессируют mAChR (M1–M5) и nAChR (α2, α5, α6, α7, α10, β2). Т- и В-клетки также обладают рецепторами к ACh (nAChR α2, α5, α9, α10, β1, β2, β4 и M1, M3, M4, M5 mAChR для Т-клеток; α4, α7, β2 nAChR и M2 mAChR для B-клеток). В кишке ChAT+ Т-клетки связывают с производством антимикробных пептидов и микробным разнообразием, хотя роль ACh + Т-клеток в колите не выяснена. Предполагается, что разные типы иммунных клеток могут быть мишенью для ACh [25, 31].
Катехоламины (catecholamines, CCh) – это класс нейроактивных молекул симпатических окончаний. Они действуют как гормоны и нейротрансмиттеры СНС, однако становится все более очевидным, что также способны выступать в качестве иммуномодуляторов врожденных и адаптивных иммунных клеток, включая макрофаги. Те в свою очередь могут реагировать, а также вырабатывать собственные CCh. Адренорецепторы (ADR) представлены α1, α2 и β1, β2 рецепторами [8, 22, 50, 72, 77].
Симпатический отдел АНС иннервирует все лимфоидные органы, и именно катехоламины в пресинаптических окончаниях модулируют иммунные клетки в первичных и вторичных лимфоидных органах, вызывая иммуномодуляцию. Активность этих NT прекращается за счет обратного захвата нервными окончаниями, растворения во внеклеточных жидкостях, поглощения и метаболической трансформации [8, 32, 52].
Катехоламины подавляют продукцию провоспалительных цитокинов, таких как IL-1, TNF-α, INFγ, и стимулируют выработку противовоспалительных цитокинов, таких как IL-10, IL-1RA и трансформирующий ростовой фактор-бета (transforming growth factor beta, TGF-β). Таким образом, они способны вызывать избирательное подавление клеточного иммунитета (ответы Th1) и повышать гуморальный иммунитет (ответы Th2). В модуляции иммунных ответов могут также участвовать местный катехоламинергический синтез и передача сигналов [8, 52, 77].
Недавние исследования показывают, что Т-клетки могут также синтезировать и выделять катехоламины, которые затем способны регулировать функцию Т-клеток. Кроме того, макрофаги и нейтрофилы при стимуляции способны генерировать и высвобождать катехоламины de novo, которые затем аутокринно-паракринным образом, благодаря участию адренорецепторов, регулируют высвобождение медиатора из этих фагоцитов. Более того, регуляция активности ферментов, вырабатывающих катехоламины, а также ферментов разложения, таких как высвобождение провоспалительных медиаторов, явно меняет характер воспалительной реакции фагоцитов [32, 64].
Вещество P (SP), член семейства нейропептидов тахикинина, экспрессируется нейронами ЭНС и способен стимулировать сократимость кишки и снижать кровяное давление. Ген tachykinin precursor-1 (Tac1) кодирует препротахикинин-1, который может быть далее процессирован в четыре альтернативно сплайсированных нейропептида тахикинина: SP, нейрокинин A, нейрокинин K и нейрокинин гамма. Их нейрокининовые рецепторы NK1R включают NK2R и NK3R (кодируемые Tacr1, Tacr2 и Tacr3). Последние представляют собой рецепторы, связанные с G-белком, экспрессируемые нейрональными, а также другими типами клеток. В кишке основными источниками SP являются нейроны метасимпатических узлов и сплетений [6, 44, 71].
Этот предполагаемый нейротрансмиттер для медленного синаптического возбуждения в ЭНС и для аксональных рефлексов, опосредованных афферентами спинного мозга, приводит к высвобождению гистамина, протеаз тучных клеток и цитокинов. В случае возбуждающего действия токсина-A на нервные элементы высвобождается вещество P, которое дегранулирует тучные клетки. В этом случае воздействие токсина-A деполяризует мембранный потенциал и повышает возбудимость нейроцитов [71].
Иммунореактивность тахикинина наблюдается в телах нейронов межмышечного и подслизистого сплетений, а также в отростках, иннервирующих мышцы, подслизистые артерии и слизистую оболочку. NK1R экспрессируется кишечными нейроцитами, интерстициальными клетками Кахаля и эпителием, NK2R – мышечными и эпителиальными клетками, причем в подвздошной кишке в большей степени по сравнению с двенадцатиперстной и толстой. Наконец, NK3R преимущественно экспрессируется энтеральными нейронами и опосредует межнейронную передачу. NK1R и NK2R локализованы в Т-лимфоцитах пластинки, макрофагах, тучных клетках и их экспрессия увеличивается во время воспаления. SP индуцирует секрецию иммунными клетками провоспалительных цитокинов (IL-1β, IL-6, IL-8, TNF-α) через NF-κB-зависимый путь. Проведенные исследования указывают на пагубную роль активации SP и NK1R при колите. Мыши генотипа Tac1–/–, получавшие антагонист NK1R, продемонстрировали снижение потери веса, активности миелоидной пероксидазы, гистопатологических показателей и продукции провоспалительных цитокинов по сравнению с мышами дикого типа. При этом, согласно данным другого исследования, стимуляция NK1R в фибробластах приводит к увеличению синтеза коллагена и фиброгенезу, и способствуют выживанию колоноцитов посредством анти-апоптотических AKT сигнальных механизмов. Следовательно, хотя антагонисты NK1R могут демонстрировать потенциальные противовоспалительные преимущества при IBD, они могут также ухудшать течение реакции [44].
Следует еще отметить, что провоспалительная активность вещества P связана с усилением продукции IL-1, TNF-α и IL-6 моноцитами. Вещество P может регулировать выработку цитокинов DC, что впоследствии влияет на поляризацию Т-клеток и опосредованную продукцию эффекторных цитокинов [52].
Кальцитонин ген-родственный пептид (Calcitonin Gene-Related Peptide, CGRP) представляет собой сенсорный нейропептид с сильной и продолжительной сосудорасширяющей активностью, которая проявляется в 10–1000 раз сильнее, чем у других классических вазодилататоров. Мыши, у которых отсутствует рецептор CGRP, экспрессируемый соматосенсорными нейронами, спонтанно гипертоничны, хотя источник CGRP, который опосредует расслабление сосудов, остается неизвестным [38, 44, 52].
Существуют две изоформы данного нейропептида – CGRPα и CGRPβ, которые у человека отличаются всего тремя аминокислотами и кодируются генами Calca и Calcb соответственно. Иммунореактивность CGRP обнаружена во всех слоях кишки и сосредоточена вокруг подслизистых кровеносных сосудов. CGRP в значительной степени экспрессируется вместе с SP; однако, в отличие от волокон SP, волокна CGRP иннервируют Пейеровы бляшки. Кишечные нейроны вносят вклад в общую экспрессию CGRP, при этом указанные нейроциты преимущественно экспрессируют изоформу CGRPβ [44, 47–49].
CGRP демонстрирует нейроиммунные двунаправленные взаимодействия, в которых многие врожденные и адаптивные иммунные клетки изменяют свою функцию в ответ на CGRP, в то время как некоторые из них (например, моноциты, Т-клетки, В-клетки) сами высвобождают CGRP или регулируют его экспрессию сенсорными нейронами [67].
Мыши с двойным нокаутом CGRP/SP в равной степени защищены от колита по сравнению с мышами SP–/–, что позволяет предположить, что CGRP не обеспечивает дополнительной защиты, если повреждающие ткани эффекты SP отсутствуют. CGRP может оказывать направленную хемотаксическую активность на незрелые DC in vitro, тогда как норэпинефрин усиливает подвижность DC, помогая в их отборе и приобретении антигена в тканях [44]. Механизмы регуляции CGRP воспаления желудочно-кишечного тракта (ЖКТ) практически не изучены.
Вазоактивный кишечный пептид (VIP) впервые был идентифицирован в кишке свиней. Он является основным тормозным нейромедиатором, высвобождаемым секретомоторными нейронами. Рецепторы к соматостатину (somatostatin, SST1 и SST2) опосредуют неадренергические ингибирующие постсинаптические потенциалы в нехолинергических VIP-секретомоторных нейронах. Пептид действует на гладкие мышцы и эпителиальные клетки, влияя на моторику, абсорбцию жидкости, секрецию электролитов и слизи. Его иммунологические эффекты опосредуются работой основных рецепторов, связанных с G-белком, а именно VPAC1 и VPAC2 (кодируемых генами Vipr1 и Vipr2 соответственно). VIP-рецепторы экспрессируются на многих специализированных иммунных клетках (Т-клетках, макрофагах, DC, нейтрофилах и врожденных лимфоидных клетках). Кроме того, следует отметить, что VIP-иммунопозитивные нервные волокна обнаружены во всех слоях кишки [8, 44, 65].
VIP играет решающую роль в развитии и поддержании целостности эпителиального барьера кишки и способствует восстановлению эпителия во время колита. Мыши с дефицитом VIP демонстрируют пониженное количество бокаловидных клеток и сниженную экспрессию секретируемых факторов бокаловидных клеток – муцина 2 и фактора трилистника-3 (trefoil factor 3, TFF3). Эти изменения связаны с экспрессией гомеобокса 2 каудального типа (Cdx2), регулятора функции и гомеостазиса органа [73].
На модели IBD у собак показано, что IBD ассоциировано с изменениями плотности VIP-положительных нервных волокон подслизистого сплетения. Это свидетельствует о том, что VIP участвует в развитии патологического процесса [56].
VIP, вырабатываемый Th2, является одним из мощных ингибиторов Th1 вследствие стимуляции выработки противовоспалительных цитокинов. Короткий период полувыведения системного VIP и его вмешательство в деятельность сердечно-сосудистой и желудочно-кишечной систем ограничивают его практическое применение. На модели аутоиммунной периферической полинейропатии у мышей показано, что DC, экспрессирующие VIP, трансдуцированные лентивирусными векторами (LV-VIP-DC), оказывают устойчивый терапевтический эффект, повышают выживаемость [8, 55, 75].
VPAC1 и VPAC2, имеющие различное сродство к VIP, экспрессируются на разных уровнях: VPAC1 на покоящихся Т-клетках и макрофагах, VPAC2 на Т-клетках. При этом конститутивно низкая экспрессия VPAC2 повышается при активации, сопровождаясь снижением экспрессии VPAC1 [30, 44].
Высвобождая регуляторные медиаторы трансформирующего фактора роста TGF-β и IL-10, клетки Treg или Breg подавляют ответ других клеток, которые удерживают иммунные ответы в надлежащем диапазоне, во избежание повреждения тканей. VIP обеспечивает осуществление иммунных регуляторных функций, например, таких как повышение иммунной толерантности за счет рекрутирования. Недостаточные уровни VIP в микросреде ускоряют распад мРНК IL-10, вызывая дисфункцию Breg [61].
В активированных макрофагах VIP ингибирует продукцию TNF-α, IL-12 и NO, прежде всего через конститутивный VPAC1 и, в меньшей степени, через индуцибельный VPAC2. Связывание VIP с VPAC1 индуцирует цАМФ-зависимый и цАМФ-независимый пути, по которым регулируется продукция цитокинов и NO на уровне транскрипции. VIP подавляет экспрессию TNF-α, IL-12 и индуцибельной синтазы оксида азота (iNOS) за счет уменьшения связывания фактора транскрипции NF-κB [9].
При TNBS-индуцированном колите, содержание VIP в нервных волокнах снижается в подслизистой и увеличивается в слизистой оболочке. Он может играть защитную роль, включая увеличение цитокинов (IL-10, IL-4, IL-13), снижение провоспалительных цитокинов (TNF-α, IL-1β, IL-6, IL-12), а также способствует усилению вызванного бактериями разрушения плотных контактов эпителия кишки. При введении высоких доз препарата останавливает защитные реакции. VIP–/– мыши оказались устойчивыми к колиту, демонстрируя потерю веса, низкие уровни провоспалительных цитокинов и отсутствие разницы в гистопатологических показателях с мышами дикого типа [44, 66].
VIP–/– мыши с DSS-индуцированным колитом демонстрируют снижение признаков воспаления и повреждения слизистой оболочки вместе со сниженной или отсутствующей экспрессией мРНК провоспалительных цитокинов в толстой кишке. Мыши VPAC1–/– оказались более устойчивы к DSS-индуцированному колиту, чем мыши VPAC2–/–. К тому же у последних наблюдалось стремительное развитие колита, сопряженное с большей потерей веса, продукцией провоспалительных цитокинов и более неблагоприятной гистопатологической картиной по сравнению с диким типом [44, 73]. Результаты этих исследований подчеркивают необходимость использования рецептор-специфических агонистов или антагонистов для нацеливания на различные пути передачи сигналов нейропептидов во время воспаления ЖКТ.
Серотонин (5-HT) представляет собой моноамин и является ключевым посредником, обеспечивающим выполнение ряда центральных и периферических функций в организме. Он опосредует многочисленные процессы, например, поддержание тонуса сосудов, развитие иммунных ответов, в том числе при воспалении кишки. Показано, что эндогенный серотонин усиливает и сокращения толстой кишки. Серотонинэргические энтеральные нейроны получают сигналы от всех трех ветвей АНС и отвечают на воздействие высвобождением провоспалительных цитокинов (в частности, IL-1β, IL-8). Этот медиатор продуцируется различными типами клеток кишки и выполняет множество физиологических функций [8, 10, 19, 74].
5-HT был впервые идентифицирован как медиатор, обладающий сосудосуживающими свойствами. Его основными источниками в кишке являются тучные клетки и специфические энтерохромаффинные EEC клетки (клетки Кульчицкого). Примерно 90% серотонина в организме секретируется ЕС, еще 5% производятся также в структурах ЭНС, что свидетельствует об исключительной важности этого амина для функции кишки. Большое количество 5-HT рецепторов было идентифицировано в лимфоидных тканях. Вероятно, серотонинергическая передача в лейкоцитах способствует реализации иммунного ответа, либо за счет усиления DC-опосредованной активации Т-клеток, либо через влияние на поляризацию макрофагов и фагоцитоз [19, 68, 74].
Из-за отсутствия прямого контакта между просветом и ЭНС, энтерохромаффинные клетки действуют как посредник, секретируя серотонин и стимулируя близлежащие энтеральные нейроны, увеличивая моторику и перистальтику кишки. Клетки EC базолатерально высвобождают серотонин и для стимуляции сенсорных афферентных нейронов МНС. Серотонинергические нейроны защищают и саму кишечную нервную систему в целом от воспалительного поражения, тогда как слизистая оболочка может выделять провоспалительные медиаторы [19, 58, 59].
Метасимпатические нейроны и иммунные клетки, включая макрофаги, DC, B- и T-клетки, экспрессируют триптофангидроксилазу (TPH-1/2), ограничивающую скорость биосинтеза 5-HT [59, 77]. Экспрессия TPH-1 обнаружена в ЕС, макрофагах, тучных и Т-клетках. У мышей, лишенных 5-HT кишечных нейронов из-за потери TPH-2 в ЖКТ, наблюдается снижение развития кишечных нейронов, особенно экспрессирующих дофамин и гамма-аминомасляную кислоту. У TPH2-R439H мутантных мышей (аналогичная мутация у человека связана с тяжелой депрессией) уровни 5-HT в кишечных нейронах значительно ниже, нежели у контрольных [40, 59].
Серотонин с самого открытия определен как ключевой фактор в развитии синдрома раздраженной кишки (СРК). Стимуляция вагуса инициирует высвобождение 5-HT в энтерохромаффинных клетках, и это, по-видимому, опосредуется активацией адренергических рецепторов. Считается, что серотонин слизистой оболочки является важнейшей паракринной сигнальной молекулой [19, 76].
Идентифицировано пятнадцать рецепторов 5-HTR, разделенных на семь семейств, наиболее изученные с точки зрения функции кишки – это 5-HT3R, 5-HT4R и 5-HT7R. Активация 5-HT3R внутренних афферентов в подслизистом и межмышечном сплетениях увеличивает подвижность органа, внося вклад в перистальтический рефлекс у грызунов. 5-HT3R также экспрессируются на клетках ЕС. Все шесть изоформ 5-HT4R (A, B, C, D, G, I) экспрессируются в МНС и гладкомышечных клетках кишки, где они регулируют моторику. 5-HT4R обнаружены также на энтерохромаффинных и бокаловидных клетках. У мышей 5-HT4 с нокаутом наблюдается потеря кишечных нейронов после первых месяцев жизни. Это может служить доказательством того, что передача 5-HT сигналов через 5-HT4 рецептор опосредует постнатальный энтеральный рост, выживаемость и гомеостазис. Активация 5-HT4R может приводить и к стимуляции возбуждающих холинергических нейронов, что сопровождается высвобождением SP [19, 59, 67, 74].
Серотонин может оказывать про- и противовоспалительное действие в слизистой оболочке кишки посредством активации 5-HT7 или 5-HT4 рецепторов [60]. Семейства рецепторов HTR4 и HTR7 связаны с G-белками и повышают уровень клеточного цАМФ [74]. В кишке встречаются три подтипа 5-HT7R (A, B и C). Имеющиеся на сегодняшний день данные указывают на то, что 5-HT7R является важным регулятором воспаления в ЖКТ. В частности, его экспрессия значительно увеличивается при колите, индуцированном декстран-сульфатом натрия (DSS), при этом ингибирование 5-HT7R улучшает течение колита [67].
Гистамин, как известно, является одним из основных медиаторов нейроиммунной передачи сигналов в кишке. Тучные клетки, продуцирующие и высвобождающие гистамин, играют важную роль в патофизиологии ее воспалительных заболеваний. Гистамин, выделяемый тучными клетками, также регулирует клетки Treg. Взаимодействие с рецепторами гистамина H1 в Treg вызывает снижение экспрессии CD25 и Foxp3, что приводит к снижению и супрессивной активности Treg [1, 14, 23].
Медиатор может активировать IPAN, причем повышенные уровни гистамина и 5-HT коррелируют с повышенной активацией подслизистых метасимпатических нейронов. Это увеличение активации подавляется антагонистами 5-HT и гистаминовых рецепторов. Ингибитор захвата 5-HT и норэпинефрина амитриптилин подавляет секрецию гистамина тучными клетками, не влияя на продукцию 5-HT. Последнее дает основание полагать, что секреция гистамина может модулироваться CCh [76].
Существует четыре подтипа гистаминовых рецепторов, связанных с G-белками: H1, H2, H3, H4. Роль гистамина как нейромодулятора в МНС на животных моделях продемонстрирована следующими эффектами: 1) активация кишечных нервных клеток, с участием в основном Н2-рецепторов; 2) ингибирование высвобождения ацетилхолина и соматостатина нейронами через пресинаптические H3-рецепторы, а также высвобождение норадреналина из симпатических окончаний. У человека также H1 и H4 рецепторы вовлечены в гистаминовый ответ, причем обнаружено H3-опосредованное возбуждающее действие в подслизистом сплетении кишки. Человеческий гистаминовый H4-рецептор (hH4R) обладает более высокой конститутивной активностью и как H1-рецептор (hH1R) участвует в патогенезе аллергических реакций I типа [24, 30].
МЕСТНЫЙ ИММУНИТЕТ В КИШКЕ
Слизистая оболочка кишки содержит плотную сеть иммунных клеток, особенно в лимфоидных структурах, таких как Пейеровы бляшки (ПБ). Этот компонент кишечной лимфоидной ткани (gut-associated lymphoid tissue, GALT), состоящий из фолликулов В- и Т-клеток и субэпителиального купола, с DC, участвует в ответе на микробные угрозы. Специализированный фолликул-ассоциированный эпителий, покрывающий ПБ, включает “микроскладчатые” М-клетки, которые захватывают антигены из просвета и транспортируют их в нижележащие лимфоидные области купола для обработки антигенпрезентирующими клетками. Кроме того, GALT представлена организованными лимфоидными структурами (лимфоидные фолликулы и мезентериальные лимфатические узлы, в которых инициируются иммунные ответы) и диффузно распределенными эффекторными клетками (плазматические клетки, макрофаги, тучные клетки, лимфоциты, эозинофилы и DC) в эпителии и собственной пластинке слизистой оболочки кишки [1, 33].
Система врожденного иммунитета представляет собой первую линию защиты от вторжения патогенов. Многие популяции клеток врожденного иммунитета имеют решающее значение для физиологии хозяина, гомеостазиса и восстановления определенных тканей, а также защиты от инфекции. При этом, сохранение целостности кишечного барьера имеет первостепенное значение, так как клетки врожденного иммунитета осуществляют эффекторные функции, направленные против патогенов. Барьерный иммунитет слизистой оболочки остро необходим для поддержания комменсальной микробиоты и борьбы с инвазивной бактериальной инфекцией [66].
Распознавание антигенов обеспечивают рецепторы врожденного иммунитета – паттерн-распознающие рецепторы (Pattern-Recognition Receptors, РRR), которые узнают высоко консервативные структуры – патоген-ассоциированные молекулярные паттерны (Pathogen-Associated Molecular Patterns, PAMP) и схожие с ними эндогенные молекулярные структуры – молекулярные паттерны, ассоциированные с повреждениями (Damage-Associated Molecular Patterns, DAMP). Многие из них выполняют сигнальные функции, регулируя синтез провоспалительных медиаторов, способствуя адгезии и миграции макрофагов [9].
Представителями PRR являются Toll-подобные рецепторы (Toll-like receptor, TLR), индуцируемые ретиноевой кислотой рецепторы, подобные гену-1 (RIG-I-like receptors, RLR) и Nod-подобные рецепторы (Nod-like-receptor, NLR). Все они содержат домены с богатыми лейцином повторами (leucine-rich repeats, LRR). Активация указанных рецепторов запускает сигнальный каскад реакций, определяющих транскрипцию генов иммунитета, таких как антимикробные вещества и цитокины [1, 26].
Особенности строения и функционирования кишечного эпителия обеспечивают взаимодействие слизистой оболочки с подслизистым слоем через М-клетки, бокаловидные и энтероэндокринные клетки. Мононуклеарные фагоциты в этом случае являются иммунными клетками, контактирующими с различными чужеродными агентами, и, как следствие, участвующими в иммунном ответе на них. Мононуклеарные фагоциты, включая DC и макрофаги, способны распознавать и различать патогенные и непатогенные антигены. При этом они инициируют и поддерживают защитные иммунные ответы в отношении патогенных организмов, в то же время обеспечивая местную и системную толерантность в ответ на безвредные антигены [9, 18, 77].
Макрофаги (Mϕ) – одни из наиболее распространенных лейкоцитов в слизистой оболочке кишки, необходимые для поддержания функционального гомеостазиса. Это сидячие, резидентные в ткани клетки, основная роль которых состоит в очистке и деградации дебриса или патогенов, с небольшой способностью или вообще без способности стимулировать наивные Т-клетки (Naive T cells) [3, 18].
Тканевые макрофаги происходят преимущественно из моноцитов крови, которые мигрируют в ткани и дифференцируются в различные популяции. Активированные макрофаги делятся на подтипы М1 (классически активированные) и М2 (альтернативно активированные). Дифференцировка в М1 стимулируется интерфероном гамма (IFNγ), а также IFNγ совместно с LPS и TNF. Их основные функции – уничтожение патогенных микроорганизмов и индукция воспалительной реакции. При этом секретируются провоспалительные медиаторы. Макрофаги экспрессируют рецепторы IL-1R1, TLR и стимулирующие молекулы, усиливающие воспалительный ответ, а также противовоспалительный цитокин – IL-10, при характерном высоком соотношении IL-12/IL-10. Эти клетки также характеризуются поверхностной экспрессией интегринов CD11c и CD11b, и антигена F4/80 (EGF-подобный модуль, содержащий муцин-подобный гормональный рецептор-1; EMR1). Помимо того, макрофаги кишки экспрессируют CD64, рецептор Fc-γ 1 (FcγRI) и уникально высокие уровни хемокинового рецептора CX3CR1 [18, 50, 77].
Секреция IL-определяет Тh1 поляризацию, а IL-1β и IL-23 направляют иммунный ответ по Тh17 пути. М2 поляризация наблюдается при стимуляции интерлейкинами, глюкокортикоидами, иммунными комплексами, агонистами TLR и др. Такие клетки проявляют большую по сравнению с М1 макрофагами способность к фагоцитозу. Для них характерно также низкое отношение IL-12/IL-10. Достаточно четко различаются их подтипы: М2а, М2b и М2с. Примером М2а фенотипа макрофагов являются клетки, скапливающиеся вокруг личинок гельминтов и простейших, аллергены которых индуцируют иммунный Тh2 ответ, сопровождающийся продукцией IL-4 и IL-13. Они не секретируют значительных количеств провоспалительных цитокинов, но активно синтезируют особый спектр хемокинов. Для этих клеток характерен синтез IL-10. Важной характеристикой данной популяции является синтез антагониста рецептора IL-1, который, связываясь с IL-1, блокирует его провоспалительное действие [3, 50].
Кишечные макрофаги можно идентифицировать по их анатомическому расположению и в целом разделить на макрофаги слизистой оболочки или собственной пластинки (Lamina propria macrophages, LpM) и мышечные макрофаги (muscularis macrophages, MМ). LpM преимущественно экспрессируют провоспалительные или M1 гены с повышенной экспрессией CD80 рецепторов по сравнению с MM, в то время как мышечные макрофаги имеют M2 поляризацию и экспрессируют CD86 на значительно более высоком уровне, чем CD80.
LpM макрофаги сосредоточены в эпителии и занимают стратегическое положение для отбора проб люминальных антигенов, фагоцитоза мертвых клеток и устранения проникающих через эпителий патогенов. Вероятно, ввиду регулярного контакта с микробными агентами и локализацией, эти клетки обладают более провоспалительным транскрипционным профилем, чем их аналоги из мышечного слоя. Способность макрофагов слизистой оболочки образовывать трансэпителиальные дендриты (transepithelial dendrite, TED), позволяет проникать через эпителий и захватывать потенциальные патогены из просвета кишки. TED-опосредованное распознавание антигенов опосредуется CX3CR1 рецептором [33, 50].
Также была установлена роль LpM в поддержании ниши кишечных стволовых клеток, когда опосредованное антителами истощение LpM приводит к нарушению дифференцировки клеток Панета и снижению Lgr5+ стволовых клеток. Последнее оказывает влияние на дифференцировку и восполнение пула дополнительных IEC, включая бокаловидные и M-клетки. Макрофаги, выделенные из собственной пластинки кишки IL-10–/– мышей, у которых развивается колит, подобный воспалительному заболеванию органа (IBD), экспрессируют сниженные уровни IκBNS, ингибитора активации NF-κB, который отвечает за подавление LPS-индуцированной продукции цитокинов макрофагами слизистой оболочки. Сдвиг поляризации макрофагов с противовоспалительного “M2” на провоспалительный “M1” вызывает старение. Оно сопровождается повышением содержания цитокинов и иммунных клеток в МНС. Этот фенотипический сдвиг связан с реакцией нервного компонента на воспалительные сигналы, усилением апоптоза и потерей энтеральных нейронов [22, 50].
Мышечные макрофаги (MM) представляют собой клетки, присутствующие в серозном, кольцевом и продольном мышечных слоях, со значительной долей в Мейсснеровом и Ауэрбаховом сплетениях. MM тесно связаны с телами клеток и отростками глии и нейронов, а также с варикозными расширениями по длине симпатических аксонов [17, 33, 53]. Фенотипически их можно определить по высокому уровню экспрессии главного комплекса гистосовместимости (ГКГС класса II), CD163 и CX3CR1. Большая часть популяции ММ представлена ранними макрофагами костного мозга и Mϕ эмбрионального происхождения, имеющими противовоспалительный профиль. Высвобождение LPS при сепсисе приводит к активации ММ и усилению регуляции маркера активации лимфоцитов интегрина αLβ2 (Lymphocyte function-associated antigen 1, LFA-1) и коррелирует с глубоким снижением перистальтики кишки. Увеличение LFA-1+ ММ также коррелирует с проявлениями синдрома послеоперационной кишечной непроходимости (postoperative ileus, POI) в организме человека, который характеризуется большим притоком иммунных клеток. Холинергическая стимуляция макрофагов, обусловленная воздействием вагусных эфферентов на кишечные нейроны, снижает количество нейтрофилов и дополнительных макрофагов, облегчает симптомы заболевания. Понимание возможных эффектов активации MM на моторику кишки не ограничивается POI. В контексте индуцированного диабетом гастропареза, продуцируемые ММ воспалительные цитокины (IL-6, TNF-α и IL-1β), по-видимому, способствуют потере пейсмекерных клеток, названных интерстициальными клетками Кахаля. МНС кишки при наличии инфекций еще больше смещает эту популяцию макрофагов в сторону тканезащитного профиля. Стимуляция адренергических бета 2 рецепторов (ADR-β2 ММ) энтеральной части МНС приводит к изменению экспрессии генов MM [33, 72].
Мышечные макрофаги находятся в тесном контакте с нейронами мышечного и подслизистого сплетений. Истощение MM существенно изменяет моторику толстой кишки. Среди наиболее дифференциально экспрессируемых генов, костный морфогенетический белок 2 (bone morphogenetic protein 2, BMP2) является одним из факторов, влияющих на устойчивый ММ-контроль моторики. Кишечные нейроны, в свою очередь, регулируют количество макрофагов за счет фактора стимуляции колоний 1 (colony stimulating factor 1, CSF1), также известного как фактор стимуляции колоний макрофагов (M-CSF) [45, 50].
Помимо того, взаимодействие между кишечными нейронами и макрофагами мышечной ткани может зависеть от сигналов микробиоты, которая регулирует уровни BMP2 и CSF1. Также макрофаги участвуют в предполагаемом устранении невропатий, о чем свидетельствует их связь с дистрофическими нейронами и нейритами, расположенными по всему миэнтеральному сплетению и в стенке гладких мышц у старых крыс. Паттерны взаимодействий макрофагов и нейронов в кишечнике совпадают с более широко охарактеризованными взаимодействиями микроглии и нейронов в ЦНС [33, 53].
Мышечные макрофаги колонизируют кишку плода мыши раньше кишечных нейронов. Кроме того, кишка новорожденных мышей и человека, в которой отсутствуют энтеральные нейроны МНС, содержит нормальное количество фенотипически интактных ММ с хорошо структурированным рисунком. Эти данные позволяют предположить, что энтеральные нейроны не требуются для колонизации кишки ММ и что модулирующие нейроиммунные цепи кишки созревают постнатально и могут зависеть от факторов окружающей среды, таких как кишечная микробиота или диета [17].
Дендритные клетки (DC) проникают в монослой эпителия кишки для отбора проб бактерий просвета, не нарушая целостности эпителиального барьера. Это возможно, потому что сами DC экспрессируют белки плотных контактов, такие как окклюдин 1 (zonula occludin 1) и клаудин. Когда патоген преодолевает эпителиальный барьер, DC являются одними из первых антигенпрезентирующих клеток, которые сталкиваются с микробным агентом. После обнаружения патогена и фагоцитоза DC мигрируют в местные лимфатические узлы (ЛУ) через периферические лимфатические сосуды [25].
DC постоянно мигрируют CCR7-зависимым образом в ЛУ, где они взаимодействуют с рециркулирующими Т-клетками и вызывают их дифференцировку. На миграцию и подвижность постоянного тока влияют симпатические и сенсорные нервные импульсы. Норадренергические аксональные волокна находятся в непосредственной близости от DC, плазматических клеток и в зонах Т-клеток. Медиатор NA может влиять на их миграцию. Незрелые DC также реагируют на NA и на CGRP [29, 51].
В зависимости от стадии их созревания по-разному экспрессируются 5-HTR рецепторы. 5-HT1R и 5-HT2R опосредуют хемотаксис. Уровни IL-1β и IL-8 увеличиваются после активации 5-HT4R и 5-HT7R рецепторов DC, при этом высвобождение IL-12 и TNF-α снижается. Продукция IL-6 DC повышается после активации 5-HT3R, 5-HT4R и 5-HT7R. DC направляют дифференцировку наивных Т-клеток, и 5-HT участвует в этом процессе [18, 67].
Сенсорные нейроны через SP и CGRP могут регулировать выработку цитокинов IL-12/23 дендритными клетками, а NA может влиять на продукцию, например, IL12, IL-6, посредством связывания с адренорецепторами (β2, α1, α2). Потенциал этих нейротрансмиттеров определяет профиль цитокинов, секретируемых DC, позволяет СНС стимулировать поляризацию Т-клеток в сторону Th1 и выработку эффекторных цитокинов, приводя к усилению Th1-ответа. При воспалении созревание DC является важным этапом в запуске адаптивного иммунного ответа [29, 51]. Следовательно, нервная регуляция косвенно влияет на его формирование.
Тучные клетки (mast cells, MC) циркулируют в крови в небольших количествах в виде незрелых предшественников. Мигрируя в ткани, они завершают свою дифференцировку в зрелые MC под влиянием местного микроокружения, которое определяет их фенотип и функцию. Они концентрируются в непосредственной близости от кровеносных и лимфатических сосудов, и кишечных нервов, в основном в слизистой оболочке (большая часть MCT – содержат высокие уровни триптазы) и подслизистом слое (фенотип MCTC, содержат триптазу, химазу и карбоксипептидазу) [1, 29, 45, 62].
В ЖКТ, как хорошо известно, находится самая большая популяция тучных клеток в организме, хоуминг которых зависит от связывания интегрина α4β7 с соответствующими молекулами адгезии и хемокиновым рецептором – 2CXC [1, 62]. Эти высокоспециализированные лейкоцитарные клетки включают большое количество гранул, содержащих предварительно сформированные (гистамин, серотонин, протеазы, гепарин и факторы роста, включая GMCSF (granulocyte-macrophage colony-stimulating factor), NGF (nerve growth factor), VEGF (vascular endothelial growth factor), TNF-α, протеогликаны, инициирующие раннее привлечение иммунных клеток в очаг инфекции) и синтезированные молекулы – простагландины, лейкотриены и цитокины (IL-1β, IL-2, IL-3, IL-4, IL-6, IL-8, IL-16 и IL-18) [1, 62].
Тучные клетки выделяют широкий спектр хемотаксических факторов для различных CD4+ Т-хелперных (Th) клеток: CCL3, CCL4, CXCL9 и CXCL10 для Th1; CCL5 и CCL11 для Th2; и CCL2 и CCL20 для Th17. Кроме того, они также поддерживают поляризацию ответов Th-клеток за счет секреции специфических медиаторов, таких как IL-12 и IFNγ для Th1; IL-4 для Th2; IL-6 и TGFβ1 для Th17; и IL-6 и TNF-α для Th22 [1, 63]. MC экспрессируют Kit-рецепторную тирозинкиназу. Kit является лигандом фактора стволовых клеток (SCF) и играет критическую роль в биологии MC, регулируя развитие, миграцию, рост, выживаемость и локальную активацию MC. Другие факторы также могут модулировать рост и выживаемость MC, в том числе IL-3, IL-4, IL-9, IL-10, IL-33, CXCL12, TGF-β и NGF. Нервные волокна кишки продуцируют и секретируют лиганд фактора роста Kit на плазматической мембране, что делает возможным прямой контакт между тучными клетками и нервными волокнами. MC могут реагировать на различные эндогенные стимулы, поскольку экспрессируют рецепторы нейротрансмиттеров (таких как ACh и 5-HT), нейропептидов (таких как SP и VIP), нейротрофины (такие как фактор роста нервов, NGF) и газообразные нейротрансмиттеры (например, NO) [19, 45, 54, 62, 65].
Дегранулирующие тучные клетки высвобождают триптазы, PG, TNF-α и гистамин, чтобы сигнализировать МНС о наличии угрозы в просвете кишки, одновременно привлекая иммунные воспалительные клетки в стенку кишки путем экстравазации из кишечного кровотока. В ответ на электростимуляцию афферентов, воздействие SP или CGRP, капсаицина, соединения 48/80 происходит высвобождение гистамина и протеазы II тучных клеток. Ответы нейронов в МНС на паракринное высвобождение гистамина и других продуктов дегрануляции тучных клеток приводят к активации центрального генератора паттерна (central pattern generator, CPG). В МНС CPG создают организованные и повторяющиеся двигательные паттерны независимо от сенсорного ввода [38, 63, 70].
Действие гистамина на уровне отдельных нейронов приводит к выработке CPG, который впоследствии трансформируется в повторяющийся паттерн поведения на уровне железистого эпителия и мускулатуры. Активация гистамином рецепторов H2 подтипа переводит нейроны из состояния низкой возбудимости в состояние повышенной возбудимости. Пресинаптическое ингибирующее действие гистамина опосредуется H3 подтипом гистаминовых рецепторов. Тот факт, что воспалительные и иммунные клетки паракринно взаимодействуют с элементами МНС, способствует лучшему пониманию моторики и секреторной патофизиологии при пищевой аллергии, инфекционном энтерите, идиопатическом колите, а также при стрессорных событиях при функциональных желудочно-кишечных расстройствах, таких как СРК [71].
Нейроны в энтеральной части МНС экспрессируют тот же набор рецепторов для продуктов дегрануляции тучных клеток, что и на афферентах блуждающего нерва и спинного мозга. Эти клетки могут высвобождать медиаторы воспаления, такие как IL-1β и простагландины, которые, в свою очередь, активируют афферентные волокна блуждающего нерва. При этом активация VN подавляет высвобождение провоспалительных цитокинов макрофагами на модели эндотоксемии у крыс [29].
Стимуляция возбудимости нейронов, пресинаптическое подавление высвобождения нейротрансмиттеров и активация сети МНС, ведущие к увеличению секреции слизистой оболочки в сочетании с мощной аборальной пропульсивной подвижностью, могут явиться результатом нейроиммунной коммуникации тучных клеток в кишке. Нейропептиды SP и NGF вызывают высвобождение вазоактивных медиаторов из тучных клеток, тем самым способствуя секреции хлоридов, дисфункции барьера, гипералгезии, диарее, воспалению и изменениям моторики. Из-за малочисленности в норме, роль тучных клеток в нейроиммунном взаимодействии особенно важна при воспалительных состояниях, таких как пищевая аллергия, паразитарная инфекция и некоторые формы синдрома IBS, характеризующихся резким увеличением количества MC. При этом высвобождаемые ими медиаторы приводят к гиперчувствительности нейронов кишки [45, 54, 61, 66].
ЭКСПРЕССИРУЕМЫЕ В МНС ПАТТЕРН-РАСПОЗНАЮЩИЕ РЕЦЕПТОРЫ
При распознавании микроб-ассоциированных молекулярных паттернов, PRR запускают воспалительный сигнальный каскад, который завершается выработкой провоспалительных цитокинов и хемокинов, опосредующих ответ на вторжение патогенов. На основе гомологии белковых доменов выделяют пять семейств, которые состоят из Toll-подобных рецепторов (TLR), лектиновых рецепторов C-типа (C-type lectin receptors, CLR) рецепторов, содержащих нуклеотид-связывающий домен, (или NOD-подобных) рецепторов, богатых лейцином (LRR), RIG-I-подобных рецепторов (RLR) и AIM2-подобных рецепторов. Связанные с мембраной рецепторы TLR и CLR находятся на поверхности клетки или в эндосомальных компартментах, обнаруживают и распознают микробные лиганды во внеклеточном пространстве и внутри эндосом [1, 25].
PRR экспрессируются на эпителиальных и иммунных клетках, таких как тучные клетки, макрофаги, нейтрофилы, DC, естественные киллеры (NK) и в меньшей степени на эозинофилах и лимфоцитах. При этом имеются данные о синергическом усилении ответа клеток врожденного иммунитета при их одновременной активации парными сочетаниями агонистов PRR, в частности TLR4 + NOD2, TLR4 + TLR9 или TLR9 + NOD2. Интеграция сигнальных путей, идущих от TLR4, TLR9 и NOD2-рецепторов в макрофагах мыши, приводит к возрастанию активности протеинкиназ TAK1, IKKa/p, ERK1/2 и TBK1, являющихся звеньями NF-kB-, MAPK- и IRF-сигнальных осей. На сегодняшний день появляются данные, что тела и отростки нейронов в энтеральной части МНС распознают различные лиганды патогенов через паттерн-распознающие рецепторы [1, 12, 20, 27, 39].
Продукты комменсальных бактерий способны также взаимодействовать с афферентами ЭНС через PRR. Например, воздействие Lactobacillus rhamosus и Bacteroides fragilis на эпителий активирует первичные афференты кишки в течение нескольких секунд и повышает их возбудимость в течение нескольких минут. Короткая латентность ортодромных потенциалов действия свидетельствует, что IPAN ответы являются прямыми потенциалами сенсорного действия, опосредованными нервными процессами. Сенсорные нейроны также получают синаптические входы от локальных цепей кишечных афферентов, о чем свидетельствует регистрация вторичных возбуждающих постсинаптических потенциалов. Кроме того, было обнаружено, что капсульный полисахарид А из B. fragilis является критическим медиатором активации сенсорных нейрональных ответов [43].
В целом, имеющиеся данные указывают, что опосредованное бактериальными лигандами усиление возбудимости сенсорных нейронов может снижать перистальтику толстой кишки, и это снижение мышечного напряжения может быть фактором, способствующим пробиотическому облегчению висцеральной боли.
Толл-подобные рецепторы в кишке. В настоящее время известно 13 подтипов рецепторов TLR у млекопитающих, имеющих общий консервативный домен, связанный с Toll-интерлейкином-1 (TIR), которые при этом отличаются специализированным доменом с высоким содержанием лейцина, определяющим специфичность лиганда. Видовые различия демонстрируют отсутствие рецепторов TLR11, TLR12 и TLR13 у человека, а мыши не экспрессируют функциональный TLR10. Активация TLR консервативными антигенами патогенов вызывает быстрые и локализованные ответы, опосредованные фагоцитами через различные сигнальные пути, что приводит к продукции провоспалительных цитокинов, хемокинов (TNF-α и IL-8) и интерферона 1 типа, а также индуцирует локальный иммунный ответ [20, 26, 35].
Некоторые TLR, такие как TLR3, TLR5 и TLR9, распознают только один тип PAMP, в то время как другие, например, TLR2, по-видимому, распознают несколько разных микробных молекул. После гомо- или гетеродимеризации TLR домены TIR связываются с доменами внутриклеточных адаптерных молекул. Все TLR, кроме TLR3, ассоциируются с TIR-содержащим фактором миелоидной дифференцировки MyD88, который при активации опосредует сигнальный каскад, ведущий к активации фактора транскрипции NF-κB [35].
Важным свойством данных рецепторов является толерантность к PAMP, экспрессируемым комменсальной микробиотой, с одновременной способностью распознавать антигены патогенов для обеспечения последующего полноценного иммунного ответа против них. Это в основном достигается за счет подавления поверхностной экспрессии TLR2, TLR4 и MD-2 в эпителии кишки и активного участия местных иммунных и нервных клеток [26, 36].
Так, in vitro, на модели IEC продемонстрировано, что стимуляция LPS или пептидогликаном перемещает конститутивную поверхностную экспрессию TLR2 и TLR4 во внутриклеточные компартменты вблизи базолатеральной мембраны. Кишечный эпителий также использует специфическое тканевое распределение и компартментализацию TLR-экспрессирующих клеток, чтобы избежать ненужной активации TLR и в то же время обеспечить развитие быстрой и эффективной защиты хозяина от вторжения патогенных организмов. Показано, что эпителиальные клетки крипт экспрессируют TLR2 и TLR4, тогда как зрелые IEC экспрессируют только TLR3. Поскольку эпителиальные клетки крипт не вступают в прямой контакт с комменсальными бактериями, экспрессия ими рецепторов TLR2 и TLR4 не сопровождается негативными последствиями для собственной микробиоты кишки. Аналогичным образом, экспрессия TLR3 в просвете кишки также не оказывает негативного влияния [26].
Установлено, что человеческие 5-HT+ энтероэндокринные клетки и линии энтероэндокринных клеток мыши экспрессируют несколько типов TLR, включая TLR 1, 2, 4, 5, 6 и 9, активация которых модулирует выработку холецистокинина и усиление секреции воспалительных цитокинов и хемокинов [45]. Таким образом, TLR способны экспрессироваться в кишке различными типами клеток во всех анатомических слоях.
Наличие TLR в первичных сенсорных нейронах может запускать активацию местных аксональных рефлексов, таких как противовоспалительный рефлекс и периферическое высвобождение сенсорными окончаниями различных медиаторов и нейропептидов в ответ на локальные воздействия. Метасимпатические энтеральные нейроны, как и иммунные клетки, экспрессируют TLR, распознающие PAMP патогенов, такие как LPS грамотрицательных бактерий (TLR4) и липопротеины грамположительных бактерий (TLR2 и TLR6), вирусные РНК (TLR3 и TLR7), неметилированные цитидин-фосфатгуанозиновые последовательности CpG-ДНК (TLR9) [12, 20, 26, 27, 35].
TLR4-опосредованная активация кишечных нейронов регулирует выживание нейроцитов и подвижность кишки, тогда как передача сигналов TLR2 влияет на структуру ЭНС и сократимость органа. Сенсорный компонент ЭНС IPAN экспрессирует рецепторы врожденного иммунитета, включая TLR2, TLR3, TLR4 и TLR7 [12, 20, 43].
Конститутивная экспрессия рецепторов TLR2/4/9 толстой кишки взрослых крыс обнаружена в нейронах SMP и LMMP. При этом TLR2 идентифицирован во всех нейронах SMP и LMMP, тогда как TLR4 – только в некоторых телах нейронов и волокнах. Реактивность TLR9 была продемонстрирована для нейронов и межганглионарных пучков. Было также показано, что в нормальных условиях TLR3, TLR4 и TLR7 экспрессируются в нейронах и глиальных клетках межмышечного и подслизистого сплетений тонкой и толстой кишки мыши и крысы, а также в сплетениях подвздошной кишки человека. При этом, по одним данным интенсивность экспрессии TLR4 сильнее в дистальном отделе толстой кишки, по другим – в двенадцатиперстной кишке. В целом демонстрируется тенденция к снижению в анальном направлении [12, 29, 43].
Индуцированная LPS продукция TNF-α кишечными нейронами вызывает нейрональную экспрессию TLR2, посредством активации канонического пути ERK, а также AMPK-зависимым образом. Активация МНС через ингибирование этих путей снижает продукцию TNF-α в миэнтеральном сплетении человека и первичных культурах ЭНС крысы, тем самым модулируя воспалительную реакцию, вызванную эндотоксином. LPS-индуцированное увеличение экспрессии TLR2 в кишечных нейронах может участвовать в защитном ответе на воспалительные или инфекционные стимулы, поскольку недавно показано, что генетический дефицит TLR2 вызывает аномалии в структуре, нейрохимическом кодировании и функции МНС [28].
У мышей с нокаутом TLR2 и TLR4 отмечено уменьшение числа нейронов и глиальных клеток в дистальном отделе подвздошной кишки в Ауэрбаховом сплетении, где число нитроергических нейронов снижалось. Структурные аномалии в подслизистом сплетении мышей с нокаутом TLR2 функционально проявлялись как снижение нейронно-управляемых секреторных ответов на холинергическую стимуляцию. Воздействие in vitro на культуру гладкомышечных клеток сосудов золотистым стафилококком приводило к TLR2-зависимому двухфазному эффекту на экспрессию белка циклооксигеназы (ЦОГ-2) в мышцах, при этом простагландины, производные ЦОГ-2, обладают значительным сократительным действием на сосуды и мышцы кишки. Следовательно, существует вероятность, что функция гладких мышц кишки может регулироваться простагландинами, происходящими из микрососудов [26].
Стимуляция культур ЭНС эмбрионов крысы селективными лигандами индуцировала активацию NF-kB и высвобождение цитокинов и хемокинов нейронами и резидентными иммуноцитами. Нейтрализация TLR2 перед воздействием LPS снижает продукцию медиаторов воспаления, тогда как комбинация лигандов TLR2/4 способствует миграции макрофагов. Комбинированная стимуляция культур LPS и CpG-олигонуклеотидом 1826 (лиганды TLR4/9) вызывала синергетическое увеличение хемоаттракции и продукции цитокинов. Эти данные свидетельствуют о том, что МНС в целом, или ее область ЭНС, и особенно кишечные нейроны, могут интегрировать множество микробных сигналов и реагировать относительно избирательно, в зависимости от конкретных стимулированных TLR [27].
На мышиной модели колита, индуцированного тринитробензолсульфоновой кислотой (TNBS), которая имитирует болезнь Крона, было показано, что воздействие вазоактивным кишечным пептидом (VIP) может восстанавливать сверхэкспрессию TLR2 и TLR4 до исходного уровня. Механизм действия этого явления неизвестен, но может включать либо VIP-опосредованное подавление активации NF-κB (ведущее к прекращению дальнейшей экспрессии TLR), либо подавление цитокинов, которые, как известно, вносят вклад в активацию TLR в IEC. Это, по-видимому, новый механизм, с помощью которого кишечный пептид подавляет активность TLR [43, 73].
Помимо того, VIP оказывает негативную модуляцию передачи сигналов TLR4 путем подавления важных MyD88-зависимых и независимых сигнальных путей. VIP также проявляет ингибирующую активность в отношении ядерной транслокации факторов транскрипции, активированных TLR3 и TLR7 с последующим снижением антивирусных и провоспалительных медиаторов [9].
Хорошо известно, что во время опосредованной LPS TLR4-зависимой кишечной непроходимости обычно наблюдается подавление сократимости гладких мышц кишки. Экспрессия TLR в энтеральных сплетениях подчеркивает присутствие основанной на TLR системы нервного контроля и убедительно свидетельствует о том, что вирусные и бактериальные агенты могут напрямую активировать нейронные ответы кишки без вмешательства иммунных или эпителиальных клеток [14, 20, 26].
ЗАКЛЮЧЕНИЕ
Рассмотренные выше исследования демонстрируют преимущественное участие энтеральной части МНС и ее медиаторов в механизме воспалений тонкой и толстой кишки, а также в бактериальной защите хозяина комменсальной микробиотой кишки. С одной стороны, сенсорные нейроны способны распознавать бактериальные антигены и инфекционные процессы, генерируя ответ через центральную или периферическую нервную систему. С другой стороны, они также могут модулировать или подавлять врожденные и адаптивные иммунные ответы в ЖКТ посредством нейрогенных механизмов, таких как высвобождение нейропептидов (рис. 2).
Понимание механизмов защиты, опосредованных двунаправленными взаимодействиями в иммунной системе и АНС, имеет огромное значение и может расширить существующие возможности в лечении заболеваний, таких как СРК, IBD, рак ЖКТ и микробные инфекции.
Следует отметить, что в данном обзоре не рассматривались эффекты широко представленных в кишке местных энтероэндокринных клеток. Посредством продукции и высвобождения модуляторов, таких как 5-HT, хемокинов и цитокинов, они участвуют в нормальных и патофизиологических процессах в ЖКТ через сенсорные волокна и иммунные клетки. Мы полагаем и надеемся, что последующие исследования будут рассматривать уже трехкомпонентные модели нейроиммуноэндокринных взаимодействий в ЖКТ и в других органах и системах.
Список литературы
Лебедева Е.С. и др. Кооперативное взаимодействие сигнальных путей рецепторов TLR4, TLR9 и NOD2 в макрофагах мыши // Иммунология. 2018. Т. 39. № 1. С. 4–11.
Мюльберг А.А., Гришина Т.В. Цитокины как медиаторы нейроиммунных взаимодействий // Успехи физиологических наук. 2006. Т. 37. № 1. С. 18–27.
Нижегородова Д.Б., Левковская А.Н., Зафранская М.М. Иммунологические механизмы нейровоспаления и нейродегенерации // Иммунопатология, аллергология, инфектология. 2018. № 4. С. 27–42.
Ноздрачев А.Д. Полимодальная интероцептивная сенсорная система. // Интегративная физиология: Всероссийская конференция с международным участием, Санкт-Петербург (24–26 сентября 2019 г.). Тезисы докладов. СПб.: Институт физиологии им. И.П. Павлова РАН, 2019. С. 183–186.
Ноздрачев А.Д. Черниговский В.Н. Избранные труды (К 100-летию со дня рождения). Издательство “Наука”, 2007. С. 30–223
Павленко В.В. и др. Провоспалительные цитокины как предикторы эффективности фармакотерапии язвенного колита // Колопроктология. 2016. № S1. С. 98–98.
Порсева В.В., Маслюков П.М., Ноздрачев А.Д. Серое вещество спинного мозга. СПб.: Из-во С.-Петерб. ун-та, 2021. 184 с.
Самотруева М.А., Теплый Д.Л., Тюренков И.Н. Пути реализации нейро-иммуно-эндокринных взаимодействий // Естественные науки. 2009. Т. 4. С. 112–130.
Сарбаева Н.Н., Пономарева Ю.В., Милякова М.Н. Макрофаги: разнообразие фенотипов и функций, взаимодействие с чужеродными материалами // Гены и клетки. 2016. Т. 11. № 1. С. 9–17.
Смирнов В.М. и др. Серотонинергическая регуляция сокращений двенадцатиперстной кишки // Экспериментальная и клиническая гастроэнтерология. 2015. № 10. С. 55–60.
Тучина О.П. Нейро-иммунные взаимодействия в холинергическом противовоспалительном пути // Гены и клетки. 2020. Т. 15. № 1. С. 23–28.
Филиппова Л.В. и др. Экспрессия Толл-подобных рецепторов 4 в нервных сплетениях двенадцатиперстной, тощей и ободочной кишки крысы // Докл. Академии наук. Федеральное государственное бюджетное учреждение “Российская академия наук”, 2012. Т. 445. № 3. С. 353–353.
Филиппова Л.В., Ноздрачев А.Д. Интероцепция и нейроиммунные взаимодействия. Наука, 2007. 296 с.
Филиппова Л.В. Ноздрачев А.Д. Участие периферических сенсорных структур автономной нервной системы в механизмах нейроиммунных взаимодействий // Российский физиологический журн. им. И.М. Сеченова. 2014. Т. 100. № 10. С. 1138–1151.
Филиппова Л.В.. Ноздрачев А.Д. Висцеральные афференты. СПб.: Информ-Навигатор, 2011. 415 с.
Albert-Bayo M. et al. Intestinal mucosal mast cells: key modulators of barrier function and homeostasis // Cells. 2019. T. 8. № 2. C. 135.
Avetisyan M. et al. Muscularis macrophage development in the absence of an enteric nervous system // Proceedings of the National Academy of Sciences. 2018. V. 115. № 18. P. 4696–4701.
Bain C.C., Mowat A.M.I. The monocyte-macrophage axis in the intestine // Cellular immunology. 2014. V. 291. № 1–2. P. 41–48.
Banskota S., Ghia J.E., Khan W.I. Serotonin in the gut: Blessing or a curse // Biochimie. 2019. V. 161. P. 56–64.
Barajon I. et al. Toll-like receptors 3, 4, and 7 are expressed in the enteric nervous system and dorsal root ganglia // J. Histochemistry & Cytochemistry. 2009. V. 57. № 11. P. 1013–1023.
Barnes M.A., Carson M.J., Nair M.G. Non-traditional cytokines: how catecholamines and adipokines influence macrophages in immunity, metabolism and the central nervous system // Cytokine. 2015. V. 72. № 2. P. 210–219.
Becker L. et al. Age-dependent shift in macrophage polarisation causes inflammation-mediated degeneration of enteric nervous system // Gut. 2018. V. 67. № 5. P. 827–836.
Breunig E. et al. Histamine excites neurones in the human submucous plexus through activation of H1, H2, H3 and H4 receptors // The J. physiology. 2007. V. 583. № 2. P. 731–742.
Brinkman D.J. et al. Neuroimmune interactions in the gut and their significance for intestinal immunity // Cells. 2019. V. 8. № 7. P. 670.
Brubaker S.W. et al. Innate immune pattern recognition: a cell biological perspective // Annual review of immunology. 2015. V. 33. P. 257–290.
Buchholz B.M., Bauer A.J. Membrane TLR signaling mechanisms in the gastrointestinal tract during sepsis // Neurogastroenterology & Motility. 2010. V. 22. № 3. P. 232–245.
Burgueño J.F. et al. TLR2 and TLR9 modulate enteric nervous system inflammatory responses to lipopolysaccharide // J. neuroinflammation. 2016. V. 13. № 1. P. 1–15.
Coquenlorge S. et al. Modulation of lipopolysaccharide-induced neuronal response by activation of the enteric nervous system // J. neuroinflammation. 2014. V. 11. № 1. P. 202.
Costes L.M.M. et al. Neural networks in intestinal immunoregulation // Organogenesis. 2013. V. 9. №. 3. P. 216–223.
Deml K.F. et al. Interactions of histamine H1-receptor agonists and antagonists with the human histamine H4-receptor // Molecular pharmacology. 2009. V. 76. № 5. P. 1019–1030.
Flierl M.A. et al. Catecholamines-crafty weapons in the inflammatory arsenal of immune/inflammatory cells or opening Pandora’s box? // Molecular medicine. 2008. V. 14. № 3. P. 195–204.
Fung C., Vanden Berghe P. Functional circuits and signal processing in the enteric nervous system // Cellular and molecular life sciences. 2020. V. 77. №. 22. P. 4505–4522.
Gabanyi I. et al. Neuro-immune interactions drive tissue programming in intestinal macrophages // Cell. 2016. V. 164. № 3. P. 378–391.
Garza A. et al. Expression of nicotinic acetylcholine receptors and subunit messenger RNAs in the enteric nervous system of the neonatal rat // Neuroscience. 2009. V. 158. № 4. P. 1521–1529.
Harris G., KuoLee R., Chen W. Role of Toll-like receptors in health and diseases of gastrointestinal tract // World journal of gastroenterology: WJG. 2006. V. 12. № 14. P. 2149–2160.
Hodo T.W. et al. Critical Neurotransmitters in the Neuroimmune Network // Frontiers in Immunology. 2020. V. 11. P. 1869–1869.
Holzer P. Efferent-like roles of afferent neurons in the gut: blood flow regulation and tissue protection // Autonomic Neuroscience. 2006. V. 125. № 1–2. P. 70–75.
Hu H., Spencer N.J. Enteric nervous system structure and neurochemistry related to function and neuropathology // Physiology of the gastrointestinal tract. Academic Press, 2018. P. 337–360.
Hyland N.P., Cryan J.F. Microbe-host interactions: Influence of the gut microbiota on the enteric nervous system // Developmental Biology. 2016. V. 417. № 2. P. 182–187.
Israelyan N. et al. Effects of serotonin and slow-release 5-hydroxytryptophan on gastrointestinal motility in a mouse model of depression // Gastroenterology. 2019. V. 157. № 2. P. 507–521. e4.
Jarret A. et al. Enteric nervous system-derived IL-18 orchestrates mucosal barrier immunity // Cell. 2020. V. 180. № 1. P. 50–63. e12.
Jayawardena D. et al. Expression and localization of VPAC1, the major receptor of vasoactive intestinal peptide along the length of the intestine // American J. Physiology-Gastrointestinal and Liver Physiology. 2017. V. 313. № 1. P. G16–G25.
Lai N.Y., Mills K., Chiu I.M. Sensory neuron regulation of gastrointestinal inflammation and bacterial host defence // J. internal medicine. 2017. V. 282. № 1. P. 5–23.
Margolis K.G. et al. Enteric neuronal density contributes to the severity of intestinal inflammation // Gastroenterology. 2011. V. 141. № 2. P. 588–598. e2.
Margolis K.G., Gershon M.D., Bogunovic M. Cellular organization of neuroimmune interactions in the gastrointestinal tract // Trends in immunology. 2016. V. 37. № 7. P. 487–501.
Martínez C. et al. A Clinical Approach for the Use of VIP Axis in Inflammatory and Autoimmune Diseases // International J. Molecular Sciences. 2020. V. 21. № 1. P. 65–105.
Meerschaert K.A. et al. Unique molecular characteristics of visceral afferents arising from different levels of the neuraxis: location of afferent somata predicts function and stimulus detection modalities // J. Neuroscience. 2020. V. 40. № 38. P. 7216–7228.
McCoy E.S., Taylor-Blake B., Zylka M.J. CGRPα-expressing sensory neurons respond to stimuli that evoke sensations of pain and itch // PloS One. 2012. V. 7. № 5. P. e36355–e36355.
Mittal R. et al. Neurotransmitters: The critical modulators regulating gut–brain axis // J. cellular physiology. 2017. V. 232. № 9. P. 2359–2372.
Muller P.A., Matheis F., Mucida D. Gut macrophages: key players in intestinal immunity and tissue physiology // Current Opinion in Immunology. 2020. V. 62. P. 54–61.
Ordovas-Montanes J. et al. The regulation of immunological processes by peripheral neurons in homeostasis and disease // Trends in immunology. 2015. V. 36. № 10. P. 578–604.
Pabello N.G., Lawrence D.A. Neuroimmunotoxicology: Modulation of neuroimmune networks by toxicants // Clinical Neuroscience Research. 2006. V. 6. № 1–2. P. 69–85.
Phillips R.J., Powley T.L. Macrophages associated with the intrinsic and extrinsic autonomic innervation of the rat gastrointestinal tract // Autonomic Neuroscience. 2012. V. 169. № 1. P. 12–27.
Reber L.L. et al. Potential effector and immunoregulatory functions of mast cells in mucosal immunity // Mucosal immunology. 2015. V. 8. № 3. P. 444–463.
Rychlik A. et al. Vasoactive Intestinal Polypeptide (VIP) in the Intestinal Mucosal Nerve Fibers in Dogs with Inflammatory Bowel Disease // Animals. 2020. V. 10. № 10. P. 1759–1770.
Savidge T.C. Epigenetic regulation of enteric neurotransmission by gut bacteria // Frontiers in cellular neuroscience. 2016. V. 9: 503.https://doi.org/10.3389/fncel 2015. 00503
Smith T.K., Koh S.D. A model of the enteric neural circuitry underlying the generation of rhythmic motor patterns in the colon: the role of serotonin // American J. Physiology-Gastrointestinal and Liver Physiology. 2017. V. 312. № 1. P. G1–G14.
Spencer N.J., Hu H. Enteric nervous system: sensory transduction, neural circuits and gastrointestinal motility // Nature Reviews Gastroenterology & Hepatology. 2020. P. 1–14.
Spohn S.N., Mawe G.M. Non-conventional features of peripheral serotonin signalling—the gut and beyond // Nature reviews Gastroenterology & Hepatology. 2017. V. 14. № 7. P. 412–420.
Sun X. et al. Vasoactive intestinal peptide stabilizes intestinal immune homeostasis through maintaining interleukin-10 expression in regulatory B cells // Theranostics. 2019. V. 9. № 10. P. 2800–2811.
Traina G. Mast cells in gut and brain and their potential role as an emerging therapeutic target for neural diseases // Frontiers in Cellular Neuroscience. 2019. V. 13: 345. https://doi.org/10.3389/fncel.2019.00345
Uranga J.A., Martínez V., Abalo R. Mast Cell Regulation and Irritable Bowel Syndrome: Effects of Food Components with Potential Nutraceutical Use // Molecules. 2020. V. 25. 4314; https://doi.org/10.3390/molecules25184314
Vasamsetti S.B. et al. Sympathetic neuronal activation triggers myeloid progenitor proliferation and differentiation // Immunity. 2018. V. 49. № 1. P. 93–106. e7.
Verma A.K. et al. Neuroendocrine cells derived chemokine vasoactive intestinal polypeptide (VIP) in allergic diseases // Cytokine & Growth Factor Reviews. 2017. V. 38. P. 37–48.
Vu J.P. et al. Inhibition of vasoactive intestinal polypeptide (VIP) induces resistance to dextran sodium sulfate (DSS)-induced colitis in mice // J. Molecular Neuroscience. 2014. V. 52. № 1. P. 37–47.
Wang G.D. et al. Innervation of enteric mast cells by primary spinal afferents in guinea pig and human small intestine // American J. Physiology-Gastrointestinal and Liver Physiology. 2014. V. 307. № 7. P. G719–G731.
Wang S.J., Sharkey K.A., McKay D.M. Modulation of the immune response by helminths: a role for serotonin? // Bioscience Reports. 2018. V. 38. № 5. BSR20180027 https://doi.org/10.1042/BSR20180027
Wang X.N. et al. Orthogonal label and label-free dual pretreatment for targeted profiling of neurotransmitters in enteric nervous system // Analytica Chimica Acta. 2020. V. 1139. P. 68–78.
Watson C., Kirkcaldie M., Paxinos G. The brain: an introduction to functional neuroanatomy // Academic Press, 2010. P. 43–47.
Wood J.D. Autonomic brain in the gut // Integrative Physiology. 2020. V. 1. № 1. P. 5–10.
Wood J.D. Enteric nervous system: Brain-in-the-gut // Physiology of the Gastrointestinal Tract. Academic Press, 2018. P. 361–372.
Wu L. et al. Bidirectional role of β2-adrenergic receptor in autoimmune diseases // Frontiers in pharmacology. 2018. V. 9:1313. https://doi.org/10.3389/fphar.2018.01313
Wu X. et al. Vasoactive intestinal polypeptide promotes intestinal barrier homeostasis and protection against colitis in mice // PloS one. 2015. V. 10. № 5. P. e0125225–e0125225.
Yabut J.M. et al. Emerging roles for serotonin in regulating metabolism: New implications for an ancient molecule // Endocrine reviews. 2019. V. 40. № 4. P. 1092–1107.
Yalvac M.E. et al. VIP-expressing dendritic cells protect against spontaneous autoimmune peripheral polyneuropathy // Molecular Therapy. 2014. V. 22. № 7. P. 1353–1363.
Yoo B.B., Mazmanian S.K. The enteric network: interactions between the immune and nervous systems of the gut // Immunity. 2017. V. 46. № 6. P. 910–926.
Zigmond E., Jung S. Intestinal macrophages: well educated exceptions from the rule // Trends in immunology. 2013. V. 34. №. 4. P. 162–168.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук