Успехи физиологических наук, 2022, T. 53, № 4, стр. 15-26
Взаимодействие мезенхимальных стромальных и эндотелиальных клеток: роль факторов микроокружения
О. В. Жидкова a, *, Е. Р. Андреева a, **, Л. Б. Буравкова a, ***
a ГНЦ РФ – Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: olgavzhidkova@gmail.com
** E-mail: andreeva1564@gmail.com
*** E-mail: buravkova@imbp.ru
Поступила в редакцию 01.07.2022
После доработки 05.07.2022
Принята к публикации 09.07.2022
- EDN: LAGMNP
- DOI: 10.31857/S0301179822040099
Аннотация
Взаимодействие стромальных и эндотелиальных клеток является ключевым физиологическим процессом, который лежит в основе роста и поддержания целостности сосудистой сети в организме. От этих контактов зависит нормальное функционирование сосудистой системы и, как следствие, поддержание тканевого гомеостаза. Взаимная регуляция функциональной активности эндотелиальных и стромальных клеточных элементов не ограничена только формированием и поддержанием циркуляторного русла. Предполагается, что периваскулярная область является одним из локальных депо мезенхимальных стромальных клеток-предшественников (МСК), ответственных за процессы физиологического и репаративного ремоделирования различных тканей. Локальные тканевые клеточные и внеклеточные факторы оказывают модулирующее действие на процессы межклеточной коммуникации. В представленном обзоре обсуждается, каким образом факторы микроокружения изменяют эффекты взаимодействия МСК и эндотелиальных клеток.
ВВЕДЕНИЕ
Интерес к изучению взаимного влияния эндотелиальных клеток (ЭК) и МСК обусловлен рядом причин: расположение МСК в периваскулярной тканевой нише, хоуминг МСК в область повреждения из сосудистого русла, использование для восстановительного лечения тканеинженерных конструкций на основе МСК с добавлением ЭК для лучшей васкуляризации трансплантата [32, 61, 99]. Это способствовало исследованию роли МСК в поддержании гомеостаза сосудистой сети, и в частности их влияния на свойства ЭК [19, 32, 88, 91, 96]. В меньшей степени изучено влияние ЭК на функциональную активность МСК, а также способность МСК модулировать дисфункцию ЭК.
Известно, что факторы микроокружения в значительной мере влияют на функциональную активность клеток. Содержание кислорода в среде является одним из важных физиологических параметров, регулирующих свойства МСК и ЭК, значения которого можно контролировать in vitro [8, 13, 21, 24, 60]. При развитии ишемических и воспалительных заболеваний нормальное функционирование сосудистой сети нарушается. При этом наблюдается активация эндотелиальных клеток, миграция цитокин-продуцирующих иммунных клеток в периваскулярное пространство, ухудшение кровообращения и снижение оксигенации ткани [27, 69]. В ответ на повреждение ткани МСК мобилизируются из локальных тканевых депо и продуцируют трофические факторы, необходимые для репаративного ремоделирования [99]. Результаты, полученные при исследовании взаимодействия МСК и ЭК in vitro с учетом влияния факторов микроокружения, позволяют расширить представления о механизмах, обеспечивающих нормальное функционирование сосудистой сети в органах. Настоящий обзор посвящен анализу имеющихся данных о взаимном влиянии мезенхимальных стромальных и эндотелиальных клеток, а также о роли факторов микроокружения, таких как уровень О2 и присутствие провоспалительных цитокинов, на различные аспекты этого взаимодействия.
ВЛИЯНИЕ МСК НА ЭНДОТЕЛИАЛЬНЫЕ КЛЕТКИ
Рост и развитие сосудистой сети является сложным физиологическим процессом, в регуляцию которого вовлечены различные факторы [29, 55, 62, 87, 98]. По мере накопления экспериментальных данных стало понятно, что стромальные клетки, благодаря своим свойствам, играют значительную роль в поддержании структурной целостности и функционирования сосудов. Это обусловлено позитивным влиянием МСК на функциональную активность ЭК [26, 64, 88, 91]. В организме соседние клетки оказывают взаимное влияние через межклеточные контакты (контактное взаимодействие) и секретируя растворимые медиаторы (паракринное взаимодействие). Таким образом, важно понимать, какие эффекты МСК на ЭК реализуются при непосредственном контакте клеток, а какие возникают при действии секретируемых молекул.
Как показано in vitro, МСК могут индуцировать пролиферацию и миграцию ЭК [19, 40, 84]. Кондиционированная среда от МСК и контактное сокультивирование сосудистого эндотелия с МСК способствует формированию тубулоподобных структур в матригеле, в то же время наличие прямых межклеточных контактов оказывает стабилизирующее действие на эти структуры и препятствует их распаду [18, 53]. Кроме того, МСК стимулируют способность ЭК деградировать внеклеточный матрикс in vitro за счет активации различных протеаз [37]. Все эти процессы играют важную роль в формировании новых сосудов. Как известно, МСК располагаются вдоль формирующейся кровеносной сети, выполняя роль периваскулярных клеток-предшественников [35, 42, 73].
Эти свойства МСК создали предпосылки для их использования в клинических исследованиях с целью терапии ишемических заболеваний [3, 57, 101]. Паракринная активность МСК является одним из ведущих механизмов позитивного влияния на рост и развитие сосудистой сети [7, 26, 64, 88, 91]. Секретом МСК включает факторы роста и цитокины, которые стимулируют пролиферативный и миграционный потенциал эндотелиальных клеток. К ним относятся фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов 2 (FGF-2, также известный как основной фактор роста фибробластов), фактор роста тромбоцитов (PDGF), трансформирующий фактор роста β (TGF-β) и фактор роста гепатоцитов (HGF) [72, 91]. Предполагается, что VEGF является ключевым фактором в индукции прорастания сосудов, стимулируя пролиферацию и миграцию эндотелиальных клеток вместе с FGF-2 и PDGF [29, 68]. Известно, что помимо позитивного влияния на ангиогенез, VEGF регулирует проницаемость сосудов [98]. Фактор роста FGF-2 способствует деградации внеклеточного матрикса [68], TGF-β поддерживает формирование трубулоподобных структур [31], в то время как HGF увеличивает пролиферацию и миграцию ЭК [25].
Таким образом, МСК стимулируют активность эндотелиальных клеток, необходимую для формирования сосудистой сети и способствуют стабилизации этой сети. Эффекты МСК на сосудистый эндотелий реализуются преимущественно за счет растворимых медиаторов. В то же время контактное взаимодействие МСК и ЭК, вероятно, поддерживает структурно-пространственную организацию образующихся сосудистых элементов. Эти механизмы могут вносить значительный вклад в регуляцию роста и образования новых сосудов в процессе репарации поврежденной ткани, а также в поддержание нормального функционирования уже существующей сосудистой сети.
ВЛИЯНИЕ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК НА МСК
В моделях сокультивирования МСК с различными клетками установлено, что такое взаимодействие может оказывать влияние на процесс коммитирования МСК [41, 90]. При взаимодействии с ЭК в МСК наблюдается изменение транскрипционного профиля генов, ассоциированных с дифференцировкой МСК в миогенном или остеогенном направлении, а также возрастает экспрессия некоторых тканеспецифических маркеров на белковом уровне. Итоговый результат, по всей видимости, обусловлен не только самим взаимодействием клеток, но и дополнительными факторами, такими как соотношение клеток в сокультуре, характер (контактное, паракринное) и длительность взаимодействия.
Целый ряд работ свидетельствует об изменении экспрессии генов, связанных с миогенной дифференцировкой МСК [44, 46, 52]. Так показано, что контактное сокультивирование с ЭК в течение 48 ч вызывало повышение уровня мРНК генов-маркеров гладкомышечной дифференцировки: кальпонина 1, гладкомышечного актина α. Однако изменения транскрипционного профиля не приводили к появлению функционального сократительного фенотипа гладкомышечных клеток. МСК, которые отделили от ЭК после сокультивирования, сохраняли способность к дифференцировке в хондрогенном, остеогенном и адипогенном направлении [46].
В работе Li и соавт. продемонстрировано увеличение активности генов, кодирующих маркеры миогенной дифференцировки, а также генов регуляторов ангиогенеза в МСК при краткосрочном сокультивировании с ЭК (6–24 ч). Также отмечалось повышение экспрессии TGF-β как в МСК, так и в ЭК. Ингибирование блокирующими антителами TGF-β приводило к частичному снижению экспрессии транскрипционного фактора, под регуляцией которого находятся гены, вовлеченные в гладкомышечную дифференцировку [44]. Более длительное (5 сут) контактное сокультивирование МСК с ЭК сопровождалось возрастанием экспрессии гладкомышечного актина в МСК, этот же эффект обеспечивала кондиционированная среда от сокультуры МСК и ЭК. При этом увеличения концентрации TGF-β не было обнаружено, а наблюдаемые изменения были обусловлены высоким содержанием активина А в кондиционированной среде [52].
Часть экспериментальных данных свидетельствуют о коммитировании МСК в остеогенном направлении при длительном взаимодействии с ЭК. Показано, что контактное сокультивирование МСК и ЭК от 5 до 15 сут приводило к изменению уровня транскрипции генов маркеров ангиогенеза (PECAM1, CDH5, ANGPTL4, CD34) и остеогенеза (ALP, FKBP5, BMP). Также изменялся уровень экспрессии генов, кодирующих молекулы, необходимые для взаимодействия с внеклеточным матриксом (CD93, CDH5, vWF, MMRN1), и генов, связанных с активацией сигнального пути TGF-β (BMP, FST, MYC, ERK, DP1, THBS1) [95]. Показано, что контактное сокультивирование МСК с ЭК в течение различных временных промежутков приводило к повышению уровня экспрессии одного из основных генов-регуляторов остеогенной дифференцировки RUNX2 [15, 16, 103], возрастанию мРНК ALP (щелочной фосфатазы) [15, 16, 81] и транскрипции генов, кодирующих белки внеклеточного матрикса (COL1, ON, BSP) [15]. С помощью иммуногистохимических методик было продемонстрировано стимулирующее влияние ЭК на активность щелочной фосфатазы в МСК (маркер коммитирования в остеогенном направлении), а также на продукцию белка внеклеточного матрикса остеонектина и на минерализацию внеклеточного матрикса [15, 16, 58]. Важным условием остеокоммитирования МСК при взаимодействии с ЭК является наличие прямых межклеточных контактов и приблизительно равное соотношение клеток (1 : 1) [15, 17, 81].
Таким образом, присутствие ЭК может способствовать диференцировке МСК в определенном направлении. При краткосрочном сокультивировании (6–72 ч) не наблюдается появления функционального фенотипа дифференцированных клеток и сохраняется пластичность стромальных клеток, при увеличении времени взаимодействия возрастает экспрессия тканеспецифических белков. В то же время имеющиеся экспериментальные данные не дают однозначного ответа на вопрос, в каком направлении произойдет коммитирование МСК при взаимодействии с ЭК.
ЭФФЕКТЫ ЛОКАЛЬНОГО МИКРООКРУЖЕНИЯ НА ВЗАИМОДЕЙСТВИЕ МСК И ЭК
Тканевое микроокружение характеризуется определенными физико-химическими параметрами, составом внеклеточного матрикса, и включает различные типы клеток. Все эти компоненты могут оказывать влияние на функциональную активность МСК и ЭК.
Важное место в формировании неклеточного микроокружения и регуляции физиологического и репаративного ремоделирования ткани принадлежит матриксу [14, 89]. Взаимное влияние МСК и ЭК способствует увеличению уровня матриксных белков и различных протеолитических ферментов. Контактное сокультивирование ЭК и МСК в течение нескольких дней приводило к формированию сетевидных структур, которые располагались вокруг ассоциированных клеток. Было установлено, что сетевидные структуры образованы белками внеклеточного матрикса ламинином, коллагеном IV, перлеканом 1 [52]. Повышение продукции ламинина, фибронектина, перлекана 1 и коллагена IV наблюдается в процессе ангиогенеза, что, вероятно, необходимо для стабилизации сосудистой сети [55].
Некоторые работы свидетельствуют о том, что межклеточное взаимодействие модулирует протеолитическую активность МСК и ЭК. Путем паракринной регуляции ЭК повышают активность ММР-2 в МСК, что сопровождается увеличением скорости направленной миграции стромальных клеток [24]. Микрочастицы, которые секретируют ЭК микрососудов, содержат ферменты, ремоделирующие матрикс, например ММР-2, -7, -13, и не содержат ингибиторов металлопротеаз. Протеазы, которые находятся в микрочастицах от ЭК, расщепляют белки матрикса и переводят про-ММР-2, которую продуцируют МСК, в активную форму (ММР-2) [49]. При добавлении МСК к ЭК наблюдается усиление ветвления и образования тубулярной сети в матригеле, что сопровождается значительным возрастанием активности ММР-2 и ММР-9 по сравнению с активностью этих протеаз в монокультуре ЭК [36]. Однако содержание ферментов определялось в белковых экстрактах из смешанной культуры, в связи с чем сложно судить о вкладе каждого типа клеток в секрецию протеаз. Предполагается, что более активное формирование тубулярной сети in vitro при взаимодействии МСК и ЭК связано в том числе с индукцией экспрессии ММР3 в ЭК [58].
Результат межклеточного взаимодействия определяется во многом исходным уровнем метаболизма и функциональной активности участвующих в нем клеток. Периваскулярная область, в которой происходит взаимодействие МСК и сосудистого эндотелия, характеризуется определенными физиологическими параметрами. Одним из важнейших факторов, который определяет тканевой гомеостаз и функциональную активность клеток, является содержание О2. Уровень О2 в периваскулярной области ниже, чем в сосудистом русле, таким образом гипоксия является частью физиологического микроокружения МСК в организме [22, 34]. Известно, что МСК, культивируемые в гипоксических условиях, обладают более высоким пролиферативным и клоногенным потенциалом по сравнению с нормоксическими условиями, характеризуются увеличением подвижности и экспрессией молекул межклеточного взаимодействия [1, 28, 74, 94, 97]. Предполагается, что такие условия помогают стромальным клеткам, расположенным в локальных тканевых депо, поддерживать некоммитированный статус, способность к мобилизации и миграции, мультилинейной дифференцировке при действии соответствующих стимулов.
Эндотелиальный монослой, выстилающий внутреннюю поверхность сосудов, играет важную роль в регуляции различных физиологических процессов: поддержание сосудистого тонуса, свертывание крови, воспаление, адгезия и экстравазация лейкоцитов, ангиогенез [2, 4, 71]. ЭК постоянно контактируют с оксигенированной кровью и при снижении парциального давления О2 быстро реагируют на такие изменения, адаптируя свой метаболизм к новым условиям. Данные литературы свидетельствуют о том, что ЭК отвечают на гипоксическое воздействие повышением уровня активных форм кислорода (АФК) и увеличением транскрипционной активности гипоксия-индуцируемого фактора HIF. Эти события индуцируют экспрессию транспортеров глюкозы и ферментов гликолиза [54, 77, 85]. Кроме того, значительное снижение концентрации О2 в среде повышает экспрессию маркеров провоспалительной активации и апоптоза [10, 104]. Выраженная тканевая гипоксия и продукция провоспалительных цитокинов иммунными клетками при повреждении ткани может изменять конечный итог межклеточного взаимодействия МСК и ЭК.
Далее будут представлены эффекты депривации О2 и повышения уровня провоспалительных цитокинов на взаимодействие МСК и ЭК.
Как уже упоминалось, сокультивирование МСК и ЭК в нормоксических условиях способствует экспрессии проангиогенных маркеров в МСК, а также маркеров остеогенной дифференцировки. В гипоксических условиях сокультивирование МСК и ЭК в большей мере стимулировало ангиогенные свойства МСК, но не процессы коммитирования [60]. Возможно, это связано с тем, что после гипоксического воздействия МСК продуцируют паракринные факторы, которые снижают апоптоз ЭК, стимулируют их миграцию и участие в формировании новых капилляров [100].
Мы провели эксперименты по краткосрочному сокультивированию МСК и ЭК, при котором клетки взаимодействовали при пониженной концентрации О2 (5 и 0.1%) как через прямые межклеточные контакты, так и паракринно. Было обнаружено, что при 5% О2 (физиологическая гипоксия) сохранялся стромальный иммунофенотип и количество КОЕ-ф в популяции МСК. При этом возрастала экспрессия маркера остеогенеза RUNX2 и увеличивалась транскрипционная активность и продукция ИЛ-6, ИЛ-8 в МСК и ЭК. Кроме того, в присутствии МСК уменьшалась адгезия иммунных клеток к активированным ЭК. При более выраженном снижении уровня О2 до 0.1% эффекты сокультивирования МСК и ЭК были схожими с таковыми при 5% О2, однако наблюдалась отмена индукции транскрипции RUNX2 в МСК после взаимодействия, в меньшей степени возрастала экспрессия ИЛ-6 и наблюдалась еще большая индукция транскрипции и продукции ИЛ-8. По сравнению с физиологической гипоксией (5% О2), снижение концентрации О2 до 0.1% усиливало признаки окислительного стресса и адгезивные свойства в монокультуре ЭК, о чем свидетельствовало значительное повышение продукция оксида азота, возрастание мРНК эндотелиальной NO-синтазы (NOS3) и адгезии иммунных клеток к ЭК. МСК оказывали протективное действие на ЭК при 0.1% О2, что выражалось в частичном снижении избыточной продукции оксида азота и транскрипции NOS3, также уменьшении адгезии иммунных клеток к активированному эндотелию. Таким образом взаимодействие при физиологической гипоксии стимулировало регенеративные свойства МСК, а острая депривация О2 частично ослабляла эффекты взаимодействия МСК и ЭК [102].
Гипоксия (1% О2) и сокультивирование с ЭК оказывает модулирующее влияние на скорость направленной миграции МСК в системе трансвелл. Изменение подвижности МСК сопровождалось снижением экспрессии интегрина α4, увеличением активности киназы фокальной адгезии, ее мишеней белков-регуляторов цитоскелета (RhoA и ROCK1) и реорганизацией актинового цитоскелета [24]. Эти данные свидетельствуют о мобилизации МСК в ответ на паракринные факторы, продуцируемые ЭК, в особенности при депривации О2, что может иметь место в ишемизированной ткани.
Патологические изменения тканей при ишемических заболеваниях сопровождаются не только изменением концентрации О2, но и формированием провоспалительного микроокружения в результате продукции провоспалительных цитокинов иммунными клетками [27, 38]. Провоспалительные цитокины и острая гипоксия могут вызывать развитие эндотелиальной дисфункции. При этом наблюдается снижение вазодилатирующих и увеличение протромботических свойств сосудистого эндотелия, появление признаков провоспалительной активации (повышение экспрессии молекул межклеточной адгезии и продукции цитокинов), что сопровождается возрастанием продукции АФК [45, 51]. Увеличение проницаемости ЭК является одним из признаков эндотелиальной дисфункции и развивается при действии различных повреждающих факторов (бактериальные липополисахариды (ЛПС), провоспалительные цитокины, проапоптотические факторы) [43, 82]. Эти изменения лежат в основе развития различных хронических заболеваний [69, 92]. Предполагается, что МСК способствуют компенсации признаков эндотелиальной дисфункции (уровень окислительного стресса, проницаемость клеток для крупных молекул и адгезивные свойства).
В ряде работ продемонстрировано, что МСК могут паракринно регулировать проницаемость ЭК, вероятно, за счет синтезируемых растворимых медиаторов [22, 63, 80, 83, 93]. Так, кондиционированная среда от МСК и сокультуры МСК и ЭК вызывала повышение экспрессии VE-кадгерина, снижала проницаемость ЭК для макромолекул [63]. Добавление кондиционированной среды от МСК к ЭК после повреждающего действия ЛПС способствовало снижению экспрессии кавеолина-1, ответственного за трансэндотелиальный транспорт и, соответственно, уменьшало проницаемость ЭК. С помощью блокирующих антител к HGF и VEGF в эксперименте было установлена роль этих факторов в реализации регуляторного влияния кондиционированной среды от МСК на меж- и трансэндотелиальный транспорт в ЭК [23, 83]. Предполагается, что механизм восстановления барьерной функции сосудистого эндотелия обусловлен стимулирующим влиянием фактора роста HGF на экспрессию молекул межклеточного взаимодействия VE-кадгерина и оклюдина [93].
Один из возможных путей позитивного влияния МСК на ЭК реализуется через снижение продукции АФК. После сокультивирования с МСК показано снижение выраженности окислительного стресса в ЭК, индуцированного перекисью водорода, а также восстановление нарушенного пролиферативного потенциала и подвижности эндотелия [3]. Полученные нами данные свидетельствуют о снижении в ЭК избыточной продукции оксида азота и экспрессии гена эндотелиальной NO-синтазы (NOS3), вызванного значительной депривацией О2, после сокультивирования с МСК [102]. Ингибирующее действие МСК на индуцированный окислительный стресс и стресс эндоплазматического ретикулума является одним из механизмов антиапоптотического действия на ЭК [20, 47].
Использование МСК в моделях воспалительных заболеваний у животных продемонстрировало уменьшение системного воспалительного ответа и инфильтрации ткани иммунными клетками [12, 39, 76]. Данные, полученные in vitro, свидетельствуют о снижении выраженности признаков провоспалительной активации ЭК при взаимодействии с МСК [50, 56, 63]. Исследование механизмов противовоспалительного действия МСК показало, что кондиционированная среда, полученная от сокультур МСК и ЭК снижает адгезивные свойства активированных ЭК [56, 63], что говорит о важной роли продуцируемых паракринных факторов в регуляции позитивных эффектов взаимодействия. Использование блокирующих антител к ИЛ-6 позволило обнаружить весомый вклад этого цитокина в реализацию ингибирующего влияния кондиционированной среды от МСК и сокультур МСК и ЭК на адгезию иммунных клеток к активированным ЭК [50, 56]. Помимо увеличения продукции ИЛ-6, контактное сокультивирование МСК и ЭК модулирует уровень цитокинов ИЛ-8, МСР-1 [11, 13, 50, 102]. Интересным представляется наблюдение, что формирование прямых межклеточных контактов между МСК и ЭК способствует более выраженной индукции ИЛ-6, чем при разделении их полупроницаемой мембраной [47].
Одним из важных свойств МСК с точки зрения терапевтического применения является их способность к трансэндотелиальной миграции из просвета сосуда в ткань. Подобно иммунным клеткам, МСК более активно мигрируют в поврежденные ткани [47]. В основе этого процесса лежит способность МСК к хемотаксису по градиенту растворимых медиаторов (ИЛ-1β, ИЛ-6, ИЛ-8, МСР-1, CCL5, SDF-1), которые продуцируются различными клетками, в том числе эндотелиальными [9, 48]. Ранее мы провели сравнительный анализ паракринного влияния активированных ФНО-α и интактных эндотелиальных клеток на миграцию МСК. Было показано, что кондиционированная среда от активированных ЭК содержала более высокие концентрации ИЛ-6, -8 и увеличивала скорость миграции МСК, по сравнению с кондиционированной средой от неактивированных ЭК [103]. Таким образом, изменение эффектов, которые оказывают на подвижность МСК провоспалительно активированные ЭК, может быть связано с увеличением продукции растворимых медиаторов, выполняющих роль хемоаттрактантов (ИЛ-6, ИЛ-8, МСР-1 и др.) [6, 51, 103].
Трансэндотелиальная миграция МСК инициируется при межклеточном взаимодействии МСК и активированных ЭК с помощью молекул межклеточной адгезии, таких как P-селектин, VCAM-1/VLA-4, хемокины (CXCR4, ИЛ-8, CCL2, CCL5) [9, 75, 86], а также интегрины [75] и фактор Виллебранда [66].
МСК, несущие на своей поверхности хемокиновый рецептор CXCR4, взаимодействуют с ЭК через лиганд SDF-1, экспрессия которого возрастает при действии гипоксии [65]. Было показано, что адгезия к активированным ЭК происходит при взаимодействии рецептора VLA-4 на поверхности МСК с VCAM-1 на поверхности ЭК при моделировании действия тока крови [75]. Эти результаты соотносятся с исследованиями in vivo, которые демонстрируют, что у мышей после инфаркта миокарда введенные в коронарные артерии МСК адгезируют к ЭК сосудов сердца через VCAM-1 с возможным участием рецептора VLA-4 [78]. Кроме того, адгезия МСК к ЭК может быть опосредована рецепторами LFA-1/ICAM-1 на поверхности клеток [59]. С другой стороны, получены противоречивые данные относительно взаимодействия МСК и ЭК с помощью молекул VLA-4/VCAM-1 и LFA-1/ICAM-1. ЭК активировали ФНО-α и ИЛ-1β одновременно с добавлением ингибиторов синтеза РНК и белка, чтобы клетки не экспрессировали молекулы адгезии, характерные для активации (E-селектин, ICAM-1, VCAM-1). Несмотря на отсутствие экспрессии предполагаемых молекул посредников, адгезия МСК к ЭК увеличивалась. Повреждение эндотелия приводило к накоплению в кондиционированной среде фактора Виллебранда, который при экзогенном добавлении в среду вызывает дозозависимое повышение адгезии МСК к ЭК, вероятно, в результате связывания с мембраной клеток [66].
Помимо селектинов и молекул межклеточной адгезии, семейство интегринов участвует во взаимодействии МСК с сосудистым эндотелием. Анализ роли интегринов в обеспечении адгезии МСК к различным типам активированных ЭК, показал, что при взаимодействии МСК с клетками легочной артерии участвуют интегрины β1, α5, αХ, для адгезии к ЭК микрососудов сердца необходимы интегрины β2, α7, αХ, αD, а для адгезии к ЭК пупочной вены – интегрины β1, β2 и β3. Нейтрализующие антитела к интегринам подкласса β5 снижали адгезию МСК ко всем вышеуказанным видам эндотелия, что говорит об особой роли этой молекулы в механизме адгезии МСК и ЭК [79]. После сокультивирования с ЭК было выявлено повышение уровня интегринов α1 и αVβ3, а также снижение экспрессии интегрина α4 и N‑кадгерина в МСК. Изменение доли МСК, экспрессирующих эти молекулы, может указывать на их участие в формировании контактов между МСК и эндотелиальными клетками [102].
Действие провоспалительных цитокинов на МСК активно изучается в настоящее время. Экспериментальные данные предполагают, что активация некоторыми цитокинами может усиливать репаративный потенциал МСК и их вовлечение в ремоделирование ткани [14, 30]. В присутствии ИФН-γ и ФНО-α МСК синтезируют медиаторы, которые не продуцируются в неактивированном состоянии, и увеличивают экспрессию антивоспалительных метаболитов и молекул адгезии [67, 70]. Праймирование МСК ИФН-γ в течение 24 ч вызывало в МСК увеличение продукции АФК, снижение пролиферативной активности, способности к остеодифференцировке и уровня продукции VEGF и ИЛ-8, тогда как уровень MCP-1 и ИЛ-6 в кондиционированной среде возрастал. Возможно, в результате изменения паракринного профиля после праймирования ИФН-γ МСК сильнее стимулировали миграционную активность ЭК, чем неактивированные МСК [8]. Показано, что провоспалительный цитокин ФНО-α оказывает позитивный эффект на способность МСК участвовать в формировании сосудистой сети. МСК культивировали в фибриновом геле, затем обрабатывали ФНО-α в течение 2 суток, и оценивали формирование сосудистой сети in vitro и прорастание сосудов в трансплантат in vivo. Предварительно активированные ФНО-α МСК, по сравнению с неактивированными клетками, увеличивали длину и ветвление эндотелиальной сосудистой сети in vitro, стимулировали более выраженное прорастание сосудов в трансплантаты in vivo [33]. Вероятно, провоспалительные цитокины могут способствовать вовлечению МСК в регуляцию функциональной активности эндотелиальных клеток и формирование новых сосудов.
ЗАКЛЮЧЕНИЕ
Многочисленные экспериментальные данные, приведенные в настоящем обзоре, свидетельствуют о том, что межклеточная коммуникация МСК и ЭК происходит при участии паракринных медиаторов, прямых межклеточных контактов, а также компонентов внеклеточного матрикса, что обеспечивает поддержание тканевого гомеостаза.
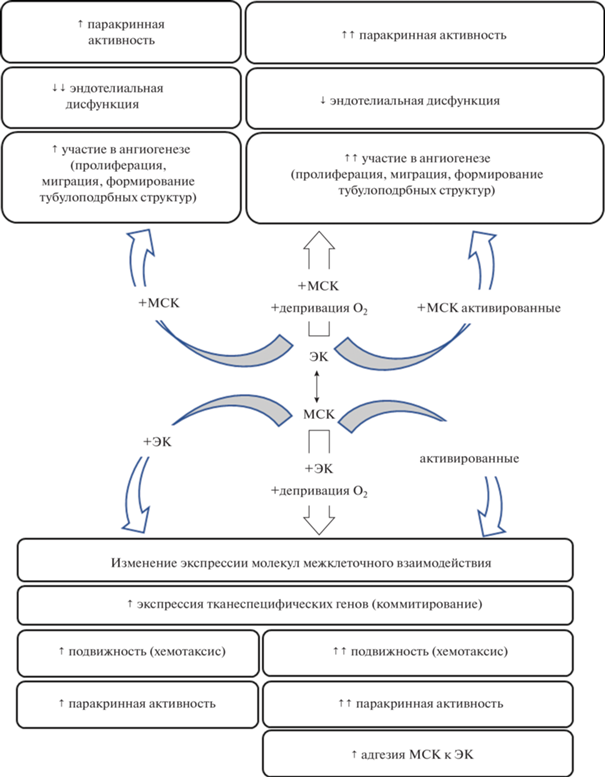
МСК модулируют процессы, важные для формирования новых сосудов, а именно пролиферацию, миграцию ЭК, их паракринную активность и формирование тубулоподобных структур. МСК уменьшают признаки провоспалительной активации и окислительного стресса, восстанавливают барьерную функцию ЭК, поддерживая целостность и нормальное функционирование сосудистой стенки. В свою очередь, взаимодействие с ЭК может индуцировать коммитирование МСК, что выражается в увеличении экспрессии генов-регуляторов дифференцировки, а при длительном сокультивировании возрастает экспрессия тканеспецифических белков. При этом важным условием начала дифференцировки МСК в сокультуре с ЭК является формирование прямых межклеточных контактов. Взаимодействие с ЭК регулирует протеолитическую активность МСК за счет изменения продукции внеклеточных матриксных белков и различных металлопротеаз. Более того, ЭК оказывают мобилизующее действие на МСК, увеличивая их подвижность и вызывая изменения в экспрессии поверхностных молекул адгезии (рис. 1).
Участие МСК и ЭК в регуляции физиологических и патологических процессов во многом обусловлено стимулами тканевого микроокружения, в частности концентрацией О2 и содержанием различных растворимых медиаторов. Экспериментальные данные предполагают, что значительная депривация О2 и действие цитокинов (ФНО-α, ИЛ-1β) может модулировать паракринные изменения, которые возникают в результате межклеточного взаимодействия, усиливать хемотаксис МСК при взаимодействии с ЭК. С другой стороны, острая гипоксия способствует индукции окислительного стресса в клетках, что может ослаблять позитивные эффекты межклеточной коммуникации. Провоспалительная активация ЭК способствует усилению экспрессии молекул адгезии и хемоаттрактантов, стимулирующих трансэндотелиальную миграцию МСК. Активированные МСК демонстрируют повышение продукции растворимых факторов, способствуют увеличению подвижности ЭК и формированию более длинной и разветвленной сосудистой сети, что свидетельствует об усилении проангиогенных свойств (рис. 1).
Изучение особенностей влияния различных компонентов клеточного и экстрацеллюлярного (О2, цитокины, внеклеточный матрикс) микроокружения на мезенхимальные стромальные и эндотелиальные клетки расширяет понимание их физиологической роли в организме, и показывает возможные пути применения этих клеток для регенеративной терапии различных заболеваний. С помощью подбора условий совместного культивирования МСК и ЭК in vitro можно в значительной степени влиять на дифференцировочный потенциал МСК, стимулировать продукцию клетками трофических факторов, белков матрикса и протеолитических ферментов, а также усиливать васкуляризацию трансплантатов, предназначенных для замещения тканей. Использование коротких гипоксических экспозиций и добавление в культуральную среду провоспалительных цитокинов является одним из методов моделирования локального микроокружения для клеток in vitro. Такой подход может быть использован для воспроизведения процессов, происходящих в организме, с целью изучения клеточного метаболизма и сигналинга, а также активности различных фармакологических препаратов. В то же время дальнейший поиск способов модификации свойств МСК и ЭК с помощью факторов микроокружения остается актуальным с точки зрения повышения их терапевтического потенциала.
Список литературы
Буравкова Л.Б., Гринаковская О.С., Андреева Е.Р., и др. Характеристика мезенхимальных стромальных клеток из липоаспирата человека, культивируемых при пониженном содержании кислорода // Цитология. 2009. № 51(1). С. 5–11.
Иванов А.Н., Попыхова Э.Б., Терешкина Н.Е., и др. Вазомоторная функция эндотелия // Успехи физиологических наук. 2020. № 51(4). С. 82–104. https://doi.org/10.31857/S0301179820030066
Коноплянников М.А. Стволовые клетки для терапии ишемической болезни сердца: достижения и перспективы // Клиническая практика. 2012. № 3. С. 63–73.
Abumaree M.H., Hakami M., Abomaray F.M. et al. Human chorionic villous mesenchymal stem/stromal cells modify the effects of oxidative stress on endothelial cell functions // Placenta. 2017. V. 59. P. 74–86. https://doi.org/10.1016/j.placenta.2017.05.001
Al-Soudi A., Kaaij M.H., Tas S.W. Endothelial cells: From innocent bystanders to active participants in immune responses // Autoimmun. Rev. 2017. V. 16(9). P. 951–962. https://doi.org/10.1016/j.autrev.2017.07.008
Al-Sowayan B., Keogh R.J., Abumaree M., et al. The effect of endothelial cell activation and hypoxia on placental chorionic mesenchymal stem/stromal cell migration // Placenta. 2017. V. 59. P. 131–138. https://doi.org/10.1016/j.placenta.2017.06.341
Andreeva E., Andrianova I., Bobyleva P. et al. Adipose tissue-derived stromal cells retain immunosuppressive and angiogenic activity after coculture with cord blood hematopoietic precursors // Eur. J. Cell. Biol. 2020. V. 99(2–3). P. 151069. https://doi.org/10.1016/j.ejcb.2020.151069
Andreeva E.R., Udartseva O.O., Zhidkova O.V. et al. IFN-gamma priming of adipose-derived stromal cells at “physiological” hypoxia // J. Cell. Physiol. 2018. V. 233(2). P.1535–1547. https://doi.org/10.1002/jcp.26046
Anton K., Banerjee D., Glod J. Macrophage-associated mesenchymal stem cells assume an activated, migratory, pro-inflammatory phenotype with increased IL-6 and CXCL10 secretion // PLoS One. 2012. V. 7(4). P. e35036. https://doi.org/10.1371/journal.pone.0035036
Antonova O.A., Loktionova S.A., Golubeva N.V. et al. Damage and activation of endothelial cells during in vitro hypoxia // Bull. Exp. Biol. Med. 2007. V. 144(4). P. 504–506. https://doi.org/10.1007/s10517-007-0362-x
Bachmann S., Jennewein M., Bubel M. et al. Interacting adipose-derived stem cells and microvascular endothelial cells provide a beneficial milieu for soft tissue healing // Mol. Biol. Rep. 2020. V. 47(1). P. 111–122. https://doi.org/10.1007/s11033-019-05112-y
Bai L., Shao H., Wang H. et al. Effects of Mesenchymal Stem Cell-Derived Exosomes on Experimental Autoimmune Uveitis // Sci. Rep. 2017. V. 7. P. 4323. https://doi.org/10.1038/s41598-017-04559-y
Bartaula-Brevik S., Bolstad A.I., Mustafa K. et al. Secretome of Mesenchymal Stem Cells Grown in Hypoxia Accelerates Wound Healing and Vessel Formation In Vitro // Int. J. Stem. Cell. Res. Ther. 2017. V. 4. P. 045. https://doi.org/10.23937/2469-570X/1410045
Bernardo M.E., Fibbe W.E. Mesenchymal stromal cells: sensors and switchers of inflammation // Cell Stem Cell. 2013. V. 13(4). P. 392–402. https://doi.org/10.1016/j.stem.2013.09.006
Bidarra S.J., Barrias C.C., Barbosa M.A. et al. Phenotypic and proliferative modulation of human mesenchymal stem cells via crosstalk with endothelial cells // Stem. Cell. Res. 2011. V. 7(3). P. 186–197. https://doi.org/10.1016/j.scr.2011.05.006
Böhrnsen F., Schliephake H. Supportive angiogenic and osteogenic differentiation of mesenchymal stromal cells and endothelial cells in monolayer and co-cultures // Int. J. Oral. Sci. 2016. V. 8(4). P. 223–230. https://doi.org/10.1038/ijos.2016.39
Bok J.S., Byun S.H., Park B.W. et al. The Role of Human Umbilical Vein Endothelial Cells in Osteogenic Differentiation of Dental Follicle-Derived Stem Cells in In Vitro Co-cultures // Int. J. Med. Sci. 2018. V. 15. P. 1160–1170. https://doi.org/10.7150/ijms.27318
Boomsma R.A., Geenen D.L. Mesenchymal stem cells secrete multiple cytokines that promote angiogenesis and have contrasting effects on chemotaxis and apoptosis // PLoS One. 2012. V. 7(4). P. e35685. https://doi.org/10.1371/journal.pone.0035685
Bronckaers A., Hilkens P., Martens W. et al. Mesenchymal stem/stromal cells as a pharmacological and therapeutic approach to accelerate angiogenesis // Pharmacol. Ther. 2014. V. 143(2). P. 181–196. https://doi.org/10.1016/j.pharmthera.2014.02.013
Buono L., Scalabrin S., De Iuliis M. et al. Mesenchymal Stem Cell-Derived Extracellular Vesicles Protect Human Corneal Endothelial Cells from Endoplasmic Reticulum Stress-Mediated Apoptosis // Int. J. Mol. Sci. 2021. V. 22(9). P. 4930. https://doi.org/10.3390/ijms22094930
Buravkova L.B., Andreeva E.R., Gogvadze V. et al. Mesenchymal stem cells and hypoxia: Where are we? // Mitochondrion. 2014. V. 19. P. 105–112. https://doi.org/10.1016/j.mito.2014.07.005
Carreau A., Hafny-Rahbi B.E., Matejuk A. et al. Why is the partial oxygen pressure of human tissues a crucial parameter? Small molecules and hypoxia // J. Cell. Mol. Med. 2011. V. 15(6). P. 1239–1253. https://doi.org/10.1111/j.1582-4934.2011.01258.x
Chen G., Yue A., Ruan Z. et al. Comparison of biological characteristics of mesenchymal stem cells derived from maternal-origin placenta and Wharton’s jelly // Stem. Cell. Res. Ther. 2015. V. 6. P. 228. https://doi.org/10.1186/s13287-015-0219-6
Choi J.H., Lim S.M., Yoo Y.I. et al. Microenvironmental Interaction Between Hypoxia and Endothelial Cells Controls the Migration Ability of Placenta-Derived Mesenchymal Stem Cells via a4 Integrin and Rho Signaling // J. Cell. Biochem. 2016. V. 117. P. 1145–1157. https://doi.org/10.1002/jcb.25398
Ding S., Merkulova-Rainon T., Han Z.C. et al. HGF receptor up-regulation contributes to the angiogenic phenotype of human endothelial cells and promotes angiogenesis in vitro // Blood. 2003. V. 101(12). P. 4816–22. https://doi.org/10.1182/blood-2002-06-1731
Dubey N.K., Mishra V.K., Dubey R. et al. Revisiting the Advances in Isolation, Characterization and Secretome of Adipose-Derived Stromal/Stem Cells // Int. J. Mol. Sci. 2018. V. 19. P. 2200. https://doi.org/10.3390/ijms19082200
Evora P.R., Nather J., Tubino P.V. et al. Curbing inflammation in the ischemic heart disease // Int. J. Inflam. 2013. V. 2013. P. 183061. https://doi.org/10.1155/2013/183061
Fehrer C., Brunauer R., Laschober G. et al. Reduced oxygen tension attenuates differentiation capacity of human mesenchymal stem cells and prolongs their lifespan // Aging. Cell. 2007. V. 6(6). P. 745–757. https://doi.org/10.1111/j.1474-9726.2007.00336.x
Gerhardt H., Golding M., Fruttiger M. et al. VEGF guides angiogenic sprouting utilizing endothelial tip cell filopodia // J. Cell. Biol. 2003. V. 161. P. 1163–1177. https://doi.org/10.1083/jcb.200302047
Gornostaeva A., Andreeva E., Buravkova L. Inflammatory priming of mesenchymal stem cells: Focus on growth factors enhancement // Biocell. 2022. V. 46(9). P. 2049–2052. https://doi.org/10.32604/biocell.2022.019993
Goumans M.-J., Lebrin F., Valdimarsdottir G. Controlling the Angiogenic Switch A Balance between Two Distinct TGF-b Receptor Signaling Pathways // Trends. Cardiovasc. Med. 2003. V. 13. P. 301–307. https://doi.org/10.1016/S1050-1738(03)00142-7
Huang N.F., Li S. Mesenchymal stem cells for vascular regeneration // Regen. Med. 2008. V. 3(6). P. 877–892. https://doi.org/10.2217/17460751.3.6.877
Hutton D.L., Kondragunta R., Moore E.M. et al. Tumor necrosis factor improves vascularization in osteogenic grafts engineered with human adipose-derived stem/stromal cells // PLoS One. 2014. V. 9(9). P. e107199. https://doi.org/10.1371/journal.pone.0107199
Ivanovic Z. Hypoxia or in situ normoxia: The stem cell paradigm // J. Cell. Physiol. 2009. V. 219(2). P. 271–275. https://doi.org/10.1002/jcp.21690
Janebodin K., Zeng Y., Buranaphatthana W. et al. VEGFR2-dependent angiogenic capacity of pericyte-like dental pulp stem cells // J. Dent. Res. 2013. V. 92(6). P. 524–31. https://doi.org/10.1177/0022034513485599
Jiang F., Ma J., Liang Y. et al. Amniotic Mesenchymal Stem Cells Can Enhance Angiogenic Capacity via MMPs In Vitro and In Vivo // Biomed. Res. Int. 2015. V. 2015. P. 324 014. https://doi.org/10.1155/2015/324014
Kachgal S., Putnam A.J. Mesenchymal stem cells from adipose and bone marrow promote angiogenesis via distinct cytokine and protease expression mechanisms // Angiogenesis. 2011. V. 14(1). P. 47–59. https://doi.org/10.1007/s10456-010-9194-9
Kawabori M., Yenari M.A. Inflammatory responses in brain ischemia // Curr. Med. Chem. 2015. V. 22(10). P. 1258–1277.https://doi.org/10.2174/0929867322666150209154036
Kehoe O., Cartwright A., Askari A. et al. Intra-articular injection of mesenchymal stem cells leads to reduced inflammation and cartilage damage in murine antigen-induced arthritis // J. Transl. Med. 2014 3. V. 12. P. 157. https://doi.org/10.1186/1479-5876-12-157
Kim S.W., Zhang H.Z., Kim C.E. et al. Amniotic mesenchymal stem cells with robust chemotactic properties are effective in the treatment of a myocardial infarction model // Int. J. Cardiol. 2013. V. 168(2). P. 1062–1069. https://doi.org/10.1016/j.ijcard.2012.11.003
Kubosch E.J., Heidt E., Bernstein A. et al. The trans-well coculture of human synovial mesenchymal stem cells with chondrocytes leads to self-organization, chondrogenic differentiation, and secretion of TGFβ // Stem. Cell. Res. Ther. 2016. V. 7. P. 64. https://doi.org/10.1186/s13287-016-0322-3
Lee R.H., Pulin A.A., Seo M.J. et al. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6 // Cell. Stem. Cell. 2009. V. 5(1). P. 54–63. https://doi.org/10.1016/j.stem.2009.05.003
Lee W.L., Liles W.C. Endothelial activation, dysfunction and permeability during severe infections // Curr. Opin. Hematol. 2011. V. 18(3). P. 191–196. https://doi.org/10.1097/MOH.0b013e328345a3d1
Li J., Ma Y., Teng R. et al. Transcriptional profiling reveals crosstalk between mesenchymal stem cells and endothelial cells promoting prevascularization by reciprocal mechanisms // Stem. Cells. Dev. 2015. V. 24(5). P. 610–623. https://doi.org/10.1089/scd.2014.0330
Liao J.K. Linking endothelial dysfunction with endothelial cell activation // J. Clin. Invest. 2013. V. 123(2). P. 540–541. https://doi.org/10.1172/JCI66843
Lin C.H., Lilly B. Endothelial cells direct mesenchymal stem cells toward a smooth muscle cell fate // Stem. Cells. Dev. 2014. V. 23(21). P. 2581–2590. https://doi.org/10.1089/scd.2014.0163
Liu Y., Huang W., Zhang R. et al. Proteomic analysis of TNF-α-activated endothelial cells and endothelial microparticles // Mol Med Rep. 2013. V. 7(1). P. 318–26. https://doi.org/10.3892/mmr.2012.1139
Lourenco S., Teixeira V.H., Kalber T. et al. Macrophage migration inhibitory factor-CXCR4 is the dominant chemotactic axis in human mesenchymal stem cell recruitment to tumors // J. Immunol. 2015. V. 194(7). P. 3463–74. https://doi.org/10.4049/jimmunol.1402097
Lozito T.P., Tuan R.S. Endothelial cell microparticles act as centers of matrix metalloproteinsase-2 (MMP-2) activation and vascular matrix remodeling // J. Cell. Physiol. 2012. V. 227(2). P. 534–549. https://doi.org/10.1002/jcp.22744
Luu N.T., McGettrick H.M., Buckley C.D. et al. Crosstalk between mesenchymal stem cells and endothelial cells leads to downregulation of cytokine-induced leukocyte recruitment // Stem. Cells. 2013. V. 31(12). P. 2690–702. https://doi.org/10.1002/stem.1511
Makó V., Czúcz J., Weiszhár Z. et al. Proinflammatory activation pattern of human umbilical vein endothelial cells induced by IL-1β, TNF-α, and LPS // Cytometry A. 2010. V. 77(10). P. 962–70. https://doi.org/10.1002/cyto.a.20952
Merfeld-Clauss S., Lupov I.P., Lu H. et al. Adipose stromal cells differentiate along a smooth muscle lineage pathway upon endothelial cell contact via induction of activin A // Circ. Res. 2014. V. 115(9). P. 800–809. https://doi.org/10.1161/CIRCRESAHA.115.304026
Merino A., Sablik M., Korevaar S.S. et al. Membrane Particles Derived From Adipose Tissue Mesenchymal Stromal Cells Improve Endothelial Cell Barrier Integrity // Front. Immunol. 2021. V. 12. P. 650522. https://doi.org/10.3389/fimmu.2021.650522
Michiels C., Arnould T., Remacle J. Endothelial cell responses to hypoxia: initiation of a cascade of cellular interactions // Biochim. Biophys. Acta. 2000. V. 1497(1). P. 1–10. https://doi.org/10.1016/s0167-4889(00)00041-0
Mongiat M., Andreuzzi E., Tarticchio G. et al. Extracellular Matrix, a Hard Player in Angiogenesis // Int. J. Mol. Sci. 2016. V. 17(11). P. 1822. https://doi.org/10.3390/ijms17111822
Munir H., Luu N.T., Clarke L.S. et al. Comparative Ability of Mesenchymal Stromal Cells from Different Tissues to Limit Neutrophil Recruitment to Inflamed Endothelium // PLoS One. 2016. V. 11(5). P. e0155161. https://doi.org/10.1371/journal.pone.0155161
Murohara T. Autologous adipose tissue as a new source of progenitor cells for therapeutic angiogenesis // J. Cardiol. 2009. V. 53(2). P. 155–63. https://doi.org/10.1016/j.jjcc.2009.01.003
Mutschall H., Winkler S., Weisbach V. et al. Bone tissue engineering using adipose-derived stem cells and endothelial cells: Effects of the cell ratio // J. Cell. Mol. Med. 2020. V. 24(12). P. 7034–7043. https://doi.org/10.1111/jcmm.15374
Nassiri S.M., Rahbarghazi R. Interactions of mesenchymal stem cells with endothelial cells // Stem. Cells. Dev. 2014 15. V. 23(4). P. 319–32. https://doi.org/10.1089/scd.2013.0419
Nguyen V.T., Canciani B., Cirillo F. et al. Effect of Chemically Induced Hypoxia on Osteogenic and Angiogenic Differentiation of Bone Marrow Mesenchymal Stem Cells and Human Umbilical Vein Endothelial Cells in Direct Coculture // Cells. 2020. V. 19(3). P. 757. https://doi.org/10.3390/cells9030757
Nitzsche F., Müller C., Lukomska B. et al. Concise Review: MSC Adhesion Cascade-Insights into Homing and Transendothelial Migration // Stem. Cells. 2017. V. 35(6). P. 1446–1460. https://doi.org/10.1002/stem.2614
Parfenova Y., Plekhanova O., Solomatina M. et al. Contrasting effects of urokinase and tissue-type plasminogen activators on neointima formation and vessel remodelling after arterial injury // J. Vasc. Res. 2004. V. 41(3). P. 268–276.
Pati S., Gerber M.H., Menge T.D., et al. Bone marrow derived mesenchymal stem cells inhibit inflammation and preserve vascular endothelial integrity in the lungs after hemorrhagic shock // PLoS One. 2011. V. 6(9). P. e25171. https://doi.org/10.1371/journal.pone.0025171
Periasamy R., Elshaer S.L., Gangaraju R. CD140b (PDGFRβ) Signaling in Adipose-Derived Stem Cells Mediates Angiogenic Behavior of Retinal Endothelial Cells // Regen. Eng. Transl. Med. 2019. V. 5. P. 1–9. https://doi.org/10.1007/s40883-018-0068-9
Potapova I.A., Brink P.R., Cohen I.S. et al. Culturing of human mesenchymal stem cells as three-dimensional aggregates induces functional expression of CXCR4 that regulates adhesion to endothelial cells // J. Biol. Chem. 2008. V. 283(19). P. 13100–13107. https://doi.org/10.1074/jbc.M800184200
Potapova I.A., Cohen I.S., Doronin S.V. Apoptotic endothelial cells demonstrate increased adhesiveness for human mesenchymal stem cells // J. Cell. Physiol. 2009. V. 219(1). P. 23–30. https://doi.org/10.1002/jcp.21645
Prasanna S.J., Gopalakrishnan D., Shankar S.R. et al. Pro-inflammatory cytokines, IFNgamma and TNFalpha, influence immune properties of human bone marrow and Wharton jelly mesenchymal stem cells differentially // PLoS One. 2010. V. 5(2). P. e9016. https://doi.org/10.1371/journal.pone.0009016
Presta M., Dell’Era P., Mitola S. et al. Fibroblast growth factor/fibroblast growth factor receptor system in angiogenesis // Cytokine. Growth. Factor. Rev. 2005. V. 16. P. 159–178. https://doi.org/10.1016/j.cytogfr.2005.01.004
Rajendran P., Rengarajan T., Thangavel J. et al. The vascular endothelium and human diseases // Int. J. Biol. Sci. 2013. V. 9(10). P. 1057–1069. https://doi.org/10.7150/ijbs.7502
Ren G., Zhang L., Zhao X. et al. Mesenchymal stem cell-mediated immunosuppression occurs via concerted action of chemokines and nitric oxide // Cell. Stem. Cell. 2008 7. V. 2(2). P. 141–150. https://doi.org/10.1016/j.stem.2007.11.014
Rodrigues S.F., Granger D.N. Blood cells and endothelial barrier function // Tissue. Barriers. 2015. V. 3(1-2). P. e978720. https://doi.org/10.4161/21688370.2014.978720
Romanov Y.A., Vtorushina V.V., Dugina T.N. et al. Human Umbilical Cord Tissue-Derived Multipotent Mesenchymal Stromal Cells Exhibit Maximum Secretory Activity in the Presence of Umbilical Cord Blood Serum // Bull. Exp. Biol. Med. 2020. V. 169(4). P. 544–548. https://doi.org/10.1007/s10517-020-04926-2
Roobrouck V.D., Clavel C, Jacobs S.A. et al. Differentiation potential of human postnatal mesenchymal stem cells, mesoangioblasts, and multipotent adult progenitor cells reflected in their transcriptome and partially influenced by the culture conditions // Stem. Cells. 2011. V. 29(5). P. 871–82. https://doi.org/10.1002/stem.633
Rosová I., Dao M., Capoccia B. et al. Hypoxic preconditioning results in increased motility and improved therapeutic potential of human mesenchymal stem cells // Stem. Cells. 2008. V. 26(8). P. 2173–82. https://doi.org/10.1634/stemcells
Rüster B., Göttig S., Ludwig R.J. et al. Mesenchymal stem cells display coordinated rolling and adhesion behavior on endothelial cells // Blood. 2006. V. 108(12). P. 3938–44. https://doi.org/10.1182/blood-2006-05-025098
Ryu J.S., Jeong E.J., Kim J.Y. et al. Application of Mesenchymal Stem Cells in Inflammatory and Fibrotic Diseases // Int. J. Mol. Sci. 2020. V. 21(21). P. 8366. https://doi.org/10.3390/ijms21218366
Schieber M., Chandel N.S. ROS Function in Redox Signaling and Oxidative Stress // Current Biology. 2014. V. 24. P. R453–R462. https://doi.org/10.1016/j.cub.2014.03.034
Segers V.F., Van Riet I., Andries L.J. et al. Mesenchymal stem cell adhesion to cardiac microvascular endothelium: activators and mechanisms // Am. J. Physiol. Heart. Circ. Physiol. 2006. V. 290. P. H1370–H1377. https://doi.org/10.1152/ajpheart.00523.2005
Semon J.A., Nagy L.H., Llamas C.B. et al. Integrin expression and integrin-mediated adhesion in vitro of human multipotent stromal cells (MSCs) to endothelial cells from various blood vessels // Cell. Tissue. Res. 2010. V. 341(1). P. 147–58. https://doi.org/10.1007/s00441-010-0994-4
Sierra-Parraga J.M., Merino A., Eijken M. et al. Reparative effect of mesenchymal stromal cells on endothelial cells after hypoxic and inflammatory injury // Stem. Cell. Res. Ther. 2020. V. 11(1). P. 352. https://doi.org/10.1186/s13287-020-01869-3
Steiner D., Mutschall H., Winkler S. et al. The Adipose-Derived Stem Cell and Endothelial Cell Coculture System-Role of Growth Factors? // Cells. 2021. V. 10(8). P. 2074. https://doi.org/10.3390/cells10082074
Sukriti S., Tauseef M., Yazbeck P. et al. Mechanisms regulating endothelial permeability // Pulm. Circ. 2014. V. 4(4). P. 535–51. https://doi.org/10.1086/677356
Sun Y., Hu G., Zhang X. et al. Phosphorylation of caveolin-1 regulates oxidant-induced pulmonary vascular permeability via paracellular and transcellular pathways // Circ. Res. 2009. V. 105(7). P. 676–685. https://doi.org/10.1161/CIRCRESAHA.109.201673
Takahashi M., Suzuki E., Oba S. et al. Adipose tissue-derived stem cells inhibit neointimal formation in a paracrine fashion in rat femoral artery // Am. J. Physiol. Heart. Circ. Physiol. 2010. V. 298(2). P. H415–423. https://doi.org/10.1152/ajpheart.00391.2009
Tang N., Wang L., Esko J. et al. Loss of HIF-1alpha in endothelial cells disrupts a hypoxia-driven VEGF autocrine loop necessary for tumorigenesis // Cancer Cell. 2004. V. 6(5). P. 485–495. https://doi.org/10.1016/j.ccr.2004.09.026
Teo G.S., Ankrum J.A., Martinelli R. et al. Mesenchymal stem cells transmigrate between and directly through tumor necrosis factor-α-activated endothelial cells via both leukocyte-like and novel mechanisms // Stem. Cells. 2012. V. 30(11). P. 2472–2486. https://doi.org/10.1002/stem.1198
Tkachuk V.A., Plekhanova O.S., Parfyonova Y.V. Regulation of arterial remodeling and angiogenesis by urokinase-type plasminogen activator // Can. J. Physiol. Pharmacol. 2009. V. 87(4). P. 231–251. https://doi.org/10.1139/Y08-113
Traktuev D.O., Merfeld-Clauss S., Li J. et al. A population of multipotent CD34-positive adipose stromal cells share pericyte and mesenchymal surface markers, reside in a periendothelial location, and stabilize endothelial networks // Circ. Res. 2008. V. 102. P. 77–85. https://doi.org/10.1161/CIRCRESAHA.107.159475
Tseng Y.T., Chen M., John J.S. et al. Targeting Matrix Metalloproteinases: A Potential Strategy for Improving Cell Transplantation for Nervous System Repair // Cell. Transplant. 2021. V. 30. P. 9636897211012909. https://doi.org/10.1177/09636897211012909
Ullah I., Seo K., Wi H. et al. Induction of the differentiation of porcine bone marrow mesenchymal stem cells into premature hepatocyte-like cells in an indirect coculture system with primary hepatocytes // Anim. Cells. Syst. (Seoul). 2020. V. 24(5). P. 289–298. https://doi.org/10.1080/19768354.2020.1823473
Verseijden F., Sluijs S.J.P.-V., Pavljasevic P. et al. Adult Human Bone Marrow– and Adipose Tissue–Derived Stromal Cells Support the Formation of Prevascular-like Structures from Endothelial Cells In Vitro // Tissue. Eng. Part A. 2010. V. 16. P. 101–114. https://doi.org/10.1089/ten.tea.2009.0106
Virdis A., Colucci R., Bernardini N. et al. Microvascular Endothelial Dysfunction in Human Obesity: Role of TNF-α // J. Clin. Endocrinol. Metab. 2019. V. 104(2). P. 341–348. https://doi.org/10.1210/jc.2018-00512
Wang H., Zheng R., Chen Q. et al. Mesenchymal stem cells microvesicles stabilize endothelial barrier function partly mediated by hepatocyte growth factor (HGF) // Stem. Cell. Res. Ther. 2017. V. 8(1). P. 211. https://doi.org/10.1186/s13287-017-0662-7
Wei X., Yang X., Han Z.P. et al. Mesenchymal stem cells: a new trend for cell therapy // Acta. Pharmacol. Sin. 2013. V. 34(6). P. 747–54. https://doi.org/10.1038/aps.2013.50
Xue Y., Xing Z., Bolstad A.I. et al. Co-culture of human bone marrow stromal cells with endothelial cells alters gene expression profiles // Int. J. Artif. Organs. 2013. V. 36(9). P. 650–662. https://doi.org/10.5301/ijao.5000229
Yamamoto K., Tanimura K., Watanabe M. et al. Construction of Continuous Capillary Networks Stabilized by Pericyte-like Perivascular Cells // Tissue. Eng. Part. A. 2019. V. 25. P. 499–510. https://doi.org/10.1089/ten.TEA.2018.0186
Yang S., Pilgaard L., Chase L.G. et al. Defined xenogeneic-free and hypoxic environment provides superior conditions for long-term expansion of human adipose-derived stem cells // Tissue. Eng. Part. C. Methods. 2012. V. 18(8). P. 593–602. https://doi.org/10.1089/ten.TEC.2011.0592
Ylä-Herttuala S., Rissanen T.T., Vajanto I. et al. Vascular Endothelial Growth Factors: Biology and Current Status of Clinical Applications in Cardiovascular Medicine // J. Am. Coll. Cardiol. 2007. V. 49. P. 1015–1026. https://doi.org/10.1016/j.jacc.2006.09.053
Zachar L., Bačenková D., Rosocha J. Activation, homing, and role of the mesenchymal stem cells in the inflammatory environment // J. Inflamm. Res. 2016. V. 9. P. 231–240. https://doi.org/10.2147/JIR.S121994
Zhang H.C., Liu X.B., Huang S. et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo // Stem. Cells. Dev. 2012. V. 21(18). P. 3289–97. https://doi.org/10.1089/scd.2012.0095
Zhang J.Y., Li L.C. Genetic expression and functional characterization of the RUNX2 gene in human adult bone marrow mesenchymal stem cells // Genet. Mol. Res. 2015. 28. V. 14(4). P. 18210–18217. https://doi.org/10.4238/2015.December.23.8
Zhidkova O., Andreeva E., Ezdakova M. et al. Crosstalk of Endothelial and Mesenchymal Stromal Cells under Tissue-Related O2 // Int. J. Trans. Med. 2021. V. 1(2). P. 116–136. https://doi.org/10.3390/ijtm1020009
Zhidkova O.V., Andreeva E.R., Buravkova L.B. Endothelial Cells Modulate Differentiation Potential and Mobility of Mesenchymal Stromal Cells // Bull. Exp. Biol. Med. 2018. V. 165(1). P. 127–131. https://doi.org/10.1007/s10517-018-4113-y
Zhou X., Liu J., Yang S. et al. Ketamine ameliorates hypoxia-induced endothelial injury in human umbilical vein endothelial cells // Clinics (Sao Paulo). 2020. V. 75. P. e1865. https://doi.org/10.6061/clinics/2020/e1865
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук