Успехи физиологических наук, 2023, T. 54, № 4, стр. 18-35
Нарушения когнитивных функций при длительной социальной изоляции: результаты исследований на людях и экспериментов на животных
Н. А. Крупина a, *, С. Д. Ширенова a, **
a Федеральное государственное бюджетное научное учреждение “Научно-исследовательский институт
общей патологии и патофизиологии”
125315 Москва, Россия
* E-mail: krupina-na@yandex.ru
** E-mail: shirenova.jr@gmail.com
Поступила в редакцию 25.05.2023
После доработки 30.05.2023
Принята к публикации 03.06.2023
- EDN: YHDQSA
- DOI: 10.31857/S0301179823040045
Аннотация
Наличие близких социальных связей – необходимое условие для психического и физического здоровья и благополучия в любом возрасте. Существенный процент населения Земли пережил условия “локдауна” в связи с пандемией COVID-19. Появляется все больше данных научной литературы, посвященных негативному воздействию социальной изоляции на внимание, память, восприятие, исполнительные функции и другие аспекты когнитивных процессов. Это может усложнять повседневную жизнь людей, снижая качество жизни. В обзоре предпринята попытка систематизации накопленных научных фактов о взаимосвязи социальной изоляции и развития нарушений когнитивных функций у человека, собранных в лонгитюдных популяционных исследованиях, а также проведен анализ данных о влиянии социальной изоляции разной длительности на процессы обучения и памяти, полученных в экспериментальных исследованиях на животных. Затронуты вопросы возможной связи этих нарушений, индуцированных социальной изоляцией, с изменением функционирования одной из систем стресс-реактивности – гипоталамо-гипофизарно-адреналовой оси и иммуновоспалительным ответом.
ВВЕДЕНИЕ
Социальную изоляцию определяют как явление, при котором вследствие разных причин происходит отторжение индивида или социальной группы от других индивидов или социальных групп в результате резкого сокращения (социальная депривация) или полного прекращения (собственно, изоляция) социальных контактов [66]. У людей выделяют особое состояние одиночества, которое определяют как осознаваемое ощущение недостаточности социальных связей по сравнению с желаемым (цит. по обзору [74]). Оба явления – социальная изоляция и одиночество – широко распространены среди населения во всем мире. В последнее время отмечено парадоксальное несоответствие между увеличением возможностей расширения социальных связей и ростом социальной изоляции внутри сообщества [78]. Это связано с социальными и демографическими изменениями – ростом продолжительности жизни и старением населения, нарушением института брака, заменой живого межличностного взаимодействия цифровыми коммуникациями, которые предоставляет Интернет и др. [132]. Все это объективно приводит к значительному увеличению числа и длительности периодов снижения социальных взаимосвязей не только на месяцы, но и на годы. Более 50% людей старше 60 лет находятся в группе риска пребывания в социальной изоляции [50, 62, 124]. К факторам риска нужно добавить и освоение человечеством новых жизненных пространств, когда исследователи долгое время находятся в экспедициях в условиях социальной депривации (космические и арктические исследования), и продолжительное пребывание в условиях социальной изоляции/депривации при пандемиях, в экстремальных ситуациях (например, пенитенциарный стресс) и др.
Для социальных видов млекопитающих, включая человека, коммуникации с представителями своего сообщества – это сформировавшееся в эволюции важное условие выживания [78, 118]. Социальные невзгоды являются предикторами ухудшения состояния здоровья. При низкой социальной интеграции можно ожидать примерно 50%-го увеличения риска смертности от разных заболеваний (инсульт, астма, болезни сердца и сосудов и др.), этот эффект сопоставим или даже превышает риск смертности, ассоциированный с ожирением, алкоголизмом, курением или малоподвижным образом жизни [47].
Исследования показывают, что социальная изоляция и одиночество часто не коррелируют [33, 96]. Люди могут находиться в ситуации социальной изоляции, но не испытывать чувства одиночества, или чувствовать себя одинокими вне зависимости от возраста, несмотря на адекватное количество социальных связей. Однако ухудшение психического и физического здоровья выявлено как у людей, находящихся в условиях социальной изоляции (оцененной объективными методами), так и у людей, испытывающих ощущение одиночества [74, 75].
Социальная изоляция/депривация – это источник хронического стресса как у людей, так и в эксперименте у социальных животных [132]. Хроническое или повторяющееся действие стресса увеличивает риск возникновения нарушений ЦНС, ведущих к развитию психоневрологических расстройств и дистресса у людей [55, 75, 105], а также эмоционально-мотивационных расстройств у животных в эксперименте [83, 128]. Однако ответ на хронический стресс предполагает развитие адаптивной реакции. Социальная изоляция относится к психологическому типу стресса [1]. В теории Лазаруса [64, 106] выработка копинг-стратегии (стратегии совладания) определяется процессом управления стрессом, напрямую связанным с переживаемым видом эмоции и с условиями, которые ее вызывают, – стресс может рассматриваться субъектом как угроза или как вызов. А когнитивные оценки влияют на характер и силу эмоциональных реакций и таким образом определяют выбор копинг-стратегии.
В период пандемии COVID-19 собран уникальный научный материал по влиянию социальной изоляции на состояние разных физиологических систем организма, в первую очередь сердечно-сосудистой системы [35, 65]. Однако, как следует из названия настоящего обзора, мы будем обращаться к находкам, связанным с нарушениями когнитивной деятельности. Ограничения социальных взаимосвязей на фоне COVID-19 привели к значительному увеличению бремени проблем с психическим здоровьем среди населения – росту уровня тревожности и депрессивности у переболевших (цит. по [15, 48]). Нарушения в психоэмоциональной сфере при стрессе социальной изоляции неотъемлемо связаны с изменениями функционирования гипоталамо-гипофизарно-адреналовой оси (ГГА-оси) [91] и симпатоадреналовой системы (САС) [122]: как правило, отмечается активация ГГА-оси и САС, что завершается высвобождением соответственно глюкокортикоидов (ГК) и катехоламинов, с последующим высвобождением цитокинов и включением механизмов обратной связи, однако, в целом данные противоречивы [2, 83, 87].
Завоевывают признание представления о том, что в основе аффективной симптоматики при остром и длительном течении COVID-19 могут лежать изменения в иммуновоспалительных путях [14, 68]. Такие изменения связывают с социальной изоляцией, поскольку известно, что психосоциальный стресс может вызывать воспалительный ответ при одновременном подавлении противовирусного иммунитета, в результате чего развивается нейровоспалительная сенсибилизация [67]. В пользу таких представлений свидетельствуют данные о том, что у людей среднего и старшего возраста с высоким уровнем одиночества с помощью полногеномного анализа с использованием микрочипов выявлена “up”-регуляция транскриптов генов, кодирующих провоспалительные цитокины и другие медиаторы воспаления, и “down”-регуляция генов, кодирующих противовоспалительные медиаторы – снижение транскрипционной активности глюкокортикоидных рецепторов (ГР) в пуле циркулирующих лейкоцитов [28, 29]. Хроническое воспаление привлекают к объяснению повышенного риска развития физических и психосоматических заболеваний у людей, которые в течение продолжительного времени испытывают высокий уровень субъективной социальной изоляции [54]. Преобразование социально-экологических неблагоприятных факторов в провоспалительный ответ осуществляется путем регуляции со стороны систем стресс-реактивности – ГГА-оси и САС (рис. 1) [102, 116].
Рис. 1.
Трансдукция социальных сигналов (по [102, 116]). Трансдукция (или преобразование) субъективного восприятия социальных стимулов в сигналы физиологических систем. Стрессогенные социальные стимулы активируют структуры мозга, которые обрабатывают социальные переживания. Эти структуры передают сигнал в другие отделы мозга, которые модулируют ответ на стресс по трем основным путям: гипоталамо-гипофизарно-адреналовая (ГГА) ось (1), симпатоадреналовая система (САС) (2), эфферентные волокна блуждающего нерва (3). Активация этих путей приводит к выработке глюкокортикоидов, норадреналина и ацетилхолина, которые взаимодействуют с рецепторами клеток, продуцирующих цитокины (макрофаги, Т-клетки, натуральные киллеры). Цитокины могут оказывать влияние на ЦНС, попадая в мозг через проницаемые участки гемато-энцефалического барьера, а также стимулируя афферентные нервные волокна в составе блуждающего нерва (4), передающие информацию в системы мозга, регулирующие настроение, двигательную активность, мотивацию, чувствительность к социальной угрозе и возбуждение. В мозге цитокины могут снижать нейротрофическую сигнализацию и изменять нейромедиаторную передачу в системе моноаминов, что приводит к расстройствам поведения, эмоциональной регуляции и когнитивных функций. Кроме того, цитокины стимулируют секрецию кортикотропин-рилизинг гормона (КРГ) в паравентрикулярном ядре гипоталамуса, что может приводить к дальнейшей продукции адренокортикотропного гормона (АКТГ) и высвобождению глюкокортикоидов. Длительная активация путей 1–3 может со временем стать самоподдерживающейся из-за развития нейровоспалительной сенсибилизации и сохраняться долгое время после того, как реальная угроза миновала.
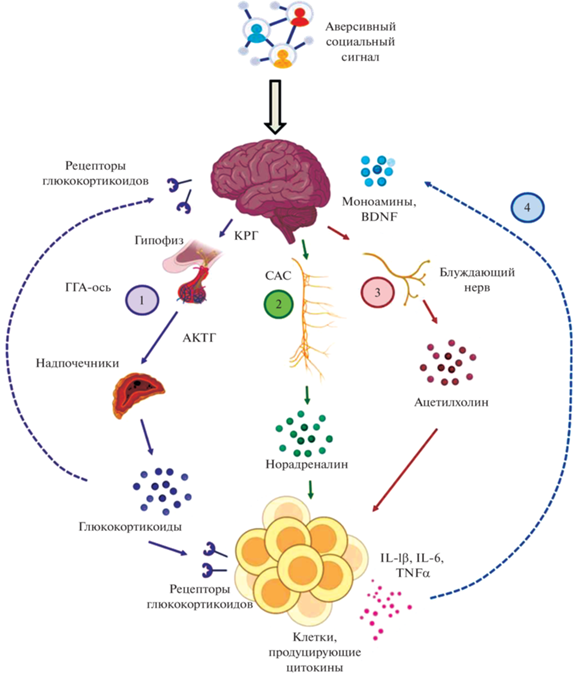
Сформировались представления о том, что активация иммуновоспалительных реакций в ситуациях социального дефицита может отражать включение эволюционно консервативных механизмов, лежащих в основе адаптивного краткосрочного режима самосохранения, вызванного отсутствием социальной защиты на фоне уязвимости особи к действию внешних угроз здоровью и жизни [78, 116]. В этом случае социальная изоляция (у людей также одиночество) действует как аверсивный раздражитель, призванный способствовать адаптации к этой уязвимости и мотивировать воссоединение с конспецификами путем включения эффекторных механизмов (включая нейрофизиологические), что напоминает работу гомеостатической системы, предназначенной для поддержания социальных связей на должном уровне. Mattew и Tye [78] предлагают распространить “надорганизменную” концепцию “социального гомеостаза”, предполагающую сохранение стабильной организации внутри большой группы, на индивидуальный уровень, чтобы расширить понимание того, как выявляются и оцениваются недостатки в социальных связях и как активируются эффекторные системы для компенсации патогенных воздействий. Однако при хронической социальной изоляции непрерывная активация систем, предназначенных для организации быстрого адаптивного ответа, может приводить к развитию функциональных расстройств и даже болезненных состояний.
Несмотря на то, что собрано достаточно много клинических и экспериментальных данных о соматических, психосоматических, аффективных и эмоциональных нарушениях при социальной изоляции, данные о когнитивных расстройствах разрозненны и относительно малочисленны. Недавно обнаружена ассоциативная связь тяжести нейропсихиатрических симптомов, включающих ухудшение памяти, c ростом депрессивности и, в меньшей степени, тревожности при COVID-19 [69], что представляет интерес для отдельного анализа в будущем. Однако в настоящем обзоре, наряду с описанием феномена нарушений когнитивных функций у млекопитающих при социальной изоляции, мы коснемся вопросов о том, можно ли связать эти нарушения с изменением функционирования одной из систем стресс-реактивности – состоянием ГГА-оси – и иммуновоспалительным ответом.
ВЛИЯНИЕ СОЦИАЛЬНОЙ ИЗОЛЯЦИИ РАЗНОЙ ДЛИТЕЛЬНОСТИ НА КОГНИТИВНЫЕ ФУНКЦИИ
Исследования на людях
По объективным причинам пожилым людям старше 60 лет чаще приходится проживать в социальной изоляции, они получают меньше социальной поддержки, и это сопровождается развитием когнитивных нарушений. В исследовании Jang et al. [52] показано, что у пожилых граждан США корейского происхождения именно социальная изоляция приводила к снижению когнитивных функций при их оценке объективными методами, в то время как субъективное ощущение утраты когнитивных способностей (по отчетам испытуемых) было связано с чувством одиночества, но не с ситуаций социальной изоляции. Сходные результаты были получены в лонгитюдном исследовании жителей Китая [134]: социальная изоляция, но не одиночество являлась предиктором снижения объективно оцененной эпизодической памяти. В исследовании на австралийцах в возрасте 70–94 лет только у женщин выявлена взаимосвязь снижения когнитивных функций с социальной изоляцией и отсутствием социальной поддержки [53]. Для понимания данного факта надо учитывать, что независимо от условий проживания, риск развития когнитивных расстройств у пожилых мужчин ниже, чем у женщин, что связывают, в первую очередь, со снижением уровня эстрогенов у женщин в постменопаузе [63].
Условия проживания сами по себе вне зависимости от возраста могут приводить к нарушениям когнитивной деятельности. Так, у участников антарктической экспедиции (мужчин), находившихся в условиях групповой социальной изоляции в течение 8 мес., было обнаружено резкое снижение когнитивных функций в тесте на запоминание, требующем, в том числе, включения функций исполнительного контроля [56].
Результаты оценок когнитивной деятельности (внимание, память, принятие решения и др.) в возрастной группе 18–72 лет в период COVID-19 показали, что социальная изоляция связана со снижением когнитивных функций вне зависимости от фактора старения [51]. В течение 13 нед. участники выполняли онлайн-задачи, оценивающие внимание, память, принятие решений, оценку времени и обучение. Производительность определялась уровнем социальной изоляции людей и обычно улучшалась по мере увеличения возможностей для социальных контактов. В исследовании Labos et al. [61] по результатам онлайн-опроса обнаружено, что под влиянием социальной изоляции в условиях COVID-19 у жителей Аргентины в возрасте 52.7 ± 2.8 лет ухудшались внимание, память, восприятие внешних раздражителей, у них нарушались исполнительные функции и снижались показатели высшей нервной деятельности, определяющие эффективность когнитивных процессов. В Японии по результатам ответов на вопросы анкеты, рассылаемой по электронной почте, у людей в возрасте более 70 лет с исходно сохранными когнитивными функциями после 7 мес. социальных ограничений в связи с COVID-19 исследователи наблюдали снижение когнитивных оценок до уровня легких нарушений и выше, то есть развивалось когнитивное снижение [86].
Наиболее тяжелые последствия стресс социальной депривации имеет в раннем возрасте, поскольку нарушает процесс развития нервной системы у детей в условиях возрастной недостаточности адаптационных возможностей [20, 84]. Интегративная оценка эффектов стресса раннего периода жизни, к которому относится стресс социальной депривации [117], показала, что неблагоприятные условия в раннем возрасте ассоциированы с дефицитом ряда когнитивных (память и исполнительные функции) и аффективных (обработка вознаграждения, обработка социальных и аффективных стимулов и регуляция эмоций) функций [81, 95]. Согласно мета-анализу, в который было включено 75 исследований интеллектуального развития 3888 детей из 19 стран [123], дети, проживавшие в детских домах в условиях депривации стимулирующих сигналов окружающей среды (то есть в условиях сенсорной депривации), имели значительно более низкие баллы IQ, чем дети, жившие в приемных семьях. По результатам лонгитюдного исследования с применением автоматизированной нейропсихологической батареи тестов дети, которые проживали в детских домах Румынии, в возрасте 12 лет демонстрировали значительный дефицит в зрительном распознавании и пространственной рабочей памяти, что сопровождалось нарушениями переключения внимания и усвоения ими правил [20]. В исследовании Bos et al. [22] приемные дети школьного возраста, прожившие в детских домах от 9 до 33 мес. (в среднем 23.6 мес.), хуже справлялись с задачами на ассоциативное научение и рабочую пространственную память и демонстрировали ухудшение исполнительных функций по сравнению со школьниками, выросшими в родных семьях. В совокупности, накопленные данные свидетельствуют о том, что ранний опыт формирует процессы развития памяти, обучения и исполнительных функций, а психосоциальная депривация в раннем возрасте приводит к заметным нарушениям когнитивной деятельности. Эти наблюдения нашли подтверждение в период пандемии COVID-19: нарушения внимания и памяти были более выражены в младших возрастных группах [61].
Социальная поддержка, как можно ожидать, должна снижать риск развития когнитивных нарушений. Действительно, на большой когорте пожилых и старых жителей Португалии обоего пола показано, что поддержка друзей снижает риск развития когнитивных нарушений [93], однако, в этом же исследовании обнаружена интересная зависимость: группа, состоявшая из разведенных, разлученных, овдовевших и одиноких участников, имела более низкий коэффициент риска когнитивных расстройств, чем группа из участников, состоявших в браке. Авторы связали этот, на первый взгляд, неожиданный факт с тем, что участники исследования, переживавшие состояние социального дефицита, лучше воспринимали социальную поддержку. Не менее интересное наблюдение, сделанное в период пандемии COVID-19, приведено в исследовании Welzel et al. [130]: отмечена тенденция к более высоким значениям общей удовлетворенности жизнью и меньшей ситуативной стрессогенности среди лиц в возрасте от 65 до 74 лет по сравнению с более молодыми возрастными группами, что, как считают исследователи, может объясняться наличием опыта когнитивной оценки ситуации, связанной с психологическим стрессом, и использованием вариантов совладания с ней.
Несмотря на большой объем собранных данных, в настоящее время остается много вопросов о самом феномене и механизмах влияния социальной изоляции на когнитивные функции у людей. Однако в исследованиях на людях практически нет возможности анализировать влияние сроков начала социальной изоляции, трудно накапливать данные о связи последствий перенесенной социальной изоляции с ее длительностью и выраженностью когнитивных нарушений у лиц разного пола, а из-за различий в методических подходах нет возможности сопоставить оценки нарушений когнитивной деятельности, выявленные в разных работах. В контексте темы обзора практически отсутствуют данные о состоянии ГГА-оси и предполагаемой взаимосвязи с иммуновоспалительным ответом. В решении этих вопросов определенную помощь могут оказать экспериментальные модели социальной изоляции, которые отвечают этиологическому критерию валидности и широко применяются в трансляционных исследованиях.
Исследования на животных
Хронический стресс социальной изоляции, начатый в раннем периоде постнатального развития, сочетает в себе два фактора, имеющих самостоятельное значение: изоляционный стресс и стресс раннего возраста, приводящий к эпигенетическим изменениям [26, 41]. В многочисленных экспериментальных исследованиях обнаружено, что хронический стресс социальной изоляции у социальных животных, так же, как и у людей, наряду с эмоционально-мотивационными нарушениями (тревожность, страх, депрессивность), провоцирует развитие когнитивного дефицита [39, 71, 83, 128]. В отличие от исследований на людях, в экспериментах на грызунах как социальных животных есть возможность сопоставить сроки начала социальной изоляции и ее длительность с последующими нарушениями когнитивных функций. Известно, что в раннем периоде жизни грызуны наиболее чувствительны к стрессу, что приводит к нарушениям нейроразвития [71, 128], а подростковый возраст является критическим периодом социального стресса для последующей индукции нарушений в поведении [39, 104]. Считается, что специфический подростковый опыт приводит к постоянным нервным и гормональным изменениям, необходимым для развития когнитивных процессов, которые позволяют эффективно справляться с трудностями во взрослой жизни [119]. Исходя из сказанного, в табл. 1 мы представили результаты ряда исследований когнитивных функций у крыс разных линий как представителей социальных животных [112], подвергнутых социальной изоляции разной длительности в разные сроки подросткового периода, который у грызунов длится с 28 по 56 постнатальные дни [71].
Таблица 1.
Результаты оценки когнитивных функций у грызунов, подвергнутых стрессу социальной изоляции (СИ) в подростковом периоде
| Объект, пол |
Возраст начала СИ | Длительность СИ | Тест | Эффект | Ссылка |
|---|---|---|---|---|---|
| Крысы Lister hooded, самцы |
ПНД 22–24 | 4 недели | Локомоторная активность (в течение 1 ч) (ПНД 50–52) |
Дефицит привыкания | [80] |
| Распознавание нового объекта(не социального)(ПНД 58–60) | Ухудшение распознавания | ||||
| Условный рефлекс страха (замирание) (ПНД 71–73) | Снижение контекстуальной обусловленности страха | ||||
| Крысы Sprague- Dawley, самцы |
ПНД 21 | 4 недели | Распознавание нового объекта (не социального) (ПНД 90–93) |
Ухудшение распознавания | [23] |
| Радиальный 8-лучевой лабиринт (ПНД 120–130) | Рабочая пространственная память и переобучение не нарушены | ||||
| Крысы Lister hooded, самцы |
ПНД 25–28 | 30 дней | Распознавание нового объекта (не социального) | Ухудшение распознавания | [19] |
| Крысы Sprague- Dawley, самцы |
ПНД 25–30 | 30 дней | Водный лабиринт Морриса | Улучшение обучения и долговременной пространственной памяти | [98] |
| Крысы Sprague- Dawley, самцы |
ПНД 28 | 34 дня | Локомоторная активность (в течение 10 мин) |
Снижение скорости привыкания | [24] |
| Крысы Wistar–Imamichi, самцы |
ПНД 21 | 39 дней | Распознавание нового объекта: – не социального – социального |
Улучшение распознавания – выбор из 5 объектов – выбор из 3 объектов |
[121] |
| Крысы Lister hooded, самцы |
ПНД 21 | 6 недель | Водный лабиринт Морриса | Улучшение обучения, долговременной памяти и переучивания | [129] |
| Крысы Lister hooded, самки |
ПНД 21–23 | Минимум 6 недель | Распознавание нового объекта(не социального) Переключение внимания |
Ухудшение распознавания Способность к переключению внимания при смене модальности стимула нарушена |
[82] |
| Крысы Wistar, самцы | ПНД 22–24 | 46–48 дней | Условный рефлекс пассивного избегания (ПНД 110–120) Условный рефлекс активного избегания (ПНД 110–120) |
Ухудшение пассивного избегания Ухудшение активного избегания |
[5] |
| Крысы Wistar, самцы | ПНД 22 | 8 недель | Условный рефлекс пассивного избегания | Ухудшение пассивного избегания | [133] |
| Распознавание нового объекта (не социального) | Распознавание нового объекта не нарушено | ||||
| Крысы Sprague-Dawley, самцы |
ПНД 22 | 4 недели 8 недель |
Водный лабиринт Морриса | Ухудшение обучения Ухудшение обучения |
[70] |
| Крысы Lister hooded, Самцы |
ПНД 21 | 8.5 недель | Переключение внимания (начиная с ПНД 80) |
Способность к переключению внимания при смене модальности стимула нарушена | [111] |
| Крысы Lister hooded, самцы и самки |
ПНД 23 | 8–9 недель | Локомоторная активность (в течение 1 ч) |
Снижение скорости привыкания у крыс обоего пола | [100] |
| Крысы Wistar, самцы | ПНД 24 | 9 недель | Сенсомоторная реактивность (акустический стартл-рефлекс) | Дефицит кратковременного привыкания | [3] |
| Крысы Sprague-Dawley, самцы |
ПНД 21 | 9–10 недель | Условный рефлекс пассивного избегания | Ухудшение пассивного избегания | [34] |
| Крысы Wistar, самцы | ПНД 26 | 12 недель | Локомоторная активность (в течение 10 мин) |
Снижение скорости привыкания | [8] |
| Сенсомоторная реактивность (акустический стартл-рефлекс) | Дефицит кратковременного привыкания | ||||
| Водный лабиринт Морриса | Ухудшение обучения, нет нарушений долговременной памяти |
||||
| Крысы Lister hooded, самцы |
ПНД21 | 12 недель | Водный лабиринт Морриса | Обучение и долговременная память не нарушены |
[110] |
| Крысы Long-Evans, самцы |
ПНД21 | 12 недель | Водный лабиринт Морриса | Ухудшение обучения, нет нарушений долговременной памяти | [46] |
| Крысы Sprague–Dawley, самцы и самки | ПНД 21 | 13 недель | Условный рефлекс страха (замирание) |
Снижение контекстуальной обусловленности страха у крыс обоего пола | [129] |
| Крысы Wistar, самки | ПНД 35–36 | 16 недель | Условный рефлекс пассивного избегания | Ухудшение пассивного избегания | [9] |
| Крысы Sprague-Dawley, самцы и самки | ПНД 22 | 53 дня | Выработка условного рефлекса активного избегания | Ухудшение обучения у крыс обоего пола | [126] |
| 17 недель | Проверка сохранности рефлекса | Воспроизведение рефлекса нарушено у самцов |
Примечание. Локомоторная активность и сенсомоторная реактивность – оценка привыкания (неассоциативного обучения); условный рефлекс пассивного и активного избегания, условный рефлекс страха – оценка аверсивного ассоциативного обучения (включая оценку референтной и контекстно-зависимой памяти); водный лабиринт Морриса и 8-лучевой радиальный лабиринт – оценка пространственной памяти (рабочей и долговременной памяти); распознавание нового объекта – оценка эпизодической памяти; переключение внимания – оценка поведенческой гибкости.
По приведенным в таблице оценкам видно, что когнитивный дефицит в виде нарушения неассоциативного и ассоциативного обучения у крыс можно обнаружить уже после 4–6 нед. социальной изоляции [3, 5, 19, 24, 34, 80], начатой в предподростковом и раннем подростковом возрасте. Дефицит сохраняется при пролонгировании изоляции на срок более трех месяцев.
Однако изменения в пространственном обучении (рабочей памяти) и долговременной памяти, выявленные в лабиринте Морриса, не так однозначны (см. табл. 1). Парадоксальное улучшение обучения показано у самцов Sprague-Dawley и Lister hooded, после месяца–полутора социальной изоляции [98, 131], но после 4 и 8 нед. изоляции, то есть после социальной изоляции примерно той же длительности, у самцов Sprague-Dawley обнаружено и ухудшение обучения [71]. После 12 недель изоляции на приведенных примерах хорошо видны различия в оценках в зависимости от линии крыс: нарушений может не быть [110] либо ухудшение обучения сочетается с отсутствием нарушений долговременной памяти [8, 46]. Неожиданным является улучшение пространственного обучения и памяти у крыс на относительно раннем сроке социальной изоляции. Авторы этих находок связывают феномен с возрастными особенностями функционирования холинергической системы крыс [131], что имеет научное обоснование [37], либо с выявленным во время обучения усилением экспрессии BDNF, опосредующем развитие пластических изменений в гиппокампе, или повышенным уровнем кортикостерона в плазме [98]. В основе последнего предположения лежат данные о том, что глюкокортикоидные гормоны, высвобождаемые корой надпочечников в ответ на стресс-стимулы, усиливают консолидацию долговременных воспоминаний об эмоционально возбуждающих переживаниях [79]. Все упомянутые предположения справедливы, так как холинергические нейроны базальных отделов переднего мозга, глюкокортикоидные рецепторы гиппокампа и процессы, обеспечивающие синаптическую пластичность, вовлечены в регуляцию стресс-ответа, а нарушение такой регуляции может влиять на когнитивные функции [13, 94].
Влияние социальной изоляции на распознавание нового объекта – несоциального или социального – также не поддается однозначной интерпретации (см. табл. 1). После 4 нед. изоляции у крыс обнаружено ухудшение распознавания нового объекта [19, 80], после 5.5 нед., напротив, – улучшение [121], а после 8 нед. социальной изоляции изменений не было выявлено [133]. Отметим, что в этих работах, помимо различий в сроках социальной изоляции, были использованы крысы разных линий, что, по-видимому, является существенным фактором. Кроме того, воздействие ГК, усиливающих консолидацию, на память распознавания объектов зависит от эмоционального возбуждения особи [89], обусловленного не только привыканием к экспериментальному контексту, но и собственно эмоциональным статусом, который может различаться на разных сроках социальной изоляции. По приведенным в табл. 1 данным и после четырех [80], и после 13 нед. социальной изоляции [129] контекстуальная память у крыс была снижена независимо от пола. Такой воспроизводимый на разных сроках изоляции эффект может отражать стойкое нарушение регуляции ГГА-оси глюкокортикоидами у социально изолированных крыс.
Интересны данные об особенностях переключения внимания у социально изолированных крыс после 6–8 мес. социальной изоляции [82, 111]. Авторы приходят к выводу о том, что такое воздействие нарушает тормозной контроль при переключении внимания на релевантные стимулы новой модальности, но оставляет нетронутым тормозной контроль при аффективной обработке информации о смене релевантных стимулов в пределах одной и той же модальности.
В настоящее время экспериментальные исследования в нейробиологии проводят в большинстве случаев только на самцах [32], что хорошо иллюстрируют приведенные в табл. 1 работы. С учетом того, что функциональные и молекулярные аспекты функционирования ГГА-оси у самцов и самок крыс различаются [43], очевидна необходимость проведения исследований с параллельной оценкой влияния стресса социальной изоляции у самцов и самок. Недавно показано, что нейропластические изменения, возникающие у подопытных животных в обогащенной среде, также различны у представителей разного пола [59]. Дефицит данных об особенностях поведенческих, нейрохимических и молекулярных изменений у грызунов женского пола при моделировании социальной изоляции ограничивает трансляционную валидность результатов.
Кроме того, в экспериментальных работах, посвященных изучению воздействия социальной изоляции, ее длительность редко превышает 8–12 нед. На таких сроках сложно проследить, развиваются ли в физиологических системах при данном типе хронического стресса адаптационные процессы, требующие достаточного времени, и, если да, то в чем они проявляются. Ответы на эти вопросы можно, по крайней мере частично, получить при моделировании пролонгированной социальной изоляции с изучением ее воздействия в динамике на разных сроках у животных по мере увеличения их возраста.
В наших исследованиях мы выбрали именно такой путь: моделирование хронического стресса социальной изоляции на крысах, параллельно у самцов и самок, начиная с их раннего возраста (наиболее чувствительный период) и до достижения ими возраста 10 мес., анализируя изменения в различных физиологических системах, обеспечивающих реализацию поведения и когнитивных функций. В данном обзоре, как сказано выше, мы рассмотрим особенности нарушений когнитивных функций у крыс, подвергнутых длительной социальной изоляции с раннего возраста: крысят отсаживали от матерей на 26-й ПНД, социальную изоляцию начинали у самок на 33-й, а у самцов на 37-й ПНД [60], что было обусловлено необходимостью предварительной оценки поведения.
В тесте на пространственную память в лабиринте Морриса (с наиболее противоречивыми результатами, см. табл. 1) пролонгированная до 4.5 мес. социальная изоляция вызывала у крыс нарушения в процессе обучения. Такие крысы, независимо от пола, в 1-й день обучения позже достигали платформы и приплатформенной зоны, а в 1-й и 4-й (последний) дни обучения проводили больше времени в краевой зоне лабиринта, возможно, за счет усиления тигмотаксиса как поведения, направленного на снижение стресса новой обстановки [42, 60]. Усиление тигмотаксиса мы также отмечали на другой выборке у самцов крыс Wistar после двух месяцев социальной изоляции [8]. В 1-й день обучения средняя скорость самок, подвергнутых социальной изоляции, была ниже, чем в других группах крыс. Однако на этапе обучения половые различия у крыс-изолянтов были не очевидны.
Основные различия были выявлены при проверке выработки пространственной памяти через сутки после последней обучающей сессии при удалении платформы из лабиринта: у самок, подвергнутых социальной изоляции, было обнаружено увеличение доли времени, проведенного в целевом квадранте, где ранее находилась платформа. Этот показатель иногда используют как основной для определения эффективности научения [127]. Однако его интерпретация не согласовывалась с результатами анализа других показателей: ни время нахождения зоны платформы, ни время достижения платформенной зоны у этих самок не отличалось от показателей у социально изолированных самцов и контрольных крыс, что не дало возможности однозначно интерпретировать выявленные отличия. Мы решили использовать новый прием отсроченной проверки сохранности пространственной памяти у крыс, спустя 4 мес. после обучения. Такая проверка при отсутствии платформы в лабиринте не выявила влияния социальной изоляции на воспроизведение памяти о местоположении платформы, однако нам удалось обнаружить, что крысы всех групп быстрее достигали приплатформенной зоны, чем при первой попытке обучения за 4 мес. до этого. Также социально изолированные крысы не проводили больше времени в краевой зоне лабиринта по сравнению с крысами контрольных групп. Этот достаточно неожиданный результат свидетельствует в пользу сохранения памяти у крыс в лабиринте Морриса – контекстно-зависимой и, возможно, пространственной – даже через столь продолжительное время после обучения. Эффект не зависел ни от пола животных, ни от условий содержания. Спустя сутки в двух попытках напоминания с вновь установленной платформой было обнаружено снижение средней скорости перемещения у социально изолированных крыс, причем у самок был увеличен латентный период достижения приплатформенной зоны по сравнению с самцами. При тестировании через сутки после напоминания крысы-изолянты позже достигали приплатформенной зоны, и вновь латентный период достижения этой зоны был наибольшим в группе самок, подвергнутых социальной изоляции. Данные в целом свидетельствуют в пользу предположения о большей уязвимости пространственной памяти самок к стрессу длительной социальной изоляции. Ранее в нашей работе [60] была подробно обсуждена возможная связь выявленных когнитивных нарушений у самок с изменениями эстрального цикла, однако мы не оценивали уровень эстрогенов в крови. Стоит отметить, что к выводу о том, что самки более уязвимы к данному виду стресса привело использование приема значительно отсроченной дополнительной проверки сохранения пространственного навыка с напоминанием. Вероятно, использование такого приема перспективно в дальнейших исследованиях когнитивных оценок в эксперименте.
Мы выявили дефицит формирования УРПИ у самцов и самок крыс после 8-месячного изолированного содержания [60] при проверке через сутки и через неделю после обучения без очевидных различий по полу по количественным показателям. Однако использование качественной оценки УРПИ по дополнительным поведенческим показателям, предложенной в работе [7], позволило обнаружить разницу между самцами и самками: качество УРПИ было ниже у социально изолированных самок по сравнению с самцами.
Как следует из приведенных в табл. 1 данных, дефицит пассивного избегания также был обнаружен в нашей работе в серии, выполненной на самках крыс Wistar, после их содержания в изоляции в течение 4.5 мес. [9]. В эксперименте на самках крыс Wistar было выявлено ухудшение ассоциативного обучения в тесте условного рефлекса активного избегания после 7.5 мес. социальной изоляции, но нарушений в сохранении памяти (по числу реакций избегания и избавления) через сутки и через 2 мес. после обучения обнаружено не было [4]. Возможным объяснением этого эффекта может быть нарушение у крыс рабочей памяти, но не процесса ее консолидации при социальной изоляции.
Обобщая данные, приведенные в табл. 1, и результаты, полученные в наших исследованиях, можно полагать, что пролонгирование социальный изоляции у крыс на срок более трех месяцев сопровождается прогрессированием ухудшения когнитивных функций по показателям разных видов памяти, а нарушения более выражены у самок крыс.
Ухудшение внимания, памяти и исполнительных функций препятствуют социальной адаптации [30]. Исходя из этого, а также из нашего предположения о большей по сравнению с самцами уязвимости самок крыс к действию стресса социальной изоляции, мы оценили социальность и предпочтение социальной новизны у самок крыс Wistar в динамике длительной социальной изоляции в трехкамерном социальном тесте. После двух месяцев социальной изоляции крысы демонстрировали повышение предпочтения социального объекта несоциальному, но одновременно были отмечены признаки снижения предпочтения нового социального объекта уже знакомому социальному объекту (признаки снижения предпочтения “социальной новизны”). А после 8.5 мес. изоляции у крыс были выявлены признаки дефицита социальности и выраженное снижение предпочтения “социальной новизны” [11]. Эти данные свидетельствовали о зависимости влияния социальной изоляции на социальное поведение и распознавание нового социального объекта (социальную память) от ее длительности. Известно, что социальное взаимодействие играет важную роль в преодолении раннего стресса социальной изоляции, а адаптивный социальный фенотип способствует выживанию социальных видов животных [104, 108]. Мы полагаем, что увеличение общительности самок крыс после двух месяцев изоляции является проявлением стратегии преодоления стресса на данном сроке. Однако снижение предпочтения “социальной новизны” при значительном пролонгировании социальной изоляции дает основание думать о развитии у крыс нарушений процессов обработки социальной информации и социальной памяти [113], поскольку предпочтение “социальной новизны” можно отнести к когнитивным функциям, характеризующим социальное узнавание (social recognition). В совокупности с данными Toyoshima et al. [121] об улучшении социального распознавания у крыс после 5.5 нед. социальной изоляции (отметим, что эти данные получены на самцах крыс другой линии) наши данные предполагают прогрессивное ухудшение социальной адаптации у крыс при увеличении срока социальной изоляции на фоне снижения ряда когнитивных функций. С позиции гипотезы о том, что под влиянием хронического стресса происходит смещение поведения от исследования к эксплуатации уже известных, знакомых ресурсов [77], значительное снижение предпочтения нового социального объекта с увеличением сроков социальной изоляции можно рассматривать как свидетельство снижения мотивации к исследованию нового и говорить о смене стратегий преодоления стресса.
По совокупности накопленных в эксперименте данных можно проследить схожие нарушения когнитивных функций у человека и животных при длительной социальной изоляции: речь, в первую очередь, идет о нарушениях разных видов обучения и памяти, внимания, исполнительных функций. Все это в целом позволяет говорить по крайней мере о частичной валидности модели пролонгированной социальной изоляции на основании ее соответствия признанным критериям “внешней схожести” и этиологического сходства с клиническим прообразом [18]. Возвращаясь к поставленному выше вопросу о возможной связи когнитивных нарушений, индуцированных социальной изоляцией, с изменениями функционирования одной из систем стресс-реактивности – ГГА-оси – и иммуновоспалительным ответом, рассмотрим данные о биомаркерах состояния ГГА-оси и воспаления в модельных экспериментах, то есть проанализируем соответствие модели критерию биомаркеров, включенному в состав более общего конструкционного критерия.
МАРКЕРЫ ФУНКЦИОНИРОВАНИЯ ГГА-ОСИ ПРИ МОДЕЛИРОВАНИИ СОЦИАЛЬНОЙ ИЗОЛЯЦИИ
Кортикостерон
Глюкокортикоиды как основные гормоны ГГА-оси регулируют множество физиологических процессов, включая ответ на стресс, иммунную функцию и познавательную деятельность [109]. Социальная изоляция вызывает изменения активности ГГА-оси [25, 114], однако данные по изменению гормона стресса в крови крыс противоречивы.
На крысах линии Sprague-Dawley выявлено снижение содержания кортикостерона в крови у самцов и самок крыс после 30 дней социальной изоляции (начало – ПНД 30) [99], а после 6-недельной социальной изоляции – повышение содержания кортикостерона в крови у самцов [40]. Weiss et al. [129] показали, что у самок и самцов Sprague-Dawley после 13-недельной социальной изоляции (начало социальной изоляции – ПНД 21) не был изменен базовый уровень кортикостерона в крови. На крысах линии Wistar не удалось выявить изменений содержания кортикостерона в крови самцов после 2 нед. социальной изоляции (начало – ПНД 21) [45], а после 6 нед. изоляции (начало – ПНД 21) [76] и 2 мес. изоляции (начало – ПНД 16) [107] у самцов обнаружено снижение базового уровня кортикостерона в крови. Serra et al. [114] выявили гиперсенситивность ГГА-оси у самцов крыс линии Sprague-Dawley под влиянием 30-дневной социальной изоляции: интрацеребровентрикулярное введение кортикотропин-рилизинг гормона приводило к более выраженному повышению уровня кортикостерона в крови социально изолированных крыс по сравнению с контрольными животными. Больше данных по изменению уровня кортикостерона в ответ на социальную изоляцию у разных видов приведено в обзоре [25].
В наших исследованиях не было выявлено изменения базового уровня кортикостерона в крови самцов и самок крыс Wistar после 9 мес. социальной изоляции (начало – ПНД 33 у самок, ПНД 37 у самцов) по сравнению с крысами того же пола, которых содержали в группах [60]. Очевидно, что содержание кортикостерона зависит, как минимум, от длительности социальной изоляции, линии крыс и пола животных. Свидетельствует ли отсутствие изменений в базовом уровне кортикостерона при пролонгировании социальной изоляции о развитии адаптационных изменений в состоянии ГГА-оси? По-видимому, анализ только уровня кортикостерона не достаточен для ответа на этот вопрос.
Орган-маркер стресса – надпочечники
В качестве еще одного общепринятого показателя стресс-реактивности принято оценивать вес органов-маркеров стресса, в первую очередь надпочечников. Однако и по этому показателю результаты противоречивы. У самцов Sprague-Dawley после 5 нед. социальной изоляции (начало – ПНД 24) [85] не выявлено изменение веса надпочечников, а после 6 нед. социальной изоляции обнаружено увеличение их веса [40]. У самцов Wistar после 6 нед. [76] и после 8 нед. социальной изоляции [107] вес надпочечников не был изменен. У самок крыс Wistar [44] после 13 нед. социальной изоляции (ПНД отъема от матери не указан) и у самок крыс Hooded после 14 нед. изоляции (начало – ПНД 23) [120] выявлено увеличение относительного веса надпочечников. Как и в случае с показателем уровня кортикостерона в крови, прослеживается зависимость изменений веса надпочечников от длительности социальной изоляции, линии крыс и их пола. В наших исследованиях срок социальной изоляции был существенно больше, однако результат оценок оказался схож в нескольких сериях: после 9 мес. социальной изоляции относительный вес надпочечников был увеличен у самок, но не у самцов крыс Wistar. По приведенным данным можно говорить об увеличении веса надпочечников у самок крыс разных линий на разных сроках социальной изоляции.
Глюкокортикоидные рецепторы
Ответ ГГА-оси на любой стресс, включая психосоциальный, может быть изменен за счет изменения экспрессии и/или аффинности ГР. Эффекты ГК опосредованы связыванием с ГР – ядерным рецептором, фосфопротеином, содержащим многочисленные потенциальные сайты фосфорилирования, который функционирует как лиганд-зависимый транскрипционный фактор [88, 125]. Социальная изоляция может нарушать функционирование ГР (см. обзор [25]). Сведения об экспрессии ГР в мозге при социальной изоляции разнятся. Например, после 8-недельной социальной изоляции взрослых самок крыс Sprague-Dawley было обнаружено снижение экспрессии ГР в отделах гиппокампа и вентромедиальном ядре гипоталамуса [103], а 13-недельная социальная изоляция крыс Sprague-Dawley обоего пола не сопровождалась изменением экспрессии ГР ни в одном из изученных отделов гиппокампа (СА1, СА3, зубчатая извилина) [129].
В наших исследованиях с началом длительной социальной изоляции в подростковом периоде было выявлено изменение экспрессии ГР в структурах мозга и самцов, и самок крыс Wistar [11, 12, 115]. После 9 мес. социальной изоляции у крыс обоего пола выявлено повышение экспрессии ГР во фронтальной коре мозга, а в гиппокампе только у самцов отмечено снижение экспрессии ГР. Несмотря на отсутствие изменений содержания кортикостерона в крови на данном сроке изоляции, результаты свидетельствуют об изменениях функционирования ГГА-оси и подтверждают формирование у животных ответа на стресс. Отметим, что повышение экспрессии ГР во фронтальной коре было обнаружено в наших исследованиях у самок и после 5 мес. изоляции [11]. На основании наших данных об изменении социального интереса у крыс уже после двух месяцев изоляции нельзя исключить, что повышение экспрессии ГР в мозге происходит на ранних сроках социальной изоляции и сохраняется при пролонгировании этого стрессирующего воздействия. Djordjevic et al. [36] по результатам анализа состояния ГГА-оси и ГР у самцов Wistar, подвергнутых трехнедельной социальной изоляции во взрослом возрасте, пришли к заключению о том, что стресс-специфические ответы ГР преимущественно выявляются в префронтальной коре, а не в гиппокампе. Несмотря на то, что в наших исследованиях длительность стресса социальной изоляции была значительно больше, а его действие начиналось в подростковом периоде, полученные результаты принципиально согласуются с наблюдением Djordjevic et al. [36]. По существующим представлениям преимущественно ГР гиппокампа обеспечивают эффективность петли отрицательной обратной связи по ГГА-оси при действии хронического стресса [27, 57, 72], а снижение экспрессии ГР в этой структуре ухудшает способность регулировать ответ на стресс [69]. Выявленное в наших исследованиях снижение экспрессии ГР в гиппокампе самцов крыс может свидетельствовать о формировании у них дефицита механизмов регуляции по ГГА-оси под влиянием длительной 9-месячной социальной изоляции, что требует отдельного анализа, так как ставит вопрос о возможном начале развития глюкокортикоидной резистентности [6].
По данным Perlman et al. [97], в мозге подростков и взрослых отмечен высокий уровень экспрессии мРНК ГР в префронтальной коре. Предполагается, что когнитивные и эмоциональные процессы, которые регулируются этими областями мозга, могут быть чувствительны к регуляции глюкокортикоидами в зависимости от возраста [72]. Возможно, что выявленное в наших работах повышение экспрессии ГР во фронтальной коре мозга у взрослых крыс обоего пола отражает развитие процессов адаптации к хроническому действию стресса социальной изоляции для компенсации вызванных им нарушений когнитивных функций.
МАРКЕРЫ ИММУНОВОСПАЛИТЕЛЬНОГО ОТВЕТА ПРИ МОДЕЛИРОВАНИИ СОЦИАЛЬНОЙ ИЗОЛЯЦИИ
В случаях, когда длительный психологический или физиологический стресс гиперактивирует ГГА-ось, развивается ГР-резистентность, и, как сказано выше, появляются признаки нейровоспаления [57], так как не реализуется компенсаторный механизм – противовоспалительный эффект активации рецепторов глюкокортикоидами, осуществляемый путем ингибирования провоспалительных сигнальных путей [16]. Отметим, что этот эффект зависит от уровня половых гормонов: эстрогены снижают, в то время как тестостерон повышает эффективность опосредованного глюкокортикоидами подавления активности ГГА-оси, что может частично объяснять разницу между полами в восстановлении после стресса [43]. При хроническом стресс-индуцированном воспалении, сопровождающемся неконтролируемой секрецией провоспалительных цитокинов, ответная активация ГГА-оси с включением механизмов секреции ГК может способствовать торможению нейровоспалительной реакции, однако цитокины, в свою очередь, способны снижать экспрессию ГР и тормозить транслокацию ГР из цитоплазмы в ядро, а также увеличивать экспрессию относительно инертной изоформы ГР [92], тем самым препятствуя развитию защитного ответа.
В эксперименте показано, что повышение уровня IL-1β в мозге участвует в нарушении контекстуально обусловленного страха, вызванного социальной изоляцией [17, 101]: у взрослых самцов крыс Sprague-Dawley после нескольких часов социальной изоляции, примененной сразу после выработки обусловливания, обнаружили повышение содержания IL-1β в гиппокампе, что сопровождалось нарушением памяти. Более того, интрацеребровентрикулярное введение антагониста IL-1 рецептора после выработки страха предотвращало влияние социальной изоляции на нарушение контекстуально-зависимой памяти. Как у самцов, так и у самок крыс Sprague-Dawley 9-недельная социальная изоляция (начало – ПНД 21–23) вызывала повышение уровня провоспалительных цитокинов (IL-1β, IL-6, TNF-alpha, IFN-gamma) в крови [58]. Участие провоспалительных цитокинов в когнитивных процессах показано также в экспериментах на грызунах другого рода – на самцах мышей C57Bl/6 [49]: социальная изоляция длительностью 4 нед. (начало – ПНД 31) сама по себе не нарушала пространственное поведение животных в Y-образном лабиринте и распознавание нового объекта, однако после введения в дорзальный гиппокамп лентивируса для оверэкспресии IL-1β у социально изолированных животных отмечали дефицит спонтанной альтернации и памяти о несоциальном объекте. IL-1β может участвовать в процессах модуляции синаптической пластичности и нейрогенеза в гиппокампе [73, 90], которые нарушены при социальной изоляции [21].
Десятинедельная социальная изоляция (начало – ПНД 21) самцов крыс Wistar нарушала привыкание по оценке локомоторной активности (тестирование в течение 20 минут), что сопровождалось снижением мРНК противовоспалительного цитокина IL-10 и содержания самого белка в крови крыс, а также снижением экспрессии белка IL-6 в гиппокампе и его мРНК в префронтальной коре мозга [31]. Следовательно, аверсивное действие социальной изоляции, начатой в раннем возрасте, снижало способность крыс вырабатывать цитокины с про- и противовоспалительным действием.
Однако в наших исследованиях при значительно более длительной социальной изоляции нам не удалось обнаружить изменений уровня IL-6 либо IL-1β у самцов Wistar ни в одной из структур мозга. Изменения экспрессии провоспалительных цитокинов были выявлены только в мозге самок: это снижение экспрессии IL-1β во фронтальной коре после 5 мес. социальной изоляции и преимущественное снижение IL-1β и/или Il-6 гиппокампе и стриатуме после 5 и 9 мес. изоляции [11, 12]. Поскольку после 5 мес. социальной изоляции повышение уровня ГР было выявлено только во фронтальной коре мозга самок, можно предположить, что именно активация ГГА-оси способствовала снижению уровня провоспалительного IL-1β. Наблюдение о разнонаправленности изменения экспрессии ГР и IL-1β позволяет с осторожностью предположить развитие признаков нейровоспаления у самок крыс в первые месяцы действия хронического стресса социальной изоляции и последующее включение адаптационных механизмов преодоления провоспалительного ответа. Однако в гиппокампе и стриатуме самок, демонстрировавших ухудшение когнитивных функций в сравнении с самцами, снижение экспрессии IL-1β и/или Il-6 не сопровождалось повышением уровня ГР. Является ли такое снижение экспрессии провоспалительных цитокинов частью механизмов адаптации к пролонгированному стрессу у самок? Обусловлено ли оно влиянием половых гормонов на эффективность опосредованного глюкокортикоидами подавления активности ГГА-оси или на другие мишени? Связано ли такое снижение экспрессии цитокинов и, если да, то как, с ухудшением когнитивных способностей? Отметим, что мы не оценивали уровень цитокинов с преимущественно противовоспалительным действием и не можем судить о том, был ли уровень таких цитокинов в мозге увеличен. Сложности для понимания механизмов развития адаптивного ответа по ГГА-оси при пролонгировании социальной изоляции добавляет и тот факт, что у самцов после 9 мес. изоляции ни повышение экспрессии ГР во фронтальной коре, ни снижение экспрессии ГР в гиппокампе не сопровождались изменениями экспрессии провоспалительных цитокинов. В настоящее время вопросы о путях взаимодействия ГГА-оси и иммуновоспалительных медиаторов, а также о возможных механизмах формирования адаптивного ответа при действии пролонгированного психосоциального стресса у особей разного пола остаются открытыми. К поиску ответов на эти вопросы, на наш взгляд, целесообразно привлекать данные о динамике адаптационных изменений, включая оценку выбора стратегии преодоления.
ЗАКЛЮЧЕНИЕ
Когнитивные расстройства являются составляющей последствий длительного стресса социальной изоляции у социально живущих млекопитающих. Эти расстройства сопровождаются изменениями состояния ГГА-оси и появлением признаков иммуновоспалительного ответа, о чем свидетельствует характер изменения различных биомаркеров. Однако физиологические и патофизиологические механизмы взаимосвязи между системами стресс-реактивности, иммуновоспалительными реакциями и когнитивным дефицитом остаются во многом неясными. В целом, накопленные данные позволяют говорить о том, что увеличение срока социальной изоляции до нескольких месяцев сопровождается ухудшением когнитивных функций по показателям разных видов обучения и памяти.
Для выявления таких нарушений в эксперименте может быть полезным прием повторной оценки выработанного навыка у животных с последующим напоминанием через продолжительный отрезок времени на модели пролонгированной социальной изоляции. Такой прием, в сопоставлении с оценкой динамики маркеров систем стресс-реактивности и иммуновоспалительного ответа, открывает возможность выявить половые различия в снижении когнитивных функций под влиянием длительной социальной изоляции и оценить вклад самих систем стресс-реактивности и механизмов воспаления в развитие когнитивного дефицита.
Данные о характере изменения биомаркеров, характеризующих состояние ГГА-оси и иммуновоспалительный ответ, полученные на модели пролонгированной социальной изоляции, приводящей к нарушению когнитивных функций, свидетельствуют о высокой трансляционной значимости этой модели. Использование данной модели, на наш взгляд, может быть полезным для выяснения нейробиологических основ адаптационно-компенсаторных механизмов при длительной социальной изоляции.
Список литературы
Василенко Е.А. Социальный стресс и его влияние на социально-психологическую адаптацию личности. Челябинск: Южно-Уральский научный центр Российской академии образования, 2019. 272 с.
Ватаева Л.А., Михайленко В.А., Кассиль В.Г. Влияние сроков отлучения от самки на поведение в открытом поле и состояние симпатоадреналовой системы у крыс, выращенных в условиях социальной изоляции // Журн. эвол. биохим. физиол. 2002. Т. 38. № 1. С. 66. PMID: 11966207
Крупина Н.А., Хлебникова Н.Н., Орлова И.Н. Ранняя социальная изоляция увеличивает агрессивность и нарушает кратковременное привыкание у крыс // Патол. физиол. эксп. тер. 2015. Т. 59. № 4. С. 4. PMID: 27116871
Крупина Н.А., Ширенова С.Д., Хлебникова Н.Н. Длительная социальная изоляция ухудшает обучение в тесте условного рефлекса активного избегания у самок крыс // Тезисы XIX международного междисциплинарного конгресса “НЕЙРОНАУКА ДЛЯ МЕДИЦИНЫ И ПСИХОЛОГИИ”, 4–10 июня 2023 г., Судак, Крым, Россия. С. 162. https://doi.org/10.29003/m3276.sudak.ns2023-19/162-163
Левшина И.П., Пасикова Н.В., Шуйкин Н.Н. Выработка условных реакций избегания и морфометрические характеристики сенсомоторной коры крыс, социально депривированных в раннем онтогенезе // Журн. высш. нерв. деят. им. И.П. Павлова. 2005. Т. 55. № 4. С. 558. PMID: 16217971
Меркулов В.М., Меркулова Т.И., Бондарь Н.П. Механизмы формирования глюкокортикоидной резистентности в структурах головного мозга при стресс-индуцированных психопатологиях // Биохимия. 2017. Т. 82. № 3. С. 494.
Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожно-депрессивном и оборонительном поведении крыс Вистар // Журн. высш. нерв. деят. им. И.П. Павлова. 2020. Т. 70. № 2. С. 243.https://doi.org/10.31857/S0044467720020100
Хлебникова Н.Н., Медведева Ю.С., Крупина Н.А. Ранняя социальная изоляция, вызывающая эмоционально-мотивационные нарушения у крыс, сопровождается дефицитом кратковременного привыкания, но не влияет на пространственную память // Журн. высш. нерв. деят. им. И.П. Павлова. 2018. Т. 68. № 5. С. 646.https://doi.org/10.1134/S0044467718050052
Ширенова С.Д. Влияние социальной изоляции на выработку условного рефлекса пассивного избегания у самок крыс. Cognitive Neuroscience – 2020: материалы международного форума, 11–12 декабря 2020 г., Екатеринбург // [отв. ред. Э.Э. Сыманюк]; Министерство науки и высшего образования Российской Федерации, Уральский федеральный университет. Екатеринбург: Изд-во Урал. Ун-та. 2021. Екатеринбург, 11–12 декабря, 2020. С. 329.
Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Изменения социальности и предпочтения социальной новизны у самок крыс в условиях пролонгированной социальной изоляции // Журн. высш. нерв. деят. им. И.П. Павлова. 2022. Т. 72. № 4. С. 520.https://doi.org/10.31857/S0044467722040104
Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Экспрессия интерлейкинов IL-1β и IL-6 и рецепторов глюкокортикоидов в структурах мозга самок крыс, подвергнутых длительной социальной изоляции // Тезисы VI Международной междисциплинарной конференции “Современные проблемы системной регуляции физиологических функций”, посвященной 90-летию со дня рождения академика К.В. Судакова. Июль, 6–8, 2022. Москва. С. 552.
Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Экспрессия рецепторов глюкокортикоидов и интерлейкинов IL-1β и IL-6 в структурах мозга крыс, подвергнутых длительной социальной изоляции: половые различия // Патогенез. 2022. Т. 20. № 3. С. 147. https://doi.org/10.25557/2310-0435.2022.03.147-148
Aisa B., Gil-Bea F.J., Marcos B. et al. Neonatal stress affects vulnerability of cholinergic neurons and cognition in the rat: Involvement of the HPA axis // Psychoneuroendocrinology. 2009. V. 34. № 10. P. 1495. https://doi.org/10.1016/j.psyneuen.2009.05.003
Almulla A.F., Al-Hakeim H.K., Maes M. Chronic fatigue and affective symptoms in acute and long COVID are attributable to immune-inflammatory pathways // Psychiatry Clin. Neurosci. 2023. V. 77. № 2. P. 125. https://doi.org/10.1111/pcn.13514
Barendse M.E.A., Flannery J., Cavanagh C. et al. Longitudinal change in adolescent depression and anxiety symptoms from before to during the COVID-19 pandemic // J. Res. Adolesc. 2023. V. 33. № 1. P. 74.https://doi.org/10.1111/jora.12781
Barnes PJ. Glucocorticosteroids // Handb. Exp. Pharmacol. 2017. V. 237. P. 93.https://doi.org/10.1007/164_2016_62
Barrientos R., Sprunger D., Campeau S. et al. Brain-derived neurotrophic factor mRNA downregulation produced by social isolation is blocked by intrahippocampal interleukin-1 receptor antagonist // Neuroscience. 2003. V. 121. № 4. P. 847.https://doi.org/10.1016/s0306-4522(03)00564-5
Belzung C., Lemoine M. Criteria of validity for animal models of psychiatric disorders: focus on anxiety disorders and depression // Biol. Mood Anxiety Disord. 2011. V. 1. № 1. P. 9.https://doi.org/10.1186/2045-5380-1-9
Bianchi M., Fone K.F.C., Azmi N. et al. Isolation rearing induces recognition memory deficits accompanied by cytoskeletal alterations in rat hippocampus // Eur. J. Neurosci. 2006. V. 24. № 10. P. 2894.https://doi.org/10.1111/j.1460-9568.2006.05170.x
Bick J., Zeanah C.H., Fox N.A., Nelson C.A. Memory and executive functioning in 12-Year-old children with a history of institutional rearing // Child Dev. 2018. V. 89. P. 495.https://doi.org/10.1111/cdev.12952
Biggio F., Mostallino M.C., Talani G. et al. Social enrichment reverses the isolation-induced deficits of neuronal plasticity in the hippocampus of male rats // Neuropharmacology. 2019. V. 151. P. 45.https://doi.org/10.1016/j.neuropharm.2019.03.030
Bos K.J., Fox N., Zeanah C.H., Nelson C.A. Effects of early psychosocial deprivation on the development of memory and executive function // Front. Behav. Neurosci. 2009. V. 3. 16.https://doi.org/10.3389/neuro.08.016.2009
Braun M.D., Kisko T.M., Witt S.H. et al. Long-term environmental impact on object recognition, spatial memory, and reversal learning capabilities in Cacna1c haploinsufficient rats // Hum. Mol. Genet. 2019. V. 28. № 24. P. 4113. https://doi.org/10.1093/hmg/ddz235
Brenes J.C., Padilla M., Fornaguera J. A detailed analysis of open-field habituation and behavioral and neurochemical antidepressant-like effects in postweaning enriched rats // Behav. Brain Res. 2009. V. 197. № 1. P. 125.https://doi.org/10.1016/j.bbr.2008.08.014
Cacioppo J.T., Cacioppo S., Capitanio J.P., Cole S.W. The Neuroendocrinology of Social Isolation // Annu. Rev. Psychol. 2015. V. 66. № 1. P. 733.https://doi.org/10.1146/annurev-psych-010814-015240
Card J.P. Early experience modifies the postnatal assembly of autonomic emotional motor circuits in rats // J. Neurosci. 2005. V. 25. № 40. P. 9102.https://doi.org/10.1523/JNEUROSCI.2345-05.2005
Cintra A., Bhatnagar M., Chadi G. et al. Glial and neuronal glucocorticoid receptor immunoreactive cell populations in developing, adult, and aging brain // Ann. N.Y. Acad. Sci. 1994. V. 736. P. 42.https://doi.org/10.1111/j.1749-6632.1994.tb39210.x
Cole S.W., Hawkley L.C., Arevalo J.M. et al. Social regulation of gene expression in human leukocytes // Genome Biol. 2007. V. 8. R189.https://doi.org/10.1186/gb-2007-8-9-r189
Cole S.W., Hawkley L.C., Arevalo J.M.G., Cacioppo J.T. Transcript origin analysis identifies antigen-presenting cells as primary targets of socially regulated gene expression in leukocytes // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 7. P. 3080.https://doi.org/10.1073/pnas.1014218108
Colvert E., Rutter M., Kreppner J. et al. Do theory of mind and executive function deficits underlie the adverse outcomes associated with profound early deprivation?: findings from the English and Romanian adoptees study // J. Abnorm. Child Psychol. 2008. V. 36. № 7. P. 1057.https://doi.org/10.1007/s10802-008-9232-x
Corsi-Zuelli F., Fachim H.A., Loureiro C.M. et al. Prolonged periods of social isolation from weaning reduce the anti-inflammatory cytokine IL-10 in blood and brain // Front. Neurosci. 2019. V. 12. 1011.https://doi.org/10.3389/fnins.2018.01011
Couzin-Frankel J. National Institutes of Health. Needed: more females in animal and cell studies // Science. 2014. V. 344. № 6185. P. 679.https://doi.org/10.1126/science.344.6185.679
Coyle C.E., Dugan E. Social isolation, loneliness and health among older adults // J. Aging Health. 2012. V. 24. № 8. P. 1346. https://doi.org/10.1177/0898264312460275
Del Arco A., Zhu S.W., Terasmaa A., Mohammed A.H., Fuxe K. Hyperactivity to novelty induced by social isolation is not correlated with changes in D2 receptor function and binding in striatum // Psychopharmacology. 2004. V. 171. P. 148.https://doi.org/10.1007/s00213-003-1578-8
Dixit N.M., Churchill A., Nsair A, Hsu J.J. Post-acute COVID-19 syndrome and the cardiovascular system: What is known? // Am. Heart. J. Plus. 2021. V. 5. 100025.https://doi.org/10.1016/j.ahjo.2021.100025
Djordjevic A., Adzi M., Djordjevic J., Radojcic M.B. Stress type dependence of expression and cytoplasmic-nuclear partitioning of glucocorticoid receptor, hsp90 and hsp70 in Wistar rat brain // Neuropsychobiology. 2009. V. 59. № 4. P. 213.https://doi.org/10.1159/000223733
Dumas J.A., Newhouse P.A. The cholinergic hypothesis of cognitive aging revisited again: cholinergic functional compensation // Pharmacol. Biochem. Behav. 2011. V. 99. № 2. P. 254.https://doi.org/10.1016/j.pbb.2011.02.022
Einon D.F., Morgan M.J. A critical period for social isolation in the rat // Dev. Psychobiol. 1977. V. 10. № 2. P. 123. https://doi.org/10.1002/dev.420100205
Fone K.C.F., Porkess M.V. Behavioural and neurochemical effects of post-weaning social isolation in rodents – relevance to developmental neuropsychiatric disorders // Neurosci Biobehav Rev. 2008. V. 32. № 6. P. 1087.https://doi.org/10.1016/j.neubiorev.2008.03.003
Gamallo A., Villanua A., Trancho G., Fraile A. Stress adaptation and adrenal activity in isolated and crowded rats // Physiol. Behav. 1986. V. 36. P. 217.https://doi.org/10.1016/0031-9384(86)90006-5
Gapp K., Ziegler L., Tweedie-Cullen R.Y., Mansuy I.M. Early life epigenetic programming and transmission of stress-induced traits in mammals // BioEssays. 2014. V. 36. № 5. P. 491.https://doi.org/10.1002/bies.201300116
Garthe A., Behr J., Kempermann G. Adult-generated hippocampal neurons allow the flexible use of spatially precise learning strategies // PloS One. 2009. V. 4. № 5. e5464.https://doi.org/10.1371/journal.pone.0005464
Goel N., Workman J.L., Lee T.T., Innala L., Viau V. Sex differences in the HPA axis // Compr. Physiol. 2014. V. 4. № 3. P. 1121.https://doi.org/10.1002/cphy.c130054
Hatch A.M., Wiberg G.S., Zawidzka Z. et al. Isolation syndrome in the rat // Toxicol. Appl. Pharmacol. 1965. V. 7, № 5. P. 737.https://doi.org/10.1016/0041-008x(65)90132-8
Heidbreder C.A., Weiss I.C., Domeney A.M. et al. Behavioral, neurochemical and endocrinological characterization of the early social isolation syndrome // Neuroscience. 2000. V. 100. № 4. P. 749. https://doi.org/10.1016/s0306-4522(00)00336-5
Hellemans K.G.C., Benge L.C., Olmstead M.C. Adolescent enrichment partially reverses the social isolation syndrome // Brain Res. Dev. Brain Res. 2004. V. 150. P. 103.https://doi.org/10.1016/j.devbrainres.2004.03.003
Holt-Lunstad J., Smith T.B., Layton J.B. Social relationships and mortality risk: A meta-analytic review // PLoS Medicine. 2010. V. 7. № 7. e1000316.https://doi.org/10.1371/journal.pmed.1000316
Hossain M.M., Tasnim S., Sultana A. et al. Epidemiology of mental health problems in COVID-19: A review // F1000Research. 2020. V. 9. 636. https://doi.org/10.12688/f1000research.24457.1
Hueston C.M., Cryan J.F., Nolan Y.M. Adolescent social isolation stress unmasks the combined effects of adolescent exercise and adult inflammation on hippocampal neurogenesis and behavior // Neuroscience. 2017. V. 365. P. 226.https://doi.org/10.1016/j.neuroscience.2017.09.020
Ibrahim R., Abolfathi Momtaz Y., Hamid T.A. Social isolation in older Malaysians: prevalence and risk factors // Psychogeriatrics. 2013. V. 13. P. 71.https://doi.org/10.1111/psyg.12000
Ingram J., Hand C.J., Maciejewski G. Social isolation during COVID-19 lockdown impairs cognitive function // Appl. Cogn. Psychol. 2021. V. 35. № 4. P. 935.https://doi.org/10.1002/acp.3821
Jang Y., Choi E.Y., Park N.S. et al. Cognitive health risks posed by social isolation and loneliness in older Korean Americans // BMC Geriatrics. 2021. V. 21. № 1. 123.https://doi.org/10.1186/s12877-021-02066-4
Joyce J., Ryan J., Owen A. et al. Social isolation, social support, and loneliness and their relationship with cognitive health and dementia // Int. J. Geriatr. Psychiatry. 2022. V. 37. № 1. P. 1.https://doi.org/10.1002/gps.5644
Karelina K., DeVries A.C. Modeling social influences on human health // Psychosom. Med. 2011. V. 73. № 1. P. 67.https://doi.org/10.1097/PSY.0b013e3182002116
Karpenko O., Syunyakov T.S., Kulygina M.A. et al. Impact of COVID-19 pandemic on anxiety, depression and distress –online survey results amid the pandemic in Russia // Consortium Psychiatricum. 2020. V. 1. № 1. P. 8. https://doi.org/10.17650/2712-7672-2020-1-1-8-20
Khandelwal S.K., Bhatia A., Mishra A.K. Psychological adaptation of Indian expeditioners during prolonged residence in Antarctica // Indian J. Psychiatry. 2017. V. 59. P. 313.https://doi.org/10.4103/psychiatry.IndianJPsychiatry_296_16
Kim Y.-K., Na K.-S., Myint A.-M., Leonard B.E. The role of pro-inflammatory cytokines in neuroinflammation, neurogenesis and the neuroendocrine system in major depression // Prog. NeuroPsychopharmacol. Biol. Psychiatry. 2016. V. 64. P. 277https://doi.org/10.1016/j.pnpbp.2015.06.008
Ko C.Y., Liu Y.P. Disruptions of sensorimotor gating, cytokines, glycemia, monoamines, and genes in both sexes of rats reared in social isolation can be ameliorated by oral chronic quetiapine administration // Brain Behav. Immun. 2016. V. 51. P. 119. https://doi.org/10.1016/j.bbi.2015.08.003
Kokras N., Sotiropoulos I., Besinis D. et al. Neuroplasticity-related correlates of environmental enrichment combined with physical activity differ between the sexes // Eur. Neuropsychopharmacol. 2019. V. 29. № 1. P. 1.https://doi.org/10.1016/j.euroneuro.2018.11.1107
Krupina N.A., Shirenova S.D., Khlebnikova N.N. Prolonged social isolation, started early in life, impairs cognitive abilities in rats depending on sex // Brain Sci. 2020. V. 10. 799.https://doi.org/10.3390/brainsci10110799
Labos E., Zabala K., Renato A. et al. Restricción cognitiva durante la cuarentena por COVID-19 [Cognitive impairment during the COVID-19- social isolation period] // Medicina (B Aires). 2021. V. 81. № 5. P. 722. PMID: 34633944. [Article in Spanish]
Landeiro F., Barrows P., Nuttall Musson E., Gray A.M., Leal J. Reducing social isolation and loneliness in older people: a systematic review protocol // BMJ Open. 2017. V. 7. № 5. e013778. https://doi.org/10.1136/bmjopen-2016-013778
Laws K.R., Irvine K., Gale T.M. Sex differences in cognitive impairment in Alzheimer’s disease // World J. Psychiatry. 2016. V. 6. № 1. P. 54.https://doi.org/10.5498/wjp.v6.i1.54
Lazarus R.S. Coping theory and research: past, present, and future // Psychosom. Med. 1993. V. 55. № 3. P. 234.https://doi.org/10.1097/00006842-199305000-00002
Lee C.C.E., Ali K., Connell D. et al. COVID-19-associated cardiovascular complications // Diseases. 2021. V. 9. 47. https://doi.org/10.3390/diseases9030047
Leigh-Hunt N., Bagguley D., Bash K. et al. An overview of systematic reviews on the public health consequences of social isolation and loneliness // Public Health. 2017. V. 152. P. 157.https://doi.org/10.1016/j.puhe.2017.07.035
Leschak C.J., Eisenberger N. Two distinct immune pathways linking social relationships with health: Inflammatory and antiviral processes // Psychosom. Med. 2019. V. 81. P. 711. https://doi.org/10.1097/PSY.0000000000000685
Liu P.Z., Nusslock R. How stress gets under the skin: early life adversity and glucocorticoid receptor epigenetic regulation // Curr. Genomics. 2018. V.19. № 8. P. 653.https://doi.org/10.2174/1389202919666171228164350
Loftis J.M., Firsick E., Shirley K. et al. Inflammatory and mental health sequelae of COVID-19 // Compr. Psychoneuroendocrinol. 2023. V. 15. 100186. https://doi.org/10.1016/j.cpnec.2023.100186
Lu L., Bao G., Chen H. et al. Modification of hippocampal neurogenesis and neuroplasticity by social environments // Exp. Neurol. 2003. V. 18. P. 600.https://doi.org/10.1016/s0014-4886(03)00248-6
Lukkes J.L., Watt M.J., Lowry C.A., Forster G.L. Consequences of post-weaning social isolation on anxiety behavior and related neural circuits in rodents // Front. Behav. Neurosci. 2009. V. 3. 18.https://doi.org/10.3389/neuro.08.018.2009
Lupien S.J., McEwen B.S., Gunnar M.R., Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition // Nat. Rev. Neurosci. 2009. V. 10. № 6. P. 434.https://doi.org/10.1038/nrn2639
Machado I., Schiöth H.B., Lasaga M., Scimonelli T. IL-1β reduces GluA1 phosphorylation and its surface expression during memory reconsolidation and α-melanocyte-stimulating hormone can modulate these effects // Neuropharmacology. 2018. V. 128. P. 314.https://doi.org/10.1016/j.neuropharm.2017.09.041
Malcolm M., Frost H., Cowie J. Loneliness and social isolation causal association with health-related lifestyle risk in older adults: a systematic review and meta-analysis protocol // Syst. Rev. 2019. V. 8. № 48. P. 1.https://doi.org/10.1186/s13643-019-0968-x
Mann L.M., Walker B.R. The role of equanimity in mediating the relationship between psychological distress and social isolation during COVID-19 // J. Affect. Disord. 2022. V. 296. P. 370.https://doi.org/10.1016/j.jad.2021.09.087
Maslova L.N., Bulygina V.V., Amstislavskaya T.G. Prolonged social isolation and social instability in adolescence in rats: immediate and long-term physiological and behavioral effects // Neurosci. Behav. Physiol. 2010. V. 40. P. 955.https://doi.org/10.1007/s11055-010-9352-y
Matisz C.E., Badenhorst C.A., Gruber A.J. Chronic unpredictable stress shifts rat behavior from exploration to exploitation // Stress. 2021. V. 24. № 5. P. 635.https://doi.org/10.1080/10253890.2021.1947235
Matthews G.A., Tye K.M. Neural mechanisms of social homeostasis // Ann. N. Y. Acad. Sci. 2019. V. 1457. № 1. P. 5.https://doi.org/10.1111/nyas.14016
McGaugh J.L., Roozendaal B. Role of adrenal stress hormones in forming lasting memories in the brain // Curr. Opin. Neurobiol. 2002. V. 12. P. 205.https://doi.org/10.1016/s0959-4388(02)00306-9
McIntosh A.L., Ballard T.M., Steward L.J., Moran P.M., Fone K.C.F. The atypical antipsychotic risperidone reverses the recognition memory deficits induced by post-weaning social isolation in rats // Psychopharmacology. 2013. V. 228. P. 31.https://doi.org/10.1007/s00213-013-3011-2
McLaughlin K.A., Sheridan M.A., Nelson Ch.A. Neglect as a violation of species-expectant experience: Neurodevelopmental consequences // Biol. Psychiatry. 2017. V. 82. № 7. P. 462. https://doi.org/10.1016/j.biopsych.2017.02.1096
McLean S., Grayson B., Harris M. et al. Isolation rearing impairs novel object recognition and attentional set shifting performance in female rats // J. Psychopharmacol. 2008. V. 24. № 1. P. 57.https://doi.org/10.1177/0269881108093842
Mumtaz F., Khan M.I., Zubair M., Dehpour A.R. Neurobiology and consequences of social isolation stress in animal model – A comprehensive review // Biomed. Pharmacother. 2018. V. 105. P. 1205.https://doi.org/10.1016/j.biopha.2018.05.086
Naumova O.Y., Rychkov S.Y., Kornilov S.A. et al. Effects of early social deprivation on epigenetic statuses and adaptive behavior of young children: A study based on a cohort of institutionalized infants and toddlers // PLoS One. 2019. V. 14. № 3. e0214285.https://doi.org/10.1371/journal.pone.0214285
Ness J.W., Marshall T.R., Aravich P.F. Effects of rearing condition on activity-induced weight loss // Dev. Psychobiol. 1995. V. 28. № 3. P. 165.https://doi.org/10.1002/dev.420280304
Noguchi T., Kubo Y., Hayashi T. et al. Social isolation and self-reported cognitive decline among older adults in Japan: A longitudinal study in the COVID-19 pandemic // J. Am. Med. Dir. Assoc. 2021. V. 22. № 7. P. 1352.e2.https://doi.org/10.1016/j.jamda.2021.05.015
Nowland R., Robinson S.J., Bradley B.F., Summers V., Qualter P. Loneliness, HPA stress reactivity and social threat sensitivity: Analyzing naturalistic social challenges // Scand. J. Psychol. 2018. V. 59. № 5. P. 540.https://doi.org/10.1111/sjop.12461
Oakley R.H., Cidlowski J.A. The biology of the glucocorticoid receptor: new signaling mechanisms in health and disease // J. Allergy Clin. Immunol. 2013. V. 132. № 5. P. 1033.https://doi.org/10.1016/j.jaci.2013.09.007
Okuda S., Roozendaal B., McGaugh J.L. Glucocorticoid effects on object recognition memory require training-associated emotional arousal // Proc. Natl Acad. Sci. 2004. V. 101. № 3. P. 853.https://doi.org/10.1073/pnas.0307803100
O'Léime C.S., Cryan J.F., Nolan Y.M. Nuclear deterrents: Intrinsic regulators of IL-1β-induced effects on hippocampal neurogenesis // Brain Behav. Immun. 2017. V. 66. P. 394.https://doi.org/10.1016/j.bbi.2017.07.153
Oyola M.G., Handa R.J. Hypothalamic–pituitary–adrenal and hypothalamic–pituitary–gonadal axes: Sex differences in regulation of stress responsivity // Stress. 2017. V. 20. № 5. P. 476.https://doi.org/10.1080/10253890.2017.1369523
Pace T.W.W., Mille A.H. Cytokines and glucocorticoid receptor signaling // Ann. N. Y. Acad. Sci. 2009. V. 1179. № 1. P. 86.https://doi.org/10.1111/j.1749-6632.2009.04984.x
Pais R., Ruano L., Moreira C. et al. Social support and cognitive impairment: results from a portuguese 4-year prospective study // Int. J. Environ. Res. Public Health. 2021. V. 18. № 16. 8841. https://doi.org/10.3390/ijerph18168841
Paul S., Jeon W.K., Bizon J.L., Han J.-S. Interaction of basal forebrain cholinergic neurons with the glucocorticoid system in stress regulation and cognitive impairment // Front. Aging Neurosci. 2015. V. 7. 43https://doi.org/10.3389/fnagi.2015.00043
Pechtel P., Pizzagalli D.A. Effects of early life stress on cognitive and affective function: an integrated review of human literature // Psychopharmacology. 2010. V. 214. P. 55.https://doi.org/10.1007/s00213-010-2009-2
Perissinotto C.M., Stijacic C.I., Covinsky K.E. Loneliness in older persons // Arch. Intern. Med. 2012. V. 172. № 14. P. 1078.https://doi.org/10.1001/archinternmed.2012.1993
Perlman W.R., Webster M.J., Herman M.M., Kleinman J.E., Weickert C.S. Age-related differences in glucocorticoid receptor mRNA levels in the human brain // Neurobiol. Aging. 2007. V. 28 P. 447.https://doi.org/10.1016/j.neurobiolaging.2006.01.010
Pisu M.G., Dore R., Mostallino M.C. et al. Down-regulation of hippocampal BDNF and Arc associated with improvement in aversive spatial memory performance in socially isolated rats // Behav. Brain Res. 2011. V. 222. № 1. P. 73.https://doi.org/10.1016/j.bbr.2011.03.021
Pisu M.G., Garau A., Boero G. et al. Sex differences in the outcome of juvenile social isolation on HPA axis function in rats // Neuroscience. 2016. V. 320. P. 172.https://doi.org/10.1016/j.neuroscience.2016.02.009
Powell S.B., Swerdlow N.R., Pitcher L.K., Geyer M.A. Isolation rearing-induced deficits in prepulse inhibition and locomotor habituation are not potentiated by water deprivation // Physiol. Behav. 2002. V. 77. P. 55. https://doi.org/10.1016/s0031-9384(02)00817-x
Pugh C., Nguyen K.T., Gonyea J.L. et al. Role of interleukin-1 beta in impairment of contextual fear conditioning caused by social isolation // Behav. Brain Res. 1999. V. 106. № 1–2. P. 109.https://doi.org/10.1016/s0166-4328(99)00098-4
Raison C.L., Capuron L., Miller A.H. Cytokines sing the blues: inflammation and the pathogenesis of depression // Trends Immunol. 2006. V. 27. № 3. P. 24.https://doi.org/10.1016/j.it.2005.11.006
Ramos-Ortolaza D.L., Doreste-Mendez R.J., Alvarado-Torres J.K., Torres-Reveron A. Ovarian hormones modify anxiety behavior and glucocorticoid receptors after chronic social isolation stress // Behav. Brain Res. 2017. V. 328. P. 115.https://doi.org/10.1016/j.bbr.2017.04.016
Rivera-Irizarry J.K., Skelly M.J., Pleil K.E. Social isolation stress in adolescence, but not adulthood, produces hypersocial behavior in adult male and female c57bl/6j mice // Front. Behav. Neurosci. 2020. V. 14. 129. https://doi.org/10.3389/fnbeh.2020.00129
Rodriguez-Romaguera J., Stuber G.D. Social isolation co-opts fear and aggression circuits // Cell. 2018. V. 173. № 5. P. 1071.https://doi.org/10.1016/j.cell.2018.04.031
Rom O., Reznick A.Z. The stress reaction: A historical perspective // Adv. Exp. Med. Biol. 2015. V. 905. P. 1.https://doi.org/10.1007/5584_2015_195
Sánchez M.M., Aguado F., Sanchez-Toscano F., Saphier D. Neuroendocrine and immunocytochemical demonstrations of decreased hypothalamo-pituitary-adrenal axis responsiveness to restraint stress after long-term social isolation // Endocrinology. 1998. V. 139. P. 579. https://doi.org/10.1210/endo.139.2.5720
Sandi C., Haller J. Stress and the social brain: behavioural effects and neurobiological mechanisms // Nat. Rev. Neurosci. 2015. V. 16. № 5. P. 290.https://doi.org/10.1038/nrn3918
Sapolsky R.M., Romero L.M., Munck A.U. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions // Endocr. Rev. 2000. V. 21. № 1. P. 55.https://doi.org/10.1210/edrv.21.1.0389
Schrijver N.C.A., Bahr N.I., Weiss I.C., Wurbel H. Dissociable effects of isolation rearing and environmental enrichment on exploration, spatial learning and HPA activity in adult rats // Pharmacol. Biochem. Behav. 2002. V. 73. P. 209.https://doi.org/10.1016/s0091-3057(02)00790-6
Schrijver N.C.A., Wurbel H. Early social deprivation disrupts attentional, but not affective, shifts in rats // Behav. Neurosci. 2001. V. 115. № 2. P. 437. PMID: 11345968
Schweinfurth M.K. The social life of Norway rats (Rattus norvegicus) // Elife. 2020. V. 9. e54020. https://doi.org/10.7554/eLife.54020
Seillier A., Giuffrida A. Disruption of social cognition in the sub-chronic PCP rat model of schizophrenia: Possible involvement of the endocannabinoid system // Eur. Neuropsychopharmacol. 2016. V. 26. № 2. P. 298. https://doi.org/10.1016/j.euroneuro.2015.12.009
Serra M., Pisu M.G., Floris I., Biggio G. Social isolation-induced changes in the hypothalamic–pituitary–adrenal axis in the rat // Stress. 2005. V. 8. P. 259.https://doi.org/10.1080/10253890500495244
Shirenova S.D., Khlebnikova N.N., Krupina N.A. Glucocorticoid receptor expression in brain structures of socially isolated rats // “2nd Clinical neurology and neurosurgery congress”. Berlin, July 15–16, 2021. P. 10.
Slavich G.M., Irwin M.R. From stress to inflammation and major depressive disorder: a social signal transduction theory of depression // Psychol. Bull. 2014. V. 140. № 3. P. 774.https://doi.org/10.1037/a0035302
Smith K.E., Pollak S.D. Early life stress and perceived social isolation influence how children use value information to guide behavior // Child Dev. 2022. V. 93. № 3. P. 804.https://doi.org/10.1111/cdev.13727
Snyder-Mackler N., Burger J.R., Gaydosh L. et al. Social determinants of health and survival in humans and other animals // Science. 2020. V. 368. № 6493. eaax9553. https://doi.org/10.1126/science.aax9553
Spear L.P. The adolescent brain and age-related behavioral manifestations // Neurosci. Biobehav. Rev. 2000. V. 24. P. 417. https://doi.org/10.1016/s0149-7634(00)00014-2
Syme L.A. Social isolation at weaning: Some effects on two measures of activity // Animal Learning & Behavior. 1973. V. 1. P. 161.https://doi.org/10.3758/BF03199065
Toyoshima M., Yamada K., Sugita M., Ichitani Y. Social enrichment improves social recognition memory in male rats // Anim. Cogn. 2018. V. 21. № 3. P. 345. https://doi.org/10.1007/s10071-018-1171-5
Turner A.I., Smyth N., Hall S.J. et al. Psychological stress reactivity and future health and disease outcomes: A systematic review of prospective evidence // Psychoneuroendocrinology. 2020. V. 114. 104599. https://doi.org/10.1016/j.psyneuen.2020.104599
van Ijzendoorn M.H., Luijk M.P.C.M, Juffer F. IQ of children growing up in children’s homes: A meta-analysis on IQ delays in orphanages // Merrill-Palmer Quarterly. 2008. V. 54. № 3. P. 341.https://doi.org/10.1353/mpq.0.0002
Victor C.R., Scambler S.J., Bowling A., Bond J. The prevalence of, and risk factors for, loneliness in later life: a survey of older people in Great Britain // Ageing and Society. 2005. V. 25. № 6. P. 357.https://doi.org/10.1017/s0144686x04003332
Vitellius G., Trabado S., Bouligand J., Delemer B., Lombès M. Pathophysiology of glucocorticoid signaling // Annales d’Endocrinologie. 2018. V. 79. № 3. P. 98. https://doi.org/10.1016/j.ando.2018.03.001
Viveros M.P., Hernandez R., Gallego A. Effects of social isolation and crowding upon active-avoidance performance in the rat // Animal Learning & Behavior. 1990. V. 18. № 1. P. 90.https://doi.org/10.3758/bf03205243
Vorhees C.V., Williams M.T. Assessing spatial learning and memory in rodents // ILAR Journal. 2014. V. 55. № 2. P. 310.https://doi.org/10.1093/ilar/ilu013
Walker D.M., Cunningham A.M., Gregory J.K., Nestler E.J. Long-term behavioral effects of post-weaning social isolation in males and females // Front. Behav. Neurosci. 2019. V. 13. 66.https://doi.org/10.3389/fnbeh.2019.00066
Weiss I.C., Pryce C.R., Jongen-Rêlo A.L., Nanz-Bahr N.I., Feldon J. Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat // Behav. Brain Res. 2004. V. 152. № 2. P. 279.https://doi.org/10.1016/j.bbr.2003.10.015
Welzel F.D., Schladitz K., Förster F., Löbner M., Riedel-Heller S.G. Gesundheitliche Folgen sozialer Isolation: Qualitative Studie zu psychosozialen Belastungen und Ressourcen älterer Menschen im Zusammenhang mit der COVID-19-Pandemie [Health-related consequences of social isolation: a qualitative study on psychosocial stress and resources among older adults in the COVID-19 pandemic] // Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2021. V. 64. № 3. P. 334. [Article in German]https://doi.org/10.1007/s00103-021-03281-5
Wongwitdecha N., Marsden C. Social isolation increases aggressive behaviour and alters the effects of diazepam in the rat social interaction test // Behav. Brain Res. 1996. V. 75. P. 27.https://doi.org/10.1016/0166-4328(96)00181-7
Xia N., Li H. Loneliness, social isolation, and cardiovascular health // Antioxid. Redox Signal. 2018. V. 28. № 9. P. 837.https://doi.org/10.1089/ars.2017.7312
Yazdanfar N., Ali Mard S., Mahmoudi J. et al. Maternal morphine exposure and post-weaning social isolation impair memory and ventral striatum dopamine system in male offspring: Is an enriched environment beneficial? // Neuroscience. 2021. V. 461. P. 80https://doi.org/10.1016/j.neuroscience.2021.02.024
Yu B., Steptoe A., Chen Y., Jia X. Social isolation, rather than loneliness, is associated with cognitive decline in older adults: the China health and retirement longitudinal study // Psychol. Med. 2021. V. 51. № 14. P. 2414.https://doi.org/10.1017/S0033291720001014
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


