Вестник РАН, 2020, T. 90, № 4, стр. 305-311
Периодический закон химических элементов: 150 лет развития
Ю. А. Золотов *
Российская академия наук
Москва, Россия
* E-mail: zolotov.32@mail.ru
Поступила в редакцию 16.10.2019
После доработки 16.10.2019
Принята к публикации 23.01.2020
Аннотация
Рассматривая вклад Д.И. Менделеева в российскую и мировую науку, автор доклада рассказывает об истории открытия знаменитого периодического закона химических элементов, его значении для развития химии и физики. Главная мысль докладчика состоит в том, – что в своих обобщениях Менделеев поднялся до уровня формулирования закона, имеющего предсказательную силу, позволяющего делать прогнозы. Прошедшие с тех пор 150 лет полностью подтвердили это. Таблица Менделеева содержала 63 элемента, теперь в ней 118 элементов.
Дмитрий Иванович Менделеев – наиболее известный за пределами нашей страны русский учёный, а в России он, безусловно, входит в первую тройку деятелей науки. Менделеева знают как химика, хотя его интересы были более широкими, химии принадлежит не более трети его публикаций, другие относятся к физике, метрологии, воздухоплаванию, но особенно к экономике и конкретным вопросам промышленности и сельского хозяйства. На закате жизни Менделеев писал: “Сам удивляюсь, чего я только не делывал в своей научной жизни” [1, с. 714]. Л.А. Чугаев, известный химик, руководивший с 1911 г. кафедрой неорганической химии Петербургского университета, которой до 1890 г. заведовал Д.И. Менделеев, выступая на I Менделеевском съезде в 1907 г., так сказал о своём предшественнике: “Гениальный химик, первоклассный физик, плодотворный исследователь в области гидродинамики, метеорологии, геологии, в различных отделах химической технологии (взрывчатые вещества, нефть, учение о топливе и др.) и других сопредельных с химией и физикой дисциплинах, глубокий знаток химической промышленности и промышленности вообще, особенно русской, оригинальный мыслитель в области учения о народном хозяйстве, государственный ум, которому, к сожалению, на суждено было стать государственным человеком, но который видел и понимал задачи и будущность России лучше представителей официальной власти. Таков был Дмитрий Иванович Менделеев” [2].
ОТКРЫТИЕ ЗАКОНА
Из числа работ нашего великого соотечественника к химии относятся химическая, или гидратная, теория растворов (растворы как ассоциации), гипотеза о минеральном происхождении нефти, знаменитая книга “Основы химии”, создание варианта бездымного пороха, пропаганда нефтехимии, ряд других достижений. Но, конечно, главный его вклад – разработка периодического закона химических элементов, значение которого вышло за пределы химии. Закон использовался и используется при решении множества научных и практических задач, оплодотворяет новые области исследований. Создание периодического закона – несомненно, одно из выдающихся научных достижений ХIХ столетия, автора этого закона мы с полным основанием считаем великим учёным.
Менделеев сформулировал закон следующим образом: “Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости… от их атомного веса”. Периодический закон нашёл своё воплощение в составленной Менделеевым Периодической системе, или таблице, элементов. Сам учёный обычно использовал слово “система”, у нас в стране употребляют оба термина, в англоязычной литературе обычно говорят о таблице. Иногда эти термины различают, выстраивая иерархию: закон, система, таблица. Точнее – таблицы, поскольку таблиц, так или иначе отражающих периодичность свойств элементов, предложено много. В России и Советском Союзе, как правило, говорили и писали о периодическом законе, а не о таблице, что отражено, в частности, в названиях огромного числа книг, посвящённых открытию Д.И. Менделеева. Отмечали юбилеи именно закона. Тем более что таблицы, показывающие аналогии в свойствах групп элементов, были предложены и до Менделеева, и одновременно с ним.
Ещё до рождения Менделеева И. Дëберейнер разработал пять групп (триад) элементов, по три элемента в каждой, с похожими свойствами. В этой области работали англичане У. Одлинг и Дж. Ньюлендс (предложивший так называемый закон октав), француз Б. Шанкуртуа, немец Ю.Л. Мейер. Некоторые опубликованные ими таблицы были не хуже менделеевской. Однако никто из этих учёных не поднялся в своих обобщениях до уровня формулирования закона, имеющего предсказательную силу, позволяющего делать прогнозы. Только Менделеев, расположив известные тогда 63 элемента в порядке увеличения их атомного веса, увидел в этой последовательности пустоты, более того – предсказал свойства элементов, которые, по его мнению, должны быть обнаружены в этих пустотах. Через несколько лет эти элементы были открыты, и свойства их оказались близкими к предсказанным Менделеевым. Речь идёт прежде всего о галлии, германии и скандии. В таблице в качестве примера приведены данные для галлия, который Менделеев называл экаалюминием. Это стало триумфом периодического закона.
Процесс формирования периодической системы элементов не был простым. Менделеев сталкивался с трудностями расположения в системе водорода, таллия, индия, редкоземельных и некоторых других элементов. Так, он безуспешно пытался встроить в систему редкоземельные элементы, но позднее Б. Браунер предложил включить их в одну клетку периодической системы, где находился лантан, и вынести для удобства в отдельный ряд лантанидов вне основной таблицы. Новые затруднения возникли после открытия в конце ХIХ столетия инертных газов, приходилось идти на компромиссы. А когда была открыта радиоактивность, появился повод для некоторой растерянности; кстати, до своей кончины в 1907 г. Менделеев радиоактивность так и не признал. Что касается положения водорода, то до сих пор этот элемент – чужой среди своих, в системе Менделеева для него не нашлось очевидного места, его присутствие в первой группе, в первом периоде Периодической системы – результат компромисса.
ПРИЧИНЫ ПЕРИОДИЧНОСТИ. ЭВОЛЮЦИЯ ПЕРИОДИЧЕСКОГО ЗАКОНА
Причина периодичности была непонятна. Менделеев пытался отыскать её на пути исследования мирового эфира, существование которого интересовало учёного всю жизнь, но это направление оказалось тупиковым. В то же время он писал, что разгадку периодичности надо искать “во внутренней механике атомов и молекул”. В эту “внутреннюю механику” стали проникать только на рубеже ХIХ и ХХ столетий.
В 1913 г. благодаря работам Г. Мозли периодический закон приобрёл новую формулировку. Не атомный вес, или, как мы сейчас говорим, не атомная масса легла в основу расположения элементов, а заряд ядра атома, совпадающий с порядковым номером элемента в Периодической системе. Закон зазвучал так: “Свойства химических элементов… находятся в периодической зависимости от заряда атомных ядер”. Эта формулировка, как и менделеевская, не раскрывала причин периодичности. Действительно, почему при постоянном росте заряда ядра возникает периодическое изменение свойств элементов, повторяющаяся аналогия этих свойств? Затем Н. Бор и представители его школы выдвинули объяснение периодичности на основе “старой квантовой теории”. Имеет место корреляция между структурой внешних электронных оболочек атома и химическими свойствами атома. Структура же электронных оболочек определяется принципом Паули и минимумом полной энергии атома.
В принципе данный подход оказался эффективным. Квантово-корпускулярная теория по отношению к атому, развитая Бором и Зоммерфельдом, позволила Бору в 1922 г. рассчитать электронную конфигурацию ещё не открытого элемента № 72, тоже предсказанного Менделеевым, и предположить, что этот элемент должен быть похожим на цирконий. На следующий год элемент был обнаружен, назван гафнием и действительно оказался аналогом циркония. Периодический закон действовал! После работ Л. де Бройля за электроном признали волновые свойства, отказались от понятия траектории его движения, в обиход вошло понятие об электронном облаке, об электронных орбиталях атома, принятое и сегодня. Пришли к выводу, что изменения в электронной конфигурации атомов лежат в основе повторяемости их свойств. Отсюда новая формулировка Периодического закона: “Периодичность свойств химических элементов определяется периодичностью электронных структур атомов”. На этих представлениях зиждется объяснение многого в химии, на этом базируется её преподавание.
Но и самая современная трактовка периодичности не свободна от шероховатостей, структура электронных оболочек атомов нередко отклоняется от последовательностей, предписываемых квантовой механикой, соответствующие представления оказываются не всегда достаточными для объяснения природы химических связей, есть дополнительная периодичность элементов. Выяснение причин периодичности продолжается. Встают новые вопросы, например при изучении антиэлементов. Получен антиводород, у которого заряд ядра не 1+, а 1–, на его оболочке расположен не электрон, как у обычного водорода, а позитрон. Первые данные показывают, что водород и антиводород – по сути, один и тот же элемент.
ГРАНИЦЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Первые таблицы Менделеева насчитывали 63 элемента плюс несколько предсказанных, к началу атомной эры, то есть к 1938–1940 гг., было известно 92 элемента, среди которых несколько радиоактивных; последним, 92-м, самым тяжёлым, стал уран. В дальнейшем были получены трансурановые элементы. Нобелевский лауреат по химии 1951 г. Г. Сиборг выдвинул гипотезу о ряде элементов – актинидов, аналогов лантанидов, которые, как и лантаниды, не помещались целиком в основном теле Периодической системы, точнее, помещались, но большой группой в одной клетке. Эта гипотеза оказалась по сути верной, несмотря на то, что первые члены ряда актинидов, а именно торий, протактиний, уран, нептуний и плутоний, мало похожи на лантаниды. Ряд актинидов был заполнен до конца, до элемента 103, среди новых элементов был и элемент 101, названный менделевием. Начиная с элемента 104, стал пополняться седьмой большой период Периодической системы, последним был открыт элемент 118, названный в честь академика Ю.Ц. Оганесяна оганесоном. В этом периоде ещё несколько элементов имеют ласкающие душу названия – московий, дубний, флеровий. Общеизвестно, какой большой вклад внесли в открытие элементов конца Периодической системы наши коллеги из Дубны. Вопрос о продолжении Периодической системы в сторону тяжёлых элементов (остров стабильности, релятивистские эффекты, возможные нарушения периодичности) довольно широко обсуждается. Поэтому обратимся к началу Периодической системы.
Это может показаться неожиданным, но Менделеев ставил вопрос о продолжении таблицы и в сторону элементов легче водорода. Он, в частности, писал: “Никогда мне в голову не приходило, что именно водородом должен начинаться ряд элементов” [3]. Менделеев ставил перед собой цель “лишить водород того исходного положения, которое он давно занимает, и заставить ждать элементов с ещё меньшим, чем у водорода, весом атома, во что я всегда верил” [там же]. Эти соображения рождались на фоне глубокого интереса Менделеева к идее мирового эфира. Он полагал, что такой эфир не только существует, но что он дискретен, структурирован, должен иметь материальный носитель или носителей. Учёный предполагал существование элемента, атомный вес которого, по его расчётам, должен лежать в интервале от 10–11 до 10–7 от атомного веса водорода, принятого за единицу. Этому элементу Менделеев даже придумал название – ньютоний. Допускалось существование и ещё одного элемента до водорода, который Менделеев назвал коронием.
Идея мирового эфира (правда, не такого, о каком писал Менделеев, а однородного, сплошного, неструктурированного) была похоронена физиками ещё в 1920-х годах. А мысль об элементах легче водорода периодически высвечивается. Например, было предложение считать элементом позитроний – безъядерную систему из электрона и позитрона, или мюоний – водородоподобную систему мюон+электрон, где тяжёлый мюон как бы играет роль ядра. Высказывалась идея, что периодическая система может начинаться и заканчиваться нейтронным веществом. Нейтрон и его “изотопы” – это как бы элементы нулевой группы, с нулевым зарядом. Тот факт, что ультрахолодные нейтроны можно держать в вакууме как “газ”, ставит вопрос о том, считать ли этот “газ” веществом. На этот вопрос мы должны дать положительный ответ, как только вспомним о нейтронных звёздах, а также о гипотетических пока сверхтяжёлых элементах, в которых число нейтронов намного превышает число протонов.
ОБ АВТОРЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
Трудно обойти стороной тему “Менделеев и Академия наук”. Известно, что одним из грехов нашей академии считается неизбрание в число её членов автора периодического закона. Нужно уточнить: Менделеев был членом академии, в 1876 г. его избрали членом-корреспондентом; он не стал академиком. Между прочим, не были академиками и оставались, как и Менделеев, до конца жизни членами-корреспондентами филолог В.И. Даль, биологи И.М. Сеченов, К.А. Тимирязев и И.И. Мечников, врач Н.И. Пирогов, механик Н.Е. Жуковский, историк Н.И. Костомаров. Неплохая компания! Но, разумеется, Менделеев должен был бы быть избран академиком.
Парадоксально, но от неизбрания академиком Дмитрий Иванович даже выиграл – в смысле общественного признания, поддержки, популярности, получения престижных званий. Волна возмущения в связи с неизбранием, поднявшаяся не без участия профессора Н.А. Меншуткина, заведовавшего в Петербургском университете кафедрой аналитической химии, оказалась очень мощной, прокатилась по России и вышла за её пределы. На этой волне многие университеты, академии, общества стали избирать Менделеева своим почётным членом: только с 11 ноября по 31 декабря 1880 г. такое решение приняли 14 обществ и учебных заведений России, в том числе Московский, Казанский, Харьковский и Новороссийский университеты. 24 ноября 1880 г. “Новости и Биржевая газета” написала следующее: «История с забаллотировкой в Академии проф. Менделеева принимает положительно гомерические размеры и становится вопросом всероссийским, общенациональным. Популярность почтенного профессора возросла и распространилась вдруг, с гораздо большей экспрессией, чем если бы он обогатил науку в стократ важнейшими открытиями, сравнительно с теми, которые им сделаны… В газетах образовалась уже целая литература об его учёных трудах и заслугах, из-за него ломаются перья в полемическом походе против академических тевтонов – “дядюшек” и “племянников”. Теперь остаётся, чтобы г. Менделеев сам почтил академический ареопаг тоже благодарственным письмом за то, что он забаллотировал его, оказал ему этим в сущности неоценимую услугу. Ведь благодаря несговорчивости “дядюшек” Менделеев в одну неделю стал одним из популярнейших людей в России!»
Чуть позже волна пересекла границы страны, началось массовое признание за рубежом, например, в 1882 г. Менделееву присудили медаль имени Дэви Лондонского королевского общества, в следующем году он стал почётным членом Английского химического общества.
Рис. 4.
Одна из первых систем элементов, подготовленная Д.И. Менделеевым, с указанием предполагаемых элементов

Рис. 5.
Периодическая система элементов из 8-го издания “Основ химии” Д.И. Менделеева, в которой отражены элементы ньютоний и короний
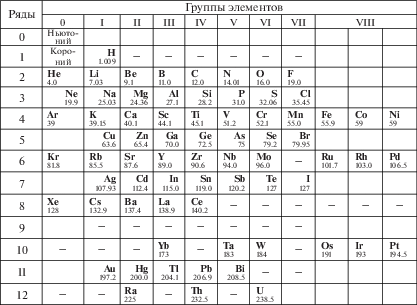
Таблица 1.
Характеристки предсказанного Менделеевым экаалюминия и открытого позднее галлия
| Свойство | Экаалюминий (Ea) | Галлий (Ga) |
|---|---|---|
| Относительная атомная масса | 68 | 69.9 |
| Температура плавления, °С | Низкая | 29.78 |
| Плотность, г/см3 | 5.9 | 5.94 |
| Формула осадка | Eа2О3 | Ga2O3 |
Разумеется, Менделеев заслуживал Нобелевской премии. Его выдвигали трижды – в 1905, 1906 и 1907 гг. В 1905 г. премию по химии присудили немецкому учёному Адольфу Байеру, которого до этого выдвигали не один раз. В 1906 г. Комитет по химии рекомендовал Менделеева (4:1), но Королевская академия присудила премию французу Анри Муассану, который был старше Менделеева; видимо, рассудили, что Менделеев ещё успеет, а Муассан, возможно, нет. Договорились, что в следующем году Менделеев будет бесспорным первым, но в феврале он умер. Лауреатов объявляют в октябре, а умершим премии не присуждают.
Широкая известность человека чревата повышенным интересом к его личной жизни или к его недостаткам, а также возникновением мифов. Сложилось несколько мифов и о Менделееве: о том, что он автор рецепта русской водки, что периодическая система ему приснилась, что он вычислил секрет бездымного пороха, что он известный изготовитель чемоданов и отменный переплётчик. Эти мифы по большей части не имеют отношения к действительности. Правда лишь то, что Менделеев сам переплетал свои бумаги, а состав бездымного пороха просчитал, но по бумагам, а не подсчитывая, как полагали, тайком вагоны с ингредиентами пороха, поступавшими на завод.
В заключение вернёмся к периодическому закону. Многие химики 1860–1870-х годов вначале довольно равнодушно отнеслись к попыткам систематизации химических элементов. После первого сообщения о периодичности в Русском химическом обществе известный химик академик Н.Н. Зинин высказался в том смысле, что лучше бы Менделеев занимался делом. Однако, когда значение этого открытия становилось всё более очевидным, начались споры о том, кому принадлежит первенство. Основным оппонентом был Ю.Л. Мейер. Чтобы не разбираться по существу, в 1882 г. Лондонское химическое общество присудило упомянутую медаль Дэви одновременно и Менделееву, и Мейеру. Впоследствии приоритет Менделеева признавался всё больше и больше. Мейер отмечал позднее, что он не додумался до предсказаний, как это сделал Менделеев [4]. Не имея возможности поехать в 1882 г. в Лондон, чтобы получить медаль Дэви, Дмитрий Иванович послал телеграмму, в которой, помимо прочего, написал в духе Ломоносова, что мир ещё узнает российских ньютонов, дальтонов или дэви. Сейчас мы можем констатировать, что это произошло. И имя Менделеева стало одним из первых в этом ряду.
История периодического закона служит символом взаимопроникновения наук, особенно химии и физики. Здесь особенно ярко проявилась справедливость слов М.В. Ломоносова: “Химик без знания физики подобен человеку, который всего искать должен ощупью. И сии две науки так соединены между собой, что одна без другой в совершенстве быть не могут” [5, с. 269].
Список литературы
Менделеев Д.И. Соч. Т. 25. Л.–М.: Изд-во АН СССР, 1952.
Чугаев Л.А. Дмитрий Иванович Менделеев: Жизнь и деятельность. Л.: Науч. хим.-технич. изд-во, 1924.
Менделеев Д.И. Периодический закон / Редакция, статья и примечания Б.М. Кедрова. М.: Изд-во АН СССР, 1958. С. 470–517.
Семишин В.И. Периодическая система химических элементов Д.И. Менделеева. М.: Химия, 1972.
Ломоносов М.В. О воспитании и образовании. М.: Директ-Медиа, 2014.
Дополнительные материалы отсутствуют.





