Вестник РАН, 2022, T. 92, № 11, стр. 1076-1087
ИССЛЕДОВАНИЯ СТРУКТУРНОЙ ОРГАНИЗАЦИИ И ЭКСПРЕССИИ ГЕНОМА ЖИВОТНЫХ
ДОКЛАД ЛАУРЕАТА БОЛЬШОЙ ЗОЛОТОЙ МЕДАЛИ ИМЕНИ М.В. ЛОМОНОСОВА РАН 2021 ГОДА
a Институт биологии гена РАН
Москва, Россия
* E-mail: georgiev@genebiology.ru
Поступила в редакцию 11.05.2022
После доработки 27.06.2022
Принята к публикации 20.07.2022
- EDN: HXLAXW
- DOI: 10.31857/S0869587322110056
Аннотация
Автором открыта информационная РНК животных клеток и разработан метод её выделения в чистом виде. Установлено, что она имеет тот же нуклеотидный состав, что и ДНК (дРНК). В состав ядерной дРНК входит как новообразованный предшественник мРНК, пре-мРНК, так и зрелая мРНК. Пре-мРНК имеет существенно более высокий молекулярный вес, чем мРНК. Содержание дРНК составляет от 1/3 до 1/2 всей ядерной РНК. Раскрыта организация ядерных нуклеопротеидных комплексов, содержащих дРНК: длинная молекула дРНК намотана на поверхность серии глобулярных мультибелковых частиц (информоферов), соединённых мостиками РНК. На один информофер приходится отрезок РНК длиной в 700 нуклеотидов. Эта ранее неизвестная структура нуклеопротеидов обеспечивает резкое сокращение линейных размеров РНК при сохранении её доступности для разных белковых факторов. В ходе дальнейших исследований открыты мобильные генетические элементы животных. Установлено, что практически все умеренные повторы генома, то есть около 10% последнего, являются мобильными элементами разных размеров. Выявлены и охарактеризованы два основных типа мобильных элементов дрозофилы и мыши.
Начало описываемым ниже работам было положено в 1959 г., когда я работал младшим научным сотрудником у прекрасного учёного и человека И.Б. Збарского11 в Институте морфологии животных им. А.Н. Северцова АН СССР. После защиты мною в том же году кандидатской диссертации Илья Борисович великодушно предоставил мне полную научную самостоятельность, и я решил исследовать РНК клеточного ядра.
Открытие и характеристика ядерной информационной РНК животных. К тому времени схема передачи генетической информации (ДНК→РНК→ белок) стала общепринятой и не вызывала сомнений. Однако, как показали А.С. Спирин22 и А.Н. Белозёрский33, между нуклеотидным составом ДНК и РНК разных видов бактерий не наблюдалось соответствия. Соотношение Г+Ц/А+Т44 в ДНК варьировало в широких пределах, а в РНК соотношение Г+Ц/А+У оставалось консервативным. Отсюда следовал вывод, что большая часть РНК не могла участвовать в переносе информации от ДНК к белку.
Предполагалось, что эту функцию способна осуществлять особая фракция РНК. В ядре клетки содержится практически вся ДНК, и там же, как считалось, идёт синтез РНК. Поэтому я ожидал, что изучение ядерной РНК может дать ответ на многие вопросы, касающиеся переноса генетической информации.
С моей сотрудницей В.Л. Мантьевой, позднее кандидатом биологических наук, мы приступили к исследованию РНК клеточного ядра. Основная трудность состояла в том, что в ходе выделения и фракционирования ядер РНК обычно деградировала под действием рибонуклеаз, и определить её истинные свойства не удавалось.
Высокополимерную, недеградировавшую РНК тогда получали прямо из клеток, обрабатывая клеточную суспензию фенолом. После встряхивания и центрифугирования в пробирке выявлялись три основных слоя. Верхний, водная фаза, содержал РНК, нижний, фенольный – почти все белки, а между ними образовывался промежуточный слой. Однажды я сделал мазок из этого слоя, покрасил препарат на ДНК и РНК и с помощью микроскопии обнаружил, что он состоит из сохранившихся клеточных ядер, содержавших хроматин и ядрышки [1]. Сразу понял, что такие “фенольные ядра” – ключ к получению ядерной РНК, поскольку фенол подавляет активность всех ферментов, включая рибонуклеазы (РНКазы).
Далее был разработан метод получения РНК из фенольных ядер путём их обработки в смеси 0.14 М NaCl–фенол при температуре 60°С. Эта РНК при выделении не деградировала и имела высокий молекулярный вес. При короткой инкубации клеток с радиоактивным предшественником РНК (обычно фосфатом 32Р) она метилась гораздо сильнее остальной РНК, то есть представляла собой новообразованную РНК клетки. Что особенно интересно, её нуклеотидный состав оказался промежуточным между ДНК и изученной к тому времени рибосомальной РНК (рРНК) – доминирующей РНК клетки. Соотношение Г+Ц/А+Т(У) составляло для ДНК 0.7, для рРНК – 1.6, а для ядерной РНК – 1.1–1.2 [2]. Исходя из этих данных, я предположил, что в ядре содержатся по меньшей мере два типа высокополимерной РНК: рРНК и РНК сходная по составу с ДНК (дРНК), или информационная РНК.
Мы провели опыты по фракционированию ядерной РНК. Первый же эксперимент по проверке гипотезы дал ожидаемый результат. Две полученные фракции РНК (экстрагируемая и неэкстрагируемая в смеси фенол–раствор п-аминосалицилата) различались по нуклеотидному составу. Одна приближалась к рРНК, Г + Ц/А + У = = 1.4, другая – к ДНК – 0.9. Хотя метод и не был ещё доведён до совершенства и две РНК были явно не очень чистыми, вывод из эксперимента следовал однозначный – в клеточном ядре содержатся два разных типа высокополимерной РНК, один из которых представляет собой РНК, сходную по нуклеотидному составу с ДНК (дРНК), потенциально информационную РНК. Сообщили о результате в 1961 г. [2], а публикация вышла в январе 1962 г. [3].
В 1961 г. французские микробиологи Ф. Жакоб и Ж. Моно55 опубликовали статью, в которой на основании изучения биосинтеза белка у бактерий сделали вывод, что в бактериях должна присутствовать небольшая фракция информационной РНК или мРНК (messenger RNA – mRNA), переносящей информацию от ДНК к белку [4]. Начались поиски этой РНК у бактерий, и результаты работ были опубликованы в том же году. К сожалению, зарубежные научные журналы поступали к нам тогда с большим опозданием, и мы об этих результатах узнали много позднее.
Далее последовала разработка более совершенного метода фракционирования. Им оказалась последовательная обработка “фенольных ядер” смесью 0.14 М NaCl – фенол при ступенчато повышающихся температурах [5]. При 40°С в водный раствор переходила чистая ядерная рРНК, при 55°С – смесь рРНК и дРНК, а при 65°С – РНК с нуклеотидным составом, полностью совпадавшим с нуклеотидным составом ДНК (Г + Ц/А + У = 0.7), то есть чистая дРНК (табл. 1). Хотя западная публикация о бактериальной мРНК вышла чуть раньше, мы впервые обнаружили информационную РНК у животных (эукариот) и, что особенно важно, впервые получили информационную РНК в чистом виде.
Таблица 1.
Фракционирование ядерной РНК на рРНК и дРНК
| Фракция | Г | Ц | А | У | Г + Ц/А + У(Т) |
|---|---|---|---|---|---|
| ДНК мыши | 21 | 21 | 29 | 29 | 0.72 |
| Рибосомная РНК мыши | 32 | 30 | 19 | 19 | 1.63 |
| Цитоплазматическая РНК, 4°С | 32 | 30 | 20 | 18 | 1.63 |
| Ядерная РНК, 4–40°С | 32 | 29 | 20 | 19 | 1.56 |
| Ядерная РНК, 55–65°С | 23 | 20 | 28 | 29 | 0.76 |
| Новообразованная РНК, 55–65°С | 21 | 20 | 29 | 30 | 0.7 |
Вскоре после защиты в 1962 г. докторской диссертации я получил приглашение от Владимира Александровича Энгельгардта66 возглавить лабораторию в созданном им в 1959 г. Институте радиационной и физико-химической биологии АН СССР (с 1988 г. Институт молекулярной биологии им. В.А. Энгельгардта). Это резко увеличило наши экспериментальные возможности, прежде всего благодаря доступу к ультрацентрифуге Spinco, что позволило характеризовать РНК с помощью ультрацентрифугирования в сахарозном градиенте.
Первым делом мы определили размеры ядерной РНК в полученных фракциях, причём не только тотальной РНК фракции, но и новообразованной РНК. Ее выявляли как РНК, в которую включился радиоактивный предшественник (32Р-фосфат) за короткое время инкубации с ним клеток. Использование 32Р позволяло также определять и нуклеотидный состав новообразованной РНК. Во всех случаях нуклеотидный состав общей и новообразованной РНК фракции совпадали.
Тотальная дРНК имела широкий спектр распределения с константами седиментации от 15S до 80S, то есть была весьма гетерогенной, что и ожидалось для информационной РНК [6]. Эти константы седиментации примерно соответствуют цепям РНК длиной от 1 до 40 тыс. нуклеотидов (1–40 kb).
Важно, что дРНК составляла от трети до половины всей ядерной РНК. С одной стороны, мы могли работать с очищенной дРНК, имея её в миллиграммовых количествах. С другой стороны, высокое содержание дРНК в ядре и очень высокий молекулярный вес, особенно у новообразованной дРНК, указывали на то, что формирование информационной РНК у животных (эукариот) происходит иначе, чем у бактерий, и процесс этот явно сложнее.
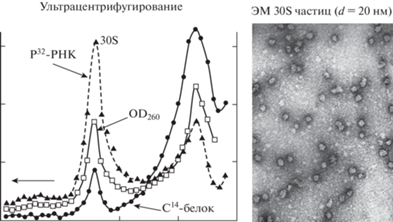
Мы разработали также метод выявления цитоплазматической дРНК по включённой в неё радиоактивной метке (32Р) в условиях подавления синтеза рРНК малыми дозами актиномицина Д. Определение нуклеотидного состава по включению метки в четыре нуклеотида РНК показало, что в этих условиях меченая РНК цитоплазмы представлена дРНК [6]. В результате мы могли сравнивать молекулярные веса дРНК ядра и цитоплазмы. Оказалось, что максимальный молекулярный вес был у ядерной новообразованной дРНК. В тотальной ядерной дРНК он в среднем снижался, а в цитоплазматической дРНК, то есть в зрелой мРНК, был ещё ниже (рис. 1).
Рис. 1.
Свойства ядерной дРНК
а – ультрацентрифугирование в сахарозном градиенте ядерной дРНК из клеток асцитного рака Эрлиха, инкубированных в течение 1 часа с радиоактивным предшественником РНК; б – сравнение молекулярных весов новообразованной ядерной дРНК и зрелой мРНК цитоплазмы с помощью ультрацентрифугирования в сахарозном градиенте; в – гибридизция меченой ядерной дРНК и цитоплазматической мРНК с ДНК. Добавленная немеченая дРНК полностью подавляет гибридизацию, а мРНК только частично ингибирует гибридизацию ядерной дРНК
На основе полученных данных была сформулирована гипотеза, согласно которой в ядре синтезируется высокополимерная РНК-предшественник зрелой мРНК. В ядре же происходит её частичный распад и снижение молекулярного веса вплоть до характерного для зрелой мРНК. Последняя переносится в цитоплазму, где связывается с рибосомами и направляет синтез белка.
Частичное подтверждение эта гипотеза получила в опытах по гибридизации ДНК с разными типами меченой РНК при конкуренции с немечеными РНК. Оказалось, что немеченая дРНК ядра полностью подавляет гибридизацию мРНК цитоплазмы с ДНК. Напротив, цитоплазматическая мРНК лишь частично подавляла гибридизацию ядерной дРНК. Эти и ряд данных западных авторов подтвердили концепцию. Они были суммированы в обзорах [7, 8], где мы обозначили ядерную дРНК термином пре-мРНК, предшественник мРНК (или pre-mRNA, precursor of mRNA).
Через 2–3 года после нашего открытия ядерной информационной РНК появились зарубежные работы по ядерной дРНК [9, 10]. Как это нередко бывает, западные учёные для претензии на приоритет дали ей новое название – hnRNA (he-terogeneous nuclear RNA). Впрочем, в наши дни снова в ходу термин pre-mRNA.
Итак, на первом этапе работы мы открыли ядерную информационную РНК подобную по нуклеотидному составу ДНК (дРНК), получили её в чистом виде и описали ряд ее свойств. Из наших опытов с большой долей вероятности вытекало, что в ядре, где содержание дРНК очень высоко, идёт сложный процесс её превращения в мРНК. У бактерий такой процесс вообще отсутствует, у них ещё до окончания синтеза мРНК с ней связываются рибосомы, и начинается синтез белка. У животных (эукариот) белок в ядре не синтезируется, но зато идёт процесс перестройки и частичного распада вновь синтезированной РНК и транспорт зрелой мРНК в цитоплазму.
Открытие ядерных частиц, содержащих пре-мРНК и нового типа организации нуклеопротеидов. Далее наш поиск развивался в двух направлениях. Одно из них – попытка ответа на вопрос, в каком виде дРНК присутствует в клеточном ядре. Эти исследования мы вели с О.П. Самариной, затем к ней присоединился Е.М. Луканидин (оба, позднее, доктора биологических наук). Начали с разработки метода выделения содержащих дРНК нативных комплексов. При последовательной экстракции полученных обычным методом ядер печени крысы растворами 0.14 M NaCl, 1 мМ MgCl2, 10 мМ tris с повышающимся рН (от 7 до 8) удалось получить экстракт, содержащий всю ядерную дРНК и не содержащий рРНК. При ультрацентрифугировании в сахарозном градиенте вся дРНК выявлялась в составе одного гомогенного пика с константой седиментации 30S. При электронной микроскопии материала 30S пика были видны частицы диаметром около 20 нм (рис. 2). Выделенная из 30S частиц РНК имела низкий молекулярный вес, что указывало на её деградацию в процессе выделения частиц [11, 12]. Незадолго до нашей публикации вышла статья А.С. Спирина с соавторами [13] о цитоплазматических частицах (информосомах), содержащих мРНК, но позднее оказалось, что они имеют совершенно иные структуру и функции.
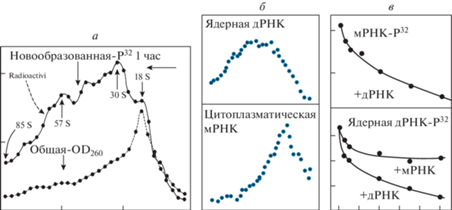
Мы предположили, что 30S частица – это основной составной компонент более крупных частиц. Чтобы понять истинную структуру рибонуклеопротеидов, содержащих пре-мРНК (сокр. пре-мРНП), мы стали искать ингибитор РНКазы. Остановились на белковом ингибиторе из цитоплазмы печени крысы, выделили его и добавили во все растворы, используемые для изоляции ядер и экстракции пре-мРНП. Результат превзошёл ожидания [14]. Вместо 30S пика выявилась серия пиков: 30S, 45S, 57S и т.д. вплоть до материала с константами седиментации более 100S. Максимальное количество материала открывалось в зоне 60–80S. При мягкой обработке РНКазой весь материал количественно переходил в 30S пик (рис. 3).
Рис. 3.
Выделение и характеристика нативных комплексов, содержащих ядерную дРНК с помощью ингибитора РНКазы
Слева и вверху – два эксперимента по ультрацентрифугированию дРНП в сахарозном градиенте. Материал из эксперимента, приведённого вверху, брали для выделения и анализа РНК, электронной микроскопии и определения плавучей плотности в CsCl
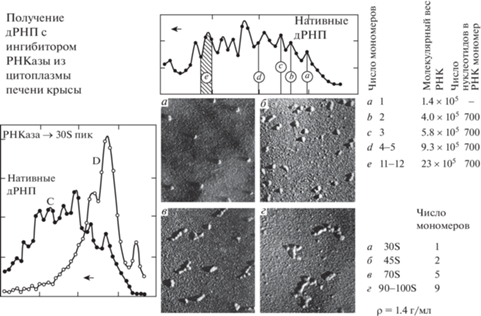
С помощью электронного микроскопа в 30S пике выявлялись частицы диаметром 20 нм, в 45S пике – димеры этих частиц, в 75S пике – преимущественно пентамеры, в 100S зоне – протяжённые мультимеры. Соотношение РНК/белок во всех компонентах оказалось одинаковым, равно как и белковый состав, выявляемый с помощью электрофореза. Наконец, молекулярный вес РНК возрастал пропорционально увеличению числа мономеров. На один мономер приходился отрезок РНК длиной примерно в 700 нуклеотидов [14].
Таким образом, выяснилось, что пре-мРНП – это цепочки из мономеров, 30S частиц, соединённых мостиками РНК. Оставался вопрос о том, как устроена 30S частица, где в ней располагаются РНК и белки. Мы получили 30S частицы, содержащие меченую 14С РНК, и дополнительно метили их белки in vitro с помощью 125I. Обрабатывали частицы 2 М NaCl и проводили ультрацентрифугирование. РНК и белок диссоциировали. Вся РНК оказывалась в верхней части пробирки из-за низкого молекулярного веса, а белок оставался в зоне 30S. При использовании электронного микроскопа было видно, что частицы практически не изменялись, сохраняя свой диаметр 20 нм. При добавлении к белковым частицам дРНК и удалении диализом 2 М NaCl восстанавливались рибонуклеопротеидные 30S частицы, по всем свойствам не отличимые от исходных. Если РНК имела бо́льший молекулярный вес, можно было получить димеры и даже тримеры [15] (рис. 4).
Рис. 4.
Диссоциация РНК и белков 30S частиц в 2М NaCl
Слева – ультрацентрифугирование 30S частиц и свободных информоферов в сахарозном градиенте и градиенте CsCl. Справа сверху – электронная микроскопия 30S частиц и свободных информоферов. Справа внизу – модель структуры 30S частиц и их диссоциации на РНК и свободные информоферы с последующей реконструкцией 30S дРНП
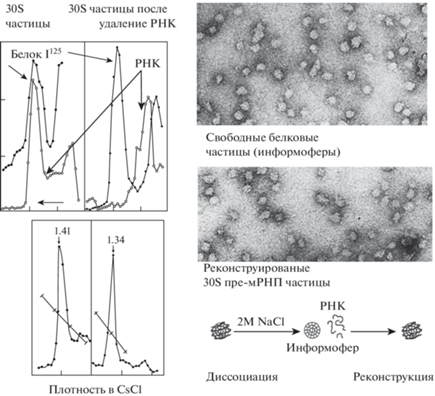
Результаты экспериментов по снятию и посадке РНК на белковые глобулы указывали на то, что РНК располагаются на поверхности белковых глобул. Мы предложили для обозначения последних термин “информоферы”, то есть переносчики информационной РНК.
Наконец, мы определили, на каких этапах транспорта пре-мРНК связана с информоферами. Оказалось, что этот комплекс образуется сразу, как только РНК синтезируется, и сохраняется на всех последующих этапах ядерного транспорта. Ядерная информационная РНК связана с информоферами на этапах её превращений от пре-мРНК до зрелой мРНК. Лишь при транспорте мРНК через ядерную мембрану комплекс диссоциирует. Белки информоферов полностью остаются в клеточном ядре. Эти и другие данные суммированы в обзорах [8, 16].
Итак, была установлена организация ядерных частиц – длинная цепь РНК, намотанная на серию белковых глобулярных частиц (информоферов). Такая организация имеет двойное значение. С одной стороны, в 15–20 раз сокращаются линейные размеры РНК. Учитывая очень большую длину пре-мРНК, вплоть до 20 мкм, этот первичный уровень упаковки цепи РНК крайне важен. С другой стороны, РНК, расположенная на поверхности белковой глобулы, остаётся доступной для взаимодействия с различными белковыми факторами, обеспечивающими её созревание в мРНК и транспорт из ядра в цитоплазму.
Иными словами, был открыт новый тип организации нуклеопротеидов, важный, когда надо сократить линейные размеры нуклеиновой кислоты, сохранив её доступность для регуляторных факторов. Неудивительно, что такая же организация была позднее обнаружена другими исследователями и в случае нуклеопротеидов хроматина. Структура построенной по тому же принципу нуклеосомы сокращает линейные размеры ДНК в 6–7 раз, но при этом позволяет сохранять её доступность для белковых факторов, контролирующих транскрипцию и репликацию.
Интересно, что оба термина – наш термин “информоферы” и “информосомы”, предложенный А.С. Спириным, на Западе приняты не были, хотя результаты наших работ намного обогнали зарубежные исследования, получив там подтверждение лишь через несколько лет.
Открытие и характеристика мобильных генетических элементов в геноме животных (дрозофилы). Второе направление изучения ядерной пре-мРНК – попытка выяснить, как же устроен ген. Почему синтезируемая на его матрице пре-мРНК намного длиннее, чем кодирующая белок мРНК?
Здесь надо несколько отвлечься. В 70-е годы уже было хорошо известно, что в геноме эукариот значительная часть ДНК приходится на так называемые повторяющиеся последовательности разной длины, или повторы. Почти все гены представлены одной или немногими копиями. По общему мнению, повторы представляли собой некодирующую ДНК. Действительно, один класс повторов состоит из множества коротких последовательностей длиной в несколько нуклеотидов. Однако на них приходится более 10% генома. Они, концентрируясь в немногочисленных блоках, выполняют структурные функции.
Другой тип повторов – “умеренные повторы”. Они представлены в количестве от десятков до тысяч копий, рассеянных по геному. Умеренные повторы имеют различные размеры, от нескольких сотен до нескольких тысяч пар нуклеотидов. Их функция оставалась неясной.
Я предположил, что умеренные повторы являются регуляторными элементами, с которыми связываются белки, контролирующие транскрипцию. Согласно гипотезе, эти повторы располагались в начальной части гена. Содержащая их зона транскрибировалась и входила в пре-мРНК. Первые опыты по проверке гипотезы дали неоднозначные результаты. Тогда мы решили попытаться изучить структуру генов на модели дрозофилы, лучшем объекте для генетических исследований в то время. Кстати, в 1976 г. появилась технология клонирования генов, разработанная в США. Я обратился к одному из главных её разработчиков, Р. Дэвису, с просьбой прислать нужный для клонирования бактериофаг и вскоре получил его с любезным разрешением передавать его и другим учёным в СССР.
В результате мы в короткий срок создали библиотеку клонов генома дрозофилы. Идея эксперимента была проста – выявить клоны, содержащие последовательности, кодирующие мРНК, и одновременно содержащие умеренные повторы. Далее можно было исследовать их взаимное расположение, а потом и функцию. В работе приняли участие мои сотрудники Ю.В. Ильин (академик РАН с 1992 г.) и Н.А. Чуриков (позднее доктор биологических наук), а также сотрудники Института молекулярной генетики АН СССР В.А. Гвоздев (академик РАН с 2006 г.) и Е.В. Ананьев (позднее доктор биологических наук).
Мы выявили серию клонов, ДНК которых гибридизировалась с мРНК и с умеренными повторами ДНК, то есть отвечала поставленным требованиям. ДНК полученных клонов нарезали на фрагменты и гибридизировали с мРНК или с ДНК повторов, пытаясь их разделить. Однако обе зоны совпадали, то есть повторами оказывались сами кодирующие мРНК гены [17, 18]. Этот результат фактически опровергал проверяемую гипотезу.
Вопрос о структуре генов высших эукариот вскоре был решён в работах иностранного лауреата Большой золотой медали имени М.В. Ломоносова РАН 2021 г. Ричарда Робертса (Великобритания), а также Филиппа Шарпа77 (США). Ими показано, что гены в составе генома разорваны, то есть в ДНК участки, кодирующие белки, которые затем входят в состав мРНК, чередуются с некодирующими участками. Последние удаляются из пре-мРНК и в мРНК уже не входят. Кодирующие сегменты были названы экзонами, некодирующие – интронами. Таким образом, пре-мРНК включает в себя копии и экзонов, и интронов. Далее интроны вырезаются, а концы экзонов соединяются. Поскольку интроны обычно более протяжённые, то молекулярный вес у пре-мРНК гораздо выше, чем у мРНК. Процесс вырезания интронов обозначается термином “сплайсинг”. Такую структуру гена никто не мог предположить. Она выявилась в результате экспериментов по изучению структуры аденовирусной мРНК. Стало ясно, почему пре-мРНК имеет значительно больший молекулярный вес, чем мРНК.
Несмотря на то, что выполнение нашей программы привело к отказу от проверяемой гипотезы, хорошо продуманные эксперименты способствовали открытиям в смежной области, как это часто случается в науке. Прежде всего большой интерес представлял сам факт, что в геноме животных содержится целый ряд ранее неизвестных повторяющихся генов, которые рассеяны по геному и на которых синтезируется мРНК. Сразу возник вопрос о природе этих генов.
Основной результат был достигнут при изучении локализации ДНК полученных клонов в хромосомах путём её гибридизации с политенными хромосомами дрозофилы [17, 18]. У насекомых в некоторых типах клеток удвоение ДНК не сопровождается делением клетки. В результате хромосомы не расходятся на две, а становятся многонитчатыми, политенными. Число параллельных нитей ДНК в политенной хромосоме достигает нескольких тысяч. Их структура хорошо видна в обычный микроскоп. Они состоят из дисков и междисков, то есть компактных и декомпактизованных участков, которые детально изучены. Отметим здесь, что гомологичные политенные хромосомы дрозофилы сливаются, так что видны такие спаренные хромосомы. Наряду с этим иногда на некоторых участках слияния хромосом не происходит, и на небольшом протяжении гомологичные хромосомы, происходящие от двух родителей, расходятся.
Мы проводили гибридизацию ДНК клонов с политенными хромосомами. Выявилось, что клоны действительно содержат повторы, представленные десятками копий, рассеянных по всему геному. При этом обнаружился очень интересный факт. В тех участках, где гомологичные хромосомы расходились, тоже выявлялись повторы, гибридизирующиеся с ДНК клонов. Однако многие из них имеют разную локализацию в гомологичных хромосомах (рис. 5 а,б). Следовательно, у материнской и отцовской хромосомы одни и те же повторы располагаются в разных местах. Тогда была изучена локализация ДНК наших клонов с хромосомами большого числа мух и удалось показать, что у разных особей она варьирует в широких пределах [18, 19]. У мух одной линии различия были менее выражены, а мухи из разных линий различались по большинству положений повторов (рис. 5в). Мы сразу предположили, что проклонировали не обычные гены, а мобильные генетические элементы [18].
Рис. 5.
Гибридизация мдг1 с политенными хромосомами дрозофилы
Использовали политенные хромосомы гетерозиготы gtwa × gt13z: а – окрашенный препарат, б – тот же препарат, не окрашенный, стрелками указаны некоторые места, где выявлена различная локализация мдг1 в гомологичных хромосомах в неспаренных участках; в – различия в локализации мдг1 у разных особей дрозофилы: слева – две особи, взятые из разных генетических линий дрозофилы, справа – из одной и той же линии. Вертикальные линии – три хромосомы дрозофилы (Х, 2-я и 3-я). Горизонтальные отрезки – места мдг1. Указаны места, где локализация мдг1 совпадает у двух особей

Мобильные элементы, или прыгающие гены, были открыты американским учёным-цитогенетиком Барбарой Мак-Клинток в кукурузе ещё в 1940-х годах с помощью чисто генетических методов. Работа поначалу не снискала широкого признания и лишь в 1983 г., после получения убедительных результатов молекулярных исследований её автор была удостоена Нобелевской премии. До нашей работы мобильные гены были найдены ещё и у бактерий, где их оказалось немного.
Теперь (1977 г.) подвижные гены были нами впервые обнаружены у животных с помощью молекулярных методов. Что особенно важно, мобильные элементы у дрозофилы, в отличие от бактерий, составляют значительную часть генома. На три первых полученных нами мобильных гена приходилось около 1% всей ДНК. Учитывая же общее содержание умеренных повторов, можно было ожидать, что доля мобильных элементов составляет около 10% генома дрозофилы. Так оно далее, по мере описания разными научными группами новых мобильных элементов, и оказалось. Мы назвали первые обнаруженные элементы мобильными диспергированными генами (сокр. мдг) – мдг1, мдг3 и мдг4.
Далее мы исследовали структурную организацию трёх проклонированных мдг [20]. Их размеры варьировали в пределах 5–10 kb, а каждый из них содержал ряд функционально значимых последовательностей. Во-первых, по краям мдг находились короткие повторы длиной в несколько нуклеотидов. Эти повторы представляли собой дупликацию последовательности того участка генома дрозофилы, куда встроился мдг. Такие дупликации прямо указывают на внедрение в геном нового фрагмента ДНК. Во-вторых, уже в самом мдг, в его начале и на конце, расположены однонаправленные длинные концевые повторы (ДКП) размером от 250 до 600 нуклеотидных пар. В них находятся отрезки, отвечающие за начало транскрипции, промоторы РНК полимеразы II. ДКП также содержат сайты для завершения транскрипции, ее терминацию и полиаденилирование мРНК. Промоторы расположены несколько ближе к началу мдг. В результате при транскрипции синтезируется полная копия мобильного элемента с коротким повтором на концах. Есть ещё ряд характерных последовательностей как в составе ДКП, так и в других участках мдг. Между ДКП находится основная часть мдг длиной порядка 5–6 kb. В ней расположены участки, кодирующие белки (рис. 6).
Рис. 6.
Общая структурная организация мдг на примере мдг1 (приведена только одна цепь ДНК, соответствующая основному транскрипту)
а – общая организация мдг1, видны дупликация отрезка генома по краям мдг1 (для двух разных копий), нуклеотидная последовательность несовершенного обращённого повтора на концах ДКП (LTR – long terminal repeat), участок гомологии с концом тРНК и олигопуриновый блок; б – нуклеотидная последовательность ДКП: выделен жирным шрифтом и подчёркнут промотор РНК-полимеразы II, выделен жирным шрифтом, курсивом и подчёркнут сигнал полиаденилирования (область терминации транскрипции), подчёркнуты обращённые повторы на концах ДКП

Особенно важно, что точно такая же структура была обнаружена ранее для интегрированных в геном хозяина копий ретровирусов (к ним относятся, в частности, многие онкогенные вирусы и вирус СПИДа). Геном ретровирусов представлен не ДНК, а РНК. В клетке на матрице РНК синтезируется (при участии фермента обратной транскриптазы) ДНК, которая может встроиться в геном клетки. Затем на её матрице синтезируются как полноразмерная вирусная РНК, так и более короткие мРНК, обеспечивающие синтез белков вируса. Среди них – обратная транскриптаза, необходимая для синтеза ДНК на матрице РНК, а также белки вирусных частиц. Последние связываются с полноразмерной РНК и образуют зрелые вирусы.
Полное совпадение структурной организации мдг и интегрированных в геном ретровирусов указывало на их генетическое родство, а также на механизм перемещения мдг: синтез полноразмерной РНК, синтез на её матрице ДНК с помощью обратной транскриптазы и внедрение копии ДНК в новый участок генома. ДКП играют важную роль в правильной транскрипции и обратной транскрипции мдг.
Все этапы встраивания мдг на новое место в геноме были однозначно продемонстрированы Ю.В. Ильиным уже без моего участия в его собственной лаборатории. Из клеток дрозофилы ему удалось выделить и охарактеризовать все промежуточные продукты, образующиеся в ходе этого сложного процесса [21]. Подробное описание работ по мдг дрозофилы можно найти в обзорах [22–24].
Скорее всего, мдг в геноме возникли в результате инфицирования ретровирусами. После прекращения образования вирусных частиц внедрившиеся в геном копии ДНК сохранили тем не менее способность к перемещению в геноме. Для этого необходимо, чтобы хотя бы часть мдг продолжала кодировать активную обратную транскриптазу. Гены для синтеза белков вирусных частиц представлены в них дефектными копиями. Поэтому мдг не способны образовывать зрелые вирусы.
После открытия мдг, или мобильных элементов ретровирусного типа, на Западе был выявлен другой тип мобильных элементов, названный LINE. По своей генетической организации они сходны с мдг, но не содержат длинных концевых повторов. Их перемещение, по-видимому, тоже происходит через обратную транскрипцию. Мдг и LINE имеют, вероятно, общее происхождение.
Итак, была решена загадка природы умеренных повторов в геноме, по крайней мере, протяжённых повторов. Столь широкое распространение мобильных элементов в геноме тоже никто не мог предсказать. Оно обнаружилось при проведении поставленных с другой целью экспериментов.
Открытие коротких генетических элементов В1 и В2 в геноме млекопитающих (мыши). Параллельно с детальным изучением мобильных элеменов дрозофилы мы с А.П. Рысковым (член-корреспондент РАН с 1994 г.) и Д.А. Крамеровым (позднее доктор биологических наук) начали исследование повторяющихся последовательностей в геноме млекопитающих, в частности, мыши. У млекопитающих существует два типа рассеянных по геному повторов – длинные (5–10 kb) и короткие (100–300 пар оснований). К этому моменту уже стало ясно, что у мыши длинные рассеянные по геному повторы – это, как и у дрозофилы, мобильные элементы. Большинство из них относилось к типу LINE. Поэтому мы сосредоточились на исследовании коротких повторов, природа которых оставалась неясной. Проклонировали фрагменты ДНК, содержащие короткие повторы, и с помощью гибридизации определили, сколько разных типов повторов содержится в наших клонах. Оказалось, что во всех изученных клонах присутствуют только два типа последовательностей, обозначенных нами как В1 и В2. Число копий В1 и В2-повторов на геном мыши составляло более 200 тыс. Следовательно, на эти короткие повторы приходилось более 2% всей ДНК мыши [24].
Вскоре за рубежом сходная работа была проведена с ДНК человека. Там выявился только один тип коротких повторов, названных Alu-последовательностями, тоже представленными сотнями тысяч на геном. В итоге выяснилось, что геном млекопитающих буквально нафарширован однотипными короткими повторами, неслучайно их стали называть вездесущими.
Чтобы понять природу В1 и В2, мы определили их нуклеотидную последовательность (рис. 7а). Оказалось, что они содержат ряд функционально значимых фрагментов. Так, в них имеются два участка гомологии с промотором для РНК полимеразы III, а также сайт терминации транскрипции РНК полимеразой III на конце элементов. В составе В2 также присутствует последовательность, необходимая для полиаденилирования РНК. Эти данные указывали на возможность независимой транскрипции В1 и В2. Наконец, по краям геномных копий В1 и В2 обнаружились короткие дупликации геномной ДНК. Как уже отмечалось, подобные дупликации присутствуют по краям инсерций, то есть фрагментов ДНК, внедрившихся в геном. Полученные результаты позволили предположить, что короткие повторы также являются мобильными элементами [25, 26].
Рис. 7.
Организация В1 и В2 последовательностей и транскрипция В2
а – общая организация: заштрихованные блоки – дупликация геномной последовательности, сплошные блоки – промотор РНК-полимеразы III, T – сайты полиаденилирования, t – сайт терминации РНК-полимеразы III, A-rich – область, обогащённая А; б – транскрипты, содержащие В2-РНК. Из клеток асцитного рака Эрлиха, инкубированных с 32Р, выделяли цитоплазматическую (1, 2) и ядерную (3, 4) поли(А)+РНК. В части опытов подавляли транскрипцию с участием РНК-полимеразы II (2, 3). После гель-электрофореза отбирали В2-РНК контактной гибридизацией с В2-ДНК. Видно, что в ядре и цитоплазме присутствует 32Р В2-РНК. Однако синтез всей высокомолекулярной РНК зависит от РНК-полимеразы II, тогда как короткая В2-РНК (копия В2 повтора) синтезируется РНК-полимеразой III
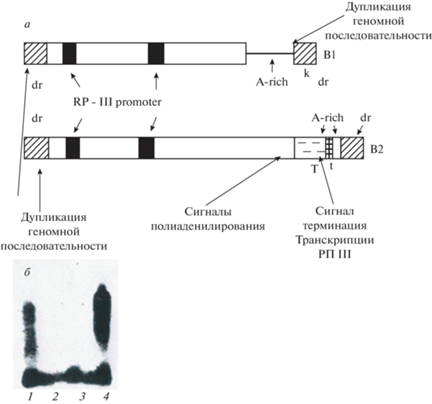
Транскрипты, содержащие В1 и В2, представлены двумя типами РНК: короткими и длинными (рис. 7б). При подавлении активности РНК-полимеразы II остаются только короткие транскрипты. Среди них доминирует В2-РНК. Короткие В2-транскрипты гомогенны и соответствуют самим В2-повторам. Они синтезируются с помощью РНК-полимеразы III и затем полиаденилируются. Именно короткие В2-РНК, вероятно, участвуют в синтезе ДНК путём обратной транскрипции и внедрения ДНК копии на новое место в геноме. Естественно, из-за малых размеров короткие В2-РНК не могут кодировать какие-либо белки, но обратная транскриптаза может синтезироваться длинными мдг или LINE.
Длинные транскрипты, содержащие В1 и В2-повторы, весьма гетерогенны. Они синтезируются РНК полимеразой II и входят в основном в состав интронов. Однако часть из них выявляется в концевых экзонах, где они обеспечивают терминацию транскрипции [27, 28].
Наконец, оказалось, что, вопреки распространённому мнению, короткие повторы присутствуют и в геноме дрозофилы: Н.А. Чуриков с соавторами описали такой повтор, названный “суффиксом”, поскольку он часто присутствовал на концах ряда обычных генов. По своим свойствам суффикс напоминал В1 и В2, но был представлен значительно меньшим числом копий [29, 30]. Подробное описание коротких мобильных элементов содержится в обзорах [24, 31, 32].
Возникает вопрос, каково биологическое значение присутствия в геноме животных огромного числа мобильных элементов. Согласно популярной точке зрения, мобильные элементы являются “эгоистическими генами”, которые не выполняют никаких функций в геноме, но поддерживают своё существование и даже размножение за счёт наличия у них соответствующих структур. Поэтому их ещё называют “генетическим мусором”. Вероятно, это положение правильно, но лишь отчасти. Дело в том, что благодаря мобильным элементам резко возрастает изменчивость генома, что может сильно ускорять процесс эволюции. Например, их встраивание рядом с геном или в сам ген хозяина способно вызывать его активацию или инактивацию, или приводить к изменению структуры гена и его белкового продукта. Как отмечалось выше, В1 и В2-повторы мыши и “суффикс” дрозофилы часто составляют концевой экзон гена. Интересно, что в опухолях мыши сильно повышена транскрипция В1 и В2-повторов, а также элементов LINE. Наконец, протяжённые мобильные элементы у дрозофилы участвуют в построении теломер хромосом.
Подводя итоги, отмечу следующие основные результаты наших многолетних исследований:
• открытие, изоляция и характеристика ядерной информационной РНК в клетках животных, приведшие к концепции высокополимерного предшественника мРНК (пре-мРНК);
• открытие ядерных частиц, содержащих предшественников мРНК, и установление их структуры, оказавшейся новой структурой нуклеопротеидов;
• открытие в геноме животных и характеристика мобильных генетических элементов разного типа, составляющих существенную часть (порядка 10%) генома.
Список литературы
Георгиев Г.П., Мантьева В.Л. Выделение клеточных ядер фенольным методом и их характеристика // Биохимия. 1960. Т. 25 (1). С. 143–150.
Георгиев Г.П. Рибонуклеиновая кислота хромосомно-ядрышкового аппарата // Биохимия. 1961. Т. 26 (6). С. 1095–1107.
Георгиев Г.П., Мантьева В.Л. О существовании рибонуклеиновой кислоты АУ-типа в хромосомно-ядрышковом аппарате // Вопросы медицинской химии. 1962. № 8. С. 93–94.
Jacob F., Monod J. Genetic regulation mechanism in the synthesis of proteins // J. Mol. Biol. 1961. V. 3. P. 318–356.
Georgiev G.P., Mantieva V.L. The isolation of DNA-like RNA and ribosomal RNA from the nucleolo-chromosomal apparatus of mammalian cells // Biochim. Biophys. Acta. 1962. V. 61. P. 153–154.
Georgiev G.P., Samarina O.P., Lerman M.I., Smirnov M.N. Biosynthesis of messenger and ribosomal ribonucleic acids in the nucleoli-chromosomal apparatus of animal cells // Nature. 1963. V. 200. P. 1201–1294.
Georgiev G.P. The nature and biosynthesis of nuclear RNA fractions // Progr. in Nuucleic Acid Res. and Molecular Biology. Acad. Press., 1967. V. 6. P. 259–353.
Georgiev G.P. Precursor of mRNA (pre-mRNA) and ribonucleoprotein particles containing pre-mRNA // The Cell Nucleus. Acad. Press, 1974. V. 3. P. 67–109.
Scherrer R., Marcaud L., Zajdela F. et al. Patterns of RNA metabolism in a differentiated cell: a rapidly labeled unstable 60S RNA with messenger properties in duck erythroblasts // Proc. Natnl. Acad. Sci. USA. 1966. V. 56. P. 1571–1578.
Warner J., Soeiro R., Birnboim H.C. et al. Identification by zone sedimentation of a heterogeneous fraction separated from ribosomal precursor RNA // J. Mol. Biol. 1966. V. 19. P. 349–356.
Самарина О.П., Асриян И.С., Георгиев Г.П. Выделение ядерных нуклеопротеидов, содержащих информационную рибонуклеиновую кислоту // Докл. АН СССР. Т. 163. С. 1510–1513.
Samarina O.P., Krichevskaya A.A., Georgiev G.P. Nuclear ribonucleoproteins containing messenger RNA // Nature. 1966. V. 210. P. 1319–1322.
Спирин А.С., Белицина Н.В., Айтхожин М.А. Информационная рибонуклеиновая кислота в раннем эмбриогенезе // Ж. общ. биол. 1964. Т. 24. С. 321–338.
Samarina O.P., Lukanidin E.M., Molnar J., Georgiev G.P. Structural organization of nuclear complexes containing DNA-like RNA // J. Mol. Biol. 1968. V. 33. P. 251–263.
Lukanidin E.M., Zalmanzon E.S., Samarina O.P., Georgiev G.P. Structure and function of informofers // Nature (New Biol.) 1972. V. 238. P. 193–198.
Georgiev G.P., Samarina O.P. D-RNA containig ribonucleoprotein particles // Adv. Cell Biol. 1971. V. 2. P. 47–110.
Georgiev G.P., Ilyin Y.V., Ryskov A.P. et al. Isolation of eukaryotic DNA fragments containing structural genes and adjacent sequences // Science. 1977. V. 195. P. 394–397.
Ilyin Y.V., Tchurikov N.A., Ananiev E.V. et al. Studies on the DNA fragments of mammals and Drosophila containing structural genes and adjacent sequences // Cold Spring Harbor Symp. Qant. Biol. 1978. V. 42. P. 959–969.
Ananiev E.V., Gvozdev V.A., Ilyin Y.V. et al. Reiterated genes with variable location in intercalary heterochromatin regions of Drosophila melanogaster polytene chromosomes // Chromosoma. 1978. V. 70. P. 1–17.
Bayev A.A., Krayev A.S., Lyubomirskaya N.V. et al. The transposable element Mdg3 in Drosophila melanogaster is flanked with perfect direct and mismatched inverted repeats // Nucl. Acids Res. 1980. V. 8. P. 3263–3273.
Arkhipova I.R., Mazo A.M., Cherkasova V.A. et al. The steps of reverse transcription of Drosophila mobile genetic elements and U3-R-U5 structure of their LTs // Cell. 1986. V. 44. P. 555–563.
Georgiev G.P., Ilyin Y.V., Chmeliauskaite V.G. et al. Mobile dispersed genetic elements and other middle repetitive sequences in the genome of Drosophila and mouse: transcription and biological significance // Cold Spring Harbor Symp. Qant. Biol. 1981. V. 45. P. 641–654.
Tchurikov N.A., Ilyin Y.V., Skryabin K.G. et al. General properties of mobile dispersed genetic elements in Drosophila melanogaster // Cold Spring Harbor Symp. Qant. Biol. 1981. V. 45. P. 641–654.
Georgiev G.P., Kramerov D.A., Ryskov A.P. et al. Dispersed repetitive sequences in eukaryotic genome and their possible biological significance // Cold Spring Harbor Symp. Qant. Biol. 1983. V. 47. P. 1110–1121.
Krayev A.S., Kramerov D.A., Skryabin K.S. et al. The nucleotide sequence of the ubiquitous repetitive DNA sequence B1 complementary to most abundant class of mouse fold-back RNA // Nucl. Acids Res. 1980 V. 8. P. 1201–1215.
Krayev A.S., Markusheva T.V., Kramerov D.A. et al. Ubiquitous transposon-like repeats B1 and B2 of the mouse genome; B2 sequencing // Nucl. Acids Res. 1982. V. 10. P. 7461–7475.
Kramerov D.A., Tillib S.V., Ryskov A.P., Georgiev G.P. Nucleotide sequence of small polyadenylated B2 RNA // Nucl. Acids Res. 1985. V. 13. P. 6423–6437.
Ryskov A.P., Ivanov P.I., Kramerov D.A., Georgiev G.P. Mouse ubiquitous B2 repeat in polysomal and cytoplasmic poly(A)+RNA: unidirected orientation and 3’-end localization // Nucl. Acids Res. 1983. V. 11. P. 6541–6558.
Tchurikov N.A., Naumova A.K., Zelentsova E.S., Georgiev G.P. A cloned unique gene of Drosophila melanogaster contains a repetitive 3'-end exon whose sequence is present at the 3'-ends of many different mRNAs // Cell. 1982. V. 28. P. 365–373.
Tchurikov N.A., Ebralidze A.K., Georgiev G.P. The suffix sequence is involved in processing the 3'-ends of different mRNAs in Drosophila melanogaster // ENBO J. 1986. V. 9. P. 2341–2347.
Ilyin Y.V., Georgiev G.P. The main types of organization of genetic material in eukaryotes // CRC Critical Reviews in Biochem. 1982. V. 12. P. 237–287.
Georgiev G.P. Mobile genetic elements in animal cells and their biological significance (plenary lecture at the 16th FEBS meeting) // Eur. J. Biochem. 1984. V. 145. P. 203–220.
Дополнительные материалы отсутствуют.