Вестник РАН, 2022, T. 92, № 7, стр. 671-677
ДИФФУЗНЫЕ ПОРАЖЕНИЯ ЛЁГКИХ ПОСЛЕ ПЕРЕНЕСЁННОГО COVID-19
А. В. Аверьянов a, *, О. В. Данилевская a, **
a Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства России
Москва, Россия
* E-mail: averyanovav@mail.ru
** E-mail: danless@mail.ru
Поступила в редакцию 31.01.2022
После доработки 11.02.2022
Принята к публикации 09.03.2022
- EDN: BZCJGF
- DOI: 10.31857/S0869587322070040
Аннотация
В статье проанализированы наиболее частые причины диффузных интерстициальных поражений лёгких у больных, перенёсших COVID-19, часто либо имитирующие его, но имеющие другую природу, либо сохраняющиеся вследствие длительного персистирирования SARS-CoV-2 в нижних дыхательных путях. Авторами предложен диагностический алгоритм, позволяющий в большинстве случаев поставить правильный диагноз, ключевым звеном которого является исследование жидкости бронхоальвеолярного лаважа.
Уже через несколько месяцев после начала пандемии COVID-19 врачи столкнулись со случаями рецидивирующих диффузных интерстициальных процессов в лёгких, клинически, рентгенологически, а часто и лабораторно похожих на острую коронавирусную инфекцию, вызванную SARS-CoV-2. Участью этих пациентов стали повторные госпитализации в ковидные госпитали с многократными курсами этиотропной и иммуносупрессивной терапии, несмотря на отрицательные в большинстве случаев показатели ПЦР-анализа к коронавирусу в мазках из носо- и ротоглотки. Многие больные отвечали на лечение кортикостероидами и антицитокиновыми препаратами, однако после его завершения болезнь возвращалась в прежней форме. У некоторой части пациентов противовоспалительная и иммуносупрессивная терапия не давала эффекта, болезнь либо персистировала, либо прогрессировала, порой приводя к летальному исходу. По мере роста числа переболевших COVID-19 случаев интерстициальных поражений лёгких в постковидном периоде становится всё больше. В данной статье мы анализируем спектр патологических процессов в лёгких, развивающихся после новой коронавирусной инфекции, а также предлагаем диагностический алгоритм, позволяющий в большинстве случаев установить точную причину болезни и назначить правильное лечение.
Опираясь на собственный опыт работы с пациентами с персистирующими диффузными интерстициальными процессами в лёгких в постковидном периоде, приходим к выводу, что их можно разделить на 4 основные группы.
1. Интерстициальные пневмонии, вызванные оппортунистическими возбудителями. Одной из наиболее часто встречавшихся нам оппортунистических инфекций оказалась пневмония, Pneumocystis jirovecii. Причём её возбудитель вызывал интерстициальные поражения не только у лиц с исходным иммунодефититом, но и у некоторых пациентов с тяжёлым течением COVID-19, подвергавшихся мощной, часто длительной и бесконтрольной иммуносупрессии. Клинически болезнь проявлялась фебрильной или субфебрильной лихорадкой, диффузными зонами “матового стекла” (рис. 1), часто с так называемыми воздушными ловушками на компьютерной томограмме грудной клетки, лейко- и лимфопенией, повышением уровня С-реактивного белка и интерлейкина-6 в анализах крови, другими словами, практически полностью повторяя признаки COVID-19. Несколько подобных случаев уже описано в литературе, в том числе протекающих с признаками “цитокинового шторма”, поэтому насторожённость в отношении пневмоцистной пневмонии при рецидивирующем постковидном поражении лёгких непременно должна присутствовать [1, 2]. С появлением высокочувствительных тест-систем для выявления РНК SARS-CoV-2 любой отрицательный результат ПЦР-анализа на COVID-19 у больного с острым диффузным поражением лёгких должен рассматриваться с позиций возможного альтернативного диагноза, в первую очередь – пневмоцистной пневмонии, в том числе у пациентов, первично госпитализируемых в ковидные стационары.
Рис. 1.
Пневмоцистная пневмония, развившаяся через 2 месяца после COVID-19 у длительно лечившегося высокими дозами системных глюкокортикостероидов
Разлитые зоны “матового стекла”, тотально заполняющего паренхиму лёгких. Слева – единичная непоражённая долька (стрелка)

Ещё в начале пандемии мы описали у ВИЧ-инфицированной пациентки случай тяжёлой пневмоцистной пневмонии, по своим проявлениям мимикрирующей под CОVID-19 [3]. Главный метод диагностики указанной инфекции – ПЦР-анализ жидкости бронхоальвеолярного лаважа (БАЛ) к P. jirovecii. Лечение пневмоцистной пневмонии традиционное: высокие дозы триметоприма-сульфаметаксозола в сочетании с системными глюкокортикостероидами.
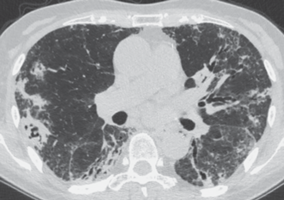
Следующей возможной подгруппой оппортунистических возбудителей постковидных поражений лёгких выступают грибковые инфекции, чаще всего Aspergillus spp. Подозревать такую инфекцию следует у всех больных с признаками вялотекущего воспаления, наличием зон консолидаций в лёгких, окружённых очагами отсева, и особенно в случае постковидных полостей в лёгких (рис. 2). Частота инвазивного аспергиллёза у пациентов с тяжёлым течением COVID-19 достигает 30%, оказываясь одним из факторов негативного прогноза [4], если проблема не была вовремя распознана. В дальнейшем, после выписки из стационара именно пневмомикоз может определять персистирующую картину поражения лёгких. В числе методов диагностики инвазивного аспергиллёза – культуральное исследование мокроты или жидкости БАЛ, определение уровня галактоманнана в крови или жидкости БАЛ, а также ПЦР-тестирование на ДНК аспергилл из бронхиального содержимого, мокроты или БАЛ [5]. В качестве диагностического препарата применим вариконазол.
Рис. 2.
Инвазивный аспергиллез лёгких у больной после тяжёлого COVID-19
В нижней доле правого лёгкого – толстостенная полость с внутриполостными включениями (симптом “погремушки”). Двусторонние фокусы консолидации неправильной формы с обеих сторон, ретикулярные изменения
Инвазивный кандидоз – второе по частоте грибковое осложнение после COVID-19. У пациентов с острой коронавирусной инфекцией выявляют представителей рода Candida – C. albicans, C. tropicalis, C. parapsilosis, C. orthopsilosis и C. Glabrata. В постковидном периоде происходит существенное изменение микробиома кишечника, в нём начинает преобладать кандидозная флора [6]. Её транслокация может вызвать поражение многих органов вплоть до центральной нервной системы [7]. Диагностика лёгочного кандидоза строится на культуральном исследовании жидкости БАЛ, определении антигена маннана (олигосахарида клеточной стенки кандид) и ПЦР-тесте к кандиде в том же субстрате или (1-3)-β-D-глюкана в сыворотке крови. Препаратами выбора для лечения инвазивного кандидоза служат эхинокандины (анидулафунгин, каспофунгин или микафунгин) [8].
Цитомегаловирусная пневмония после перенесённого COVID-19 – более редкий, но возможный случай [9], поэтому ПЦР-тестирование крови и БАЛ на цитомегаловирус, на наш взгляд, следует включать в перечень диагностических тестов при поиске оппортунистов-возбудителей.
Оживление латентных форм туберкулёза после новой коронавирусной инфекции также встречалось в нашей практике, однако этот процесс на компьютерной томограмме грудной клетки обычно проявляется в виде появляющихся очагов, а не диффузных интерстициальных изменений и поэтому менее сложен для диагностики.
Вирус Эпштейна–Барр, относящийся к группе герпес-вирусов, как латентная инфекция присутствует у 90% взрослого населения [10]. У 66% пациентов с сохраняющимися после перенесённого COVID-19 симптомами слабости, бессонницы, головной боли, миалгиями выявлены признаки реактивации этой вирусной инфекции [11]. Нельзя исключить, что упомянутый патоген может играть роль и в персистирующем поражении лёгких в постковидном периоде после иммуносупрессивной терапии, поскольку Эпштейн–Барр- ассоциированные пневмониты ранее были описаны у иммуноскомпрометированных пациентов [12].
2. Ковид-индуцированные васкулиты с поражением лёгких. На сегодня у специалистов сложилось вполне определённое мнение о том, что как SARS-CoV-2, так и противовирусные вакцины способны индуцировать развитие ряда аутоиммунных заболеваний – синдрома Гийена–Барре, аутоиммунных тиреоидитов, аутоиммунной гемолитической анемии, васкулитов [13]. В литературе пока описано всего несколько случаев АНЦА-ассоциированных васкулитов, возникших в краткосрочном периоде после COVID-19 или вакцинации как в форме диффузных альвеолярных геморрагий, так и инфильтративного процесса с полостными образованиями в лёгких [14]. В нашей практике встретились как минимум два пациента с выявленными на компьютерных томограммах признаками двусторонних перибронховаскулярных инфильтратов в лёгких, с персистирующей системной воспалительной реакцией после COVID-19 и вакцинации от SARS-CoV-2 (рис. 3). В обоих случаях исследование крови на антитела к протеиназе-3 и миелопероксидазе позволило поставить правильный диагноз, не прибегая к бронхоскопии и биопсии лёгкого.
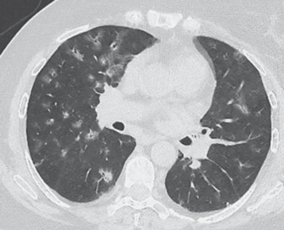
Рис. 3.
АНЦА-ассоциированный васкулит, развившийся в течение 1 месяца после вакцинации от COVID-19
Двусторонние фокусы “матового стекла” и консолидации с перибронховаскулярным распределением
3. Интерстициальное поражение лёгких, вызванное персистенцией SARS-CoV-2. После выхода в свет матаанализа [15] (он был проведён на основании 79 исследований, в которых приняли участие 5340 пациентов) с оценкой жизнеспособности SARS-CoV-2 по результатам анализа биологических культур, стало понятно, что новый коронавирус, во всяком случае его штаммы, вызвавшие первые две волны заболевания, имеют очень короткую активную фазу в организме инфицированного: за пределами 9 дней от начала заболевания не удалось идентифицировать живой вирус ни у одного пациента. Тем не менее есть больные, у которых SARS-CoV-2 может персистировать неделями и даже месяцами, вызывая как общие воспалительные симптомы, так и рецидивирующее интерстициальное поражение лёгких (рис. 4). К ним относятся больные с тяжёлым иммунодефицитом клеточного лимфоцитарного звена, в первую очередь с онкогематологическими заболеваниями, особенно получавшими иммуносупрессивную терапию, прежде всего ритуксимаб, до COVID-19 [16, 17]. Интересно, что у многих таких пациентов ПЦР-тест к SARS-CoV-2 со слизистых верхних дыхательных путей становится отрицательным, но при этом вирусная РНК определяется в жидкости бронхоальвеолярного лаважа или в желудочно-кишечном тракте [18, 19].
Рис. 4.
Персистирующее течение SARS-CoV-2 инфекции в течение 9 месяцев у 25-летнего пациента с В-клеточной лимфомой в анамнезе, завершившего курс лечения ритуксимабом накануне заболевания COVID-19
Двусторонние области “матового стекла” и фрагменты консолидации с субплевральным и перибронховаскулярным распределением

В нашей практике встретилась пациентка с тяжёлой лимфопенией, лихорадкой и рецидивирующими фокусами “матового стекла” по данным компьютерной томографии. В силу невозможности провести БАЛ ей была выполнена пункция костного мозга, в которой ПЦР-тест к новому коронавирусу дал позитивный результат через 5 месяцев после перенесённой острой инфекции. Таким образом, при подозрении на персистирующее течение COVID-19 следует обязательно выполнять ПЦР-тестирование жидкости БАЛ, кала или костного мозга (при наличии лимфопении) на SARS-CoV-2 для подтверждения возможной вирусной инфекции.
Лечение больных с длительно персиситирующей коронавирусной инфекцией – трудная задача. Мы успешно применили у таких пациентов комбинацию плазмообмена (не менее 3-х литров плазмы) с замещением плазмой реконвалесцентов COVID-19 и большой дозы ковид-глобулина. После создания противовирусных моноклональных антител появилась надежда, что такие больные могут быть полностью излечены данными препаратами. Первый такой опыт лечения больного с трёхсотдневным персистированием коронавируса путём подкожного введения антител Regen-COV уже опубликован [16].
4. Ковид-индуцированное интерстициальное заболевание лёгких (КИ-ИЗЛ). По данным первого исследования, ретроспективно оценившего когорту таких пациентов, признаки КИ-ИЗЛ наблюдались у 4.8% выписанных из ковидного стационара больных. Несмотря на то, что эти больные всё чаще и чаще встречаются в пульмонологической клинике, до настоящего времени не сформулировано ни определения болезни, ни единых подходов к их ведению. Опираясь на временно́й фактор болезни, рассмотренный в исследовании [20], мы предлагаем следующее определение: “постковидная интерстициальная болезнь лёгких – персистирующее интерстициальное воспаление в период более 6 недель после перенесённого COVID-19, не связанное с инфекцией, лекарственными или иными экзогенными факторами и системными заболеваниями”. Такой подход требует прежде всего исключения иных возможных причин интерстициальных поражений в постковидном периоде, о которых было сказано выше. Изменения, фиксируемые компьютерной томограммой у больных КИ-ИЗЛ, чаще всего соответствуют паттерну организующейся пневмонии (перибронховаскулярные и субплевральные фокусы консолидации и “матового стекла” (рис. 5), в комбинации нередко образующие признак гало или обратного гало). На втором месте по частоте стоит паттерн клеточного варианта неспецифической интерстициальной пневмонии (области “матового стекла” с умеренными ретикулярными изменениями преимущественно субплеврально тяготеющие к базальным отделам). Гистологически у этих больных также находят признаки организующейся или неспецифической интерстициальной пневмонии со следами перенесённого диффузного альвеолярного повреждения. Основной метод лечения КИ-ИЗЛ предполагает назначение системных глюкокортикостероидов в средних дозах с медленным осторожным их снижением (с учётом контроля оценки диффузионной способности лёгких – главного функционального критерия течения заболевания) [21]. В нашей клинике в дополнение к системным глюкокортикостероидам при КИ-ИЗЛ мы используем короткие курсы циклофосфамида в дозе 200 мг/сутки в течение 3–5 дней. Применяем также ингаляционный сурфактант (75 мг × 3 раза в день) в сочетании с неинвазивной вентиляцией лёгких на время ингаляций или чередуя ингаляцию с дыханием с сопротивлением на выдохе для расправления ателектазированных участков лёгочной ткани.
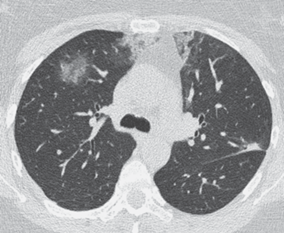
Рис. 5.
Интерстициальное заболевание лёгких, индуцированное COVID-19, у 43-летней пациентки
Рецидивирующие в течение 6 месяцев двусторонние области “матового стекла” и консолидации, полностью исчезающие после приёма системных стероидов. Распределение участков поражения субплевральное и перибронхиальное. Компьютерная томограмма паттерна организующейся пневмонии
Несмотря на наши опасения в начале пандемии по поводу рисков развития тяжёлых фиброзов лёгких после COVID-19, полученный опыт позволяет утверждать, что лёгочный фиброз после новой коронавирусной инфекции – крайне редкое состояние, отмечаемое только у больных, выживших после тяжёлых форм болезни, и не имеющее, в отличие от идиопатического лёгочного фиброза, тенденции к прогрессированию.
Среди других возможных причин интерстициальных поражений лёгких после COVID-19 можно обсуждать болезни, связанные не столько с самой перенесённой вирусной инфекцией, сколько c последствиями терапии. К ним относятся лекарственно-индуцированные интерстициальные заболевания лёгких, которые могут вызвать многие из применяемых препаратов, и альвеолярные геморрагии, как следствие приёма антикоагулянтов. Важнейшим инструментом диагностики, как и в большинстве других случаев постковидных поражений лёгких, служит цитологический анализ бронхоальвеолярного лаважа, в котором находят лимфоцитоз (при лекарственных пневмонитах) или эритроцитоз (при альвеолярных геморрагиях). Хотелось бы подчеркнуть, что цитологический и ПЦР-анализ бронхиальных смывов, часто используемых в рутинной практике вместо БАЛ для ускорения процедуры бронхоскопии, по нашим данным, более чем в половине случаев не позволяет выявить реальных возбудителей и оценить клеточную доминанту постковидной патологии лёгких.
Для дифференциальной диагностики постковидных диффузных поражений лёгких мы используем диагностический алгоритм, представленный на рисунке 6, благодаря ему практически во всех случаях нам удалось поставить точный диагноз. На первом этапе рекомендуем исследование крови на маркеры аутоиммунных заболеваний (антинейтрофильные цитоплазматические антитела, антинуклеарные антитела) и бактериальной инфекции (прокальцитонин). Их позитивный результат чаще всего приближает постановку диагноза без проведения инвазивных процедур. При отрицательном результате дальнейшие действия должны быть основаны на особенностях компьютерной томографии паттерна диффузного процесса в лёгких. Паттерн фиброза (ретикулярные изменения, тракционные бронхоэктазы) без признака “матового стекла” и при отсутствии воспалительных симптомов позволяют приостановить дальнейший диагностический поиск и сосредоточиться на лечении. Если на компьютерной томограмме грудной клетки выявляют воспалительные признаки (“матовое стекло”, консолидация, очаги и прочее), больному показано проведение бронхоскопии и бронхоальвеолярного лаважа со спектром исследований, обсуждавшихся выше. Исключение инфекций и иных более редких причин позволяет дигностировать ковид-индуцированное интерстициальное заболевание лёгких.
Рис. 6.
Диагностический алгоритм при диффузных поражениях лёгких после COVID-19 АНА – антинуклеарные антитела, АНЦА – антинейтрофильные цитоплазматические антитела, БАЛ – бронхоальвеолярный лаваж, ПКТ – прокальцитонин

٭ ٭ ٭
Дифференциальный диагноз диффузных постковидных поражений лёгких – сложная, но решаемая задача. Наиболее частыми причинами продолжающегося после COVID-19 интерстициального процесса в лёгочной паренхиме оказываются оппортунистические инфекции (грибковые, пневмоцистные, цитомегаловирусные, туберкулёз), аутоиммунные заболевания с поражением лёгких, продолжающаяся в лёгочной ткани персистенция SARS-CoV-2 (обычно у больных, получавших предшествующее лечение ритуксимабом). Если все эти факторы исключены, высока вероятность развития интерстициальной болезни лёгких, индуцированной COVID-19.
Список литературы
Viceconte G., Buonomo A.R., Lanzardo A. et al. Pneumocystis jirovecii pneumonia in an immunocompetent patient recovered from COVID-19 // Infect. Dis. (Lond.). 2021. V. 53. № 5. P. 382–385. https://doi.org/10.1080/23744235.2021.1890331
Chakravarthy K.K., Cherukuri B., Anne S. et al. An unusual case of severe pneumocystis jiroveci pneumonia (PJP) presenting as “recurrent cytokine storm'' following COVID-19 // Infection J. Assoc. Physicians India. 2021. V. 69. № 5. P. 78.
Аверьянов А.В., Сотникова А.Г., Лесняк В.Н. Пневмоцистная пневмония, мимикрирующая под COVID-19 // Клиническая практика. 2020. № 2. С. 87–92.
Apostolopoulou A., Esquer Garrigos Z., Vijayvargiya P. et al. Invasive pulmonary aspergillosis in patients with SARS-CoV-2 infection: a systematic review of the literature // Diagnostics. 2020. V. 10(10): Article number 807. https://doi.org/10.3390/diagnostics10100807
Abdoli A., Falahi S., Kenarkoohi A. COVID-19-associated opportunistic infections: a snapshot on the current reports // Clin. Exp. Med. 2021. Aug. 23. P. 1–20. https://doi.org/10.1007/s10238-021-00751-7
Zuo T., Wu X. Wen W., Lan P. Gut microbiome alterations in COVID-19 // Genomics, Proteomics and Bioinformatics. 2021. Sep. 21. S1672-0229(21)00206-0. https://doi.org/10.1016/j.gpb.2021.09.004
Miranda M.A., Sousa S.C., Montes V.L. Post-COVID-19 neurocandidiasis // Neurol. Sci. 2021. V. 9. P. 1–2. https://doi.org/10.1007/s10072-021-05515-5
Ghosh A., Sarkar A., Paul P., Patel P. The rise in cases of mucormycosis, candidiasis and aspergillosis amidst COVID-19 // Fungal Biol. Rev. 2021. Dec. 38. P. 67–91. https://doi.org/10.1016/j.fbr.2021.09.003
Shah M., Kakar A., Gogia A., Langer S. Convalescent plasma, cytomegalovirus infection, and persistent leukopenia in COVID-19 recovery phase: What is the link? // J. Postgrad. Med. 2021. V. 67(2). P. 100–102. https://doi.org/10.4103/jpgm.JPGM_1168_20
Neves M., Marinho-Dias J., Ribeiro J., Sousa H. Epstein-Barr virus strains and variations: Geographic or disease-specific variants? // J. Med. Virol. 2017. V. 89. P. 373–387. https://doi.org/10.1002/jmv.24633
Gold J.E., Okyay R.A., Licht W.E., Hurley D.J. Investigation of long COVID prevalence and its relationship to Epstein-Barr virus reactivation // Pathogens. 2021. V. 10(6). Article number 763. https://doi.org/10.3390/pathogens10060763
Sauter A., Faul C., Bitzer M. et al. Imaging findings in immunosuppressed patients with Epstein Barr virus-related B cell malignant lymphoma // AJR Am. J. Roentgenol. 2010. V. 194(2). P. W141–W149. https://doi.org/10.2214/AJR.09.3264
Dotan A., Muller S., Kanduc D. et al. The SARS-CoV-2 as an instrumental trigger of autoimmunity // Autoimmun Rev. 2021. V. 20(4). P. 102792. https://doi.org/10.1016/j.autrev.2021.102792
Izci Duran T., Turkmen E., Dilek M. et al. ANCA-associated vasculitis after COVID-19 // Rheumatol. Int. 2021. V. 41(8). P. 1523–1529. https://doi.org/10.1007/s00296-021-04914-3
Cevik M., Tate M., Lloyd O. et al. SARS-CoV-2, SARS-CoV, and MERS-CoV viral load dynamics, duration of viral shedding, and infectiousness: a systematic review and meta-analysis // Lancet Microbe. 2021. V. 2(1). P. e13–e22. https://doi.org/10.1016/S2666-5247(20)30172-5
Drouin A.C., Theberge M.W., Liu S.Y. et al. Successful Clearance of 300 Day SARS-CoV-2 Infection in a Subject with B-Cell Depletion Associated Prolonged (B-DEAP) COVID by REGEN-COV Anti-Spike Monoclonal Antibody Cocktail // Viruses. 2021 V. 13(7). Article number 1202. https://doi.org/10.3390/v13071202
Borges V., Isidro J., Cunha M. et al. Long-Term Evolution of SARS-CoV-2 in an Immunocompromised Patient with Non-Hodgkin Lymphoma // mSphere. 2021. V. 6(4). P. e0024421. https://doi.org/10.1128/mSphere.00244-21
Caci G., Minervini F., Fechner C. et al. Bronchoalveolar lavage-detected SARS-CoV-2 infection in presence of serial negative nasopharyngeal swabs: a case report // Ann. Transl. Med. 2021. V. 9(7). Article number 583. https://doi.org/10.21037/atm-20-4307
Hu F., Chen F., Ou Z. et al. A compromised specific humoral immune response against the SARS-CoV-2 receptor-binding domain is related to viral persistence and periodic shedding in the gastrointestinal tract // Cell. Mol. Immunol. 2020. V. 17(11). P. 1119–1125. https://doi.org/10.1038/s41423-020-00550-2
Wild J.M., Porter J.C., Molyneaux P.L. et al. Understanding the burden of interstitial lung disease post-COVID-19: the UK Interstitial Lung Disease-Long COVID Study (UKILD-Long COVID) // BMJ Open Respir. Res. 2021. V. 8(1). P. e001049. https://doi.org/10.1136/bmjresp-2021-001049
Myall K.J., Mukherjee B., Castanheira A.M. et al. Persistent post-COVID-19 interstitial lung disease. An observational study of corticosteroid treatment // Ann. Am. Thorac. Soc. 2021. V. 18. № 5. P. 799–806. https://doi.org/10.1513/AnnalsATS.202008-1002OC
Дополнительные материалы отсутствуют.


