Вестник РАН, 2022, T. 92, № 8, стр. 747-755
АГЕНТНЫЙ ПОДХОД К МОДЕЛИРОВАНИЮ ЭПИДЕМИИ COVID-19 В РОССИИ
Г. Н. Рыкованов a, *, С. Н. Лебедев a, **, О. В. Зацепин a, ***, Г. Д. Каминский b, ****, Э. В. Карамов b, c, *****, А. А. Романюха d, ******, А. М. Фейгин e, *******, Б. Н. Четверушкин f, ********
a Российский федеральный ядерный центр “Всероссийский научно-исследовательский институт технической физики им. академика Е.И. Забабахина”
Снежинск, Россия
b Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний
Москва, Россия
c Национальный исследовательский центр эпидемиологии и микробиологии им. почётного академика Н.Ф. Гамалеи
Москва, Россия
d Институт вычислительной математики им. Г.И. Марчука РАН
Москва, Россия
e Институт прикладной физики РАН
Нижний Новгород, Россия
f Институт прикладной математики им. М.В. Келдыша РАН
Москва, Россия
* E-mail: g.n.rykovanov@vniitf.ru
** E-mail: s.n.lebedev@vniitf.ru
*** E-mail: o.v.zatsepin@vniitf.ru
**** E-mail: gregkaminski.gk@gmail.com
***** E-mail: Karamov2004@yandex.ru
****** E-mail: eburg101@mail.ru
******* E-mail: feigin@appl.sci-nnov.ru
******** E-mail: office@keldysh.ru
Поступила в редакцию 08.02.2022
После доработки 20.02.2022
Принята к публикации 10.03.2022
- EDN: WDBEZY
- DOI: 10.31857/S0869587322080138
Аннотация
Пандемия COVID-19 создала чрезвычайную ситуацию в области общественного здравоохранения в России и мире в целом. Волнообразное распространение новой коронавирусной инфекции, вызванное вновь появляющимися вариантами коронавируса, привело к высокому уровню заболеваемости во всех субъектах РФ. Сейчас крайне актуальным становится получение возможности управления процессом развития эпидемии и оценки влияния на этот процесс тех или иных регулирующих мер. Это поможет государственным органам в обоснованном принятии решений для управления нагрузкой на медицинские учреждения. Получение таких оценок без использования современных математических моделей возможно далеко не во всех случаях.
Консорциум учёных (РФЯЦ-ВНИИТФ им. академика Е.И. Забабахина, ИПФ РАН, ИПМ им. М.В. Келдыша РАН, ИВМ им. Г.И. Марчука РАН, НИЦЭМ им. Н.Ф. Гамалеи, НМИЦ ФПИ) работает над созданием новых математических моделей и комплекса программ для моделирования развития эпидемий вирусных инфекций. Это позволит получать прогноз эффективности регулирующих мер для обоснованного принятия решений государственными органами с целью управления нагрузкой на медицинские учреждения. В мультидисциплинарный коллектив входят физики, математики, медики, вирусологи, эпидемиологи. Работы ведутся в рамках проекта Мин-обрнауки России “Моделирование эпидемий вирусных инфекций” подпрограммы “Фундаментальные научные исследования для долгосрочного развития и обеспечения конкурентоспособности общества и государства” государственной программы “Научно-технологическое развитие Российской Федерации”. Актуальность работы обусловлена отсутствием применимых на практике и адаптированных к российским условиям систем прогнозирования распространения вирусных инфекций и реакции эпидемического процесса на различные меры контроля.
Развитие эпидемии – по сути, цепная реакция. Цепные реакции в химии, ядерной физике достаточно хорошо изучены и описываются уравнениями, близкими к уравнениям, характеризующим развитие эпидемии. Однако между этими процессами есть существенное различие. Если рассматривать цепные ядерные реакции, возникающие при работе систем, которыми традиционно занимается федеральный ядерный центр, то здесь всё строго детерминировано. Сечения взаимодействия нейтронов и геометрия системы хорошо известны. Это позволяет точно описывать количественные характеристики и эффективность мер регулирования работы ядерной системы. Для вирусной инфекции таких данных нет. Как правило, характеристики инфекции и параметры протекания заболевания известны с некоторой степенью неопределённости и могут меняться в процессе развития эпидемии. Для новых инфекций, с которыми человечество встречается впервые, исследование и определение характеристик заболевания требуют времени. Далеко не для всех инфекций известно иммунное состояние популяции, кроме того, эффективность борьбы с инфекцией зависит от поведения индивидуумов. Поэтому долгосрочное точное описание развития эпидемии вряд ли возможно.
Может возникнуть вопрос: а нужно ли в этом случае математическое моделирование эпидемий? Действительно, в двух предельных случаях – низкой и высокой летальности заболевания – польза от математического моделирования невелика. В первом случае эпидемия заканчивается с набором требуемого значения коллективного иммунитета, во втором методы борьбы хорошо отработаны – строгая локализация возможных очагов инфекции. Таким способом примерно за 70 дней была ликвидирована вспышка COVID-19 в десятимиллионном Ухане (КНР, провинция Хубэй) [1]. Другим примером успешной борьбы с особо опасным заболеванием может служить ликвидация в Москве в 1960 г. вспышки чёрной оспы [2], когда инфекцию удалось остановить в течение 19 дней с момента её идентификации. При этом в кратчайшие сроки была проведена массовая вакцинация почти 10 млн жителей Москвы и Московской области.
Роль математического моделирования возрастает, если предполагается управлять процессом развития эпидемии. Для этого нужен инструмент, позволяющий прогнозировать эффективность планируемых ограничительных мероприятий и нагрузки на систему здравоохранения. Именно это, а не точность описания фактических данных по заболеваемости, – главная задача математического моделирования.
Прогнозирование необходимо для определения эффективности воздействия, в частности, выявления и изоляции источников инфекции, лечения, вакцинации и профилактики. При этом математическая модель должна показывать результаты, близкие к статистическим данным в течение всего периода заболевания, чтобы давать наиболее достоверный прогноз для того или иного сценария введения регулирующих мер. Моделирование должно учитывать не только сам факт возможного инфицирования восприимчивой части населения, но и потерю здоровья неинфицированной частью популяции, обусловленную протекающей эпидемией. Кроме последствий самого инфекционного заболевания, необходимо учитывать потери населения как за счёт обострений хронических болезней, вызванных нарушениями психологического благополучия в обществе (тревожность, депрессия), так и несвоевременным оказанием медицинской помощи из-за перегрузки системы здравоохранения.
Традиционно для описания эпидемий применяются модели, вытекающие из SIR модели, предложенной А. МакКендриком и У. Кермаком в 1927 г. [3]. Решение задачи, полученное с помощью этих моделей, можно сопоставить с решением уравнений кинетики для гомогенной среды, например, гомогенного ядерного реактора. Для выработки эффективных мер противодействия вирусным инфекциям такого подхода недостаточно. Имея большой опыт в численных методах решения уравнения переноса нейтронов, авторы попробовали применить эти методы для описания развития эпидемии. Один из них – метод Монте-Карло [4] – может быть достаточно просто адаптирован для моделирования вирусной инфекции. С использованием этого подхода была разработана агентная модель распространения вирусной инфекции [5–7]. Отметим, что в настоящее время агентные модели широко применяются для анализа различных аспектов распространения COVID-19 и прогнозирования развития пандемии [8–12].
Агентную модель можно рассматривать как некоторый аналог метода решения уравнения переноса нейтронов для гетерогенной среды в многогрупповом приближении. Популяция разбита на характерные группы по типу ежедневного поведения – работники предприятий, офисов, сферы жизнеобеспечения, школьники, дошкольники, студенты и пенсионеры. Каждая группа имеет свой дневной жизненный цикл – последовательность мест пребывания и интервал времени, в который они там находятся. Модель относится к классу “индивидуум-ориентированных” моделей [13, 14] и позволяет учесть сложную демографическую структуру, особенности распространения и протекания заболеваний, медицинские статистические данные и систему контактов жителей городов.
Модель города основана на:
• описании специфического для города распределения жителей по социальному статусу (социальным группам, возрасту, полу) и по посещению общественных мест (ячеек) – центров заражения, включая дома (квартиры), детские сады, школы, рабочие места, места отдыха, транспорт и др.;
• разбивке общества на набор социальных групп, объединённых посещением ячеек, образующих идентифицируемые кластеры, через которые возможно заражение;
• описании набора случайных траекторий, приписанных каждому индивидууму (агенту) в соответствии с заданным сценарием дня; сценариев посещения ячеек может быть несколько, что позволяет строить различные режимы противодействия распространению эпидемии (режим самоизоляции, карантин, полная изоляция для определённой группы населения);
• описании таких характеристик эпидемии, как степень заразности, радиус заражения, вероятностные характеристики перехода из одного состояния индивидуума в другое, фазы заболевания, временны́е распределения нахождения в той или иной фазе;
• статистическом характере изменения популяции при развитии эпидемии, что позволяет оценивать не только актуальные параметры популяции во времени, но и статистические характеристики: вероятности разных сценариев развития эпидемии, среднее по ансамблю популяций количество больных в зависимости от времени, среднестатистический разброс и другие параметры, позволяющие проводить статистический анализ.
Городская среда приближённо описывается в виде ячеек, в которых возможен контакт, приводящий к заражению агента: квартира, три вида транспорта (метро, автобус, маршрутное такси), место работы или учёбы, общественные места, три вида магазинов (гипермаркет, супермаркет, магазин у дома). Характеристики ячеек (в первую очередь площадь, приходящаяся на одного человека), установленные по статистическим данным для Москвы, оказались близкими и для других крупных городов России. Вероятность заражения в ячейке является функцией от площади ячейки, количества инфицированных и суммарного количества человек в ячейке.
Для каждого агента определён бюджет времени на одни сутки – время, в течение которого агент взаимодействует с другими агентами в заданном множестве ячеек. Каждая ячейка описывает квартиру (дом), место работы или учёбы, транспорт, магазины и торговые центры. Группы жителей отличаются способами взаимодействия, которые характеризуются различными алгоритмами перехода из одной ячейки в другую. Например, динамика поведения работников предприятий и офисов описывается алгоритмом “дом–транспорт–работа–транспорт–магазин–дом”. Динамике поведения пенсионеров соответствует алгоритм “дом–транспорт–магазин–транспорт–дом”. Школьники и дошкольники не пользуются ячейками “транспорт” и “магазин”.
Схема протекания заболевания COVID-19 в модели приведена на рисунке 1. Длительность фаз заболевания неоднократно изменялась по мере накопления фактических данных. Одним из параметров моделирования выступает процент скрытых больных. Этот параметр явным образом никем из исследователей не определён, данные о нём кардинально различаются. Так, в начале наших работ в марте–апреле 2020 г. доля скрытых больных варьировалась от 1%, по данным Мин-обороны РФ [15], до 25–40%, по данным Роспотребнадзора [16]. При таком различии говорить о точности предсказаний нагрузки на систему здравоохранения и развития эпидемии просто не имеет смысла. Этот параметр оценивался по данным тестирования на коронавирус в Нью-Йорке и Москве, проведённого в мае 2020 г., и впоследствии корректировался за счёт переобработки статистических данных. Длительность фаз заболевания COVID-19 была взята из результатов медицинских исследований. В модели принято, что в среднем латентный период (когда человек инфицирован, но не заразен) длится 3 дня, субклинический (когда заразен, но не проявляет симптомов болезни) составляет 2 дня, для скрытых больных период, когда он может заразить кого-либо, составляет 4 дня, для амбулаторных больных, представляющих опасность для своей семьи, срок изоляции – 10 дней, госпитализированные больные находятся в стационаре в среднем 14 дней. Длительность иммунитета к одному и тому же штамму при перенесённом заболевании – 180 дней. При смене штамма средняя продолжительность иммунитета снижается до 120 дней. При вакцинации для всех штаммов продолжительность иммунитета – 180 дней.
Для получения достоверного прогноза развития эпидемической ситуации математическая модель должна показывать результаты, близкие к статистическим данным. Любая приближённая модель требует калибровки на фактических данных. Такая калибровка была проведена на двух мегаполисах – Ухане и Нью-Йорке, близких по структуре населения к Москве. Данные по заболеваемости для этих городов были взяты с сайта Университета им. Дж. Хопкинса [1].
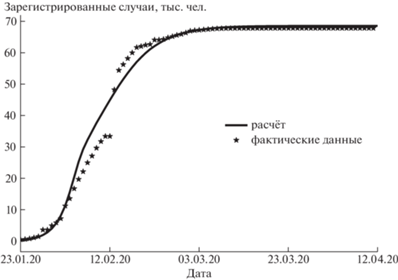
Бо́льшая часть жителей Уханя была изолирована в местах проживания, выявленные больные помещались в стационары, а жители с подозрением на заболевание изолировались в так называемых центрах здоровья. При этом действия властей были одинаковыми для всех групп населения, для моделирования такая городская популяция однородна. В этом случае влияние скрытых больных на развитие эпидемии мало́, и моделирование в значительной степени опирается на длительность фаз заболевания. Развитие эпидемии в Ухане удалось описать в широком диапазоне изменения доли скрытых больных – от 50 до 90%. На рисунке 2 приведены результаты моделирования. В фактических данных по заболеваемости есть скачок, что говорит как о возможности наличия погрешности в приводимой оперативной информации по заболеваемости и смертности, в том числе и в других странах, так и о возможном изменении подхода к регистрации числа заболевших.
Развитие эпидемии в Нью-Йорке весной 2020 г., где вводились ограниченные карантинные меры, удалось описать только в предположении доли скрытых больных в интервале 70–90%. Это значение существенно превышало оценку Роспотребнадзора – 25–40%, что вызывало сомнения в корректности модели. В середине мая 2020 г. появились фактические данные по наличию антител у жителей Нью-Йорка на выборке в 15 тыс. человек (табл. 1). Сопоставление с фактическим значением заболеваемости позволило оценить долю скрытых больных на уровне 90%. С учётом возможных погрешностей фактических данных для дальнейшего моделирования было выбрано среднее значение доли скрытых больных в 80%. На рисунке 3 показано сравнение расчётного моделирования развития начальной стадии эпидемии в Нью-Йорке с фактическими данными.
Таблица 1.
Данные о доле скрытых больных при тестировании в Нью-Йорке 30 апреля – 10 мая 2020 г.
| Район | Положительные тесты на антитела, % | Инфицированных на 100 тыс. человек | Зарегистрировано случаев на 100 тыс. человек | Доля скрытых носителей, % |
|---|---|---|---|---|
| Бронкс | 27.6 | 27 600 | 2624 | 90.5 |
| Статен-Айленд | 19.2 | 19 200 | 2407 | 87.5 |
| Квинс | 18.4 | 18 400 | 2093 | 88.6 |
| Бруклин | 19.2 | 19 200 | 1654 | 91.4 |
| Манхэттен | 17.3 | 17 300 | 1111 | 93.6 |
| В среднем | 20 | 20 000 | 1943 | 90.3 |
Для чего могут быть полезны результаты математического моделирования? Агентная модель позволяет выделять вероятности заражения по различным каналам и изменение этой вероятности с течением времени. Проведённое моделирование показало, что основными каналами заражения в начале эпидемии являются транспорт (35% от общего числа) и места работы (25–30%). Примерно через два месяца эпидемии вероятность заражения на работе уменьшается, а вероятность заражения дома увеличивается до уровня заражения на работе (~22%). Это означает, что и сами вводимые ограничения, то есть меры регулирования эпидемии, могут зависеть от времени.
Результаты моделирования позволяют дать количественную оценку влияния используемых мер как в совокупности, так и по различным каналам. При введении ограничений на посещение общественных мест для различных групп населения темпы развития эпидемии меняются (табл. 2). Так, ограничения для пенсионеров изменяют нагрузку на систему здравоохранения примерно на 10%. В то же время перевод работающего населения, кроме работников сферы жизнеобеспечения города, на удалённый режим снижает максимальное значение количества больных в стационаре почти в 3 раза. Моделирование ограничений при посещении общественных мест (табл. 3) показало слабое влияние закрытия магазинов на снижение заболеваемости (20%), зато подтвердило существенную роль общественного транспорта в распространении инфекции. Такая гипотетическая мера, как повсеместное закрытие общественного транспорта, привела бы к снижению нагрузки на медицинские учреждения в 2 раза.
Таблица 2.
Влияние на нагрузку медицинской системы введения карантина для отдельных категорий населения
| Категория населения | Пенсионеры | Пенсионеры и школьники | Пенсионеры, школьники, студенты | Работающие (кроме сферы жизнеобеспечения) |
|---|---|---|---|---|
| Коэффициент уменьшения нагрузки на медицинскую систему | 1.1 | 1.2 | 1.4 | 3 |
Таблица 3.
Влияние на нагрузку медицинской системы закрытия отдельных видов общественных мест
| Ограничения (закрыты) | Магазины | Транспорт |
|---|---|---|
| Коэффициент уменьшения нагрузки на медицинскую систему | 1.2 | 2 |
Модель допускает более подробное описание городской инфраструктуры. Можно ввести “особые точки” с высокой вероятностью заражения, например, поликлиники, и оценить их роль в распространении инфекции. Как уже сказано выше, основная задача математического моделирования эпидемии – количественная оценка функции отклика системы на внешнее воздействие (ограничения). Тем не менее степень доверия к результатам всё же зависит от точности моделирования развития эпидемии. Проиллюстрируем точность описания развития эпидемии на двух примерах.
Первый – замена доминирующего штамма альфа (В.1.1.7) на штамм дельта (В.1.617.2, AY.1, AY.2). По данным технического брифинга агентства Public Health при Министерстве здравоохранения Великобритании № 17 от 25.06.2021 г., по результатам секвенирования замещение штамма альфа на штамм дельта в Великобритании произошло примерно за 70 дней. После введения в модель возможности одновременного присутствия в популяции двух различных штаммов было показано, что в расчётах замещение преобладающего в Москве штамма (B1) происходит приблизительно за тот же период (рис. 4). Впоследствии длительность замещения первоначального штамма на штамм дельта в Москве была подтверждена исследованиями [17]. Контагиозность штамма дельта принималась в соответствии с информацией, предоставленной вирусологами НИЦЭМ им. Н.Ф. Гамалеи и НМИЦ ФПИ, и была в 2 раза больше по сравнению с первоначальным штаммом.
Второй пример – длительность прогноза. Из-за того, что модель приближённо описывает гетерогенную структуру Москвы, а поведение людей в процессе протекания эпидемии меняется и может отличаться от заложенного в модели образа жизни, константы модели для описания фактических данных периодически приходится перекалибровывать. На рисунке 4 можно видеть, что прогноз, рассчитанный после калибровки на 1 августа 2021 г., с достаточной степенью точности описывает фактические данные в течение трёх месяцев. Введение карантина с конца октября 2021 г. в это время ещё не ожидалось, поэтому при получении прогноза в расчёте не учитывалось. В октябре 2021 г. Президент РФ В.В. Путин объявил о введении ограничительных мер в связи с усложнившейся эпидемической обстановкой. Возникла необходимость получения прогноза, в котором такие меры были бы учтены. В расчётах принимался во внимание не только карантин в период с 28 октября по 7 ноября 2021 г., но и предполагалось, что такой же карантин будет действовать в предстоящие новогодние (31.12.2021 г.–09.01.2022 г.) и майские (30.04.2022 г.–08.05.2022 г.) праздники.
На рисунке 5 показан прогноз заболеваемости в Москве при фактических данных по темпам вакцинации на 17.11.2021 г. На этом же графике приведён расчёт с увеличенным до 50 тыс. чел./день темпом вакцинации, который свидетельствует о подавлении развития эпидемии. Появление нового штамма может кардинально изменить картину заболеваемости, как это уже происходило при возникновении штамма дельта.
Рис. 5.
Расчёт прогноза от 25 октября 2021 г. с учётом карантинных мер 28 октября – 7 ноября 2021 г. в Москве

Прежде чем переходить к моделированию развития эпидемии в стране, было необходимо обобщить модель для мегаполиса на регион, рассмотрев влияние маятниковой трудовой миграции. В качестве примера была проанализирована маятниковая миграция для Московской области. Агломерация Москвы и Московской области насчитывает, по данным исследования НИУ ВШЭ [18], около 16.7 млн человек. При этом ежедневная трудовая миграция насчитывает 1.3 млн. При моделировании учитывались города с населением больше 100 тыс. жителей, в которых суммарно проживает 3.7 млн человек. Фактические данные описываются с достаточной степенью точности. Максимумы заболеваемости коррелируют с полученными в Москве данными, отставание пиков составляет не более 2–3 дней.
Построена модель для получения числовых оценок распространения инфекции по всей территории России. Основная идея данной модели – представить страну в виде набора населённых пунктов с локальными эпидемиями, связанных между собой транспортными потоками. Модель страны представляет собой совокупность набора моделей городов и матрицы потоков жителей, определённой для каждых суток. Каждая модель города из набора описывает некоторый населённый пункт Российской Федерации и имеет свои независимые параметры. Для моделирования развития эпидемии в РФ модель была дополнена транспортными связями, реализованы три схемы сообщений.
В первой схеме учитывалось авиа- и железнодорожное сообщение между крупными транспортными узлами. Пассажиропоток моделировался с учётом реального расписания рейсов. Величина пассажиропотока и заполняемость рейсов брались в соответствии с ежегодными отчётами РЖД и группы компаний “Аэрофлот”. Учитывались сезонные колебания пассажиропотока. Например, минимальное число пассажиров, перевозимых авиатранспортом, согласно статистике, наблюдается с середины января по середину марта, а максимум перевозок приходится на июль – первую половину сентября [19]. Вторая схема включает перевозки, обеспечивающие взаимодействие региональных центров с ближайшими соседями. К ним относятся перевозки пассажирским, железнодорожным, автотранспортом и малой авиацией. Третья схема охватывает пригородное сообщение между населёнными пунктами агломерации и её центром. В основном это личный транспорт, пригородное автобусное сообщение и пригородные электропоезда.
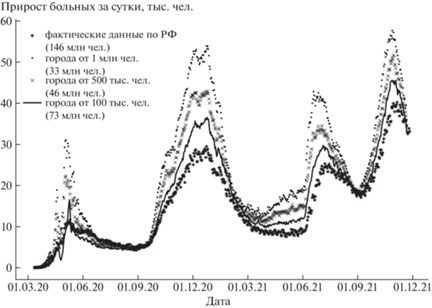
Применение схем по отдельности или в сочетании позволяет проводить моделирование развития эпидемической ситуации в стране при различных уровнях детализации. На рисунке 6 представлены первые результаты моделирования развития эпидемии в России. Во всех расчётах учитывались реальные ограничения карантинного характера, введённые в разных субъектах страны. Первый расчёт охватывает города с населением свыше 1 млн человек. Он учитывает только крупные транспортные потоки. Во втором расчёте добавлены крупные региональные центры с населением более 500 тыс. человек. Охват населения при этом увеличился с 33 до 46 млн человек. Наконец, в третьем расчёте были учтены города с численностью не менее 100 тыс. человек, в которых суммарно проживает 73 млн человек. Результаты моделирования, приведённые на рисунке 6, нормированы на численность всего населения страны – 146 млн человек. Пока результаты не в полной мере описывают фактические данные, но приближаются к ним по мере повышения точности описания городской структуры регионов и страны.
В заключение отметим, что в рамках проекта Минобрнауки России разрабатываются модель и комплекс программ для прогнозирования различных сценариев развития эпидемий вирусных инфекций в масштабе страны. Более корректное описание развития эпидемий требует учёта влияния ограничительных мер на комплексное состояние общества в экономической и социальной сферах. Необходимо научиться прогнозировать потери населения как за счёт обострений хронических заболеваний, так и по причине несвоевременного оказания медицинской помощи. Прогнозирование реалистичной изменчивости настроений общества в ходе эпидемии на основе методов искусственного интеллекта, более точное описание общества за счёт развития баз данных в области вирусологии, социологии, медицины, авиационного, железнодорожного и автотранспортного сообщения могут улучшить прогностические возможности моделирования.
Указом Президента РФ от 12.10.2020 г. образована Межведомственная комиссия Совета безопасности РФ по вопросам создания национальной системы защиты от новых инфекций. Прогнозирование темпов развития эпидемий и эффективности принимаемых мер противодействия должны быть составной частью национальной системы защиты от новых инфекций. Разрабатываемые модель и расчётный комплекс могут стать прообразом системы прогнозирования развития эпидемий в России.
Список литературы
COVID-19 Data Repository by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University. https://github.com/CSSEGISandData/COVID-19 (дата обращения 05.05.2020).
Бароян О.В., Серенко А.Ф. Вспышка оспы в Москве в 1959–1960 гг. // Журнал микробиологии, эпидемиологии и иммунологии. 1961. № 4. С. 72–79.
Kermack W.O., McKendrick A.G. A Contribution to the Mathematical Theory of Epidemics // Proceedings of the Royal Statistical Society. 1927. V. 115. P. 700–721.
Зацепин О.В., Кандиев Я.З., Кашаева Е.А. и др. Расчёты методом Монте-Карло по программе ПРИЗМА нейтронно-физических характеристик активной зоны ВВЭР-1000 // ВАНТ. Серия “Физика ядерных реакторов”. 2011. № 4. С. 64–73.
Адарченко В.А., Бабань С.А., Брагин А.А. и др. Моделирование развития эпидемии коронавируса по дифференциальным и статистическим моделям. Снежинск: РФЯЦ–ВНИИТФ, 2020.
Зацепин О.В., Брагин А.А., Власов В.В. и др. Агентная модель развития эпидемии COVID-19 // Забабахинские научные чтения: сборник тезисов докладов XV Международной конференции 27.09.2021–01.10.2021. : РФЯЦ–ВНИИТФ, 2021.
Дерябин А.М., Брагин А.А., Власов В.В. и др. Учёт перемещения населения в агентной модели развития эпидемии вирусной инфекции // Забабахинские научные чтения: сборник тезисов докладов XV Международной конференции 27.09.2021–01.10.2021. : РФЯЦ–ВНИИТФ, 2021.
Kerr C.C., Stuart R.M., Mistry D. et al. Covasim: an agent-based model of COVID-19 dynamics and interventions // PLOS Computational Biology. 2021. V. 17 (7). e1009149.
Li J., Giabbanelli P. Returning to a normal life via COVID-19 vaccines in the United States: A large-scale agent-based simulation study // JMIR Medical Informatics. 2021. № 9 (4). e27419.
Hinch R., Probert W.J., Nurtay A. et al. Open ABM-Covid19 – An agent-based model for non-pharmaceutical interventions against COVID-19 including contact tracing // PLoS computational biology. 2021. V. 17 (7). e1009146.
Howick S., McLafferty D., Anderson G.H. et al. Evaluating intervention strategies in controlling coronavirus disease 2019 (COVID-19) spread in care homes: An agent-based model // Infection Control & Hospital Epidemiology. 2021. V. 42 (9). P. 1060–1070.
Lorig F., Johansson E., Davidsson P. Agent-based social simulation of the covid-19 pandemic: A systematic review // JASSS: Journal of Artificial Societies and Social Simulation. 2021. V. 24 (3). http://jasss.soc.surrey.ac.uk/24/3/5.html (дата обращения 18.07.2021).
Grimm V., Railsback S.F. Individual-based Modeling and Ecology. Princeton, Oxford: Princeton University Press, 2005.
Корнилина М.А., Перминов В.Д. Индивидуум-ориентированная модель распространения эпидемии в городских условиях // Математическое моделирование. 2007. № 5. С. 116–127.
Серговенцев А.А., Азаров И.И., Паценко М.Б. и др. Диагностика, лечение и профилактика новой коронавирусной инфекции (COVID-19) // Военно-медицинская академия им. С.М. Кирова. Материалы по коронавирусной инфекции. https://www.vmeda.org/wp-content/uploads/2020/04/covid-190406.pdf
Газета “Известия”. Видеозапись: “Доклад главы Роспотребнадзора Анны Поповой на совещании с Путиным”. https://iz.ru/1005598/video/doklad-glavy-rospotrebnadzora-anny-popovoi-na-soveshchanii-s-putinym (дата обращения 28.04.2020).
Обзор динамики вариантов COVID-19 в разных странах. https://covariants.org/per-country (дата обращения 06.07.2021).
Махрова А., Бочкарёв А. Маятниковая миграция в Московском регионе: новые данные. http://demoscope.ru/weekly/2017/0727/tema01.php (дата обращения 06.09.2021).
Финансовые результаты ПАО “Аэрофлот” за 9 месяцев 2021 г. по МСФО. https://www.aviastat.ru/reports/116-finansovye-rezultaty-pao-aeroflot-za-9-mesyacev-2021-goda-po-msfo (дата обращения 10.11.2021).
Дополнительные материалы отсутствуют.