Высокомолекулярные соединения (серия А), 2019, T. 61, № 1, стр. 59-66
ТРАНСПОРТНЫЕ СВОЙСТВА И РАЗМЕРЫ МАКРОМОЛЕКУЛ ЛИГНИНА В РАСТВОРЕ
А. П. Карманов a, *, Л. С. Кочева b, c, В. А. Белый d, В. В. Володин a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
167982 Сыктывкар, Коммунистическая ул., 28, Россия
b Институт геологии Коми научного центра Уральского отделения Российской академии наук
167982 Сыктывкар, Первомайская ул., 54, Россия
c Сыктывкарский государственный университет им. Питирима Сорокина
167001 Сыктывкар, Октябрьский пр., 55, Россия
d Институт химии Коми научного центра Уральского отделения Российской академии наук
167982 Сыктывкар, Первомайская ул., 48, Россия
* E-mail: apk0948@yandex.ru
Поступила в редакцию 04.04.2018
После доработки 27.06.2018
Принята к публикации 11.07.2018
Аннотация
Методами капиллярной вискозиметрии и седиментационно-диффузионного анализа исследованы молекулярные свойства разбавленных растворов лигнина Пеппера из стеблей серпухи венценосной Serratula coronata L в диметилформамиде. Определены ММ фракций и гидродинамические радиусы макромолекул, проанализированы скейлинговые зависимости в рамках уравнения Марка–Куна–Хаувинка. Показано, что лигнин из стеблей серпухи венценосной заметно отличается по комплексу физико-химических свойств от линейных полимеров, а также от других лигнинов различного ботанического происхождения и соответствует сверхразветвленным полимерам.
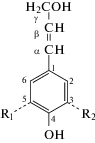
Лигнины – ароматические биополимеры различного строения, входящие в состав ксилемы большинства видов наземных растений в количестве 15–40%. Макромолекулы лигнинов состоят в основном из структурных единиц трех типов: гваяцильных (G), сирингильных (S) и п-кумаровых (H). Соответственно основными мономерными предшественниками лигнинов (монолигнолами) являются 4-[(E)-3-гидроксипроп-1-енил]-2-метоксифенол (конифериловый спирт), 4-[(E)-3-гидроксипроп-1-енил]-2, 6-диметоксифенол (синаповый спирт) и 4-[(E)-3-гидроксипроп-1-енил]-фенол (п-кумаровый спирт), имеющие фенилпропановую структуру
 ,
,
где R1 = H, R2 = H – п-кумаровый спирт (Н-единица); R1 = H, R2 = ОСH3 – конифериловый спирт (G-единица), ); R1 = ОСH3, R2 = ОСH3 – синаповый спирт (S-единица).
Процесс образования лигнина протекает по механизму свободнорадикальной дегидрополимеризации кониферилового, синапового и п-кумарового спиртов при участии ферментативного каталитического комплекса, образованного пероксидазой и пероксидом водорода [1–3].
Один из главных факторов, определяющих химическую структуру и топологию макромолекул лигнинов, – их филогенетическая предыстория как объектов биологической природы. Показано, что лигнины гваяцильного типа хвойных растений представляют собой хаотически разветвленные полимеры [4, 5], тогда как лигнины ряда лиственных пород древесины [6–8], в частности березы, яблони, рябины, акации являются как регулярно разветвленными полимерами звездообразного типа. Топологическая структура лигнинов травянистых растений остается в настоящее время малоисследованной. Можно отметить работу [9], согласно которой гидродинамическое поведение и конформационные свойства лигнинов, выделенных из стеблей однолетних растений семейства злаковых, отвечают топологии линейных полимеров. Необходимо проведение более широких исследований, которые позволят приблизиться к решению фундаментальной проблемы топотаксономической классификации лигнинов. Большой интерес представляет также задача выявления лигнинных биополимеров с новыми свойствами и необычной структурой макромолекул. Такая возможность принципиально существует, что обусловлено уникальностью механизмов биосинтеза лигнина. Как известно [10], сборка макромолекул из монолигнолов протекает без генетического контроля в соответствии с закономерностями функционирования сложных открытых неравновесных систем. В связи с этим структура лигнина, в том числе на топологическом уровне, формируется при непосредственном влиянии эндо- и экзогенных факторов природной среды с участием механизмов динамической самоорганизации. Данное обстоятельство приводит к множественности вариантов структуры и биоразнообразию лигнинов.
Актуальность исследований лигнинов определяется не только значительной ролью, которые играют эти полимеры в технологических процессах химической переработки древесины, но и многими другими возможностями их практического использования. В частности, особый интерес представляют лигнины различных цветковых растений, играющих важную роль в жизни человека. Так, лигнины серпухи венценосной обладают высокой антиоксидантной активностью и геропротекторными свойствами, обусловливающими, как показано на примере дрозофил, существенное увеличение продолжительности жизни [11]. Лигнины, выделенные из этого растения, могут способствовать профилактике онкологических заболеваний репродуктивных органов человека, поскольку оказывают положительное влияние на механизм гепато-энтеральной циркуляции половых стероидных гормонов у млекопитающих – эстадиола, эстрона и прогестерона [12]. Таким образом, изолированный лигнин серпухи венценосной, а также надмолекулярные лигнин-пектиновые комплексы являются перспективными биоразлагаемыми материалами для создания фармакологических препаратов с заданными свойствами для использования в медицине и “красной” биотехнологии [13]. Безусловно, все уникальные свойства этого вида природных лигнинов предопределяются его структурной организацией, однако экспериментальные данные о строении макромолекул лигнина серпухи практически отсутствуют.
В настоящей работе исследован лигнин, выделенный из серпухи венценосной (Serratula coronata L.), которая относится к растениям семейства сложноцветных (Asteraceae Dumort). Основная задача работы – характеристика гидродинамических, скейлинговых и конформационных свойств разбавленных растворов указанного лигнина с целью установления топологической структуры его макромолекул.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования служил лигнин, выделенный из надземной части ксилемы (стеблей) серпухи венценосной Serratula coronata L. Растения выращены на плантациях Института биологии (лаборатория биохимии и биотехнологии) Коми Научного центра Уральского отделения Российской академии наук (Сыктывкар). Возраст растений составил не менее трех лет. Сырье заготавливали в конце вегетационного периода. Компонентный состав стеблей серпухи венценосной, %: лигнин – 15.3, целлюлоза – 42.2, легкогидролизуемые полисахариды – 23.6, экстрактивные вещества – 6.2, зола – 6.7.
Препарат лигнина из растительного сырья выделяли известным методом путем обработки смесью диоксан–вода (9 : 1) в присутствии HCl (0.7%) при температуре кипения. Очистку препаратов от низкомолекулярных примесей проводили двукратным переосаждением из диоксана в диэтиловый эфир. Препараты высушивали методом лиофильной сушки. Выход препарата лигнина из серпухи венценосной (ЛСВ) составил 22% от общего количества лигнина в исходном сырье.
Элементный состав ЛСВ по данным химического анализа (“Hewlett Packard” (США) следующий: С 59.0, Н 6.3, О 34.7%. Мономерный состав макромолекул ЛСВ вычисляли по результатам спектроскопии ЯМР 13С (спектрометр “Bruker АМ-300”). Установлено, что количество G-единиц составляет 42%, S-единиц 50% и H-единиц 8%. Число межмономерных связей Cβ–О–С4 61, Cβ–О–С4 13, ΣCβ–5, Cβ–Cβ 18 (на 100 фенилпропановых единиц). Остальные межмономерные связи приходятся на долю Cγ–О–Cα и C5–C5.
Фракционирование лигнинов проводили методом дробного осаждения в системе диоксан–бензол. Количество неучтенных потерь при фракционировании около 6%. Каждую из восьми полученных фракций исследовали с помощью методов молекулярной гидродинамики. Растворитель ДМФА; $\eta _{0}^{{25}}$ = 0.78 × 10–3 Па с, $\rho _{0}^{{25}}$ = = 0.9434 г/см3. Измерения выполняли при 25°С.
Вязкость растворителя и растворов измеряли в капиллярном вискозиметре Оствальда с временем течения растворителя t0 = 52.0 с при температуре 25°С. Характеристическую вязкость [η] рассчитывали из экспериментальных значений удельной вязкости по уравнению Хаггинса ηуд./c = [η]с + k' $[\eta ]_{с }^{2}$ c + …, где c – массовая концентрация, k'– коэффициент Хаггинса, [η]с = = [η]ρ0 (ρ0 – плотность растворителя).
Эксперименты по скоростной седиментации проводили на аналитической ультрацентрифуге МОМ-3180 (Венгрия), оснащенной рефрактометрической оптической системой Филпота–Свенссона. Скорость вращения ротора 48 000 об/мин. Использовали двухсекторную полиамидную кювету с формированием искусственной границы методом наслаивания. Коэффициенты скоростной седиментации рассчитывали по скорости смещения максимума седиментограммы: S = = (Δlnx/Δt) ω–2, где ω – скорость вращения ротора центрифуги, x – координата максимума седиментограммы, Δt – время седиментации. Концентрация растворов при седиментационных экспериментах составляла ∼(1.5 ± 0.5) × 10–3 г/cм3. При характеристической вязкости 6–9 см3/г такая концентрация соответствует значениям критерия Дебая [η]с < 0.02, что свидетельствует о предельном разбавлении изучаемой системы. Поскольку в области сильного разбавления S очень слабо зависит от концентрации, коэффициенты седиментации считали отвечающими условию с → 0. Аналогичные рассуждения применимы и при диффузионных экспериментах.
Коэффициенты поступательной диффузии D определяли также на аналитической центрифуге МОМ-3180 из временной зависимости дисперсии концентрационной границы, образуемой в двухсекторной полиамидной кювете с формированием искусственной границы (высота вкладыша по ходу луча 12 мм). Угол фазоконтрастной пластинки 30°. Скорость вращения ротора 5 × 103 об/мин. Концентрация растворов ∼2.5 × 10–3 г/см3. Температура 25°С. Дисперсию рассчитывали стандартным по уравнению Δ2 = 0.5(F/Hмакс)2π–1 = 2Dt, где F и Hмакс – площадь и максимальная ордината контура диффузионной кривой. Значения коэффициента диффузии находили по формуле D = = 0.5(F/Hмакс)2/4πt.
Молекулярную массу MSD фракций ЛСВ вычисляли по формуле Сведберга
Здесь R – универсальная газовая постоянная, T – абсолютная температура, (1 – νρo) – фактор плавучести системы ЛСВ–ДМФА, который измеряли пикнометрическим методом. Согласно измерениям, фактор плавучести равен 0.334.При определении молекулярной массы низкомолекулярных фракций вместо соотношения Сведберга использовали уравнение
где [D] = ηoD/T; Ao – гидродинамический инвариант, найденный по результатам исследований высокомолекулярных фракций методом седиментационно-диффузионного анализа.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены концентрационные зависимости приведенной вязкости ηуд/c для образца ЛСВ, на основании которых рассчитана характеристическая вязкость [η]. Исследуемый полимер имеет довольно низкие значения [η] (табл. 1). К примеру, для фракции 2 при MSD = 26.8 × 103 значение [η] составляет всего 9.4 см3/г. Это заметно меньше величин [η] для линейных полимеров соответствующей молекулярной массы. Звездообразные полимеры, например лигнины GS-типа, также могут иметь более высокую характеристическую вязкость. Так, фракция лигнина осины с MSD = 29.2 × 103 характеризуется значением [η] = 16.1 см3/г, что существенно выше, чем для образца ЛСВ [14]. В то же время характеристическая вязкость соснового лигнина, по данным [4], составляет 8.1 × 103 при М = 24 × 103.
Рис. 1.
Зависимость приведенной вязкости ηуд/с от концентрации лигнина с для фракций образца ЛСВ. Номера прямых соответствуют номерам фракций в табл. 1.
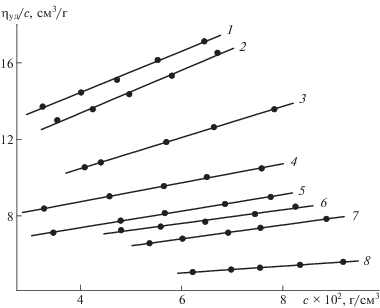
Таблица 1.
Гидродинамические характеристики лигнина серпухи венценосной
| Фрак-ция, № | [η], см3/г | D × 107, см2/c | S × 1013, c | MSD × 10–4 | MDη × 10–4 | MSη × 10–3 | A0 × 1010, эрг/К моль1/3 | k′ | Rh–D, нм | Rh–[η], нм | df | q |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 10. 7 ± 0.2 | 6.2 | 2.8 | 3.4 | 3.4 | 3.4 | 2.55 | 1.06 | 4.4 | 3.8 | 2.3 | 6.1 |
| 2 | 9.4 ± 0.3 | 7.0 | 2.5 | 2.7 | 2.7 | 2.7 | 2.56 | 1.42 | 3.9 | 3.4 | 2.3 | 5.3 |
| 3 | 7.6 ± 0.3 | 8.1 | 2.3 | 2.1 | 2.1 | 2.1 | 2.54 | 1.57 | 3.4 | 2.9 | 2.3 | 4.3 |
| 4 | 7.2 ± 0.1 | 10.1 | 1.7 | 1.3 | 1.2 | 1.3 | 2.62 | 1.09 | 2.7 | 2.4 | 2.3 | 4.1 |
| 5 | 6.0 ± 0.1 | 12.1 | 1.3 | 0.8 | 0.9 | 0.8 | 2.55 | 1.36 | 2.2 | 2.0 | 2.2 | 3.4 |
| 6 | 5.8 ± 0.2 | 13.2 | 1.1 | 0.6 | 0.6 | 0.6 | 2.48 | 1.19 | 2.1 | 1.8 | 2.2 | 3.3 |
| 7 | 4.9 ± 0.1 | 14.6 | – | – | 0.6 | – | – | 1.71 | 1.9 | – | – | 2.4 |
| 8 | 4.2 ± 0.1 | 16.3 | – | – | 0.5 | – | – | 1.16 | 1.7 | – | – |
Сравнимые с ЛСВ характеристические вязкости [η] демонстрируют сверхразветвленные полимеры [15–18]. Согласно работе [16], для фракции полиметил(аллил)карбоксилана с MSD = 10 × 103 характеристическая вязкость равна 6.5 см3/г, а для фракции 5 ЛСВ, для которой MSD = 8 × 103, величина [η] = 6 ± 0.1. Достаточно низкие значения характеристической вязкости свидетельствуют о том, что макромолекулы ЛСВ в растворе представляют собой весьма компактные структуры. Возникает вопрос, возможно ли использование в данном случае модели непроницаемых жестких сфер? В табл. 1 представлены степени сольватации q, найденные по соотношению $q = 0.{\text{4}}\left[ \eta \right]{\text{/}}\bar {\nu }$. Они находятся в интервале 2.4–6.1, т.е. [η] для изучаемого полимера в несколько раз выше, чем для непроницаемых сферических частиц. Это означает, что модель непроницаемых сфер в данном случае неприменима, как и для сверхразветвленных полимеров типа полиметил(аллил)карбосилана (ПКС-3, q = 1.5–4.4) и полиметил(ундеценил) карбосилана (ПКС-11, q = 4.5–8.1) [16–18].
Особенностью лигнинных полимеров вне зависимости от их биологического происхождения являются довольно высокие значения константы Хаггинса k', которая характеризует термодинамические взаимодействия полимер–растворитель и гидродинамическое поведение раствора [19]. В работе [20] приводятся данные о поведении различных полимерных систем с достаточно высокими, как и в нашем случае, константами Хаггинса. Для нашей системы ЛСВ–ДМФА величина k′ находится в интервале 1.0–1.7, причем какая-либо четкая зависимость от молекулярной массы отсутствует. В связи с этим определенный интерес представляет анализ значений k' с помощью уравнения, предложенного в работе [21]:
(1)
${{d}_{f}} = {\text{3ln}}M{\text{/}}[{\text{ln}}M + {\text{ln}}\left( {{\text{7}}.{\text{14}}k{\text{'}} - {\text{1}}} \right) - {\text{ln}}{{K}_{\eta }} - {\text{ln}}k{\text{'}}],$Как показали расчеты по уравнению (1), параметр df для различных фракций практически одинаков (табл. 1), хотя экспериментальные значения k' изменяются в довольно широких пределах. В частности, фракции 1 и 7 отличаются по этому показателю более чем в 1.6 раза. Отметим, что при расчетах использовали значения молекулярной массы MSD. Анализ данных в рамках уравнения (1) подтверждает надежность оценок коэффициентов Хаггинса. Найденная фрактальная размерность df, как характеристика степени заполненности объема, занимаемого макромолекулой, может быть использована для анализа конформационных свойств полимеров [22].
Фрактальная размерность df для θ-клубка линейного полимера равна двум. В “хорошем” растворителе макромолекула набухает, соответственно ее плотность уменьшается, что приводит к изменению фрактальной размерности до df = = 1.67. Конформация протекаемого клубка характеризуются размерностью df = 3/2, а для глобулярного состояния df = 3. Таким образом, судя по фрактальной размерности, конформация ЛСВ отлична от перечисленных выше, и этот полимер явно не относится к классу линейных.
Для характеристики степени связности элементов структуры предложено использовать фрактонную размерность ds [23], которая в отличие от фрактальной размерности df определяется лишь топологической структурой объекта. Согласно T.A. Vilgis [24], для макромолекулы в любом низкомолекулярном растворителе ds можно вычислить из соотношения
(D = 3 – размерность евклидова пространства).Параметр ds характеризует топологию макромолекул, поскольку его величина определяется уровнем связности мономерных элементов системы. Для линейной макромолекулы фрактонная размерность равна единице. Для разветвленных молекул величина ds всегда больше единицы. По имеющимся данным [25] для перколяционных кластеров ds = 1.33, а для сильно разветвленных объектов других типов может достигать 1.5 и более. Так, для биосинтетического лигнина на основе феруловой кислоты ds = 1.8, а моделирование роста разветвленных фрактальных макромолекул по механизму диффузионно-лимитированной агрегации указывает на то, что параметр ds может быть выше 2.3. Величина ds, рассчитанная по соотношению (2), для исследуемого полимера составляет 1.5–1.7 (табл. 2). Если опираться на этот параметр, то топологию макромолекул ЛСВ следует характеризовать как сильно разветвленную. Отметим, что при расчетах ds использовали значения фрактальной размерности df, определенные по соотношению $d_{f}^{{ - 1}}$ = |bD| = [(bη + 1)/3] = = 1 – bS [25], где bD, bη и bS – параметры соотношений Марка–Куна–Хаувинка (табл. 2).
Таблица 2.
Параметры соотношений типа Марка–Куна–Хаувинка и фрактальные размерности для лигнина серпухи венценосной
| Корреляция | bi | Ki | ri | df | ds |
|---|---|---|---|---|---|
| [η]–MSD | 0.34 ± 0.04 | 2.9 × 10–1 | 0.93 | 2.2 | 1.6 |
| D–MSD | –0.44 ± 0.02 | 6.1 × 10–5 | 0.99 | 2.3 | 1.7 |
| S–MSD | 0.56 ± 0.02 | 8.2 × 10–16 | 0.99 | 2.3 | 1.7 |
| [η]–МDη | 0.41 ± 0.04 | 1.5 × 10–1 | 0.94 | 2.1 | 1.5 |
| D–МDη | –0.47 ± 0.01 | 8.3 × 10–5 | 0.99 | 2.1 | 1.5 |
| S–МDη | 0.57 ± 0.04 | 7.5 × 10–16 | 0.98 | 2.3 | 1.7 |
Анализ гидродинамического поведения и топологической структуры ЛСВ продолжим с помощью результатов, полученных методом поступательной диффузии. В табл. 1 представлены гидродинамические радиусы макромолекул, рассчитанные на основе значений D по уравнению Стокса
Здесь R – газовая постоянная, T – абсолютная температура, N – число Авогадро, η0 – вязкость растворителя.
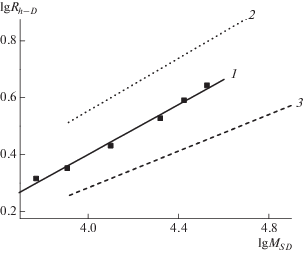
Представляет интерес сопоставление гидродинамических радиусов макромолекул ЛСВ и других полимеров. Как показывает анализ данных, размеры молекул ЛСВ и лигнинов G-типа (хвойные растения) приблизительно одинаковы [26]. Так, в низкомолекулярной области для лигнина лиственницы Rh–D = 1.8 нм (МSD = 4.6 × 103), для соснового лигнина Rh–D = 1.5 нм (МSD = 4.6 × 103), а для ЛСВ Rh–D = 1.7 нм (МDη = 4.7 × 103). Как уже указывалось, лигнины хвойных растений относят к полимерам с хаотически разветвленной структурой. Если же сравнить ЛСВ с лигнинами GS-типа (лиственные растения), то можно заметить, что у макромолекул лигнинов лиственных пород древесины размеры несколько выше. Например, для лигнина акации, который отнесен к звездообразным полимерам, гидродинамический радиус фракции с МDη = 5.8 × 103 составляет 2 нм. Для получения более полной картины можно сравнить исследуемый образец с сверхразветвленными полимерами. На рис. 2 показана взаимосвязь между молекулярной массой и гидродинамическими радиусами Rh–D для ЛСВ и двух поликарбосиланов [16]: ПКС-3 и ПКС-11. Данная взаимосвязь демонстрирует близость ЛСВ к типичным сверхразветвленным сополимерам по характеру гидродинамического поведения.
Для анализа конформационных свойств в системе полимер–растворитель часто используются соотношения, устанавливающие корреляционную взаимосвязь между гидродинамическими характеристиками и молекулярной массой в виде уравнений Марка–Куна–Хаувинка
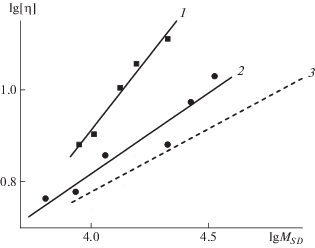
где Сi = [η] S или D; bi ≡ bη, bD, и bS – скейлинговые индексы; Ki – соответствующие коэффициенты.Показатель степени bη для ЛСВ составляет 0.34 ± 0.04 при расчетах по величине MSD (рис. 3, прямая 2) и 0.41 ± 0.04 при вычислении из данных по MDη (табл. 2), тогда как лигнин рябины Sorbus aucuparia [7], представляющий собой звездообразный полимер, характеризуется величиной bη = = 0.65 (рис. 3, прямая 1).
Можно также сравнить эти показатели с результатами исследования разветвленных полимеров, например хвойных лигнинов и полиметил(аллил)карбосиланов [16] (рис. 3, прямая 3). Для лигнинов сосны и ели приводятся [4, 5] следующие значения bη: 0.25 (по MDη) и 0.28 (MDS), 0.25 (по MDη) и 0.22 (MSD) соответственно, что указывает на некоторые различия между этими лигнинами и ЛСВ по форме макромолекул. Показатели степени bη для систем ЛСВ–ДМФА и ПКС-3–гексан [16] приблизительно совпадают.
На рис. 4 представлены зависимости lgS и lgD от lgMSD, которые имеют линейный характер. Скейлинговые индексы Марка–Куна–Хаувинка, соответствующие им коэффициенты Кi и стандартные ошибки определения представлены в табл. 2.
Рис. 4.
Зависимость коэффициентов поступательной диффузии D и скоростной седиментации S от MSD для ПКС-3 [16] (1, 3) и ЛСВ (2, 4).
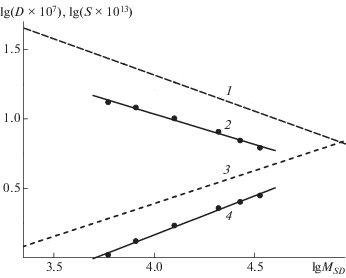
Полученные данные свидетельствуют о корректности линейной аппроксимации результатов в координатах уравнения Марка–Куна–Хаувинка. При анализе скейлинговых индексов следует отметить безусловную выполнимость соотношения |bD| = [(bη + 1)/3] = 1 – bS и полное соответствие гидродинамических характеристик, оцениваемых по эффектам вращательного и поступательного трения. Кроме того, необходимо обратить внимание на то, что bS > |bD| > bη. Такое соотношение значений индексов отражает, но с точностью до наоборот, типичную для линейных полимеров закономерность по чувствительности соответствующих гидродинамических параметров к изменению молекулярной массы.
В дополнение к приведенным выше данным проведем расчет показателей степени в уравнении, связывающем молекулярную массу с вязкостным гидродинамическим радиусом макромолекул Rh–[η]:
Радиус гидродинамически эквивалентной сферы Rh–[η] определяли по уравнению Эйнштейна
Как показали вычисления с использованием МDη, величина bh–[η] составляет 0.44, что не противоречит другим характеристикам гидродинамического поведения исследуемого полимера.
В табл. 1 представлены значения гидродинамического инварианта Цветкова–Кленина [27]
Величины A0 для различных фракций ЛСВ практически одинаковы, а среднее по фракциям значение не превышает 2.6 × 1010 эрг/К моль1/3, что даже меньше теоретической величины для жестких непроницаемых сфер (2.91 × 1010 эрг/К моль1/3). Для синтетических гибкоцепных полимеров A0 обычно составляет 3.2 × 1010 эрг/К моль1/3. Жесткоцепные полимеры характеризуются средним значением инварианта 3.8 × 1010 эрг/К моль1/3 [27].
Значения параметра A0 зависят от термодинамической гибкости цепи и особенностей топологической структуры полимеров [27]. Что касается природных лигнинов, то экспериментально показано, что для них величина A0 зависит от происхождения лигнина. По данным [26], наименьшее значение A0 имеют лигнины гваяцилсирингильного типа (лиственные породы древесины) – для них A0 = (2.3–2.9) × 1010 эрг/К моль1/3, для гваяцильных (хвойных) лигнинов A0 = (2.9–3.1) × × 1010 эрг/К моль1/3, а для лигнинов однолетних растений семейства злаковые A0 = (3.1–3.2) × × 1010 эрг/К моль1/3. Фракции биосинтетических лигнинов характеризуются широким разбросом величин A0, от 2.1 × 1010 до 3.6 × 1010 эрг/К моль1/3 [28].
Для исследуемого препарата ЛСВ значение A0 ≅ 2.6 × 1010 эрг/К моль1/3, что совпадает с литературными данными для лигнинов GS-типа и фторированных производных полиметил(аллил)карбосилана, (2.6 ± 0.5) × 1010 эрг/К моль1/3 [18].
Можно отметить, что достаточно низкие значения A0 получают и для дендримерных молекул, например, для лактодендримеров A0 = (2.61 ± 0.07) × × 1010 эрг/К моль1/3 [29]. Так или иначе, значения инварианта Цветкова–Кленина для ЛСВ находятся в хорошем соответствии с данными для полимеров с высокой степенью разветвленности. Однако, как уже неоднократно отмечалось [16–18], интерпретация величин инварианта Цветкова–Кленина требует дальнейшего развития теории для полимеров сложной архитектуры.
Таким образом, впервые проведено исследование лигнинного биополимера, выделенного из многолетнего травянистого растения вида серпуха венценосная Serratula coronata L. На основании экспериментальной оценки транспортных характеристик и характеристической вязкости вычислены гидродинамические радиусы макромолекул, скейлинговые и фрактальные показатели, отражающие закономерности поведения этого полимера при изменении молекулярной массы фракций. Сравнительный анализ гидродинамического поведения различных полимеров свидетельствует о том, что лигнин ЛСВ по комплексу физико-химических свойств отличается от линейных и звездообразных лигнинов GSH- и GS-типа и, напротив, мало отличается от сверхразветвленных полимеров. Полученные экспериментальные данные могут быть использованы для дальнейшего развития топотаксономической классификации природных лигнинов, а также для разработки новых продуктов биомедицинского и биотехнологического направления.
Исследования выполнены в рамках Государственного задания Института биологии (ГР № АААА-А17-117121270025-1), Института геологии (ГР № AAAA-A17-117121270037-4) и Института химии (ГР № АААА-А18-118012390189-3) Коми научного центра Уральского отделения Российской академии наук. Работа выполнена с использованием оборудования Центра коллективного пользования “Химия” Института химии Коми научного центра Уральского отделения Российской академии наук (Сыктывкар).
Список литературы
Lignins: Occurrence, Formation, Structure, Properties, and Reactions / Ed. by K.V. Sarkanen, C.H. Ludwig. New York: Wiley–Interscience, 1971.
Faix O. // Holzforschung–International Journal of the Biology, Chemistry, Physics and Technology of Wood. 1991. V. 45. № s1. P. 21.
Ralph J., Lundquist K., Brunow G., Lu F., Kim H., Schatz P.F., Marita J.M., Hatfield R.D., Ralph S.A., Christensen J.H., Boerjan W. // Phytochem. Rev. 2004. V. 3. P. 29.
Павлов Г.М., Михайлова Н.А., Беляев В.Ю., Сюткин В.Н. // Журн. прикл. химии. 1995. Т. 68. С. 316.
Afanasjev N.I., Fesenko A.V., Vishnyakova A.P., Chainikov A.N. // Polymer Sience A. 2008. V. 50. № 2. P. 190.
Karmanov A.P., Belyaev V.Yu., Marchenko T.A., Kocheva L.S., Monakov Yu.B. // Polymer Science A. 2002. V. 44. № 2. P. 129.
Karmanov A.P., Kuz’min D.V., Shamshina I.N., Be-lyaev V.Y., Kocheva L.S., Matveev D.V., Monakov Y.B. // Polymer Science A. 2004. V. 46. № 6. P. 613.
Karmanov A.P., Belyaev V.Y., Kocheva L.S. // Russ. J. Bioorgan. Chem. 2011. V. 37. № 7. P. 842.
Kocheva L.S., Karmanov A.P., Mironov M.V., Belyi V.A., Belyaev V.Y., Monakov Y.B. // Russ. J. Appl. Chem. 2008. V. 81. № 11. P. 2033.
Achyuthan K.E., Achyuthan A.M., Adams P.D., Dirk S.M., Harper J.C., Simmons B.A., Singh A.K. // Molecules. 2010. V. 15. № 12. P. 8641.
Белый В.А., Печникова А.А., Кочева Л.С., Москалев А.А., Карманов А.П. // Успехи геронтологии. 2010. Т. 23. № 2. С. 221.
Карманов А.П., Кочева Л.С., Борисенков М.Ф. // Бутлеровские сообщения. 2016. Т. 45. № 1. С. 76.
Borisenkov M.F., Karmanov A.P., Kocheva L.S., Markov P.A., Istomina E.I., Bakutova L.A., Popov S.V. // Int. J. Polym. Mater. Polymeric Biomater. 2016. V. 65. № 9. P. 433.
Karmanov A.P., Marchenko T.A., Kocheva L.S., Belyaev V.Y., Kuznetsov S.P., Monakov Y.B. // Russ. Polym. News. 2002. V. 7. P. 16.
Perevyazko I., Seiwert J., Schömer M., Frey H., Schubert U.S., Pavlov G.M. // Macromolecules. 2015. V. 48. № 16. P. 5887.
Tarabukina E.B., Shpyrkov A.A., Tarasova E.V., Amirova A.I., Filippov A.P., Sheremet’eva N.A., Muzafarov A.M. // Polymer Science A. 2009. V. 51. № 2. P. 150.
Amirova A.I., Belyaeva E.V., Tarabukina E.B., Sheremet’eva N.A., Muzafarov A.M., Filippov A.P. // Polymer Science C. 2010. V. 52. № 1. P. 70.
Filippov A.P., Belyaeva E.V., Tarabukina E.B., Amirova A.I. // Polymer Science C. 2011. V. 53. № 1. P. 107.
Yamakawa H. Modern Theory of Polymer Solutions. New York: Harper & Row, 1971.
Pamies R., Cifre J.G.H., Martínez M.D.C.L., de la Torre J.G. // Colloid Polym. Sci. 2008. V. 286. № 11. P. 1223.
Козлов Г.В., Темираев К.Б., Созаев В.А. // Журн. физ. химии. 1999. Т. 73. № 4. С. 766.
Kozlov G.V., Doblin I.V., Zaikov G.E. The Fractal Physical Chemistry of Polymer Solutions and Melts. Toronto: Apple Acad. Press, 2013. P. 334.
Alexander S., Orbach R. // J. Phys. Lett. 1982. 43: P. 625.
Vilgis T.A. // Physica A. 1988. V. 153. P. 341.
Karmanov A.P., Monakov Y.B. // Russ. Chem. Revs. 2003. V. 72. № 8. P. 715.
Bogolitsyn K.G., Lunin V.V., Kosyakov D.S., Karmanov A.P., Skrebets T.E., Popova N.R., Malkov A.V., Gorbova N.S., Pryakhin A.N., Shkaev A.N., Ivanchenko N.L. Fizicheskaya khimiya lignina (Physical Chemistry of Lignin). Moscow: Akademkniga, 2010.
Цветков В.Н., Лавренко П.Н., Бушин С.В. // Успехи химии. 1982. Т. 51. № 10. С. 1698.
Карманов А.П., Монаков Ю.Б. // Высокомолек. соед. Б 1995. Т. 37. № 2. С. 328.
Павлов Г.М., Корнеева Е.В., Михайлова Н.А., Roy R., Cejas Ortega P.C., Alamino Perez M.A. // Высокомолек. соед. A. 1999. Т. 41. № 11. С. 1810.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)