Высокомолекулярные соединения (серия А), 2019, T. 61, № 1, стр. 82-90
Процессы самоорганизации в водном растворе поливинилового спирта, L-цистеина и нитрата серебра
Д. В. Вишневецкий a, *, А. Н. Адамян a, В. С. Лагусева a, А. И. Иванова a, С. Д. Хижняк a, П. М. Пахомов a
a Тверской государственный университет
170100 Тверь, ул. Желябова, 33, Россия
* E-mail: rickashet@yandex.ru
Поступила в редакцию 05.06.2018
После доработки 06.08.2018
Принята к публикации 20.08.2018
Аннотация
Комплексом методов (вискозиметрия, УФ- и ИК-спектроскопия, pH-метрия и динамическое светорассеяние) исследованы процессы самоорганизации в водном растворе ПВС, L-цистеина и нитрата серебра под действием сульфата натрия. Показано, что макромолекулы ПВС взаимодействуют с супрамолекулами на основе цистеина и серебра, представляющими собой цепочки [—Ag−S(R)—Ag−S(R)—]n, где R – остаток цистеина, путем образования водородных связей. Увеличение концентрации ПВС ведет к росту вязкости получаемых гидрогелей, более выраженным тиксотропным свойствам, росту интенсивности основных полос поглощения в УФ-спектре, отвечающих за образование супрамолекулярных структур, увеличению pH, росту средних гидродинамических размеров частиц и падению электропроводности системы. Методом сканирующей электронной микроскопии выявлено образование регулярной макропористой структуры высушенных гидрогелей. Установлено, что путем изменения концентрации ПВС в растворе можно регулировать как плотность пространственной сетки, так и пористость высушенного геля. При высокой концентрации ПВС в растворе (2%) обнаружено образование суперпористой структуры высушенного геля.
ВВЕДЕНИЕ
Получение и изучение свойств супрамолекулярных структур на основе серосодержащих аминокислот и солей серебра имеет более чем десятилетний опыт [1–3]. Результатом этих исследований стало открытие новой гелеобразующей системы, состоящей из аминокислоты L-цистеина и некоторых солей серебра. Смешение исходных компонентов при определенной концентрации приводило к гелеобразованию. В большинстве случаев процесс гелеобразования инициировался добавлением в цистеин-серебряный раствор ряда электролитов (водных растворов различных солей металлов). Методами ИК-, УФ-спектроскопии и реологии было выяснено, что именно анион соли оказывает существенное влияние на гелеобразование. Полученный гидрогель имел тиксотропные свойства, т.е. восстанавливал свою прежнюю структуру после механического разрушения.
Рассматриваемая система представляет интерес в связи с тем, что гелеобразование протекает при взаимодействии довольно простых по структуре низкомолекулярных компонентов и их крайне низкой концентрации (0.01%). Кроме того, прекурсоры сами по себе являются биологически активными веществами: серебро обладает ярко выраженными антибактериальными свойствами, а цистеин играет особую роль в процессах жизнедеятельности организма и имеет радиопротекторные и антиоксидантные свойства. Изучение антибактериальных свойств получаемого гидрогеля показало, что в структуре геля цистеин и ионы серебра оказывают более сильный эффект, чем цистеин и нитрат серебра по отдельности [4–7].
Указанным супрамолекулярным гидрогелям помимо антимикробных можно придать и другие лечебные свойства путем введения в гидрогель соответствующих лекарственных препаратов [2]. Такие гидрогели можно использовать также в тканевой инженерии.
Существенными недостатками супрамолекулярных гидрогелей являются их низкие вязкость и прочностные свойства. Для повышения вязкости гидрогеля можно вводить в него водорастворимый полимер. Но до сих пор не ясно, будут ли супрамолекулярные гидрогели совмещаться с раствором полимера, образуя взаимопроникающие пространственные сетки, или же супрамолекулярная система будет инкапсулирована в матрице полимера. Этот вопрос представляет как научный, так и практический интерес. В случае образования взаимопроникающих сеток можно создавать композиции с равномерным распределением супрамолекулярных гидрогелей, а, следовательно, и лекарственных препаратов в полимерной матрице. Во втором случае можно готовить полимерные капсулы, содержащие лекарственные супрамолекулярные гидрогели для адресной доставки лекарственных препаратов в живой организм.
Особый интерес вызывают наиболее доступные полимерные гидрогели ПВС и выделенные в отдельную группу криогели ПВС [8]. Гидрогели и криогели ПВС в частности предлагается использовать для адресной доставки биоактивных веществ [9]. Однако такие системы ввиду слишком больших значений концентрации полимера (10% и выше) при получении геля обладают сравнительно низкой степенью пористости. Сам по себе ПВС хорошо сочетается с аминокислотами, улучшая доставку веществ к сердцу и скелетной мускулатуре, т.е. способствует минимизации отторжения имплантированных материалов [10]. Кроме того, ПВС может применяться в качестве заменителя плазмы при переливании крови [11].
Целью настоящей работы является изучение процесса самоорганизации в смешанных водных растворах ПВС, L-цистеина и нитрата серебра, а также обсуждение возможности практического использования новых получаемых систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе использовали L-цистеин 99% и нитрат серебра 99.8% (“Acros”), сульфат натрия квалификации “х. ч.”, а также ПВС с молекулярной массой 5 × 104 и количеством остаточных ацетатных групп менее 2% (“Нева Реактив”, Россия). Растворителем служила дистиллированная вода.
Цистеин-серебряный раствор (ЦСР) готовили из растворов цистеина (10–2 моль/л) и нитрата серебра (10–2 моль/л). В пустой сосуд сначала наливали воду в определенном количестве, затем добавляли L-цистеин и нитрат серебра. Далее опалесцирующий раствор оставляли на сутки для созревания. В конечном итоге получали прозрачный с желтоватой окраской ЦСР, созревание которого контролировали с помощью УФ-спектроскопии и динамического светорассеяния (ДСР) [2]. Гидрогели ЦСР−ПВС получали добавлением к раствору ЦСР водного раствора ПВС, а после водного раствора электролита Na2SO4.
ИК-спектры образцов (22−24 мг), приготовленных в виде таблеток с бромидом калия (∼700 мг), регистрировали на ИК-фурье-спектрометре “Vertex-70” (“Bruker”). Образцы предварительно вымораживали, осадок отделяли центрифугированием при скорости 104 об/мин в течение 30 мин, тщательно промывали водой, а затем сушили при температуре ∼30°С.
Электронные спектры образцов регистрировали на УФ-спектрофотометре “Evolution Array” (“Thermo Scientific”) в кварцевой кювете с толщиной слоя 1 мм.
Интенсивность светорассеяния в исследуемых растворах измеряли методом ДСР с использованием анализатора Zetasizer “Nano ZS” (“Malvern”) c Не−Ne-лазером (633 нм) мощностью 4 мВт. Все измерения осуществляли при температуре 25°С в конфигурации обратного рассеяния (173°), обеспечивающей наибольшую чувствительность прибора. Математическую обработку результатов полученных кросс-корреляционных функций флуктуаций интенсивности рассеянного света g2(τ) проводили в программе Zetasizer Software методом куммулянтов. Гидродинамический радиус рассеивающих частиц рассчитывали из коэффициента диффузии D по формуле Стокса−Эйнштейна: D = kT/6πηR, где k – константа Больцмана, T – абсолютная температура, η – вязкость среды, R – радиус рассеивающих частиц. Электрофоретическую подвижность агрегатов в образцах измеряли в U-образных капиллярных кюветах.
Вязкость образцов измеряли на вибрационном вискозиметре SV-10 (“A&D Company”), в котором вибрация сенсорных пластин проходила с частотой 30 Гц и постоянной амплитудой ∼1 мм. Измерение осуществляли при комнатной температуре. Прочность гидрогелей оценивали по пятибалльной шкале в соответствии с работой [12].
Величину pH растворов и гелей вычисляли, используя pH-метр “Seven Multi S70” фирмы “Mettler Toledo”.
Морфологию высушенных гидрогелей (ксерогелей) исследовали методом сканирующей электронной микроскопии с помощью установки “JEOL JSM-6610 LV” в Центре коллективного пользования Тверского гос. ун-та. Образцы наносили тонким слоем на двустороннюю проводящую углеродную ленту для хорошего электрического контакта с предметным столиком микроскопа. Сушку осуществляли в режиме вакуума 10–4 Па. Для уменьшения деградирующего воздействия на образцы сканирующего электронного зонда исследования выполняли при низком ускоряющем напряжении (не более 7 кВ) в режиме вторичных электронов. Разрешающая способность микроскопа при таком напряжении составляла 5 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе рассмотрен процесс самоорганизации в низкоконцентрированных (0.01 мас. %) смешанных водных растворах L-цистеина, нитрата серебра и ПВС.
Установлено, что при смешении созревшего водного раствора ЦСР (Ag+ : L-цистеин = 1.27 : 1.0, 0.01 мас. % в конечном растворе) с водным раствором ПВС концентрации 0.002, 0.01, 0.02, 1.0 и 2.0 мас. % в конечном растворе образуется гомогенный оптически прозрачный раствор.
При добавлении к полученному раствору электролита Na2SO4 (0.0001 мас. % в конечном растворе) через 30 мин происходит структурирование ЦСР, смешанного с ПВС, и образование оптически прозрачного гидрогеля.
Ввиду того что гидрогель цистеина и нитрата серебра обладает тиксотропными свойствами [2], интересно проверить, будут ли гели с ПВС обладать таким же свойством. При ежедневном разрушении гелей в течение двух месяцев наблюдений восстановление прежней структуры протекало для всех гелей. Однако их прочность существенно зависела от содержания ПВС в геле. Система с содержанием ПВС 2% имела оценку 5 баллов в течение двух месяцев (при переворачивании пузырька с гидрогелем система находилась в состоянии геля в течение 1 ч и далее разрушалась). Остальные гели: гель без ПВС и гели с содержанием ПВС 0.002, 0.01, 0.02 и 1.0% оценивались в 5 баллов в течение первых 7 суток и в 2 балла далее (при переворачивании пузырька с гидрогелем система моментально разрушалась). Таким образом, визуальный анализ показывает, что концентрация ПВС оказывает существенное влияние на структурирование образующихся гидрогелей.
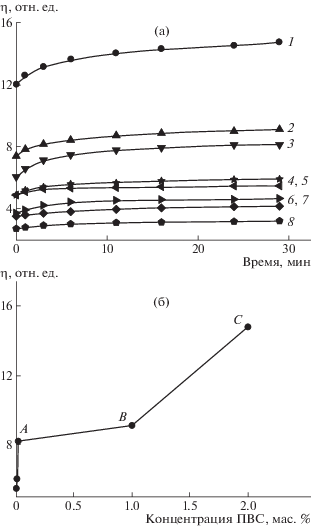
Реологические испытания гидрогелей подтвердили закономерности, наблюдаемые визуально. На рис. 1а приведены кинетические кривые изменения вязкости гелеобразных систем. Вязкость увеличивается со временем и постепенно выходит на насыщение. Чем выше содержание ПВС в системе, тем выше ее вязкость. На рис. 1б приведена зависимость вязкости гидрогелей от концентрации ПВС. Увеличение концентрации полимера в 50 раз по отношению к концентрации ЦСР слабо влияет на вязкость системы (отрезок AB), тогда как повышение концентрации полимера в 100 раз (2% ПВС) – уже оказывает существенное влияние на вязкость (отрезок BC). Похожие зависимости были получены в работах [13, 14] при изучении влияния ПВС на реологические характеристики сильно заряженных смешанных мицелл олеат калия−N-октилтриметиламмоний бромид. На этих зависимостях также можно выделить два участка изменения вязкости: при концентрации ПВС до 1% и выше.
Рис. 1.
а: Зависимости вязкости гелеобразных систем от времени после смешения компонентов ЦСР− 2.0%ПВС−Na2SO4 (1), ЦСР−1.0%ПВС−Na2SO4 (2), ЦСР−0.02%ПВС−Na2SO4 (3), ЦСР−0.01%ПВС−Na2SO4 (4), ЦСР−2.0%ПВС (5), ЦСР−0.002%ПВС−Na2SO4 (6), ЦСР−Na2SO4 (7) и ЦСР (8). б: Вязкость гидрогеля через 1 сутки после приготовления в зависимости от концентрации ПВС.
Для изучения мгновенных тиксотропных характеристик, полученные гидрогели были механически разрушены, после чего сразу же проводилось измерение их вязкостных характеристик. При значениях концентрации полимера сравнимых с концентрацией ЦСР, вязкость системы не меняется, однако при увеличении концентрации полимера в 50 и 100 раз вязкость линейно увеличивается. Таким образом, можно предположить, что макромолекулы ПВС взаимодействуют с супрамолекулярной структурой ЦСР. Каков же характер этого взаимодействия?
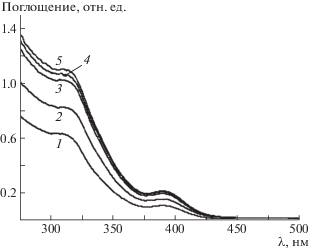
Для ответа на данный вопрос рассмотрим УФ-спектры гидрогелей, которые представлены на рис. 2. Положение основных полос поглощения при 310 и 390 нм, отвечающих супрамолекулярным цепочкам (–Ag−S(Cys)–Ag−S(Cys)–)n, которые образованы за счет нековалентного взаимодействия молекул меркаптида серебра [12], не изменяется при добавлении ПВС к ЦСР, что свидетельствует о хорошей их совместимости. Следует также заметить, что добавление полимера увеличивает интенсивность указанных полос. Можно предположить, что макромолекулы ПВС выступают в роли сшивок, соединяющих цепочки ЦСР, или вытесняют молекулы ЦСР в отдельную фазу, тем самым концентрируя их. Действительно [15], при получении криогеля ПВС, движущей силой быстрого образования сетки геля является образование льда при замерзании воды и вытеснение льдом макромолекул ПВС в отдельные каналы, в результате чего происходит концентрирование ПВС и быстрое образование пространственной сетки.
Рис. 2.
УФ-спектры поглощения гидрогелей: 1 – ЦСР, 2 − ЦСР:Na2SO4 (0.01 : 0.0001 мас. %); 3, 4, 5 – ЦСР : ПВС : Na2SO4 (0.01 : 1.0 : 0.0001, 0.01 : 0.02 : 0.000, 0.01 : 2.0 : 0.0001 мас. % соответственно).
Измерение pH гидрогелей показало, что увеличение концентрации полимера ведет к сдвигу pH в щелочную область. Это может быть следствием образования водородной связи между гидроксильными группами ПВС и карбоксильной группой ЦСР. В химии полимеров хорошо известны реакции взаимодействия ПВС или ПЭГ с поликислотами, например с полиметакриловой кислотой, приводящие к образованию прочных комплексов за счет водородных связей [16]. Здесь следует обратить внимание на количество протонированных и депротонированных карбоксильных групп. Действительно, pK1 для чистого L-цистеина в воде при 25°С составляет 1.71, для ЦСР – 2.60, т.е. депротонирование уже имеет место быть. В работе [17] показано, что для ЦСР отношение депротонированных к протонированным карбоксильным группам 4:1. Следовательно, в нашем случае имеется 20% групп несущих протон, а значит, происходит образование водородной связи (рис. 3). Кроме того, возможны ион-дипольные взаимодействия гидроксильной группы ПВС и полностью протонированной положительно заряженной аминогруппы ЦСР; взаимодействие же цепей ПВС с серебром маловероятно, так как сродство кислорода к серебру крайне низкое [18].
Результаты исследования объектов методом ДСР показаны на рис. 4. Видно, что во всех случаях в процессе самоорганизации получается полимодальное распределение частиц по размерам. Для гелей коэффициенты полидисперсности частиц отдельных пиков выше, чем для ЦСР, что указывает на процессы структурирования при переходе от ЦСР к гелю. Увеличение концентрации полимера приводит к значительному укрупнению агрегатов (в 2−4 раза), что также подтверждает участие полимера в структурировании конечной композиции (табл. 1). Следует отметить, что собственные размеры макромолекул ПВС (гидродинамический диаметр) составляют ∼20 нм. Однако наши исследования водных растворов ПВС разной концентрации показали, что помимо основного пика малых частиц (быстрая мода) присутствует и пик больших частиц (250 нм, медленная мода), возможно, это связано с процессом агрегации клубков ПВС за счет водородного связывания [19] и в образовании агрегатов участвуют как малые, так и большие частицы.
Рис. 4.
Распределение частиц по размерам: 1 – ЦСР, 2 − ЦСР : Na2SO4 (0.01 : 0.0001 мас. %); 3, 4, 5 – ЦСР : ПВС : Na2SO4 (0.01 : 1.0 : 0.0001, 0.01 : 0.02 : 0.000, 0.01 : 2.0 : 0.0001 мас. % соответственно).
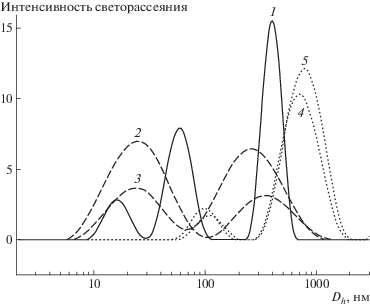
Таблица 1.
Средний гидродинамический диаметр частиц Dh для изучаемых супрамолекулярных систем
| Образец | Dh, нм |
|---|---|
| ЦСР | 15 |
| 60 | |
| 400 | |
| ЦСР−Na2SO4 | 25 |
| 340 | |
| ЦСР−0.02% ПВС−Na2SO4 | 25 |
| 250 | |
| ЦСР−1.0% ПВС−Na2SO4 | 100 |
| 800 | |
| ЦСР−2.0% ПВС−Na2SO4 | 100 |
| 800 |
Еще одним доказательством взаимодействия макромолекул ПВС с супрамолекулами ЦСР может быть измерение заряда поверхности частиц ЦСР при добавлении к нему ПВС. Данные табл. 2 свидетельствуют о том, что добавление электролита к исходному ЦСР (без ПВС) влечет понижение величины заряда ξ ровно в 2 раза (что и следовало ожидать). Добавление полимера оказывает слабое влияние на величину заряда (табл. 2). Таким образом, можно сделать вывод о преимущественном взаимодействии гидроксильных групп полимера с карбоксильными группами ЦСР путем образования водородной связи. Здесь также обращает на себя внимание необычное поведение системы при увеличении концентрации ПВС от 0 до 1.0%: вначале увеличение, а затем, спад величины заряда, электрофоретической подвижности μp и электропроводности σ. Электропроводность растворов определяется в основном двумя факторами – концентрацией активных частиц и скоростью их движения. В зависимости от условий, оба фактора могут стать лимитирующими. В данном случае, согласно данным УФ-спектроскопии, в системе с содержанием ПВС 0.02% концентрация активных частиц выше, чем в системе без ПВС, что и приводит к небольшому скачку электропроводности. При переходе к системе с содержанием ПВС 2.0% наблюдается падение электропроводности, а также увеличение электрофоретической подвижности и заряда поверхности частиц. Возможно, это связано с увеличением скорости движения частиц за счет вытеснения макромолекулами ПВС молекул ЦСР в каналы. Действительно, для ПВС с М = 5 × 104 и концентрацией в растворе 2.0% система находится вблизи концентрации кроссовера С* [19, 20] (по нашим оценкам с использованием вискозиметра Уббелоде С* = 1.7 мас. %). В результате этого ПВС начинает образовывать слабую пространственную сетку зацеплений, вероятно, через ее каналы и происходит направленное движение частиц ЦСР. Более того, если каналы ориентированы по ходу приложенного потенциала электродов, то данный эффект становится лимитирующим.
Таблица 2.
Дзетта потенциал ξ, электрофоретическая подвижность μp и электропроводность σ полученных гидрогелей
| Образец | ξ, мВ | μp, мкм см/(В с) | σ, м См/см |
|---|---|---|---|
| ЦСР | 57.8 ± 4.87 | 4.53 ± 0.38 | 0.279 |
| ЦСР−Na2SO4 | 29.7 ± 6.75 | 2.33 ± 0.53 | 0.225 |
| ЦСР−0.02% ПВС−Na2SO4 | 30.9 ± 8.07 | 2.42 ± 0.63 | 0.240 |
| ЦСР−1.0% ПВС−Na2SO4 | 28.2 ± 7.53 | 2.20 ± 0.59 | 0.177 |
| ЦСР−2.0% ПВС−Na2SO4 | 34.3 ± 5.25 | 2.69 ± 0.41 | 0.157 |
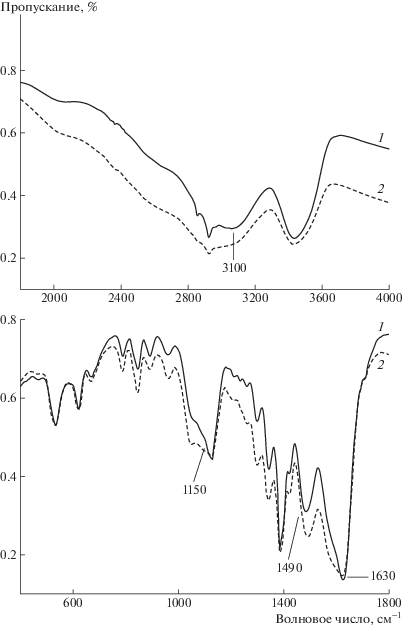
Результаты ИК-спектрального анализа полученных гидрогелей представлены на рис. 5. Так, благодаря введению в систему ПВС в ИК-спектре наблюдаются характерные изменения в области валентных колебаний ν(NH$_{3}^{ + }$). Полоса поглощения на частоте 3100 см–1 сдвигается в область меньших частот (∼2950 см–1). В области деформационных асимметричных колебаний δа(NH$_{3}^{ + }$) полоса поглощения 1630 см–1 также сдвигается в область меньших частот, а полоса 1490 см–1, характеризующая деформационные симметричные колебания δs(NH$_{3}^{ + }$), − в область более высоких частот. Для валентных колебаний протонированной карбоксильной группы ν(СО) в области 1150 см–1 наблюдается изменение формы полосы [21–23]. Предварительные результаты анализа ИК-спектров указывают на взаимодействие ПВС с молекулами ЦСР преимущественно путем образования Н-связей с частично протонированной карбоксильной группой и кислым протоном заряженной аминогруппы.
Суммируя полученные данные, можно заключить, что введение полимера в раствор ЦСР, во-первых, приводит к образованию гомогенных оптически прозрачных гидрогелей (что свидетельствует о хорошей совместимости ПВС с ЦСР), а во-вторых, повышает вязкость получаемых гидрогелей.
Представляет интерес также морфология полученных гидрогелей. На рис. 6 представлены микроснимки высушенных гидрогелей. Хорошо видна пространственная сетка геля и довольно регулярная макропористая структура. Для контрольной системы (рис. 6в, гель без ПВС) средний диаметр пор составляет 5 мкм, средняя толщина нитей сетки – 0.7 мкм. Для сравнения представлена микрофотография исходного высушенного ЦСР (рис. 6а), на которой, как и следовало ожидать, отсутствует пространственный каркас, но видна плотная ламелярно-цепочечная структура, ранее наблюдаемая в ЦСР методом просвечивающей электронной микроскопии [12]. Важно, что у высушенного раствора ПВС (рис. 6б) отсутствует какая-либо пространственная организация. Добавление в гидрогель на основе ЦСР поливинилового спирта при концентрации 0.02 мас. % (рис. 6г) влечет изменение формы пор от сферической к эллиптической, а также увеличение средней толщины нитей пространственной сетки до 2 мкм, при этом средний диаметр пор сохраняется (∼5 мкм). Для геля с содержанием ПВС 1.0% (рис. 6д) характеристики сохраняются, однако здесь уже можно наблюдать образование пористо-слоистой структуры. Увеличение концентрации ПВС до 2.0% (рис. 6е) приводило к утолщению нитей до 4 мкм и уменьшению среднего диаметра пор до 2 мкм, пористо-слоистая структура сохранялась. Таким образом, морфологически полученные ксерогели представляют собой пространственную сетку, построенную из супрамолекулярных цепочек меркаптида серебра, которая инкапсулирована в матрицу ПВС [2, 12]. Действительно, при увеличении концентрации полимера прослеживалось утолщение нитей пространственной сетки и уменьшение размера пор. Это согласуется с результатами реологических испытаний: при повышении концентрации полимера вязкость геля росла за счет наличия более плотной пространственной сетки. На кривых распределения частиц по размерам при концентрации полимера в растворе 1.0 и 2.0% можно видеть агрегаты со средним диаметром 0.7–0.8 мкм. При их объединении в пространственную сетку образуются нити, толщина которых, согласно микроснимкам, составляет 2.0–4.0 мкм. Результаты УФ-спектроскопии и измерения дзетта потенциала, также подтверждают предполагаемое строение сетки. В ксерогеле, как уже упоминалось, супрамолекулярные структуры ЦСР находятся в матрице ПВС, в растворе же (особенно при концентрации ПВС 1.0–2.0%) ПВС образует сеть каналов, по которым могут двигаться заряженные частицы ЦСР.
Рис. 6.
Микрофотографии высушенных образцов ЦСР (а), 2% ПВС (б), гидрогелей ЦСР–Na2SO4 (в), ЦСР–0.02%ПВС–Na2SO4 (г), ЦСР–1.0%ПВС–Na2SO4 (д), ЦСР–2.0%ПВС–Na2SO4 (е).
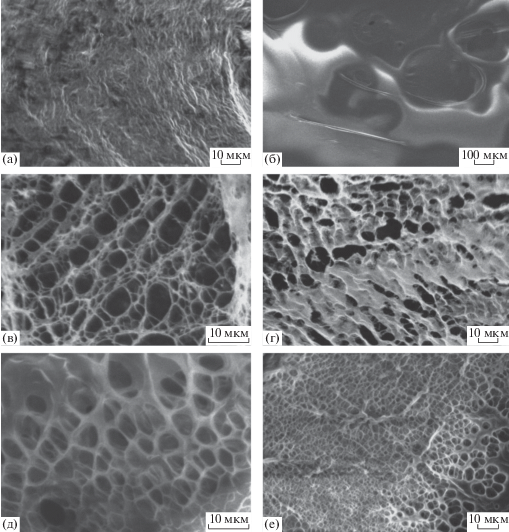
На рис. 6е представлена структура ксерогеля ЦСР−2% ПВС−Na2SO4. Как видно, она является суперпористой. Данный результат представляет интерес как с теоретической, так и с практической точки зрения. Действительно, при концентрации ПВС 2% (Mn = 5 × 104) система приближается к режиму полуразбавленного раствора, когда макромолекулярные клубки ПВС начинают контактировать друг с другом. Казалось бы, при высушивании данной системы не должно было получиться такой высокоразвитой поверхности с регулярным распределением пор по размерам. По-видимому, коллапса пор не происходит, так как вследствие взаимодействия ПВС с ЦСР система становится термодинамически стабильной.
ЗАКЛЮЧЕНИЕ
Макропористые материалы нашли широкое применение в областях техники и медицины [24–26]. В качестве примера можно привести инкапсулирование различных веществ как в матрицу ПВС, так и в поры самого гидрогеля (ксерогеля). Актуальным направлением является применение таких материалов в тканевой инженерии. Обычно они используются как переносчики для клеток и (или) ростовых факторов, а их первоначальная задача − поддержка роста и развития здоровой ткани, а также интеграция в окружающие ткани. Поэтому подложки должны быть биосовместимы и не должны выделять токсичных веществ или вызывать явный воспалительный ответ.
Кроме того, макропористая структура гидрогеля может использоваться для адресной доставки биологически активных веществ к тканям организма. Например, в геле можно инкапсулировать различные полианионы (ДНК, микрорибонуклеиновая кислота) путем их связывания положительно-заряженными частицами ЦСР, а образуемая структура будет инкапсулирована в матрице ПВС. При этом доставку лекарственных веществ к определенным органам можно осуществить, например, путем введения в поры образца магнитных частиц.
Таким образом, в результате проведенных исследований создана гидрогелевая термодинамически совместимая стабильная система на основе L-цистеина, нитрата серебра и ПВС, которая имеет повышенную вязкость и пористость.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 18-33-00146мол_а) и фонда Министерства образования и науки (код проекта 4.5508.2017/БЧ) на оборудовании Центра коллективного пользования Тверского государственного университета.
Список литературы
Pakhomov P.M., Ovchinnikov M.M., Khizhnyak S.D., Lavrienko M.V., Nierling W., Lechner M.D. // Colloid J. 2004. V. 66. № 1. P. 65.
Супрамолекулярные гели / П.М. Пахомов, С.Д. Хиж-няк, М.М. Овчинников, П.В. Комаров. Тверь: Тверской гос. ун-т, 2011.
Ilyin S.O., Spiridonova V.M., Savelyeva V.S., Ovchinnikov M.M., Khizhnyak S.D., Frenkin E.I., Pakhomov P.M., Malkin A.Ya. // Colloid J. 2011. V. 73. № 5. P. 646.
Pakhomov P.M., Abramchuk S.S., Khizhnyak S.D., Ovchinnikov M.M., Spiridonova V.M. // Nanotechnol. Russ. 2010. V. 5. № 3–4. P. 209.
Pakhomov P.M., Ovchinnikov M.M., Khizhnyak S.D., Roshcina O.A., Komarov P.V. // Polymer Science A. 2011. V. 53. № 9. P. 820.
Baranova O.A., Kuz’min N.I., Samsonova T.I., Rebetskaya I.S., Petrova O.P., Pakhomov P.M., Khizhnyak S.D., Komarov P.V., Ovchinnikov M.M. // Fibre Chem. 2011. V. 43. № 1. P. 90.
Баранова О.А., Хижняк С.Д., Пахомов П.М. // Изв. вузов. Технология легкой промышленности. 2014. № 1. С. 37.
Bucholz F.L., Peppas N.A. // ACS Symp. “Superabsorbent Polymer. Science and Technology”. Washington: Am. Chem. Soc., 1994. P. 573.
Lozinsky V.I., Zubov A.L., Titova E.F. // Enzyme Microb. Technol. 1997. V. 20. P. 182.
Lok Chum-Nam, Ho Chi-Ming, Chen Rong // J. Biol. Inorg. Chem. 2007. V. 12. P. 527.
DeMerlis C.C., Schoneker D.R. // Food Chem. Toxicol. 2003. V. 41. P. 319.
Khizhnyak S.D., Komarov P.V., Ovchinnikov M.M., Zherenkova L.V., Pakhomov P.M. // Soft Matter. 2017. V. 30. № 13. P. 5168.
Shibaev A.V., Abrashitova K.A., Kuklin A.I., Orekhov A.S., Vasiliev A.L., Iliopoulos I., Philippova O.E. // Macromolecules. 2017. V. 50. P. 339.
Shibaev A.V., Makarov A.V., Kuklin A.I., Iliopoulos I., Philippova O.E. // Macromolecules. 2018. V. 51. P. 213.
Lozinsky V.I. // Usp. Khim. 1998. V. 67. № 7. P. 641.
Yiping C., Ying G., Juan D., Juan L., Yuxing P., Yip C., Albert C. // J. Mater. Chem. 2002. V. 12. P. 2957.
Alekseev V.G., Semenov A.N., Pakhomov P.M. // Russ. J. Inorg. Chem. 2012. V. 57. № 7. P. 1041.
Sant S.B., Weir D.G., Burrel R.E. // Scr. Mater. 2009. V. 61. № 9. P. 907.
Kjoniksen A.-L., Nistrom B. // Macromolecules. 1996. V. 29. P. 7116.
Hanwen G., Jiyu H., Rongjie Y., Lei Y. // J. Appl. Polym. Sci. 2010. V. 116. P. 2734.
Koleva B., Spiteller M., Kolev T. // Am. Acids. 2010. V. 38. P. 295.
Cui Y., Wang Y., Zhao L. // Small. 2015. V. 11. № 38. P. 5118.
Pakhomov P.M., Ovchinnikov M.M., Khizhnyak S.D., Komarov P.V. // Macromol. Symp. 2012. V. 316. P. 97.
Yasuda H.Ed. // J. Appl. Polym. Sci. 1990. V. 46. P. 46.
Vlakh E.G., Tennikova T.B. // J. Sep. Sci. 2013. V. 36. P. 110.
Lozinsky V.I., Galaev I.Yu., Plieva F.M., Savina1 I.N., Jungvid H., Mattiasson B. // Trends Biotechnol. 2003. V. 21. № 10. P. 445.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)