Высокомолекулярные соединения (серия А), 2019, T. 61, № 1, стр. 24-32
Инфракрасные спектры и структура твердых полимерных электролитов на основе поливинилового спирта и галогенидов лития
С. А. Загорская a, О. Н. Третинников a, *
a Институт физики Национальной академии наук Беларуси
220072 Минск, пр. Независимости, 68-2, Белоруссия
* E-mail: o.tretinnikov@ifanbel.bas-net.by
Поступила в редакцию 31.05.2018
После доработки 04.08.2018
Принята к публикации 16.08.2018
Аннотация
Методом ИК-фурье-спектроскопии исследованы пленки, полученные из водных растворов поливинилового спирта с солями MX, где M = Li, Na, K, Cs и X = Cl, Br, I, с концентрацией соли 10 мол. % относительно полимера. Установлено, что степень кристалличности ПВС в пленках, содержащих “нелитиевые” соли, в 1.5 раза выше, чем в пленке без соли (51–57 и 37% соответственно), тогда как в пленках с литиевыми солями полимер почти полностью аморфный (0–7%). Показано, что литиевые соли растворяются в полимере полностью, а “нелитиевые” – лишь частично. Добавление солей приводит к смещению максимума полосы валентных колебаний гидроксильных групп ПВС. Направление и величина смещения зависят от размера аниона и катиона добавленной соли. Это объясняется разрывом водородных связей ОН···ОН и образованием связей OH···Х– и донорно-акцепторных связей M+···OH между ионами солей и ОН-группами полимера. Сила этих связей убывает в последовательности Cl– > Br– > I– и Li+ > Na+ > K+ > Cs+ соответственно. Высокая растворимость литиевых солей в ПВС и подавление ими его кристаллизации обусловлены высоким сродством атома кислорода ОН-группы полимера к иону лития.
ВВЕДЕНИЕ
Одной из важнейших задач в области применения литиевых батарей является получение твердых полимерных электролитов (ТПЭ), сочетающих в себе химическую стойкость, механическую прочность, гибкость и проводимость по ионам лития выше 10–4 См см–1 при комнатной температуре [1, 2]. Такие электролиты позволили бы перейти к производству полностью твердотельных, гибких, тонкопленочных литий-ионных химических источников тока.
Исторически первыми и наиболее изученными ТПЭ являются растворы солей лития в полиэтиленоксиде. Эти, ставшие классическими, ТПЭ дают требуемую проводимость только при температуре выше 70–90°С, а подвижность ионов лития в них меньше, чем подвижность анионов. Причины недостатков литиевых ТПЭ на основе ПЭО были выяснены в результате детальных исследований их структуры методами ИК-, КР- и ЯМР-спектроскопии [3]. Установлено, что ион лития сольватирован атомами кислорода четырех–пяти мономерных звеньев ПЭО. Поэтому для переноса иона лития необходима сегментальная подвижность цепей, которая, как известно, возникает при более высоких значениях температуры, чем значения температуры стеклования. Также обнаружено, что ПЭО при добавлении солей лития сохраняет способность кристаллизоваться. Кристаллические области составляют до 60% объема полимера и не участвуют в ионном транспорте, так как необходимая для этого подвижность на уровне сегментов цепей в них отсутствует. Наконец, было показано, что анионы, в отличие катионов, не сольватируются полимером, что обусловливает их высокую подвижность по сравнению с катионами. Данные о структуре растворов солей лития в ПЭО, объясняющие особенности их ионной проводимости, позволяют разрабатывать химические (сополимеризация, сшивание) и физические (введение твердых добавок и наполнителей) способы получения ТПЭ на основе ПЭО с улучшенными свойствами [4].
Соли лития растворяются не только в ПЭО, но и в некоторых других полярных полимерах. Одним из таких полимеров является поливиниловый спирт. Растворы солей лития в ПВС имеют несколько важных особенностей по сравнению с растворами в ПЭО [5]. Во-первых, введение литиевых солей в ПВС понижает его кристалличность. Во-вторых, подвижность ионов лития в ПВС не связана с его сегментальной подвижностью. В-третьих, ионная проводимость композиций ПВС–соль лития растет с ростом содержания последней в широком диапазоне концентрации. Благодаря этим особенностям ионная проводимость растворов литиевых солей в ПВС при комнатной температуре на несколько порядков выше, чем растворов в ПЭО [5]. Поэтому в последние годы твердые полимерные электролиты на основе ПВС и солей лития привлекают к себе все более пристальное внимание [6–8]. Очевидно, что для эффективной разработки таких ТПЭ нужны детальные знания их структуры и механизмов структурообразования.
Цель данной работы заключается в том, чтобы, используя ИК-спектры ТПЭ состава ПВС–LiX (X = Cl, Br, I), полученных в виде пленок из водных растворов, определить механизм растворения солей в полимере, природу ион-полимерных взаимодействий и их влияние на кристалличность полимера. Также для сравнения исследованы пленки ПВС с галогенидами натрия, калия и цезия. Пленки с так называемыми “нелитиевыми” солями, но на основе ПВС меньшей чистоты, молекулярной массы и степени гидролиза уже были изучены ранее [9].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В настоящей работе использовали ПВС марки “Mowiol™ 28-99” (“Aldrich”) со степенью гидролиза ≥99.0% и средней М = 14.5 × 104. Соли LiCl и LiBr (чистота ≥99.0%; “Sigma-Aldrich”), LiI (чистота ≥99.0%; “Aldrich”), CsCl (чистота ≥98.0%; “Sigma”); соли KCl, KBr, KI и NaCl (все квалификации “х. ч.”; “Реахим”) применяли без дополнительной очистки.
Для получения пленок ПВС–соль сначала готовили отдельно водный раствор ПВС с концентрацией полимера 8 мас. % (2 моль/кг) и растворы солей с концентрацией 0.2 моль/кг. Из исходных растворов путем их смешивания (1 : 1) получали совместные водные растворы с концентрацией полимера и соли 1.0 : 0.1 моля/кг. Таким образом, мольное соотношение ПВС : соль в пленках составляло 10 : 1. Далее в раствор соли покапельно добавляли раствор ПВС при постоянном перемешивании на магнитной мешалке, после чего перемешивание продолжали еще 1 ч при скорости 900–1000 об/мин. Для приготовления пленки ПВС без соли исходный раствор ПВС разбавляли водой в 2 раза. Из полученных растворов готовили пленки толщиной 4–6 мкм методом полива на дно чашек Петри из ПС (Cell Culture Dish, Corning) с последующей сушкой при 20–25°С 1–3 суток. Пленки с солями лития получались пластичными из-за содержащейся в них воды и необратимо растягивались при попытке отделить их от подложки. Поэтому их дополнительно подсушивали в течение 1 ч при 50°С в чашках Петри в низкотемпературной лабораторной печи, после чего сразу отделяли от подложки и фиксировали в держателях образцов для ИК-спектроскопии. Для удаления остаточной воды пленки с нелитиевыми солями и пленки без соли, закрепленные в держателях, дополнительно сушили 2 ч при 70°С, а пленки с литиевыми солями – 2 ч при температуре 100°С. Полученные таким способом пленки ПВС с солями лития были полностью прозрачными. Кроме того, пленки с LiCl и LiBr были бесцветными, а пленки с LiI – слегка желтоватыми. Пленки с нелитиевыми солями были слегка белесыми.
Так как пленки с солями лития отличаются высокой гигроскопичностью, то для уменьшения времени контакта пленок с воздухом их ИК-спектры записывали непосредственно после сушки. В промежутке между извлечением из печи и помещением в кюветное отделение спектрометра пленки держали в эксикаторе.
ИК-спектры регистрировали на ИК-фурье-спектрометре “Nicolet Nexus 670 FT-IR” с разрешением 2 см–1 и усреднением 64 сканирований в интервале 4000–400 см–1. Спектр фона записывали для каждой пленки отдельно непосредственно перед завершением ее сушки. Содержание воды в пленках контролировали по интенсивности полосы деформационных колебаний группы ОН при 1640 см–1. Для всех исследуемых пленок оно не превышало 3%. Это свидетельствовало о том, что наблюдаемые спектральные эффекты обусловлены влиянием соли, а не остаточной воды.
Анализ и обработку спектров выполняли с помощью программного обеспечения Omnic 7.3. Степень кристалличности поливинилового спирта α (%) в исследуемых пленках определяли из ИК-спектров по формуле [10]:
где (A1144/A1094) – отношение пиковых интенсивностей полос поглощения ПВС при 1144 и 1094 см–1, измеренных относительно базовой линии, представляющей собой касательную к крыльям сложного спектрального контура в области 930–1180 см–1.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Структура всякого способного к кристаллизации гидроксилсодержащего полимера характеризуется, в первую очередь, степенью кристаллического порядка и системой водородных связей. Для исследования кристалличности ПВС наибольший интерес представляет сложная широкая полоса поглощения в области 930–1180 см–1 с максимумом при 1094 см–1, образованная сильно перекрывающимися полосами валентных колебаний С–О в группе СОН полимера [11]. При кристаллизации ПВС на высокочастотном крыле этой широкой полосы появляется узкая полоса с максимумом при 1144 см–1, интенсивность которой растет с увеличением содержания кристаллической фазы в структуре полимера [12, 13], что позволяет определять степень кристалличности ПВС из его ИК-спектра [10]. Наибольшей чувствительностью к структуре водородных связей обладают полосы валентных колебаний гидроксильных групп νОН, которые в случае спиртов лежат в диапазоне 3100–3600 см–1. Поэтому при представлении и анализе спектральных данных в настоящей работе приведены только структурно-чувствительные области 930–1180 и 3100–3600 см–1. Для возможности сравнения толщины исследуемых пленок ПВС по интенсивности полос валентных колебаний С–Н, дополнительно показана область 2750–3000 см–1, в которой расположены эти полосы.
Согласно литературным данным, при растворении щелочно-галоидных солей в воде [14–16] и низкомолекулярных спиртах метаноле и глицерине [17–19] происходит разрыв водородных связей OH…OH между ОН-группами молекул растворителя с образованием донорно-акцепторных связей атомов кислорода этих групп с катионами M+…OH и водородных связей с анионами соли OH…A–. При этом сила связи О–Н меняется, что проявляется в смещении максимума полосы νОН. Кроме того, изменяется интенсивность этой полосы в ИК-спектрах [14–20]. Описанные эффекты зависят от размеров аниона и катиона растворенной соли. ПВС является полимером, в состав мономерного звена которого входит спиртовая ОН-группа. Поэтому можно ожидать, что и для него будут наблюдаться аналогичные изменения. Согласно работе [11] в сухих пленках ПВС, полученных из его водных растворов, каждая ОН-группа ПВС образует водородные связи с двумя другими гидроксилами, выступая одновременно и донором и акцептором протона. При добавлении соли в раствор, из которого формируются пленки, ОН-группы ПВС могут связываться уже не только друг с другом, но и с ионами соли, приводя тем самым к изменениям в ИК-спектре полимера [9].
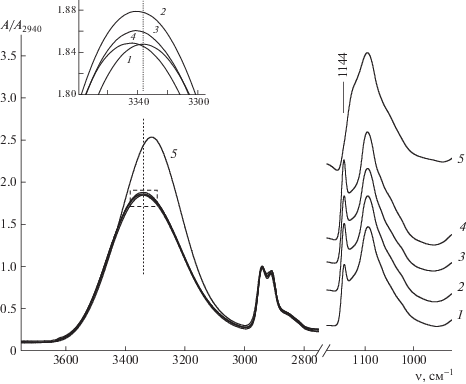
Рассмотрим сначала влияние катионов на ИК-спектры ПВС в пленках ПВС–соль. Чтобы исключить влияние аниона, будем сравнивать пленки, содержащие соли, отличающиеся только катионом: LiCl, NaCl, KCl и CsCl. ИК-спектры этих пленок показаны на рис. 1. Спектр пленки ПВС с хлоридом лития резко выделяется на фоне остальных спектров увеличенной интенсивностью и существенным низкочастотным смещением полосы νОН, а также отсутствием кристаллического пика при 1144 см–1. Спектры пленок с нелитиевыми хлоридами, относительно спектра пленки без соли, характеризуются небольшим увеличением интенсивности и слабым высокочастотным смещением полосы νОН, а также сильно увеличенной интенсивностью полосы кристалличности при 1144 см–1.
Рис. 1.
ИК-спектры пленки ПВС без соли (1) и с солями NaCl (2), KCl (3), CsCl (4) и LiCl (5). Здесь и на рис. 2 в области 1180–920 см–1 спектры смещены по оси ординат для удобства рассмотрения. На вставке в увеличенном масштабе показана область спектра, выделенная пунктиром на основном рисунке.
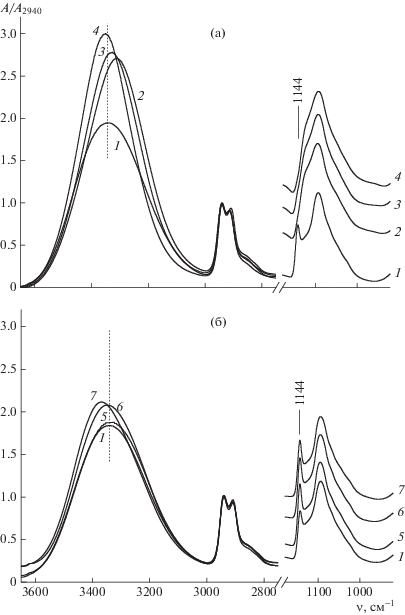
ИК-спектры пленок, отлитых из водных растворов ПВС с добавлением хлорида, бромида, иодида лития и аналогичных солей калия показаны на рис. 2. В этих двух сериях пленок соли отличаются только анионом. Видно, что добавление любого галогенида лития в раствор ПВС влечет за собой исчезновение полосы кристалличности ПВС при 1144 см–1. Одновременно смещается максимум полосы νОН ПВС и существенно увеличивается ее интенсивность. В спектрах пленок, содержащих LiCl и LiBr, максимум полосы νОН смещен в область низких частот относительно его положения в спектре пленки без соли (причем для LiCl смещение сильнее), а в спектре пленки с LiI – в область высоких частот. Интенсивность полосы νОН растет с увеличением размера аниона добавленной соли, т.е. в последовательности LiCl, LiBr, LiI. Галогениды калия, в отличие от галогенидов лития, приводят не к исчезновению полосы кристалличности ПВС при 1144 см–1, а к сильному росту ее интенсивности (рис. 2б). Интенсивность полосы νОН тоже увеличивается, но гораздо слабее, чем в случае солей лития, а ее максимум смещается в высокочастотную область.
Рис. 2.
ИК-спектры пленки ПВС без соли (1) и с солями: а – LiCl (2), LiBr (3), LiI (4); б – KCl (5), KBr (6), KI (7).
Перейдем к количественному анализу и интерпретации полученных результатов. Сначала рассмотрим влияние солей на кристалличность ПВС, а затем на частоту и интенсивность полосы νOH.
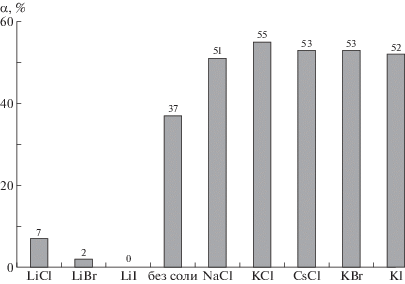
На рис. 3 представлена диаграмма значений степени кристалличности ПВС в пленках, полученных из его водного раствора без соли и из растворов с различными щелочно-галоидными солями. Значения α были определены из ИК-спектров пленок по приведенной выше формуле. Видно, что литиевые соли влекут понижение степени кристалличности с 37% для пленки без соли до значений близких к нулю. Соли других щелочных металлов, напротив, повышают α почти в 1.5 раза.
Рис. 3.
Диаграмма значений степени кристалличности ПВС в пленках, отлитых из водного раствора без соли и из растворов с различными щелочно-галоидными солями. Пояснения в тексте.
Кристаллизующее действие на ПВС нелитиевых солей было объяснено ранее [9]. В водном растворе макромолекулы ПВС связаны водородными связями с молекулами воды, тогда как для формирования и стабилизации кристаллического порядка в ПВС необходимо образование водородных связей между OH-группами полимера. По мере испарения воды из формирующейся пленки, ОН-группы ПВС освобождаются и могут создавать водородные связи друг с другом. Но одновременно с этим снижение содержания воды приводит к уменьшению подвижности полимерных цепей, которая также необходима для кристаллизации. В результате пленки, сформированные из чисто водного раствора ПВС, имеют относительно небольшую кристалличность. При формировании пленки из водного раствора ПВС с нелитиевыми солями, по мере испарения воды возникает и растет “конкуренция” между ионами соли и гидроксильными группами полимера за молекулы H2O, в результате которой гидроксилы ПВС “отдают” связанную воду ионам соли. Благодаря этому процессу, разрыв водородных связей ПВС–вода и образование водородных связей ПВС–ПВС происходит при большем содержании воды, а значит и при большей подвижности полимерных цепей, чем в растворе ПВС без соли. Это вызывает более высокую кристалличность ПВС в пленке. Что касается растворов ПВС с литиевыми солями, то можно предположить, что в них ионы лития связаны не только с молекулами воды, но и с ОН-группами полимера. Такое допущение оправдано, так как известно, что спиртовые ОН‑группы обладают высоким сродством к ионам Li+: оно примерно в 1.5, 2.0 и 2.5 раза выше, чем к ионам Na+, K+ и Cs+ соответственно [21]. При испарении воды гидроксилы ПВС остаются связанными с ионами лития, а значит, не могут образовывать водородные связи друг с другом, препятствуя тем самым кристаллизации полимера. Поэтому ПВС в пленках с солями лития практически полностью аморфный. Кроме того, высокое сродство ОН-групп ПВС к ионам лития должно приводить к высокой растворимости литиевых солей в этом полимере. Действительно, пленки ПВС с литиевыми солями, подобно пленкам без соли, выглядят совершенно прозрачными как при рассмотрении невооруженным глазом, так и в оптическом микроскопе. Тогда как пленки с галогенидами остальных щелочных металлов визуально матовые и при рассмотрении через микроскоп обнаруживают узорчатые структуры из микрокристаллов соли (рис. 4).
На рис. 5а в виде диаграммы представлены частоты максимума полосы νOH в ИК-спектрах пленок ПВС с хлоридами щелочных металлов LiCl, NaCl, KCl и CsCl, расположенные в порядке увеличения радиуса катиона соли. Видно, что частота растет с увеличением радиуса катиона. Согласно исследованиям колебательных спектров воды и спиртов в присутствии ионов соли, такое поведение полосы νOH в ряду солей щелочных металлов с одинаковым анионом вызвано образованием донорно-акцепторной связи M+···OH катиона соли с кислородом ОН-группы [13–16]. Чем меньше плотность заряда катиона M+ (т.е. больше его радиус), тем слабее донорно-акцепторная связь M+…O–H и сильнее валентная связь О–Н, а значит больше частота νOH [16]. На рис. 5а видно, что частота максимума полосы νOH в спектре пленки ПВС, содержащей хлорид лития, почти на 30 см–1 меньше, чем в спектре пленки без соли, а в спектрах пленок с нелитиевыми хлоридами она на 1–10 см–1 больше. Это объясняется тем, что донорно-акцепторная связь Li+…OH иона лития с кислородом ОН-группы ПВС настолько сильная, что уменьшает силу связи О–Н и понижает частоту νОН сильнее, чем образование по этому атому кислорода водородной связи ОН···ОН. Для катионов остальных щелочных металлов связь M+···OH слабее, чем для Li+, соответственно связь О–Н сильнее, причем настолько, что частота νOH оказывается больше, чем в спектре ПВС без соли.
Рис. 5.
Диаграммы значений частоты максимума полосы νOH в ИК-спектрах пленок ПВС с хлоридами щелочных металлов (а) и галогенидами лития и калия (б), расположенных в порядке увеличения радиуса катиона и аниона соли. Пунктирной линией обозначена частота максимума полосы νOH в спектре пленки без соли (ν$_{{{\text{OH}}}}^{{{\text{П В С }}}}$).
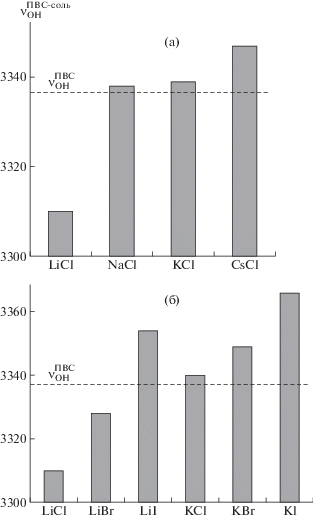
На рис. 5б приведена диаграмма значений частоты максимума полосы νOH в ИК-спектрах пленок ПВС с галогенидами лития и калия, расположенными в порядке увеличения радиуса аниона соли. Как для серии с ионом лития, так и для серии с ионом калия частота максимума полосы νOH тем больше, чем больше радиус аниона. На основании исследований ИК-спектров растворов солей в воде и спиртах [14, 19, 20] такое поведение частоты νOH можно однозначно объяснить образованием водородной связи OH···Х– между ОН-группой ПВС и анионом соли, сила которой ослабевает с увеличением радиуса аниона, так как при этом уменьшается его плотность заряда. Отметим, что хотя внутри литиевой и калиевой серий значение νOH растет с увеличением размера аниона, в литиевой серии оно меньше значения νOH чистого ПВС для анионов Cl– и Br– и больше для аниона I–, тогда как в калиевой серии значения νOH больше, чем для чистого ПВС для всех трех анионов. Это объясняется совместным влиянием катиона и аниона соли на частоту νOH. В общем случае катион и анион могут как усиливать, так и ослаблять связь О–Н в ПВС относительно силы этой связи в ПВС без соли. Причем их влияние может отличаться как по абсолютному значению, так и по направлению. Наблюдаемое в ИК-спектре смещение полосы νOH будет определяться результирующим действием.
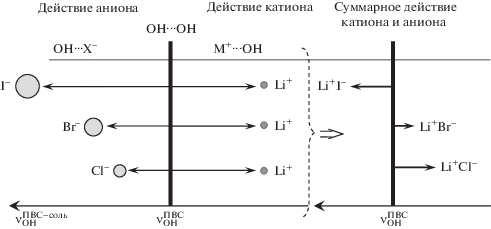
Схематически эффект совместного влияния катиона и аниона соли на частоту νOH показан на рис. 6 для галогенидов лития. Катионы и анионы связываются с ОН-группой ПВС, разрывая связь OH⋅⋅⋅OH в полимере, которой соответствует частота νОН, обозначенная на рисунке как ν$_{{{\text{OH}}}}^{{{\text{П В С }}}}$. С одной стороны, анионы соли смещают полосу νОН в сторону больших частот, потому что образуют водородные связи с гидроксильной группой ПВС (OH⋅⋅⋅X–), которые слабее связи OH⋅⋅⋅OH. Смещение тем сильнее, чем больше радиус аниона. С другой стороны, катион лития смещает полосу νОН в сторону меньших частот из-за образования донорно-акцепторной связи Li+…OH, которая настолько сильная, что понижает частоту νОН сильнее, чем образование по этому атому кислорода водородной связи ОН…ОН. Направление и величина результирующего (наблюдаемого в ИК-спектре) смещения полосы νОН относительно ее положения в спектре ПВС без соли представляет собой сумму смещений, обусловленных анионом и катионом.
Рис. 6.
Направление смещения полосы νOH относительно ее положения в спектре пленки ПВС без соли (ν$_{{{\text{OH}}}}^{{{\text{П В С }}}}$), вызванное разрывом водородной связи ОН…ОН между ОН-группами ПВС и связыванием этих групп с катионом (M+…OH) и анионом (OH⋅⋅⋅X–) соли; результат суммарного действия аниона и катиона на примере галогенидов лития.
Как установлено выше (см. рис. 2), взаимодействие ионов соли с ОН-группами ПВС не только смещает полосу νOH, но и увеличивает ее интенсивность. Это особенно заметно для солей лития. Можно предположить, что ион лития влияет на интенсивность полосы νOH сильнее, чем ионы других щелочных металлов. Однако утверждать это однозначно не представляется возможным. Интенсивность поглощения пропорциональна концентрации поглощающих центров, которыми в данном случае являются комплексы M+…OH. Концентрация таких комплексов в пленках ПВС с солями лития выше, чем в пленках с нелитиевыми солями, так как в последних только небольшая часть добавленной соли растворена в полимере (см. рис. 4). Поэтому более сильное увеличение интенсивности полосы νOH при добавлении литиевых солей может быть вызвано их лучшей растворимостью в ПВС.
Что касается анионов соли, то на рис. 2 виден рост интенсивности полосы νOH относительно ее интенсивности в спектре пленки без соли в последовательности Cl– < Br– < I–. При этом литиевые соли дают существенно большее усиление интенсивности по сравнению с солями калия, что, возможно, обусловлено отмеченной выше лучшей растворимостью литиевых солей в ПВС. Рост интенсивности полосы νOH при образовании водородной связи обусловлен изменением электронной плотности на связи О–Н за счет взаимодействия с акцептором водородной связи по механизму переноса заряда или электростатической поляризации [22–24]. Перенос заряда в нашем случае можно исключить, так как согласно работе [24], в электронной структуре комплексов OH⋅⋅⋅X– он уменьшается с увеличением радиуса галогенид-иона. В то же время, поляризуемость галогенид-ионов растет с увеличением их радиуса [25], т.е. в том же порядке, что и их влияние на интенсивности полосы νOH в ПВС. Таким образом, можно сделать вывод, что именно электростатическая поляризация ОН-группы под действием аниона ответственна за наблюдаемое увеличение интенсивности полосы валентных колебаний данной группы.
ЗАКЛЮЧЕНИЕ
В результате ИК-спектроскопических исследований пленок поливинилового спирта, содержащих щелочно-галоидные соли, обнаружено, что соли лития (в отличие от нелитиевых солей) хорошо растворяются в этом полимере и препятствуют его кристаллизации. Установлено, что растворение соли происходит путем сольватации ее ионов ОН-группами полимера за счет образования водородных связей этих групп с анионами и донорно-акцепторных связей с катионами. Показано, что причина высокой растворимости литиевых солей в ПВС и подавления ими его кристаллизации – высокое сродство атома кислорода ОН-группы полимера к иону лития. Полученные данные позволяют объяснить высокую проводимость литиевых ТПЭ на основе ПВС на уровне их ион-молекулярной структуры.
Список литературы
Tarascon J.M., Armand M. // Nature. 2001. V. 414. № 6861. P. 359.
Meyer W.H. // Adv. Mater. 1998. V. 10. № 6. P. 439.
Ratner M.A., Shriver D.F. // Chem. Rev. 1988. V. 88. № 1. P. 109.
Yue L., Ma J., Zhang J., Zhao J., Dong S., Liu Z., Cui G., Chen L. // Energy Storage Mater. 2016. V. 5. P. 139.
Yamamoto T., Inami M., Kanbara T. // Chem. Mater. 1994. V. 6. № 1. P. 44.
Hu X.L., How G.M., Zhang M.Q., Rong M.Z., Ruan W.H., Giannelis E.P. // J. Mater. Chem. 2012. V. 22. № 36. P. 18961.
Ma Y., Li L.B., Gao G.X., Yang X.Y., You Y. // Electrochim. Acta. 2016. V. 187. P. 535.
Ek G., Jeschull F., Bowden T., Brandell D. // Electrochim. Acta. 2017. V. 246. P. 208.
Tretinnikov O.N., Zagorskaya S.A. // Polymer Science A. 2013. V. 55. № 8. P. 463.
Tretinnikov O.N., Zagorskaya S.A. // J. Appl. Spectrosc. 2012. V. 79. № 4. P. 521.
Buslov D.K., Sushko N.I., Tretinnikov O.N. // Polymer Science A. 2011. V. 53. № 12. P. 1121.
Todokoro H., Seki S., Nitta T. // Bull. Chem. Soc. Jpn. 1955. V. 28. № 8. P. 559.
Лебедева В.Н., Дистлер Г.И., Кортукова Е.И. // Высокомолек. соед. А. 1967. Т. 9. № 10. С. 2076.
Motojima T., Ikawa S., Kamura M. // J. Quant. Spectrosc. Radiat. Transfer. 1981. V. 26. № 3. P. 177.
Lee H.M., Tarakeshwar P., Park J., Kołaski M.R., Yoon Y.J., Yi H.B., Kim K.S. // J. Phys. Chem. A. 2004. V. 108. № 15. P. 2949.
Miller D.J., Lisy J.M. // J. Am. Chem. Soc. 2008. V. 130. № 46. P. 15393.
Allerhand A., von Rague Schleyer P. // J. Am. Chem. Soc. 1963. V. 85. № 9. P. 1233.
Kuntz I.D., Cheng C.J. // J. Am. Chem. Soc. 1975. V. 97. № 17. P. 4852.
Huang Z., Hua W., Verreault D., Allen H.C. // J. Phys. Chem. A. 2013. V. 117. № 29. P. 6346.
Cabarcos O.M., Weinheimer C.J., Martınez T.J., Lisy J.M. // J. Chem. Phys. 1999. V. 110. № 19. P. 9516.
Ma N.L., Siu F.M., Tsang C.W. // Chem. Phys. Let. 2000. V. 322. № 1–2. P. 65.
Иогансен А.В. // Водородная связь. М.: Наука, 1981. С. 122.
Zilles B.A., Person W.B. // J. Chem. Phys. 1983. V. 79. № 1. P. 65.
Thompson W.H., Hynes J.T. // J. Am. Chem. Soc. 2000. V. 122. № 26. P. 6278.
Coker H. // J. Phys. Chem. 1976. V. 80. № 19. P. 2078.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)



