Высокомолекулярные соединения (серия А), 2019, T. 61, № 3, стр. 222-226
МУКОАДГЕЗИВНЫЕ ПОЛИМЕРНЫЕ НОСИТЕЛИ ИНТРАНАЗАЛЬНЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
И. Л. Валуев a, *, М. Ю. Горшкова a, Л. В. Ванчугова a, Л. И. Валуев a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
* E-mail: ivaluev@ips.ac.ru
Поступила в редакцию 03.09.2018
После доработки 05.10.2018
Принята к публикации 05.11.2018
Аннотация
Изучена кинетика выделения тирозина и фенилаланина из адгезированных на поверхности полимерного гидрогеля мукоадгезивных растворов полиакриламида и сополимера акриламида с акриловой кислотой. Показано, что время удерживания растворов на поверхности в несколько раз превосходит время полного выделения аминокислот. Эти результаты демонстрируют принципиальную возможность создания интраназальных препаратов, обеспечивающих их доставку в мозг при быстром выделении лекарства из адгезированной на слизистой оболочке носа полимерной композиции.
Интраназальное применение лекарственных средств – один из самых известных и достаточно широко применяемых путей введения в организм целого ряда препаратов. Площадь слизистой носа у человека составляет около 150 см2. Она обильно снабжена кровеносными сосудами, что обеспечивает быструю абсорбцию большинства лекарственных средств, создает их высокую концентрацию в системном кровотоке и позволяет избежать эффекта первого прохождения препарата через печень, с которым приходится считаться при другом способе введения лекарственных средств. Такой способ введения (в обход желудочно-кишечного тракта) позволяет вводить даже пептидные гормоны, например инсулин или глюкагон [1].
В последние годы было показано, что при интраназальном применении лекарств в виде растворов, спреев или мазей большая их часть естественно всасывается в кровь, а меньшая – по чувствительным нервам попадает непосредственно в мозг через нейроны обонятельного тракта и далее распространяется по структурам головного мозга по механизмам, не связанным с кровотоком [2]. Возможность прямого поступления лекарств в мозг, минуя гематоэнцефалический барьер, открывает новые перспективы для эффективного лечения заболеваний центральной нервной системы и опухолей мозга, что особенно важно при заболеваниях центральной нервной системы сосудистого генезиса: несмотря на наличие тромба в кровеносном сосуде, оказывается возможным доставка препаратов непосредственно к клеткам головного мозга, причем не позднее нескольких минут после введения. Это позволяет рассматривать интраназальный путь введения лекарств как своеобразный аналог внутримозгового введения препаратов. Учитывая необходимость в большинстве случаев предотвращения нежелательного проникновения лекарства в кровоток, задача создания препаратов сводится к удерживанию их непосредственно в месте введения на слизистой носа и контролируемому выделению активного начала со скоростью, необходимой для их доставки в области поражения головного мозга. Обычно уже через 10–15 мин лекарства, введенные интраназально, обнаруживаются в мозге [1].
Цель настоящей работы – изучение возможности использования для решения этой задачи мукоадгезивных полимерных носителей, способных удерживаться на слизистой оболочке и достаточно быстро выделять введенное в них лекарственное соединение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали акриламид, N,N,N',N'-тетраметилэтилендиамин, фенилаланин и хлорид натрия (“Sigma”, США), персульфат аммония и акриловую кислоту (“Aldrich”, США), тирозин (“Fluka”, Германия). Все растворы готовили на дважды перегнанной бидистиллированной воде. Полиакриламид (ПАА) и сополимер акриламида с акриловой кислотой получали полимеризацией мономеров в водном растворе под действием окислительно-восстановительного катализатора персульфат аммония – N,N,N',N'-тетраметилэтилендиамин. Акриловую кислоту предварительно нейтрализовали бикарбонатом натрия в водном растворе до рН 7.5. Полученный раствор полимера диализовали с использованием диализной мембраны Spectra/Por 3 Dialysis membrane tubing: MWCO: 3500 (“Spectrum Medical Industrics”, США) в течение трех суток до тех пор, пока значения оптической плотности промывных вод, измеренные при 200 нм, не становились меньше 0.002. Полимер высушивали при 70°С до постоянной массы. Определение молекулярной массы полимера и его препаративное разделение на фракции проводили методом водной эксклюзионной хроматографии на хроматографической системе (“Shimadzu”, Япония).
Для оценки адгезионной устойчивости носителя 0.08 г раствора выбранной концентрации наносили на поверхность пластины сшитого полигидроксиэтилметакрилата, моделирующего слизистую оболочку [3]. Пластины толщиной 0.5 мм получали сополимеризацией гидроксиэтилметакрилата с диметакрилатом этиленгликоля в водном растворе между двумя стеклами. Содержание воды в полимере 56%. Затем композицию помещали на дно стеклянного стакана, добавляли 20 мл раствора фосфатного буфера (рН 7.4) и в течение различного периода времени измеряли оптическую плотность раствора при 203 нм. Перед взятием пробы раствор аккуратно перемешивали. Время повышения оптической плотности до 0.1 считали временем удерживания носителя на подложке. Измерения проводили как в воде, так и в физрастворе (0.9%-ный раствор хлористого натрия).
Аналогичным образом изучали выделение аминокислот из образцов, которые готовили озвучиванием в ультразвуковой ванне УЗВ-3/200 в течение 25–30 мин смеси носителя и аминокислоты или смеси носителя, аминокислоты и хлористого натрия. Через определенное время отбирали пробы для регистрации количества аминокислоты в растворе, используя предварительно построенные калибровочные кривые зависимости оптической плотности раствора при 275 нм (тирозин) и 257.8 нм (фенилаланин) от концентрации раствора. После окончания измерения пробу возвращали в стакан.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Подавляющее большинство мукоадгезивных полимеров представляют собой природные или синтетические гидрофильные макромолекулы, содержащие функциональные группы, например гидроксильные, карбоксильные или аминогруппы, способные образовывать водородные связи [4–7].
В настоящей работе в качестве таких полимеров были использованы полиакриламид и его сополимеры с акриловой кислотой, хорошо зарекомендовавшие себя при создании препаратов инсулина для перорального введения [8, 9]. Молекулярная масса полимеров равна (2.0 × 104)–(5.1 × 105).
Лекарственными соединениями в работе служили фенилаланин и тирозин, близкие по строению аминокислоты, сильно различающиеся по растворимости в водных растворах.
Растворимость фенилаланина в воде при 25°С составляет 30 мг/мл, а тирозина 0.5 мг/мл [10]. Выбор этих соединений обусловлен тем, что именно аминокислоты составляют основу проникающего в мозг препарата Семакс – синтетического пептида, который применяют для повышения адаптационных возможностей организма человека при стрессах в экстремальных ситуациях [11].
При изучении адгезионной способности носителя (раствора ПАА) было обнаружено, что полимер достаточно прочно сорбировался на подложке (табл. 1). Присутствие хлористого натрия в полимере приводило к незначительному уменьшению времени удерживания носителя.
Таблица 1.
Зависимость времени удерживания носителя на подложке от молекулярной массы ПАА и его концентрации
| Молекулярная масса ПАА | Концентрация ПАА, мас. % | Время удерживания, ч (±0.05) | |
|---|---|---|---|
| ПАА | ПАА + NaCl | ||
| (4.6–5.1) × 105 | 6.0 | 4.2 | 3.9 |
| 3.5 | 2.8 | 2.6 | |
| 2.0 | 2.2 | 2.1 | |
| (0.7–1.0) × 105 | 6.0 | 3.6 | 3.4 |
| 3.5 | 2.4 | 2.2 | |
| 2.0 | 1.9 | 1.8 | |
| (2.0–4.0) × 104 | 6.0 | 3.1 | 2.9 |
| 3.5 | 2.1 | 2.0 | |
| 2.0 | 1.5 | 1.4 | |
Видно, что чем выше концентрация ПАА в носителе и чем выше его молекулярная масса, тем больше время удерживания носителя. Причем определяющим является концентрация полимера, а не его молекулярная масса.
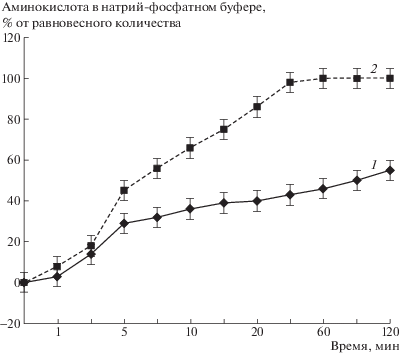
На рис. 1 показано выделение аминокислот из 6%-ного раствора ПАА. Скорость и степень выделения аминокислот определяется их растворимостью в воде. Так, в случае тирозина за 1 ч выделялось около 50% введенной в полимер аминокислоты, а фенилаланин практически полностью выделялся за первые 30 мин. Особо следует отметить, что выделение аминокислот происходило при отсутствии растворения самого носителя.
Очевидно, что одним из решающих факторов, определяющих скорость выделения аминокислот, должна быть концентрация полимера в носителе. И действительно, чем выше концентрация полимера, т.е. чем выше вязкость полимерного носителя, тем ниже скорость выделения тирозина (табл. 2). В случае хорошо растворимого фенилаланина небольшое различие в уменьшении скорости высвобождения его для ПАА с большей концентрацией наблюдалось лишь на начальном этапе инкубации (10 мин). Через 30 мин для обеих концентраций ПАА (6 и 3.5%) в раствор выделялось уже почти 100% фенилаланина от его равновесного значения.
Таблица 2.
Выделение аминокислоты из 80 мг раствора ПАА
| Аминокислота | Концентрация ПАА, мас. % | Массовое соотношение аминокислота : : ПАА | Количество аминокислоты (±5%), выделившейся через | ||
|---|---|---|---|---|---|
| 10 мин | 30 мин | 60 мин | |||
| Тирозин | 6.0 | 0.6 | 36 | 43 | 46 |
| 6.0 | 1.2 | 41 | 46 | 50 | |
| 6.0 | 1.8 | 38 | 48 | 55 | |
| 3.5 | 0.5 | 44 | 65 | 91 | |
| 3.5 | 1.1 | 50 | 71 | 90 | |
| 3.5 | 1.9 | 52 | 72 | 88 | |
| Фенилаланин | 6.0 | 0.8 | 66 | 98 | 100 |
| 6.0 | 1.5 | 67 | 87 | 100 | |
| 6.0 | 2.7 | 86 | 100 | 100 | |
| 3.5 | 0.6 | 85 | 99 | 100 | |
| 3.5 | 1.6 | 93 | 100 | 103 | |
| 3.5 | 2.6 | 99 | 102 | 100 | |
В табл. 2 также представлены данные по зависимости степени выделения аминокислот от их исходной концентрации в носителе. Видно, что степень выделения аминокислоты практически не зависела от ее содержания в композиции и для тирозина через 30 мин составляла 43–48%, а для фенилаланина 87–100%. При этом, естественно, чем выше содержание аминокислоты в поли-акриламиде, тем большее ее количество выделялось в раствор, и чем меньше концентрация ПАА, тем выше скорость высвобождения тирозина. В случае фенилаланина за 30 мин он высвобождался количественно.
Поскольку в живых организмах большинство процессов протекают в физиологическом растворе (0.9%-ный раствор NaCl), в работе было изучено влияние этой соли на скорость выделения аминокислоты (рис. 2).
Рис. 2.
Выделение тирозина (1, 2) и фенилаланина (3, 4) из 80 мг 6%-ных растворов ПАА в воде (1, 3) и в воде + NaCl (2, 4). Количество выделившихся тирозина 1.7 (1) и 1.6 мг (2), фенилаланина 1.6 мг (3, 4).
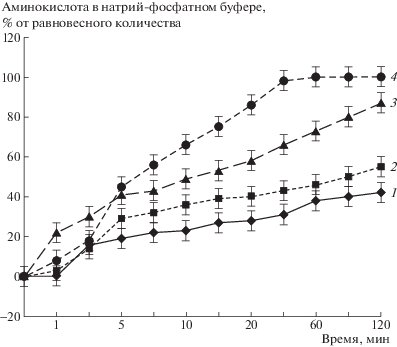
При введении хлорида натрия в исходную композицию увеличивалась степень выделения аминокислот, вероятно, за счет улучшения их растворимости в присутствии соли [10].
Один из подходов к повышению мукоадгезивности полимеров включает введение в их состав карбоксильных групп [12]. В работе был использован сополимер 25% акриламида и 75% акриловой кислоты. Введение 75% звеньев акриловой кислоты в состав полимера приводило к повышению времени удерживания носителя на подложке на 18–24%. На рис. 3 показано выделение аминокислот из полиакриламида и сополимера акриламида с акриловой кислотой.
Рис. 3.
Выделение тирозина (1, 2) и фенилаланина (3, 4) из 80 мг 6%-ных водных растворов ПАА (1, 3) и сополимера (2, 4). Количество выделившихся тирозина 1.7 (1) и 1.6 мг (2), фенилаланина 1.6 мг (3, 4).
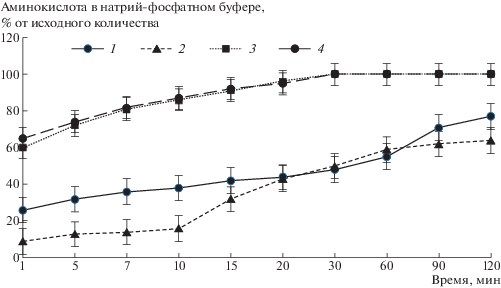
Видно, что введение карбоксильных групп в состав полимера-носителя практически не влияло на скорость выделения хорошо растворимого фенилаланина, но несколько понижало скорость выделения тирозина. Можно предположить, что причина этого, скорее всего, заключается в уменьшении растворимости тирозина вследствие образования водородных связей между гидроксильной группой аминокислоты и карбоксильными группами сополимера [13].
Таким образом, полученные результаты свидетельствуют о том, что изменением природы полимерного носителя, его вязкости или введением специальных добавок, можно в достаточно широких пределах варьировать скорость выделения модельного лекарственного вещества. Продемонстрирована принципиальная возможность создания интраназальных препаратов, обеспечивающих их доставку в мозг при быстром выделении лекарства из адгезированной на слизистой оболочке носа полимерной композиции.
Работа выполнена в рамках Госзадания ИНХС РАН.
Список литературы
Leary A.C., Dowling M., Cussen K., O’Brien J., Stote R.M. // J. Diabetes Sci Technol. 2008. V. 2. № 6. P. 1054.
Привалова А.М., Гуляева Н.В., Букреева Т.В. // Нейрохимия. 2012. Т. 29. № 2. С. 93.
Коков Л.С., Цыганков В.Н., Петрушин К.В., Лучкин В.М. // Матер. 2-й Междунар. конф. “Современные технологии и возможности реконструктивно-восстановительной и эстетической хирургии”. М., 2010. С. 84.
Odeniyi M.A., Khan N.H., Peh K.K. // Acta Polym. Pharm. 2015. V. 72. № 3. P. 559.
Smart J.D. // Adv. Drug Deliv. Rev. 2005. V. 57. № 11. P. 1556.
Cui F., Qian F., Yin C. // Int. J. Pharm. 2006. V. 316. № 1–2. P. 154.
Serra L., Domenech J., Peppas N.A. // Eur. J. Pharm. Biopharm. 2006. V. 63. № 1. P. 11.
Платэ Н.А., Валуев Л.И., Княжев В.А. // Вестн. РАН. 2001. Т. 71. С. 899.
Валуев И.Л., Валуев Л.И., Сытов Г.А., Платэ Н.А. // Биохимия. 1996. Т. 61. № 9. С. 1584.
Khoshkbarchi M.K., Vera J.H. // Ind. Eng. Chem. Res. 1997. V. 36. № 6. P. 2445.
Шевченко К.В., Нагаев И.Ю., Алфеева Л.Ю., Андреева Л.А., Каменский А.А., Левицкая Н.Г., Шевченко В.П., Гривенников И.А., Мясоедов Н.Ф. // Биоорган. химия. 2006. Т. 32. № 1. С. 64.
Smart J.D. // Adv. Drug Deliv. Rev. 2005. V.57. № 11. P. 1612.
Banik D., Kundu S., Banerjee P., Dutta R., Sarkar N. // J. Phys. Chem. B. 2017. V. 121. P. 1533.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)