Высокомолекулярные соединения (серия А), 2019, T. 61, № 4, стр. 324-329
АССОЦИАЦИЯ МАКРОМОЛЕКУЛ КАРБОКСИМЕТИЛХИТИНА В ВОДНОМ РАСТВОРЕ
В. А. Александрова a, *, Л. Н. Широкова a, Е. А. Литманович b, Г. Н. Бондаренко a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
b Московский государственный университет им. М.В. Ломоносова. Химический факультет
119899 Москва, Ленинские горы, Россия
* E-mail: alexandrova@ips.ac.ru
Поступила в редакцию 28.12.2018
После доработки 06.03.2019
Принята к публикации 18.03.2019
Аннотация
Методом динамического светорассеяния исследованы процессы ассоциации макромолекул 6-О-карбоксиметилхитина (в солевой и смешанной форме) в водном растворе. Установлено, что раствор 6-О-карбоксиметилхитина в форме соли содержит два вида частиц: мелкие (9–16 нм), соответствующие размеру единичных макромолекул, и более крупные (150–177 нм) – ассоциаты. В растворе смешанной формы 6-О-карбоксиметилхитина присутствуют только ассоциированные частицы (80–800 нм). С использованием метода ИК-фурье-спектроскопии показано, что ассоциирование макромолекул 6-О-карбоксиметилхитина в водном растворе обусловлено образованием как водородных связей, так и ионных пар между функциональными группами полимера.
Хитин, поли-β-2-ацетамидо-2-дезокси-D-глюкопираноза, является вторым по распространенности в природе полисахаридом после целлюлозы. В наибольшем количестве хитин находится в составе экзоскелета большинства классов беспозвоночных животных (крабы, креветки и т.д.), а также этот полисахарид входит в состав грибов, водорослей и других организмов. Хитин обладает уникальным комплексом физико-химических свойств и биологических характеристик, однако он не растворяется в большинстве доступных растворителей, что существенно ограничивает возможности его применения. Путем химических модификаций хитин может быть преобразован в водорастворимые формы. Одно из таких производных хитина – 6-О-карбоксиметилхитин (КМХ), который растворяется в воде в широком интервале рН. Для КМХ характерны низкая токсичность, биодеградируемость и биосовместимость. Благодаря наличию таких свойств КМХ широко используется в пищевой промышленности, фармацевтике, косметологии, медицине и других областях. В частности, в медицине КМХ используют для восстановления живых тканей, создания перевязочных материалов, а также систем контролируемого высвобождения фармацевтических средств [1, 2]. При этом доставляемый субстрат может быть присоединен к цепи полимера ковалентными, ионными связями или за счет специфической адсорбции. Следует отметить, что при проведении полимераналогичных превращений макромолекул КМХ, рН среды может изменяться в интервале от 3 до 8 в зависимости от формы, в которой получен полимер [3]. В связи с этим необходимо понимать поведение макромолекулы – носителя лекарственного препарата при различных рН среды.
Известно, что метод динамического светорассеяния успешно применяется для изучения ассоциации полиэлектролитов, в частности различных производных хитина [4, 5].
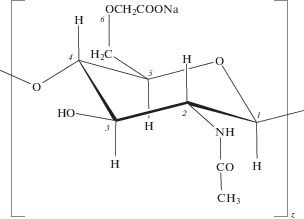
Учитывая это, в настоящей работе с помощью методов динамического светорассеяния и ИК-фурье-спектроскопии было изучено ассоциирование макромолекул КМХ, полученного в различных формах: в солевой, содержащей карбоксильную группу в виде соли –COONa (КМХ-Na)
 ,
,
в кислой, содержащей карбоксильную группу в виде –COOН (КМХ-Н)
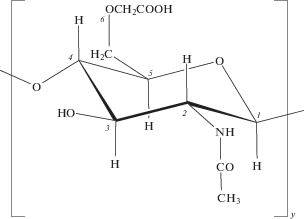
и смешанной, содержащей в макромолекуле в равном соотношении звенья цепи в кислой и солевой формах (n = m = 0.5) (КМХ-50Н)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Водорастворимый полимер КМХ синтезировали из хитина по методу [6]. В качестве карбоксилирующего агента использовали CH2ClCOOH, которой обрабатывали предварительно активированный хитин в присутствии избытка NaOH в водно-спиртовой среде при повышенной температуре 72°С. В результате синтезировали КМХ с Мw = 7 × 104 (метод ультрацентрифугирования) и степенью карбоксиметилирования 1.0 [6].
Смешанную форму КМХ-50Н (рН 4.5) и солевую форму КМХ-Na (pH 8.5) получали из кислой формы КМХ-Н, добавляя 0.1 М NaOH в количестве, необходимом для превращения 50% и 100% групп –СООН в группы –СООNa, в соответствии с кривой титрования кислой формы [7].
Рентгеноструктурный анализ
Рентгеноструктурные исследования образцов проводили на установке на базе 12-кВт генератора с вращающимся медным анодом “RU-200 Rotaflex” (“Rigaku”, Япония) в режиме на прохождение (40 кВ, 140 мА). Использовали CuKα-излучение с длиной волны λ = 0.1542 нм. Образцы толщиной 0.4 мм помещали в тонкий лавсановый пакет, который закрепляли в стандартном держателе. Степень кристалличности определяли с помощью специализированного программного обеспечения “EVA Diffrac plus” (“Bruker AXS”, Германия).
Динамическое светорассеяние
В работе использовали гониометр рассеянного лазерного света “Photocor Complex” (“Photocor Instruments”, США) с He-Ne-лазером (длина волны λ = 633 нм, мощность 25 мВт) в качестве источника. Временную автокорреляционную функцию g2 флуктуаций интенсивности рассеянного света определяли на 288-канальном корреляторе “Photocor-FC” (“Photocor Instruments”, США) и обрабатывали с использованием программы DynaLS [8] по уравнению
При обработке автокорреляционной функции всех образцов применяли одинаковые параметры регуляризации: каналы коррелятора с 30 по 180, число интервалов 200. Из распределений по коэффициентам диффузии получали распределения по гидродинамическим радиусам с использованием формулы Стокса–Эйнштейна
где k – постоянная Больцмана, Т – абсолютная температура, η – вязкость растворителя.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Хитин, используемый в настоящей работе, получен из панцирей крабов и, как известно, имеет α-структуру, которая отличается высокой степенью кристалличности, обусловленной системой регулярно чередующихся водородных связей, образующихся между цепями макромолекул при взаимодействии протоноакцепторных и протонодонорных групп. К таким группам относятся: ацетамидная группа при С2 и группа –СН2ОН при С6 углеродных атомов глюкопиранозного цикла. При синтезе КМХ происходит значительное разрушение межмолекулярных водородных связей в α-хитине, что приводит к образованию водорастворимого полимера.
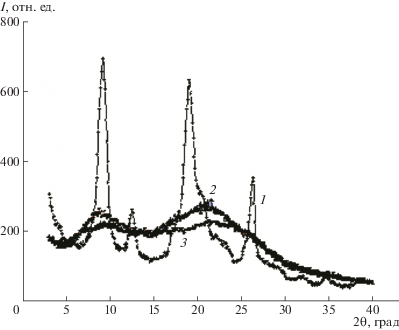
Для исследования структуры исходного хитина, а также полученного на его основе КМХ, представленного в солевой КМХ-Na и кислой форме КМХ-Н, использовали метод РСА (рис. 1).
Из анализа данных и из сопоставления с описанными в литературе параметрами [9] следует, что исходный полисахарид является α-хитином с ячейкой орторомбической структуры (а = 4.74 Å, b = 18.86 Å, c = 10.32 Å) и высокой степенью кристалличности 89%, которая была определена с помощью специализированного программного обеспечения.
В отличие от высокоупорядоченной структуры исходного α-хитина, КМХ, полученный на его основе, имеет аморфную структуру. При этом для КМХ-Na и КМХ-Н на дифрактограмме (рис. 1) видны две области аморфного гало. Для КМХ-Na более выраженной является область первого аморфного гало (2θ = 9°). Эта область может быть охарактеризована неким ближним порядком макромолекул с усредненным расстоянием около 1 нм. Для структуры КМХ-Н более выраженной является область второго аморфного гало (2θ = = 21.5°), что указывает на ближний порядок в системе с усредненным расстоянием 0.4 нм. По-видимому, в пленках, полученных из КМХ-Н, присутствуют ассоциаты макромолекул, возникающие за счет образования водородных связей между цепями полимера. Область первого аморфного гало близка по положению к рефлексу кристаллической решетки хитина, находящейся на расстоянии 2θ = 9°. Область второго аморфного гало приближается по положению к рефлексам кристаллической решетки α-хитина, лежащих в области 2θ = 15°–25°. Это может свидетельствовать о лишь незначительном смещении рассеивающих центров в кристаллическом α-хитине при проведении реакции полимераналогичных превращений с целью получения КМХ – водорастворимого производного хитина.
Чтобы подтвердить наличие ассоциатов макромолекул в растворе КМХ, имеющем в своей структуре карбоксильные группы в кислой форме было проведено исследование растворов КМХ-Na и КМХ-Н с использованием метода динамического светорассеяния. Подчеркнем, что вследствие ограниченной растворимости в воде КМХ-Н была выбрана форма КМХ-50Н, содержащая карбоксильные группы как в солевой КМХ-Na, так и в кислой форме КМХ-Н.
Результаты исследования ассоциации макромолекул в водном растворе КМХ-Na (рис. 2а) показали, что в системе присутствуют и единичные макромолекулы (9 нм), и их ассоциированные формы (177 нм). При уменьшении ионной силы раствора КМХ-Na (с 0.5 до 0.125 М NaCl) размер макромолекулярного клубка увеличивался до 16 нм вследствие полиэлектролитного набухания. Образование ассоциированных форм в КМХ-Na (рис. 2а) может быть связано не только с гидрофильным (с образованием водородных связей), но также и с гидрофобным взаимодействием группы –СН3 в ацетамидном заместителе при С2 глюкопиранозного цикла. При введении карбоксильных групп в кислой форме в структуру КМХ повышается вероятность гидрофильного взаимодействия между макромолекулами, что подтверждают данные, полученные при исследовании КМХ-50Н методом динамического светорассеяния.
Рис. 2.
Распределение рассеивающих частиц по гидродинамическим радиусам Rh в водных растворах КМХ-Na (а) и КМХ-50Н (б). Концентрация раствора полимера 0.5 мас. %, I = 0.5 М NaCl, Т = 20°С.
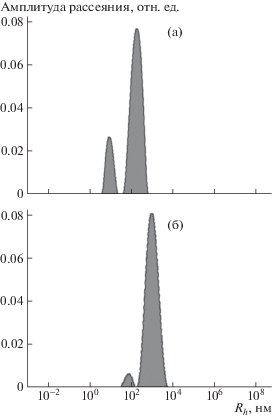
Как видно на рис. 2б, в растворе КМХ-50Н практически отсутствуют единичные макромолекулы, при этом обе популяции частиц (80 и 800 нм) представляют собой ассоциированные формы, что обусловлено увеличением вероятности образования межмолекулярных водородных связей с ростом доли протонодонорных групп в структуре КМХ.
При уменьшении концентрации КМХ, как в КМХ-Na (рис. 3а и 3в) так и в КМХ-50Н (рис. 3б и 3г) формах, наблюдали снижение размеров ассоциатов, что связано с уменьшением вероятности возникновения зон контакта макромолекул [10].
Рис. 3.
Распределение рассеивающих частиц по гидродинамическим радиусам Rh в водных растворах КМХ-Na (а, в) и КМХ-50Н (б, г). Концентрация раствора полимера 0.25 (а, б) и 0.125 мас. % (в, г), I = 0.5 М NaCl, Т = 20°С.
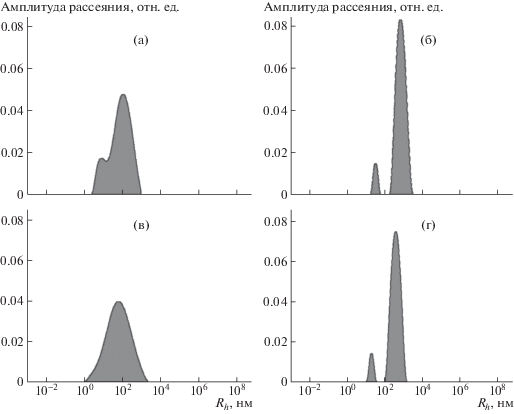
С появлением в структуре КМХ карбоксильных групп в кислой форме увеличивается доля ассоциатов макромолекул. Это может быть вызвано межмолекулярным взаимодействием функциональных групп полимера, что подтверждают спектральные данные, полученные методом ИК-фурье-спектроскопии.
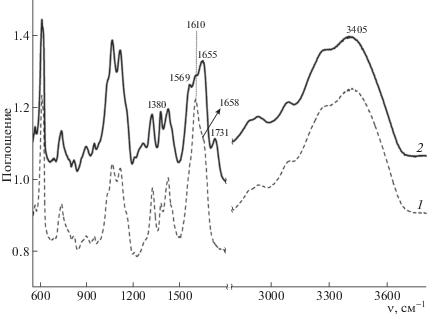
Так, в спектре КМХ-50Н (рис. 4, спектр 2) появление полосы поглощения, характерной для валентных колебаний неионизованной карбоксильной группы (1731 см–1), сопровождалось резким увеличением интенсивности и уширением полосы поглощения амидной группы (1655 см–1). Возможно, это связано с образованием межмолекулярных ассоциатов между группами –С(О)ОН и –С(О)NН с участием протона карбоксильной группы.
Кроме того, в спектре КМХ-50Н (рис. 4, спектр 2) полоса 1569 см–1, отсутствующая в спектре КМХ-Na, может быть отнесена к валентным колебаниям карбоксилат-аниона с противоионом – аммониевым катионом. Ионные пары могут появиться в присутствии ионизированных в кислой среде аминогрупп, которые могут образоваться при частичном дезацетилировании хитина. Какой-то процент дезацетилирования мог быть в исходном хитине, как описано в работе [6], где в исходном хитине было 3% дезацетилирования. Второй источник дезацетилированных фрагментов – сам процесс обработки хитина: активация и карбоксиметилирование в щелочных средах. Другая полоса, которая также характерна для карбоксилат-аниона – 1380 см–1, проявляется более интенсивно в спектре КМХ-50Н, чем в спектре КМХ-Na. Известно, что интенсивность этой полосы растет с увеличением размера противоиона, и помимо карбоксилат-анионов с противоионом Na+ в структуре КМХ-50Н присутствуют карбоксилат-анионы с противоионами большего размера.
Нельзя исключить образование ассоциированных форм между карбоксилатными и амидными группами с участием молекул воды. На присутствие воды в образце указывает очень интенсивная расщепленная полоса в области 3600–3300 см–1, которая может быть отнесена к валентным колебаниям N–H и О–Н. Полоса от карбоксилат иона 1610 см–1 в спектре солевой формы (рис. 4, спектр 1) имеет хорошо выраженное плечо при 1658 см–1, что также указывает на присутствие воды, поскольку именно в этой области лежат полосы от деформационных колебаний молекулы воды. Таким образом, если в ассоциацию между карбоксильными и амидными группами включаются молекулы воды, то размер таких ассоциатов сильно возрастет. Именно такая ассоциация может быть причиной плохого удаления воды из образцов несмотря на длительное высушивание их.
ЗАКЛЮЧЕНИЕ
В работе показано, что растворы солевой формы КМХ помимо частиц мелкого размера (единичные макромолекулы) содержат ассоциаты. При появлении в структуре КМХ карбоксильных групп в кислой форме в растворе исчезают одиночные макромолекулы и образуются ассоциаты, включающие большое число макромолекул. При понижении концентрации полимера в растворе размер ассоциатов уменьшается, что связано с понижением вероятности возникновения зон контакта макромолекул.
Из анализа данных ИК-фурье-спектроскопии следует, что ассоциирование макромолекул КМХ в водном растворе может быть обусловлено образованием как водородных связей, так и ионных пар между функциональными группами полимера. В большей степени это характерно для макромолекул КМХ-50Н, где появляются карбоксильные группы в кислой форме.
Работа выполнена в рамках Госзадания Института нефтехимического синтеза РАН.
Список литературы
Wongpanit P., Sanchavanakit N., Pavasant P., Supaphol P., Tokura S., Rujiravanit R. // Macromol. Biosci. 2005. V. 5. № 10. P. 1001.
Tokura S., Tamura H. // Biomacromolecules. 2001. V. 2. № 2. P. 417.
Dudarev V.G., Iozep A.A. // Russ. J. Appl. Chem. 2009. V. 82. № 10. P. 1867.
Philippova O.E., Korchagina E.V., Volkov E.V., Smirnov V.A., Khokhlov A.R., Rinaudo M. // Carbohydr. Polym. 2012. V. 87. P. 687.
Wu C., Zhou S., Wang W. // Biopolym. 1995. V. 35. № 4. P. 385.
Vihoreva G.A., Gladyshev D.Yu., Bazt M.R., Barkov V.V., Gal’braikh L.S. // Cellul. Chem. Technol. 1992. V. 26. № 6. P. 663.
Aleksandrova V.A., Shirokova L.N. // Polymer Science B. 2018. V. 60. № 6. P. 727.
Yudin I.K., Nikolaenko G.L., Kosov V.I., Agayan V.A., Anisimov M.A., Sengers J.V. // Int. J. Thermophys. 1997. V. 18. № 5. P. 1237.
Paralikar K., Balasubramanya R. // J. Polym. Sci., Polym. Lett. Ed. 1984. V. 22. P. 543.
Тагер А.А. Физико-химия полимеров / Под ред. А.А. Аскадского. М.: Научный мир, 2007.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)