Высокомолекулярные соединения (серия А), 2019, T. 61, № 4, стр. 330-334
Антимикробные свойства комплексов полиэлектролит–амфифильное поверхностно-активное вещество, содержащих четвертичные аммониевые группы
Е. А. Дешевая a, Е. В. Долгова b, *, М. Г. Дьякова c, Н. Д. Новикова a, В. А. Тверской c
a Государственный научный центр Российской Федерации
Институт медико-биологических проблем Российской академии наук
123007 Москва, Хорошёвское ш., 76А, Россия
b Всероссийский научно-исследовательский институт авиационных материалов
105005 Москва, ул. Радио, 17, Россия
c МИРЭА – Российский технологический университет
Институт тонких химических технологий имени М.В. Ломоносова
119571 Москва, пр. Вернадского, 86, Россия
* E-mail: dolgova_ev@bk.ru
Поступила в редакцию 15.01.2019
После доработки 28.02.2019
Принята к публикации 07.03.2019
Аннотация
Синтезированы полимер-коллоидные комплексы полистиролсульфоната и полиакрилата натрия с диметилалкил(С8-16)бензиламмоний хлоридами и поливинилбензилтриметиламмоний хлорида с додецилсульфатом и лауратом натрия, имеющих близкую структуру ионной пары макромолекулярный ион–противоион. Проведен анализ состава образующихся комплексов. Изучены их антимикробные свойства и показано, что комплексы, в которых четвертичные аммониевые группы являются противоионами и связаны с цепью макромолекулы электростатическим взаимодействием, обладают более высокой антифунгальной активностью, чем комплексы, в которых эта группа связана с цепью макромолекулы ковалентной связью. Показана важная роль ассоциированных в составе комплекса молекул аммониевого соединения, содержащего в своей структуре длинноцепной алкильный заместитель, на антифунгальную активность комплексов. Проведен сравнительный анализ свойств пленочных покрытий из синтезированных комплексов.
ВВЕДЕНИЕ
Известно, что соединения, содержащие четвертичные аммониевые группы (СЧАГ), обладают антимикробными свойствами [1–4]. В многочисленных обзорах, в частности [5–7], рассмотрены возможности синтеза полимеров, обладающих антимикробными свойствами и содержащих четвертичные аммониевые группы как ковалентно связанные с цепью макромолекулы, так и являющиеся противоионами и связанные с цепью макромолекулы кулоновским взаимодействием в составе полимер-коллоидных комплексов (ПКК) полиэлектролит–катионоактивное поверхностно-активное вещество. В указанных работах показано влияние на их антимикробную активность концентрации четвертичных аммониевых групп и природы заместителей у атома азота, а также рассмотрены возможности применения этих полимеров.
В цитируемых выше и других работах [8–10] рассмотрены ПКК, в которых четвертичные аммониевые группы являются противоионами карбоксилатных групп, входящих в состав полиэлектролита. В литературе также имеются сведения о синтезе и свойствах ПКК, где четвертичная аммониевая группа – противоион сильнокислотной группы, такой как сульфокислотная [11, 12]. Полиэлектролиты, содержащие данную группу, могут быть получены гомо- и сополимеризацией стиролсульфоната щелочного металла [13].
Однако до настоящего времени отсутствуют исследования антимикробных свойств ПКК полимерных сульфокислот с СЧАГ. В связи с этим цель настоящей работы – синтез и исследование антимикробных свойств комплексов полистиролсульфоната натрия (ПССН) с диметилалкилбензиламмонийгалогенидами
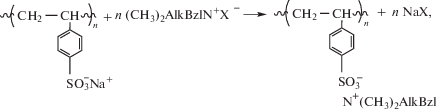
в которых четвертичная аммониевая группа связана с цепью макромолекулы электростатическим взаимодействием, и сравнение свойств данных комплексов со свойствами комплекса поливинилбензилтриметиламмоний хлорида (полимер I) с додецилсульфатом натрия (ДСН):
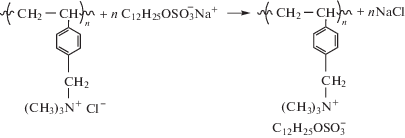
В нем четвертичная аммониевая группа ковалентно связана с цепью макромолекулы. Оба комплекса имеют близкую структуру ионной пары макромолекулярный ион-противоион: $\sim {\kern 1pt} {\text{SO}}_{3}^{ - }$ R3N+~. Представляло также интерес сравнение антимикробных свойств этих ПКК с антимикробными свойствами традиционных комплексов, где ионная пара состоит из карбоксилатной и четвертичной аммониевой групп.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты
Стиролсульфонатнатрия (ССН), гидрат, 97,5% (“Aldrich”); смесь мета- и пара-винилбензилтриметиламмоний хлорида, 99% (“Aldrich”); диметил-гексадецилбензиламмоний хлорид (СЧАГ-С16), гидрат, 97% (“Aldrich”); N,N-диметилбензиламин, 99% (“Acros Organics”); н-октилбромид, 99% (“Aldrich”); н-додецилбромид, ≥95% (“Aldrich”) и персульфат аммония, 98% (ROTH) использовали без дополнительной очистки. Поли-акриловую кислоту (ПАК) с Мn = 13.0 × 104, (“Aldrich”) также применяли без дополнительной очистки.
Синтез полимеров
Полимеризацию ССН и винилбензилтриметиламмоний хлорида осуществляли в водном растворе при 60°С в запаянных ампулах, предварительно продутых азотом. Инициатором служил персульфат аммония. По окончании полимеризации полимеры очищали от остатков мономеров диализом (диализные мешки “ROTH” с отсечкой по молекулярной массе (MWCO) 4000–6000). Очищенные от мономеров растворы полимеров концентрировали на роторном испарителе и сушили при 50°С до постоянной массы.
Средневязкостную молекулярную массу ПССН рассчитывали по уравнению [14]:
где $\bar {P}$ – средневязкостная степень полимеризации.Вискозиметрические измерения проводили в вискозиметре Уббелоде.
Полиакрилат натрия (ПАК-Na) получали нейтрализацией раствора ПАК эквимолярным количеством щелочи.
Синтез четвертичных аммониевых соединений
Синтез N,N-диметилоктилбензиламмоний бромида (СЧАГ-С8) и N,N-диметилдодецилбензиламмоний бромида (СЧАГ-С12) проводили в ДМФА при 90°С в течение 34 ч при эквимольном соотношении N,N-диметилбензиламина и н-октилбромида (при синтезе СЧАГ-С8) и н-додецилбромида (при синтезе СЧАГ-С12). По окончании процесса образовавшиеся аммониевые соли осаждали из раствора диэтиловым эфиром и переосаждали им же из раствора в изопропиловом спирте. Осадок сушили сначала на роторном испарителе, затем на воздухе при 50°С.
Выход СЧАГ-С8 82%.
Найдено, %: С 61.2, Н 9.4, N 4.1, Br 25.1.
Вычислено, %: С 62.3, Н 9.1, N 4.3, Br 24.3.
Выход СЧАГ-С12 74%.
Найдено, %: С 62.8, Н 9.8, N 3.6, Br 20.9.
Вычислено, %: С 65.6, Н 9.9, N 3.6, Br 20.9.
Синтез полимер-коллоидных комплексов
Комплексы ПССН и ПАК-Na со СЧАГ и комплексы полимера I с ДСН получали при смешивании компонентов в эквивалентных соотношениях в пересчете на ионные группы. Для этого к водным растворам полимеров при перемешивании по каплям добавляли водные растворы низкомолекулярных солей. Выделившийся осадок комплексов промывали на фильтре водой, сушили на воздухе и затем в вакуум-сушильном шкафу при температуре 50°С до постоянной массы.
Комплексы ССН со СЧАГ синтезировали смешиванием эквимольных количеств водных растворов компонентов. Выделившиеся в виде осадков комплексы очищали от исходных компонентов многократным промыванием водой. Полимеризацию мономерных комплексов проводили в изопропаноле при 70°С в течение 3 ч в ампулах, продутых азотом, с использованием ДАК (2 мас. % от массы комплексов) в качестве инициатора. Полученные полимеры осаждали водой и сушили на воздухе при 50°С до постоянной массы.
Формирование пленочных покрытий и исследование их свойств
Пленочные покрытия из всех полученных ПКК формировали из растворов в изопропаноле с концентрацией ~5 г/дл на пластинах из силикатного стекла размером 2.5 × 2.5 см, после чего сушили на воздухе в течение 1 суток при температуре 20–25°С.
Оценку твердости пленочных покрытий проводили с помощью карандаша согласно ГОСТ Р 54586-2011 (ISO 15184:1998).
Краевые углы смачивания на границе раздела образец–вода–воздух определяли методом сидячей капли.
Стойкость пленочных покрытий к воздействию плесневых грибов оценивали, используя штаммы микромицетов плесневых грибов: Penicillium expansum, Penicillium aurantiogressium, Aspergillus versicolor, Aspergillus sydowii, Cladosporium cladosporioges. Для заражения использовали ассоциацию спор грибов с концентрацией 5 × 106 в 1 мл (по 1 × 106 в 1 мл по каждому виду спор). Заражение образцов, помещенных в стерильные чашки Петри, осуществляли путем равномерного нанесения приготовленной взвеси спор грибов в растворе минеральных солей без сахара (среда Чапека–Докса) на их поверхность. Открытые чашки Петри с образцами выдерживали в течение 28 суток, после чего проводили учет содержания и состава микроорганизмов на опытных образцах в соответствии с шестибальной шкалой ГОСТ 9.049-91 (ISO 846), представленной в табл. 1.
Таблица 1.
Шкала роста грибов в баллах
| Балл | Характеристика балла |
|---|---|
| 0 | При осмотре под микроскопом рост плесневых грибов не виден |
| 1 | При осмотре под микроскопом видны проросшие споры и незначительно развитый мицелий в виде неветвящихся гиф |
| 2 | При осмотре под микроскопом виден мицелий в виде ветвящихся гиф, возможно спороношение |
| 3 | При осмотре невооруженным глазом рост грибов едва виден, но отчетливо виден под микроскопом |
| 4 | При осмотре невооруженным глазом отчетливо виден рост грибов, покрывающих менее 25% испытываемой поверхности |
| 5 | При осмотре невооруженным глазом отчетливо виден рост грибов, покрывающих более 25% испытываемой поверхности |
Параллельно определяли жизнеспособность всех культур плесневых грибов, используемых в данных испытаниях. По истечении 5 суток проводили осмотр контрольных чашек Петри с питательной средой и спорами грибов. Если на питательной среде рост грибов наблюдался, то споры грибов, которые применяли для заражения, считались жизнеспособными. Во всех экспериментах, описанных в настоящей статье, жизнеспособность спор грибов всегда подтверждалась.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 2 приведены условия получения ПКК, а в табл. 3 – их элементный анализ и состав. Видно, что состав полученных комплексов, рассчитанный по анализам на содержание в них серы и азота, близок к стехиометрическому. В обоих случаях выход ПКК не достигал 100%, т.е. регенты не полностью участвуют в образовании не растворимых в воде стехиометрических комплексов. Присутствие брома в составе комплекса ПССН со СЧАГ указывает на то, что в комплексе имеется некоторое количество не связанных в виде противоионов молекул СЧАГ, ассоциированных за счет гидрофобного взаимодействия с катионами СЧАГ, являющимися противоионами. Присутствие в этом комплексе натрия, а в комплексе полимера I с ДСН хлора указывает на “дефекты” структуры комплексов: наличие в них ионогенных звеньев полиэлектролита, не прореагировавших с ПАВ.
Исследование биоцидных свойств пленок из этих комплексов показало полное подавление роста грибов комплексом ПССН со СЧАГ-С12 и рост грибов, соответствующий 3 баллам, на пленке из комплекса полимера I с ДСН. Иными словами, ПКК, в котором четвертичная аммониевая группа является противоионом и связана с цепью макромолекулы электростатическим взаимодействием, обладает более высокой антифунгальной активностью, чем комплекс, в котором данная группа связана с цепью макромолекулы ковалентной связью. В монографии [15] сравниваются свойства полиметакрилатов, содержащих ковалентно связанные четвертичные аммониевые группы, с соответствующими мономерами. Более низкую антимикробную активность первых авторы объясняют низкой подвижностью ковалентно связанных с макромолекулой аммониевых групп.
Такой вывод подтверждается и сравнением биоцидной активности комплексов ПАК-Na и СЧАГ-С12
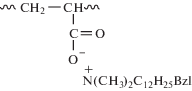 ,
,
а также полимера I с лауратом натрия
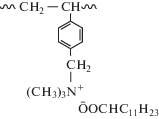 ,
,
имеющих близкую структуру ионных пар.
Оказалось, что полимер-коллоидный комплекс ПАК-Na со СЧАГ-С12, в котором четвертичные аммониевые группы связаны с макромолекулой электростатическим взаимодействием, также полностью подавляет рост плесневых грибов и обладает фунгицидным эффектом, тогда как на пленках ПКК из полимера I с лауратом натрия их рост соответствует 1 баллу.
Безусловно, ассоциированное СЧАГ, катионы которого не связаны с макромолекулой в виде противоиона, повышает биоцидную активность комплекса ПССН со СЧАГ-С12. Действительно, расчеты на основании элементного анализа состава этого комплекса показали, что в нем одна молекула ассоциированного СЧАГ-С12 приходится на семь катионов СЧАГ-С12, являющихся противоионами сульфокислотных групп.
Чтобы исключить влияние ассоциированных молекул СЧАГ на биоцидные свойства данного комплекса последний был переосажден. После переосаждения содержание брома в комплексе уменьшилось с 2.0 до 0.9%, что соответствует содержанию в ПКК одной молекулы ассоциированного СЧАГ-С12 на четырнадцать катионов СЧАГ-С12, являющихся противоионами сульфокислотных групп. Однако и этот переосажденный комплекс полностью подавляет рост грибов. Кроме того, уменьшение содержания в комплексе ассоциированного СЧАГ в результате преосаждения приводит к увеличению гидрофобности комплекса: краевой угол смачивания покрытия увеличивается с 80° до 90°.
Помимо реакции комплексообразования полиэлектролит–СЧАГ синтез ПКК возможен полимеризацией комплексов мономерных электролитов с противоположно заряженными СЧАГ, в частности, полимеризацией мономерного комплекса ССН со СЧАГ, содержащими длинноцепной алкильный заместитель
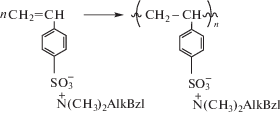
Данный способ позволяет получать комплексы со строго эквимолярным соотношением компонентов, не содержащие в своей структуре молекул ассоциированного СЧАГ.
Действительно, элементный анализ полученных таким способом ПКК со СЧАГ-С8 СЧАГ-С12 и СЧАГ-С16 показал отсутствие в них галогена, что подтверждает образование стехиометрических, строго эквимолярных ПКК, не содержащих ассоциированных СЧАГ. Оказалось, что и эти комплексы со СЧАГ-С12 и СЧАГ-С16 полностью подавляют рост грибов. Более низкая биоцидная активность ПКК со СЧАГ-С8 (рост грибов оценивался в 1 балл) связана с меньшей длиной алкильного заместителя в последнем, не достаточной для существенного нарушения жизнедеятельности клеток грибов [1, 16].
Итак, дифильные четвертичные аммониевые соединения в составе ПКК, являясь противоионами сильной полистирольсульфокислоты, сохраняют высокие биоцидные свойства, присущие этим соединениям как в составе ПКК на основе слабых карбоновых кислот [5], так и свободным СЧАГ, где противоионом является анион галоида [16].
Сравнение свойств рассмотренных выше комплексов ПССН с четвертичными аммониевыми соединениями со свойствами аналогичных комплексов на основе ПАК-Na показало, что при одинаковом уровне биоцидной активности этих ПКК пленочные покрытия из комплексов на основе ПССН имеют большую твердость и гидрофобность (табл. 4).
ЗАКЛЮЧЕНИЕ
В настоящей работе синтезированы ПКК, содержащие четвертичные аммониевые группы, связанные с цепью макромолекулы как кулоновским взаимодействием, так и ковалентной связью, в обоих случаях являясь противоионом сульфонатной группы. Изучены антифунгальные свойства этих ПКК. Выявлено, что более высокой фунгицидной активностью обладают ПКК, в которых четвертичная аммониевая группа связана с цепью макромолекулы кулоновским взаимодействием. Присутствие в составе указанных стехиометрических комплексов ассоциированных молекул СЧАГ не является определяющим в высокой фунгицидной активности ПКК.
Сравнение свойств комплексов ПССН со СЧАГ и комплекса ПАК-Na cо СЧАГ показало сопоставимый уровень антимикробных свойств, причем было обнаружено, что первые образуют боле твердые и гидрофобные пленочные покрытия.
Список литературы
Gilbert P., Moore L.E. // J. Appl. Microbiol. 2005. V. 99. № 4. P. 703.
Timofeeva L., Kleshcheva N. // Appl. Microbiol. Biotechnol. 2011. V. 89. P. 475.
KaurR., Liu S., // Progr. Surface Sci. 2016. V. 91. № 3. P. 136.
Siedenbiedel F., Tiller J.C. // Polymers. 2012. V. 4. № 1. P. 46.
Panarin E.F., Kopeikin V.V. // Polymer Science C. 2002. V. 44. № 2. P. 185.
Kenawy El-R., Worley S.D., Broughton R. // Biomacromolecules. 2007. V. 8. № 5. P. 1359.
Tashiro T. // Macromol. Mater. Eng. 2001. V. 286. № 2. P. 63.
Фельдштейн М.М., Зезин А.Б. // Молек. биология. 1974. Т. 8. № 1. С. 142.
Новаков И.А., Шулевич Ю.В., Ковалева О.Ю., Навроцкий А.В., Навроцкий В.А. // Изв. ВолгГТУ. 2005. Т. 1. С. 5.
Goddard E.D. // Colloids Surf. 1986. V. 19. № 2–3. P. 301.
Antonietti M., Főrster S., Zisenis M., Conrad J. // Macromolecules. 1995. V. 28. № 7. P. 2270.
Yoshimura T., Nagata Y., Esumi K. // J. Colloid Inerface Sci. 2004. V. 275. № 2. P. 618.
Prokhorova E.V., D’yakova M.G., Zubov V.P., Shevlyakova N.V., Tverskoy V.A. // Polymer Science B. 2014. V. 56. № 1. P. 21.
Бектуров Е.А., Мягченков В.А., Куренков В.Ф. Полимеры и сополимеры стиролсульфокислоты. Алма-Ата: Наука, 1989.
Афиногенов Г.Е., Панарин Е.Ф. Антимикробные полимеры. СПб.: Гиппократ, 1993.
Gilbert P., Al-Taae A. // Lett. Appl. Microbiol. 1985. V. 1. P. 101.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


