Высокомолекулярные соединения (серия А), 2019, T. 61, № 5, стр. 448-457
КОМПОЗИТНЫЕ ПЛЕНКИ НА ОСНОВЕ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ И НАНОКРИСТАЛЛОВ ГИДРОКСИАПАТИТА: МОРФОЛОГИЯ, СТРУКТУРА И СВОЙСТВА
Н. А. Архарова a, А. В. Северин b, А. К. Хрипунов c, С. В. Крашенинников d, А. А. Ткаченко e, А. С. Орехов a, d, Г. А. Давыдова f, Е. В. Ракова a, В. В. Клечковская a, *
a Федеральный научно-исследовательский центр “Кристаллография и фотоника”.
Институт кристаллографии им. А.В. Шубникова Российской академии наук
119333 Москва, Ленинский пр., 59, Россия
b Московский государственный университет им. М.В. Ломоносова. Химический факультет
119899 Москва, Ленинские горы, Россия
c Институт высокомолекулярных соединений Российской академии наук
119004 Санкт-Петербург, Большой пр., 31, Россия
d Научно-исследовательский центр “Курчатовский институт”
123182 Москва, пл. академика Курчатова, 1, Россия
e Санкт-Петербургский государственный университет
199178 Санкт-Петербург, 16-я линия В/О, 29, Россия
f Институт теоретической и экспериментальной биофизики Российской академии наук
142290 Московская обл., Пущино, ул. Институтская, 3, Россия
* E-mail: klechvv@crys.ras.ru
Поступила в редакцию 29.03.2019
После доработки 23.04.2019
Принята к публикации 07.05.2019
Аннотация
Изучен новый композитный материал, представляющий собой слоистую пленку, на основе целлюлозы, полученной при статическом культивировании Komagataeibacter rhaeticus, и нанокристаллов гидроксиапатита. Образцы с массовым соотношением целлюлозы и гидроксиапатита 1 : 25, 1 : 4, 1 : 1 получены двумя способами – совместной дезинтеграцией водных суспензий нанокристаллов гидроксиапатита с макрофрагментированной нано-гель-пленкой бактериальной целлюлозы и синтезом нанокристаллов гидроксиапатита в суспензии дезинтегрированной бактериальной целлюлозы. Показано, что, независимо от способа, увеличение доли целлюлозы приводит к возрастанию плотности композитного материала, степени текстурированности, модуля Юнга и прочности на разрыв, а также к уменьшению пористости и объема пор. Анализ цитотоксичности, проведенный на фибробластах, выделенных из клеток подкожной соединительной ткани мышей С3H/An, продемонстрировал отсутствие цитотоксичности исследуемых пленок.
ВВЕДЕНИЕ
В последнее десятилетие наблюдается значительный прогресс в создании новых материалов для медицинских приложений. Особый интерес представляют композиты на основе полимеров природного происхождения, в первую очередь целлюлоз различных источников. Такие материалы созданы для решения широкого круга медицинских задач: от разработки раневых покрытий и искусственных заменителей кожи до изготовления восстановителей и заменителей сосудистой, хрящевой и костной тканей [1–5]. Основной проблемой здесь является получение композита, который был бы максимально близок по структуре и свойствам к своему естественному аналогу.
Среди природных целлюлоз бактериальная целлюлоза (БЦ) статического культивирования может служить идеальной основой композита, поскольку представляет собой нано-гель-пленку, характеризующуюся 3D-структурой в виде сетки микрофибрилл и лент. В ее объеме содержится до 98% воды, но при этом гель-пленка бактериальной целлюлозы по сравнению с целлюлозами других источников не содержит примесей, поскольку бактерии, продуцирующие ее внеклеточно, легко удаляются. Она обладает достаточно высокими механическими характеристиками. Показано, например, что композиты на основе бактериальной целлюлозы и полиакриламида очень близки по своим механическим параметрам к естественной хрящевой ткани [6, 7].
Весьма перспективными для применения в медицинской практике представляются композиты бактериальной целлюлозы с нанодисперсным гидроксиапатитом (ГАП) – неорганическим матриксом костной ткани, успешно применяющимся в костной хирургии и стоматологии [8, 9]. На химическом факультете МГУ им. М.В. Ломоносова была создана методика синтеза наногидроксиапатита [10], особенностью ее является не только полная биосовместимость с организмом человека и животных, но и высокая биологическая активность в процессах остеосинтеза, что было подтверждено клиническими испытаниями [11, 12]. По результатам данного исследования разработана промышленная технология синтеза наногидроксиапатита [13, 14], применяемая для производства серии медицинских препаратов под маркой “Остим”, а также профилактической зубной пасты “Пародонтол” фабрики “Свобода”. Все большее число работ посвящается созданию на основе наногидроксиапатита композитных органо-минеральных комплексов, в том числе в сочетании с бактериальной целлюлозой [15–17]. Биосовместимость материалов на основе бактериальной целлюлозы–ГАП подтверждена многими исследованиями in vitro и in vivo [18–22].
Широко распространенным методом получения композита БЦ–ГАП является биоминерализация (имитация процесса образования минеральной составляющей в естественной костной ткани). Метод заключается в последовательном погружении нано-гель-пленки бактериальной целлюлозы в жидкость, близкую по составу к плазме крови человека [15, 16, 19, 23–26]. В таких композитах наночастицы ГАП располагаются преимущественно на поверхностных фибриллах гель-пленки бактериальной целлюлозы, проникая внутрь в небольшом количестве. Этого эффекта удается избежать при уменьшении толщины нано-гель-пленки бактериальной целлюлозы и, соответственно, размеров самого композита [27]. Только придать образцу необходимую форму из такого материала достаточно сложно: хотя гель-пленка и обладает эластичностью, но является трудно формуемым материалом. В работах последних лет в качестве основы композита используют порошок или водную суспензию бактериальной целлюлозы [17, 27, 28], способствующие образованию более гомогенного продукта. Однако значительное нарушение фибриллярной структуры нано-гель-пленки бактериальной целлюлозы влечет ухудшение механических характеристик композитов.
Основная цель настоящей работы – получение композитов БЦ–ГАП с удовлетворительными прочностными характеристиками, пригодными для применения в ортопедии. В качестве основы композитного материала использовали суспензию дезинтегрированной бактериальной целлюлозы, сохраняя ее фибриллярную структуру. При этом варьировали способы приготовления композитов и соотношения компонентов в них для получения материалов с широким спектром характеристик.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе использовали нано-гель-пленку целлюлозы Komagataeibacter rhaeticus (ВКПМ В-13015), получаемую методом статического поверхностного культивирования на кафедре микробиологии СПбГУ, а также карбонат кальция CaCO3 и фосфорная кислота H3PO4 квалификации х.ч. (“ИРЭА-2000”, Россия). Оксид кальция СаО синтезировали разложением карбоната кальция при нагревании до температуры 1100°С и выдерживании 3 ч.
Синтез целлюлозы Komagataeibacter rhaeticus ВКПМ В-13015
Нано-гель-пленку необходимой толщины формировали при поверхностном культивировании бактерий на питательной среде Шрама–Хестрина. Состав пленки: глюкоза 2.0%, дрожжевой экстракт ДЭ-0.5%, пептон 0.5%, лимонная кислота 0.15%, Na2HPO4 0.27% [29]. Культивирование бактерий прекращали после достижения необходимой толщины гель-пленки, которую затем отмывали от остатков культуральной среды дистиллированной водой и обрабатывали кипячением в растворе NaOH 0.5% для удаления нецеллюлозных компонентов с последующим тщательным промыванием в дистиллированной воде.
Дезинтегрирование нано-гель-пленки осуществляли в блендере при скорости вращения ножей 2000 об/мин в течение 15 мин.
Синтез наночастиц гидроксиапатита
Синтез нанодисперсного гидроксиапатита Са5(РО4)3ОН осуществляли путем постепенного добавления раствора ортофосфорной кислоты с концентрацией Н3РО4 7.93 моль/л при стехиометрическом соотношении Са/Р = 1.67 в водную суспензию СаО. Массу навески СаО и количество воды рассчитывали таким образом, чтобы при постоянном интенсивном перемешивании в результате реакции образовывалась 5% (по массе) суспензия целевого продукта. Контроль за синтезом вели по изменению рН раствора; реакция считалась законченной при достижении значения рН 6.5–7.0 [30].
Приготовление композита БЦ–ГАП
Композиты БЦ–ГАП получали двумя способами: совместным дезинтегрированием водных суспензий нанокристаллов гидроксиапатита и макрофрагментированной нано-гель-пленки бактериальной целлюлозы; синтезом наночастиц гидроксиапатита в присутствии фибриллярных фрагментов суспензии дезинтегрированной бактериальной целлюлозы. В обоих случаях брали идентичные массовые соотношения компонентов БЦ : ГАП = 1 : 25, 1 : 4, 1 : 1, 2.3 : 1.0.
В первом способе совместное дезинтегрирование макрофрагментов суспензии бактериальной целлюлозы и наночастиц гидроксиапатита проводили в лабораторном блендере в течение 15 мин при скорости вращения ножей 2000 об/мин.
Второй способ основан на осуществлении синтеза ГАП в суспензии бактериальной целлюлозы. Для получения композитов с разным соотношением компонентов брали известное количество суспензии диспергированной бактериальной целлюлозы, доводили объем реакционной смеси до 150 мл с помощью дистиллированной воды и вносили навеску оксида кальция при интенсивном перемешивании. Навески компонентов рассчитывали таким образом, чтобы после завершения химической реакции образования гидроксиапатита в итоговом композите массовое соотношение БЦ : ГАП составляло величины 1 : 25, 1 : 4 и 1 : 1 г/г. Далее смесь гомогенизировали в течение 5 мин, а затем проводили синтез наночастиц ГАП по методике, описанной выше: путем добавления фосфорной кислоты через специальный керамический капилляр (скорость ~1 мл/мин, концентрация Н3РО4 7.93 моль/л) в полученную водную суспензию бактериальной целлюлозы и Са(ОH)2 до достижения стехиометрического соотношения Ca/P = 1.67. Реакцию считали законченной при достижении рН 6.5–7.0. При дальнейшем увеличении доли бактериальной целлюлозы в растворе синтез неосуществим, поэтому для приготовления композита с массовой долей бактериальной целлюлозы, большей доли гидроксиапатита, к композитной суспензии БЦ : ГАП (1 : 1) добавляли суспензию бактериальной целлюлозы, взятой в таком количестве, чтобы получить массовое соотношение БЦ : ГАП = 2.3 : 1.0.
Композитные пленки толщиной до 0.05 мм получали методом полива на стекло с последующим высушиванием их при комнатной температуре. При испарении 95% воды из суспензии БЦ–ГАП на поверхности стекла образуется пленка, которой можно придать любую форму (рис. 1).
Методы исследования
Исследование морфологии и структуры полученных композитов проводили с использованием растровых электронных микроскопов “Quanta 200-3D”, “Scios” при ускоряющем напряжении 2–5 кВ, и просвечивающего электронного микроскопа “Tecnai Osiris” производства “FEI” (США) при ускоряющем напряжении 200 кВ. Для обработки изображений применяли программы Digital micrograph (“Gatan”, США). Интерпретацию дифракционных картин выполняли в программе JEMS.
Для расчета удельной свободной поверхности образцов S и характеризации их пористой структуры (V – объем пор) использовали метод тепловой десорбции азота на приборе “Micrometrics ASAP 2010M” (США). Обработку результатов осуществляли по модели Брунауэра–Эммета–Теллера при условии проведения анализа (температура –196°С и относительное давление паров P/P0 = 0.2). Размеры пор диаметром ≤100 нм в композитах определяли по модели Баррета–Джойнера–Халенда. Плотность и пористость находили расчетным методом по данным массы и объема композитных образцов.
Для проведения механических испытаний из полученных пленок вырезали образцы в виде двухсторонних лопаток с размерами рабочей части 10 × 3 мм. Испытания осуществляли на универсальном испытательном приборе “INSTRON 5965” в режиме одноосного растяжения с постоянной скоростью 1 мм/мин. Механические характеристики (модуль Юнга, разрывная прочность) представили по результатам испытаний в соответствии с рекомендациями ГОСТ 11262-80.
Для исследования цитотоксичности использовали вытяжки из исследуемых пленок, приготовленных согласно требованиям ISO 10993-12:2007 в культуральной среде DMEM/F-12 при Т = = 37 ± 1°С в течение 72 ± 2 ч, соотношение площади материала к объему экстрагирующей жидкости составило 3 см2/мл. Перед началом работы пленки стерилизовали, помещая в 70%-й раствор этилового спирта на 10 мин, и далее промывали в среде DMEM. Исследование вытяжек на цитотоксичность выполняли с применением МТТ-теста, основанного на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ) митохондриальными и цитоплазматическими дегидрогеназами живых метаболически активных клеток с образованием голубых кристаллов формазана, растворимого в диметилсульфоксиде. Исследования проводили на фибробластах линии NCTС клон L-929, полученные из клеток подкожной соединительной ткани мышей С3H/An (“Flow Laboratories”, Великобритания). Клетки линии NCTC клон L-929 в концентрации 25 тыс. кл/см2 в среде ДМЕМ/F-12, содержащей 5% сыворотки ЭТС (эмбриональная телячья сыворотка), 100 Ед/мл пенициллин/стрептомицина высевали в лунки 96-луночного планшета и помещали в СО2-инкубатор при температуре 37°С. Через 18 ч среду удаляли и вводили 100 мкл вытяжек исследуемых образцов в среде ДМЕМ/ F-12, не содержащей сывороточных факторов прикрепления. В качестве контроля в лунки добавляли среду ДМЕМ/F-12 без вытяжек, не содержащую сывороточные факторы прикрепления. Спустя 24 и 48 ч соответственно после внесения вытяжек материалов культуральную среду удаляли и в каждую лунку вносили по 100 мкл раствора МТТ в концентрации 0.5 мг/мл в культуральной среде DMEM/F-12, не содержащей сыворотку. После инкубирования в течение трех часов при Т = 37°С в увлажненной атмосфере, содержащей 5% СО2, жидкость удаляли, вносили по 100 мкл ДМСО и, встряхивая планшеты при комнатной температуре в течение 10 мин, растворяли образовавшиеся соли формазана. Количество восстановленного формазана определяли по оптической плотности растворов на фотометре модели 680 (“BIO-RAD”, США) при длине волны 540 нм. Статистический анализ полученных результатов проводили с использованием непараметрического U-критерия Манна–Уитни – статистического критерия, используемого для оценки различий между двумя независимыми выборками по уровню какого-либо признака, измеренного количественно.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Морфология и структура пленок БЦ–ГАП
Известно, что исходная нано-гель-пленка бактериальной целлюлозы статического культивирования на питательной среде описанного выше состава обладает плоскостной текстурой: микрофибриллы (преимущественно Iβ моноклинная фаза) располагаются плоскостью ($1\bar {1}0$) параллельно поверхности [31]. Исследования показали, что подобная ориентация наблюдается и в пленках, сформированных из диспергированной бактериальной целлюлозы. При испарении воды из суспензии, помещенной на стекло, фибриллярные фрагменты бактериальной целлюлозы ориентируются параллельно поверхности стекла, образуя “листы”, которые при дальнейшем высыхании пленки “схлопываются”, т.е. происходит своего рода структурная самосборка фрагментов бактериальной целлюлозы. На рис. 2 видно, что при увеличении доли бактериальной целлюлозы в композите структура поперечных сколов становится подобной структуре исходной раздробленной бактериальной целлюлозы (рис. 2ж). В полученных образцах наночастицы гидрокси-апатита располагаются как между “листами” бактериальной целлюлозы, так и в плоскости “листа” на фибриллах. Однако абсолютно гомогенной структуры не получается: агломераты и отдельные нанокристаллы гидроксиапатита, не закрепившиеся на фибриллах бактериальной целлюлозы, располагаются в объеме образца неравномерно.
Рис. 2.
РЭМ-изображения поверхности и боковых сколов пленок БЦ : ГАП при значениях массовой доли бактериальной целлюлозы в композитах 1 : 25 (а, г), 1 : 4 (б, д) и 1 : 1 (в, е), полученных смешиванием компонентов композита первым (а–в) и вторым способом (г–е); ж – исходная дезинтегрированная нано-гель-пленка БЦ.

На рис. 3 приведены электронно-микроскопические изображения волокон и микрофибрилл бактериальной целлюлозы и связанных с ними агломератов наночастиц ГАП. Картины электронной дифракции от нанокристаллов ГАП, представленные на вставках, отвечают гексагональной фазе гидроксиапатита (параметры элементарной ячейки a = 0.942, c = 0.688 нм, пространственная группа P-63/m) [32]. Видно, что при увеличении массовой доли бактериальной целлюлозы в композите (независимо от способа получения) геометрия электронограмм постепенно изменяется, наблюдается переход от кольцевой картины к четко выраженной текстуре (рис. 3в, 3е). Из геометрического анализа электронограмм и распределения интенсивности вдоль колец следует, что наночастицы гидрокси-апатита располагаются преимущественно осью с вдоль поверхности фибрилл бактериальной целлюлозы. Такое взаимное расположение органической и неорганической компонент композита аналогично положению минеральной составляющей костной ткани относительно коллагеновых фибрилл [33, 34]. Это важный результат, поскольку именно такая структура композита может дать возможность использовать этот материал для трансплантации.
Рис. 3.
ПЭМ-изображения волокон бактериальной целлюлозы с агломератами наночастиц ГАП в композитах с увеличением доли БЦ слева направо 1 : 25 (а, г), 1 : 4 (б, д) и 1 : 1 (в, е), полученных первым (а–в) и вторым способом (г–е). На вставках представлена электронная дифракция от соответствующих агломератов наночастиц ГАП.

Плотность и пористость
Физико-химические характеристики композитных пленок БЦ–ГАП представлены в таблице 1. Видно, что для серий образцов БЦ–ГАП, полученных разными методами, вплоть до соотношения БЦ : ГАП = 1 наблюдается тенденция разнонаправленного изменения удельной поверхности. Для композитов, образованных совместным диспергированием водных суспензий бактериальной целлюлозы и ГАП, увеличение доли гидроксиапатита в композите приводит к увеличению удельной поверхности S и объема пор V. Вместе с тем для образцов, синтезированных ГАП в среде бактериальной целлюлозы, прослеживается обратная зависимость величин удельной поверхности. При этом общий объем пор колеблется вблизи значения 0.32 ± 0.05 см3/г (рис. 4а, 4б).
Таблица 1.
Физико-химические свойства композитных пленок БЦ–ГАП
| Композит | Удельная поверхность, м2/г | Объем пор, см3/г | Средний размер нанопор, нм | Пористость, % | Плотность, г/см3 | Модуль Юнга/ разр. прочность, ГПа/МПа |
|---|---|---|---|---|---|---|
| БЦ : ГАП* (1 : 25) | 77.4 ± 3.7 | 0.47 ± 0.07 | 9.6 ± 0.7 | 58.9 ± 2.7 | 1.25 ± 0.07 | –/– |
| БЦ : ГАП* (1 : 4) | 68.8 ± 2.5 | 0.43 ± 0.06 | 11.9 ± 1.0 | 52.8 ± 2.3 | 1.23 ± 0.07 | 4.9 ± 0.7 /77 ± 14 |
| БЦ : ГАП* (1 : 1) | 55.1 ± 2.1 | 0.33 ± 0.07 | 10.4 ± 1.1 | 40.7 ± 1.9 | 1.23 ± 0.07 | 8.0 ± 0.5 /134 ± 14 |
| БЦ : ГАП* (2.5 : 1.0) | 11.0 ± 1.0 | 0.039 ± 0.06 | 8.3 ± 0.5 | 6.7 ± 0.7 | 1.7 ± 0.08 | 7.5 ± 0.7 /136 ± 15 |
| БЦ диспергиро-ванная | 7.5 ± 0.5 | 0.015 ± 0.07 | 1.1 ± 0.01 | 2.3 ± 0.05 | 1.54 ± 0.09 | 8.5 ± 0.2 /176 ± 44 |
| БЦ : ГАП** (1 : 25) | 56.3 ± 3.0 | 0.27 ± 0.06 | 10.5 ± 1.1 | 44.8 ± 1.5 | 1.6 ± 0.09 | 3.2 ± 0.1 / 8 ± 1 |
| БЦ : ГАП** (1 : 4) | 70.1 ± 3.2 | 0.37 ± 0.07 | 9.9 ± 1.0 | 49.2 ± 1.9 | 1.32 ± 0.08 | 5.6 ± 0.4 /59 ± 2 |
| БЦ : ГАП** (1 : 1) | 86.8 ± 4.0 | 0.27 ± 0.06 | 12.3 ± 1.2 | 36.0 ± 1.2 | 1.33 ± 0.08 | 5.0 ± 0.7 /59 ± 5 |
| БЦ : ГАП** (2.5 : 1.0) | 22.8 ± 1.4 | 0.10 ± 0.01 | 11.4 ± 1.1 | 15.5 ± 1.5 | 1.55 ± 0.09 | 7.5 ± 0.6/140 ± 17 |
| БЦ гель-пленка | 7.4 ± 0.5 | 0.001 ±0.0001 | 0.5 ± 0.05 | 0.1 ± 0.01 | 1.56 ± 0.09 | 10.4 ± 0.5 /254 ± 20 |
Рис. 4.
Зависимость удельной поверхности S (а) и объема пор V (б) от соотношения компонентов в композите и способа его приготовления: 1 – первый способ, 2 – второй способ.
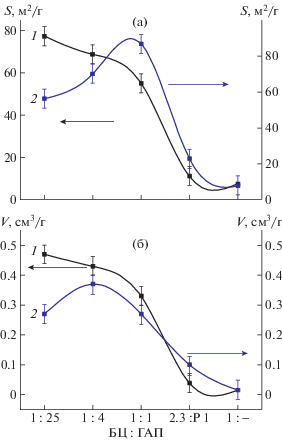
Средний размер нанопор практически не зависит от способа получения композита и соотношения компонентов в нем и составляет величину 10.4 ± 2.0 нм. Cледовательно, изменение удельной поверхности связано с образованием в мезопористой структуре композита различий в построении текстуры в зависимости от способа получения. В случае смешивания двух компонентов наночастицы ГАП и их агломераты просто адсорбируются на фрагментах бактериальной целлюлозы в растворе. В том случае, когда гидроксиапатит синтезируется в среде бактериальной целлюлозы, наночастицы, по всей вероятности, зарождаются как в растворе, так и на фибриллах бактериальной целлюлозы, ориентируясь своей плоской гранью параллельно поверхности фибриллы. Если целлюлозы в системе немного, то такая адсорбция не будет влиять на большинство образующихся в объеме кристаллов ГАП, однако частицы, формирующиеся на фрагментах целлюлозы, будут выступать центрами агрегации для других частиц. По мере увеличения содержания целлюлозы количество нанокристаллов, зародившихся на волокнах бактериальной целлюлозы, будет существенно возрастать, при этом наличие целлюлозных фрагментов в растворе мешает агломерации наночастиц. В связи с этим, эффект “раздвигания” фибрилл остается, хотя пространство между ними в процессе синтеза заполняется ГАП более плотно. Когда соотношение БЦ : ГАП составляет 2.3 : 1.0, при втором способе реализуется смешанный механизм формирования композита. В этом случае начинает существенно влиять механизм образования текстуры, характерный для простых смесей ГАП–БЦ, полученных первым способом. Кроме того, как отмечалось выше, при увеличении доли бактериальной целлюлозы уменьшаются значения удельной поверхности и пористости.
Модуль Юнга
Типичные кривые растяжения композиционных материалов БЦ–ГАП, полученных разными методами и с разным соотношением компонентов, представлены на рис. 5.
Рис. 5.
Кривые растяжения в координатах напряжение–деформация (σ–ε) для композитов БЦ–ГАП, полученных смешением суспензий (а) и синтезом гидроксиапатита в присутствии фибрилл бактериальной целлюлозы (б), соотношения компонентов БЦ : ГАП = 1 : 25 (1), 1 : 4 (2), 1 : 1 (3), 2.3 : 1.0 (4), дезинтегрированная БЦ (5), исходная нано-гель-пленка БЦ (6).
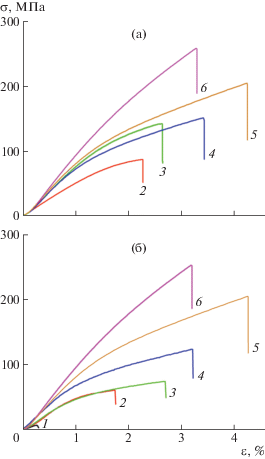
Измельченная бактериальная целлюлоза демонстрирует меньшую прочность и меньший модуль Юнга при большей деформируемости по сравнению с исходной гель-пленкой бактериальной целлюлозы. Введение в целлюлозу нанокристаллов ГАП влечет существенное уменьшение модуля Юнга и прочности. Тенденция к снижению основных механических параметров не зависит от способа приготовления композита. Однако в зависимости от способа получения существуют особенности в изменении механических характеристик.
Статистический разброс значений модуля Юнга и разрывной прочности в зависимости от соотношения компонентов для разных способов получения образцов представлены на рис. 6.
Рис. 6.
Зависимость модуля Юнга Е (а) и разрывной прочности σ (б) от массового соотношения целлюлозной компоненты и способа получения композита.
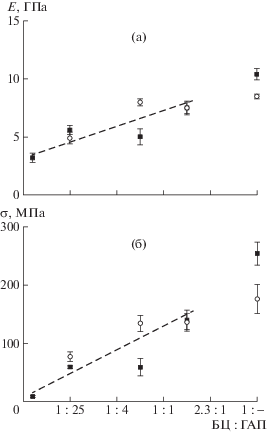
Анализируя полученные значения модуля Юнга и прочности от содержания бактериальной целлюлозы в композите, можно отметить, что их изменение, с учетом имеющегося разброса в характеристиках, описывается линейной зависимостью. Разброс является следствием неравномерности распределения наночастиц гидроксиапатита в композите, что было показано выше методом электронной микроскопии. Несмотря на способ получения образцов, изменение механических характеристик может быть представлено одной линейной зависимостью (рис. 6), т.е. можно свидетельствовать об особенностях, присущих каждому из способов получения. При введении наполнителя основное влияние оказывает способ введения частиц и присущее этому способу их распределение по объему. Так, показано, что при синтезе ГАП в среде бактериальной целлюлозы локальные значения концентрации образующегося на фибриллах продукта могут существенно превосходить усредненную по массе концентрацию. Эти скопления частиц ГАП при растяжении могут служить “концентраторами напряжения”, приводящими к преждевременному снижению механических характеристик пленки. В то же время, в образцах, полученных методом смешения, распределение частиц по объему более равномерно. Выражается это в следующем: в композитах, синтезированных совместным диспергированием БЦ–ГАП, характеристики снижаются незначительно, вплоть до соотношения БЦ : ГАП = 1 : 1, в то время как в образцах, полученных синтезом ГАП в присутствии суспензии бактериальной целлюлозы, существенное снижение параметров наблюдается при соотношении 2.3 : 1.0.
Для сравнения характеристик композитов с механическими свойствами костной ткани были приготовлены композиты при соотношении компонентов, аналогичном известному соотношению коллагеновой и минеральной составляющих в естественной костной ткани – 2.3 : 1.0. Значения модуля упругости полученных пленок БЦ–ГАП при таком соотношении оказались близки к значениям модуля упругости для кортикальной костной ткани [35].
Цитотоксичность
Исследование метаболической активности клеток NCTC L-929 с использованием МТТ-теста продемонстрировало отсутствие значимых различий между опытом и отрицательным контролем, свидетельствующее об отсутствии токсического либо угнетающего действия на клетки у вытяжек материалов. Статистический анализ не показал подтвержденных различий между воздействием на клетки вытяжек из материалов. Таким образом, можно полагать, что исследуемые образцы не обладают острой токсичностью (рис. 7).
Рис. 7.
Метаболическая активность клеток NCTC L-929 по результатам МТТ-теста при инкубации 24 ч с 3-суточными вытяжками из материалов (φ – выживаемость клеток) при разных соотношениях компонентов: а – дезинтегрированная БЦ, б – получение по первому способу, в – по второму способу.
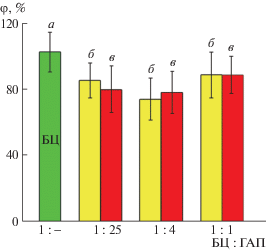
Известно, что такие характеристики как плотность, пористость и модуль Юнга различных участков костной ткани могут существенно отличаться [34]. Предложенные способы получения композитного материала позволяют варьировать пористость от 59 до 1%, плотность от 1.23 до 1.7 г/см3, модуль Юнга от 3.2 до 7.5 ГПа в зависимости от метода получения и соотношения компонентов.
Появилась возможность создания слоистых композитов на основе бактериальной целлюлозы и нанокристаллов гидроксиапатита с разной степенью текстурированности и различными физическими характеристиками для создания материалов с наилучшим соответствием структуре естественной костной ткани. На рис. 8 представлен композит БЦ–ГАП с градиентом свойств, состоящий из последовательно нанесенных слоев с разным соотношением компонентов.
ЗАКЛЮЧЕНИЕ
Исследование наноструктуры композитов, приготовленных совместным дезинтегрированием водных суспензий бактериальной целлюлозы и ГАП, а также синтезом ГАП в среде с фрагментами фибрилл и лент бактериальной целлюлозы, показало, что наночастицы и агломераты ГАП располагаются преимущественно осью с параллельно поверхности фибрилл (лент) бактериальной целлюлозы независимо от способа получения композита БЦ–ГАП. Установлено, что плотность и модуль Юнга возрастают с увеличением содержания целлюлозной составляющей в композитах.
Варьирование соотношения компонентов и методов получения композита БЦ–ГАП позволяет формировать имплантаты сложной архитектуры с управляемыми физико-химическими характеристиками каждого его участка для лучшего соответствия неоднородным свойствам костной ткани в соответствии со структурой замещаемого очага поражения.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках работ по Госзаданию с использованием оборудования Центра коллективного пользования Федерального научно-исследовательского центра “Кристаллография и фотоника” РАН.
Список литературы
Wang J., Zhu Y., Du J.J. // Mech. Med. Biol. 2011. V. 11. P. 285.
Novotna Katarina, Havelka Pavel, Sopuch Tomas, Kolarova Katerina, Vosmanska Vladimira, Vera Lisa, Svorcik Vaclav, Bacakova Lucie // Cellulose. 2013. V. 20. № 5. P. 2263.
Ning Lin, Dufresne Alain // Eur. Polym. J. 2014. V. 59. P. 302.
Eftekhari S., El Sawi I., Bagheri Z.S., Turcotte G., Bougherara H. // Mater. Sci. Eng., Mater. Biol. Appl. 2014. V. 39. P. 120.
Xifeng Liu, Shanfeng Wang. Encyclopedia of Biomedical Polymers and Polymeric Biomaterials / Ed by Munmaya Mishra. New York: CRC Press, 2016. P. 7957.
Buyanov A.L., Gofman I.V., Revel’skaya L.G., Khripunov A.K., Tkachenko A.A. // J. Mechan. Behavior Biomed. Mater. 2010. V. 3. № 1. P. 102.
Buianov A.L., Gofman I.V., Hripunov A.K., Tkachenko A.A., Ushakova E.E. // A. 2013. V. 55. № 5. P. 512.
Баринов C.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2005.
Глимчер М. Молекулярная биология минерализованных тканей, в частности костной ткани. Современные проблемы биофизики. М.: Иностр. лит., 1961. С. 94. Т. II.
Мелихов И.В., Комаров В.Ф., Божевольнов В.Е., Северин А.В. // Докл. РАН. 2000. Т. 373. № 3. С. 355.
Зуев В.П., Сергеев П.В., Мелихов И.В. // Химико-фармацевтический журн. 1994. № 2. С. 10.
Панкратов А.С., Древаль А.А., Пылаев А.С., Коршунов В.М., Кафарская Л.И., Лекишвили М.В. // Рос. стомат. журн. 2000. № 5. С. 4.
Rudin V.N., Komarov V.F., Melikhov I.V., Orlov A.Yu., Minaev V.V., Bozhevolnov V.E., Zuev V.P. // Stomat. Comp. Eur. Pat. 2001. P. 950 354.7.
Рудин В.Н., Комаров В.Ф., Мелихов И.В., Орлов А.Ю., Минаев В.В., Божевольнов В.Е., Зуев В.П. Пат. № 2122520 Россия. 1998.
Wan Y.Z., Hong L., Jia S.R., Huang Y., Zhu Y., Wang Y.L., Jiang H.J. // Comp. Sci. Technol. 2006. V. 66. P. 1825.
Wan Y.Z., Huang Y., Yuan C.D., Raman S., Zhu Y., Jiang H.J., He F. Gao C. // Mater. Sci. Eng. 2007 . V. 27. P. 855.
Lai C., Zhang S.J., Wang L.Q. // J. Mater. Chem. 2015. V. 3. P. 9001.
Grande C.J., Torres F.G., Gomez C.M., Bano M.C. // Acta Biomater. 2009. V. 5. № 5. P. 1605.
Zimmermann K.A., LeBlanc J.M., Sheets K.T., Fox R.W., Gatenholm P. // Mater. Sci. Eng. C. 2011. V. 31. № 1. P. 43.
Saska S., Barud H.S., Gaspar A.M., Marchetto R., Ribeiro S.J.L., Messaddeq Y. // Biomaterials. 2011. Art. ID 175362.
Tazi N., Zhang Z., Messaddeq Y., Almeida-lopes L., Zanardi L.M., Levinson D., Rouabhia M. // AMB Exp. 2012. V. 2. № 1. P. 61.
Petrauskaite O., Gomes P.S., Fernandes M.H., Juodzbalys G., Stumbras A., Maminskas J., Liesiene J., Cicciu M. // BioMed. Res. Int. 2013. Art. ID 452750.
Yin N., Chen S., Ouyang Y., Tang L., Yang J., Wang H. // Prog. Nat. Sci. Mater. Int. 2011. V. 21. P. 472.
Wan Y.Z., Gao C., Luo H.L., He F., Liang H., Li X.L., Wang Y.L. // J. Nanosci. Nanotechnol. 2009. V. 9. № 11. P. 6494.
Gao C., Xiong G.Y., Luo H.L., Ren K.J., Huang Y., Wan Y.Z. // Cellulose. 2010. V. 17. P. 365.
Nge T.T., Sugiyama J. // J. Biomed. Mater. Res. A. 2007. V. 81. № 1. P. 124.
Chen P.Y., Lai J.T. // J. Med. Bioengin. 2013. V. 2. P. 228.
Arkharova N.A., Suvorova E.I., Severin A.V., Khripunov A.K., Krasheninnikov S.V., Klechkovskaya V.V. // Scanning. 2016.V. 38. № 6. P. 757.
Whistler R.L. // Cellulose. 1963. V. III. P. 4.
Мелихов И.В., Комаров В.Ф., Божевольнов В.Е., Северин А.В. // Докл. РАН. 2000. Т. 373. № 3. С. 355.
Klechkovskaya V.V., Baklagina Yu.G., Stepina N.D., Khripunov A.K., Buffat P.A., Suvorova E.I., Zanaveskina I.S., Tkachenko A.A., Gladchenko S.V. // Crystallography Rep. 2003. V. 48. P. 755.
Kay M.I., Young R.A., Posner A.S. // Nature. 1964. V. 204. P. 1050.
Suvorova E.I., Petrenko P.P., Buffat P.A. // Scanning. 2007. V. 29. № 4. P. 162.
McNally E.A., Schwarcz H.P., Botton G.A., Arsenault A.L. // PLoS One. 2012. V. 7. № 1. P. 437.
Khan S.N., Warkhedkar R.M., Shyam A.K. Int. // J. Curr. Eng. Technol. 2014. № 2. P. 539.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)




