Высокомолекулярные соединения (серия А), 2019, T. 61, № 5, стр. 431-439
Аддукты эпоксидных олигомеров с олигогексаметиленгуанидином и модифицированные эпоксиаминные пленки на их основе
Е. С. Жаворонок a, И. П. Седишев a, А. В. Сафонов b, И. Н. Сенчихин b, *
a МИРЭА – Российский технологический университет,
институт тонких химических технологий им. М.В. Ломоносова
119571 Москва, пр. Вернадского, 86, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, корп. 4, Россия
* E-mail: isenchikhin@gmail.com
Поступила в редакцию 17.04.2019
После доработки 30.04.2019
Принята к публикации 07.05.2019
Аннотация
Из промышленно выпускаемого гидрохлорида олигогексаметиленгуанидина синтезирован его гидросалицилат, имеющий более высокую растворимость в эпоксидных олигомерах. На его основе в среде диметилсульфоксида получены ковалентные аддукты с эпоксидными олигомерами. Методом рефрактометрии исследована кинетика синтеза таких аддуктов и определено стехиометрическое соотношение олигогексаметиленгуанидина и эпоксидного олигомера. Аддукты отверждены олигомерным амином с учетом реального содержания эпоксидных групп. В результате получены эластичные свободные пленки, температура стеклования которых ниже комнатной. Выявлена активность модифицированных пленок по отношению к грамположительным и грамотрицательным микроорганизмам, что указывает на перспективность исследуемых составов для создания бактерицидных покрытий.
ВВЕДЕНИЕ
Эпоксиаминные композиции благодаря хорошим механическим показателям, водостойкости и высокой адгезии к различным субстратам, нашли широкое применение в промышленности, строительстве и других областях [1–5]. Однако их стойкость к биоповреждению не всегда удовлетворительна [6, 7]. Одним из простых и эффективных способов повышения биостойкости эпоксиаминных составов является их модификация добавками, обеспечивающими биоцидные свойства. К числу перспективных модификаторов такого рода можно отнести полимеры и олигомеры гуанидинового ряда, которые проявляют антимикробную, антивирусную, спороцидную, фунгицидную, инсектицидную, пестицидную, альгицидную активность, способны воздействовать на аэробную и анаэробную микрофлору, обладают пролонгированным биоцидным действием и в то же время мало опасны для высших животных и человека [8–10]. Их типичными представителями являются олигогексаметиленгуанидины (ОГМГ), которые легко доступны и используются в качестве действующего вещества в составе многих дезинфицирующих средств для сельскохозяйственного производства и медицины [8]. Однако хорошая растворимость ОГМГ в воде препятствует его пролонгированному действию из-за смывания, вызывая необходимость неоднократной повторной обработки поверхностей. Ковалентное связывание молекул ОГМГ за счет их введения в эпоксиаминные сетки позволило бы значительно продлить биоцидное действие защитных покрытий.
Промышленно выпускаемые олигогексаметиленгуанидины в форме гидрохлоридов очень плохо растворимы в эпоксидных олигомерах (ЭО), что затрудняет их введение в эпоксиаминные сетки. Один из способов улучшения термодинамической совместимости с ЭО и отвердителем – введение в структуру ОГМГ гидрофобных фрагментов. Ранее [11] из гидрохлорида ОГМГ мы синтезировали гидропальмитат и гидростеарат с повышенной растворимостью в ЭО. Настоящая работа является продолжением этих исследований, и в ней в качестве кислотного остатка выбран фрагмент салициловой кислоты, способствующий коагуляции белков в протоплазме микробных клеток [12, 13]. Иными словами, цель настоящей работы – синтез салицилата ОГМГ и ковалентное введение его в эпоксидные составы для получения модифицированных эпоксиаминных пленок.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Базовыми объектами исследования служили диановый ЭО Epikote 828, поли-глицидиловый эфир олигооксипропилентриола Лапроксид 703, олигооксипропилендиамин Jeffamine D-230, структурные формулы которых приведены в работе [14], и гидрохлорид олигексаметиленгуанидина (Фарма-Покров, Россия)
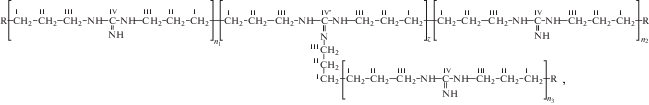
где R ≡ $ - {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} - {\kern 1pt} {\text{N}}{{{\text{H}}}_{2}}$ или  ; HА≡HCl (римские цифры над атомами соответствуют условным обозначениям в расшифровках
ЯМР-спектров).
; HА≡HCl (римские цифры над атомами соответствуют условным обозначениям в расшифровках
ЯМР-спектров).
Перед проведением экспериментов диановый ЭО выдерживали в течение 3 ч при 60°С для удаления кристаллитов.
Некоторые свойства ЭО и отвердителя представлены в табл. 1. Молекулярно-массовые характеристики гидрохлорида ОГМГ определены в рамках настоящей работы.
Таблица 1.
Основные характеристики ЭО и отвердителя
| Олигомер | Mn | Среднее число звеньев в молекуле | fЭП/ fNH/ fОН | Tg (ДСК, w+ = 10 град/мин), К |
|---|---|---|---|---|
| Epikote 828 | 376 | 0.12 | 1.99/ – / 0.13 | 255 |
| Лапроксид 703 | 732 | 8.68 | 2.43/ – / 0.57 | 202 |
| Jeffamine D230 | 230 | 2.69 | – / 3.99 / 0.01 | 200 |
Гидросалицилат ОГМГ синтезировали путем смешения предварительно приготовленного водного раствора салицилата натрия (из салициловой кислоты и карбоната натрия в водной среде) и водного раствора гидрохлорида ОГМГ. После выпадения осадка гидросалицилата ОГМГ систему нагревали до 85–95°С и добавляли этанол до полного растворения продукта. После охлаждения выделившийся продукт сушили на вакуумном роторном испарителе до постоянной массы.
Синтез аддуктов ОГМГ с ЭО вели в среде диметилсульфоксида (х.ч.). Очищенный гидросалицилат ОГМГ растворяли в ДМСО (1 : 1 мас.ч.), а полученный раствор совмещали со значительным мольным избытком ЭО (гидросалицилат ОГМГ : : ЭО = 1 : (2–5) мас.ч.). Эту систему далее подвергали термообработке при постоянной температуре 30°С в лабораторном реакторе с магнитной мешалкой и обратным холодильником.
Системы для отверждения ЭО или аддукта ЭО–ОГМГ со стехиометрическим количеством отвердителя готовили в расчете на остаточное содержание эпоксидных групп. Отверждение проводили при постоянной температуре 22 ± 2°С.
Исследования проводили методами спектроскопии ЯМР 1Н и ЯМР 13С, дифференциальной сканирующей калориметрии и рефрактометрии. Спектры ЯМР 1Н растворов солей ОГМГ в D2О или ДМСО-d6 регистрировали на ЯМР-фурье-спектрометре “Bruker DPX-300” со сверхпроводящим магнитом (рабочая частота 300 и 70 МГц для спектров ЯМР 1Н и ЯМР 13С соответственно). С целью количественного анализа состава образцов ОГМГ их спектры регистрировали в режиме Inverse Gate, при котором происходит полное широкополосное подавление взаимодействия с протонами и отсутствует ядерный эффект Оверхаузера. Для предотвращения релаксационных эффектов задержка между импульсами составляла 1.8 с. Число сканирований 3199. При анализе спектров химические сдвиги сигналов приведены относительно внутреннего стандарта метанола-d4.
Исследование солей ОГМГ, их аддуктов с ЭО и отвержденных систем методом ДСК проводили на приборе DSC Q-100 (“TA Instruments”, США) в динамическом режиме при постоянной скорости нагревания 10 град/мин. Экспериментальные данные обрабатывали с помощью пакета программ TA Universal Analysis 2000 (V4.5A).
Контроль синтеза аддуктов ЭО с ОГМГ вели методом рефрактометрии, отбирая образцы реакционной массы и исследуя их на приборе RL2 по стандартной методике при постоянной температуре 22 ± 2°С с погрешностью ±0.0001.
Биоцидную активность отвержденных эпоксиаминных пленок на основе аддуктов ОГМГ–ЭО изучали с помощью стандартного МТТ-теста, основанного на оценке дыхательной активности клетки. В качестве тестовых микроорганизмов использовали грамотрицательный штамм Pseudomonas. putida К12 и грамположительный штамм Paenibacillus jamilae DCB-2-2. Исследования проводили на таблетках диаметром 3 мм и толщиной 1–2 мм, вырубленных из отвержденного ЭО или аддукта ЭО с ОГМГ. Поверхность таблетки покрывали каплей объемом 30 мкл плотной клеточной суспензии в питательной среде состава: пептон 5 г/л, дрожжевой экстракт 2.5 г/л, декстроза 1 г/л при рН 7.2, и выдерживали в течение недели, после чего в течение двух часов проводили МТТ тест [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Предварительные эксперименты показали, что промышленно выпускаемый гидрохлорид ОГМГ крайне плохо растворяется в эпоксидных олигомерах различной природы – как диановом, так и алифатическом. Для улучшения совместимости с ЭО из гидрохлорида ОГМГ была синтезирована и охарактеризована органическая соль – гидросалицилат. Спектры ЯМР 1Н и ЯМР 13С исходной и синтезированной соли представлены на рис. 1 и 2 соответственно. На спектре ЯМР 1Н гидрохлорида ОГМГ (рис. 1а) (300 МГц, D2О) видны следующие пики δ, м.д.: 1.33 (4Н, уш.с, СН2 – I); 1.55 (4Н, уш.с, СН2 – II); 2.95 (т, СН2 – III – концевой); 3.23 (4Н, уш.с, СН2 – III). NH–протоны гуанидиниевой группы не разрешены от остаточных протонов Н2О. На спектре ЯМР 1Н гидросалицилата ОГМГ (рис. 1б) (300 МГц, ДМСО-d6) наблюдаются пики δ, м.д., J, Гц : 1.30 (4Н, уш.с, СН2 – I); 1.47 (4Н, уш.с, СН2 – II); 3.11 (4Н, уш.с, СН2 – III); 3.11 (4Н, уш.с, СН2 – III); 6.66 (2Н, м, Аr 3,5); 7.19 (1Н, м, Аr 4, J3 = 8.6); 7.30–7.75(4Н, м, Аr 6 + NH); 8.00–8.50 (2Н, м, ОН + NH). По соотношению интегральных интенсивностей разрешенных сигналов алифатических (1.30 и 1.47 м.д., 8Н) к ароматическим (6.66 и 7.19 м.д., 3Н) рассчитана степень замещения гидрохлорида на гидросалицилат в ОГМГ, которая составляет не менее 95.7%.
Рис. 1.
Спектры ЯМР1Н промышленно выпускаемого гидрохлорида (а) и синтезированного из него гидросалицилата ОГМГ(б).
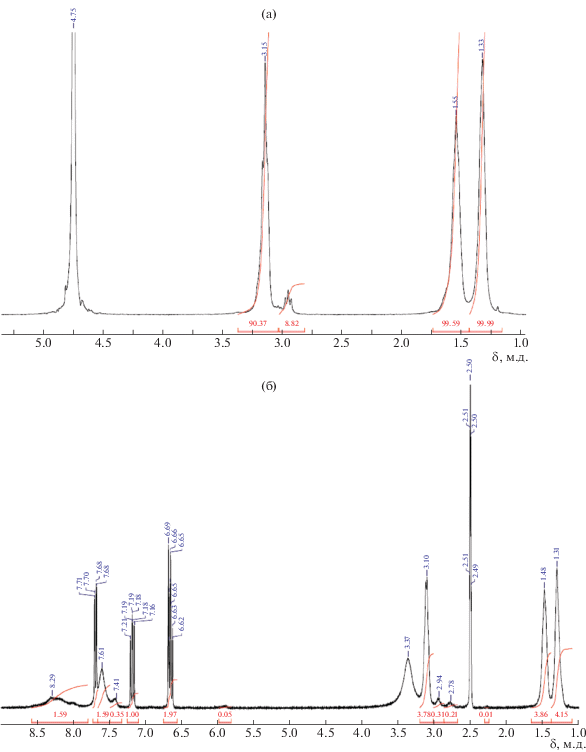
Рис. 2.
Спектры ЯМР13С промышленно выпускаемого гидрохлорида (а) и синтезированного из него гидросалицилата ОГМГ(б).
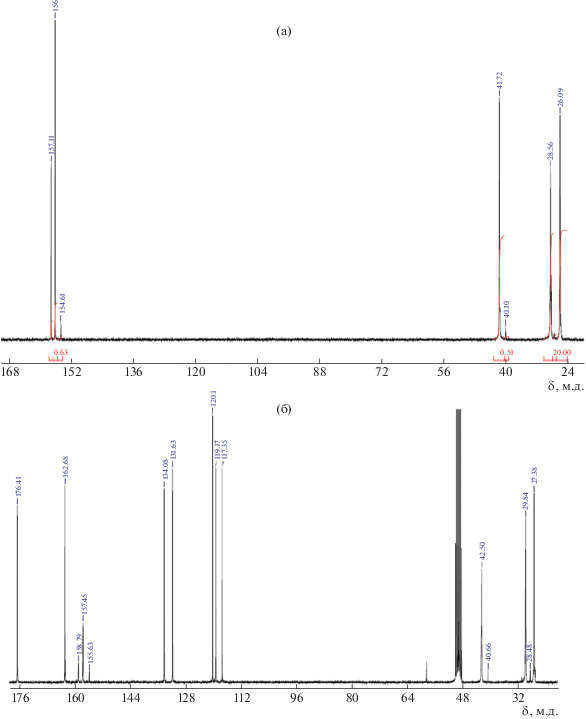
На спектре ЯМР 13С исходного гидрохлорида ОГМГ (рис. 2а) (70 МГц, D2О) зарегистрированы следующие пики δ, м.д.: 26.09 (2С, СН2 – I); 27.13 (СН2 – II'); 28. 56 (2С,СН2 – II); 40.10 (СН2 – III'); 41.72 (2С, СН2 – III); 154.61, 156.08, 157.11 (1С, гуанидин, IV'', IV', IV). На спектре ЯМР 13С синтезированного гидросалицилата ОГМГ (рис. 2б) (70 МГц, метанол-d4) наблюдаются пики δ, м.д.: 27.38 (2С, СН2 – I); 28.48 (СН2 – II'); 29. 84 (2С,СН2 – II); 40.66 (СН2 – III'); 42.50 (2С, СН2 – III); 117.35 (1С, Аr 4); 119.17 (1С, Аr 5); 120.11 (1С, Аr 3); 131.63 (1С, Аr 6); 134.08 (1С, Аr 1); 155.63, 157.45, 158,79 (1С, гуанидин, IV'', IV', IV); 162.68 (1С, Аr 2); 176.41 (1С, АrСООН). По соотношению интегральных интенсивностей сигналов алифатических (27.38–42.50 м.д., 6С) к ароматическим (117.35–176.41 м.д., 7С) рассчитана степень замещения на гидросалицилат в ОГМГ, которая составляет не менее 97.4%. Таким образом, значения степени замещения гидрохлорида на гидросалицилат, найденные методами ЯМР 1Н и ЯМР 13С, согласуются друг с другом.
По методике [15], разработанной ранее с участием авторов настоящей статьи, для исходной и синтезированной солей ОГМГ на основании данных спектров ЯМР 13С рассчитаны среднечисленная молекулярная масса Mn, содержание концевых гуанидиновых [гуан]конц и гексаметилендиаминовых [ГМДА]конц остатков, а также среднее число разветвлений на молекулу ОГМГ z. Результаты расчетов представлены в табл. 2.
Таблица 2.
Молекулярно-массовые характеристики образцов солей ОГМГ
| ОГМГ | Mn | [гуан]конц., мас.% | [ГМДА]конц., мас.% | z, экв/моль |
|---|---|---|---|---|
| Гидрохлорид ОГМГ | 951 | 1.90 | 0.57 | 0.47 |
| Гидросалицилат ОГМГ | 1298 | 2.14 | 0.35 | 0.49 |
Обращает на себя внимание некоторое увеличение средней молекулярной массы ОГМГ после получения гидросалицилата из гидрохлорида. Однако, судя по приведенным спектрам ЯМР (рис. 1 и 2), такой эффект не затрагивает основную цепь ОГМГ, а является следствием потери низкомолекулярных фракций ОГМГ в процессе синтеза и очистки новых солей ОГМГ.
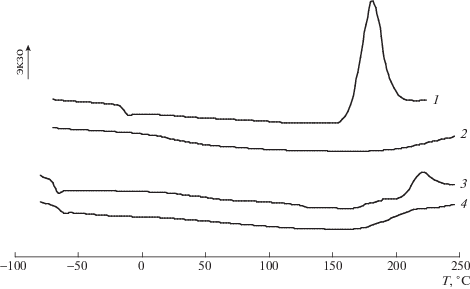
Для успешного ковалентного включения в эпоксиаминную сетку соль ОГМГ должна химически взаимодействовать с ЭО либо отвердителем. На термограммах ДСК бинарных систем ЭО–гидросалицилат ОГМГ (рис. 3) в области температур Т ≥ 150°С регистрируется экзотермический пик, очевидно, соответствующий выделению тепла вследствие реакции между ЭО и ОГМГ. Температура начала этого пика заметно ниже, чем аналогичная температура для системы Epikote 82 – гидрохлорид ОГМГ, которая, согласно работе [11], превышает 200°С. Следует отметить, для системы Epikote 828–гидросалицилат ОГМГ температура начала экзотермического пика заметно ниже, а его площадь значительно выше, чем для системы Лапроксид 703–гидросалицилат ОГМГ (рис. 3). Кроме того, характерная область стеклования, расположенная в низкотемпературной области, в случае Epikote 828 значительнее смещается в зону высоких температур по сравнению с Лапроксидом. Описанное выше указывает на более выраженное химическое взаимодействие в системе Epikote 828 – гидросалицилат ОГМГ.
Рис. 3.
Термограммы ДСК смесей гидросалицилата ОГМГ с ЭО Epikote 828 (1, 2) и Лапроксидом 703 (3, 4) после первого (1, 3) и второго (2, 4 ) сканирования по температуре.
Температура начала реакции между ОГМГ и ЭО заметно выше, чем в случае ЭО и аминных отвердителей (около 50°С). Таким образом, при совместном отверждении тройных систем ЭО–ОГМГ–алифатический амин включение фрагментов ОГМГ в общую сетку маловероятно. Избежать этого можно путем предварительного проведения реакции между ОГМГ и ЭО, с последующим отверждением полученной системы аминным отвердителем.
Химическая реакция между ЭО и ОГМГ, вероятно, протекает прежде всего с участием эпоксидных групп ЭО и первичных аминогрупп ОГМГ по схеме
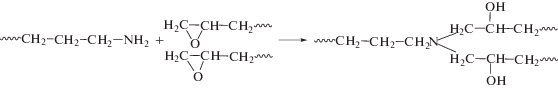
В результате реакции образуются аддукты ЭО и ОГМГ, причем, судя по единственной температуре стеклования Tg продуктов взаимодействия (рис. 3, кривые 2 и 4), полученные системы являются гомогенными. Tg аддуктов выше, чем исходных ЭО: 27.8°С против –18°С в случае Epikote 828 и примерно –65.8°С против –71°С для Лапроксида 703. Очевидно, это обусловлено повышением молекулярной массы продукта. Отсутствие дальнейших химических превращений в аддуктах, фиксируемое при повторном ДСК-исследовании позволяет рассматривать их как химически стабильные модифицирующие добавки для эпоксиаминных композиций широкого применения.
Обобщение результатов ДСК показало, что наиболее выраженный экзотермический эффект наблюдается в случае системы гидросалицилат ОГМГ–ЭО Epikote 828, на которой и были проведены дальнейшие эксперименты.
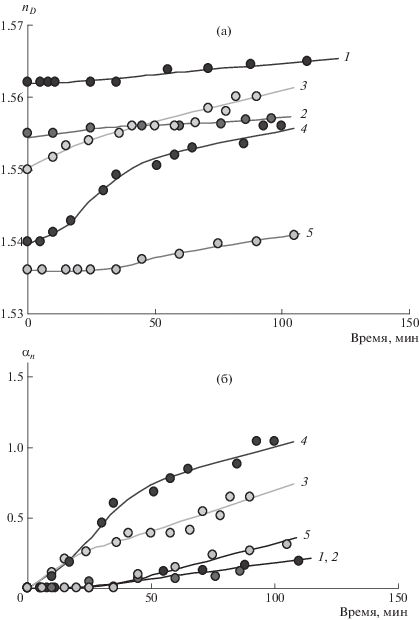
Несмотря на то, что гидросалицилат лучше растворим в ЭО, чем другие исследованные соли ОГМГ, его растворимость все-таки недостаточна для того, чтобы сформировать гомогенную систему с достаточно высоким содержанием ОГМГ (более 5 мас. %). В связи с этим было принято решение проводить совмещение гидросалицилата ОГМГ и ЭО в общем растворителе. Оба олигомера хорошо растворимы в ДМСО, и при их смешении не происходит визуально наблюдаемого разделения фаз. При небольшом нагревании (35°С) была исследована кинетика взаимодействия ОГМГ с ЭО в растворе методом рефрактометрии и установлено, что по мере протекания процесса показатель преломления системы монотонно повышается (рис. 4). Для сравнительного анализа кинетики удобен относительный показатель αn = = $\frac{{{{n}_{D}} - {{n}_{{{{D}_{0}}}}}}}{{{{n}_{{{{D}_{0}}}}}}} \cdot 100\% $. Из зависимостей (рис. 4б) следует, что более выраженный эффект химического взаимодействия наблюдается при эквимассовом соотношении реагентов.
Рис. 4.
Кинетические зависимости показателя преломления (a) и относительного показателя αn (б) системы гидросалицилат ОГМГ–диановый ЭО Epikote 828 в диметилсульфоксиде при 35°С. Мольное соотношение ОГМГ : ЭО = = 1.00 : 0.22 (1), 1.00 : 0.67 (2), 1.00 : 0.83 (3), 1.00 : 1.00 (4) и 1.00 : 1.33 мас. ч. (5).
Итоговый продукт представляет собой гомогенный прозрачный раствор. Для оценки оптимального содержания отвердителя, необходимого для полного отверждения этой системы, мы использовали методику авторов [16], заключающуюся в определении соотношения аддукт : : отвердитель, которому соответствует максимальный тепловой эффект отверждения на термограмме ДСК. Типичные термограммы ДСК различного состава аддукт : отвердитель представлены на рис. 5, а данные по тепловому эффекту отверждения и Tg полностью отвержденной системы – в табл. 3.
Рис. 5.
Типичные термограммы ДСК смеси аддукта (салицилат ОГМГ : Epikote 828 = 1 : 1 мас.ч.) и отвердителя Jeffamine D-230 в соотношении 1.00 : 0.13 мас. ч. после первого (1) и второго (2) сканирования по температуре.
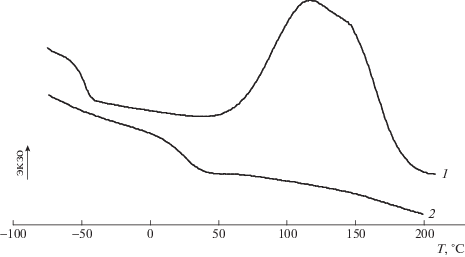
Таблица 3.
Термохимические характеристики отверждения аддукта (салицилат ОГМГ: Epikote 828 = = 1: 1 мас.ч.) отвердителем Jeffamine D-230
| Аддукт: Jeffamine D-230, мас.ч. | Исходная система | Отвержден-ная система Tg∞, °C | |
|---|---|---|---|
| Tg0, °C | ΔН, кДж | ||
| 1.0 : 0.08 | –47.1 | 261.6 | 20.4 |
| 1.0 : 0.13 | –48.1 | 269.6 | 24.7 |
| 1.0 : 0.20 | –45.8 | 258.4 | 24.2 |
| 1.0 : 0.33 | –51.5 | 253.9 | 11.2 |
| 1.0 : 0.43 | –52.2 | 250.0 | 10.8 |
Из приведенных данных видно, что оптимальное соотношение аддукт (салицилат ОГМГ : : Epikote 828 = 1: 1 мас.ч.): Jeffamine D-230 = 1.00 : : 0.13 мас.ч. Такое соотношение было использовано как базовое при получении отвержденных эпоксиаминных пленок, модифицированных ОГМГ. Температура стеклования модифицированных эпоксиаминных пленок ниже или близка к комнатной температуре. Это означает, что модифицированные эпоксиаминные системы при естественных условиях находятся в эластическом состоянии и не требуют термического доотверждения для достижения топологического предела реакции отверждения.
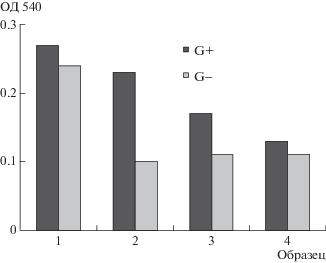
На основании полученных результатов были сформированы и отверждены свободные эпоксиаминные пленки, ковалентно модифицированные ОГМГ. Они представляют собой оптически прозрачные практически бесцветные эластичные пленки. Для проверки возможности их использования в качестве основы бактерицидных покрытий была исследована их активность по отношению к грамположительным (Paenibacillus jamilae) и грамотрицательным (Pseudomonas. putida К12) микроорганизмам. Выбор штаммов был обусловлен предполагаемой областью применения покрытия. Так, штамм Pseudomonas putida К12 был выбран как близкий к виду Pseudomonas aeruginosa (синегнойная палочка) – наиболее часто встречающемуся в медучреждениях и резистентному к антибиотикам патогенному организму, вызывающему нозокомиальные инфекции, инфекции кожи и верхних дыхательных путей человека [17]. Paenibacillus jamilae – микроорганизмы с высокой способностью образовывать бактериальные биопленки, также обладающие устойчивостью к антибиотикам, способные вызывать загноения ран и внутренние воспаления [18]. Исследования биологической активности модифицированных пленок показали (рис. 6), что модифицированные эпоксиаминные составы действуют и на грамположительные и на грамотрицательные микроорганизмы, причем с увеличением концентрации модификатора эффект усиливается. При этом полимер без аддукта (образец 1) не вызывает снижения бактериальной дыхательной активности, оцененной по оптической плотности на длине волны 540 нм. В целом грамположительные бактерии оказались более устойчивыми к воздействию добавок ОГМГ, причем наибольший эффект для них проявляется в случае образца 4. При воздействии на грамотрицательные бактерии дыхательная активность снижается в среднем в 2.5–3.0 раза. Следует, однако, отметить, что полной остановки дыхания в изученных образцах зафиксировано не было. Различие в поведении грамположительных и грамотрицательных микроорганизмов в присутствии исследуемых образцов, по-видимому, связано с отличиями в составе и структуре их клеточных стенок. Иными словами, проведенные исследования показывают перспективность ковалентной модификации эпоксиаминных систем гидросалицилатом ОГМГ для получения составов для бактерицидных покрытий.
ЗАКЛЮЧЕНИЕ
Таким образом, одним из способов направленного ковалентного включения олигогексаметилендиаминов в эпоксиаминную трехмерную сетку может быть предварительное получение аддуктов органической соли ОГМГ (гидросалицилата) с эпоксидным олигомером в растворе с последующим отверждением этих аддуктов стехиометрическим количеством аминного отвердителя. Количественно охарактеризована кинетика химического взаимодействия между гидросалицилатом ОГМГ и диановым ЭО, выбран оптимальный состав тройной системы гидросалицилат ОГМГ–ЭО–аминный отвердитель для получения модифицированной пленки и показана ее активность по отношению к грамположительным и грамотрицательным микроорганизмам.
Авторы выражают благодарность Е.О. Косакович (РТУ МИРЭА) за содействие в постановке экспериментов.
Часть экспериментальной работы была выполнена с использованием оборудования Центра коллективного пользования физическими методами исследования Института физической химии и электрохимии им. А.Н. Фрумкина РАН.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект 18-08-01252А).
Список литературы
Зайцев Ю.С., Кочергин Ю.С., Пактер М.К., Кучер Р.В. Эпоксидные олигомеры и клеевые композиции. Киев: Наукова думка, 1990.
Petrie E.M. Epoxy Adhesive Formulations. New York: McGraw-Hill, 2006.
Epoxy polymers. New Materials and Innovations / Ed. by J.-P. Pascault, R.J.J. Williams. Weinheim: Wiley-VCH, 2010.
Micro and Nanostructured Epoxy/ Rubber Blends/ Ed. by Th. Sabu, Ch. Sinturel, Th. Raju. Weinheim: Wiley-VCH, 2014.
Кочнова З.А., Жаворонок Е.С., Чалых А.Е. Эпоксидные смолы и отвердители: промышленные продукты. М.: ООО “Пэйнт-Медиа”, 2006.
Дергунова А.В. Дис. … канд. техн. наук. Иваново: Ивановский государственный архитектурно-строительный университет, 2011.
Смирнов И.В. Дис. … канд. техн. наук. Саранск: Российский университет транспорта (МИИТ), 2017.
Воинцева И.И., Гембицкий П.А. Полигуанидины – дезинфекционные средства и полифункциональные добавки в композиционные материалы. М.: ЛКМ-Пресс, 2009.
Стельмах С.А. Дис. … канд. хим. наук. Иркутск: Иркутский гос. ун-т, 2012.
Светлов Д.А. Дис. … канд. техн. наук. Пенза: Пензенский гос. ун-т архитектуры и строительства, 2008.
Сенчихин И.Н., Жаворонок Е.С., Матвеев А.В., Урюпина О.Я., Ролдугин В.И. // Коллоид. журн. 2018. Т. 80. С. 324.
Чупак-Белоусов В.В. Фармацевтическая химия. Книга первая. М.: БИНОМ, 2012.
Vlot A.C., Dempsey D.A., Klessig D.F. Salicylic Acid, a Multifaceted Hormone to Combat Disease // Annu. Rev. Phytopathol. 2009. V. 47. P. 177.
Zhavoronok E.S., Senchikhin I.N. // Polymer Science B. 2019. V. 61. № 4. P. 452.
Cory A.H., Owen T.C., Barltrop J.A., Cory J.G. // Cancer Commun. 1991. V. 3. P. 207.
Кедик С.А., Бочарова О.А., Ха Кам Ань, Панов А.В., Седишев И.П., Жаворонок Е.С., Тимофеева Г.И., Суслов В.В., Бексаев С.Г. // Хим.-фармацевт. журн. 2010. Т. 44. № 10. С. 40.
Garcia F.G., da Silva P.M., Soares B.G., Briones J.R. // Polymer Testing. 2007. V. 26. P. 95.
Сидоренко С.В., Резван С.П., Стерхова Г.А., Грудинина С.А. // Антибиотики и химиотерапия. 1999. № 3. С. 25.
Saez-Nieto J.A., Medina-Pascual M.J., Carrasco G., Garrido N., Fernandez-Torres M.A., Villalon P., Valdezate S. // New Microbes and New Infections. 2017. V. 19. P. 19.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)