Высокомолекулярные соединения (серия А), 2019, T. 61, № 6, стр. 491-502
Реологические свойства комплексов полиакриловой кислоты с полистиролсульфонатом натрия в полуразбавленных водных растворах
Е. А. Литманович a, *, В. В. Ефремов a
a Московский государственный университет имени М.В. Ломоносова. Химический факультет
119899 Москва, Ленинские горы, Россия
* E-mail: elitmanovich@yandex.ru
Поступила в редакцию 06.05.2019
После доработки 13.06.2019
Принята к публикации 03.07.2019
Аннотация
Методами потенциометрии, вискозиметрии и ротационной реометрии исследованы растворы смесей полиакриловой кислоты с полистиролсульфонатом натрия в воде и в децимолярной соляной кислоте. Установлено, что в широком интервале составов смесей образуются термочувствительные полиэлектролитные комплексы за счет ион-дипольных взаимодействий функциональных групп полимеров. Формирование комплексов в режиме полуразбавленных растворов сопровождается существенным ростом вязкости по сравнению с растворами исходных полимеров, что позволяет получать системы с высокой вязкостью без использования больших концентраций полиэлектролитов. Зависимость вязкости от состава смеси проходит через максимум, соответствующий наиболее полному связыванию компонентов комплекса, причем положение максимума не зависит от молекулярной массы полистиролсульфоната натрия и определяется соотношением концентраций функциональных групп полимеров. Частотные зависимости модуля упругости и модуля потерь показали сильное структурирование системы в процессе комплексообразования.
ВВЕДЕНИЕ
В настоящее время термочувствительные водорастворимые полимеры вызывают большой интерес в связи с перспективой применения их в качестве “умных” полимерных материалов, реологические свойства которых можно регулировать, изменяя не только концентрацию раствора, но и температуру. Использование полиэлектролитов в этих целях, однако, ограниченно, что вызвано двумя основными причинами. Во-первых, вязкость полуразбавленных бессолевых водных растворов полиэлектролитов значительно ниже вязкости растворов неионогенных полимеров соответствующих концентраций. Во-вторых, для заряженных макромолекул вода является хорошим растворителем в широком интервале температур, поэтому получить термочувствительные системы на основе полиэлектролитов крайне сложно. Решить обе указанные проблемы можно, используя водорастворимые полиэлектролитные комплексы (ПЭК).
Как известно [1–4], в растворах полиэлектролитов выделяют четыре концентрационных режима: разбавленный, полуразбавленный без зацеплений, полуразбавленный с зацеплениями и концентрированный. Концентрированные растворы по свойствам ближе к твердым полимерам, пластифицированным растворителем, поэтому основное внимание как в теоретических, так и в экспериментальных исследованиях уделяется первым трем режимам. Переход из разбавленного в полуразбавленный режим (кроссовер) происходит в условиях, при которых весь объем раствора заполняется полимерными клубками, т.е., когда средняя концентрация мономерных звеньев в растворе становится равной концентрации звеньев внутри клубка [5]. Приблизительно оценить концентрацию кроссовера С* можно по величине обратной характеристической вязкости [6]: С* ≈ ≈ 1/[η]. В области кроссовера изменяется механизм теплового движения макромолекул: если при C < C* реализуется трансляционная диффузия изолированных полимерных клубков, то при C > C* появляются кооперативные моды диффузии [7–12], что также позволяет экспериментально определить С*. Однако механизм течения раствора при C > C* остается трансляционным. В этом состоит существенное отличие растворов полиэлектролитов от растворов неионогенных полимеров: в последнем случае в области С* начинается взаимопроникновение полимерных клубков и формирование сетки зацеплений, причем механизм течения раствора меняется с трансляционного на рептационный, а вязкость значительно возрастает [13, 14]. Для формирования сетки зацеплений в растворах полиэлектролитов необходимо экранирование электростатических взаимодействий одноименно заряженных цепей, и концентрация образования сетки зацеплений (Се) в бессолевых растворах может превышать С* на один–два порядка [3, 4]. В присутствии низкомолекулярных солей экранирование происходит не только за счет собственных противоионов полиэлектролита, но и за счет ионов соли, в результате различие между С* и Се уменьшается. Экспериментально Се определяют по изменению показателя степени в зависимости вязкости от концентрации [3, 4, 15].
Концентрационный режим раствора существенно влияет на реакции полиэлектролитов с противоположно заряженными объектами: макромолекулами [16, 17], коллоидными частицами [18], мицеллами ПАВ [19–21]. Продукты таких реакций (ПЭК) в разбавленных растворах, как правило, представляют собой изолированные частицы характеристического состава. В то время как свойства ПЭК в разбавленных растворах подробно изучены на примере огромного количества разнообразных систем (см., например, обзор [22]), образованию комплексов в полуразбавленных растворах посвящено значительно меньшее количество публикаций. В частности, установлено [17, 21], что комплексообразование в этом концентрационном режиме может приводить к формированию двойной сетки, которая содержит как узлы зацеплений, так и межцепные связи. Такое структурирование существенно расширяет возможности практического применения полиэлектролитов, поскольку позволяет получить полиэлектролитные системы с высокой и легко регулируемой вязкостью.
Как правило, ПЭК формируются за счет образования системы солевых связей между противоположно заряженными функциональными группами. Однако, если полиэлектролит неионизован, возможно образование ПЭК за счет других, более слабых типов взаимодействий. Эти ПЭК представляют особый интерес, так как слабые взаимодействия легко и обратимо разрушаются при изменении температуры, что дает перспективу получения термочувствительных полиэлектролитных систем. Например, хорошо известны комплексы полиакриловой (ПАК) и полиметакриловой кислот с полиэтиленгликолем, построенные на водородных связях и гидрофобных взаимодействиях [23]. Кроме того, обнаружены комплексы ПАК как с поликатионами [24, 25], так и с полианионами [12, 26, 27], образующиеся за счет ион-дипольных взаимодействий неионизованных карбоксильных групп с заряженными функциональными группами полиэлектролитов. В настоящей работе мы поставили цель исследовать влияние комплексообразования на реологические свойства полуразбавленных растворов смесей ПАК с полистиролсульфонатом натрия (ПСС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
ПАК получали гидролизом поли-трет-бутил-акрилата, синтезированного методом псевдоживой радикальной полимеризации по механизму обратимой передачи цепи [24], Мw = 120.5 × 103, Ð = 1.3.
Два образца ПСС фирмы “Scientific Polymer Products” (США) очищали от низкомолекулярных примесей с помощью диализа, затем лиофильно сушили, Мw = 20.4 × 103, (ПСС-1) и Мw = = 9.6 × 105 (ПСС-2).
Децимолярные HCl и NaOH приготавливали из фиксаналов “Testal” (Германия).
Исходные водные и солянокислые растворы ПАК и ПСС готовили растворением полимеров в воде или 0.1 M HCl соответственно при перемешивании в течение 48 ч. Концентрацию ПАК определяли методом потенциометрического титрования в смеси вода–ацетон (50 : 50 об. %). Концентрацию ПСС находили спектрофотометрически при длине волны 262 нм, коэффициент экстинкции ε = 383 л/(моль см) [15].
Смеси ПАК–ПСС готовили из исходных растворов одинаковой массовой концентрации, взятых в различных соотношениях. Состав смесей характеризовали мольной долей звеньев ПАК (Z = νПАК/(νПСС + νПАК), где νПАК и νПСС – молярные концентрации звеньев ПАК и ПСС соответственно.
Потенциометрическое титрование
Потенциометрические измерения проводили с использованием рН-метра “рН 211” производства “Hanna Instruments” (Германия) с комбинированным стеклянным электродом и термокомпенсацией. Прибор калибровали по стандартным буферным растворам с рН 7.01 и 4.01. Постоянное значение рН устанавливалось в течение 2–4 мин (погрешность ±0.02 ед. рН). Все измерения проводили при температуре 25°С. Степень ионизации ПАК α рассчитывали как
(в квадратных скобках указана молярная концентрация функциональных групп).Капиллярная вискозиметрия
Относительную вязкость растворов ηrel определяли в капиллярных вискозиметрах Уббелоде с подвешенным мениском (времена истечения растворителя 18.9 с и 74.5 с при 25°С). Для исследования полуразбавленных растворов использовали вискозиметр с меньшим временем истечения, для разбавленных – с большим. В переходной области концентраций использовали оба вискозиметра для проверки корректности результатов. Перед измерением образцы термостатировали в течение 15 мин, температуру в ячейке поддерживали с точностью ±0.2°С. Приведенную вязкость ηred рассчитывали по формуле ηred = = $\frac{{{{\eta }_{{rel}}} - 1}}{C}$, где С – концентрация раствора (г/дл).
Ротационная вискозиметрия
Динамическую вязкость определяли на ротационном вискозиметре “Rheotest 2.1” (Германия) с рабочим узлом типа цилиндр–цилиндр в режиме постоянных скоростей сдвига. Перед измерением все образцы термостатировали в течение 15 мин, температуру в термостатирующей ячейке поддерживали с точностью ±0.2°С.
Температурные зависимости наибольшей ньютоновской вязкости анализировали по уравнению Аррениуса–Френкеля–Эйринга в логарифмической форме:
где А = 10–4 Па с – предэкспоненциальный множитель, имеющий физический смысл вязкости, отвечающей тепловому колебанию атомов, ΔS и ΔH – энтропия и энтальпия активации вязкого течения соответственно [28].Ротационная реометрия
Частотные зависимости модуля упругости и модуля потерь определяли на ротационном реометре “RheoStress 600”, в ячейке плоскость–плоскость с диаметром плоскостей 35 мм и зазором 0.1 мм при температуре 25°С. Измерения проводили в режиме, при котором прибор задает деформацию при постоянной амплитуде 0.002 мм и регистрирует напряжение сдвига в частотном диапазоне 0.01–100 Гц. Модули рассчитывали в программе Rheo Win Data Manager.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение границ концентрационных режимов
Для определения С* и Сe в растворах исходных полиэлектролитов и их смесей различного состава использовали метод капиллярной вискозиметрии. Растворы полимеров и их смесей готовили в 0.1 М HCl. В этих условиях карбоксильные группы ПАК не ионизуются, и она ведет себя как незаряженный полимер, а в растворах ПСС подавляется эффект полиэлектролитного набухания. На рис. 1 представлены зависимости удельной вязкости ηуд от концентрации в логарифмических координатах для растворов ПСС-1 и ПАК, ПСС-2, а также для смесей ПСС-2–ПАК разного состава.
Рис. 1.
Зависимости логарифма удельной вязкости от логарифма концентрации для ПСС-1 (1) и ПАК (2) (а); ПСС-2 (б); смесей ПСС-2–ПАК состава Z = 0.42 (1), 0.66 (2) и 0.81 (3) (в); г –начальные участки зависимостей для ПСС-1 (1) и смесей состава Z = 0.42 (2), 0.66 (3) и 0.81 (4). T = 25°C.
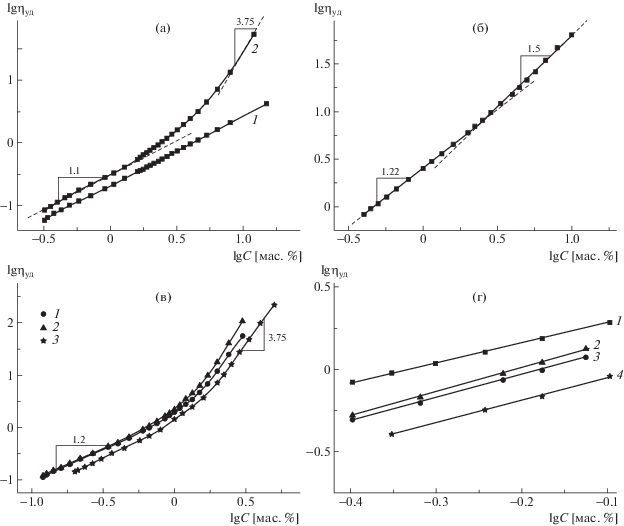
Полученные результаты анализировали с помощью скейлинговой модели растворов полиэлектролитов [1, 3, 15, 29]. Для всех исследуемых растворов в области низких концентраций ηуд ∝ ∝ С1.1–1.22. Согласно скейлинговой модели, это соответствует разбавленному высокосолевому режиму (динамическая вязкость η ∝ С1) [1, 15]. По отклонению от линейной зависимости можно определить концентрацию кроссовера С*. Концентрации образования сетки зацеплений Се определяли по выходу зависимостей на второй линейный участок, результаты представлены в табл. 1. Поскольку зависимость для короткоцепного ПСС-1 линейна во всем исследованном интервале концентраций, в табл. 1 приведено значение С*, полученное методом светорассеяния [12]. Оценочное определение по величине обратной характеристической вязкости дало очевидно завышенный результат (4.3%).
Таблица 1.
Границы концентрационных режимов для растворов ПАК, ПСС и их смесей в 0.1 М HCl
| Система содержит ПСС-1 | Система содержит ПСС-2 | ||||
|---|---|---|---|---|---|
| Z | C*, мас. % | Cе, мас. % | Z | C*, мас. % | Cе, мас. % |
| 1.0 (ПАК) | 1.6 | 8.0 | 1 (ПАК) | 1.6 | 8.0 |
| 0.95 | 1.9 | 4.6 | 0.92 | 1.0 | 1.8 |
| 0.83 | 1.6 | 3.2 | 0.81 | 1.0 | 2.0 |
| 0.74 | 1.6 | 4.0 | 0.74 | 0.48 | 1.5 |
| 0.63 | 1.6 | 3.6 | 0.66 | 0.6 | 1.5 |
| 0.50 | 1.8 | 3.6 | 0.42 | 0.6 | 1.5 |
| 0 (ПСС-1) | 1.0 | – | 0 (ПСС-2) | 2.0 | 2.9 |
В области высоких концентраций ηуд ∝ С 3.75для ПАК и всех растворов смесей ПАК–ПСС, что соответствует полуразбавленному зацепленному режиму как для незаряженных полимеров (ПАК), так и для полиэлектролитов при высоком содержании низкомолекулярного электролита [1, 29]. В случае ПСС-2 (рис. 1б) при концентрации выше 3% ηуд ∝ С1.5, что соответствует полуразбавленному зацепленному низкосолевому режиму [1, 15]. Поскольку исследование проводилось при фиксированной концентрации низкомолекулярного электролита (0.1 М HCl), по мере увеличения концентрации раствор ПСС-2 переходит из незацепленного высокосолевого в зацепленный низкосолевой режим.
Для короткоцепного ПСС-1 (рис. 1а) зависимость линейна во всем диапазоне концентраций. Это означает, что ПСС-1 не образует сетку зацеплений, что связано, вероятно, со слишком малой длиной цепи (порядка 100 звеньев). Переход из разбавленного в полуразбавленный зацепленный режим, который сопровождается изменением механизма течения, происходит, когда каждая полимерная цепь образует от 5 до 10 узлов зацеплений с соседними цепями [30, 31]. Это условие трудно реализовать для короткоцепных полимеров.
Значения С* и Сe для смесей ПАК–ПСС в пределах ошибки не зависят от соотношения компонентов и составляют С* = 1.7 ± 0.1, Сe = 3.8 ± ± 0.5 мас. % для систем, содержащих ПСС-1, и С* = 0.7 ± 0.2, Сe = 1.7 ± 0.2 мас. % для систем, содержащих ПСС-2. Важно отметить, что концентрации, при которых начинается структурирование раствора смесей, существенно ниже, чем концентрация образования сетки зацеплений в растворе ПАК (8%). Это означает, что в растворах смесей сетка формируется не только за счет образования зацеплений, но и вследствие межцепных взаимодействий ПАК–ПСС.
Приведенные результаты показывают, что при концентрации выше 2% все исследуемые системы находятся в полуразбавленном концентрационном режиме. Таким образом, исследование свойств смесей ПАК–ПСС в разбавленных растворах мы проводили при концентрации порядка 0.1%, а структурообразование в растворах смесей изучали в интервале концентраций 2–15%, который включает как полуразбавленный незацепленный режим, так и область полуразбавленных растворов с зацеплениями.
Потенциометрия разбавленных растворов
Поскольку в ион-дипольных взаимодействиях могут участвовать только неионизованные функциональные группы ПАК, образование комплекса с ПСС должно сдвигать равновесие в реакции диссоциации карбоксильных групп. На рис. 2 представлены результаты потенциометрического титрования 40 мл раствора ПАК раствором ПСС-2 (кривая 1). Для сравнения там же приведены данные, полученные при разбавлении исходного раствора водой (кривая 2).
Рис. 2.
Зависимость рН раствора ПАК от объема добавленного титранта при титровании раствором ПСС-1 (1) и при добавлении воды (2). СПАК = 0.02 осново-моль/л (0.144%), T = 25°C.
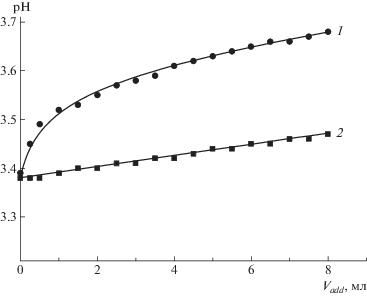
При разбавлении раствора ПАК водой pH незначительно увеличивается, что связано с уменьшением концентрации карбоксильных групп. При этом степень ионизации ПАК практически не меняется. В то же время pH системы при титровании водным раствором ПСС заметно растет. Степень ионизации карбоксильных групп ПАК уменьшается в ходе титрования (рис. 3).
Рис. 3.
Зависимость степени ионизации ПАК α от состава смеси Z при титровании раствором ПСС-1. СПАК = 0.02 осново-моль/л (0.144%), T = 25°C.
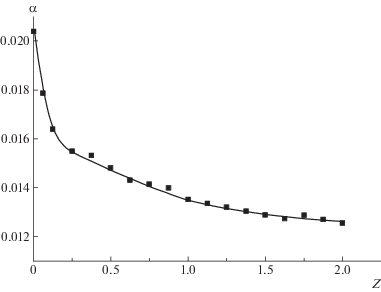
Следует отметить, что аналогичный эксперимент был проведен в работе [27] при суммарной концентрации полимеров 4%, т.е. в режиме полуразбавленных растворов. Было обнаружено понижение рН смеси по сравнению с растворами исходных компонентов. Авторы связывают полученный результат с проникновением цепей ПСС в сетку зацеплений ПАК, в результате чего полиэлектролит способствует диссоциации карбоксильных групп так же, как добавки низкомолекулярных солей. В нашем эксперименте концентрация ПАК (0.144%) ниже С*, в этих условиях образования сетки зацеплений не происходит. Полученные нами результаты свидетельствуют о том, что в разбавленных растворах неионизованные карбоксильные группы ПАК участвуют во взаимодействиях с заряженными группами ПСС. В такой системе могут быть реализованы либо межцепные водородные связи, либо ион-дипольные взаимодействия. Поскольку в работе [27] методом ИК-фурье-спектроскопии было показано, что доля водородных связей в системе ПАК–ПСС существенно меньше, чем в отсутствие ПСС, следовательно, основной вклад в комплексообразование вносят именно ион-дипольные взаимодействия.
Данные, представленные на рис. 3, свидетельствуют о том, что даже в двукратном избытке ПСС часть карбоксильных групп ПАК остается в ионизованном состоянии. Степень ионизации α = 0.0125 при степени полимеризации 1680 соответствует примерно 20 зарядам на одну полимерную цепь. Электростатическое отталкивание одноименно заряженных цепей ПАК и ПСС может уменьшать долю групп, связанных ион-дипольными взаимодействиями. Исключить такой эффект можно, используя характерную для слабых полиэлектролитов зависимость степени диссоциации от рН. При введении в раствор сильных низкомолекулярных кислот ионизация карбоксильных групп ПАК полностью подавляется, поэтому часть последующих экспериментов была проведена в присутствии 0.1 М HCl.
Смеси ПАК–ПСС в полуразбавленных растворах
Вязкость смеси двух полимеров в общем растворителе можно описать, используя правило логарифмической аддитивности [32]. Зависимость логарифма вязкости от состава смеси линейна в отсутствие взаимодействия. В случае взаимодействия полимеров имеет место положительное отклонение от линейности, а в случае несовместимости – отрицательное.
На рис. 4 показаны зависимости логарифма динамической вязкости от состава для смесей ПАК–ПСС в 0.1 M HCl (степень ионизации ПАК α = 0), в воде (α = 0.01) и в условиях, соответствующих ионизации половины карбоксильных групп ПАК (степень ионизации α = 0.5 создавали добавлением рассчитанного количества NaOH). Для систем на рис. 4а наблюдается существенное положительное отклонение от аддитивности, которое свидетельствует о взаимодействии двух полимеров в системе. Максимальное связывание происходит в области составов смеси Z = 0.5–0.7. Важно отметить, что указанный интервал составов соответствует области максимального связывания компонентов в разбавленных растворах, как было установлено нами в работе [12] для системы ПАК–короткоцепной ПСС.
Рис. 4.
Зависимости логарифма вязкости от состава смеси. а: 1 –ПАК–ПСС-1–0.1 М HCl, C = 8%, α = 0; 2 – ПАК–ПСС-1–H2O, C = 8%, α = 0.01; 3 – ПАК–ПСС-2–0.1 М HCl, C = 2%, α = 0; б: ПАК–ПСС-1–H2O, С = 8%, α = 0.5. T = 25°C.
Зависимости для растворов в воде и в соляной кислоте в пределах ошибки совпадают, следовательно, остаточная ионизация ПАК практически не влияет на образование комплекса. В то же время при сильном заряжении ПАК электростатическое отталкивание приводит к тому, что комплекс ПАК–ПСС разрушается, при этом наблюдается небольшое отрицательное отклонение от линейности (рис. 4б). Увеличение молекулярной массы ПСС не изменяет положения максимума зависимости вязкости от состава (рис. 4а). Близкое расположение максимумов вязкости для систем, содержащих длинно- и короткоцепной ПСС, свидетельствует о том, что максимальное связывание достигается примерно при одном и том же соотношении концентраций сульфо- и карбоксильных групп вне зависимости от молекулярной массы ПСС. Этот факт дополнительно подтверждает, что в основе комплексообразования в системе ПАК–ПСС лежит именно взаимодействие функциональных групп. Значительный рост вязкости смесей по сравнению с вязкостью растворов исходных полимеров наблюдается в режиме полуразбавленных растворов, в разбавленных растворах такого эффекта нет (ср. начальные участки на рис. 1г). Следовательно, возрастание вязкости при комплексообразовании обусловлено различным строением сеток полуразбавленных растворов комплексов и исходных полиэлектролитов.
Реологические свойства полуразбавленных растворов смесей ПАК–ПСС
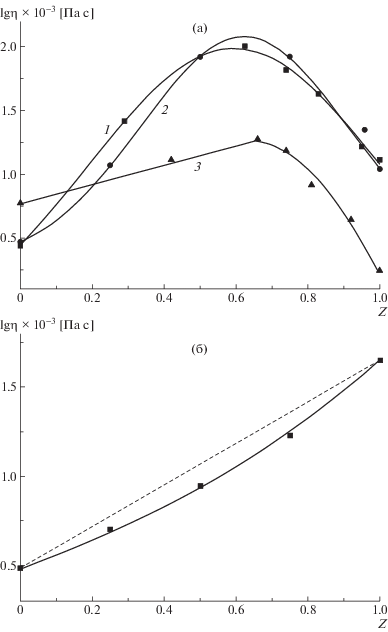
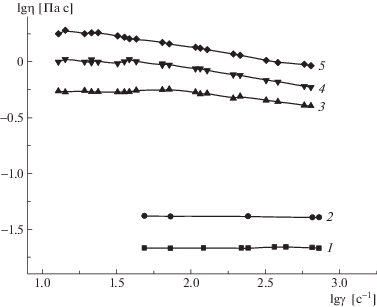
Влияние комплексообразования на свойства сеток, образующихся в полуразбавленных растворах, было исследовано методом ротационной вискозиметрии. На рис. 5 представлены кривые течения полуразбавленных водных растворов ПАК, ПСС-2 и их смесей. Видно, что динамическая вязкость растворов комплексов превосходит вязкость растворов индивидуальных полиэлектролитов более чем на порядок. Кроме того, растворы комплексов характеризуются аномально-вязкими свойствами: кривые течения при малых скоростях сдвига выходят на плато, соответствующее наибольшей ньютоновской вязкости. При больших скоростях вязкость уменьшается с ростом скорости сдвига, что вызвано разрушением структуры раствора под действием сдвигового напряжения.
Рис. 5.
Зависимость логарифма вязкости от логарифма скорости сдвига для водных растворов ПАК (1), ПСС-2 (2) и их смесей состава Z = 0.81 (3), 0.74 (4) и 0.66 (5). С = 5%, T = 25°C.
Исследование влияния температуры на реологические свойства полуразбавленных растворов смесей ПАК–ПСС дает возможность получить дополнительную информацию о структурировании системы в процессе комплексообразования.
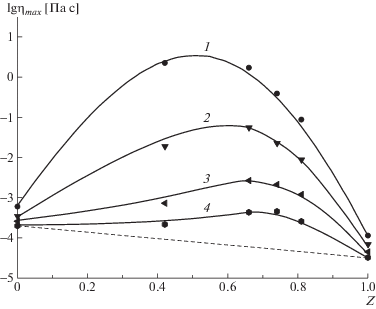
Поскольку комплекс стабилизирован слабыми ион-дипольными взаимодействиями, можно ожидать, что он будет обладать термочувствительностью. Это предположение подтверждают приведенные на рис. 6 данные по зависимости логарифма наибольшей ньютоновской вязкости от мольной доли звеньев ПАК, полученные при разной температуре. Так, если для растворов исходных полиэлектролитов наибольшая ньютоновская вязкость уменьшается в ~3 раза с повышением температуры от 30 до 60°С, то для раствора комплекса состава Z = 0.74 вязкость в том же температурном интервале понижается более чем на порядок. Приведенный факт указывает на то, что степень связывания с ростом температуры заметно уменьшается, т.е. равновесие в реакции между ПАК и ПСС сдвигается в сторону исходных полиэлектролитов. Это коренным образом отличает данную систему от комплексов, построенных на солевых связях, которые не проявляют термочувствительности.
Рис. 6.
Зависимость логарифма наибольшей ньютоновской вязкости от состава водных растворов смесей ПАК–ПСС-2 при Т = 30 (1), 40 (2), 50 (3) и 60°С (4). С = 5%.
В то же время представленные данные свидетельствуют о том, что даже при температуре 60°С вид зависимости соответствует системе с взаимодействующими компонентами. Иными словами, хотя степень связывания с повышением температуры уменьшается, комплексы в полуразбавленных растворах существуют во всем исследованном интервале температур, а значит для них возможно определение параметров активации вязкого течения.
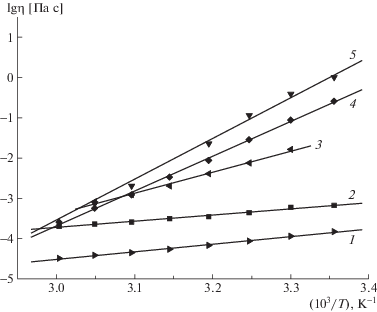
Зависимости логарифма наибольшей ньютоновской вязкости от обратной температуры для полуразбавленных растворов ПАК, ПСС-2, а также для комплексов всех исследованных составов линейны, примеры соответствующих зависимостей показаны на рис. 7.
Рис. 7.
Зависимость логарифма наибольшей ньютоновской вязкости от обратной температуры для водных растворов ПАК (1), ПСС-2 (2) и смесей состава Z = 0.92 (3), 0.81 (4), 0.74 (5). С = 5%.
Из результатов линейной аппроксимации были рассчитаны энтропия и энтальпия активации вязкого течения (см. Экспериментальную часть), результаты представлены в табл. 2.
Таблица 2.
Параметры активации вязкого течения для системы ПАК–ПСС-2–Н2О (С = 5%)
| Z | ΔH, кДж/моль | ΔS, Дж/(моль К) |
|---|---|---|
| 1.0 | 15.7 ± 0.3 | 8 ± 1 |
| 0.92 | 42.5 ± 0.1 | 76 ± 4 |
| 0.81 | 74.3 ± 0.1 | 169 ± 3 |
| 0.74 | 83.6 ± 0.1 | 204 ± 4 |
| 0.66 | 99.8 ± 0.1 | 252 ± 3 |
| 0.42 | 123.6 ± 0.1 | 332 ± 5 |
| 0 | 12.2 ± 0.4 | –9 ± 1 |
Знак и величина энтропии активации вязкого течения отражают процесс изменения структуры при течении полуразбавленного раствора. Для всех образцов, кроме раствора ПСС-2, изменение энтропии положительно. Следовательно, основной вклад вносит процесс разупорядочивания структуры, т.е. разрушения сетки. Для раствора ПСС-2 изменение энтропии отрицательно, что свидетельствует о преобладании процессов развертывания и ориентации макромолекул.
Энтальпия активации вязкого течения для раствора ПСС-2 ниже, чем для раствора ПАК. Это может быть связано со значительно более высоким зарядом цепей ПСС по сравнению с макромолекулами ПАК. Максимумы энтальпии и энтропии активации вязкого течения лежат в интервале составов, соответствующем максимальному связыванию комплексов (рис. 4).
Ротационная реометрия полуразбавленных растворов смесей ПАК–ПСС
Для более детального изучения реологических свойств образующихся сеток, полуразбавленные растворы ПАК, ПСС-2 и их смеси состава 0.42 были исследованы методом ротационной реометрии. В результате были получены частотные зависимости модуля упругости и модуля потерь, что позволило рассмотреть по отдельности вязкие и упругие свойства исследуемых систем.
Для растворов исходных полимеров (рис. 8) зависимости обоих модулей от частоты линейны, при этом G' ∝ ω2, G'' ∝ ω1 и G'' > G', что соответствует вязкотекучему состоянию растворов [33, 34]. В растворе смеси частотные зависимости модулей кардинально изменяются (рис. 9).
Рис. 8.
Логарифмическая зависимость модуля упругости (1, 2) и модуля потерь (3, 4) от частоты для растворов ПАК (1, 3) и ПСС-2 (2, 4) в 0.1 М HCl. С = 15%, T = 25°C.
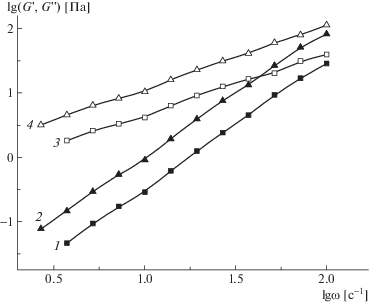
Рис. 9.
Логарифмическая зависимость модуля упругости (1) и модуля потерь (2) от частоты для раствора смеси ПАК–ПСС-2, Z = 0.42 в 0.1 М HCl. С = 10%, T = 25°C.
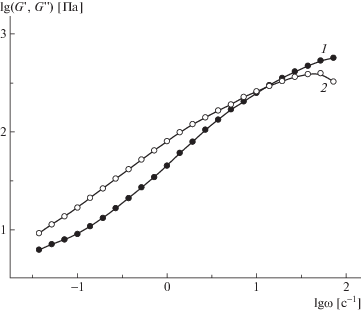
На зависимости модуля упругости от частоты видна тенденция к выходу на плато при высоких частотах, модуль потерь в этой же области проходит через максимум, а модуль упругости становится больше модуля потерь, что свидетельствует о переходе в высокоэластическое состояние.
Показатели степени в зависимостях модуля упругости и модуля потерь от частоты в области вязкотекучести уменьшаются по сравнению с зависимостями для растворов индивидуальных полимеров: G' ∝ ω0,8, G'' ∝ ω0,6, что соответствует структурированию системы. Кроме того, в области низких частот появляется тенденция к выходу модуля упругости на второе плато. Аналогичные низкочастотные плато наблюдались ранее [35–38] для комплексов полилизина с полиглутаминовой кислотой [35] и для белковых гидрогелей [36], однако авторы не приводят однозначной трактовки этого явления. Авторы [37] связывают низкочастотное плато с пределом текучести системы и образованием прочной трехмерной структуры. В работе [38] появление низкочастотного плато для растворов в ДМСО тройного сополимера акрилонитрила, метилакрилата и итаконата натрия объясняется структурированием за счет формирования межцепных водородных связей с участием растворителя.
ЗАКЛЮЧЕНИЕ
Таким образом, на примере системы ПАК–ПСС было показано, что взаимодействие карбоксильных групп неионизованной ПАК и сульфогрупп ПСС приводит к образованию термочувствительных комплексов. Комплексы существуют как в разбавленных, так и в полуразбавленных растворах, однако концентрационный режим оказывает определяющее влияние на реологические свойства таких систем. Установлено, что в полуразбавленном режиме комплексообразование вызывает значительное структурирование растворов за счет взаимодействия функциональных групп полиэлектролитов. Формирующаяся в полуразбавленных растворах трехмерная структура стабилизирована как обычными узлами зацеплений, так и системой межцепных ион-дипольных взаимодействий. Введение комплексообразователя не только позволяет получать системы с высокой вязкостью при относительно небольшой концентрации исходных полиэлектролитов, но и дает возможность регулировать реологические свойства таких систем в широких пределах, изменяя температуру, концентрацию или соотношение полимерных компонентов.
Список литературы
Dobrynin A.V., Rubinstein M., Colby R.H. // Macromolecules. 1996. V. 28. № 6. P. 1859.
Doi M., Edwards S.F. The Theory of Polymer Dynamics. Oxford: Clarendon Press, 1988.
Rubinstein M., Colby R.H., Dobrynin A.V. // Phys. Rev. Lett. 1994. V. 73. № 20. P. 2776.
Tam K.C., Tiu G. // J. Non-Newtonian Fluid Mech. 1993. V. 46. № 2–3. P. 275.
Debye P. // J. Chem. Phys. 1946. V. 14. № 10. P. 636.
Muthukumar M. // J. Chem. Phys. 1997. V. 107. № 7. P. 2619.
Sedlàk M. // Langmuir. 1999. V. 15. № 12. P. 4045.
Štěpánek P., Brown W. // Macromolecules. 1998. V. 31. № 6. P. 1889.
Nicolai T., Brown W. // Light Scattering: Principles and Development /Ed. by W. Brown. Oxford: Clarendon Press; New York: Oxford Univ. Press, 1996.
Semenov A.N. // Physica A. 1990. V. 166. № 2. P. 263.
Boudenne N., Anastasiadis S.H., Fytas G., Xenidou M., Hadjichristidis N., Semenov A.N., Fleischer G. // J. Phys. Rev. Lett. 1996. V. 77. № 3. P. 506.
Litmanovich E.A., Kotova E.V., Efremov V.V. // J. Colloid Polym. Sci. 2019. V. 297. № 3. P. 371.
De Gennes P.G. // J. Chem. Phys. 1971. V. 55. № 2. P. 572.
Doi M., Edwards S.F. // J. Chem. Soc., Faraday Trans. II. 1978. V. 74. № 10. P. 1789.
Boris D.C., Colby R.H. // Macromolecules. 1988. V. 1. № 17. P. 5746.
Liu R.C.W., Morishima Y., Winnik F.M. // Polymer. 2002. V. 34. № 5. P. 340.
Dreval’ V.E., Vasil’ev G.B., Litmanovich E.A., Kulichikhin V.G. // Polymer Science A. 2008. V. 50. № 7. P. 751.
Chapel J.-P., Berret J.-F. // Current Opinion Colloid Interface Sci. 2012. V. 17. № 2. P. 97.
Bu H., Kjoniksen A.-L., Knudsen K.D., Nyström B. // J. Colloids and Surfaces A. 2007. V. 293. P. 105.
Wu Q., Shangguan Y., Du M., Zhou J., Zheng Q. // J. Colloid Interface Sci. 2009. № 339. P. 236.
Wu Q., Du M., Shangguan Y., Zhou J., Zheng Q. // Colloids Surfaces A. 2009. V. 332. P. 13.
Thünemann A.F., Müller M., Dautzenberg H., Joanny J.F., Löwen H. // Adv. Polym. Sci. 2004. V. 166. P. 113.
Антипина А.Д., Барановский В.Ю., Паписов И.М., Кабанов В.А. // Высокомолек. соед. A. 1972. Т. 14. № 4. С. 941.
Litmanovich E.A., Chernikova E.V., Stoychev G.V., Zakharchenko S.O. // Macromolecules. 2010. V. 43. № 16. P. 6871.
Litmanovich E A., Zakharchenko S.O., Stoychev G.V., Zezin A.B. // Polymer Science A. 2009. V. 51. № 6. P. 616.
Bergfeldt K., Piculell L., Tjerneld F. // Macromolecules. 1995. V. 28. P. 3360.
M'Bareck C.O., Nguyen Q.T., Metayer M., Saiter J.M., Garda M.R. // Polymer. 2004. V. 45. P. 4181.
Tager A. // Physical Chemistry of Polymers. Moscow: MIR, 1978.
Di Cola E., Waigh T.A., Colby R.H. // J. Polym. Sci., Polym. Phys. 2007. V. 45. P. 774.
Kavassalis T.A., Noolandi J. // Macromolecules. 1989. V. 22. P. 2709.
Lin Y.H. // Macromolecules. 1987. V. 20. № 12. P. 3080.
Бартенев Г.М., Вишницкая Л.А. // Высокомолек. соед. 1964. Т. 6. № 4. С. 751.
Виноградов Г.В., Малкин А.Я. Реология полимеров. М.: Химия, 1980.
Barnes H.A. A Handbook of Elementary Rheology. Aberystwyth: University of Wales Institute of Non-Newtonian Fluid Mechanics, 2000.
Marciel A.B., Srivastava S., Tirrell M.V. // Soft Matter. 2018. V. 14. № 13. P. 2454.
Tang S., Wang M., Olsen B.D. // J. Am. Chem. Soc. 2015. № 137. V. 11. P. 3946.
Onogi S., Matsumoto T. // J. Polym. Eng. Revs. 1981. № 1. P. 45.
Kulichikhin V.G., Ilyin S.O., Mironova M.V., Berko-vich A.K., Nifant’ev I.E., Malkin A.Ya. //Adv. Polym. Technol. 2018. V. 37. № 4. P. 1076.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


