Высокомолекулярные соединения (серия А), 2020, T. 62, № 1, стр. 65-72
ВЛИЯНИЕ МАГНИТНОГО ПОЛЯ НА ФАЗОВЫЕ ПЕРЕХОДЫ И СТРУКТУРУ РАСТВОРОВ ПОЛИЭЛЕКТРОЛИТОВ
С. А. Вшивков a, *, Е. В. Русинова a, Е. С. Клюжин b, А. А. Капитанов a
a Уральский федеральный университет
620000 Екатеринбург, пр. Ленина, 51, Россия
b Научно-исследовательский институт химии и технологии полимеров имени академика В.А. Каргина
606000 Нижегородская обл., г. Дзержинск, Россия
* E-mail: sergey.vshivkov@urfu.ru
Поступила в редакцию 11.04.2019
После доработки 29.04.2019
Принята к публикации 06.05.2019
Аннотация
Изучено влияние магнитного поля на фазовые переходы и структуру растворов полиэлектролитов: желатина, полиакриловой и полиметакриловой кислоты при разных рН среды. Впервые для систем полиэлектролит–растворитель показано, что магнитное поле приводит к увеличению температуры фазовых переходов и дополнительной ассоциации макромолекул в растворах.
ВВЕДЕНИЕ
Теория взаимодействия диамагнитных макромолекул с магнитным полем находится в стадии развития [1–4]. Если такую макромолекулу поместить в магнитное поле, то на нее будет действовать сила, вызывающая ее вращение. Это обусловлено магнитной анизотропией молекулы, зависящей от магнитной анизотропии химических связей. Влияние поля заключается в повороте (ориентации) макромолекул в некотором преимущественном направлении, зависящем от знака анизотропии диамагнитной восприимчивости макромолекул данного полимера. Взаимодействие магнитного поля с диамагнитными макромолекулами увеличивает энергию системы на величину Емагн. Ориентация будет наблюдаться тогда, когда Емагн превысит величину тепловой энергии. При этом необходимо соблюдение следующих условий [1, 2]: во-первых, частица должна быть анизодиаметричной; во-вторых, объем частицы должен быть больше критической величины Vкрит = 2kTμ0/B2I∆χI ( μ0 – магнитная постоянная вакуума, В – вектор магнитной индукции, ∆χ – анизотропия диамагнитной восприимчивости, k – постоянная Больцмана, T – абсолютная температура); в-третьих, среда должна быть маловязкой.
В работах С.А. Вшивкова с сотрудниками [5–17] проведены систематические исследования влияния магнитного поля на фазовые переходы, структуру и реологические свойства жидкокристаллических растворов диамагнитных макромолекул эфиров целлюлозы. Выявлено, что магнитное поле вызывает смену типа жидких кристаллов с холестерического на нематический, значительное повышение температуры образования жидкокристаллических фаз, увеличение размеров ассоциатов макромолекул, а также рост вязкости растворов.
Экспериментально обнаружено, что магнитное поле вызывает ориентацию макромолекул и их ассоциатов в растворах, расплавах или суспензиях изотактического полипропилена, изотактического полистирола, полиэтилентерефталата, полиэтилен-2,6-нафталата, коллагена, фосфолипидов, синдиотактического полистирола, полиэтилена, микрокристаллов целлюлозы [18–29].
В работе [30] впервые для систем гибкоцепный полимер– растворитель с кристаллическим разделением фаз показано влияние магнитного поля на фазовые диаграммы. Для систем ПЭ–о-ксилол, ПЭ–н-гексан, ПЭ–хлороформ, ПЭ–о-дихлорбензол, ПЭГ–1,4-диоксан, ПЭГ–толуол обнаружено, что магнитное поле повышает температуру кристаллизации ПЭ и ПЭГ из растворов и расплавов, влияет на степень кристалличности и размеры сферолитов, выделяющихся из растворов.
Актуальными объектами для продолжения аналогичных исследований являются растворы полиэлектролитов [31–33], что обусловлено их важной ролью в природе и в технологических процессах, а также возможностью моделирования поведения сложных биологических объектов (белков, нуклеиновых кислот). В.А. Кабановым, А.Б. Зезиным, В.А. Касаикиным, В.А. Изумрудовым с сотрудниками и другими исследователями [34–42] получен большой объем экспериментальных данных для растворов полиэлектролитов различной природы: изучены структура, реологические свойства, фазовые и конформационные переходы, реакции образования полиэлектролитных комплексов при разных значениях рН среды, концентрации и температуры. Однако аналогичные исследования полиэлектролитных систем в магнитном поле отсутствуют.
Изучение свойств растворов полиэлектролитов в магнитном поле позволит получить новые данные о фундаментальных закономерностях внутренних микроскопических структурных преобразований, являющихся основой уникальных свойств и поведения этих систем.
Цель настоящей работы – исследование влияния магнитного поля на фазовые переходы и структуру систем полиэлектролит–растворитель.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали образцы желатина с Мw = 0.5 × 104, 3.7 × 105 и 1 × 106, полиакриловой кислоты (ПАК) с Мw = 3.6 × 104, 6.0 × 104, 5.7 × 105 и полиметакриловой кислоты (ПМАК) с Мw = 5.3 × 104.
Полиакриловую и полиметакриловую кислоту получали методом радикальной полимеризации в водной среде в присутствии инициатора – персульфата калия по рецептуре, приведенной в таблице 1.
Таблица 1.
Получение полиакриловой и полиметакриловой кислоты
| Компонент | Количество | |||
|---|---|---|---|---|
| г | мас. % | |||
| ПАК | ПМАК | ПАК | ПМАК | |
| Акриловая кислота | 144 | − | 38.4 | − |
| Метакриловая кислота | − | 172 | − | 25.93 |
| Персульфат калия | 3.0 | 4.3 | 0.8 | 0.65 |
| Вода | 228 | 487 | 60.8 | 73.40 |
В стеклянный реактор объемом 1 л, снабженный мешалкой, обратным холодильником и термометром для регистрации температуры, загружали указанное в таблице количество бидистиллированной воды, 1/2 часть акриловой или метакриловой кислоты, 1/3 часть персульфата калия и нагревали до 80°С. Реакционную массу выдерживали 30 мин, при этом наблюдали самопроизвольный подъем температуры до 90–105°С. Затем загружали следующие порции тех же веществ в той же пропорции, снова выдерживали в течение 30 мин. После снижения температуры в реакторе до 80°С вводили оставшуюся часть инициатора и реакционную массу выдерживали 2 ч при заданной температуре, после чего охлаждали до 30–40°С.
В качестве растворителей применяли бидистиллированную воду, 0.1 н HCl, 1,4-диоксан и тетрагидрофуран.
Растворы готовили в стеклянных запаянных ампулах при 323 К (желатин), 353 К (ПАК), 343 К (ПМАК) в течение нескольких суток. Так как полимеры являются системами с памятью [17, 43], то для исключения влияния “предыстории” приготовления растворов для последующих измерений в магнитном поле и вне поля все растворы каждой концентрации готовили в двух ампулах. Значение рН растворов определяли с помощью рН метра “pH-410”.
Температуру фазового разделения Тф растворов ПАК и ПМАК, мутнеющих при расслаивании, определяли методом точек помутнения (метод Алексеева), согласно которому температуру начала помутнения принимали за Тф [30]. Скорость изменения температуры составляла 12 град/ч. Помутнение было обратимым.
Поскольку водные растворы желатина при охлаждении переходят в гель без помутнения, то находили не значения температуры гелеобразования, а температуру плавления гелей. Использовали метод, предложенный С.П. Папковым: ампулы с гелем поворачивали так, чтобы гель находился в их верхней части, и нагревали со скоростью 12 град/ч. Фиксировали температуру начала плавления гелей, проявляющегося в изменении формы их мениска.
При изучении фазовых переходов растворов ПАК и ПМАК в магнитном поле в термостатирующую рубашку, закрепленную между полюсами магнита [5], помещали запаянную ампулу с исследуемым раствором. Силовые линии магнитного поля с напряженностью 7 кЭ направляли перпендикулярно поверхности раствора в ампуле. Температуру растворов изменяли с постоянной скоростью 12 град/ч; за Tф принимали температуру появления устойчивого помутнения.
Растворы желатина в ампулах охлаждали в магнитном поле от 323 К до температуры гелеобразования и выдерживали в поле при 298 К в течение суток. После чего находили температуру плавления геля в поле при последующем нагревании.
Размеры рассеивающих свет частиц определяли методом динамического светорассеяния [44], позволяющего узнать коэффициент диффузии D дисперсных частиц в жидкости путем анализа характерного времени флуктуаций интенсивности рассеянного света. По данным о коэффициенте диффузии рассчитывали гидродинамический радиус Rh рассеивающих свет частиц по уравнению Стокса–Эйнштейна [45] D = kT/6πηRh (k – константа Больцмана, T – абсолютная температура, η – вязкость среды). Исследования проводили с использованием анализатора дисперсий ZetaPlus фирмы “Brookhaven”. Обеспыливание растворов осуществляли их фильтрованием через фильтры c радиусом пор 0.2 мкм. При исследовании влияния магнитного поля на структуру растворов кювету с обеспыленным раствором выдерживали в магнитном поле с напряженностью 7 кЭ в течение суток, после чего ее помещали в анализатор дисперсий для проведения измерений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Система желатин–вода
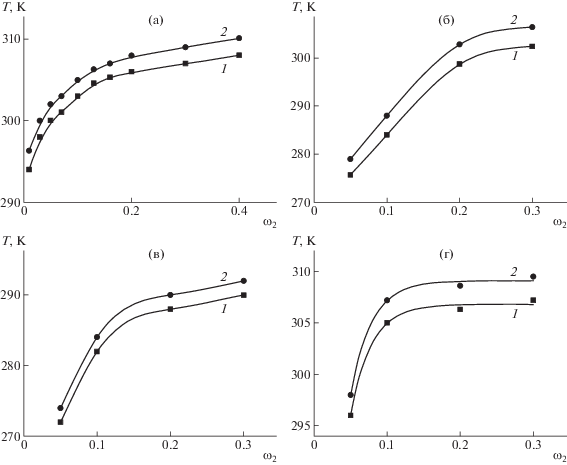
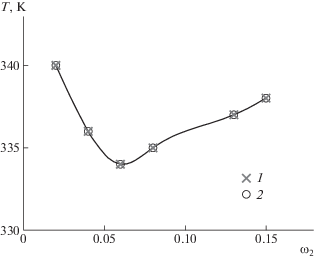
На рис. 1 приведена концентрационная зависимость температуры плавления Тпл гелей трех образцов желатина. Видно, что система желатин–вода характеризуется диаграммой, типичной для гелеобразующих систем [46]. Показано, что с увеличением молекулярной массы желатина температура плавления гелей повышается. С ростом размеров макромолекул возрастает число межцепных контактов, следовательно, усиливается межмолекулярное взаимодействие в геле. Это приводит к увеличению их температуры образования и плавления. C ростом концентрации желатина значения температуры образования и плавления гелей возрастают, что обусловлено усилением межмолекулярного взаимодействия, приводящего к формированию более прочного геля. В дальнейшем были изучены растворы желатина с Мw = 1.0 × 106.
Рис. 1.
Концентрационные зависимости Тпл для гелей желатина с Мw = 0.5 × 104 (1), 3.7 × 105 (2) и 1.0 × 106 (3); pH 7.2.
Механизм гелеобразования в водных растворах желатина подробно исследован в работах [46–51]. Авторы этих работ полагают, что при охлаждении растворов макромолекулы желатина претерпевают конформационный переход клубок–коллагеноподобная тройная спираль, фиксированная водородными связями. Из-за наличия внутримолекулярных водородных связей между карбонильным кислородом и амидным водородом звеньев полипептидной цепи при низких значениях температуры энергетически предпочтительной конформацией является спираль, обеспечивающая сближение взаимодействующих звеньев.
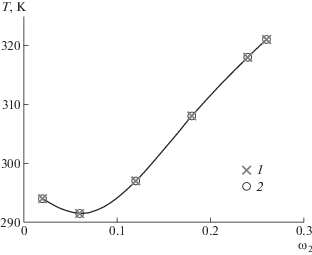
На рис. 2 приведена концентрационная зависимость Тпл гелей желатина при разных значениях рН среды. Видно, что наименьшие значения Тпл и температуры образования гелей наблюдаются при рН 4.8, т.е. в изоэлектрической точке [52]. Это обусловлено тем, что суммарный заряд макромолекул равен нулю, следовательно, отталкивание между звеньями отсутствует, приводя к уменьшению размеров макромолекул, а также их ассоциатов, к уменьшению числа контактов между ними, т.е. к ослаблению межцепного взаимодействия. Поэтому ассоциация макромолекул, приводящая к гелеобразованию, происходит при более низких значениях температуры. Это согласуется с данными работы [51], в которой показано, что в растворах в изоэлектрической точке формируются малые по размерам ассоциаты макромолекул желатина с формой, близкой к сферической. При pH 3 в растворах образуются крупные ассоциаты макромолекул анизодиаметрической формы [51], что способствует гелеобразованию при высоких значениях температуры. По той же причине гелеобразование при более высоких значениях температуры наблюдается и при рН 10.
Рис. 2.
Концентрационные зависимости Тпл для гелей желатина с Мw = 1.0 × 106 при pH 4.8 (1), 2 (2), 7.2 (3) и 10 (4).
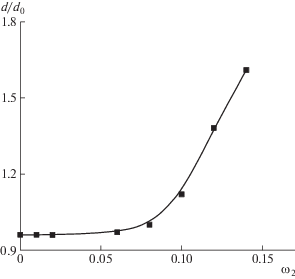
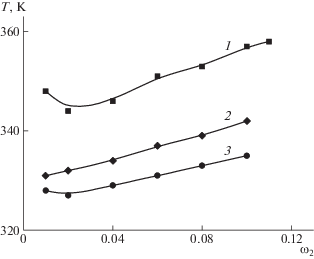
Концентрационные зависимости температуры плавления гелей желатина, полученных в магнитном поле и в его отсутствие, представлены на рис. 3. Показано, что магнитное поле приводит к повышению температуры плавления гелей желатина. По-видимому, наложение магнитного поля способствует конформационному переходу клубок–коллагеноподобная тройная спираль. Это влечет, в свою очередь, увеличение степени упорядоченности макромолекул в геле, а значит, к повышению температуры плавления геля.
Растворы ПАК и ПМАК
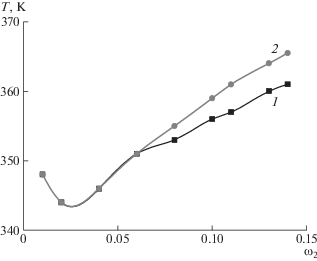
Концентрационная зависимость радиуса r рассеивающих свет частиц для системы ПАК–диоксан представлена на рис. 4. При концентрации выше 11% наблюдается значительное увеличение размеров рассеивающих свет частиц (рис. 5). Это свидетельствует об ассоциации макромолекул, вызванной усиливающимся межмолекулярным взаимодействием. По-видимому, в неполярном растворителе, 1,4-диоксане, карбоксильные группы макромолекул ПАК практически не диссоциируют и электростатическое отталкивание между цепями отсутствует. Таким образом, при увеличении концентрации полимера в растворе прослеживается дополнительная ассоциация макромолекул ПАК в результате формирования водородных связей между ними.
Рис. 4.
Концентрационная зависимость радиуса рассеивающих свет частиц для системы ПАК (Mw = 3.6 × × 104)–1,4-диоксан.
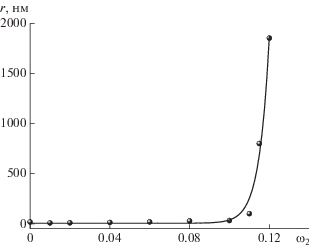
На рис. 5 показана концентрационная зависимость величины отношения размеров частиц в магнитном поле и в его отсутствие dотн для системы ПАК–1,4-диоксан. Величина dотн более наглядно отражает влияние магнитного поля на ориентационные процессы в системе. Видно, что в диапазоне концентрации 0–9% магнитное поле практически не влияет на размеры рассеивающих свет частиц. Однако дальнейшее увеличение концентрации ПАК, приводящее к росту количества магниточувствительных макромолекул в растворе, способствует усилению влияния поля на свойства раствора, что отражается в значительном увеличении относительного размера рассеивающих частиц. Аналогичное явление наблюдалось ранее для других систем [12–14]. Оно было обусловлено ориентацией макромолекул и их ассоциатов относительно силовых линий магнитного поля и увеличением межцепного взаимодействия. Таким образом, следует ожидать изменения температуры фазового перехода для системы ПАК–диоксан под действием магнитного поля.
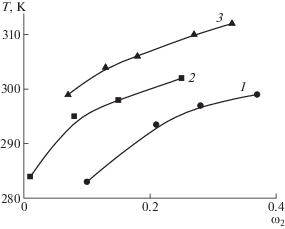
На рис. 6 приведены пограничные кривые для растворов в диоксане трех образцов ПАК разной молекулярной массы. Данная система обладает нижней критической температурой растворения, что согласуется с литературными данными [53–56]. Пограничные кривые расположены тем ниже, чем выше молекулярная масса ПАК [17]. Фазовое расслоение при нагревании свидетельствует об уменьшении растворимости полимера и может быть связано с разрушением водородных связей между звеньями макромолекул и молекулами растворителя.
Рис. 6.
Пограничные кривые для системы ПАК–1,4-диоксан с Мw = 3.6 × 104 (1), 6.0 × 104 (2) и 5.7 × 105 (3).
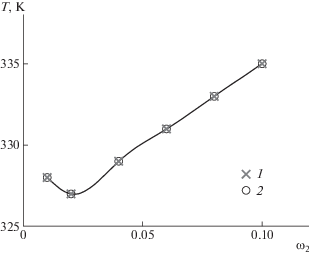
Пограничные кривые для системы ПАК (Мw = = 3.6 × 104)–1,4-диоксан, определенные в магнитном поле и в его отсутствие, представлены на рис. 7. Видно, что наложение магнитного поля влечет повышение температуры фазового разделения, что обусловлено образованием ассоциатов макромолекул, которые ориентируются относительно силовых линий магнитного поля. Эти результаты находятся в полном согласии с данными по концентрационной зависимости относительных размеров частиц.
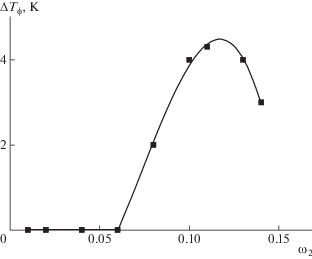
На рис. 8 продемонстрирована концентрационная зависимость ΔTф для изученной системы при разной напряженности магнитного поля (ΔTф – разность между температурой фазовых переходов в магнитном поле и в его отсутствие). Видно, что концентрационная зависимость ΔTф описывается кривой с максимумом. Аналогичные зависимости обнаружены ранее для жидкокристаллических растворов эфиров целлюлозы [17]. Они обусловлены протеканием двух противоположно направленных процессов. Увеличение числа магниточувствительных макромолекул в растворе усиливает влияние магнитного поля на свойства системы, и ΔTф растет. При дальнейшем увеличении концентрации ПАК образующаяся флуктуационная сетка зацеплений препятствует протеканию ориентационных процессов в системе и ослабляет влияние поля, в результате чего ΔTф уменьшается.
Результаты исследования фазовых переходов в системе ПАК (Mw = 5.7 × 105)–1,4-диоксан в магнитном поле и в его отсутствие приведены на рис. 9. Показано, что магнитное поле практически не влияет на фазовые переходы растворов ПАК с бóльшей молекулярной массой. Это обусловлено меньшей способностью больших макромолекул к ориентации относительно силовых линий магнитного поля. Аналогичные данные были получены для растворов эфиров целлюлозы [17].
Рис. 9.
Температура фазовых переходов системы ПАК (Mw = 5.7 × 105)– 1,4-диоксан; Н = 0 (1) и 7 кЭ (2).
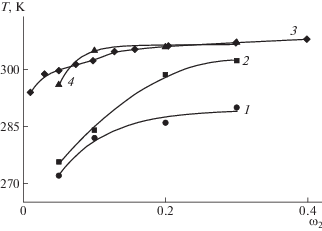
На рис. 10 представлены результаты исследования фазовых переходов в системе ПАК (Mη = = 3.6 × 104)–ТГФ в магнитном поле и в его отсутствие. Видно, что данная система обладает НКТР, что согласуется с литературными данными [57] и может быть обусловлено разрушением водородных связей между атомами кислорода молекул ТГФ и атомами водорода карбоксильных групп звеньев ПАК.
Следует отметить различное поведение систем ПАК–диоксан и ПАК–ТГФ в магнитном поле: магнитное поле не влияет на температуру фазовых переходов растворов ПАК в ТГФ даже при невысокой молекулярной массе поликислоты. Это может быть связано с тем, что дипольный момент молекул ТГФ (μ = 1.63 D) выше, чем у молекул 1,4-диоксана (μ = 0.45 D) [58]. С увеличением полярности растворителя увеличивается взаимодействие полярных макромолекул ПАК с молекулами ТГФ. Образующаяся сольватная оболочка может ослаблять взаимодействие макромолекул с магнитным полем и, следовательно, их способность к ориентации в поле.
На рис. 11 приведены результаты исследования фазовых переходов в системе ПМАК (Mw = = 5.3 × 104)–0.1 н HCl в магнитном поле и в его отсутствие. Межмолекулярные взаимодействия ПМАК с водой могут определяться как сольватацией макромолекул водой с образованием водородных связей между полимером и растворителем, так и явлением “гидрофобной гидратации” самой воды [59]. “Гидрофобная гидратация” заключается в уплотнении структуры воды при проникновении в пустоты ее структуры неполярных молекул или их фрагментов. Неполярными фрагментами являются метильные и метиленовые группы макромолекул полимера. В результате происходит уменьшение межмолекулярных расстояний в воде, усиление взаимодействия ее молекул и уменьшение энтропии за счет дополнительного структурирования [59]. При повышении температуры структура воды разрушается. В результате гидрофобные участки макромолекул входят в контакт с одиночными молекулами воды (или небольшими кластерами), плохо взаимодействующих с ними. Возникает тенденция к ассоциации гидрофобных участков, которая приводит к фазовому разделению. Добавление НCl в растворы понижает способность карбоксильных групп ПМАК к диссоциации, что также влечет ухудшение взаимодействия растворителя с полимером. В результате данная система расслаивается при нагревании, т.е. обладает НКТР (рис. 11), что согласуется с литературными данными [60, 61]. При этом фазовому переходу предшествует конформационный переход клубок–глобула [60, 61]. Магнитное поле не влияет на температуру фазового перехода, что связано, по-видимому, с отмеченным конформационным переходом: глобулы как сферические образования небольших размеров не ориентируются относительно силовых линий магнитного поля.
ЗАКЛЮЧЕНИЕ
Изучено влияние магнитного поля на фазовые переходы гелеобразующей системы желатин–вода и систем с нижней критической температурой растворения: ПАК–диоксан, ПАК–ТГФ и ПМАК–0.1 н HCl при разных значениях рН среды.
Магнитное поле приводит к увеличению температуры плавления гелей желатина, что обусловлено ориентацией макромолекул и их ассоциатов относительно силовых линий магнитного поля и усилением межцепного взаимодействия.
В растворах ПАК в диоксане магнитное поле влечет образование крупных ассоциатов макромолекул и повышение НКТР. Эти эффекты не наблюдаются для образца ПАК бóльшей молекулярной массы, поскольку с увеличением размеров молекул их способность к ориентации в поле уменьшается.
Для растворов ПАК в более полярном растворителя ТГФ влияние магнитного поля на НКТР системы отсутствует. С увеличением полярности растворителя усиливается взаимодействие полярных макромолекул ПАК с молекулами растворителя. Образующаяся сольватная оболочка может ослаблять взаимодействие макромолекул с магнитным полем и, следовательно, уменьшать их способность к ориентации в поле.
В системе ПМАК–0.1 н HCl влияние магнитного поля на НКТР не наблюдается, что обусловлено изменением конформации макромолекул ПАК: конформационным переходом клубок–глобула.
Авторы выражают благодарность А.С. Мизеву за участие в эксперименте.
Список литературы
Kimura T. // Polym. J. 2003. V. 35. № 11. P. 823.
Moore J.S., Stupp S.I. // Macromolecules. 1987. V. 20. № 2. P. 282.
Vshivkov S.A., Rusinova E.V. // Polymer Rheology. Croatia: InTech, 2018. P. 3.
Вшивков С.А., Русинова Е.В. Физика и химия полимеров. Поведение диамагнитных макромолекул в магнитном поле. СПб.: Лань, 2018.
Vshivkov S.A., Rusinova E.V., Kudrevatykh N.V., Galyas A.G., Alekseeva M.S., Kuznetsov D.K. // Polymer Science A. 2006. V. 48. № 10. P. 1115.
Vshivkov S.A., Rusinova E.V., Kutsenko L.I., Galyas A.G. // Polymer Science B. 2007. V. 49. № 7−8. P. 200.
Vshivkov S.A., Rusinova E.V. // Polymer Science A. 2008. V. 50. № 7. P. 725.
Вшивков С.А., Русинова Е.В. // Изв. вузов. Сер. Химия и хим. технология. 2007. Т. 50. № 3. С. 10.
Vshivkov S.A., Adamova L.V., Rusinova E.V., Safronov A.P., Dreval V.E., Galyas A.G. // Polymer Science A. 2007. V. 49. № 5. P. 578.
Вшивков С.А., Галяс А.Г. // Известия вузов. Сер. Химия и хим. технология. 2008. Т. 51. № 5. С. 78.
Vshivkov S.A., Rusinova E.V. // Polymer Science A. 2008. V. 50. № 7. P. 725.
Vshivkov S.A., Rusinova E.V., Galyas A.G. // Polymer Science A. 2012. V. 54. № 11. P. 827.
Vshivkov S.A., Byzov A.A. // Polymer Science A. 2013. V. 55. № 2. P. 102.
Vshivkov S.A., Rusinova E.V., Galyas A.G. // Eur. Polym. J. 2014. V. 59. P. 326.
Vshivkov S.A., Soliman T.S. // Polymer Science A. 2016. V. 58. № 3. P. 307.
Vshivkov S.A., Soliman T.S. // Polymer Science A. 2016. V. 58. № 4. P. 499.
Вшивков С.А. Фазовые переходы полимерных систем во внешних полях. Учеб. пособ.: 2-е изд., испр. и доп. СПб.: Лань, 2013.
Kawai T., Kimura T. // Polymer. 2000. V. 41. № 1. P. 155.
Ezure H., Kimura T., Ogawa S., Ito E. // Macromolecules. 1997. V. 30. № 12. P. 3600.
Kimura T., Kawai T., Sakamoto Y. // Polym. Commun. 2000. V. 41. № 2. P. 809.
Sata H., Kimura T., Ogawa S., Yamato M., Ito E. // Polymer. 1996. V. 37. № 10. P. 1879.
Guo C., Kaufman L.J. // Biomaterials. 2007. V. 28. № 6. P. 1105.
Kawamura Y., Sakurai I., Ikegami A., Iwayanagi S. // Mol. Cryst. Liq. Cryst. 1981. V. 67. № 1. P. 77.
Naga N., Saito Y., Noguchi K., Takahash K., Watanabe K., Yamato M. // Polym J. 2016. V. 48. № 2. P. 709.
Naga N., Ishikawa G., Noguchi K., Takahashi K., Watanabe K., Yamato M. // Polymer. 2013. V. 54. № 2. P. 784.
Al-Haik M.S., Hussaini M.Y. // Molecular Simul. 2006. № 8. P. 601.
Kimura F., Kimura T., Tamura M., Hirai A., Ikuno M., Hori F. // Langmuir. 2005. V. 21. № 5. P. 2034.
Sugiyama J., Chanzy H., Maret G. // Macromolecules. 1992. V. 25. № 16. P. 4232.
Revol J.F., Godbout L., Dong X.M., Gray D.G., Chanzy H., Maret G. // Liq. Cryst. 1994. V. 16. № 1. P. 127.
Vshivkov S.A., Zhernov I.V., Nadol’skii A.L., Mizyov A.S. // Polymer Science A. 2017. V. 59. № 4. P. 465.
Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах. М.: Наука, 1964.
Моравец Г. Макромолекулы в растворе. М.: Мир, 1967.
Тенфорд Ч. Физическая химия полимеров. М.: Химия, 1965.
Зезин А.Б., Рогачева В.Б. // Успехи химии и физики полимеров. М.: Химия, 1973. С. 3.
Бектуров Е.А., Бимендина Л.А. Интерполимерные комплексы. Алма-Ата: Наука, 1977.
Кабанов В.А., Паписов И.М. // Высокомолек. соед. А. 1979. Т. 21. № 2. С. 243.
Veis A. // Developments in ionic polymers. London; New York: Longman, 1983. V. 1.
Tsuchida E., Abe K. // Developments in ionic polymers. London; New York: Longman, 1983. V. 1.
Изумрудов В.А., Зезин А.Б., Кабанов В.А. // Успехи химии. 1991. Т. 60. № 7. С. 1570.
Кабанов В.А. // Высокомолек. соед. А. 1994. Т. 36. № 2. С. 183.
Кабанов В.А. // Успехи химии. 2005. Т. 74. № 1. С. 5.
Изумрудов В.А. // Успехи химии. 2008. Т. 77. № 4. С. 401.
Тагер A.A. // Высокомолек. соед. А. 1988. Т. 30. № 7. С. 1409.
Modern Methods of Particle Size Analysis / Ed. by H.G. Barth. New York: Wiley, 1984.
Einstein A. // Z. Electrochem. Angew. Phys. Chem. 1908. B. 14. S. 235
Папков С.П. Студнеобразное состояние полимеров. М.: Химия, 1974.
Измайлова В.Н., Ребиндер Д.А., Боброва Л.Е. // Коллоидн. журн. 1973. Т. 35. № 5. С. 887.
Боброва Л.Е., Измайлова В.Н., Ребиндер П.А. // Коллоидн. журн. 1972. Т. 34. № 1. С. 6.
Вейнерман Е.С., Гринберг В.Я., Толстогузов В.Б. // Изв. АН СССР. 1973. С. 200.
Фалязи Б.Г., Боброва Л.Е., Измайлова В.Н. // Коллоидн. журн. 1976. Т. 38. № 3. С. 524.
Boedtker H., Doty P. // J. Phys. Chem. 1954. V. 58. P. 968.
Физическая и коллоидная химия. Задачи и упражнения. Учебное пособие / Под ред. С.Л. Белопухова М.: Проспект, 2015.
Cuniberti C., Brianchi U. // Polymer. 1974. V. 15. № 6. P. 346.
Newman S., Krigbaum W.R., Laugier C., Flory P.J. // J. Polymer Sci. 1954. V. 14. № 77. P. 451.
Shultz A.R., Flory P.J. // J. Am. Chem. Soc. 1953. V. 75. № 16. P. 3888.
Cowie J.M.G., Swinyard B. // Polymer. 1990. V. 31. № 8. P. 1507.
Сафронов А.П., Тагер А.А., Королева Е.В. // Высокомолек. соед. Б. 1996. Т. 38. № 5. С. 900.
Краткий справочник физико-химических величин / Под ред. К.П. Мищенко, А.А. Равделя. Л.: Химия, 1974.
Белоусов В.П., Панов М.Ю. Термодинамика водных растворов неэлектролитов. Л.: Химия, 1983.
Слюсаров И.Т. // Высокомолек. соед. 1962. Т. 4. № 4. С. 619.
Липатов Ю.С., Зубов П.И., Андрющенко Е.А. // Высокомолек. соед. 1959. Т. 1. № 3. С. 425.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)