Высокомолекулярные соединения (серия А), 2020, T. 62, № 1, стр. 35-45
ВЗАИМОДЕЙСТВИЕ ТРОЙНОГО КОМПЛЕКСА КОЛЛОИД–ЛИПОСОМА–БЕЛОК С БИОЛОГИЧЕСКОЙ МЕМБРАНОЙ
А. В. Сыбачин a, *, Д. А. Степанова b, Н. С. Мелик-Нубаров a, А. А. Ярославов a
a Московский государственный университет имени М.В. Ломоносова. Химический факультет
119991 Москва, Ленинские горы, 1–3, Россия
b Московский государственный университет имени М.В. Ломоносова. Факультет наук о материалах
119991 Москва, Ленинские горы, 1–73, Россия
* E-mail: sybatchin@mail.ru
Поступила в редакцию 11.06.2019
После доработки 04.07.2019
Принята к публикации 12.07.2019
Аннотация
Исследовано формирование и свойства комплексов, полученных путем связывания анионных сферических бислойных везикул (липосом) на поверхности катионного носителя – полистирольных микрочастиц с привитыми катионными цепями (сферических поликатионных щеток). Количество предельно адсорбированных липосом зависит от мольной доли анионного липида в липосомальной мембране ν и уменьшается с 49 для липосом с ν = 0.1 до 25 для липосом с ν = 0.3. Предельно нагруженные (насыщенные) липосомами комплексы несут отрицательные заряды, однако они могут дополнительно адсорбировать значительное количество отрицательно заряженного белка (альбумина). Тройные комплексы щетка–липосома–белок способны взаимодействовать с отрицательно заряженными липидными бислоями, нанесенными на поверхность борсиликатных микросфер. Полученные результаты представляют интерес для понимания поведения мультилипосомальных носителей лекарственных веществ в биологическом окружении и, в частности, для прогнозирования их взаимодействия с клетками.
ВВЕДЕНИЕ
Сферические бислойные везикулы (липосомы) нашли широкое применение в медицине и биологии в качестве носителей биологически активных (лекарственных) веществ [1–3]. Разработаны лакарственные формы противомикробных, противовирусных и противогрибковых препаратов [4–6], которые обеспечили прогресс в лечении ряда тяжелых заболеваний. Несмотря на достигнутые успехи, многие социально значимые болезни демонстрируют высокую сопротивляемость действию традиционных, в том числе липосомальных лекарств [7, 8], что требует проведения комбинированной терапии с участием нескольких лекарств в дозировках, подобранных для конкретного пациента. Использование смеси липосомальных форм, каждая из которых заполнена индивидуальным лекарством, может привести к неравномерному распределению лекарств в кровотоке и ослабить комбинированное (синергетическое) действие смешанной рецептуры в целевой области. В ряде работ описаны удачные попытки объединения нескольких лекарств в одном липосомальном контейнере [9, 10]. Однако сложность заполнения липосом различными и часто плохо совместимыми лекарствами делает такой подход малоперспективным.
Возможное решение этой проблемы заключается в формировании мультилипосомального контейнера (МЛК), состоящего из нескольких типов липосом, каждый из которых заполнен определеннным лекарством. В литературе обсуждаются два способа получения таких контейнеров: “закрытый” через in situ получение микрочастиц, в ходе которого происходит их заполнение липосомами [11], и “открытый” в результате неспецифической или специфической сборки заранее синтезированных компонентов в частицы микрометрового размера [12, 13].
В рамках “открытого” способа МЛК может быть получен путем электростатической адсорбции анионных липосом на поверхности катионного полимерного/коллоидного носителя [14–16]. В данном случае открывается возможность регулировать соотношение инкапсулируемых в МЛК лекарств путем подготовки смеси липосом нужного состава и последующей ее адсорбции на поверхности носителя [16]. При этом следует иметь в виду, что после попадания в биологическую жидкость электростатически стабилизированный МЛК будет вступать во взаимодействие с растворенными в ней многозарядными компонентами, прежде всего с белками (альбуминами), что может привести к его дестабилизации (диссоциации, перекомплексованию и т.д.) и отразиться на эффективности его терапевтического действия. Открытым остается вопрос и о механизме взаимодействия МЛК с биологической мембраной.
В настоящей работе описано формирование МЛК, полученных адсорбцией липосом с разным содержанием анионного липида на поверхности коллоидных частиц с привитыми поликатионными цепями – сферических поликатионных щеток (СК+), связывание МЛК отрицательно заряженного альбумина и взаимодействие комплекса МЛК–альбумин с биологической мембраной (липидным бислоем), нанесенной на поверхность борсиликатных микросфер. Полученные результаты важны для понимания поведения МЛК в реальных биологических жидкостях (например, в крови), интерпретации результатов клеточных экспериментов с участием МЛК и понимания перспектив практического использования мультилипосомальных конструкций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
СК+ были получены прививочной полимеризацией катионного мономера аминоэтилметакрилат гидрохлорида на поверхности монодисперных полистирольных частиц диаметром 85 нм [17]. Концентрацию СК+ определяли электрофоретическим титрованием раствора СК+ раствором полистиролсульфокислоты известной концентрации, следуя описанной ранее методике [18], и выражали в молях протонированных аминогрупп (аминосодержащих звеньев) в литре раствора [СК+]. Флуоресцентно меченные СК+ (СК+-ФИТЦ), полученные модификацией поликатионных щеток флуоресцеинизотиоцианатом (ФИТЦ) [19], содержали в среднем одну метку на 20 аминогрупп.
Электронейтральный (цвиттер-ионный) диолеилфосфатидилхолин (ДОФХ)
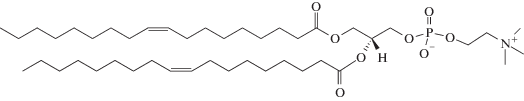 ,
,
анионный диолеилфосфатидилглицерол (ДОФГ)
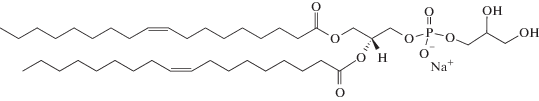
и флуоресцентно меченный липид, аммониевую соль диолеилфосфоэтаноламин-N-лиссамин родамин Б сульфонила (РФЭ)
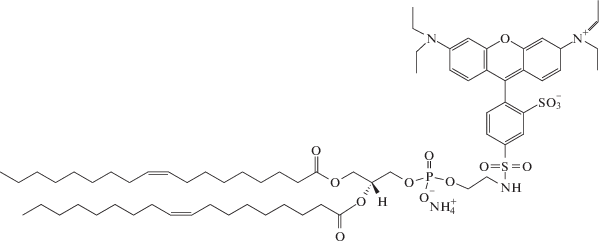
фирмы “Avanti”, бычий сывороточный альбумин (БСА) и ФИТЦ-меченный бычий сывороточный альбумин (БСА-ФИТЦ) фирмы “Sigma-Aldrich”, трис-метоксиаминометан (Трис), хлорид натрия и хлороформ фирмы “Реахим” (Россия) использовали без дополнительной очистки.
Липосомы получали ультразвуковой обработкой водно-липидной смеси [16]. В круглодонной колбе смешивали рассчитанные объемы раствора ДОФХ и раствора ДОФГ в хлороформе. Затем органический растворитель удаляли на вакуумном роторном испарителе, сформированную липидную пленку диспергировали в 2 мл 10–3 M Трис-буфера с pH 7.0 (2 × 300 с) при постоянном охлаждении водопроводной водой; использовали ультразвуковой диспергатор “Cole-Parmer CP-750”. Липосомы отделяли от титановой пыли на центрифуге и использовали в течение 1 суток. Для получения флуоресцентно меченных липосом к смеси растворов липидов добавляли раствор родамин-меченого РФЭ (0.1 мас. % от общего содержания липидов). Мольная доля анионного ДОФГ в мембране липосом ν = [ДОФГ]/([ДОФГ] + + [ДОФХ]) составляла от 0.1 до 0.3. Средний размер липосом, определенный методом динамического светорассеяния, менялся от эксперимента к эксперименту, но всегда оставался в пределах 40–60 нм. Концентрацию липосом сл выражали в мг/мл.
Липидный бислой формировали на поверхности борсиликатных микросфер (БСМ) фирмы “Duke Scientific” со средним размером 4.9 ± ± 0.5 мкм. Процедуру проводили в два этапа. На первом БСМ обезжиривали путем суспендирования в метаноле, отделяли центрифугированием, затем ресуспендировали в 1 М растворе КОН и снова центрифугировали. Осадок БСМ промывали 5 раз дистиллированной водой c электропроводностью 0.6 мкСм/см. На втором этапе 2 мг “активированных” БСМ добавляли к 1 мл 0.2 мг/мл суспензии ДОФХ/ДОФГ (ν = 0.3) липосом в Трис буфере с рН 7.0, полученную смесь перемешивали в течение 30 мин со скоростью 600 об./мин, после чего образцы отмывали 3 раза дистиллированной водой и затем 5 раз Трис буферным раствором.
Гидродинамическмй диаметр частиц в суспензии определяли методом динамического светорассеяния на приборе “Brookhaven Zeta Plus” с фиксированным углом (90°) и термостатируемой ячейкой, электрофоретическую подвижность (ЭФП) частиц методом лазерного микроэлектрофореза на приборе “Brookhaven Zeta Plus”.
Интенсивность флуоресценции измеряли на флуориметре F-4000 (“Hitachi”): в суспензии флуоресцентно меченных липосом при λэм = 591 нм (λэкст = 530 нм), в суспензии, содержавшей БСА-ФИТЦ, при λэм = 492 нм (λэкст = 525 нм).
Концентрацию БСА находили спектрофотометрически на спектрофотометре “Hitachi UV-mini 1240” при длине волны 280 нм, принимая значение коэффициента экстинкции равным 40 700 моль/(см л), определенного по калибровочной прямой.
Микрофотографии БСМ с нанесенными липидными бислоями в отсутствие и в присутствии МЛК получали на флуоресцентном микроскопе Люм-1 (“Альтами”, Россия) с фотокамерой Canon, используя программное обеспечение для удаленной съемки Canon.
В качестве буферного раствора во всех эекспериментах использовали 10-3 М Трис с рН 7.0, дополнительно содержавший 0.15 М NaCl (Трис-NaCl).
На всех графиках приведены значения, полученные усреднением результатов трех–пяти экспериментов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
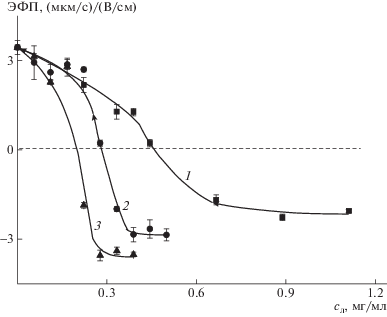
Взаимодействие анионных липосом ДОФХ/ДОФГ с катионными щетками СК+ регистрировали методом микроэлектрофореза, измеряя ЭФП частиц в системе. Добавление суспензии липосом с ν = 0.1 к суспензии СК+ приводило к нейтрализации заряда щеток и появлению отрицательного заряда на их поверхности в избытке липосом (рис. 1, кривая 1). Аналогичный профиль имели зависимости ЭФП частиц в системе от концентрации двух других типов липосом с ν = 0.2 (кривая 2) и 0.3 (кривая 3). Нейтрализующие концентрации липосом (в расчете на сумму нейтрального и анионного липидов ДОФХ + ДОФГ) прогрессивно уменьшались при переходе от ν = = 0.1 к ν = 0.2 и далее к ν = 0.3 (0.48, 0.29 и 0.17 мг/мл соответственно), при этом нейтрализующие концентрации анионного ДОФГ отличались незначительно и укладывались в интервал (7.0 ± 0.6) × 10–4 моль/л. Последнее обстоятельство указывало на доминирующую роль электростатических взаимодействий в формировании комплексов анионных липосом с катиоными щетками. Повышение содержания анионного липида в мембране сопровождалось увеличением отрицательного заряда комплекса щетка–липосома предельного состава (рис. 1).
Рис. 1.
Зависимость ЭФП комплекса СК+ и липосом ДОФХ/ДОФГ от концентрации добавленных липосом. [СК+] = = 1 × 10–4 моль/л, 10–3 М; ν = 0.1 (1), 0.2 (2) и 0.3 (3). Здесь и на рис. 2–7: Трис рН 7.0, с = 0.01 моль/л.
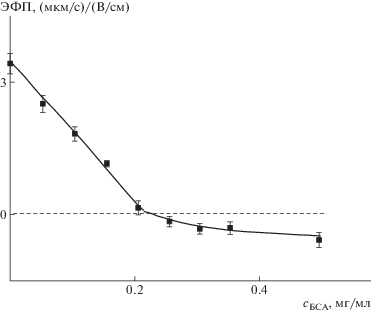
Изоэлектрическая точка БСА pI = 4.6 [20]. В Трис-буфере с рН 7.0 ЭФП белковых глобул равна –1.21 ± 0.6 (мкм/с)/(В/см), что позволяет им адсорбироваться на поверхности катионных щеток. На рис. 2 представлена зависимость ЭФП комплексов СК+/БСА от концентрации добавленного белка. Как и в случае анионных липосом ДОФХ/ДОФГ, добавление БСА к суспензии СК+ приводило к нейтрализации заряда щеток, в избытке белка комплекс СК+/БСА приобретал положительный заряд. Таким образом, отрицательно заряженный БСА адсорбировался на поверхности СК+ в Трис-буферном растворе и, следовательно, мог выступать конкурентом анионным липосомам за связывание с катионными щетками.
Рис. 2.
Зависимость ЭФП комплекса СК+ и БСА от концентрации добавленного белка. $с_{{{\text{СК}}}}^{ + }$ = 1 × 10–4 моль/л, 10–3 М.
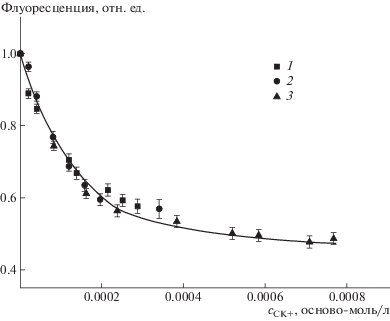
Для исследования конкуренции в тройной системе щетка–липосома–БСА был использован метод флуоресценции. Для этого были приготовлены липосомы ДОФХ/ДОФГ с разного состава анионного ДОФГ, содержавшие 0.1 мас. % флуоресцентно меченного липида РФЭ. Добавление СК+ к суспензиям всех типов липосом приводило к формированию комплексов СК+/липосома и уменьшению интенсивности флуоресценции метки (рис. 3). Полученные зависимости описывались одной кривой, что отражало повышенное сродство метки к катионным звеньям полиамина [21].
Рис. 3.
Зависимость относительной флуоресценции комплексов меченных липосом ДОФХ/ДОФГ/РФЭ от концентрации добавленных щеток. сл = 1 мг/мл; ν = 0.1 (1), 0.2 (2) и 0.3 (3).
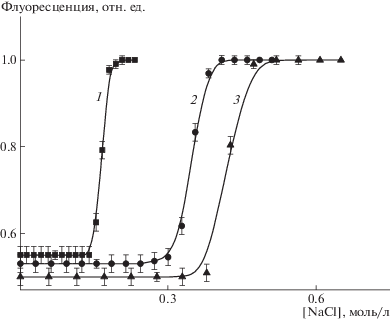
Последующее добавление низкомолекулярной соли (NaCl) к суспензиям комплексов сопровождалось восстановлением флуоресценции до исходного уровня (рис. 4), что указывало на диссоциацию комплексов до исходных компонентов – щеток и липосом – вследствие экранирования их зарядов зарядами низкомолекулярных ионов Na+ и Cl–. Увеличение доли анионного ДОФГ в липосомальной мембране закономерно требовало большей концентрации соли для полной диссоциации комплексов [22], но во всех случаях комплексы сохранялись при концентрации соли 0.15 моль/л, соответствовавшей физиологическим условиям.
Рис. 4.
Зависимость относительной флуоресценции комплексов меченных липосом ДОФХ/ДОФГ/РФЭ с СК+ от концентрации добавленного NaCl. сл = 1 мг/мл; ν = 0.1 (1), 0.2 (2) и 0.3 (3); $с_{{{\text{СК}}}}^{ + }$ ×104 = 3.0 (1), 4.8 (2) и 8.3 моль/л (3).
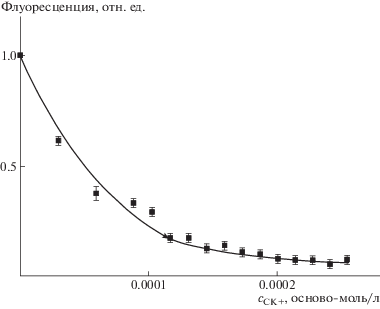
Аналогичный эксперимент был проведен с флуоресцентно меченым БСА. Формирование комплекса СК+/БСА-ФИТЦ вызывало тушение флуоресценции метки (рис. 5), причем предельный уровень флуресценции опускался до 0.1 (в относительных единицах) по сравнению с 0.5 после добавления СК+ к родамин-меченым липосомам ДОФХ/ДОФГ (рис. 3). Бóльшая эффективность тушения в случае меченого белка могла быть связана, во-первых, со способностью белка (5 нм в диаметре) проникать вглубь слоя привитых катионных цепей-тушителей, чего 50 нм липосомы сделать не могли; во-вторых, с различной реакцией ФИЦТ и родамина на взаимодействие с тушителем и другими причинами.
Рис. 5.
Зависимость относительной флуоресценции комплексов СК+/БСА-ФИТЦ от концентрации добавленных щеток. сБСА-ФИТЦ = 0.5 мг/мл.
Добавление раствора хлорида натрия к суспензии комплекса СК+/БСА-ФИТЦ приводило к полной диссоциации комплекса при [NaCl] = 0.3 моль/л (рис. 6); при физиологической концентрации соли 0.15 М комплекс сохранялся в растворе в недиссоциированном виде.
Рис. 6.
Зависимость относительной флуоресценции комплексов БСА-ФИТЦ/СК+ от концентрации добавленного NaCl. сБСА-ФИТЦ = 0.5 мг/мл, $с_{{{\text{СК}}}}^{ + }$ = 2.5 × 10–4 моль/л.

Таким образом, оба комплекса, СК+/липосома и СК+/белок, сохраняли устойчивость в физиологическом растворе с рН 7.0 и [NaCl] = = 0.15 моль/л. Это обстоятельство следовало учесть при обсуждении возможных последствий введения мультилипосомального контейнера СК+/липосома в биологическую жидкость с высоким содержанием белка. Во всех последующих экспериментах в качестве дисперсионной среды был использован буферный раствор Трис с рН 7,0, дополнительно содержавший 0.15 М раствор хлорида натрия.
Способность БСА вытеснять липосомы из их комплекса с СК+ была исследована в ходе следующего эксперимента. Родамин-меченые липосомы были добавлены к СК+ в таком количестве, чтобы сформировать комплексы, максимально насыщенные белком (комплексы предельного состава). В полученных комплексах флуоресценция родамина была частично затушена (рис. 7а). Вытеснение липосом из комплексов за счет конкурентной адсорбции БСА, если бы таковое имело место, должно было привести к полному или частичному восстановлению флуоресценции родаминовой метки. Результаты, представленные на рис. 7б, свидетельствуют об отсутствии возгорания флуоресценции в суспензии комплекса СК+/меченые липосомы даже при значительном избытке БСА, указывая тем самым на неспособность отрицательно заряженных белковых глобул вытеснить отрицательно заряженные липосомы из их комплексов с катионными щетками.
Рис. 7.
Зависимость относительной флуоресценции меченных липосом ДОФХ/ДОФГ от концентрации добавленных щеток (а) и относительной флуоресценции комплексов меченных липосом ДОФХ/ДОФГ с СК+ от концентрации добавленного БСА (б). сл= 1 мг/мл; ν = 0.1 (1), 0.2 (2) и 0.3 (3); сБСА-ФИТЦ = 0.5 мг/мл, [NaCl] = 0.15 моль/л.
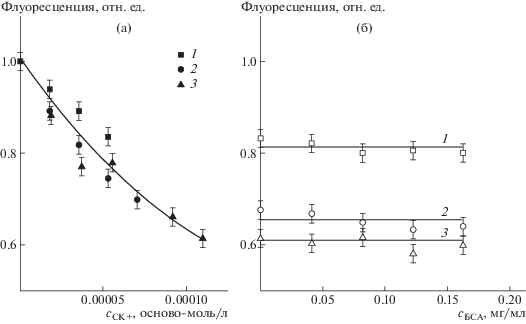
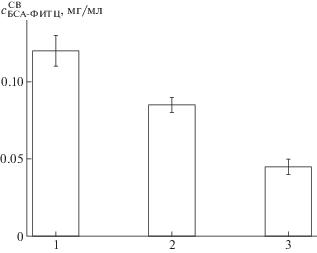
Происходит ли при этом дополнительно адсорбция БСА на поверхности СК+, максимально заполненной анионными липосомами? Для ответа на этот вопрос суспензии насыщенных комплексов СК+ и липосом с различным содержанием анионного липида (с ν = 0.1, 0.2 и 0.3) титровали раствором ФИТЦ-меченого БСА. Не сязавшийся с комплексами белок отделяли центрифугированием и определяли его концентрацию в супернатантах, измеряя оптическую плотность растворов при 494 нм. Во всех трех случах белок полностью связывался с комплексом вплоть до некоторой предельной концентрации БСАмакс, после чего начинал накапливаться в растворе. Зависимость БСАмакс от ν, представленная на рис. 8, указывает на связывание белка со всеми тремя комплексами СК+/липосома. Максимальное количество белка адсобировалось на комплексе с участием липосом ν = 0.1 и затем прогрессивно уменьшалось для комплексов с бóльшим содержанием анионного липида.
Кажется вполне очевидным, что способность отрицательно заряженного белка связываться с насышенным комплексом СК+/липосома зависит (по крайней мере) от двух факторов: наличия свободной (не занятой липосомами) поверхности СК+ и от величины отрицательного заряда насыщенного комплекса СК+/липосома или, что то же, предельного отрицательного значения ЭФП насыщенного комплекса ЭФПпред.
Состав комплекса или предельное количество липосом N, способных связаться с одной поликатионной щеткой, можно оценить по результатам элекрофоретического титрования суспензии СК+ суспензиями липосом (рис. 1). Последовательная адсорбция новых порций липосом приводит к непрерывному изменению ЭФП частиц в системе. При некоторой концентрации липосом адсорбция завершается, и ЭФП комплекса СК+/липосома достигает своего предельного отрицательного значения ЭФПпред. Как следует из литературных данных [23–27], такая схема описывает взаимодействие противоположно заряженных макроионов: линейных полимеров, мицелл, липосом, коллоидов. Используя флуоресцентно меченные липосомы в соответствии с описанной нами ранее методикой [18], были оценены концентрации липосом, предельно связывающиеся с СК+. Проделанные нами расчеты для липосом со средним диаметром 50 нм привели к следующим значениям N и свободной доли поверхности СК+, не занимаемой адсорбированными липосомами φ: 49 и 0.31 для липосом с ν = 0.1; 38 и 0.47 для липосом с ν = 0.2; 25 и 0.65 для липосом с ν = 0.3. Таким образом, значение φ увеличивается с ростом ν, и потому мы могли бы ожидать увеличения количества связанного БСА по мере повышения содержания анионного липида в адсорбированных липосомах. Однако результаты, представленные на рис. 8, свидетельствуют об обратном: связывание БСА уменьшается с ростом ν.
Второй упомянутый фактор – предельное отрицательное значение насыщенного комплекса ЭФПпред – должен препятствовать связыванию с комплексом отрицательно заряженного БСА. Такое противодействие должно увеличиваться с ростом ЭФПпред, которая в свою очередь увеличивается с повышением содержания анионного липида ν. Именно это мы и наблюдали в эксперименте (рис. 8), что указывало на определяющую роль заряда насыщеннего комплекса СК+/липосома в связывании отрицательно заряженного БСА.
Размер (гидродинамический диаметр) насыщенного комплекса СК+/липосома в избытке БСА мало зависел от содержания анионного липида в липосомальной мембране и для всех исследованных комплексов лежал в интервале 240 ± ± 20 нм.
Будучи добавленными в биологическую жидкость, отрицательно заряженные частицы комплексов должны взаимодействовать с клетками, мембраны которых тоже несут отрицательный заряд. Возможно ли такое взаимодействие и, если да, то каков его вероятный механизм?
Для прояснения ситуации был использован насыщенный тройной комплекс, приготовленный из СК+ и липосом ν = 0.1 в избытке БСА. Такой комплекс содержал наибольшее количество липосом и потому был наиболее интересен с точки зрения потенциального использования в качестве мультилипосомальных носителей лекарственных веществ. Полученный комплекс добавляли к борсиликатным микросферам с нанесенным липидным бислоем, последние выступали в качестве модели клеточной мембраны.
За взаимодействием тройного комплекса с микросферами следили с помощью метода флуоресцентной микроскопии. Чтобы независимо следить за судьбой катионного носителя СК+ и анионных липосомальных контейнеров, использовали СК+, модифицированные ФИТЦ, и родамин-меченые липосомы ДОФХ/ДОФГ. Первые давали зеленое свечение при использовании синего фильта, вторые – красное свечение при использовании зеленого фильтра.
В эксперименте 0.3 мл суспензии тройного комплекса в Трис-буфере с рН 7.0 и концентрацией хлорида натрия 0.15 моль/л добавляли к 0.2 мл суспензии БСМ с нанесенным липидным бислоем, смесь перемешивали в течение 5 мин, после чего 10 мкл смеси наносили на препаративное стекло и закрывали покровным стеклом. На микрофотографии, полученной в оптическом режиме (рис. 9), видны частицы диаметром около 5 мкм, что соответствует диаметру БСМ (см. выше). Тройной комплекс диаметром 240 нм не был виден в оптическом режиме.
Рис. 9.
Микрофотографии комплексов СК+/ФИТЦ/липосомы с родаминовой меткой БСМ, покрытых липидными мембранами, в оптическом режиме (а), в флуоресцентном режиме, синий фильтр (λвозб = 420–485 нм) (б) и в флуоресцентном режиме, зеленый фильтр (λвозб = 460–550 нм) (в). Пояснения в тексте. Цветные рисунки можно посмотреть в электронной версии.
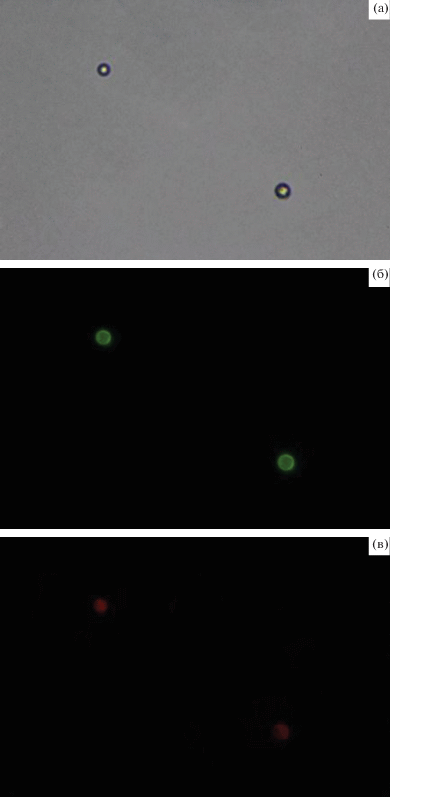
Дополнительные детали удалось различить после того, как микроскоп был переведен во флуоресцентный режим работы. Использование синего фильтра позволило зарегистрировать зеленое свечение на поверхности БСМ характерное для флуоресценции СК+/ФИТЦ (рис. 9б), использование зеленого фильтра – красное свечение родамин-меченых липосом (рис. 9в). Таким образом, и СК+, и липосомы находились на поверхности БСМ. Иными словами, отрицательно заряженый тройной комплекс СК+/липосома/белок достигал отрицательно заряженной поверхности БСМ с нанесенным липидным бислоем и закреплялся на ней.
Можно высказать некоторые соображения относительно движущих сил и механизма взаимодействия отрицательно заряженного тройного комплекса (мультилипосомального контейнера) с отрицательно заряженной биологической (липидной) мембраной на поверхноости БСМ (схематически процессы представлены на рис. 10). Это взаимодействие начинается со случайного соударения двух частиц: комплекса и БСМ. Большие массы обоих компонентов помогают им преодолеть электростатическое расталкивание, обусловленное наличием одноименных (отрицательных) зарядов на их поверхности. Весьма вероятно, что соударение инициирует цепь событий: вытеснение части липосом и белка в раствор, разрушение части липосом, переход части липидов из липосом в нанесенный липидный бислой и т.д. В результате на поверхности тройного комплекса возникают нескомпенсированные положительные заряды, с помощью которых он закрепляется на отрицательно заряженном бислое, нанесенном на поверхность БСМ. Экспериментальные данные (рис. 9б, 9в) свидетельствуют о том, что значительная часть катионного носителя и липосом достигает поверхности липидной мембраны. Точное количество липосом с иммобилизованным лекарством, связавшихся с липидной мембраной, может быть установлено в ходе дополнительных экспериментов. Однако уже сейчас ясно, что отрицательно заряженный мультилипосомальный комплекс может доставлять лекарственнное вещество к отрицательно заряженной биологической мембране. Аналогичный механизм доставки лекарства должен работать и в случае введения мультилипосомального комплекса в суспензию клеток.
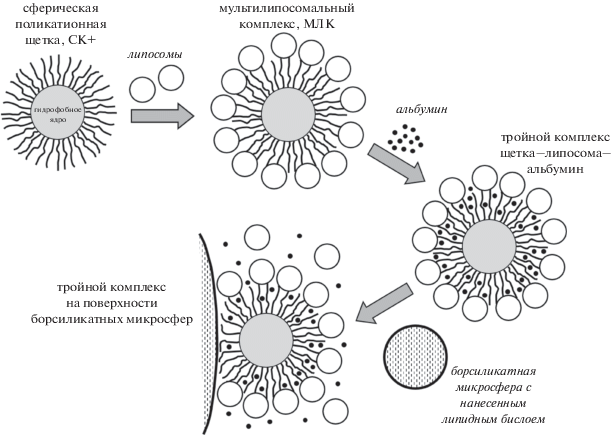
Рис. 10.
Схематическое представление основных разделов исследования: формирование МЛК, связывание МЛК с отрицательно заряженным альбумином и взаимодействие комплекса МЛК-альбумин с липидным бислоем, нанесенной на поверхность борсиликатных микросфер.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 17-03-00433).
Список литературы
Holzschuh S., Kae K., Bossa G.V., Decker C., Fahr A., May S. // J. Liposome Res. 2018. V. 28. P. 22.
Zahednezhad F., Saadat M., Valizadeh H., Zakeri-Milani P., Baradaran B. // J. Control. Release. 2019.
Li M., Du C., Guo N., Teng Y., Meng X., Sun H., Li S., Yu P., Galons H. // Eur. J. Med. Chem. 2019. V. 164. P. 640.
Aytekin A.A., Tanrıverdi S.T., Aydın Köse F., Kart D., Eroğlu İ., Özer Ö. // J. Liposome Res. 2019.
Kozhikhova K.V., Ivantsova M.N., Tokareva M.I., Shulepov I.D., Tretiyakov A.V., Shaidarov L.V., Rusinov V.L., Mironov M.A. // Pharm. Dev. Technol. 2018.V. 4. P. 334.
Deygen I.M., Seidl C., Kölmel D., Bednarek C., Heissler S., Kudryashova E.V., Bräse S., Schepers U. // Langmuir. 2016. V. 32. P. 10861.
Rello J., Parisella F.R., Perez A. // Expert Rev. Clin. Pharmacol. 2019.
Mu L.M., Ju R.J., Liu R., Bu Y.Z., Zhang J.Y., Li X.Q., Zeng F., Lu W.L. // Adv. Drug Deliv. Rev. 2017. V. 115. P.46
Saw P.E., Park J., Jon S., Farokhzad O.C. // Nanomedicine. 2017. V. 13. P. 713
Tavano L., Muzzalupo R. // Colloid. Surf. B. 2016. V. 147. P. 161.
Chiang H., Huang Y.-C., Yeh H.-Y., Yeh S.-Y., Huang Y.-Y. // Biomed. Eng., Appl. Basis Commun. 2009. V. 21. P. 107.
García-Jimeno S., Estelrich J., Callejas-Fernández J., Roldán-Vargas S. // Nanoscale. 2017. V. 9. P. 15131.
Hayward S.L., Francis D.M., Sis M.J., Kidambi S. // Sci. Rep. 2015. V. 5. P. 14683.
Yaroslavov A.A., Panova I.G., Sybachin A.V., Spiridonov V.V., Zezin A.B., Mergel O., Gelissen A., Tiwari R., Plamper F., Richtering W., Menger F.M. // Nanomedicine. 2017. V. 13. P. 1491.
Sybachin A.V., Khlynina P.O., Spiridonov V.V., Panova I.G., Melik-Nubarov N.S., Yaroslavov A.A. // Polym. Int. 2018. V. 67. P. 1352.
Yaroslavov A.A., Sybachin A.V., Zaborova O.V., Zezin A.B., Talmon Y., Ballauff M., Menger F.M. // Adv. Colloid Interface Sci. 2015. V. 226. P. 54.
Guo X., Zhao K. //J. Phys., Condens. Matter. 2017. V. 29. P. 295101.
Yaroslavov A.A., Sybachin A.V., Zaborova O.V., Zezin A.B., Talmon Y., Ballauff M., Menger F.M. // Adv. Colloid Interface Sci. 2015. V. 226. P. 54.
Nam E.V., Zhirnov A.E., Litmanovich E.A., Melik-Nubarov N.S., Grozdova I.D. // Polymer Science A. 2010. V. 52. № 9. P. 907.
Generalova A.N., Zubov V.P. // Polymer Science B. 2016. V. 58. № 4. P. 385.
Izumrudov V.A. // Usp. Khim. 2008. V. 77. P. 401.
Yaroslavov A.A., Efimova A.A., Sybachin A.V., Izumrudov V.A., Samoshin V.V., Potemkin I.I. // Colloid J. 2011. V. 73. P. 430.
Kulikouskaya V.I., Lazouskaya M.E., Agabekov V.E. // Theor. Exp. Chem. 2019. V. 54. P. 375.
Yaroslavov A.A., Efimova A.A., Sybachin A.V., Chva-lun S.N., Kulebyakina A.I., Kozlova E.V. // RSC Adv. 2015. V. 5. P. 31460.
Panova I.G., Sybachin A.V., Spiridonov V.V., Kydralieva K., Jorobekova S., Zezin A.B., Yaroslavov A.A. // Geoderma. 2017. V. 307. P. 91.
Efimova A.A., Sybachin A.V., Yaroslavov A.A. // Polymer Science C. 2011. V. 53. № 1. P. 89.
Walta S., Pergushov D.V., Oppermann A., Steinschulte A.A., Geisel K., Sigolaeva L.V., Plamper F.A., Wöll D., Richtering W. // Polymer. 2017. V. 119. P. 50.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)