Высокомолекулярные соединения (серия А), 2020, T. 62, № 3, стр. 163-169
ГИДРОДИНАМИЧЕСКИЕ И КОНФОРМАЦИОННЫЕ СВОЙСТВА БУТАДИЕН-НИТРИЛЬНЫХ КАУЧУКОВ В РАСТВОРАХ В СЛОЖНЫХ ЭФИРАХ
Ю. А. Наумова a, Л. А. Колесова a, С. Г. Карпова b, *, Л. Р. Люсова a, С. В. Котова a, А. А. Попов b
a “МИРЭА – Российский технологический университет”
(Институт тонких химических технологий им. М.В. Ломоносова)
119454 Москва, пр. Вернадского, 78, Россия
b Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: karpova@sky.chph.ras.ru
Поступила в редакцию 22.04.2019
После доработки 17.09.2019
Принята к публикации 14.10.2019
Аннотация
Вискозиметрическим методом исследованы разбавленные растворы бутадиен-нитрильных каучуков в толуоле, метилацетате, этилацетате и бутилацетате. Каучуки были получены с использованием парафинатных эмульгаторов, имели одинаковое содержание нитрила акриловой кислоты и разные молекулярные массы. Оценено влияние молекулярной массы каучука и природы растворителя на характеристическую вязкость [η], визкозиметрические константы Хаггинса k' и Крамера k'', гидродинамический объем макромолекулы, среднеквадратичное расстояние между концами макромолекулы. На основании этих данных выявлены закономерности изменения термодинамического качества растворителей по отношению к бутадиен-нитрильным каучукам, которые подтверждены результатами измерения статического светорассеяния.
ВВЕДЕНИЕ
Бутадиен-нитрильные каучуки (БНК) являются каучуками специального назначения, которые широко применяются в различных отраслях промышленности [1, 2]. Проведенный анализ рынка синтетических каучуков в России и за рубежом показывает, что данная группа каучуков является самой обширной по марочному ассортименту и объемам производства среди высокотехнологичных полимеров [2, 3]. БНК в качестве полимерной основы эластомерных материалов демонстрируют конкурентоспособное сочетание технико-экономических показателей среди каучуков как общего, так и специального назначения [1–5].
С внедрением “зеленых” технологий на предприятиях синтетических каучуков в России за последние 20 лет произошло существенное изменение марочного состава БНК. Оно связано, прежде всего, с переходом от некалевых (СКН) и сульфонатных (СКН-С) бутадиен-нитрильных каучуков к более экологичным парафинатным маркам (БНКС) [2, 3, 5, 6].
В связи с этим, проводятся фундаментальные и прикладные исследования, направленные на изучение влияния условий синтеза БНК на структуру и свойства эластомерных материалов на их основе [6–10]. С учетом перспективности применения бутадиен-нитрильных каучуков для производства композиционных материалов, получаемых переработкой растворов полимеров, например клеев и герметиков [6, 11], в данной работе изучено реологическое поведение растворов БНК в зависимости от природы растворителя. Проведена оценка растворяющей способности сложных эфиров и средневязкостной молекулярной массы “парафинатных” БНК, на основании гидродинамических свойств разбавленных растворов охарактеризованы термодинамическое качество растворителей и характер взаимодействия полимер–растворитель.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Исследовали разбавленные растворы промышленных марок бутадиен-нитрильных каучуков БНКС-28АН и БНКС-28АМН (ТУ 38.30313-2006) в следующих растворителях: толуол, метилацетат, этилацетат, бутилацетат. Цифры в названии марки полимера соответствуют содержанию нитрила акриловой кислоты в исходной смеси мономеров. Сополимеры с содержанием акрилонитрила от 26 до 28% наиболее широко используются в производстве резинотехнических изделий благодаря достижению компромисса свойств по масло-, бензо- и морозостойкости эластомерных материалов на их основе [1–6]. Каучуки данных марок имеют разную молекулярную массу и отличаются по регламентируемому показателю вязкости по Муни. Каучук марки БНКС-28АМН является “мягким” и обладает меньшей ММ по сравнению с “жестким” каучуком марки БНКС-28АН.
Метилацетат (ТУ 2435-063-00203766-2001), этилацетат (ТУ 2634-037-44493179-99, ГОСТ 8981-78) и бутилацетат (ГОСТ 8981-78) квалификации х.ч. представляют один и тот же гомологический ряд сложных эфиров. В настоящее время они востребованы предприятиями для изготовления адгезионных композиций и других полимерных композиционных материалов, получаемых переработкой растворов полимеров. Толуол использовали при изготовлении растворов для определения средневязкостной ММ бутадиен-нитрильных каучуков, так как для данной системы полимер–растворитель известны константы К и α в уравнении Марка–Куна–Хаувинка [2, 13]. Некоторые физико-химические показатели растворителей представлены в табл. 1.
Таблица 1.
Физико-химические свойства растворителей [14]
| Растворитель | δ, (МДж/м3)1/2 | ρ, г/см3 (25°С) | М | Предельно допустимая концентрация, мг/м3 | Летучесть* |
|---|---|---|---|---|---|
| Метилацетат | 18.9 | 0.933 | 74.08 | 100 | 2.2 |
| Этилацетат | 18.6 | 0.899 | 88.11 | 200/50 | 2.9 |
| Бутилацетат | 17.3 | 0.881 | 116.16 | 200/50 | 11.8 |
| Толуол | 18.2 | 0.862 | 92.14 | 150/50 | 6.1 |
Образцы готовили путем последовательного разбавления раствора с концентрацией 1.0–0.8 г/дл с шагом 0.1 г/дл. Перед проведением испытаний растворители и растворы каучуков фильтровали.
МЕТОДЫ ИССЛЕДОВАНИЯ
Вискозиметрические исследования растворов полимеров проводили при 25°С с помощью вискозиметра Оствальда “ВПЖ-2” с диаметром капилляра 0.56 мм. Перед началом измерений растворы термостатировали в течение 15 мин. Измерение времени истечения каждого раствора проводили 3 раза с точностью ±0.1 с.
Средневязкостную молекулярную массу полимеров ${{М}_{\nu }}$ бутадиен-нитрильных каучуков определяли по уравнению Марка–Куна–Хаувинка [15, 16]:
где [η] – характеристическая вязкость раствора БНК в толуоле; К и α – вискозиметрические константы; К = 49 × 10–3 дл/г, α = 0.64 [2, 13].Растворяющую способность растворителей ряда сложных эфиров по отношению к бутадиен-нитрильному каучуку оценивали по методу атомных констант [17, 18]. Для этого на основании химического строения мономерного звена сополимера и растворителей рассчитали параметр растворимости, поверхностное натяжение и мольный объем. Бутадиен-нитрильный каучук рассматривали как тройной сополимер, состоящий из полибутадиена-1,4 (62.1 мол. %), полибутадиена-1,2 (9.5 мол. %) и нитрила акриловой кислоты (28.4 мол. %) [2, 3].
Согласно методу атомных констант, условием растворяющей способности низкомолекулярной жидкости является преобладание работы, совершаемой силами поверхностного натяжения, над энергией разрыва межмолекулярных связей в полимере. Данное условие выражается через параметры А и В, определяемые как
(2)
$\begin{gathered} A = \frac{{{\delta }_{{\text{п}}}^{2}}}{{{\delta }_{{\text{Р}}}^{2}}}, \\ B = 2{\rho Ф}({\text{Ф}} - \sqrt {{{{\text{Ф}}}^{2}} - 1 + ({{{\gamma }}_{{{\text{рп}}}}}{\text{/}}{{{\gamma }}_{{\text{р}}}})} ), \\ \end{gathered} $Характеристическую вязкость рассчитывали на основании уравнений Хаггинса и Крамера [16, 19]:
(3)
$\begin{gathered} {{{\eta }}_{{{\text{уд}}}}}{\text{/}}с = \left[ {\eta } \right] + k{\text{'}}{{\left[ {\eta } \right]}^{2}}с, \\ {\text{ln}}({{{\eta }}_{{{\text{отн}}}}}){\text{/}}с = \left[ {\eta } \right] - k{\text{''}}{{\left[ {\eta } \right]}^{2}}с \\ \end{gathered} $Здесь ηуд– удельная вязкость, ηотн– относительная вязкость; k' и k'' – константы Хаггинса и Крамера соответственно; с – концентрация полимера в растворе, г/дл.
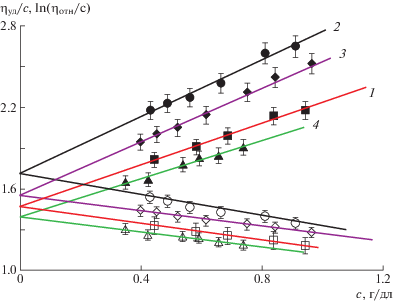
Зависимости ηуд/с и ln(ηотн)/с от концентрации полимера в растворе приведены на рис. 1. Их экстраполировали до с = 0, и по отрезку, отсекаемому прямыми на оси ординат, определяли значение [η] для каждой системы БНК–растворитель; наклоны прямых, отвечающие величинам k'[η]2 и k''[η]2, использовали для нахождения k' и k''.
Рис. 1.
Отношение ηуд/с (темные точки) и ln(ηотн/с) (светлые) в зависимости от концентрации растворов БНКС-28АН в метилацетате (1), этилацетате (2), бутилацетате (3) и толуоле (4) при 25°С.
Размеры макромолекулярных клубков характеризовали среднеквадратичным расстоянием между концами макромолекул ${{\langle ~\bar {h}_{{}}^{2}\rangle }^{{1/2}}}$ [16, 20–22]. Считая, что формула Флори и Фокса [15] для вязкости полимера в θ-растворителе справедлива для раствора полимера в хорошем растворителе, величину ${{\langle \bar {h}_{{}}^{2}\rangle }^{{1/2}}}$ определяли из соотношения [20, 22]:
(4)
$\left[ {\eta } \right] = \frac{{{\Phi }~{{{\alpha }}^{3}}{{{\langle \bar {h}_{{\theta }}^{2}\rangle }}^{{3/2}}}}}{M} = \frac{{{\Phi }~{{{\langle {{{\bar {h}}}^{2}}\rangle }}^{{3/2}}}}}{M},$Гидродинамический объем макромолекулы полимера Vмп вычисляли по формуле:
Здесь Rмп – гидродинамический радиус макромолекул в явлении вращательного трения, который вычисляли согласно выражению [24]
(7)
${{R}_{{{\text{мп}}}}} = {{\left( {3[{\eta }]~{{M}_{\nu }}{\text{/}}10{\pi }~{{N}_{А}}} \right)}^{{1/3}}},$Второй вириальный коэффициент А2 находили методом статического светорассеяния с помощью анализатора частиц “LitesizerTM 500” (“Anton Paar”), используя уравнение Дебая:
где K – оптическая постоянная раствора, Rθ – коэффициент рассеяния, М – молекулярная масса полимера, с – концентрация раствора [16].На основании зависимости $\frac{{Kc}}{{{{R}_{{}}}}} = f\left( c \right)$, как отрезок, отсекаемый на оси ординат, вычисляли средневесовую молекулярную массу БНК Мw, а по тангенсу угла наклона зависимости – удвоенный второй вириальный коэффициент. Растворы исследовали в диапазоне концентрации от 0.1 до 0.5 г/дл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С помощью уравнения Марка–Куна–Хаувинка (1) и экспериментальных данных по характеристической вязкости растворов БНК в толуоле были определены средневязкостные молекулярные массы двух образцов полимера. Для каучука марки БНКС-28АН ${{М}_{\nu }}$ составила 24.8 × 104, для БНКС-28АМН – 13.9 × 104. Согласно результатам статического светорассеяния средневесовая молекулярная масса Мw выше, чем ${{М}_{\nu }}$. В зависимости от применяемого растворителя полученный диапазон Мw составил для БНКС-28АН – (26.5–28.3) × 104, БНКС-28АМН – (14.8–15.6) × 104.
Оценка растворяющей способности сложных эфиров по методу атомных констант показала, что для сополимера бутадиена и нитрила акриловой кислоты при содержании последнего в сополимере 28 маc. % данные жидкости являются растворителями (табл. 2). Результаты расчета согласуются с экспериментальными данными. Прогнозирование растворимости БНК выявило ограниченную растворяющую способность этил- и бутилацетата в зависимости от молекулярной массы полимера. Рассчитанная критическая молекулярная масса БНК составила 24.7 × 104. Этот результат был подтвержден экспериментально для бутилацетата. Так, при изготовлении разбавленных растворов более высокомолекулярного бутадиен-нитрильного каучука марки БНКС-28АН в бутилацетате требовалось не менее 10 суток (Т = 25°С) при интенсивном перемешивании компонентов для достижения полного растворения полимера, что существенно выше, чем в случаях метилацетата и этилацетата.
Таблица 2.
Параметры критерия растворимости БНК в органических растворителях и удельное поверхностное натяжение раствора γ
| Растворитель | А | В | γ, мДж/м2 |
|---|---|---|---|
| Метилацетат | 0.845/0.930 | 0.954/0.954 | 2.286 |
| Этилацетат | 0.841/0.981 | 0.933/0.933 | 2.615 |
| Бутилацетат | 0.952/1.047 | 0.929/0.929 | 3.042 |
На основании виcкозиметрических исследований в работе проведена оценка влияния молекулярной массы БНК и природы растворителя на характеристическую вязкость [η], константы Хаггинса k' и Крамера k'', гидродинамический объем Vпм макромолекул и среднеквадратичное расстояние между концами макромолекул ${{\langle \bar {h}_{{}}^{2}\rangle }^{{\,1/2}}}$ (табл. 3). Данные показатели приведены как средние, по крайней мере, для трех параллельных испытаний. Отметим, что более высокая воспроизводимость экспериментальных данных по [η] и низкие значения относительной ошибки наблюдали для высокомолекулярного каучука БНКС-28АН.
Таблица 3.
Гидродинамические характеристики макромолекул БНК в растворителях различных химических классов при Т = 25°С
| Растворитель | [η], дл/г | k' | k'' | Vпм × 103, нм3 | ${{\langle \bar {h}_{{}}^{2}\rangle }^{{1/2}}}$, нм | A2 × 105, моль см3/г2 | D, нм |
|---|---|---|---|---|---|---|---|
| БНКС-28АМН | |||||||
| Метилацетат | 1.10 ± 0.07 | 0.20 | 0.19 | 10.15 | 42.2 | 0.67 | 0.53 |
| Этилацетат | 1.11 ± 0.07 | 0.24 | 0.18 | 10.27 | 42.3 | 0.79 | 0.64 |
| Бутилацетат | 1.24 ± 0.07 | 0.15 | 0.20 | 11.40 | 43.8 | 0.99 | 0.83 |
| Толуол | 0.96 ± 0.06 | 0.45 | 0.10 | 8.87 | 40.3 | – | – |
| БНКС-28АН | |||||||
| Метилацетат | 1.47 ± 0.04 | 0.35 | 0.13 | 24.26 | 56.5 | 0.53 | 0.96 |
| Этилацетат | 1.72 ± 0.05 | 0.35 | 0.13 | 28.27 | 59.4 | 0.64 | – |
| Бутилацетат | 1.52 ± 0.05 | 0.45 | 0.12 | 25.24 | 57.2 | 0.62 | 1.25 |
| Толуол | 1.40 ± 0.04 | 0.35 | 0.14 | 23.05 | 55.5 | – | – |
В работе [16] показано, что для гибкоцепных полимеров термодинамическое качество растворителя можно оценивать на основании значений [η], поскольку они в этом случае коррелируют со значениями второго вириального коэффициента А2: чем больше А2, тем больше [η]. При сопоставлении характеристических вязкостей для растворов одного и того же образца каучука в разных растворителях проведена качественная оценка их сродства к БНК. Согласно работам [16, 20, 25] предполагалось, что, чем выше [η], тем лучше термодинамическое качество растворителя.
Наибольшим термодинамическим сродством среди рассмотренных растворителей к бутадиен-нитрильному каучуку марки БНКС-28АМН обладает бутилацетат. Его применение обеспечивает более высокие значения [η] и, следовательно, большее набухание макромолекулярного клубка и наименьшую степень ассоциации макромолекул. Согласно полученным данным для БНКС-28АМН термодинамическое качество рассмотренных растворителей улучшается в следующей последовательности: толуол < метилацетат < этилацетат < < бутилацетат. Выявленную закономерность можно объяснить в рамках трехмерной концепции параметра растворимости Гильденбранта, предложенной Хансеном [26].
В рамках этой концепции, оценка взаимодействия полимер–растворитель проводится не только на основании сопоставления численных значений параметра растворимости жидкости и полимера ${\delta }$, но и путем выделения вкладов каждого из трех основных видов межмолекулярного взаимодействия – дисперсионного, полярного и за счет водородных связей [14, 24]:
(9)
${\delta } = {{\left( {\frac{{({{E}_{d}} + {{E}_{p}} + {{E}_{h}})}}{{{{V}_{m}}}}} \right)}^{{1/2}}} = {{({\delta }_{d}^{2} + {\delta }_{p}^{2} + {\delta }_{h}^{2})}^{{1/2}}}$Здесь Ed, Ep, Eh – значения энергии дисперсионного и полярного взаимодействий и взаимодействия за счет водородных связей; δd = = (ΔEd/Vm)1/2 – параметр, учитывающий наличие дисперсионных сил; δp = (ΔEp/Vm)1/2 – параметр, соответствующий полярным (ориентационным) силам; δh = (ΔEh/Vm)1/2 – параметр, отвечающий водородным связям; Vm – мольный объем.
В табл. 4 приведены доли данных видов взаимодействия, рассчитанные по формуле
(10)
${{f}_{n}} = {{{\delta }}_{n}}{\text{/}}\sum {\delta } = {{{\delta }}_{n}}{\text{/}}\left( {{{{\delta }}_{d}} + {{{\delta }}_{p}} + {{{\delta }}_{h}}} \right),$Таблица 4.
Составляющие параметра растворимости растворителей, в рамках трехмерной концепции параметра растворимости Хансена
| Растворитель | Параметры растворимости, (МДж/м3)1/2 | Доли составляющих параметра растворимости, % | |||||
|---|---|---|---|---|---|---|---|
| δ | δd | δp | δh | fd | fp | fh | |
| Толуол | 18.18 | 17.99 | 1.43 | 2.04 | 83.8 | 6.7 | 9.5 |
| Метилацетат | 19.36 | 13.30 | 9.50 | 10.40 | 40.1 | 28.6 | 31.3 |
| Этилацетат | 18.56 | 15.18 | 5.30 | 9.20 | 51.1 | 17.9 | 31.0 |
| Бутилацетат | 17.30 | 15.65 | 3.70 | 6.30 | 61.0 | 14.4 | 24.6 |
Самым “хорошим” с термодинамической точки зрения среди сложных эфиров по отношению к БНКС-28 АМН является бутилацетат, для которого характерна самая высокая доля, приходящаяся на дисперсионное взаимодействие. С увеличением неполярной части молекулы растворителя, сродство эфира к сополимеру, макромолекула которого содержит до 72–74 мас. % звеньев неполярного полибутадиена, повышается. Наличие карбоксильной группы в растворителе отвечает за способность к полярному взаимодействию и образованию водородных связей с нитрильными функциональными группами БНК. Баланс между данными видами взаимодействия со стороны растворителя и полимера отвечает за интенсивность изменения химических потенциалов компонентов, свободной энергии растворов и обеспечивает формирование истинных растворов. Таким образом, увеличение занимаемого макромолекулами БНК объема в бутилацетате связано с возрастанием сольватационного взаимодействия полимера с растворителем и ослаблением внутримолекулярных связей.
В разбавленных растворах метилацетата и толуола внутримолекулярные взаимодействия между сегментами полимерной цепи превалируют над сольватационными процессами. Вследствие этого интенсивность взаимодействия полимер–растворитель уменьшается, что приводит к компактизации макромолекул БНК и переходу их к более сжатым конформационным формам [27]. Так, с повышением полярности сложных эфиров и ухудшением их термодинамического качества, объем макромолекул и среднеквадратичное расстояние между концами цепи в изученных растворах БНК уменьшается.
Для более высокомолекулярного бутадиен-нитрильного каучука марки БНКС-28АН такая четкая закономерность изменения качества растворителя при переходе от одного члена гомологического ряда сложных эфиров к другому отсутствует. Термодинамическое качество растворителя улучшается в следующем ряду: толуол < метилацетат < бутилацетат < этилацетат. Достоверность данного эффекта подтверждается ранее выполненными исследованиями [28, 29].
Такой эффект может быть обусловлен масштабным фактором, связанным с большим количеством полярных нитрильных групп в макромолекулах с большей молекулярной массой, при сохранении соотношения полибутадиен : нитрил акриловой кислоты в полимере. Согласно теории пластификации, предложенной С.Н. Журковым [30], при взаимодействии полярный полимер–полярная низкомолекулярная жидкость для исключения нитрильных групп из межмолекулярного взаимодействия в самом полимере будет требоваться больше молекул менее полярного бутилацетата при его более низкой диффузионной способности по сравнению с этилацетатом. Как следствие, более значительные изменения химических потенциалов компонентов и свободной энергии всей системы характерны для раствора БНК–этилацетат, чем для БНК–бутилацетат.
При использовании толуола, у которого еще более высока доля дисперсионного взаимодействия по сравнению со сложными эфирами, процесс растворения каучука с высокой молекулярной массой не вызывал затруднений. В работе [28] было сделано предположение о существовании формулы универсального растворителя, согласно которой растворяющая способность в отношении полимеров с различной полярностью у органического растворителя максимальна, когда при любом вкладе дисперсионного взаимодействия в интервале от 55 до 85% соотношение между вкладом полярного взаимодействия и вкладом водородных связей равно 1 : 1. Данное правило работает для толуола и метилацетата, для которых отношение вклада полярного взаимодействия и вклада водородных связей составляет от 0.42 : 0.58 до 0.48 : 0.52. Этилацетат и бутилацетат при существенной разнице в доле, приходящейся на дисперсионное взаимодействие (табл. 4), объединяет большая склонность этих растворителей к образованию водородных связей по сравнению с полярным взаимодействием (${{f}_{P}}~:~{{f}_{h}}$ – 0.37 : 0.63). При таком соотношении в основных силах межмолекулярного взаимодействия, к которым способны молекулы растворителя, у более громоздкой молекулы бутилацетата возникают трудности с диффузионным проникновением внутрь макромолекулы БНК с большей молекулярной массой. В пользу повышения роли диффузионной составляющей в процессе растворения свидетельствует характер изменения вискозиметрической константы Хаггинса в зависимости от природы растворителя для БНКС-28АН. Данная константа имеет сопоставимые значения для всех рассмотренных растворителей, исключение составляет k' для раствора БНК в бутилацетате.
В разбавленных растворах бутилацетата внутримолекулярные взаимодействия между сегментами цепи высокомолекулярного БНК превалируют над сольватационными процессами, вследствие чего интенсивность взаимодействия полимер–растворитель снижается.
На основании данных светорассеяния, используя метод Дебая [16], наряду со средневесовой молекулярной массой бутадиен-нитрильных каучуков были определены второй вириальный коэффициент А2, непосредственно отражающий термодинамическое качество растворителя, и гидродинамический диаметр макромолекулярного клубка D (см. табл. 3). Полученные данные демонстрируют, что рассматриваемые в работе сложные эфиры относятся к хорошим растворителям по отношению к БНК. Выявленные тенденции в характере изменения термодинамического качества растворителей бутилацетата, этилацетата и метилацетата по результатам визкозиметрических исследований согласуются с результатами определения второго вириального коэффициента.
ЗАКЛЮЧЕНИЕ
В работе получены новые экспериментальные данные, описывающие поведение разбавленных растворов бутадиен-нитрильных каучуков в зависимости от их молекулярной массы и природы растворителя.
С использованием методов визкозиметрии и светорассеяния определены численные значения средневязкостной и средневесовой молекулярных масс, выпускаемых отечественной промышленностью бутадиен-нитрильных каучуков, содержащих 28 мас. % нитрила акриловой кислоты.
Найденные положительные значения второго вириального коэффициента А2 указывают на то, что бутилацетат, этилацетат и метилацетат являются хорошими растворителями по отношению к БНК. На основании анализа характера изменения А2 и характеристической вязкости разбавленных растворов БНК, получаемых с использованием парафинатных эмульгаторов, установлено, что термодинамическое качество сложного эфира как растворителя снижается в следующей последовательности: бутилацетат > этилацетат > метилацетат. При переходе к более высокомолекулярной марке каучука характер изменения качества растворителя меняется: метилацетат < бутилацетат < < этилацетат.
Список литературы
Корнев А.Е., Буканов А.М., Шевердяев О.Н. Технология эластомерных материалов. М.: Истек, 2009.
Резниченко С.В., Морозов Ю.Л. Большой справочник резинщика. Ч. 1: Резина и резинотехнические изделия. М.: Техинформ, 2012.
Папков В.Н., Гусев Ю.К., Ривин Э.М., Блинов Е.В. Бутадиен-нитрильные каучуки. Синтез и свойства. Воронеж: ВГУИТ, 2014.
Kotova S.V., Mikhailov S.I., Fomina A.A. // Int. Polym. Sci. Technol. 2013. V. 40. № 7. P. 11.
Мамедов Ш.М., Ядреев Ф.И., Ривин Э.М. Бутадиен-нитрильные каучуки и резины на их основе. Баку: Элм, 1991.
Чайкун А.М., Алифанов Е.В., Наумов И.С. // Новости материаловедения. Наука и техника. 2018. № 3–4 (30). С. 7.
Евдокимов А.О., Буканов А.М., Люсова Л.Р., Петроградский А.В. // Тонкие химические технологии. 2018. Т. 13. № 5. С. 58. https://doi.org/10.32362/2410-6593-2018-13-5-58-66
Livanova N.M., Karpova S.G., Popov A.A. // Polymer Science A. 2011. V. 53. № 12. P. 1128.
Sokolova L.V., Matukhina E.V., Livanova N.M., Shershnev V.A. // Polymer Science A. 2010. V. 52. № 5. P. 506.
Pinedoa B., Hadfieldb M., Tzanakisc I., Conted M., Anandb M. // Tribol. Int. 2018. V. 127. P. 24.
Karpova S.G., Naumova Yu.A., Lyusova L.R., Milyushkina E.G., Popov A.A. // Polymer Science A. 2019. V. 61. № 1. P. 9.
Зуев А.А., Люсова Л.Р., Борейко Н.П. // Пром. производство и использование эластомеров. 2017. № 2. С. 30.
Brandrup J., Immergut E.H., Grulke E.A. Polymer Handbook. New York: Wiley, 1999.
Дринберг С.А., Ицко Э.Ф. Растворители для лакокрасочных материалов: Справочник. СПб: ХИМИЗДАТ, 2003.
Flory P.J. Principles of Polymer Chemistry. Ithaca: Cornell Univ. Press, 1953.
Тагер А.А. Физикохимия полимеров. М.: Научный мир, 2007.
Аскадский А.А. Кондращенко В.И. Компьютерное материаловедение полимеров. М.: Научный мир, 1999. Т. 1.
Askadskii A.A., Matseevich T.A., Popova M.N., Kondrashchenko V.I. // Polymer Science A. 2015. V. 57. № 2. P. 186.
Будтов В.П. Физическая химия растворов полимеров. СПб.: Химия, 1992.
Рафиков С.Р., Будтов В.П., Монахов Ю.Б. Введение в физикохимию растворов полимеров. М.: Химия, 1975.
Pavlov G.M., Okatova O.V., Gavrilova I.I., Ul’yanova N.N., Panarin E.F. // Polymer Science A. 2013. T. 55. № 12. P. 699.
Практикум по высокомолекулярным соединениям / Под ред. В.А. Кабанова. М.: Химия, 1985.
Эйзнер Ю.Е., Птицын О.Б. Гидродинамика растворов полимеров // Высокомолек. соед. А. 1964. Т. 6. № 5. С. 777.
Antoniou E., Tsianou M. // J. Appl. Polym. Sci. V. 125. № 3. P. 1681.
Липатов Ю.С., Сергеева Л.М. Адсорбция полимеров Киев: Наукова думка, 1972.
Hansen C.M. Hansen Solubility Parameters. A User’s Handbook. Boca Raton: CRC Press, 2007.
Алексеева О.В., Блохина С.В., Ольхович М.В., Шарапова А.В. // Жидкие кристаллы и их практическое использование. 2009. Т. 27. № 1. С. 57.
Наумова Ю.А. Дисc. … д-ра техн. наук. М.: МИРЭА, 2013.
Naumova Y.A., Lyusova L.R., Karpova S.G., Agayants I.M., Kopylova E.V., Khmeleva E.L. // Int. Polym. Sci. Technol. 2014. V. 41. № 3. P. 24.
Журков С.Н. // Докл. АН СССР. 1945. Т. 47. № 7. С. 493.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


