Высокомолекулярные соединения (серия А), 2020, T. 62, № 4, стр. 310-318
О влиянии вторичных структур в пептидах и белках на их хроматографическое разделение
А. В. Горшков a, И. Г. Роздина a, М. Л. Придатченко a, В. В. Евреинов a, *
a Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
* E-mail: evreinov@polymer.chph.ras.ru
Поступила в редакцию 09.08.2019
После доработки 03.02.2020
Принята к публикации 17.02.2020
Аннотация
В рамках решеточной модели адсорбции и хроматографии макромолекул рассмотрен вопрос о влиянии остаточных вторичных структур в пептидах и белках на их разделение. Показано, что учет в модели вторичных структур, таких как спирали, складки или сшивки, может приводить к заметному изменению объема удерживания. Вместе с тем, для получающихся в результате ферментативного гидролиза белков коротких пептидов с числом аминокислотных звеньев порядка двадцати, воздействие вторичных структур, например, остаточных S–S-сшивок, на разделение в модельном хроматографическом эксперименте незначительно. Для таких пептидов основное влияние на разделение оказывает их аминокислотный состав, и адекватное предсказание значений объема удерживания может быть получено как в приближении линейной цепи, так и в аддитивной модели адсорбции.
ВВЕДЕНИЕ
Макромолекулы белков в живых организмах существуют в виде трехмерных глобулярных структур. Такие структуры представляют собой плотную пространственную укладку α-спиралей, β-листов, и других элементов вторичной структуры, а также и поперечных сшивок между удаленными по цепи звеньями за счет дисульфидных S–S-мостиков. Хотя последние формально не являются элементами вторичных структур, для упрощения изложения в дальнейшем под элементами вторичных структур подразумеваются и S–S-сшивки.
В условиях хромато-масс-спектрометрического эксперимента (LC–MS), который обычно проводится в водно-органических средах при pH 2.0 и температуре 50°С, происходит денатурация белка, и его глобулярная структура разрушается. Макромолекула разворачивается, приобретая конформацию, близкую к конформации клубка, при этом аминокислотные остатки, “спрятанные” внутри глобулы, выходят наружу, и для них появляется возможность взаимодействовать с поверхностью. Тем самым, при адсорбционном взаимодействии вся последовательность цепи становится доступной для “чтения” ее текста. Такая картина подтверждается экспериментальными данными: объем удерживания VR коррелирует со всем аминокислотным составом белка, а не только с той его частью, которая находится на поверхности глобулы. По этой причине модель хроматографического разделения BioLCCC [1], в основе которой лежит предположение о макромолекуле как о клубке, представленном цепью случайных блужданий на решетке, в целом правильно отображает наблюдаемые экспериментальные закономерности.
В состоянии клубка все звенья имеют возможность взаимодействовать с поверхностью, создавая наиболее выгодные условия для “чтения” текста последовательности методами хроматографии. Точечные мутации последовательности, такие как перестановка, замена аминокислот и их химическая модификация относительно легко “читаемы” в макромолекуле, находящейся в клубковом состоянии. Связанность аминокислотных остатков в цепь формирует специфическое сильное взаимодействие между удаленными по цепи звеньями, при котором небольшое изменение адсорбционных свойств какого-то одного звена (например, в результате его модификации) влияет на взаимодействие с поверхностью всех остальных и, следовательно, на адсорбцию всей макромолекулы и ее хроматографические свойства. Зависимость адсорбции от последовательности звеньев в клубке имеет, как правило, энтропийную природу, и связана с наличием в адсорбированной макромолекуле петель и хвостов, распространяющихся в раствор и не контактирующих с поверхностью. При очень сильном адсорбционном взаимодействии (практически не реализуемом в LC), когда макромолекула полностью “распластана” на поверхности, последовательность звеньев не играет роли.
Особенно заметно влияние последовательности вблизи адсорбционной критической точки, в которой адсорбированный клубок как раз характеризуется наличием длинных петель и хвостов. В критической точке имеет место тонкая компенсация потерь энтропии цепи вблизи поверхности, обусловленных уменьшением числа способов укладки, энергией адсорбционного взаимодействия звеньев, и макромолекула оказывается весьма восприимчива к любому нарушению этой компенсации. В силу фазового характера адсорбции макромолекул, эксперимент LC–MS, осуществляемый при изменении во времени состава водно-органического растворителя, автоматически приводит к тому, что разделение происходит вблизи критической точки адсорбции со стороны адсорбционного режима. Тем самым, разделение в градиенте должно отображать не только аминокислотный состав макромолекулы, но и характер чередования остатков в цепи, т.е. ее последовательность.
Для коротких цепей пептидов вклад петель и хвостов незначителен, и основную роль здесь играет аминокислотный состав. Для них весьма успешными являются аддитивные модели [2–5], дополненные поправками на длину цепи и влияние соседей.
Такая идеализированная картина, однако, не вполне точная. Существующие в глобулярном состоянии белка вторичные структуры могут не полностью разрушаться в эксперименте. В этом случае конформацию денатурированного белка можно представить в виде небольшого количества остатков α-спиралей и β-листов, соединенных гибкими цепями, сшитыми в некоторых местах дисульфидными S–S-мостиками. Остаточные вторичные структуры меняют адсорбционные свойства всей макромолекулы и должны учитываться моделью разделения. В настоящей работе в рамках модели BioLCCC теоретически проанализировано влияние остаточных вторичных структур на адсорбционные свойства белков и пептидов и указанное влияние сопоставлено с влиянием последовательности.
МОДЕЛЬ BioLCCC С ВТОРИЧНЫМИ СТРУКТУРАМИ
На рис. 1 показаны элементарные типы вторичных структур, которые могут существовать в частично денатурированном белке. В масштабе клубка α-спираль и β-лист можно представить жестким стержнем, а соединяющие их гибкие участки – цепью случайных блужданий.
Рис. 1.
Элементы вторичных структур (1–4) и их комбинации (5, 6) в макромолекуле: 1 – спираль, 2 – складка, 3 – сшивка, 4 – цикл.
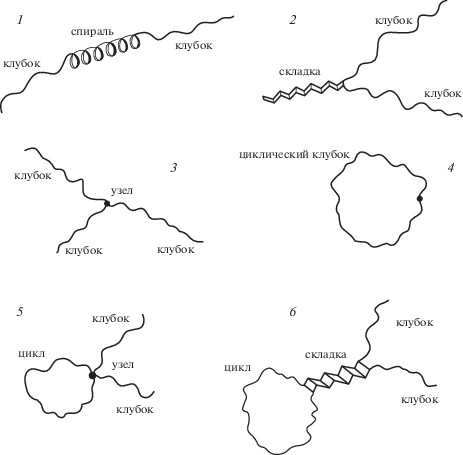
Денатурированный белок может содержать и несколько таких структур, соединенных между собой (рис. 1, тип 5 и 6). Рассмотрим, каким образом вторичные структуры возможно интегрировать в матричную модель адсорбции макромолекулы в пространстве щелеобразной поры, лежащей в основе BioLCCC.
Напомним, что измеряемый в хроматографии объем удерживания VR есть не что иное, как статистическая сумма макромолекулы в колонке, поэтому для понимания закономерностей разделения макромолекул необходимо найти их статистические суммы в представлении цепи блужданий со вставками в некоторых местах жестких стержней и сшивок. В дальнейшем выберем нормировку энергии таким образом, чтобы в неограниченном пространстве в отсутствии адсорбционных поверхностей статсумма макромолекулы Z была равна единице, а энергию адсорбции звеньев будем выражать в единицах kT.
Клубковая часть, как обычно, моделируется цепью, блуждающей по узлам кубической решетки, переходная матрица W(εi) которой имеет стандартный вид [1]:
(1)
$W({{\varepsilon }_{i}}) = \left[ {\begin{array}{*{20}{c}} {2{\text{/}}3{{e}^{{{{\varepsilon }_{i}}}}}}&{2{\text{/}}3{{e}^{{{{\varepsilon }_{i}}}}}}&0&0&{...}&0 \\ {1{\text{/}}6}&{2{\text{/}}3}&{1{\text{/}}6}&0&{...}&0 \\ 0&{1{\text{/}}6}&{2{\text{/}}3}&{1{\text{/}}6}&{...}&0 \\ {...}&{...}&{...}&{...}&{...}&{...} \\ 0&0&{...}&{1{\text{/}}6}&{2{\text{/}}3}&{1{\text{/}}6} \\ 0&0&{...}&0&{1{\text{/}}6{{e}^{{{{\varepsilon }_{i}}}}}}&{2{\text{/}}3{{e}^{{{{\varepsilon }_{i}}}}}} \end{array}} \right]$Здесь εi – энергия адсорбции i-го звена в цепи (для определенности будем отсчитывать его от C-конца), зависящая от типа соответствующего аминокислотного остатка. Для топологии поры типа щели с размером D, ограниченной в одном направлении, при расчете статсуммы можно исключить интегрирование по двум пространственным координатам в плоскости, параллельной поверхности. Тогда статистическую сумму цепи, начинающуюся в слое k и заканчивающуюся в слое l, запишем в виде:
В данной модели радиус действия адсорбционных сил δ ограничен размером аминокислотного остатка a, т.е. предполагается короткодействующим. Обычно размер a, диаметр α-спирали d и размер молекул растворителя r имеют один порядок величины. Поэтому будет естественно величины, имеющие размерность длины, выразить в единицах размера аминокислотного звена a = 5 Å. Тогда размерность матрицы равна размеру поры адсорбента, представленному в единицах размера звена (например, для поры с размером 300 Å размерность матрицы D = 60).
Для спирального участка, моделируемого стержнем, шаг по решетке зависит от его длины L, которая связана с числом n входящих в него аминокислотных остатков как L = n – 1. Первый аминокислотный остаток, входящий в спираль, логично считать последним звеном клубковой части (рис. 2). При выбранной симметрии поры и уровне энергии для расчета статсуммы существенны только положения конца стержня в плоскостях, параллельных адсорбционным поверхностям.
Рис. 2.
Представление спирали (1), складки (2), сшивки (3) и цикла (4) в решеточной модели, а также их комбинаций (5).
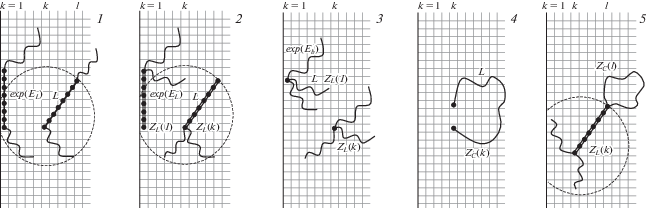
Стержень с длиной L (обычно для белков спираль содержит не менее четырех звеньев, т.е. L > 4), начинающийся в слое k, может располагаться в слоях k ± 1, … k ± L, общее число которых 2L + 1. Поскольку расстояние между плоскостями одинаковое, то вероятность попадания конца стержня на поверхность соответствующего шарового слоя также одинаковая, т.е. вероятность попадания второго конца стержня в любой доступный слой равна 1/(2L + 1). Таким образом, переходная матрица, описывающая стержень спирали в поре, имеет вид:
(2)
${{W}_{\alpha }}(L) = \left[ {\begin{array}{*{20}{c}} {1{\text{/}}(2L + 1){{e}^{{{{E}_{\alpha }}}}}}&{1{\text{/}}(2L + 1){{e}^{{{{\varepsilon }_{n}}}}}}&{1{\text{/}}(2L + 1){{e}^{{{{\varepsilon }_{n}}}}}}&0&{...}&0 \\ {1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{...}&0 \\ {1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{...}&0 \\ {...}&{...}&{...}&{...}&{...}&{...} \\ 0&0&{...}&{1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)}&{1{\text{/}}(2L + 1)} \\ 0&0&{...}&{1{\text{/}}(2L + 1){{e}^{{{{\varepsilon }_{n}}}}}}&{1{\text{/}}(2L + 1){{e}^{{{{\varepsilon }_{n}}}}}}&{1{\text{/}}(2L + 1){{e}^{{{{E}_{\alpha }}}}}} \end{array}} \right]$Для упрощения показана матрица для L = 2, в общем случае ее структура очевидна. Энергия адсорбционного взаимодействия тогда, когда стержень целиком попадает в адсорбционный слой, есть сумма значений энергии взаимодействия всех входящих в него аминокислотных остатков, ${{E}_{\alpha }} = \sum\nolimits_2^n {{{\varepsilon }_{i}}} $. Если только конец стержня n попадает в адсорбционный слой, энергия адсорбции равна энергии адсорбции концевого аминокислотного остатка ${{\varepsilon }_{n}}$; будем считать, что все остальные звенья стержня в такой “наклонной” конфигурации с поверхностью не взаимодействуют. Длина стержня L = 1, по сути, соответствует одному шагу цепи блужданий, однако, матрица (2) в этом случае несколько отличается от переходной матрицы цепи блужданий (1). Данное отличие не существенно, и для реальных длинных стержней статсумма, рассчитанная по выражению (2), мало отличается от точной модели адсорбции стержня [6, 7].
Таким образом, статсумму цепи общей длиной N, содержащей спиральный участок между звеньями m и k, представим в виде
(3)
${{Z}_{N}}\, = \,{{U}^{T}} \times \prod\limits_{i = k + 1}^N {W({{\varepsilon }_{i}})} \times {{W}_{\alpha }}(k - m) \times \prod\limits_{i = 1}^m {W({{\varepsilon }_{i}}) \times U} ,$Рассмотрим другие типы вторичных структур, представленные на рис. 2. Для начала запишем очевидное тождество для цепи блужданий с длиной N, которую можно представить в качестве цепи с длиной n, пришедшую в слой k, а затем покинувшего его цепь с длиной N – n. Если просуммировать по всем слоям k = 1 … D, то в итоге должна получиться просто статсумма цепи блужданий с длиной N:
(4)
$\begin{gathered} {{Z}_{N}} = \sum\limits_{k = 1}^D {\left( {{{U}^{T}} \times \prod\limits_{n + 1}^N {W({{\varepsilon }_{i}}) \times U_{k}^{T} \times {{U}_{k}}} } \right.} \times \\ \left. {\, \times \prod\limits_1^n {W({{\varepsilon }_{i}}) \times U} } \right) = \\ = {{U}^{T}} \times \prod\limits_{n + 1}^N {W({{\varepsilon }_{i}})} \times E \times \prod\limits_1^n {W({{\varepsilon }_{i}}) \times U} \\ \end{gathered} $Здесь E – единичная матрица. Если в звене n имеется, например, узел разветвления (рис. 2, схема 3) и к нему подходит еще одна цепь, то вместо единичной матрицы в уравнении (4) необходимо поставить диагональную матрицу, элементы которой представляют собой статистические суммы боковой цепи с длиной Nb, начинающейся в слое k:
Таким образом, статистическую сумму цепи с узлом разветвления запишем в виде
Если к звену n примыкает складка (рис. 2, схема 2), простирающаяся до l-го звена, тогда элементы диагональной матрицы суть статсуммы стержня длиной L = [l – m]/2, один конец которого находится в слое k:
Статистическую сумму цепи со складкой можно представить как
Наконец, цепь может содержать в своей структуре цикл, статистическая сумма которого
Множитель A учитывает отличие статсуммы цикла в неограниченном пространстве от единицы. Для кубической решетки этот множитель быстро становится близким к статсумме одномерной гауссовой циклической цепи:
Для рассматриваемой одномерной модели поры можно не учитывать то, что конец цикла не попадает в исходную точку (рис. 2, схема 4), а оказывается лишь в исходном слое – по координатам, параллельным адсорбционным поверхностям, звенья цепи не имеют ограничений.
Рассмотренные выше элементарные типы вторичных структур позволяют записать статсумму и для более сложной структуры, например, изображенной на схеме 5 рис. 2:
Здесь Λ – диагональная матрица, элементы которой есть статистические суммы складки, начинающейся в слое k, с примыкающим к ней на другом конце циклом:
Для завершения модели необходимо определить значения энергии адсорбции аминокислотных остатков в спиральном состоянии. Это сложно выполнимая задача: для нее потребуются модели пептидов в заведомо спиральном состоянии. В настоящей работе для оценки влияния вторичных структур использован более простой вариант. Поскольку механизм адсорбции на обращенной фазе обусловлен в основном гидрофобным взаимодействием, в первом приближении будем считать, что энергия аминокислотных звеньев в спиральном состоянии близка к энергии адсорбции аминокислот в коротких пептидах, моделируемых жестким стержнем [7]. Если принять такое предположение, то между значениями энергии звеньев в клубке εc и в спирали εh существует зависимость, близкая к линейной. Это означает, что более гидрофобная аминокислота в клубковом состоянии будет более гидрофобной и в спиральном состоянии. Такое приближение значительно сокращает набор параметров в модели: вместо двадцати дополнительных значений энергии имеем два дополнительных коэффициента линейного преобразования.
ПРИМЕРЫ РАСЧЕТА И ОЦЕНКА ВЛИЯНИЯ ВТОРИЧНЫХ СТРУКТУР
Рассмотрим особенности, к которым в адсорбционном поведении может приводить учет в клубках вторичных структур. На практике необходимо знать, какие аминокислотные остатки входят в клубковые участки, а какие в спиральные. В приложении к определенной макромолекуле белка, скорее всего, это можно определить экспериментально, используя различные физические методы. В общем случае произвольной последовательности, для теоретического анализа необходимо пользоваться математическим моделированием.
Существует множество алгоритмов, предсказывающих наличие вторичных структур в белках, которые дают примерно одинаковый результат. В настоящей работе была использована модель PSIPRED [8]. Для заданной последовательности цепи эта модель определяет в каком состоянии (с – клубок, h – спираль) находится тот или иной аминокислотный остаток. Например, для белка Cytochrome модель PRISPED предсказывает четыре спиральных участка, включающие звенья 3–18, 50–53, 61–69 и 88–101. Таким образом, если предположить, что в денатурированной макромолекуле Cytochrome спиральные участки сохраняются, то ее можно представить в виде четырех стержней разной длины, соединенных гибкими цепями. Важно, что алгоритмы предсказания вторичных структур неявно предполагают нормальные условия, в то время как хроматографический эксперимент осуществляется обычно в кислой среде (pH 2.0) при температуре ~50°С, значит, некоторые из спиралей могут разрушиться.
В рамках такого приближения были рассчитаны значения объема удерживания макромолекул белков как с учетом вторичных структур, так и без учета последних. В расчетах, как и ранее в работе [7], были использованы стандартные условия LC-эксперимента: растворитель вода–ацетонитрил с добавление кислоты для достижения pH 2.0, градиент от 0 до 100% ацетонитрила в течение 100 мин, колонка 250 × 4.6 мм, эффективность колонки ~4000 теоретических тарелок.
Аминокислотные остатки в спиральном состоянии могут иметь отличную от клубкового состояния энергию, и для более точного моделирования необходимо вводить дополнительную таблицу значений эффективной энергии остатков в состоянии спирали. В данной работе будем считать, что значения энергии остатков в спиральном состоянии близки к значениям эффективной энергии остатков в модели адсорбции пептидов как жестких стержней. Эти значения, а также значения энергии в состоянии клубка, приведены в работе [7].
На рис. 3 показана модельная хроматограмма белка Cytochrome, рассчитанная как в предположении о наличии в структуре клубка спиралей, так и для чисто клубкового состояния. Видно, что наличие вторичных структур в денатурированном белке оказывается весьма существенным и влечет заметное изменение объема удерживания по сравнению с представлением всей цепи в виде клубка. При этом, вопреки ожиданию, макромолекула со спиральными участками элюируется раньше, чем клубок, даже с учетом того, что значения эффективной энергии остатков в спирали больше таковых в клубке.
Рис. 3.
Модельная хроматограмма белка Cytochrome в представлении клубка (1) и с учетом вторичных структур типа спиралей, включающих звенья 3–18, 50–53, 61–69 и 88–101, при энергии адсорбции остатков в спиральном состоянии, соответствующей энергии в модели адсорбции стержня (2) и клубка (3).
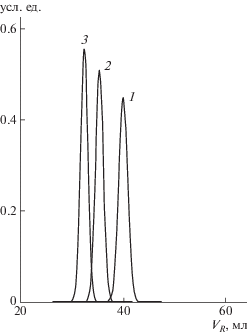
Чтобы выделить данный факт, был рассчитан объем удерживания макромолекулы в предположении о равенстве энергии адсорбции остатков в спиральном и клубковом состоянии. Объем удерживания такой макромолекулы еще меньше. Скорее всего, это связано с тем, что переход стержня в адсорбированное состояние, в зависимости от его длины, носит резкий и немонотонный характер [6]. Возможно, что такое поведение отражает особенности модели, в которой энергия “наклонных” состояний спиральных участков принята равной нулю.
Ранее в широком ряду белков обнаружена хорошая корреляция между экспериментальными и теоретическими величинами объемов удерживания в предположении о чисто клубковом состоянии макромолекулы. По-видимому, такая корреляция свидетельство того, что в условиях LC-эксперимента вторичные структуры разрушаются и их влияние становится незначительным. Однако, если эксперимент проводить в нормальных условиях при pH 7.0, влияние вторичных структур может оказаться существенным и определять картину хроматографического разделения.
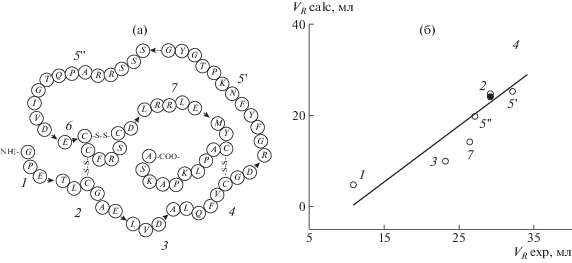
Другой пример – белок группы инсулина Relaxin, состоящий из двух цепей А и B, соединенных тремя связями S–S (рис. 4). Скорее всего, денатурированный белок имеет клубкообразную, сшитую этими связями структуру, включающую циклы и хвосты. При исследовании белки подвергают ферментативному гидролизу, в результате чего они распадаются на фрагменты, в которых связи S–S не разрушены. Образуются как линейные пептиды, так и пептиды сложной формы – разветвленные и циклические [9].
Рис. 4.
Схема макромолекулы Relaxin (а) и корреляция между экспериментальными и расчетными значениями объема удерживания (б). Стрелками показаны места “разреза” цепи протеазой, номера фрагментов, получающихся в результате разрезания, обозначены цифрами у точек на графике корреляции. Светлые точки – расчет с учетом вторичных структур фрагментов 2 и 5, темные точки – линейное приближение; через 5 ' обозначен отщепившийся от 5 фрагмент STWS.
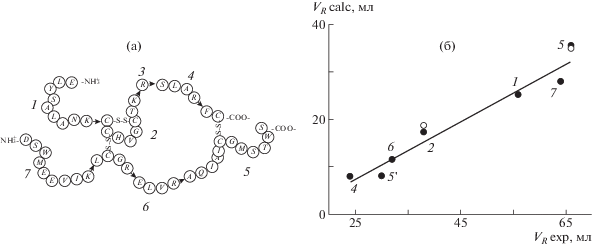
Расчет в рамках рассматриваемой модели и условий LC-эксперимента [9] показывает удовлетворительную корреляцию между экспериментальным и теоретическим порядком выхода этих фрагментов (рис. 4, темные точки). Однако, если заменить разветвленные и циклические структуры их линейными аналогами, имеющими тот же набор аминокислот, то расчетные времена мало изменяться (светлые точки), а корреляция будет не менее хорошей. Следовательно, для коротких пептидов главную роль в разделении играет их аминокислотный состав, а топология цепи мало значима. Это не удивительно, так как короткие цепи адсорбируются практически целиком, и роль петель, энтропия которых определяет зависимость от последовательности, незначительна.
Еще один пример для рассмотрения – одноцепочечный белок IGF-I, сшитый дисульфидными мостиками (рис. 5). При его гидролизе протеазой V8, наряду с линейными, также образуются разветвленные и циклические структуры [9].
Рис. 5.
Схема макромолекулы IGF-I (а) и корреляция между экспериментальными и расчетными значениями объема удерживания (б). Стрелками показаны места “разреза” цепи протеазой, номера фрагментов, получающихся в результате разрезания, обозначены цифрами у точек на графике корреляции. Светлые точки – расчет с учетом вторичных структур фрагментов 2 и 4, темные точки – линейное приближение; через 5 ' и 5 '' обозначены куски фрагмента 5, образующиеся в результате нецелевого разреза.
Как и в предыдущем случае, расчет в целом правильно предсказывает порядок выхода фрагментов. Если снова заменить сложные разветвленные структуры обычными линейными цепочками с тем же набором аминокислот, то результат корреляции получается не хуже.
Рассмотрим “мысленную”, но вполне реализуемую экспериментально задачу. Представим макромолекулу инсулина в денатурированном состоянии. Она имеет вид клубка из двух цепей A и B, соединенных тремя связями S–S, и состоит как из циклических участков, так и из линейных хвостов (рис. 6).
Рис. 6.
Схема макромолекулы Инсулин (а), а также модельные хроматограммы в градиентном (б) и изократическом (в) режимах. Цифрами обозначены макромолекулы, получающиеся после однократного (1, 2, 3) и двухкратного (1–2, 1–3, 2–3) расщепления соответствующих S–S-сшивок; А, В – отдельные цепи.
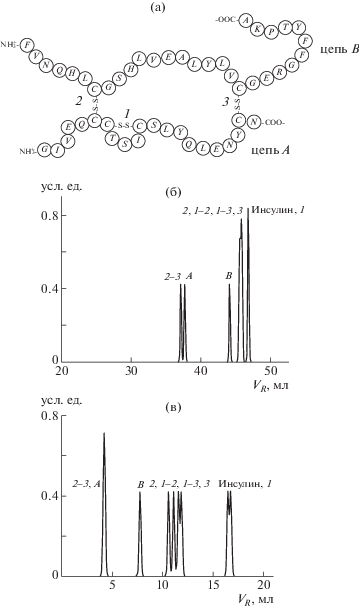
Допустим, что есть химическая реакция, расщепляющая связи S–S. В зависимости от глубины протекания этой реакции возможно образование шести различных структур, формирующихся путем разрыва одной или двух связей S–S (в пределе получаются две отдельных цепи A и B). Такие структуры имеют одинаковый набор аминокислот и отличаются своей топологией.
На рис. 6a видно, что в градиенте, некоторые из указанных структур могут разделяться, однако эффективность разделения (кроме предельного случая двух отдельных цепей) невысокая. Ситуацию можно слегка улучшить, используя изократические условия (рис. 6б), однако и в этом случае полного разделения всех шести структур вряд ли можно добиться.
ЗАКЛЮЧЕНИЕ
Модель хроматографического разделения, основанная на представлении макромолекулы в виде цепи блужданий, допускает несложное обобщение на случай наличия в ней разных типов вторичных структур: спиральных участков, складок, S–S-сшивок. Для практического применения эту модель необходимо дополнить набором значений эффективной энергии аминокислотных остатков в спиральном или складчатом состоянии, а также S–S-сшивок. Это не простая экспериментальная задача, так как для ее реализации необходимо иметь ряд моделей пептидов в заведомо известном (например, спиральном) состоянии в условиях хроматографического эксперимента. Учет влияния вторичных структур, возможно, поможет в интерпретации данных по хроматографическому разделению денатурированных белков, не подвергнутых ферментативному гидролизу.
Что касается пептидов, обычно используемых в протеомных экспериментах для идентификации белков, то для них усложнение модели, учитывающей влияние вторичных структур, оказывается малозначимым. Для интерпретации хроматографического разделения пептидов, в дополнение к их анализу методами масс-спектрометрии, вполне достаточно модели клубка и простых аддитивных моделей [1–5].
Работа выполнена в соответствии с Государственным заданием 0082-2019-0003 (№ АААА-А20-120021090129-9).
Список литературы
Gorshkov A.V., Evreinov V.V., Tarasova I.A., Gorshkov M.V. // Polymer Science B. 2007. V. 49. № 3–4. P. 93.
Guo D., Mant C.T., Taneja A.K., Parker J.M.R., Hodges R.S. // J. Chromatogr. 1986. V. 359. P. 499.
Krokhin O.V. // Anal. Chem. 2006. V. 78. № 22. P. 7785.
Reimer J., Spicer V., Krokhin O.V. // J. Chromatogr. A. 2012. V. 1256. P. 160.
Gilar M., Xie H.W., Jaworski A. // Anal. Chem. 2010. V. 82. № 1. P. 265.
Жулина Е.Б., Горбунов А.А., Скворцов А.М. // Высокомолек. соед. А. 1984. Т. 26. № 5. С. 915.
Gorshkov A.B., Goloborod’ko A.A., Pridatchenko M.L., Tarasova I.A., Rozdina I.G., Evreinov V.V., Gorshkov M.V. // Polymer Science A. 2017. V. 59. № 3. P. 354.
http://bioinf.cs.ucl.ac.uk/psipred
Canova-Davis E., Kessler T.J., Ling V.T. // Anal. Biochem. 1991. V. 196. № 1. P. 39.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


