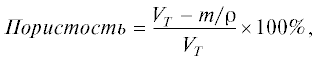Высокомолекулярные соединения (серия А), 2020, T. 62, № 4, стр. 250-255
ИССЛЕДОВАНИЕ ОБРАЗЦОВ НА ОСНОВЕ ПОЛИЭФИРИМИДА И ЕГО НАНОКОМПОЗИТОВ ДЛЯ БИОМЕДИЦИНСКОГО ПРИМЕНЕНИЯ, ПОЛУЧЕННЫХ МЕТОДОМ ТРЕХМЕРНОЙ ПЕЧАТИ
И. В. Поляков a, *, Г. В. Ваганов a, b, В. Е. Юдин a, b, Н. В. Смирнова a, b, Е. М. Иванькова a, b, Е. Н. Попова b
a Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Политехническая ул., 29, Россия
b Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
* E-mail: polyakov-iv@yandex.ru
Поступила в редакцию 06.09.2019
После доработки 15.11.2019
Принята к публикации 29.12.2019
Аннотация
Исследованы наномодифицированные полиэфиримидные образцы, полученные методом послойного наплавления с использованием экспериментальной установки для трехмерной печати высокотермостойких пластиков. Изучены их структура и термические свойства с помощью методов пикнометрического анализа, сканирующей электронной микроскопии, дифференциальной сканирующей калориметрии, термогравиметрического и дилатометрического анализов. Установлено, что при модификации полиэфиримида углеродными нановолокнами значительно снижается пористость напечатанных образцов. Проведен анализ цитотоксичности, и показано, что исследуемые материалы являются биоинертными.
ВВЕДЕНИЕ
Аддитивные технологии (3D-печать) – это различные методы производства, заключающиеся в послойном нанесении материала, они позволяют конструировать изделия сложных геометрических форм [1]. Одно из главных назначений аддитивного производства – это быстрое прототипирование, т.е. метод создания опытных образцов или работающей модели системы в короткий промежуток времени. Аддитивные технологии нашли применение в производстве функциональных изделий в самых разных областях, таких как аэрокосмическая и автомобильная промышленность, судостроение и другие. Среди наиболее перспективных развивающихся сфер их приложения является медицина. Эти технологии можно использовать при создании скаффолдов для выращивания клеток, в экзо- и эндопротезировании, а также для создания тканей и органов посредством биопринтинга [2].
В настоящее время доступен широкий набор методов аддитивного производства: селективное масочное спекание (SMS), изготовление объектов методом ламинирования (LOM), стереолитография (SLA), селективное лазерное спекание (SLS) и, наконец, самый популярный подход – моделирование методом послойного наплавления (Fused Deposition Modeling, FDM) [3]. Частоту применения именно метода послойного наплавления можно объяснить низкой стоимостью оборудования для печати, простотой в обслуживании, и при этом возможностью получения качественных полимерных деталей сложной конфигурации для мелкосерийного производства.
Широкое распространение FDM-технологии сдерживает невысокие механические свойства данных изделий по сравнению с традиционными методами производства, такими как экструзия или литье под давлением. Это связано с неизбежным наличием пор вследствие послойного нанесения материала [4], недостаточной адгезией между слоями, а также склонностью термопластичных полимеров к усадке во время охлаждения [5]. Что же касается медицинского назначения напечатанных изделий, то влияние на организм материалов, которые, например, возможно использовать для производства различных имплантатов, еще недостаточно изучено и, соответственно, у них отсутствует требуемая сертификация.
Для улучшения механических характеристик таких изделий необходимо применять новые материалы для печати или модифицировать уже существующие [6]. В настоящее время в FDM-печати чаще всего задействуют такие полимеры, как ABS-пластик и полилактид, а также полиамиды, обладающие достаточно невысокими механическими характеристиками (их прочность не превышает 60 МПа). Поэтому следует уделить серьезное внимание использованию высокотехнологичных термопластов.
Одним из представителей такого рода материалов является полукристаллический термопласт полиэфирэфиркетон (PEEK) –высокопрочный, химически инертный биосовместимый материал с температурой стеклования ~143°C и весьма высокой температурой плавления ~343°С. Благодаря этим характеристикам, изделия из сверхвысокой чистоты PEEK марки “VICTREX®” были одобрены в 2005 году для применения в биомедицине, в частности для эндопротезирования [7]. Сегодня уже осуществляется изготовление различных протезов из этого материала (в основном в краниологии и стоматологии) с помощью технологии SLS [8].
Использование РЕЕК для конструирования различных изделий методом FDM-печати началось сравнительно недавно, чему способствовали высокая стоимость материала и сложность его переработки [5, 9, 10], к тому же их физико-механические характеристики превосходили аналогичные показатели большинства стандартных термопластичных полимеров, используемых для FDM-печати. Так, прочность напечатанных образцов из PEEK достигала 75 МПа, а модуль упругости соответствовал 2.8 ГПа [11].
Одной из главных проблем PEEK, особенно сертифицированного для медицинского применения, остается крайне высокая стоимость полимера. В связи с этим, обращает на себя внимание другой полимер со схожими механическими характеристиками – полиэфиримид (PEI), который пока широко не исследуется для применения в данной области [12]. Так, PEI представляет собой аморфный полимер с плотностью 1.3 г/см3, температурой стеклования ~219°C, что позволяет его эксплуатировать при 170–180°C. Он также обладает хорошей стойкостью к растворителям и биодеградации, что выгодно отличает его и делает привлекательным при использовании в эндопротезировании. Поскольку PEI стабилен при высоких значениях температуры, то его можно подвергать стерилизации в автоклаве [13]. Значит, PEI может стать качественной и более доступной альтернативой PEEK для FDM-печати изделий биомедицинского назначения.
Эффективным способом улучшения процесса 3D-печати и характеристик представленных изделий является введение наночастиц в полимерный материал [14]. Здесь среди перспективных наполнителей выделяются углеродные нановолокна, полученные методом осаждения из газовой фазы (Vapor Grown Carbon Fibers, VGCF), так как они имеют высокое осевое соотношение и относительно легко диспергируются в расплаве и растворе полимера без дополнительной модификации их поверхности [15].
Цель данной работы – исследование структуры и термических свойств новых композиционных материалов на основе PEI, модифицированного VGCF, а также изучение их биосовместимости с организмом для возможного применения в медицинских целях, главным образом в эндопротезировании.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В настоящей работе использовали термостойкий аморфный полиэфиримид торговой марки “Ultem®1000” (“SABIC Innovative Plastics”) с плотностью 1.3 г/см3 и температурой стеклования Tg = 217°C. В качестве вводимых в полиэфиримид наночастиц применяли углеродные нановолокна VGCF (“Pyrograf®-III”) с внешним диаметром ~100 нм и длиной от 20 до 200 мкм.
Получение образцов
Нанокомпозиционный материал и филаменты из чистого и наполненного PEI изготовили с помощью двухшнекового конического микроэкструдера “DSM Xplore MC-5” (“Xplore”, Нидерланды). Печать опытных образцов в виде “лопаток” осуществляли на экспериментальной установке для FDM-печати высокотермостойкими пластиками. Для сравнения получали образцы в виде аналогичных по размеру и форме методом литья под давлением на микроинжекторе “DSM Xplore IM-5.5”. Все технологические параметры приведены в предыдущей работе [16].
Для определения цитотоксичности и коэффициента термического расширения (КТР) представляли образцы в виде цилиндров диаметром 15 и 10 мм, высотой 3 и 5 мм соответственно. Навески гранул исходного PEI или наполненного VGCF помещали в матрицу для прессования, которую выдерживали при температуре 330°C в течение 20 мин с последующим прессованием расплава полимера под давлением 50 МПа и охлаждением ее до комнатной температуры.
Методы исследования
Термический анализ образцов проводили с помощью метода дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (ТГА). ДСК-измерения выполняли на установке “DSC 204 F1 Phoenix” (“NETZSCH”, Германия) в инертной среде (аргон), в диапазоне температуры от 25 до 300°С при скорости нагревания образца 10 град/мин.
Установление температуры термодеструкции полимеров осуществляли на приборе “TG 209 F1 Iris” (“NETZSCH”, Германия). Нагревание образца в диапазоне температуры 30–800°С происходило в атмосфере аргона со скоростью 10 град/мин.
Определение коэффициента термического расширения путем дилатометрического анализа выполняли в диапазоне температуры 20–170°C с помощью термомеханического анализатора “TMA402 F1” (“NETZSCH”, Германия). Измерение проводили с предварительной нагрузкой образца (0.02 Н) в токе аргона.
Пористость образцов исследовали с помощью пикнометрического метода. Измеряли объем образца, а по разнице с теоретически рассчитанным объемом самого полимера определяли пористость:
где VT – объем исследуемого образца, установленный пикнометрическим методом; ρ – плотность материала (1.3 г/см3 для “Ultem®1000”); m – масса образца, измеренная на аналитических весах.Исследование структуры образцов осуществляли на сканирующем электронном микроскопе (СЭМ) “Supra-55” (“CarlZeiss”, Германия). Перед тем как поместить образцы внутрь камеры микроскопа, на их поверхность напыляли тонкий проводящий слой платины. Ускоряющее напряжение составляло 3–5 кВ. Для получения качественной поверхности разрушения образца делали его скол в жидком азоте.
Оценку цитотоксического действия на культуру дермальных фибробластов человека полимерных материалов на основе PEI, модифицированных углеродными нановолокнами, проводили следующим образом. Клетки культивировали в питательной среде DMEM с добавлением L-глютамина, 10% бычьей эмбриональной сыворотки, а также антибиотиков в составе 100 ед/мл пенициллина и 100 мкг/мл стрептомицина – все реактивы производства “Gibco”, США. Образцы стерилизовали автоклавированием в воде в течение 30 мин и помещали в лунки культурального планшета, по периметру образцов укладывали уплотнительные силиконовые кольца. Заливали среду DMEM без сыворотки и через 1 ч меняли среду на суспензию клеток: 25 тыс. клеток в 1 мл. Инкубировали трое суток при 37°С в CO2, после чего определяли жизнеспособность и пролиферативную активность с помощью МТТ-теста (колориметрический тест для оценки метаболической активности клеток). Затем в лунки добавляли 100 мкл раствора МТТ 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолия бромида с концентрацией 5 мг/мл и продолжали инкубацию еще в течение 2 ч. Удаляли среду и примешивали в лунки 1 мл ДМСО для растворения кристаллов формазана. Переносили полученный раствор в планшет (100 мкл в лунку) и измеряли оптическую плотность растворов при 570 нм с помощью планшетного спектрофотометра.
Исследование адгезии клеток к поверхности образцов выполняли на оптическом микроскопе “AxioScope.A1” (“Carl Zeiss”, Германия). Съемку вели в отраженном свете.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование механических свойств и структуры получаемых образцов
Как было показано ранее, увеличение механических характеристик, напечатанных FDM-методом, полимерных образцов наблюдается при добавлении в них VGCF. Действительно, введение в PEI нановолокон VGCF в количестве 1 мас. % увеличивает прочность материала с 90.1 до 97.6 МПа, а модуль – с 2527 до 2844 МПа (табл. 1). Возрастание прочности углеродных нановолокон при этом, возможно, обусловлено различной пористостью образцов, исследованной с помощью пикнометрического метода для подтверждения данного предположения. Образцы, полученные литьем под давлением, имеют низкую пористость 0.55 и 0.41% для ненаполненного полимера и нанокомпозита соответственно. В случае FDM-печати пористость образцов из ненаполненного PEI составляет ~11.21%, в то время как пористость нанокомпозита значительно ниже ~1.97%. Эти показатели согласуются с микрофотографиями СЭМ, где видно, что у образцов из ненаполненного PEI макропор больше (рис. 1). Таким образом, в случае введения нановолокон, механические характеристики возрастают не столько за счет армирующего эффекта, сколько из-за уменьшения пористости полученных образцов. Поэтому данный композит, как наиболее оптимальный по своим характеристикам, был выбран для проведения испытаний на биосовместимость и цитотоксичность.
Таблица 1.
Сравнение механических свойств образцов из чистого “Ultem® 1000” и “Ultem® 1000” + 1% VGCF, полученных по FDM-технологии и литьем под давлением (Injection Molding – IM)
| Образец | Прочность, МПа | Модуль, МПа | Деформация, % |
|---|---|---|---|
| “Ultem® 1000” IM | 109.7 ± 1.8 | 2650 ± 133 | 59.30 ± 3.49 |
| “Ultem® 1000” FDM | 90.1 ± 4.5 | 2527 ± 79 | 6.40 ± 0.50 |
| “Ultem® 1000” + 1% VGCF IM | 113.6 ± 0.4 | 2803 ± 65 | 28.57 ± 7.60 |
| “Ultem® 1000” + 1% VGCF FDM | 97.6 ± 4.6 | 2844 ± 35 | 6.13 ± 0.21 |
Термический анализ образцов
Поскольку одним из главных недостатков FDM-печати считается термическая усадка, которая может возникать из-за большой разницы в температуре, важной характеристикой используемого материала является коэффициент термического расширения, т.е. чем он ниже, тем выше качество готового изделия. Известно, что введение наполнителей (в том числе волокон) в полимерную матрицу оказывает влияние на коэффициент теплового расширения, приводя, как правило, к его уменьшению [17]. Коэффициент термического расширения для “Ultem® 1000” соответствует значению, приводимому в документации фирмы “Sabic”, и составляет 5 × 10–5 1/град в диапазоне температуры от 23 до 150°C [18]. Введение 1 мас. % VGCF влечет небольшое уменьшение КТР до 4.85 × 10–5 1/град. Нановолокна VGCF не обладают высокой адгезией к полимеру, так на микрофотографии (рис. 2) можно увидеть полости вокруг волокон, образованных на сколе при разрушении образца.
По результатам исследования методом ДСК, введение VGCF не оказывает существенного влияния на температуру стеклования. По-видимому, данный факт обусловлен отсутствием сильного адгезионного взаимодействия между VGCF и полимерной матрицей. Метод ТГА был использован для определения температуры деструкции полученных композиционных материалов. Анализ кривой термодеструкции показал, что данные материалы имеют одноступенчатый механизм термического разрушения и стабильны до температуры 521–522°С (температура, при которой происходит потеря 5% массы полимера), после чего начинают активизироваться процессы термодеструкции. Вместе с тем, введение нановолокон ведет к увеличению остаточной массы материала на ~5% (табл. 2).
Исследование материалов на цитотоксичность и биосовместимость
Материалы, которые планируется использовать для получения медицинского изделия, не должны оказывать негативного влияния на организм при контакте с ним. Воздействие токсичных материалов может повлечь необратимые повреждения или даже смерть клеток. Поэтому для применения в медицине обычно изучают их уровень цитотоксичности посредством лабораторных тестов и анализов. Таким образом, клеткам, взаимодействующим с исследуемым материалом, необходимо сохранять свой нормальный цикл функционирования, а материалам, которые планируется использовать для имплантации – обеспечивать хорошее прикрепление и рост клеток на своей поверхности.
Исследование жизнеспособности и пролиферативной активности инкубированных на поверхности материала клеток проводили с помощью МТТ-теста. Данная методика основана на способности дегидрогеназ живых клеток восстанавливать МТТ до нерастворимого в воде фиолетового кристаллического формазана.
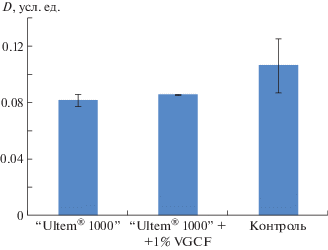
Инкубация клеток на образцах ненаполненного PEI продемонстрировала, что данный материал не оказывает выраженного цитотоксического действия на культуру дермальных фибробластов человека. При этом не выявлено статистически достоверного различия на основе сравнения оптической плотности растворов формазана между уровнем пролиферативной активности клеток, инкубированных как на чистом PEI, так и на модифицированном нановолоконами VGCF (рис. 3).
Рис. 3.
Сравнительная характеристика оптической плотности D растворов формазана, полученных с исследуемых образцов.
На фотографиях (рис. 4), выполненных с помощью оптического микроскопа, видно, что клетки плотно расположены на поверхности образца и равномерно распределены по его площади. Данное обстоятельство свидетельствует о благоприятных свойствах поверхности исследуемых образцов для адгезии, распластывания и пролиферации дермальных фибробластов кожи. Это вместе с возможностью получения необходимого рельефа поверхности при помощи FDM-печати дает основания полагать, что 3D-печать из данных материалов может успешно применяться для производства различных объектов для протезирования.
ЗАКЛЮЧЕНИЕ
Введение в полиэфиримид 1% углеродных нановолокон приводит к возрастанию прочности и модуля при растяжении как у образцов, полученных методом литья под давлением, так и методом FDM-печати. Такое увеличение прочности в случае FDM-печати обусловлено более низкой пористостью за счет введения нановолокон по сравнению с образцами из ненаполненного полиимида.
Термические свойства нанокомпозиционного материала, такие как температура стеклования, коэффициент термического расширения и температура термодеструкции, практически не изменяются при введении углеродных нановолокон.
Разработанные композиты не показали отрицательного влияния на культуру фибробластов человека, что свидетельствует об их биоинертности. Данные материалы обладают хорошей адгезией клеток к поверхности, а также подходящими условиями для пролиферативной активности клеток.
Список литературы
Xue Y., Gu P. // Computer-Aided Design. 1996. V. 28. № 4. P. 307.
Norotte C., Marga F.S., Niklason L.E., Forgacs G. // Biomaterials. 2009. V. 30. № 30. P. 5910.
Wendel B., Rietzel D., Kuhnlein F., Feulner R., Hulder G., Schmachtenberg E. // Macromol. Mater. Eng. 2008. V. 293. P. 799.
3D-печать. Технологии 3D-печати. Применение | Энциклопедия 3D-печати [online] // 3dtoday.ru. 2018. URL: http://3dtoday.ru/wiki/3D_print_technology/
3D Printing High-Strength Carbon Composites Using PEEK, PAEK [online] // Design News. 2018. URL: https://www.designnews.com/design-hardware-software/3d-printing-high-strength-carbon-composites-using-peek-paek/143795958032579
Acquah S.F., Leonhardt B.E., Nowotarski M.S., Magi J.M., Chambliss K.A., Venzel T.E., Delekar S.D., Al-Hariri L.A. // Carbon Nanotubes – Current Progress of Their Polymer Composites. London: InTech, 2016.
Thomas S., Visakh P.M. Handbook of Engineering and Specialty Thermoplastics. Salem: Scrivener Publishing, 2011. Ch. 3.
Schaefer U., Von Campe G., Uecal M., Katschnig M., Tax A., Holzer C. // Front. Bioeng. Biotechn. 2016. V. 4. № 2. P. 87.
Arevo Labs announces Carbon Fiber and Nanotube-reinforced High Performance materials for 3D Printing Process | Solvay [online] // Solvay. com. 2018. URL: https://www.solvay.com/en/media/press_releases/ 20140324-Arevo.html
Rahman K. // Proc. ASME-2015 “International Mechanical Engineering Congress and Exposition, IMECE-2015”. Houston, 2015.
Vaezi M., Yang S. //Virtual Phys. Prototyp. 2015. V. 10. № 3. P. 123.
Odian G. Principles of Polymerization. New Delhi: Wiley, 2008.
Miller D.J. Material Coefficient of Thermal Expansion Investigation for Use in Additive Manufacturing Fused Deposition Modeling for Composite Tooling. Hattiesburg: Master’s Theses, 2015. P. 85.
Berretta S., Evans K., Ghita O. // Eur. Polym. J. 2015. V. 68. P. 243.
Юдин В.Е., Светличный В.М. // Росс. хим. журн. 2009. Т. 53. № 4. С. 75.
Polyakov I.V., Vaganov G.V., Yudin V.E., Ivan’kova E.M., Popova E.N., Elokhovskii V.Yu // Mechan. Comp. Mater. 2018. V. 54. № 1. P. 33.
DeSarkar M., Senthilkumar P., Franklin S., Chatterjee G. // J. Appl. Polym. Sci. 2011. V. 124. № 1. P. 215.
SABIC – ULTEM™ Resin [online] // Sabic. com. 2018. URL: https://www.sabic.com/en/products/specialties/ultem-resins/ultem-resin
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)